配合物的电子光谱概述经典课件(PPT47页)
配合物电子光谱

c. 配位体内部的电子光谱(有机化合物的吸收光谱)
过渡金属配合物的电子吸收光谱主要特点:
a. 带状光谱(含有振动光谱的精细结构 ) b. 在可见区多数吸收强度很小,
在近紫外和紫外区,有吸收强度很大的配体内部吸收 或电荷迁移吸收带
3
2. 原子和自由离子的微观态和光谱项
4
电子组态:每个轨道上的电子数目的符号,如p2, d2和f4等。
不存在外电场和外磁场时, 这10种微态的能量简并,可 归并为一组,构成一个光谱项 2D (不考虑自旋-轨道偶合时)
5
6
光谱项的一般表现形式:
2S+1L
自旋多重态 spin multiplicities
总角量子数 L = 0,1,2,3,4 …
S P D F G…
2S+1=1, 单重态(singlet), 无未成对电子 2S+1=2, 二重态(doublet), 一个未成对电子 2S+1=3, 三重态(triplet), 两个未成对电子
能级分裂:配位体场,d电子之间的静电作用,自旋-轨道 耦合作用导致能级分裂
光谱项:不同电子组态的自由离子的能级状态 一组能量相同的微观态(不考虑自旋-轨道耦合)
4
例: d1组态的光谱项
编
m1
号 2 1 0 -1 -2
1
2
3
配合物电子光谱

Ni(en)32+ 1.2104 cm-1 2.0104 cm-1 3.5104 cm-1 紫色
电子跃迁 3A → 3T 2g 2g 3A → 3T (F) 2g 1g 3A → 3T (P) 2g 1g
蓝移
21
例3:V(H2O)63+ 电子吸收光谱
电子跃迁 V(H2O)63+ VF633T 1g
13
D E g , T2 g F A2 g, T1g, T2g G A1g , E g, T1g, T2g H Eg, 2T1 g, T2g I A1g, A2g,, Eg, T1g, 2T2g
A1g, B1g, B2g, Eg A2g, B1g, B2g, 2Eg 2A1g, A2g, B1g, B2g, 2Eg A1g, 2A2g, B1g, B2g, 3Eg 2A1g , A2g, 2B1g, 2B2g, 3Eg
对于Tb3+(4f8)基谱项为7F6(7F0>7F1>7F2>7F3>7F4…>7F6)
11
例:从d1到d9组态的自由离子的基态光谱项
12
不求出所有的 尽可能地使每个轨道上占据一个电子,同时尽 光谱项,直接求 可能使电子占据在m 值最大的轨道上,L= m , l 1 光谱基项的方法: S值为单电子占据的轨道数的一半
6
例:d2组态自由离子的光谱项
配合物的电子光谱质

1 配合物的d-d跃迁电子光谱
1.7 配体场谱项的相互作用
弯曲 排斥 远离 弯曲
二级配体场相互作用
ຫໍສະໝຸດ Baidu
谱项分裂: 一级配体场相互作用:配体场作用下,自由离子谱项内组分之间的相互作用 二级配体场相互作用:来自于不同自由离子谱项、但属于某个点群的同一不可 约表示、且自旋多重度相同的配体场谱项之间的相互作用 谱项的相互作用使对称性和自旋多重度都相同的谱项不能相交 构建能级相关图的关联规则之一
1 配合物的d-d跃迁电子光谱
1 配合物的d-d跃迁电子光谱
选律的松弛 (relaxation)
无反演对称中心的配合物,d-d跃迁可以在某 种程度上不受宇称选律的限制 四面体配合物颜色比八面体配合物颜色深 emax: 102~103 L/ molcm
深蓝色
(i) d-p轨道的混合
浅粉红色
= a 1 + b3
1
纯单重态 3 纯三重态 a 单重态的相对贡献系数 b 三重态的相对贡献系数
ʃ s’sds 0
自旋选律被松弛
1 配合物的d-d跃迁电子光谱
系列配合物CoN63+ 和 MO4n-的颜色强度
(i) CoN63+
d-d跃迁
颜色
对称禁阻
很弱
允许
加深
允许
(一级近似处理)
配合物的电子光谱

以np2组态为例:用“逐级消去法”推断np2组态的光谱 项 p2组态有15种排布方式
ml +1 0 -1 ML=Σml Ms=Σms
2 0 -2 1 0 0 (1) 0 (2) 0 (3) 1 (4) 1 (5)
ml +1 0 -1 ML=Σml Ms=Σms
-1 1
0 -1 1 0 -1
-1 (9) 0 (10)
0 (11) 0 (12) 0 (13) 0 (14) 0 (15)
-1
1 0
1 (6)
-1 (7) -1 (8)
把这15种可能的排布方式重新整理, 按每组的ML, Ms所包含 的微态数可以列成下面左上角的表。 MLMs 0 MLMs +1 0 -1 ML=2, 1, 0 根据这 Ms=0 1 1 个表, 我们 +2 +2 即 1 1 2 1 +1 可以从中找 +1 L=2, S=0 1 1 3 1 0 出相应的光 0 1D (简并度5) 1 1 2 1 谱项。例如 , -1 -1 包括5个微态 1 取出一组: 1 -2 -2 还余10个微态 MLMs
§ 5.2
配位场光谱
配位场光谱是指配合物中心离子的电子光谱。这 种光谱是由d电子在d电子组态衍生出来的能级间跃迁 产生的,所以又称为d-d跃迁光谱或电子光谱。 这种光谱有以下三个特点: ①一般包含一个或多个吸收带; ②强度比较弱,这是因为d-d跃迁是光谱选律 是禁阻的原因; ③跃迁能量较小,一般出现在可见区,所以许多 过渡金属配合物都有颜色。
配合物的电子光谱

(a) Cr(en)33+
(b) Cr(ox)33–
d轨道能级分裂 轨道能级分裂: 轨道能级分裂
(c) CrF63–
d— d 电子的相互作用 d轨道与配体 相互作用 轨道与配体L相互作用 轨道与配体
CrL6的吸收光谱
Y2O2S:Eu3+ 的激发和发射光谱 f-f 跃迁) 的激发和发射光谱( 跃迁) ( Eu3+的电子组态:4f6 ) 的电子组态:
− I−< Br− < S2−< SCN−< Cl−< NO3−< F−< OH−< − ox2−< H2O < NCS−< CH3CN< NH3 <en < dipy < <
phen < NO2− < PR3 < CN−< CO 2. 金属离子Mn+, n越大 分裂能越大 金属离子 越大, 越大
3. 周期数越高 分裂能越大 Pt2+ > Ni2+ 周期数越高, 分裂能越大, 4. 不同的配位场中 不同的配位场中: 平面四方 > 八面体 > 四面体 d8电子组态 PtCl42– ( D4h)
(2S+1): 自旋多重态 + 自旋多重态(spin multiplicity),S为总自旋 , 为总自旋 (2S+1) (2L+1) : 简并度(微态数) + 简并度(微态数) +
第五章 配合物的电子光谱

第五章过渡金属配合物的电子光谱
第一节概论
一、什么是电子光谱?
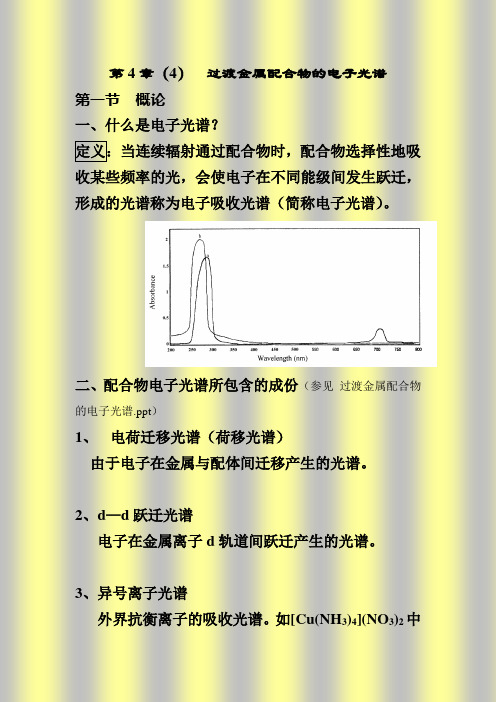
定义:当连续辐射通过配合物时,配合物选择性地吸收某些频率的光,会使电子在不同能级间发生跃迁,形成的光谱称为电子吸收光谱(简称电子光谱)。
200
4006008
A b s o r b a n c e
Wavelength(nm)
配体
配合物
二、配合物电子光谱所包含的成份 1、 电荷迁移光谱(荷移光谱) 由于电子在金属与配体间迁移产生的光谱。
2、d —d 跃迁光谱
电子在金属离子d 轨道间跃迁产生的光谱。
3、异号离子光谱
外界抗衡离子的吸收光谱。如[Cu(NH3)4](NO3)2中NO3-的吸收。
4、配体光谱
配体本身的吸收光谱。如[Ti(H2O)6]3+中H2O的吸收。
第二节电荷迁移光谱、异号离子光谱及配体光谱
一、电荷迁移光谱
不同对称类型的轨道间跃迁是允许的(u → g、u → g)
1、无π分子轨道的配体(NH3、CH3−)
L →M 跃迁:
跃迁类型 L
σ(t 1u )→ M(t 2g ) = ν1 L
σ(t 1u )→ M(e
g *) = ν2
弱场(Δ
t 2g e g *
e g V 1
V 2
NH 3、CH 3-作配体
t 1u
t 1u *a 1g *
a 1g
d0d1 d2
ν1
d3d4 d5
ν2
d6d7 d8
ν1
d9d10
无ν1 无ν1和ν2
强场(Δ>P)
d0d1 d2
ν1
d3d4 d5
ν1
d6d7 d8
无ν1 无ν1 无ν1
d9d10
无ν1 无ν1和ν2
2、具有低能充满π轨道的配体(Cl −
、F −
)
L →M 跃迁:
跃迁类型
L
π(t 1u 和t 2u ) → M(t 2g *) = ν1
第四章 配合物的电子光谱

(2)d-p 轨道混合 配位场畸变, 或配体结构的不对称性, 导致d-p 轨道混合,因而轨道禁止部分解除, 可以观察到d → d 跃迁谱带。 (3)四面体配合物的吸收强度大于八面体配合物 四面体配合物没有中心对称,并且由 于dxy、dxz、dyz 与p 轨道都具有t2 对称性, 因而d-p 轨道能够混合,这样跃迁或多或少 地是p → d 或d → p 跃迁,故四面体配合物 的吸收强度大于八面体配合物。
t2g、eg*主要为金属离子轨道成份,而t2g*主要为配体轨道。 例:[Co(CN)6]3-, M→L跃迁, ν1=49500cm-1
3、金属对金属荷移 普鲁士兰KFeIII[FeII(CN)6] 钼蓝中的MoV 和 MoVI 黑金化合物CS2AuIAuIIICl6 [AuCl4]-和[AuCl2]-基团之间产生电荷迁移
一、 d—d跃迁光谱(配位场光谱)
中心金属离子是多电子体系,各个d电 子之间的相互排斥引起能级发生分裂,分 裂后的每个能级称为一个光谱项,然后该 自由离子光谱项在配位场作用下引起能级 的再一次分裂而得到配位场项,最后,d电 子在各配位场项间发生能级跃迁,从而得 到配位场光谱。
1、dn组态金属离子的谱项 多电子体系的能量状态可用谱项符号表示:
2S+1L
L 0
1 2 3 4 5
符号 S P D F G H (2S+1)为谱项的自旋多重度。如S=1/2,L=2 时,为2D谱项。 如何求S、L见“物质结构”。
第9讲 配合物的电子光谱
洛阳师范学院
d1 、d4 、 d9、d6电子组态 在Oh弱场和Td中的简单谱项能级图
洛阳师范学院
●另外, d1、d9、d4、d6具有相似的基谱项D :(D2)和(D5)
在Oh场中:
d轨道分裂为eg和t2g, 同样D谱项也能分裂为Eg和T2g。
对d1和d6, 能量关系是Eg>T2g;
d4和d9(与d1和d6静电行为相反), 能量关系是Eg<T2g。
洛阳师范学院
第9讲 配合物的电子光谱
洛阳师范学院
9.1 配合物的电子光谱的概述 1. 定义:配合物的电子光谱属于分子光谱, 它是分子 中电子在不同能级的分子轨道间跃迁而产生的光谱。
2. 分类:根据电子跃迁的机理, 可分为三种 配位场光谱:d轨道能级之间的跃迁光谱; 荷移光谱; 配体内部的电子转移光谱。 3. 电子光谱有两个显著的特点 ①为带状光谱:这是因为电子跃迁时伴随有不同振 动精细结构能级间的跃迁之故。 ②在可见光区有吸收, 但强度不大;在紫外区, 常有 强度很大的配位体内部吸收带。
如, 对于d2, 壳层电子数少于半充满, 故:
3F 4
> 3F3 > 3F2
洛阳师范学院
二 、自由离子谱项在配位物中的分裂 1. 两种相互作用: 如果一个dn电子组态的离子处于一 个配位场之中, 这时将存在: 电子间的相互排斥 二者基本为同一个数量级 配体的静电场影响
第4章(4)过渡金属配合物的电子光谱
二、配合物电子光谱所包含的成份(参见过渡金属配合物
.ppt)
电荷迁移光谱(荷移光谱)
由于电子在金属与配体间迁移产生的光谱。
—轨道角量子数
注*矢量用黑体字母表示。
*角动量:就是质量乘以角速度(单位角度/秒)。自旋角动量:角动量是由物体自旋产生的,而不是外力给它的。
轨道角动量:角动量是由轨道运动产生的
2、电子间相互作用
在多电子体系中,l i与l j主要是通过电性相互作用;而s i与l i或s j之间则主要通过磁性作用。
s i s j
l i l j
对轻元素(原子序数<30),电子间偶合强于电子内偶合,即:
l i——l j
s i——s j的作用要大于s i——l i的作用。
此时电子间相互作用,可用L—S偶合方案处理:(参见L—S偶合方案.pdf)
Σl L (总轨道角动量)
Σs S (总自旋角动量)
即可用L、S描述多电子体系的状态。
│S│=[S(S+1)]1/2(h/2π) │L│=[L(L+1)] 1/2(h/2π)
S——总自旋角量子数L——总轨道角量子数
如何求S、L见“物质结构”。
3、d n组态金属离子的谱项
多电子体系的能量状态可用谱项符号表示:
2S+1L L 0 1 2 3 4 5
符号S P D F G H
(2S+1)为谱项的自旋多重度。如S=1/2,L=2时,为2D谱项。
组态谱项
d1 d92D
d2 d83F,3P,1G,1D,1S
d3 d74F,4P,2H,2G,2F,2x2D,2P
d4d65D,3H,3G,2x3F,3D,2x3P,1I,2x1G,1F,2x1D,
2x1S
d56S,4G,4F,4D,4P,2I,2H,2x2G,2x2G,
第五节电子光谱

因为d1电子组态d轨道只有一个电子,所以不存在 电子间的相互作用,若无外加磁场的作用, 这10种微 观态在能量上是相同的, 即是10重简并的。但对多电 子离子dn组态, 由于存在电子间的相互作用(包括电 子排斥作用及电子自旋-轨道耦合作用), 致使同一电 子组态中的微观态既使无外加电场及外加磁场的作用, 能量上也不再相同。
• d4和d9,可认为是在d5和d10状态上出现了一个空穴,因而d4和d9 的静电行为也应相同。一个空穴相当于一个正电子, 其静电 行为正好与一个电子的静电行为相反, 电子最不稳定的地方, 正电子就最稳定。因此,可以预期d4与d6、d1与d9、d1与d4、 d6与d9的静电行为都应该相反。
可以参照d轨道的对称性来理解D谱项:
在弱配位场中的分裂及能量变化情况。可用于解释自
旋允许的电子跃迁光谱。
T-S图:
描述弱场和强场中各能量状态变化的情况。可用于 解释所有可能的电子跃迁.
⑴.Orgel图
a.d1,d4,d6和d9组态(单电子或拟单电子组态)
电子组态
d10 d1, d9 d2 , d8 d3 , d7 d4 , d6 d5
380
780 435
紫 紫 蓝 480 红 红 绿蓝 490 650 蓝绿 橙 黄 绿 500 598 黄 绿
580 560
二、配位场光谱
配位场光谱有以下三个特点 ①.一般包含一个或多个吸收带; ②.强度比较弱, 这是因为d-d跃迁是光谱选律所禁阻 的跃迁; ③.跃迁能量较小, 一般出现在可见区, 所以许多过渡 金属配合物都有颜色。
第四章-配合物光谱(复旦大学)

根据电子跃迁的机理, 可将过渡金属配合物的电子光谱分为 三种:
zd轨道能级之间的跃迁光谱, 即配位场光谱;
z配位体至金属离子或金属离子至配位体之间的电荷迁移光谱; z配体内部的电子转移光谱。
电子光谱有两个显著的特点:
ⅱ d-d跃迁吸收峰的半宽度
① 由于振动将使得配体-金属之间的键长不停地 变化, 从而分裂能将随键长的增加而减小。而分裂能的 变化将导致配位场谱项之间的能量间隔发生变化, 并维 持在一定的范围。
② Janh-Taller效应导致轨道能级进一步分裂, 这 种分裂常使吸收峰谱带加宽。
③ 旋-轨偶合使谱项进一步分裂, 从而使谱带加 宽。
D2组态的电子相互作 用下分裂为五个能级: 1S >1G>3P>1D>3F, 且这些 光谱项在八面体配位场中 变为:
1S→1A1g 1G→1A1g, 1T1g, 1E1g, 1T2g 3P→3T1g 1D→1Eg, 1T2g 3F→3A1g, 3T2g, 3T1g
*第二种方法是先考虑配位场的影响, 然后再研究电子间的排
谱测定得到。由此可得这些光谱项的能级次序: 1S>1G>3P>1D>3F
3 光谱支项
光谱支项表征轨道与自旋的相互作用, 这种相互作用称为轨 -旋(或旋-轨)偶合, 旋-轨偶合将引起用光谱项表征的能级分 裂为用光谱支项表征的能级。
课件过渡金属配合物的电子光谱

其中,d2、d8、d3、d7的基谱项均为F,与 F有相同自旋多重 态的谱项为P, F与P之间的能量差为15B’。
② 强度比较弱, 这是因为d-d跃迁是光谱选律所禁阻的跃迁;
③ 跃迁能量较小, 一般出现在可见区, 所以许多过渡金属配合 物都有颜色。
整理版ppt课件
5
(一) 自由离子谱项在配位物中的分裂
如果一个dn电子组态的离子处于一个配位场之中, 这时
将存在两种相互作用:
●电子间的相互排斥; ●配体的静电场影响。
598
黄黄 绿
绿 500
580 560
整理版ppt课件
3
二 配体内部的电子光谱
配位体如水和有机分子等在紫外区经常出现吸收谱带。形成配合物后, 这 些谱带仍保留在配合物光谱中, 但从原来的位置稍微有一点移动。
配位体内部的光谱包括以下三种类型:
① n→* 处于非键轨道的孤对电子到最低未占据的空轨道 σ*反键轨道的跃迁。水、醇、胺、卤化物等配体常发生这类跃 迁。
★配位体至金属离子或金属离子至配位体之间的电荷迁移光谱; ★配体内部的电子转移光谱。
电子光谱有两个显著的特点:
①为带状光谱。这是因为电子跃迁时伴随有不同振动精细 结构能级间的跃迁之故。
②在可见光区有吸收, 但强度不大。但在紫外区, 常有强度
很大的配位体内部吸收带。整理版ppt课件
第五章 配合物的电子光谱

第五章过渡金属配合物的电子光谱
第一节概论
一、什么是电子光谱?
定义:当连续辐射通过配合物时,配合物选择性地吸收某些频率的光,会使电子在不同能级间发生跃迁,形成的光谱称为电子吸收光谱(简称电子光谱)。
200
4006008
A b s o r b a n c e
Wavelength(nm)
配体
配合物
二、配合物电子光谱所包含的成份 1、 电荷迁移光谱(荷移光谱) 由于电子在金属与配体间迁移产生的光谱。
2、d —d 跃迁光谱
电子在金属离子d 轨道间跃迁产生的光谱。
3、异号离子光谱
外界抗衡离子的吸收光谱。如[Cu(NH3)4](NO3)2中NO3-的吸收。
4、配体光谱
配体本身的吸收光谱。如[Ti(H2O)6]3+中H2O的吸收。
第二节电荷迁移光谱、异号离子光谱及配体光谱
一、电荷迁移光谱
不同对称类型的轨道间跃迁是允许的(u → g、u → g)
1、无π分子轨道的配体(NH3、CH3−)
L →M 跃迁:
跃迁类型 L
σ(t 1u )→ M(t 2g ) = ν1 L
σ(t 1u )→ M(e
g *) = ν2
弱场(Δ<P )
t 2g e g *
e g V 1
V 2
NH 3、CH 3-作配体
t 1u
t 1u *a 1g *
a 1g
d0d1 d2
ν1<ν2ν1<ν2 ν1<ν2
d3d4 d5
ν2<ν1 ν2<ν1ν1<ν2
d6d7 d8
ν1<ν2 ν1<ν2 无ν1
d9d10
无ν1 无ν1和ν2
强场(Δ>P)
d0d1 d2
ν1<ν2ν1<ν2 ν1<ν2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ML=2, 1, 0 M即 s=0
L=2, S=0
1D (简并度5)
包括5个微态
还余10个微态 再取出一组
MLMs +1 0 -1 MLMs +1 0 -1
+1
1 1 1 +1
1 11
0
1 21 0
1 11
-1
1 1 1 -1
1 11
还余1个微态
ML= 1, 0 Ms= 1, 0
例:d 2组态: ml = +2 +1 0 –1 –2
…………………….
ms=1/2,45种可能的排列(微状态)
↑↑ ↓↑ ↑↓ ↓↓
ML=4, 3, 2, 1, 0 MS =0 (2S+1)(2L+1)=9
ML= 3, 2, 1, 0 MS = 1, 0 (2S+1)(2L+1)=21
ML=2, 1, 0 MS =0 (2S+1)(2L+1)=5
这种光谱有以下三个特点。 ①一般包含一个或多个吸收带; ②强度比较弱, 这是因为d-d跃迁是光谱选律所禁阻的; ③跃迁能量较小, 一般出现在可见区, 所以许多过渡金属配 合物都有颜色。
5.2.1 自由离子光谱项
1. 自由离子光谱项的推算
求某一电子组态的能级, 就是推导其光谱项, 实质上就是推 算该电子组态的不同L和S的组合。
上述光谱项左上角的2S+1为自旋多重态 2S+1=1 单重态 无未成对电子 2S+1=2 二重态 有一个未成对电子 2S+1=3 三重态 有两个未成对电子
照这样可对上述微态组合分别写出光谱项, 如 L=2, S=0, 1D 简并度5, 单重态, 无未成对电子
简并度除能从行列式看出以外, 还可由下列关系式直接计算: 简并度=(2L+1)(2S+1)
配体内部的光谱包括以下三种类型:
① n→* 处于非键轨道的孤对电子到最低未占据的空轨道σ* 反键轨道的跃迁。水、醇、胺、卤化物等配体常发生这类跃迁。
② n→* 处于非键轨道的孤对电子到最低未占据空轨道* 反键分子轨道的跃迁, 常出现在含羰基的醛和酮类分子中。
③ →* 处于最高占据轨道分子轨道的电子向最低未占据 的空轨道*反键分子轨道跃迁, 这类跃迁经常出现在含双键、叁 键的有机分子中。
第五章 配合物的电子光谱
配合物的电子光谱属于分子光谱, 它是分子中电子在不同能 级的分子轨道间跃迁而产生的光谱。
根据电子跃迁的机理, 可将过渡金属配合物的电子光谱分为 三种:
d轨道能级之间的跃迁光谱, 即配位场光谱;
配体至金属离子或金属离子至配体之间的电荷迁移光谱; 配体内部的电子转移光谱。
电子光谱有两个显著的特点:
1
0 (13)
0
0 (14)
-1
0 (15)
把这15种可能的排布方式重新整理, 按每组的ML, Ms所包含 的微态数可以列成下面左上角的表。
MLMs +1 0 -1
+2
1
+1 1 2 1
0 1 31
-1
1 21
-2
1
根据这 个表, 我们 可以从中找 出相应的光 谱项。例如, 取出一组:
MLMs 0
如:d4, 四个电子占据五条轨道, d6, 四个空穴占据五条轨道, 产生的静电排斥作用相同。
按照Hund 规则和Pauli原理 1.对于给定组态(L相同),自旋多重度越大,即自 旋平行的电子越多,能量越低。
S值越大,能量越低。
2.对于给定多重度(S相同),L大则电子间作用力 小;L小, 电子间作用力大,能量高。例: 3F的能量低 于3P。
①为带状光谱。这是因为电子跃迁时伴随有不同振动精细 结构能级间的跃迁。
②在可见光区有吸收, 但强度不大。但在紫外区, 常有强度 很大的配体内部吸收带。
过渡金属配合物电子运动所吸收的辐射能量一般处于可见区
或紫外区, 所以这种电子光谱通常也称为可见光谱及紫外光谱。
当吸收的辐射落在可见区时,
物质就显示出颜色。物质所
配体分子, 可以具有上述一种, 也可同时具有两种跃迁方式, 但同配位场光谱相比, 只要记住他们的特点, 一是大都出现在紫 外区, 一是吸收强度大, 一般不难识别。
5.2 配位场光谱
配位场光谱是指配合物中心离子的电子光谱。这种光谱
是由d电子在d电子组态衍生出来的能级间跃迁产生的, 所以又
称为d-d跃迁光谱或电子光谱。
以一个np2组态为例:
mL +1 0 -1 ML=ΣmL Ms=Σms
2
0 (1)
0
0 (2)
-2
0 源自文库3)
1
1 (4)
0
1 (5)
-1
1 (6)
1
-1 (7)
0
-1 (8)
p2组态有15种排布方式
mL +1 0 -1 ML=ΣmL Ms=Σms
-1
-1 (9)
1
0 (10)
0
0 (11)
-1
0 (12)
显示的颜色是它吸收最少的
那一部分可见光的颜色, 或
者说是它的吸收色的补色。
右表和下图列出了可见
光的吸收与物质颜色之间的
对应关系。
380 435
780
紫紫 红
蓝
480
红
650
橙
绿蓝 蓝绿 490
598
黄黄 绿
绿 500
580 560
5.1 配体内部的电子光谱
配体如水和有机分子等在紫外区经常出现吸收谱带。形成配 合物后, 这些谱带仍保留在配合物光谱中, 但从原来的位置稍微有 一点移动。
即
MLMs 0 01
L=1, S=1
ML=0, Ms= 0
3P (简并度9) 即 L=0, S=0
包括9个微态 1S (简并度1)
上述推算光谱项的方法称为“逐级消去法”或“行列波函数
法光”。谱项书写的一般形式:
2S+1L
其中L用大写字母一表示: L=0 1 2 3 4 5 字母 S P D F G H
ML=1, 0 MS = 1, 0 (2S+1)(2L+1)=9
ML= 0 MS =0 (2S+1)(2L+1)=1
能量相同的微状态归为一组,得到自由离子的5个光谱项:
L=4, ML= 4, 3, 2, 1 0, S=0 MS= 0
1G
L=3, ML= 3, 2, 1 0,
S=1 MS= 1, 0 3F
L=2, ML= 2, 1 0,
S=0 MS= 0
1D
L=1, ML= 1, 0,
S=1 MS= 1, 0 3P
L=0, ML= 0,
S=0 MS= 0
1S
用这种方法可以推算出不同d电子组态的光谱项
由表可见, d10-n与dn具有相同的谱项, 可通过“空穴规则” 来理解:在多于半满的壳层中, 根据静电观点, “空穴”可理解成 正电子, 正电子也象电子那样会产生相互排斥作用。
