浙江化学高考第27题强化突破训练(解析版)
【浙江选考】2018年高考化学二轮专题复习提升训练:26 元素与物质推断(第27题) Word版含答案

提升训练26元素与物质推断(第27题)1.(2017·宁波模拟)某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期第ⅤA 族。
D、E、H均为难溶于水的白色固体,化合物C、E均含A元素。
其余物质均为中学化学中常见物质。
请回答:(1)写出H的化学式:。
(2)化合物A3M4中含有的化学键类型为:。
(3)写出反应②的离子方程式:。
2.(2017·名校合作体联考)为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。
请回答:(1)X的组成元素为H、O和(用元素符号表示),气体C的电子式为。
(2)写出反应①的离子方程式:。
3.为探究含结晶水的化合物X(含四种元素,摩尔质量为180 g·mol-1)的组成和性质,某兴趣小组设计并完成如下实验:请回答:(1)黑色固体Y的化学式为,气体C的电子式为。
(2)晶体X隔绝空气受热分解的化学方程式为。
4.某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:请回答:(1)写出红棕色固体C的化学式:。
(2)写出A受热分解反应的化学方程式:。
(3)写出检验A中阳离子的实验方案:。
5.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:(1)沉淀A中含有的单质是。
(2)通入的气体C的化学式是。
(3)滤液与气体C反应生成刻蚀液的离子方程式:。
6.凤凰石是一种用于建材装饰的硅酸盐矿物,已知某地出产的凤凰石可看作由主要成分硅酸铜盐X·3H2O(摩尔质量=334 g·mol-1)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液Ⅱ中滴入KSCN溶液显血红色。
请回答:(1)杂质Y中除氧以外还含有的元素为(填元素符号),X的化学式为。
高考化学三轮专题训练:第27题

第27题无机化学综合应用【知识汇总】1.粗读题干,挖掘图图示中一般会呈现超出教材范围的知识,但题目中往往会有提示或者问题中不涉及,所以一定要关注题目的每一个关键字,尽量弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。
如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。
2.携带问题,精读信息这里的“信息〞包括三个方面:一是主干,二是流程图,三是设置的问题。
读主干抓住关键字、词;读流程图,常见问题的设置方向如下:反响速率与平衡理论的运用;氧化复原反响的判断、化学方程式或离子方程式的书写;利用控制pH别离除杂;化学反响中的能量变化;实验根本操作:除杂、别离、检验、洗涤、枯燥等;流程中的物质转化和循环,资源的回收和利用;环境保护与绿色化学评价。
3.跳跃思维,标准答题答题时应注意前后问题往往没有“相关性〞,即前一问未答出,不会影响后面答题。
对反响条件的分析可以从以下几个方面着手:对反响速率有何影响,对平衡转化率有何影响,对综合生产效益有何影响(原料是否价廉易得,是否可再生,能源消耗的多少,设备能否满足生产条件的要求,对环境的影响如何)。
(1)要求用化学理论答复的问题一般采用“四段论法〞:此题“改变了什么条件〞(或“是什么条件〞)―→根据什么理论―→所以有什么变化―→结论。
[答案及评分标准](1)MgBO ·H O +2HSO △,2H 3BO +2MgSO(2分) 提高反响温度、减小2 2 522434铁硼矿粉粒径(2分)(2)FeO(1分)SiO 和CaSO(2分)3 424(3)将Fe 2+氧化成Fe 3+(1分) 使Fe 3+与Al 3+形成氢氧化物沉淀而除去 (1分)(4)(七水)硫酸镁(1 分)(5)Na+(2分)△(6)2H 3BO 3=====B 2O 3+3H 2O 、B 2O 3+3Mg △,2B +3MgO(2分)[阅卷人的忠告](1) 元素符号错、不标准、看不清的不得分,方程式不写“△〞扣分。
浙江高考化学27题

定性和定量结合推导陌生物质,题目相对较难,重点考察化学方程式的书写,并在其中结合考察学生实验方案的设计和分析能力。
■守恒的思想(电子得失守恒、电荷守恒、原子守恒、元素守恒)
定性定量结合的思想(要求考生经过定性判断和定量分析结合的方法推出未知物)
如运用氧化还原原理书写化学方程式)
实验研究的思想(运用先定性后定量的方法进行未知物质的研究
化学用语和语言表达能力(实验方案设计或评价中,需要用精炼的语言准确进行表述)。
2018年浙江高考选考化学专题训练第27题
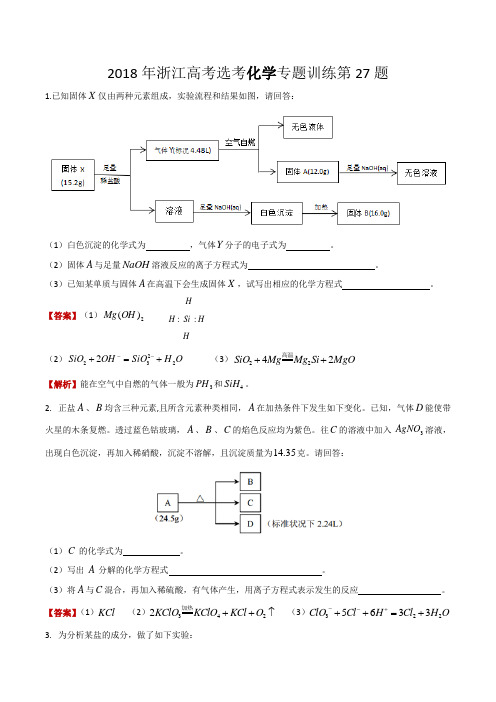
2018年浙江高考选考化学专题训练第27题1.已知固体X 仅由两种元素组成,实验流程和结果如图,请回答:(1)白色沉淀的化学式为 ,气体Y 分子的电子式为 。
(2)固体A 与足量NaOH 溶液反应的离子方程式为 。
(3)已知某单质与固体A 在高温下会生成固体X ,试写出相应的化学方程式 。
【答案】(1)2)(OH Mg HH Si H H::....(2)O H SiO OH SiO 22322+=+-- (3)MgO Si Mg Mg SiO 2422++高温【解析】能在空气中自燃的气体一般为3PH 和4SiH 。
2. 正盐A 、B 均含三种元素,且所含元素种类相同,A 在加热条件下发生如下变化。
已知,气体D 能使带火星的木条复燃。
透过蓝色钴玻璃,A 、B 、C 的焰色反应均为紫色。
往C 的溶液中加入 3AgNO 溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解,且沉淀质量为35.14克。
请回答:(1)C 的化学式为 。
(2)写出 A 分解的化学方程式 。
(3)将A 与C 混合,再加入稀硫酸,有气体产生,用离子方程式表示发生的反应 。
【答案】(1)KCl (2)↑++2432O KCl KClO KClO 加热 (3)O H Cl H Cl ClO 2233365+=+++--3. 为分析某盐的成分,做了如下实验:请回答:(1)盐 M 的化学式是 ;(2)被NaOH 吸收的气体的电子式 ;(3)向溶液A 中通入S H 2气体,有淡黄色沉淀产生,写出反应的离子方程式 (不考虑空气的影响)。
【答案】(1)34)(ClO Fe (2)⋅⋅⋅⋅⋅⋅⋅⋅:::Cl Cl (3)↓++=++++S H Fe S H Fe 2222234. 为探究矿石样品A (仅含两种元素)的组成和性质,设计并完成如下实验:已知:溶液D 中只含一种金属阳离子,与铁粉充分反应后固体质量减少g 14。
请回答:(1)样品A 的化学式为 。
考前三个月浙江专用高考化学复习系列——高考13题逐题特训(26份)高考13题逐题特训第27题 题组一

第27题 无机化学综合考查题组一 以陌生无机物为载体的综合考查[答案及评分标准] (1)Mg 2B 2O 5·H 2O +2H 2SO 4△,2H 3BO 3+2MgSO 4(2分) 提高反应温度、减小铁硼矿粉粒径(2分)(2)Fe 3O 4(1分) SiO 2和CaSO 4(2分)(3)将Fe 2+氧化成Fe 3+(1分) 使Fe 3+与Al 3+形成氢氧化物沉淀而除去(1分) (4)(七水)硫酸镁(1分)(6)2H 3BO 3=====△B 2O 3+3H 2O 、B 2O 3+3Mg=====△2B +3MgO(2分)[阅卷人的忠告] (1)元素符号错、不规范、看不清的不得分,方程式不写“△”扣分。
(2)SiO 2和CaSO 4少写,或错写其他杂质均不得分。
(3)名称写成化学式不得分。
(4)电子式漏掉离子符号或不写“[ ]”均不得分。
[挑战满分](限时20分钟)1.铜是与人类关系非常密切的有色金属。
已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+===Cu2++Cu。
大多数+1价铜的化合物是难溶物,如Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为________,某同学实验时却有黑色物质出现,该黑色物质的化学式为________________。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:a.2Cu2++4I-===2CuI↓(白色)+I2b.2Cu2++2Cl-+2I-===2CuCl↓(白色)+I2为顺利观察到白色沉淀可以加入的最佳试剂是________________________________。
A.SO2B.四氯化碳C.NaOH D.乙醇(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5的所有原子都达到稀有气体的稳定结构,NH5是__________(填“离子化合物”或“共价化合物”),在上述反应中NH5作________(填“氧化剂”、“还原剂”或“既不是氧化剂也不是还原剂”)。
浙江省高考化学学考第27题专题复习训练

浙江省高考化学学考第27题专题复习训练一.填空题(共2小题)1.氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙,甲、乙均由两种元素构成.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L H2(已折算成标准状况).甲与水反应能产生H2,同时产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙的式量为19,乙与水反应也能产生氢气;乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g/L.请回答下列问题:(1)甲的化学式是;乙的化学式是.(2)甲与水反应的化学方程式是.(3)气体丙与金属镁反应的产物是(用化学式表示).(4)乙在加热条件下与CuO反应可生成Cu、气体丙和水,写出该反应的化学方程式.(5)甲与乙之间也能发生反应产生H2,同时还生成另外两种单质,请写出相应的化学方程式.元素在周期表的位置是,简单离子的半径从大到小的顺序是(用离子符号表示);(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为,写出乙溶液在空气中变质过程的化学方程式.II.元素X与氢可形成多种化合物,如丙、丁、戊.(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式;(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L﹣1,则物质丁的化学式为;(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法).二.推断题(共23小题)3.已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去.其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C 是一种形成酸雨的大气污染物,D是白色胶状沉淀.请填空:(1)H的名称是.写出B的电子式(2)E的重要用途是(3)反应③的化学方程式是(4)反应④的离子方程式是(5)写出C与溴水反应的离子反应方程式.4.A、B、C、D、E、F是初中化学常见的物质,A、B是含有相同元素的无色液体,D是最轻的气体,F是红色固体单质.根据如图的相互转化关系判断.(1)A 物质是(填化学式);(2)写出B→D的化学方程式;(3)写出D和E反应的化学方式.5.已知A、B、C、D 是元素周期表中的四种短周期元素,A 分别与B、C、D 化合形成三种化合物;甲、乙、丙。
(浙江选考)2019版高考化学-考前提升训练26-元素与物质推断(第27题)

提升训练26元素与物质推断(第27题)1. (2018 •学军中学模拟)探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验请回答:(1) X 的化学式是____________________ 。
(2) 白色粉末溶于氢氧化钠溶液的离子方程式是 ______________________________________________ 。
(3) 白色沉淀用途广泛,请列举一例: _______________ 。
2. 某新型无机材料 AM 由两种非金属元素组成,元素M 位于第二周期第VA 族。
D E 、H 均为难溶于 水的白色固体,化合物C E 均含A 元素。
其余物质均为中学化学中的常见物质。
单康A「口务詐些壘蚯化回■S 1扁娜野廉•回1呱回—»*i请回答:(1) 写出H 的化学式: _________________ 。
(2) 化合物AM 中含有的化学键类型为 _______________________ 。
(3) 写出反应②的离子方程式 : ____________________________________________ 。
3.为了探究不溶性盐 X (仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。
请回答:(1) X 的组成元素为 H 0和 _______________ (用元素符号表示),气体C 的电子式 为 _______________ 。
(2) 写出反应①的离子方程式 : _______________________________________________ 。
4.为探究含结晶水的化合物 X(含四种元素,摩尔质量为180 g • mol -1)的组成和性质,某兴趣小组设 计并完成如下实验:白啊粧充鲫毎白也怜底些墮1无色X 帆 20 £)iJ^NaOH丸色辭薩一*请回答:(1) 黑色固体Y的化学式为_________ ,气体C的电子式为________________ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018浙江化学学考第27题强化突破训练 一、明方向 近三年均涉及无机物的推断(学考部分),主要考查了离子方程式的书写、陌生化学方程式的书写、化学式推断、定性分析与定量计算等内容。备考重点为熟记钠、镁及其化合物的性质及主要用途,掌握铁、铜及其化合物之间转化;以“单质→氧化物→含氧酸→盐”为线索,构建元素及其化合物的转化关系,计算过程中充分利用“关系式法”“守恒法”等技法 二、对点练 1.(2018·浙江金华一中月考)某研究小组为了探究一种浅绿色盐X[仅含四种元素,不含结晶水,M(X)<908 g·mol-1]的组成和性质,设计并完成了如下实验:
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3 g白色沉淀E、28.8 g红色固体G和12.8 g红色固体H。 已知: ①浅绿色盐X在570 ℃、隔绝空气条件下受热分解为非氧化还原反应; ②常温下B呈液态且1个B分子含有10个电子。 请回答如下问题: (1)X的化学式是________________。 (2)在隔绝空气、570 ℃温度下加热X至完全分解的化学反应方程式为________________________________________________________________________。 (3)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体NO。请写出该反应的离子方程式:________________________________________________________________________ ________________________。 解析:浅绿色盐X在570 ℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,则A、B、C均不是单质。常温下B呈液态且1个B分子含有10个电子,B为水,A和水反应生成的D能和
BaCl2反应生成白色沉淀E,E只能为BaSO4,A为SO3,23.3 g BaSO4的物质的量为n(BaSO4)=23.3 g233 g·mol-1=0.1 mol,n(SO3)=0.1 mol,黑色固体C可能为Fe3O4、CuO等,黑色固体C隔绝空气在1 000 ℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液,G应为Cu2O,在酸性溶液中的歧化反应为Cu2O+H2SO4===CuSO4+Cu+H2O,所以黑色固体C为CuO,气体F为O2,红色H为Cu,蓝色溶液I为CuSO4,逆推可得:一定量的浅绿色盐X中n(Cu2O)=28.8 g144 g·mol-1=0.2 mol,则n(CuO)=0.4 mol,n(CuO)∶n(SO3)=4∶1,浅绿色盐X,仅含四种元素,不含结晶水,设化学式为Cu4(OH)mSO4,Cu4(OH)mSO4=====△ 4CuO+SO3↑+m2H2O↑,根据氧元素守恒得:m=6,符合M(X)<908 g·mol-1。(1)根据上述分析可得X的化学式是Cu4(OH)6SO4。(2)X在隔绝空气、570 ℃温度下加热发生的反应为Cu4(OH)6SO4=====△ 4CuO+SO3↑+3H2O↑。(3)红色固体G为Cu2O,Cu2O中+1价的铜被硝酸氧化,稀硝酸被还原成NO,反应的离子方程式为3Cu2O+14H++2NO-3===6Cu2++2NO↑+7H2O。 答案:(1)Cu4(OH)6SO4
(2)Cu4(OH)6SO4=====△ 4CuO+SO3↑+3H2O↑ (3)3Cu2O+14H++2NO-3===6Cu2++2NO↑+7H2O 2.(2018·浙江湖州市菱湖中学月考)为探究无机盐X(除结晶水外还含有两种阳离子和一种阴离子,摩尔质量为374 g·mol-1)的组成和性质,设计并完成了如下实验:
(1)X中的金属阳离子是________,理由是____________________________________ ________________________________________________________________________ ________________________________________________________________________。 (2)X的化学式为____________。 (3)X溶液中加入少量NaOH溶液的离子方程式为______________________________ ________________________________________________________________________。 解析:(1)由题意可知X中含NH+4 0.01 mol,SO2-4 0.02 mol,铁元素0.01 mol,根据化合物中正、负化合价代数和为0可知,一定是Fe3+。(2)由计算可知NH+4、Fe3+、SO2-4三种离子物质的量的最简比为1∶1∶2,根据摩尔质量可以计算出还含有6个H2O,则X的化学式为NH4Fe(SO4)2·6H2O。(3)加入少量NaOH溶液后先与Fe3+反应,因为即使先与NH+4反应,生成的NH3·H2O 与Fe3+也不共存。 答案:(1)Fe3+ 由题意可知X中含NH+4 0.01 mol,SO2-4 0.02 mol,铁原子0.01 mol,根据化合物中正、负化合价代数和为0可知,一定是Fe3+ (2)NH4Fe(SO4)2·6H2O (3)Fe3++3OH-===Fe(OH)3↓ 3.(2018·浙江庆元中学月考)已知二元化合物甲可以用次氯酸钠溶液和过量的氨气制得,6.4 g甲完全燃烧得到4.48 L 的氮气(已折算成标准状况)。甲可以与新制Cu(OH)2 反应生成砖红色沉淀,同时生成密度为1.25 g·L-1 的无色无味的气体。请回答下列问题: (1)甲的化学式为________________。 (2)写出次氯酸钠与过量氨气的化学方程式:________________________________________________________________________ ________________________。 (3)已知乙是一种与甲含有相同电子数的液态物质,它可与甲反应生成一种常见的液态化合物和一种常见的稳定单质,同时放出大量的热,则乙的电子式为________________________________________________________________________。 解析:(1)6.4 g甲完全燃烧得到4.48 L的氮气(已折算成标准状况),则甲中含有N元素;甲可以与新制Cu(OH)2 反应生成砖红色沉淀,砖红色沉淀为Cu2O,同时生成密度为1.25 g·L-1的无色无味的气体,该气体含有N元素,其相对分子质量=1.25×22.4=28,故该气体为N2,由元素守恒可知,反应还生成水,
且甲中还含有H元素,4.48 L N2的物质的量=4.48 L22.4 L·mol-1=0.2 mol,其质量=0.2 mol×28 g·mol-1
=5.6 g,故6.4 g甲中H元素质量=6.4 g-5.6 g=0.8 g,故H原子物质的量=0.8 mol1 g·mol-1=0.8 mol,则甲中N、H原子数目之比=0.2 mol×2∶0.8 mol=1∶2,故甲为N2H4。(2)次氯酸钠与过量氨气反应生成N2H4,根据氧化还原反应可知还生成NaCl,根据元素守恒可知有水生成,反应方程式为NaClO+2NH3===N2H4
+NaCl+H2O;次氯酸钠具有强氧化性,可以氧化N2H4,过量的氨气防止N2H4被氧化。(3)乙是一种与甲含有
相同电子数的液态物质,它可与甲反应生成一种常见的液态化合物和一种常见的稳定单质,同时放出大量
的热,则乙为H2O2,其电子式为。 答案:(1)N2H4 (2)NaClO+2NH3===N2H4+NaCl+H2O
(3) 4.(2018·临安昌化中学月考)铸铁中含有一种铁碳化合物X。实验室测定化合物X组成的实验如下:
化合物X(18.0 g)――→足量空气高温煅烧固体1溶液甲溶液乙――→加热蒸发灼烧固体2(24.0 g) (1)固体X的化学式为________。 (2)若溶液甲中可能含有的阳离子为H+、Fe2+、Fe3+,若要验证溶液中有Fe2+存在,则实验选用的试剂及检验的反应原理(用离子方程式表示)分别为________________________________________________________________________ ________________________________________________________________________。 (3)由溶液甲转变为溶液乙反应的离子方程式为________________________________________________________________________ ________________________。 解析:(1)由题意分析可得固体2为Fe2O3,则化合物X中铁元素的质量为24.0 g160 g·mol-1×56 g·mol-1×2=16.8 g,则18.0 g化合物X中碳元素的质量为18.0 g-16.8 g=1.2 g,n(Fe)∶n(C)=3∶1,故X的化学式为Fe3C。(2)溶液甲中可能含有H+、Fe2+、Fe3+,验证溶液中存在Fe2+,常利用Fe2+能还原酸性KMnO4
溶液的性质,相关反应的离子方程式为5Fe2++MnO-4+8H+===Mn2++5Fe3++4H2O。(3)溶液甲转变为溶液乙的
过程中Cl2将Fe2+氧化成Fe3+,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。 答案:(1)Fe3C (2)酸性KMnO4溶液,5Fe2++MnO-4+8H+===Mn2++5Fe3++4H2O (3)2Fe2++Cl2===2Fe3++2Cl- 5.(2018·宁波高三适应性考试)为探究含结晶水的化合物X(含四种元素,摩尔质量为180 g·mol-1)的组成和性质,某兴趣小组设计并完成如图所示实验:
请回答: (1)黑色固体Y的化学式为________,气体C的电子式为________________。 (2)晶体X隔绝空气受热分解的化学方程式为________________________________________________________________________ ________________________________________________________________________。 解析:由框图可知Y中含有铁元素,且Y中的铁元素为+2价;混合气体中含有碳、氧元素,所以X中
