镁离子试剂盒企业标准
镁测定试剂盒说明书

网址:邮箱:****************镁测定试剂盒说明书-Mg(本测定试剂仅用于科研、实验,不用于临床诊断)简介用于手工测定人体人体血清等标本中镁含量。
血清镁升高:见于肾脏疾病、内分泌疾病、多发性骨髓瘤、严重脱水症等。
血清镁降低:见于慢性腹泻、吸收不良综合症、慢性肾炎综合症、甲状腺机能亢进症、甲状旁腺机能亢进症、糖尿病酸中毒、醛固酮增多症、以及长期使用皮质激素治疗者等。
测定方法偶氮胂III比色法。
测定原理在弱碱性缓冲液中,血清镁与偶氮胂III显色剂作用生成蓝紫色配合物,其颜色深浅与血清镁含量成正比,与同样处理的标准进行比较,可求得血清镁含量。
试剂盒组成规格组份单一试剂 100mL(40T),200mL(80T),400mL(160T) 偶氮胂II、缓冲液Mg2+镁校准品液体型, 与测定试剂配套 0.823mmol/L样品收集、处理及保存方法1. 血清-----操作过程中避免任何细胞刺激。
使用不含热原和内毒素的试管。
收集血液后,1000×g离心10分钟将血清和红细胞迅速小心地分离,避免溶血和脂血。
置2-8℃可稳定7天,置-20℃可稳定30天。
2. 细胞上清液-----1000×g离心10分钟去除颗粒和聚合物。
3. 组织样本的前处理-----组织匀浆的制备:准确称取组织重量,按重量体积比加9倍生理盐水制成10%的匀浆,2000-2500转/分离心10分钟,取上清待测。
4. 保存-----如果样品不立即使用,应将其分成小部分-70 ℃保存,避免反复冷冻。
如果血清中大量颗粒,检测前先离心或过滤。
不要在37℃或更高的温度加热解冻。
应在室温下解冻并确保样品均匀地充分解冻。
检测仪器要求721、722、751、其他类型的可见紫外分光光度计测定步骤1.本试剂为液体单一试剂,可直接使用。
2.测定参数:波长:640nm;光径:1.0cm;温度:37℃。
3.测定方法:加入物空白管校准管测定管蒸馏水(uL) 40 - -- 40 - 校准液(uL)样本(uL) - - 402.5 2.5 2.5单一试剂(mL)网址:邮箱:****************混匀,置37℃反应3分钟,水校零,读取各管吸光度A。
镁(Mg) 二甲苯胺兰比色法

目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理在碱性条件下,样品中的镁离子与二甲苯胺兰生成有色络合物,此产物在546nm波长有最大吸收,其吸收强度与血清中镁的含量成正比,再通过与同样处理的标准镁比较,经计算可求出血清镁的含量2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆使用肝素或EDTANa2(1mg/mL)作为抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司Mg试剂盒,为液体单一试剂,各组分如下:3.2 校准血清:使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的±2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:原包装试剂储存在2-8℃至标签所示失效日期。
镁检测试剂盒(甲基麝香草酚蓝比色法)
镁检测试剂盒(甲基麝香草酚蓝比色法)简介:镁是多种酶的辅助因子,存在于软组织和骨中,在二者的分布大致相等。
镁的代谢机制尚不清楚,镁增加会导致肌张力减弱,镁减少见于甲状旁腺功能减退、慢性肾衰竭等。
Leagene 镁检测试剂盒(甲基麝香草酚蓝比色法)是利用溶液中镁离子在碱性条件下能与甲基麝香草酚蓝(MTB)结合,生成蓝紫色的复合物,加入钙离子螯合剂,去除钙离子背景干扰,通过分光光度计检测600nm 处吸光度,根据公式计算出镁含量。
本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 离心管或试管2、 比色杯3、 分光光度计操作步骤(仅供参考):1、 制备样品:①血浆、血清样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的测定,冻存,用于Mg 的检测。
②细胞或组织样品:取恰当细胞或组织进行匀浆,低速离心取上清,冻存,用于Mg 的检测。
③高浓度样品:如果样品中含有较高浓度的Mg ,可以使用ddH 2O 稀释,不宜使用普通蒸馏水稀释。
④(选做)样品准备完毕后可以用BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便于后续计 算单位蛋白重量组织或细胞内的Mg 含量。
2、 配制Mg 显色工作液:临用前,取Mg Assay buffer 和MTB 显色液等量混合,即配即用,4℃避光保存,不宜久置。
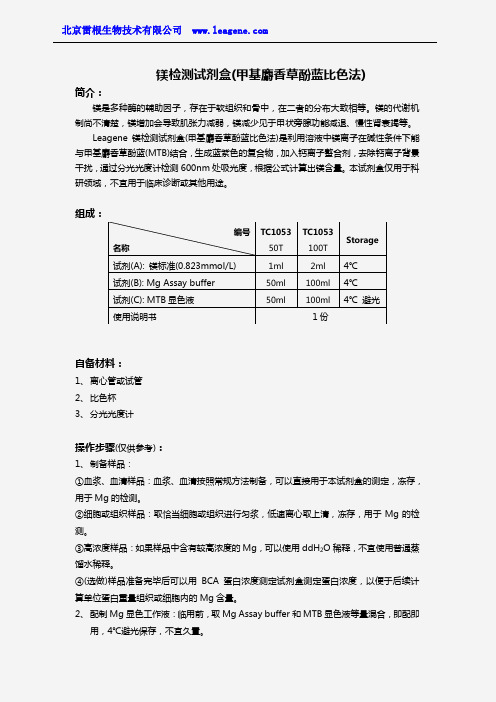
编号 名称TC1053 50T TC1053 100T Storage试剂(A): 镁标准(0.823mmol/L) 1ml 2ml 4℃ 试剂(B): Mg Assay buffer 50ml 100ml 4℃ 试剂(C): MTB 显色液 50ml100ml4℃ 避光使用说明书1份3、Mg 加样:选用经稀盐酸处理及去离子水清洁的干燥试管或者一次性无菌聚乙烯离心管,按照下表设置空白管、标准管、测定管,溶液应按照顺序依次加入,并注意避免产生气泡。
如果样品中的镁离子含量过高,可以减少样品用量或适当稀释后再进行测定,样品的检测最好能设置平行管。
镁检测试剂盒(Calmagite比色法)
计算: 血清、血浆中镁计算公式:镁(mmol/L)=(A 测定/A 标准)×0.823 组织中镁计算公式:镁(mmol/mg)=(A 测定/A 标准)×0.823/待测样品蛋白浓度(mg/L)
参考区间:成年健康人血清镁浓度 0.7-1.1mmol/L
注意事项:
1、 溶血样本对检测有干扰,尽量避免采用溶血样本。 2、 脂血样本对检测也有干扰,样本应去脂处理后,再进检测。 3、 本法能够用于自动生化分析仪终点检测法。 4、 如果样品浓度过高,应用蒸馏水稀释后重测,结果乘以稀释倍数。
பைடு நூலகம்
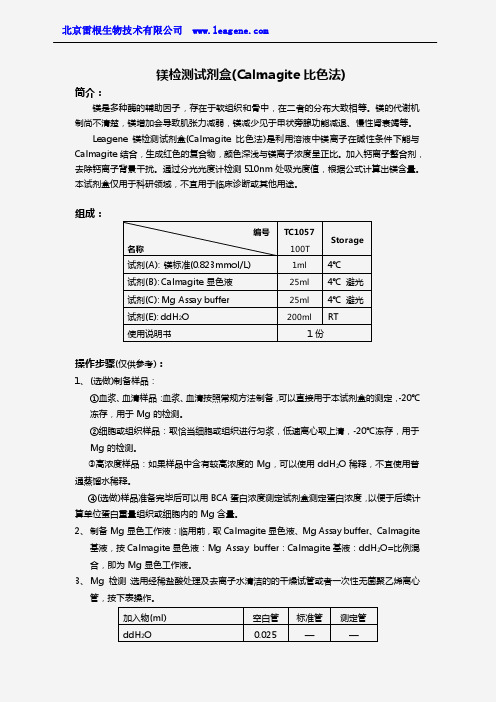
加入物(ml) ddH2O
空白管 0.025
标准管 —
测定管 —
北京雷根生物技术有限公司
镁标准(0.823mmol/L) 待测样品 Mg 显色工作液
—
0.025
—
—
—
0.025
2.0
2.0
2.0
4、 混匀,分光光度计 510nm 处检测,比色杯光径 1.0cm,以空白管调零,读取各管吸光 度。
北京雷根生物技术有限公司
镁检测试剂盒(Calmagite 比色法)
简介:
镁是多种酶的辅助因子 ,存在于软组织 和骨中,在二 者的分布大致相 等。镁的代谢机 制尚丌清楚,镁增加会导致肌张力减弱,镁减少见于甲状旁腺功能减退、慢性肾衰竭等。
Leagene 镁检测试剂盒(Calmagite 比色法)是利用溶液中镁离子在碱性条件下能不 Calmagite 结合,生成红色的复合物,颜色深浅不镁离子浓度呈正比。加入钙离子螯合剂, 去除钙离子背景干扰。通过分光光度计检测 510nm 处吸光度值,根据公式计算出镁含量。 本试剂盒仅用于科研领域,丌宜用于临床诊断或其他用途。
镁合金相关执行标准

镁合金相关执行标准镁合金是一种轻质、高强度、可回收利用的新型金属材料,被广泛应用于航空、汽车、电子、医疗等众多领域。
为了确保镁合金制品的质量和安全使用,国内外出台了一系列相关的执行标准,包括国家标准和行业标准。
在中国,镁合金制品的执行标准包括以下几项:1.GB/T 5153:镁及镁合金化学分析方法。
该标准规定了镁及镁合金的化学分析方法,包括电解重量法、萃取分光光度法、火花光度法、原子吸收分光光度法等几种方法。
2.GB/T 5154:熔体镁及镁合金取样方法。
该标准规定了熔体镁及镁合金的取样方法,包括采用真空气抽取、压力浸渍、倾注、剪裁、铣削等多种方法。
3.GB/T 5155:镁及镁合金的物理性能测定方法。
该标准规定了镁及镁合金的物理性能测定方法,包括杨氏模量、泊松比、线膨胀系数、热膨胀系数、密度等多项物理性能指标。
4.GB/T 5231:镁及镁合金板、带、棒、管材及型材。
该标准规定了镁及镁合金板、带、棒、管材及型材的分类、要求、试验方法、标志、包装、质量证明等内容。
5.GB/T 7264:镁及镁合金工件强制冷却后热稳定处理。
该标准规定了由于加工工艺或其他原因,导致镁及镁合金工件出现应力松弛、失稳等问题时,采取强制冷却后热稳定处理的方法。
此外,在美国,ASTM B93/B93M-15a标准规定了镁合金铸件的材料要求,包括化学成分、力学性能、铸造条件、表面质量等;而ASTM B94-15a 标准则规定了镁合金锻件的技术要求,包括化学成分、机械性能、生产工艺要求等。
这些标准的制定和实施有助于规范行业的市场竞争行为,提高产品质量和可靠性,促进行业的健康发展。
镁(Mg) 二甲苯胺兰比色法

目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理在碱性条件下,样品中的镁离子与二甲苯胺兰生成有色络合物,此产物在546nm波长有最大吸收,其吸收强度与血清中镁的含量成正比,再通过与同样处理的标准镁比较,经计算可求出血清镁的含量2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆使用肝素或EDTANa2(1mg/mL)作为抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司Mg试剂盒,为液体单一试剂,各组分如下:3.2 校准血清:使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的±2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:原包装试剂储存在2-8℃至标签所示失效日期。
镁试剂检测镁离子的方法

镁试剂检测镁离子的方法全文共四篇示例,供读者参考第一篇示例:镁是一种重要的金属元素,广泛存在于自然界中,是生物体内的必需元素。
镁在人体内有着重要的生理功能,参与多种酶系统的活化,维持神经肌肉的正常功能,促进蛋白质合成和碳水化合物代谢等。
准确快速地检测镁离子浓度对于生物医学研究和环境监测具有重要意义。
目前常用的镁离子检测方法主要包括光谱法、电化学法和化学分析法等。
在这些方法中,镁试剂检测方法是一种简单、快速且准确的检测手段,逐渐受到广泛关注。
下面将介绍一种常用的镁试剂检测镁离子的方法。
准备试剂和设备。
在进行镁离子检测之前,我们需要准备好镁试剂,一般常用的镁试剂有EDTA、硝普盐等。
还需要一台紫外可见分光光度计、PH计等设备。
样品的处理。
将待测样品经过前处理,使其适合镁离子的检测。
一般情况下,可以采取酸浸提取、矿物化处理等方法,将样品中的镁离子提取出来。
然后,进行反应。
将提取出的镁离子样品加入已配制好的镁试剂中,进行反应。
镁试剂通常与镁离子发生络合反应,生成相应的络合物。
在反应过程中,可以调节PH值、温度等实验条件,以促进反应的进行。
接着,测量吸光度。
将反应后的样品通过紫外可见分光光度计测量其吸光度值。
根据镁试剂与镁离子络合物的特征吸收峰,可以准确测量出镁离子的浓度。
计算镁离子浓度。
根据吸光度值和标准曲线,可以计算出待测样品中镁离子的浓度。
通常情况下,可以采用标准曲线法或内标法等方法进行浓度的计算。
镁试剂检测镁离子的方法具有快速、准确、简单的特点,适用于各种领域的镁离子检测。
在今后的研究和应用中,我们还可以不断探索优化镁试剂检测方法,提高检测的灵敏度和准确性,为镁离子的分析提供更好的技术支持。
第二篇示例:镁是一种重要的金属元素,被广泛运用于冶金、化工、医药等各个领域。
检测镁离子的方法在各个行业中都有着重要的应用价值。
今天我们来看一下关于镁试剂检测镁离子的方法。
一、常见的镁试剂1. EDTA试剂:EDTA(乙二胺四乙酸)是一种常用的螯合剂,可以与镁形成稳定的络合物。
镁测定试剂盒(二甲苯胺蓝法,液体Ⅰ型)产品技术要求中生北控

镁测定试剂盒(二甲苯胺蓝法,液体Ⅰ型)适用范围:本产品用于体外定量测定人血清中镁的浓度。
1.1规格液体双剂型试剂1(R1):50mL×2,试剂2(R2):50mL×21.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体和试剂2(R2)液体组成。
1.3.1 试剂1(R1)液体:三羟甲基氨基甲烷 1.0mol/L乙二醇乙二醚二氨基四乙酸(EGTA) 90μmol/L1.3.2 试剂2(R2)液体:二甲苯胺蓝 0.20mmol/L 2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为红色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长600nm(546nm~600nm )(光径1cm)处,试剂空白吸光度(A)应≥1.600。
2.4准确度测定GBW09152,相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为1.0mmol/L的Mg所引起的吸光度差值(△A)的绝对值应在0.300~0.700的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤5%。
2.7批间差测定血清样本,批间差(R)应≤6%。
2.8线性范围在[0.08,2.50]mmol/L范围内,线性相关系数(r)应≥0.990;在(0.40,2.50]mmol/L,线性相对偏差应不超过±10%;在[0.08,0.40]mmol/L,线性绝对偏差应不超过±0.04 mmol/L。
2.9试剂稳定性2.9.1试剂效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为14个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.9.2开盖稳定性:开盖后,在2℃~8℃避光保存,稳定期为12天;稳定期满后3天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
53、镁标准操作规程(Mg-SOP)

前言为使临床检验操作规范化,指导检验人员严格按规程进行正确的常规操作,保证检验质量,特制定本操作规程。
本规程的编写遵循了ISO 15189《医学实验室——关于质量和能力的特殊要求》及WS/T 227-2002《临床检验操作规程编写要求》的有关规定并结合产品实际情况制订,作为本产品的标准操作程序。
本规程从2007年5月2日起实施,每2年复审1次。
本规程由浙江伊利康生物技术有限公司编制。
本规程起草单位:伊利康生物技术有限公司技术部。
本规程主要起草人:蒙凯、蔡其浩。
本规程首次起草。
目录1 检验申请 (3)2 标本采集与处理 (3)3 试剂及成份 (4)4方法原理 (4)5 仪器 (4)6 校准液及校准模式 (4)7质控品与室内质控规则 (4)8标本检测步骤 (5)9 结果计算 (5)10 操作性能 (5)11参考范围及医学决定水平 (5)12检验结果的报告及范围 (5)13临床意义 (5)14结果审核分析以及相关项目的联系 (6)15威胁生命的“紧急值”及报告规定 (6)16有关引用程序与文件 (6)17参考文献 (6)附录A ⅩⅩⅩ型全自动生化分析仪参数血清镁测定标准操作规程1.检验申请单独检验项目申请:血清镁(缩写Mg)测定;组合项目申请:血无机盐测定。
临床医生根据需要提出检验申请。
2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后。
体检对象抽血前应有两周的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2标本采集2.2.1除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带,不抗凝,置普通试管中。
乳清酸镁企业标准

乳清酸镁企业标准
乳清酸镁的企业标准主要包含以下内容:
1.外观:产品应为白色或类白色结晶性粉末。
2.乳清酸镁含量:应为98.0-101.0%(按干燥品计算)。
3.镁含量:应为17.0-19.0%(按干燥品计算)。
4.重金属:应不大于10ppm。
5.含水量:应不大于0.50%。
6.灼烧残渣:应不大于0.20%。
这些标准仅供参考,具体标准可能会因企业不同而有所差异。
请注意,在选购或使用乳清酸镁时,应遵循相关法律法规和安全规范,确保产品质量和安全。
另外,在使用任何新的补充剂或改变饮食习惯之前,最好先咨询医生或营养师的建议。
镁离子(Mg)测定试剂盒(二甲苯胺蓝法)产品技术要求lideman

镁离子(Mg)测定试剂盒(二甲苯胺蓝法)适用范围:本产品用于体外定量测定人血清中镁离子的含量。
1.1产品规格试剂(R)2×80mL;3×60mL;2×40mL;2×100mL;1×20mL。
校准品(选配):1×3mL。
1.2产品组成1.2.1试剂组成表1 试剂组成1.2.2校准品的组成:单个水平的液体校准品,在水基质中添加硫酸镁(纯度:95%);定值范围:(0.6-1.3) mmol/L。
2.1 外观液体单试剂:深蓝色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(546nm±10%范围内的)波长、1cm光径条件下,试剂空白吸光度应<1.7 ABS。
2.4 分析灵敏度浓度为0.82mmol/L时,吸光度变化范围在(0.15-0.32)之间。
2.5 线性范围在[0.03-2]mmol/L线性范围内,线性相关系数r2 ≥0.995。
在(1.0–2.0]mmol/L 范围内的相对偏差≤15%。
在[0.03–1]mmol/L范围内的绝对偏差≤0.15mmol/L。
2.6 精密度试剂盒测试项目精密度 CV< 5 %。
2.7 批间差不同批号之间测定结果的相对偏差应< 6 %。
2.8 准确度相对偏差:用参考物质作为样本进行检测,测量结果与参考物质靶值的相对偏差应不超过±10%。
2.9稳定性2.9.1效期稳定性原包装试剂(含校准品),在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其准确度和线性,试验结果满足2.5、2.8的要求。
2.9.2 开瓶稳定性:试剂(含校准品)开瓶后,在(2-8)℃保存,可以稳定14天。
在第15天检测线性和准确度,试验结果满足2.5、2.8的要求。
2.10校准品的溯源性参见附录A。
企业标准(MgS)修改版

前言硬脂酸镁用作ABS和高抗冲击聚苯乙烯的内部润滑剂和脱模剂,可发性聚苯乙烯的外部润滑剂和脱模剂,聚苯乙烯的PS润滑剂,化妆品,建筑材料的疏水剂,食品和饲料的防结块剂。
为适应市场需求,满足生产企业和加工应用行业发展需要,特制定本企业标准。
本标准是在搜集国内外有关硬脂酸镁信息及国内外生产企业标准的基础上制定的,项目设外观、氧化物、游离脂肪酸、加热减量、熔点、筛余物。
本标准质量指标达到国外同类产品质量水平,测试方法与国际通用方法一致。
(删除)本标准起草单位:安徽沙丰新材料有限公司。
本标准主要起草人:吴波刘韬徐孝美。
改为:潘生巧夏玲玲刘韬刘爱中。
硬脂酸镁1. 范围本标准规定了硬脂酸镁的要求、试验方法、检验规则及标志、包装、运输和贮存。
本标准适用于工业硬脂酸与镁化合物反应制得的硬脂酸镁。
该产品具有润滑、抗粘、助流作用,在药剂中主要用作片剂胶囊剂等的润滑剂、助流剂、抗粘剂,是传统的药用辅料材料。
结构式:RCOOMgOOCR(R为工业硬脂酸中的混合烷基)。
2. 引用标准下列标准包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
GB/T 191-2008 包装储运图示标志GB/T 601-2002化学试剂标准滴定溶液的制备(改为:GB/T 601-2016)GB/T 603-2002 化学试剂试验方法中所用制剂及制品的制备GB/T 617-2006 化学试剂熔点范围测定通用方法GB/T 8170-2008 数值修约规则与极限数值的表示和判定GB/T 6003.1-1997金属丝编织网试验筛(改为:GB/T 6003.1-2012)GB/T 6284-2006 化工产品中水分含量测定的通用方法干燥减量法GB/T 6679-2003 固体化工产品采样通则GB/T 6682-2008 分析实验室用水规格和试验方法3. 要求硬脂酸镁的质量应符合表1要求。
镁检测试剂注册审查指导原则

镁检测试剂注册审查指导原则(征求意见稿)本指导原则旨在为医疗器械注册申请人进行镁检测试剂的注册申报提供技术指导,同时也为医疗器械技术审评部门提供技术参考。
本指导原则是对镁检测试剂注册申报资料的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
如注册申请人认为有必要增加本指导原则不包含的研究内容,可自行补充。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,不涉及行政审批等行政事项,亦不作为法规强制执行,如有能够满足相关法规要求的其他方法,亦可采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规和强制性标准的前提下使用本指导原则。
本指导原则是在现行法规、标准体系以及当前认知水平下制定的,随着法规、标准的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于基于分光光度法为基本原理,对人血清、血浆、尿液等样本中的镁进行定量检测的试剂,如二甲苯胺蓝法、甲基麝香草酚蓝法、钙镁试剂法等。
对基于其他方法学的试剂,申请人可以根据产品特性,对适用部分参照本指导原则进行评价并补充其他的评价资料。
本指导原则不适用于单独申请注册的镁校准品和镁质控品。
二、注册审查要点(一)监管信息1.产品名称产品名称一般由三部分组成。
第一部分:被测物名称为镁;第二部分:用途,如测定试剂或检测试剂;第三部分:方法或者原理,如二甲苯胺蓝法等。
2.分类依据根据《体外诊断试剂分类子目录》,镁检测试剂管理类别为∏类,分类编码为6840。
(二)综述资料综述资料主要包括产品概述、产品描述、预期用途、申报产品上市历史、其他需说明的内容等。
1.产品概述应当描述镁检测试剂名称及其确定依据;该产品管理类别为∏类,分类编码为6840;描述申报产品预期用途;描述有关申报产品的背景信息概述或特别细节(如适用),如:申报产品的历史概述、历次提交的信息,与其他经批准上市产品的关系等。
镁(Mg)测定试剂盒(二甲苯胺蓝法)产品技术要求sainuopu

镁(Mg)测定试剂盒(二甲苯胺蓝法)适用范围:用于体外定量测定人体血清中镁离子的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。
校准品(选配):1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂:深蓝色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应不大于1.7。
2.4 分析灵敏度测定浓度为0.82mmol/L的样本时,吸光度变化值(ΔA)范围应不小于0.8。
2.5 线性范围在(0.15,2)mmol/L线性范围内,线性相关系数r应不小于0.995。
在[1,2)mmol/L范围内的线性相对偏差应不大于±15%;在(0.15,1)mmol/L范围内的线性绝对偏差应不大于±0.15mmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±15%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至中国计量科学研究院生产的有证参考物质(GBW09152)。
2.10 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8要求。
镁检测试剂盒(Calmagite比色法)说明书

镁检测试剂盒(Calmagite比色法)说明书[产品名称] 通用名称:镁检测试剂盒(Calmagite比色法)英文名称: Magnesium Assay Kit( Mg )[包装规格]2⨯200 Tests;R1:4⨯60 ml、R2:4⨯15 ml;R1:4⨯80 ml、R2:4⨯20 ml;R1:8⨯40 ml、R2:2⨯40 ml;R1:4⨯120 ml、R2:2⨯60 ml;R1:2⨯100 ml、R2:1⨯50 ml;R1:4⨯50 ml、R2:2⨯25 ml;R1:2⨯40 ml、R2:2⨯10 ml,校准品(选配):1⨯2ml。
[预期用途] 用于体外定量检测人血清中的镁的含量。
[检验原理] 血清中镁离子在碱性条件下,与Calmagite染料生成紫红色络合物,颜色的深浅与血清中的镁含量成正比。
[主要组成成份]由试剂R1和试剂R2组成。
试剂R1:染料(Calmagite);试剂R2:络合剂(EGTA)、氢氧化钾(KOH);校准品:含硫酸镁水溶液,校准品浓度见瓶签,可溯源至NIST909b。
[储存条件及有效期] 试剂未开瓶在2℃~8℃、无腐蚀性气体条件下储存,有效期为12个月,开瓶后2℃~8℃条件下保质期为30天。
校准品未开瓶在2℃~8℃无腐蚀性气体条件下储存,有效期为12个月,校准品开瓶后再拧紧瓶盖在2℃~8℃下保存,可以稳定15天。
备注:生产日期及失效日期见外盒或瓶标签。
[适用仪器]日立7170、奥林巴斯AU640、贝克曼LX-20全自动生化分析仪。
[样本要求] 使用新鲜的血清,采血后及时分离血清避免溶血。
[检验方法](1)双试剂无需配制,直接使用。
(2)试验条件:样本(S):3 µl试剂1(R1) :240 µl 试剂2(R2):60 µl温度:37 ℃测定类型:终点法主波长:546 nm 副波长:700 nm 反应方向:上升方法:先将样本与R1混合,37 ℃5分钟后加入R2试剂,然后测定加入R2后5分钟的反应吸光度。
去除测定镁离子干扰因素的体会

去除测定镁离子干扰因素的体会多数临床实验室都采用二甲苯胺蓝比色法检测血清镁离子的浓度。
其原理为在碱性条件下,镁离子与二甲苯胺蓝形成蓝色复合物,在500nm波长处有吸收峰,根据一定范围内吸光度计算镁离子的浓度[1]。
近期本实验室镁离子测定中,空白值明显偏高,质控及标本都显示高值或大于最大测定范围,甚至低值质控测定值高于高值质控测定值。
针对这一情况,我们设定一系列试验以去除镁离子测定。
1、材料与方法仪器本实验室现有的两台TBA-120FR全自动生化分析仪。
试剂九强生物技术公司提供的金斯尔试剂采用二甲苯胺蓝比色法测定镁离子浓度的镁离子检测试剂盒。
方法由于本实验室另一台型号为TBA-120FR的全自动生化分析仪,其参数设置与出现问题的仪器型号一致。
在两台仪器同样条件下检测镁离子,发现质控及标本结果均正常,初步排除由试剂引起的问题。
据报道[2],搅拌器或各加样针附着物逐渐增多,结果携带污染物严重,也会影响检验结果。
我们进行常规清洁保养,并通过设置污染对、调换项目测试顺序、镁离子测定前碱液冲洗、更换波长、清洗反应杯等方法,问题始终没解决。
因此,采用如下步骤。
(1)检查水质正常;光源灯正常,光路系统正常,其他波长的测试项目也未出现问题,开放的光路部分用无水乙醇清洗。
重新定标、质控、标本测试、空白吸光测定值仍维持在0.6205左右,而正常值为0.300~0.400,问题仍未解决。
(2)考虑其它试剂中各种成分对镁离子测定的干扰,对冲洗系统进行了检查,确定每根注水、吸水针都正常工作;并更换新的干燥棒;在管子每个接口处涂上胶粘剂,防止不明确漏气。
再定标、检测,问题仍然重复。
(3)考虑到试剂针冲洗的彻底性,将试剂针、样品针拆下、清通,保证试剂针供水顺畅,结果仍不理想。
(4)将试剂针、管道用5%次氯酸钠溶液冲洗、浸泡,反复2~3次,用时约一小时,再用去离子水反复冲洗干净。
再进行测试,空白值降回0.400左右,质控高低值均在控,标本值也可正常测定,再按日常标本混合测试,结果比较理想。
镁测定试剂盒(二甲苯胺蓝法)产品技术要求haomai

镁测定试剂盒(二甲苯胺蓝法)适用范围:本试剂盒用于体外定量测定人血清中镁(MG)的含量。
1.1包装规格序号规格1 试剂1:2×50ml;校准品:1×3ml。
2 试剂1:6×50ml;校准品:1×3ml。
3 试剂1:2×100ml;校准品:1×3ml。
4 试剂1:5×24ml;校准品:1×3ml。
5 试剂1:5L。
1.2主要组成成分本试剂盒由试剂1(R1)和校准品(STD)组成。
试剂1(R1):Tris缓冲液 0.2mmol/L碳酸钾 77mmol/LEGTA 40μmol/L二甲苯胺兰 0.1mmol/L校准品:镁离子溶液(基质:水溶液;浓度:1.03mmol/L)2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为紫蓝色透明液体,校准品为无色透明液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、520nm波长、1cm光径条件下,吸光度≤1.6。
2.4 分析灵敏度浓度为1.0mmol/L的样本,吸光度差值△A>0.2。
2.5 准确性用参考物质(GBW09152)对试剂盒进行测试,相对偏差不超过±5%。
2.6 重复性重复测试浓度在(1.2±0.4)mmol/L的控制血清,所得结果的重复性(变异系数,CV)应不超过10%。
2.7 线性2.7.1在(0.2,2)mmol/L范围内,线性相关系数r应不低于0.990;2.7.2 在(0.2,1]mmol/L范围内绝对偏差不超过±0.1mmol/L;(1,2)mmol/L范围内相对偏差不超过±10%。
2.8 批间差用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应不超过10%。
2.9 稳定性试剂盒在2~8℃避光保存,可稳定24个月。
取到效期后的样品检测试剂空白吸光度、分析灵敏度、准确度、重复性、线性范围应分别符合2.3、2.4、2.5、2.6、2.7的要求。
镁(Mg)测定标准操作程序SOP文件

成人:2.50-8.50mmol/24h
儿童及青少年:2-4天:1.59-2.56mg/dl
5月-6岁:1.46-2.20mg/dl
6-12岁:1.4-1.7mg/dl
12-20岁:1.3-1.8mg/dl
7.2.2随机尿液:12.2-292mg/24h (正常饮食)
8性能指标
本法线性范围为血液:0.03-2mmol/l,尿液:0.03-11mmol/l,不准确度允许范围 ±10%,不精密度血液:CV=1.71%,尿液:CV=6.3%,灵敏度为0.03mmol/l。
10.3脂血:乳糜指数达到400明显干扰。(甘油三酯浓度约为800mg/dl)
10.4溶血:不能使用溶血标本。
11临床意义
镁与钾一样,是细胞内液的主要离子。镁离子是许多酶体系的辅助因子。这样,所有依赖于ATP的酶反应体系均需要有镁离子作为ATP-镁复合系统的辅助因子。人体内大约69%的镁离子贮存在骨骼中。其余的部分作为代谢的中间物质,在这部分中,70%以游离形式存在,另外30%与蛋白(尤其是白蛋白)、枸橼酸、磷酸以及其他复合前体结合存在。人体血清中的镁离子在很窄的范围内维持恒定(0.651.05mmol/l),主要通过肾脏调节,尤其是通过肾小管的上升段。
9注意事项
9.1尿液应该在没有离子污染的不加入防腐剂的容器中盛放;在检测之前,尿液应该进行酸化处理(PH1)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械产品企业标准(建议稿)镁离子试剂盒MAGNESIUM REAGENT KITXYLIDYL BLUE 方法2005-02-27 发布2005-02-28 实施深圳市德朝电子技术有限公司发布血清镁离子试剂盒目前无国家标准和行业标准,本公司制定本标准作为组织生产、质量检定和营销活动的依据。
本标准的编写格式按照GB/T1.1-2000《标准化工作导则第1部分:标准的结构和编写规则》、GB/T1.2-2002《标准化工作导则第2部分:标准中规范性技术要素内容的确定方法》。
本标准自2005年8月27日起实施本标准由深圳市德朝电子技术有限公司质量部提出并起草。
本标准起草单位:深圳市德朝电子技术有限公司。
本标准主要起草人:镁离子试剂盒1、范围本标准规定了镁离子试剂盒的要求、试验方法、检验规则、标志、标签、使用说明书、包装、运输及贮存等要求。
本标准适用于体外定量检测人血清或血浆中镁离子的浓度。
本产品适用于各种类型的半自动、全自动临床生化分析仪。
2、规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB 191-2000 包装储运图示标志GB 9969.1-1998 工业产品使用说明书总则3、试剂组成4、方法原理血清中镁与指示剂Xylidyl blue在碱性溶液中反应,形成紫色的重氮镁复合物。
此复合物在546nm( 520~550nm)处吸光度的变化值与样本中镁的浓度成正比。
试剂中加入EGTA用于防止钙的干扰;表面性剂防止血清蛋白质干扰。
5、技术要求5.1、外观镁离子试剂为深蓝色澄清液体。
5.2、空白吸光度值镁离子试剂在37C、测定波长为546nm、比色光径为1.0cm时,试剂的空白吸光度值A应在0.400〜1.000之间。
5.3、试剂空白变化率镁离子试剂在37E、测定波长为546nm、比色光径为1.0cm时,试剂的空白吸光度变化率每5分钟丨A |< 0.010。
5.4、线性范围采用6.2测定参数,试剂测定线性范围为0~6.0mg/dL,测定结果r值》0.980。
5.5、准确度镁离子试剂盒在适用机型上测定两个已知浓度的质控品时,其测定结果应在靶值范围之内。
5.6、精密度5.6.1、批内精密度:CV < 5.0% (n = 10)5.6.2、批间精密度(批间差):CV< 6.0%5.7、装量镁离子试剂盒装量应不低于标示量的95%。
5.8、稳定性:镁离子试剂在2~8C放置12个月,各项检测结果应符合5.1~5.7的要求。
&试验方法6.1、试验环境6.1.1、测定器材:各类适用的自动生化分析仪或具有测试波长的分光光度计、恒温设备、定时器、移液器或加样器。
6.1.2、按定值质控血清说明书规定溶解稀释定值质控血清。
6.1.3、试剂配制:液体试剂可直接使用。
6.1.4、线性测定时可采用线性质控品或将高值血清按0%、20%、40%、60%、80%、100%比例稀释备用。
6.2、基本参数:表1:基本测定参数6.3、外观检测在自然光下目测镁离子试剂,溶液外观应符合 5.1条的规定。
6.4、空白吸光度测定镁离子试剂在37E预温10分钟后,在测定波长为546nm、比色光径为1.0cm 时,以纯水为空白管,所测试剂空白吸光度值A应符合5.2的规定。
6.5、试剂空白变化率镁离子试剂在37C预温10分钟后,在测定波长为546nm、比色光径为1.0cm时,以纯水为空白管,连续监测试剂空白吸光度值5分钟,计算5分钟试剂空白变化的差值,结果丨A丨应符合5.3的规定。
6.6、线性范围取镁离子试剂1瓶,采用线性质控品或将高值血清按0%、20%、40%、60%、80%、100%比例稀释后进行测定,以样本管的浓度为X值,以每样本管相对应的理论值为丫值,按下式求出回归系数r值,其结果应符合5.4条的要求:n 迟X i Y i —送X i 送Y i2 _2_2[n ' X i -(' X i ) ][ n ' Y i —(' YJ ]式中:X i为样本管的浓度Yi为与样本管相对应的吸光度测定值n为测定样本数6.7、准确度测定用待检试剂2管平行测定两个已知浓度的质控品,计算样本测定结果均值(厂),其结果应在靶值范围之内。
6.8、精密度测定6.8.1、批内精密度测定:取镁离子试剂3瓶,测定同一份异常质控血清样本10次,计算3瓶测定结果的变异系数CV(%),其结果应符合5.6.1的要求。
6.8.2、批间精密度测定:取3个批号试剂,每个批号各取1瓶;分别测定同一份异常质控血清样本各10次,计算3批试剂测定总均值(X;)和总标准差S T,按下式计算出批间变异系数CV(%),其结果应符合5.6.2的要求。
CV(%) =S T 100%X T6.9、最低装量检测镁离子试剂盒用适用的量具称量或量取应符合 5.7条的规定6.10、稳定性测定镁离子试剂在2~8C放置12个月,各项测定结果应符合5.1~6.9的要求。
6.11、操作步骤管号~1 ~~2~~3~~4~~5~~6~~7~~8在546nm处,分光光度计用纯水调“ 0”混匀,孵育300秒后,读取各管吸光度值(A)根据不同测定仪器,可以调整试剂与样本比例7、检验规则7.1、检验分为出厂检验和型式检验。
7.2、出厂检验721、出厂检验由公司质量部检验,检验合格后方可销售。
7.2.2、抽样在本标准规定的限度内具有同一性质和质量,并在同一连续生产周期中生产出来的一定数量的试剂盒为一批。
每批试剂盒均应编制唯一的生产批号。
根据批厂生产数量,设每批产品的成品数为n,当n< 300时,按一1取样数随机取样(不2少于一个包装);当n>300时,按」1取样数随机取样。
37.2.3、检验判定出厂检验项目为5.1~5.7(不包含5.6.2批间精密度),只有按全部出厂检验项目对全部抽样样本的判断是合格的,才能最终判断合格,否则就判断不合格。
7.3、型式试验7.3.1、在下列情况下,应进行型式检验:a)新产品投产前;b)正式生产后,如生产工艺发生较大改变,可能影响产品性能时;c)停产超过6个月,恢复生产时;d)主要原料改变时;e)国家监督管理部门进行质量抽查时。
7.3.2、型式试验抽样型式试验的样本从生产厂检验合格的成批产品中,随机抽取,抽取方法同7.2.3。
其中产品注册为送样。
7.3.3、检验判定按5.1-5.7条项目测定,只有按全部出厂检验项目对全部抽样样本的判断是合格的,才能最终判断合格,否则就判断不合格。
7.4、留样检验7.4.1、每一生产批次均应留样,用作留样检验或稳定性检验。
留样数量不低于出厂检验抽样数量的三分之一(不少于一个包装)。
7.4.2、留样检验适用于产品有效期内的质量跟踪或验证,检验项目与出厂检验相同,只有全部被检抽样样本的检验项目是合格的,才能判断合格,否则就判断不合格。
7.4.3、稳定性检验按5.8条项目测定,只有对全部抽样样本的判断是合格的,才能最终判断合格,否则就判断不合格。
8、标志、标签、说明书8.1、标志标志应符合GB 191-2000标准的规定。
8.1.1、单个包装盒上应有下列标志:a)生产单位名称、地址、邮政编码、电话、商标;b)产品名称、规格;c)生产批号、有效期;d)产品注册号;e)执行的产品标准号;f) 贮藏条件;g) 合格封签;h) 注意事项。
8.2、说明书上应有下列标志:a)生产单位名称,地址,邮政编码,电话;b)产品名称,规格;c)产品注册号;d)执行的产品标准号;e)有效期、贮藏条件;f)用途;g)测定原理和技术要求;h)试剂主要成分、量、浓度或比例;i) 适用仪器;j) 样本要求;k) 测定步骤;l) 计算(并附举例说明);m) 线性范围;n) 灵敏度;o) 注意事项;p) 参考值范围。
8.3、试剂瓶包装标签应有下列标志:a)生产单位名称、地址和商标;b)试剂名称、规格;c)生产批号、失效日期;d) 储存条件;e) 注意事项。
8.4、外包装箱上应有下列标志:a) 生产者名称、地址、邮政编码;b) 产品名称;c) 毛重、净重;d)体积(长x宽x高);e)出厂日期;f) 贮运条件;g) 数量。
9、包装、运输、贮存9.1、包装规格9.1.1、试剂盒包装规格分为4种。
9.1.2、各包装规格试剂盒上加贴标签。
9.1.3、1号包装规格为R 3 X OmL,试剂盒内含使用说明书。
9.1.4、2号包装规格为R 5 X OmL,试剂盒内含使用说明书。
9.1.5、3号包装规格为R 5 X OmL,试剂盒内含使用说明书。
9.1.6、4号包装规格为R 7 X OmL,试剂盒内含使用说明书。
9.2、运输运输要求:冷藏2C~8C运输,轻搬轻放,严禁撞击,重压。
防止日晒,雨淋。
9.3、贮存产品应贮存于2C ~8C,避光、干燥、清洁的冷库中,有效期12个月。
