[精品]2019高考化学一轮复习原电池化学电源2(含解析)
2019通用版 高中化学 高考一轮复习 第六章第二节 原电池、化学电源
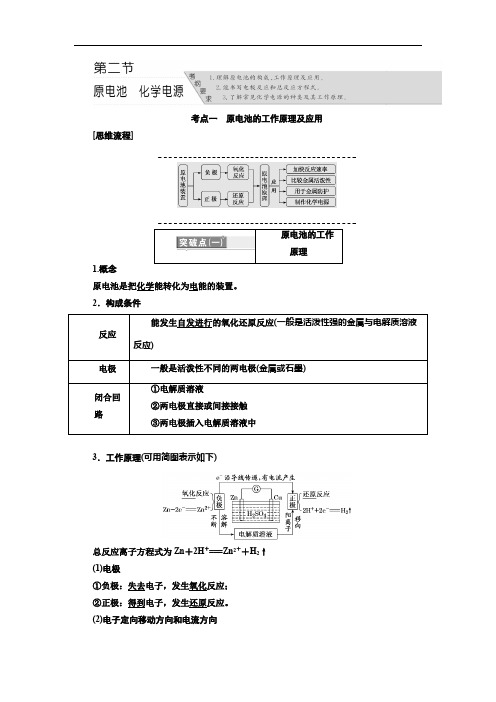
考点一原电池的工作原理及应用[思维流程]原电池的工作1.概念原电池是把化学能转化为电能的装置。
2.构成条件3.工作原理(可用简图表示如下)总反应离子方程式为Zn+2H+===Zn2++H2↑(1)电极①负极:失去电子,发生氧化反应;②正极:得到电子,发生还原反应。
(2)电子定向移动方向和电流方向①电子从负极流出经外电路流入正极;②电流从正极流出经外电路流入负极;故电子定向移动方向与电流方向正好相反。
(3)离子移动方向阴离子向负极移动(如SO2-4),阳离子向正极移动(如Zn2+和H+,溶液中H+在正极上得电子形成氢气在铜片上冒出)。
4.注意事项(1)原电池闭合回路的形成有多种方式,可以是导线连接两个电极,也可以是两电极相接触。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(3)无论在原电池中还是在电解池中,电子均不能通过电解质溶液。
5.单液原电池(无盐桥)和双液原电池(有盐桥)对比6.原电池正、负极的判断[注意]原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定势。
[对点训练]1.判断正误(正确的打“√”,错误的打“×”)。
(1)在原电池中,发生氧化反应的一极一定是负极(√)(2)原电池放电时,电流方向由电源的负极流向正极(×)(3)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动(×)(4)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长(√)2.如图是某同学设计的原电池装置,下列叙述中正确的是()A.电极Ⅰ上发生还原反应,作原电池的负极B.电极Ⅱ的电极反应式为Cu2++2e-===CuC.该原电池的总反应为2Fe3++Cu===Cu2++2Fe2+D.盐桥中装有含氯化钾的琼脂,其作用是传递电子解析:选C该原电池的总反应为2Fe3++Cu===Cu2++2Fe2+。
高考化学大一轮复习 第二单元 原电池和化学电源习题详解课件

3.提示:(1)两电极要和电解质溶液中的金属阳离子尽可能保 持相同,以提高效率;(2)两电极的金属活泼性相差尽量大 一些,现象明显,速率较快。 [高考载体·巧妙利用] (1)负 正 (2)CH4+10OH--8e-===CO23-+7H2O 2O2+4H2O+8e-===8OH- (3)OH-向负极移动 K-向正极移动 (4)4NA (5)负极:CH4+2H2O-8e-===CO2+8H+ 正极:2O2+8H++8e-===4H2O (6)H2
2.提示:粗锌快,因为粗锌中含有杂质金属,可以和锌形成原 电池,反应速率较快。
3.(1)Cu AgNO3 (2)正 Ag++e-===Ag Cu-2e-===Cu2+ (3)Cu Ag
4.解析:(1)Fe3+具有强氧化性,可以把一些金属单质如铁、铜 等氧化成相应的离子,离子方程式是: 2Fe3++Cu===2Fe2++Cu2+。 (2)由反应 2Fe3++Cu===2Fe2++Cu2+可以判断出铜发生氧化 反应,铜作负极,Fe3+发生还原反应,正极可以选用石墨棒, 电解质溶液可以选用氯化铁溶液,仿照教材上的铜锌原电池 装置,可以画出此原电池的装置图。
+
3e
-
+
4H2O===Fe(OH)3+5OH-;书写总反应的离子方程式时,关键是抓
住 Fe 和 Zn 的存在形式分别是 Fe(OH)3 和 Zn(OH)2。
(3)由普通锌锰电池放电时的总反应可知,Zn 作负极,NH4Cl 为电解 质,正极上发生还原反应:MnO2+NH+4 +e-===MnOOH+NH3。 (4)负极实际上是稀土储氢合金吸附的 H2 失去电子生成 H+,H+再与 OH-结合生成 H2O,所以负极的电极反应式为 MH-e-+OH-===M +H2O 答案:(1)CH3OCH3+3H2O-12e-===2CO2+12H+ (2)2Fe(OH)3+3ClO-+4OH-===2FeO42-+5H2O+3Cl- FeO24-+3e-+4H2O===Fe(OH)3+5OH- 2FeO24-+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH- (3)Zn NH4Cl MnO2+NH+4 +e-===MnOOH+NH3 (4)MH-e-+OH-===M+H2O
原电池(第2课时 化学电源)(课件)高二化学(人教版2019选择性必修1)

燃料电池
(2)甲烷燃料电池
用导线连接的两个铂电极插入电解质溶液中,然后向两极分别 通入CH4和O2,该电池的反应式:
② KOH溶液: 负极:CH4+10OH--8e-==CO32-+7H2O 正极:2O2+4H2O+8e-==8OH- 总反应式:CH4+2O2+2OH-==CO32-+3H2O
燃料电池
一次电池
4.锂亚硫酰氯(Li/SOCl2)电池
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 LiAlCl4-SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。 (1)负极材料为__锂__,电极反应为__8_L__i-__8_e_-_=_=_=__8_L_i+_。 (2)正极的电极反应为__3_S_O__C_l_2_+__8_e-__=_=_=_2_S_+__S_O__23-__+__6_C_l_-。
【课堂练习】
3、锂电池是一代新型高能电池,它以质量轻、能量高而受 到了普遍重视,目前已研制成功多种锂电池,某种锂电池的
总反应为Li + MnO2=LiMnO2,下列说法正确的是( B )
A、Li是正极,电极反应为 Li-e- =Li+ B、Li是负极,电极反应为 Li-e- =Li+ C、Li是负极,电极反应为 MnO2 +e-=MnO2 – D、Li是负极,电极反应为 Li-2e- = Li2+
一次电池
1) 锌-锰干电池 (酸性电解质溶液) 正极:
2MnO2 + 2NH4+ + 2e- = 2MnO(OH) + 2NH3↑
负极: Zn – 2e- = Zn2+
2019高考化学人教版一轮课件:6.2原电池化学电源

原电池装置图常见失分点提示
(1)不注明电极材料名称或元素符号。 (2)不画出电解质溶液(或画出但不标注)。 (3)误把盐桥画成导线。 (4)不能连成闭合回路。
第六章
析考点层级突破
悟真题揭密高考
练规范课时冲关
[题组 2]
原电池原理的其他应用
3.(导学号 27346675)有 A、B、C、D 四种金属,做如下实验: ①将 A 与 B 用导线连接起来,浸入电解质溶液中,B 不易腐蚀;② 将 A、D 分别投入等物质的量浓度的盐酸中,D 比 A 反应剧烈;③ 将铜浸入 B 的盐溶液里, 无明显变化, 如果把铜浸入 C 的盐溶液里, 有金属 C 析出。据此判断它们的活动性由强到弱的顺序是 ( A.A>B>C>D C.D>A>B>C B.C>D>A>B D.A>B>D>C )
相反,A 项错误;若两电极分别为 Fe 和碳棒,则 Y 为碳棒,X 为 Fe,B 项错误;X 极失电子,作负极,Y 极上发生的是还原反应,X 极上发生的是氧化反应,C 项错误;电解质溶液为稀硫酸,两金属 作电极,谁活泼谁作负极,D 项正确。]
第六章
析考点层级突破
悟真题揭密高考
练规范课时冲关
原电池正、负极的判断方法
- + -
2 是还原剂,Cr2O7 是氧化剂,即甲烧杯中发生氧化反应,电极反应
+ - +
式为 Fe2 - e ===Fe3 ,乙烧杯中发生还原反应,电极反应式为
3 Cr2O2 7 +6e + 14H ===2Cr +7H2O, A、 B 均错误;外电路的电
- - + +
流是由正极流向负极,即由 b 流向 a,C 正确;电池工作时,盐桥中
(北京专用)2019版高考化学一轮复习 第18讲 原电池 化学电源讲义

性溶液中为CH3OH-6e-+8OH- C +O6H32 2O。 3.书写电极反应式时应注意的问题
(1)两电极得失电子数目相等。
(2)电极反应式常用“ ”而不用“ ”表示。
(3)书写电极反应式时要保证电荷守恒、原子守恒。
典例1 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂
和碳,电解质是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2
L
(标准状况)。
(2)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型充电电池,电解质溶 液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2
Fe(OH)3+4KOH。
①写出正极反应式:
。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,Cu作阴极,对足量KOH溶液进行
电解,当电池中有0.2 mol K2FeO4反应时,在电解池中生成H2
名师点睛 在原电池内电路中,阳离子移向正极,阴离子移向负极(包 括盐桥中的阴、阳离子)。这是因为负极发生的是失电子的反应,致使 该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极发生的 是得电子的反应,致使该极附近有大量负电荷,所以溶液中的阳离子要 移向正极。可以简记为“正正负负”,即带正电荷的移向正极,带负电 荷的移向负极。 4.原电池原理的应用 (1)比较金属的活动性强弱 原电池中,一般活动性相对较强的金属作负极,而活动性相对较弱的金 属(或导电的非金属)作正极。 (2)加快化学反应速率
,电解质溶液是H2SO4溶液,它的电池反应式为Pb+PbO2+2H2SO4 2 PbSO4+2H2O。 3.碱性氢氧燃料电池的电极反应 负极反应式:⑥ 2H2+4OH--4e- 4H2O ;正极反应式:⑦ O2+2H2O+ 4e- 4OH- ;电池反应式:⑧ 2H2+O2 2H2O 。
2019版高考化学一轮复习 第六章 化学反应与能量 第2节 原电池化学电源优质课件

考点 2 化学电源 电极反应式的书写 1.日常生活中的三种电池
(1)碱性锌锰干电池——一次电池。 负极材料是_锌__(Z__n)__,正极材料是碳__棒___。 负极反应:_Z_n_+__2_O__H_-_-__2_e_-_=_=_=_Z__n_(_O_H__)2_; 正 极 反 应 : 2MnO2 + 2H2O + 2e - ===2MnOOH + 2OH-; 总 反 应 : Zn + 2MnO2 + 2H2O===2MnOOH + Zn(OH)2。
3.可充电电池充电时电极与外接电源的正、负极如 何连接?
答案:可充电电池充电时,电池的正极连接外接电源 的正极,电池的负极连接外接电源的负极。
[典题示例] 乙醇燃料电池中采用磺
酸类质子溶剂,在 200 ℃左右时供电, 电池总反应式为 C2H5OH+3O2===2CO2+ 3H2O,电池示意图,下列说法中正确的是( )
解析:Mg/AgCl 电池的电极反应:负极 Mg-2e- ===Mg2+,正极 2AgCl+2e-===2Ag+2Cl-,A 项正确, B 项错误;在原电池的电解质溶液中,阳离子移向正极, 阴离子移向负极,C 项正确;Mg 是活泼金属,能和 H2O 发生反应生成 Mg(OH)2 和 H2,D 项正确。
(5)可充电电池充电时,电池的正极应连接外接电源 的负极。( )
答案:(1)√ (2)× (3)× (4)× (5)×
2.(1)氢氧燃料电池以 KOH 溶液作电解质溶液时, 工作一段时间后,电解质溶液的浓度将_减_小___ (填“减 小”“增大”或“不变”,下同),溶液的 pH_减_小__。
(2)氢氧燃料电池以 H2SO4 溶液作电解质溶液时,工 作 一 段 时 间 后 , 电 解 质 溶 液 的 浓 度 将减__小__ ( 填 “ 减 小”“增大”或“不变”,下同),溶液的 pH_增_大__。
2019版高考一轮复习(江苏专用):专题4 第2讲 原电池 化学电源

第2讲原电池化学电源【2019·备考】最新考纲:1.理解原电池和电解池的工作原理,能写出简单电极反应式和电池反应方程式。
2.了解常见的化学电源,认识化学能与电能相互转化的重要应用。
最新考情:原电池、化学电源的考查,一是在选择题中单独设题,考查新型电池的分析,涉及正负极判断、离子电子流向、两极反应,如2015年碳酸盐燃料电池,2013年Mg-H2O2电池等;二是在填空题中考查,主要涉及电极方程式的书写,如2016年T20(1)、2012年T20(3)Al-Ag2O电池总反应等。
预测2019年高考延续这一命题特点,一是在选择题考查新型电池的分析,二是在填空题中考查电极反应方程式的书写,特别关注新型电池的分析。
考点一原电池的工作原理[知识梳理]1.原电池的概念:将化学能转化为电能的装置。
2.原电池的构成条件(1)能自发地发生氧化还原反应。
(2)两个活泼性不同的电极(材料可以是金属或导电的非金属)。
①负极:活泼性较强的金属。
②正极:活泼性较弱的金属或能导电的非金属。
(3)电极均插入电解质溶液中。
(4)构成闭合回路(两电极接触或用导线连接)。
3.工作原理示例:铜锌原电池名师助学:①辨明三个移动方向:电子从负极流出沿导线流入正极;电流从正极沿导线流向负极;电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
②在原电池中活泼性强的金属不一定作负极,但负极一定发生氧化反应。
如Mg-Al-NaOH溶液组成的原电池,Al作负极。
③盐桥的组成和作用:盐桥中装有饱和的KCl、KNO3等溶液和琼脂制成的胶冻。
盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。
4.原电池原理的三大应用(1)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
2019届高考化学一轮课件619 原电池 化学电源含答案92页共92张

(1)电极:负极为 Zn ,正极为 Cu 。 (2)电极反应:负极:__Z_n__-__2_e_-_=_=_=_Z_n_2_+__, 正极:__C__u_2_+_+__2_e_-_=_=_=_C_u____。 (3)电子移动方向和电流方向:电子从 负极 流出经外电路流入 正极 ; 电流从 正极 流出经外电路流入 负极 。
答案 D
4.分析下图所示的四个原电池装置,其中结论正确的是 ( )
A.①②中 Mg 作负极,③④中 Fe 作负极 B.②中 Mg 作正极,电极反应式为 6H2O+6e-===6OH-+3H2↑ C.③中 Fe 作负极,电极反应式为 Fe-2e-===Fe2+ D.④中 Cu 作正极,电极反应式为 2H++2e-===H2↑
微诊断 判断正误,正确的画“√”,错误的画“×”。 1.NaOH 溶液与稀硫酸的反应是自发进行的放热反应,此反应可以设 计成原电池。( × ) 提示 只有自发进行、放热的氧化还原反应才能设计成原电池。 2.在 Cu/CuSO 4/Zn 原电池中,正电荷定向移动的方向就是电流的方向, 所以 Cu 2+向负极移动。( × ) 提示 原电池闭合回路的意义,在外电路 (导线)中电流由正极流向负 极,而在(内电路)电解质溶液中,阳离子却由负极流向正极,这样才能形成 闭合回路,所以 Cu 2+向正极移动。
四个规律 金属腐蚀的四个规律 1.电解池原理引起的腐蚀 >原电池原理引起的腐蚀 >化学腐蚀>有防护 措施的腐蚀。 2.对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非 电解质溶液。 3.活泼性不同的两金属,活泼性差别越大,腐蚀越快。 4.对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
对点微练一 原电池的工作原理 1.(2018·北京朝阳月考 )如图为锌铜原电池装置图,下列说法不正确的 是( )
高考化学一轮复习专题6.2原电池化学电源(知识讲解)(含解析)

第二讲 原电池 化学电源【真题速递】1.(2019.全国Ⅲ卷)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn (3D −Zn )可以高效沉积ZnO 的特点,设计了采用强碱性电解质的3D −Zn —NiOOH 二次电池,结构如下图所示。
电池反应为Zn(s)+2NiOOH(s)+H 2O(l)−−−→←−−−放充电电ZnO(s)+2Ni(OH)2(s)。
A. 三维多孔海绵状Zn 具有较高的表面积,所沉积的ZnO 分散度高B. 充电时阳极反应为Ni(OH)2(s)+OH −(aq)−e −NiOOH(s)+H 2O(l)C. 放电时负极反应为Zn(s)+2OH −(aq)−2e−ZnO(s)+H 2O(l)D. 放电过程中OH −通过隔膜从负极区移向正极区 【答案】D 【解析】A 、三维多孔海绵状Zn 具有较高的表面积,吸附能力强,所沉积的ZnO 分散度高,A 正确;B 、充电相当于是电解池,阳极发生失去电子的氧化反应,根据总反应式可知阳极是Ni(OH)2失去电子转化为NiOOH ,电极反应式为Ni(OH)2(s)+OH -(aq)-e -=NiOOH(s)+H 2O(l),B 正确;C 、放电时相当于是原电池,负极发生失去电子的氧化反应,根据总反应式可知负极反应式为Zn(s)+2OH -(aq)-2e -=ZnO(s)+H 2O(l),C 正确;D 、原电池中阳离子向正极移动,阴离子向负极移动,则放电过程中OH -通过隔膜从正极区移向负极区,D 错误。
2.(2019.全国1卷)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能B. 阴极区,氢化酶作用下发生反应H 2+2MV 2+2H ++2MV +C. 正极区,固氮酶催化剂,N 2发生还原反应生成NH 3D. 电池工作时质子通过交换膜由负极区向正极区移动 【答案】B 【解析】由生物燃料电池的示意图可知,左室电极为燃料电池的负极,MV +在负极失电子发生氧化反应生成MV 2+,电极反应式为MV +—e —= MV 2+,放电生成的MV 2+在氢化酶的作用下与H 2反应生成H +和MV +,反应的方程式为H 2+2MV 2+=2H ++2MV +;右室电极为燃料电池的正极,MV 2+在正极得电子发生还原反应生成MV +,电极反应式为MV 2++e —= MV +,放电生成的MV +与N 2在固氮酶的作用下反应生成NH 3和MV 2+,反应的方程式为N 2+6H ++6MV +=6MV 2++NH 3,电池工作时,氢离子通过交换膜由负极向正极移动。
(全国通用)2019版高考化学一轮复习第6章化学反应与能量第2节原电池化学电源学案.doc

第二节 原电池 化学电源考纲定位全国卷5年考情1.理解原电池的构成、工作原理及2017 年:III 卷 T H应用,能写出电极反应和总反应方 2016 年:II 卷 Tu ; m 卷 T H程式。
2015 年:I 卷 T H ; II 卷 T 26(I . 2) 2. 了解常见化学电源的种类及其工2014年:I 【卷弘作原理。
2013 年:I 卷 Tio 、T27⑸、T28⑸;II 卷 Tn考点1丨原电池及其工作原理(对应学生用书笫115页)[考纲知识整合]1. 原电池的概念把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2. 原电池的构成(1) 有两个活动性不同的电极(常见为金属或石墨)。
(2) 将电极插入电解质溶液屮。
(3) 两电极I'可构成闭合冋路(两电极接触或用导线连接)o (4) 能自发发生氧化还原反应。
3. 工作原理电极名称 负极正极电极材料 Zn Cu 电极反应 Zn — 2e —ZnCu'* + 2e _=Cu反应类型氧化反应还原反应⑵原电池中的三个方向① 电子方向:从负极流出沿导线流入正极;② 电流方向:从疋极沿导线流向兔极;③ 离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较■ ■ Zn& IE EZn 必扁液4溶液(1)反应原理图I中Zn在CuSOi溶液中直接接触Cu2+,会有一部分Zn与CiT直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图II中Zn和CuSO;溶液分别在两个池中,Zn与C『+不直接接触,不存在Zn与C『+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
(4)盐桥作用①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
4.原电池原理的三个应用(1)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
2019届一轮复习人教版 原电池 化学电源 课件(33张)

3.用a、b、c、d四种金属按表中所示的装置进行实验,
下列叙述D中正确的是( ) 甲
乙
丙
—
+
+
实验
装置
现象
a 不断溶解
c 的质量增加 a 上有气泡产生
A .装置甲中的b金属是原电池的负极 B.装置乙中的c金属是原电池的阴极 C.装置丙中的d金属是原电池的正极 D.四种金属的活泼性顺序:d>a>b>c
一、教材 高考
2.(溯源题)(2019·上海化学,8)图1是铜锌原电池示意 x轴表示实验时流入正极的电子的物质的量,y轴表示 ③ 。
①铜棒的质量 ②c(Zn2+)
不变
增加
不变 考查视角 原电池的工作原理
③c(H+) 减少
③c(SO42-)
高考启示 透彻地理解好教材中原电池的工作原理并
能灵活运用
二、典例剖析
Li+
Li1-xMn2O4+xLi 控制Li的个数,改变
C.放电时,a 极锂的M化n的合价价态发生变化
转解
命D.题放视电时角,溶新液型中化Li+学从电b 向源a的迁移工作原理及电极反应式析
的正确书写
备考指南 关注新型化学电源的构造并能用所学知
识分析其工作原理
二、真题3
3.(2019·课标全国Ⅰ,11)微生物电池是指在微生物的作
原电池的工作原理及其应用
01 教材 高考
02
典例剖析
03 反思归纳
04 思维建模
教材图解
人教版选修4 P71 图4-1 锌铜原电池装置
e-
ClC- l- 桥KK+ +
负极
e-
Zn-2e- =Zn2+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《原电池化学电源》李仕才(考试时间:45分钟满分:100分)一、单项选择题:本题包括10小题,每小题5分,共50分。
1.下列反应没有涉及原电池的是( )A.生铁投入稀盐酸中B.铜片与银片用导线连接后,同时插入FeCl3溶液中C.纯锌投入硫酸铜溶液中D.含铜的铝片投入浓硫酸中答案:D解析:A项生铁中含碳,投入稀盐酸中时构成原电池;B项构成原电池;C项锌置换出铜片,构成锌铜原电池;D项浓硫酸不导电,不能构成原电池。
2.以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )A.锌片溶解了1 mol,铜片上析出1 mol H2B.两极上溶解和析出的物质的质量相等C.锌片溶解了31 g,铜片上析出了1 g H2D.锌片溶解了1 mol,硫酸消耗了0.5 mol答案:A解析:在涉及原电池的有关计算中,关键是要把握住一点即两极得、失电子数相等。
利用这一特点,我们从电极反应式看:负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。
当溶解1 mol锌时失去2 mol电子,铜片上析出1 mol 氢气得到 2 mol电子,得失电子守恒,这样即可推出A正确。
3.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间。
下列对实验结束时现象的描述不正确的是( )A.装置Ⅰ左侧的液面一定会下降 B.左侧液面装置Ⅰ比装置Ⅱ的低C.装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀答案:B解析:装置Ⅰ中铁钉处于盐酸的蒸气中,被侵蚀而释放出H2,使左侧液面下降,右侧液面上升;装置Ⅱ中铁钉同样处于盐酸的蒸气中,不同的是悬挂铁的金属丝由铁丝换成了铜丝,由于Fe比Cu活泼,在这种氛围中构成的原电池会加速铁钉的侵蚀而放出更多的H2,使左侧液面下降得更多,右侧液面上升得更多;装置Ⅲ中虽然悬挂铁钉的还是铜丝,但由于浓硫酸有吸水性而无挥发性,使铁钉处于一种较为干燥的空气中,因而在短时间内几乎没有被侵蚀。
4.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是( )A .该电池能够在高温下工作B .电池的负极反应式为C 6H 12O 6+6H 2O -24e -===6CO 2↑+24H +C .放电过程中,H +从正极区向负极区迁移D .在电池反应中,每消耗1 mol 氧气,理论上能生成标准状况下CO 2气体22.46 L答案:B解析:由葡萄糖微生物燃料电池结构示意图可知,此燃料电池是以葡萄糖为燃料,以氧气为氧化剂,以质子交换膜为隔膜,以惰性材料为电极的一种燃料电池。
由于是微生物电池,而微生物的生存温度有一定的范围,所以高温下微生物不一定能够生存,A 错误;放电时,负极:C 6H 12O 6被微生物分解成CO 2、H +和电子,电极反应式:C 6H 12O 6+6H 2O -24e -===6CO 2↑+24H +,B 正确;负极产生的H +透过质子交换膜进入正极室,C 错误;负极产生的电子沿外电路从负极流向正极,在正极室与H +和氧气发生反应生成水。
总反应方程式为C 6H 12O 6+6O 2===6CO 2+6H 2O ,由总反应方程式可知:每消耗1 mol 氧气,理论上可以生成标准状况下CO 2气体22.4 L ,D 错误。
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn +MnO 2+H 2O===ZnO +Mn(OH)2下列说法中,错误的是( ) A .电池工作时,锌失去电子 B .电池正极的电极反应式为 MnO 2+2H 2O +2e -===Mn(OH)2+2OH -C .电池工作时,电子由正极通过外电路流向负极D .外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g 答案:C解析:本题要求利用原电池的原理,分析碱性锌锰电池:锌为负极,在反应中失去电子,故A 正确;电池工作时,电流由正极通过外电路流向负极,而电子定向移动方向与电流方向相反,故C 错误;由电子守恒知D 项正确;由该电池反应的总反应式和原电池的原理写出正极反应式知B 正确。
6.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH 为电解液。
下列有关说法中不正确的是( )A .该能量转化系统中的水可以循环使用B .燃料电池系统产生的能量实际上来自于水C .水电解系统中的阳极反应为:4OH --4e -===2H 2O +O 2↑ D .燃料电池放电时的负极反应为:H 2-2e -+2OH -===2H 2O 答案:B解析:A选项,由转化系统可知,水分解后还可再生成,则水是循环使用的,故A正确;B选项,燃料电池系统产生的能量来源于化学反应产生的化学能,属于化学能转变为电能,不是来源于水,故B错误;C选项,水电解时,阳极上氢氧根离子失电子生成水和氧气,电极反应式为4OH--4e-===2H2O+O2↑,故C正确;D选项,该燃料电池放电时的负极发生氧化反应,在碱性环境下,2OH-+H2-2e-===2H2O,故D正确。
7.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。
电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )①每消耗1 mol CH4可以向外电路提供8 mol e-②负极上CH4失去电子,电极反应式为CH4+10OH--8e-===CO2-3+7H2O ③负极上是O2获得电子,电极反应式为O2+2H2O+4e-===4OH-④电池放电后,溶液的pH不断升高A.①② B.①③ C.①④ D.③④答案:A解析:CH4在铂电极上发生类似于CH4在O2中燃烧的反应,即CH4→CO2,严格地讲生成的CO2还与KOH反应生成K2CO3,化合价升高,失去电子,是电池的负极,电极反应式为CH4-8e-+10OH-===CO2-3+7H2O,1 mol CH4参加反应有8 mol e-发生转移,O2在正极上发生反应,获得电子,电极反应式为O2+2H2O+4e-===4OH-。
虽然正极产生OH-,负极消耗OH-,但从总反应式CH4+2O2+2KOH===K2CO3+3H2O可看出是消耗了KOH,所以电池放电时溶液的pH值不断下降,故①②正确,③④错误。
8.某蓄电池反应式为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2。
下列推断中正确的是( )①放电时,Fe为正极,Ni2O3为负极②充电时,阴极上的电极反应式是Fe(OH)2+2e-===Fe+2OH-③充电时,Ni(OH)2为阳极④蓄电池的电极必须是浸在某碱性溶液中A.①②③ B.①②④C.①③④ D.②③④答案:D9.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2OPbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是( )A.需要定期补充硫酸B.工作时铅是负极,PbO2是正极C.工作时负极上发生的反应是Pb-2e-+SO2-4===PbSO4D.工作时电解质的密度减小答案:A解析:铅蓄电池放电时相当于原电池,Pb是负极,PbO2是正极,负极发生的反应是Pb失去电子生成Pb2+,Pb2+与溶液中的SO2-4生成PbSO4沉淀,放电时消耗的硫酸与充电时生成的硫酸相等,在电池制备时,PbSO4的量是一定的,制成膏状,干燥后再安装,说明H2SO4不用补充;放电时,H2SO4被消耗,溶液中的H2SO4的物质的量浓度减小,所以溶液的密度也随之减小。
10.锌锰干电池在放电时,电池总反应方程式可以表示为Zn+2MnO2+2NH+4===Zn2++Mn2O3+2NH3+H2O,此电池放电时,在正极(碳棒)上发生反应的物质是( )A.Zn B.碳C.MnO2和NH+4 D.Zn2+和NH3答案:C解析:根据原电池原理,锌为负极,碳棒为正极,锌应参加负极反应,而MnO2在反应中得到电子,应当在正极区发生反应,又由于NH+4移向正极,在正极发生反应生成NH3。
本题考查原电池电极反应式的书写,阳离子移动的方向。
二、非选择题:本题包括4个小题,共50分.11.(除标注外,每空2分,共10分)分析如图所示的四个装置,回答下列问题:①装置a和b中铝电极上的电极反应式分别为______________________、_____________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为____________________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。
根据上述现象试推测金属铬具有的两种重要化学性质为__________________________、__________________________。
答案:(1)①2H++2e-===H2↑Al-3e-+4OH-===AlO-2+2H2O②铁(1分)O2+2H2O+4e-===4OH-(2)金属铬的活动性比铜的强且能和稀硫酸反应生成H2金属铬易被稀硝酸钝化(1分)解析:(1)在稀H2SO4溶液中,镁比铝活泼,铝电极作正极,正极的反应式为2H++2e-===H2↑。
在NaOH溶液中,铝比镁活泼,铝电极作负极,负极的反应式为Al-3e-+4OH-===AlO-2+2H2O。
在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO-3的还原反应,产生气泡。
装置d相当于金属铁发生吸氧腐蚀,铜电极作正极,正极的电极反应式为O2+2H2O+4e-===4OH-。
(2)由图1可知还原性Cr>Cu,但在稀硝酸中却出现了反常,结合稀硝酸的氧化性,不难推测铬被稀硝酸钝化,导致活动性降低。
12.(除标注外,每空2分,共10分)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。
一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。
回答下列问题:(1)这种电池放电时发生的化学反应方程式:_______________________________________________________________________。
(1)此电池的正极发生的电极反应:________________________________________________________________________,负极发生的电极反应:_____________________________________________________。
