口服液体药用聚酯瓶
YBB00092002-2015 口服液体药用高密度聚乙烯瓶

YBB00092002-2015口服液体药用高密度聚乙烯瓶Koufuyeti Yaoyong Gaomidujuyixi PingHDPE Bottles for Oral Liquid Preparation本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服液体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100mL,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,本品的密度应为0.935~0.965g/cm3。
【密封性】(1)取本品适量,用测力扳手(扭矩见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
(2)取本品适量,分别在瓶内装入适量玻璃珠,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭矩见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27KPa,维持2分钟,瓶内均不得有进水或冒泡现象。
表1 瓶与盖的扭力【抗跌性】取本品适量,加入水溶液至标示容量,从规定高度(表2)自然跌落至水平刚性光滑表面,应不得破裂。
表2 跌落高度【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法(1)在温度20±2℃,相对湿度65±5%的条件下,放置14天,重量损失不得过0.2%。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
【溶出物试验】供试液的制备:分别取本品平整部分内表面积600cm2(分割成长5cm,宽0.3cm的小片)三份,分置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作一次。
Q_CX 002-2018口服固体药用聚酯瓶(含垫片)

口服固体药用聚酯瓶(含垫片)质量标准Q/CX 002-20182018-12-01制定 2019-02-27实施广西陆川县诚信包装材料厂(普通合伙)Q/CX 002-2018口服固体药用聚酯瓶(含垫片)Koufuguti Yaoyong Juzhi Ping(Handianpian)本标准适用于以聚对苯二甲酸乙二醇酯(PET)为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
用于生产药品包装用聚酯/铝/聚酯封口垫片应符合药用聚酯/铝/聚酯封口垫片(YBB00142005-2015)的各项规定。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为1.31~1.38g/cm3。
【密封性】取本品适量(瓶盖附上垫片),于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1),置于抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭矩【振荡试验】取本品适量(瓶盖附上垫片),于每个瓶内装入酸性水为标示剂,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量(瓶盖附上垫片),照水蒸气透过量测定法(YBB00092003-2015)第三法(2),在试瓶中加无水氯化钙,在对照瓶加入相等量玻璃小球后,将盖子旋紧,热封垫片后,再去掉垫片中的纸片层。
YBB药包材标准

YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00142004笔式注射器用铝盖
YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片
YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片
YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖
YBB00182004铝/聚乙烯冷成型固体药用复合硬片
YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙Байду номын сангаас璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00242003121℃内表面耐水性测定法和分级
YBB00262003硼硅玻璃药用管
YBB00272003低硼硅玻璃药用管
YBB00282003钠钙玻璃药用管
YBB00292003硼硅玻璃输液瓶
YBB00302003低硼硅玻璃模制药瓶
YBB00312003硼硅玻璃模制注射剂瓶
YBB00322003低硼硅玻璃模制注射剂瓶
YBB00092002口服液体药用高密度聚乙烯瓶质检方案

YBB00092002口服液体药用高密度聚乙烯瓶质检方案
YBB00092002-2015口服液体药用高密度聚乙烯瓶是新版药包材标准的重要组成部分,是直接接触药品,并长期存储药品,保证药品安全的药品包装材料。
济南三泉中石实验仪器有限公司该标准规定给药厂、包材厂制定了一套全面的YBB00092002口服液体药用高密度聚乙烯瓶质检方案:
YBB00092002口服液体药用高密度聚乙烯标准适用于以高密度聚乙烯为主要原料,采用注吹成型工艺生产的口服液体制剂塑料瓶。
关键词:口服液体药用高密度聚乙烯瓶检测仪器、口服液体药用高密度聚乙烯瓶实验项目、口服液瓶实验设备
密封性测试仪
1.口服液体药用高密度聚乙烯瓶密封性测试
检测设备:密封性测试仪MFY-05A、瓶盖扭矩仪NLY-20A
标准要求:
测试方法:将口服液体药用高密度聚乙烯瓶用瓶盖扭矩仪NLY-20A封口,然后用密封性测试仪MFY-05A抽真空至真空度为27kPa维持2分钟,瓶内均不得有进或冒泡现象。
瓶盖扭矩仪
2.口服液体药用高密度聚乙烯瓶阻隔性能测试
检测设备:水蒸气透过量测试仪、透湿杯
标准要求:照水蒸气透过量测定法(YBB00092003-2015)第三法(1)在稳定20℃±2℃,相对湿度65%±5%的条件下,放置14天,重量不得损失过0.2%。
3.口服液体药用高密度聚乙烯瓶抗跌落性能测试。
口服液体药用高密度聚乙烯瓶存放时限验证的方案定

目录1、概述2、验证目的3、验证小组成员及职责4、验证范围和时间安排5、验证前的准备6、验证内容7、验证检测结果记录8、偏差处理9、验证结果评价10、附表我公司产品右旋布洛芬口服混悬液及对乙酰氨基酚口服溶液所用口服液体药用高密度聚乙烯瓶是以高密度聚乙烯为主要原料,采用注吹成型工艺生产而成,质量符合国家药品监督管理局国家药品包装容器(材料)标准YBB00092002规定。
质量管理部定期对该物料供应商“武汉环岛塑胶包装有限公司”进行审计,并进行了现场审计,该产品从投料生产至内包装完成均在洁净厂房内完成,内包装采用洁净的聚乙烯塑料袋密封。
按质量标准的要求储存于干燥清洁的环境中。
我公司物资管理部严格按计划采购物料,所购置口服液体药用高密度聚乙烯瓶存放于干燥通风的库房内,不具备微生物生长的条件,且存放时间均未超过12个月,使用该塑料瓶的产品药物相容性试验结果符合规定,批批产品均全检合格,每年进行的持续稳定性考察各项考察项目结果亦符合规定,为将微生物污染的风险降低,确保公司产品的质量,公司决定对口服液体药用高密度聚乙烯瓶的储存期进行验证,初步定为12个月,在该考察时间点合格后仍进行后续15个月、18个月的考察,以确保12个月储存期限数据的可靠性。
2.验证目的:通过本验证来确定我公司所用口服液体药用高密度聚乙烯瓶的储存期限。
从源头保证产品的质量,从而保障人民用药的安全有效。
3.验证小组成员及职责:验证范围:口服液体药用高密度聚乙烯瓶储存期限的相关验证活动。
时间安排:验证小组计划于年月日至年月日按验证方案进行验证。
5.验证前的准备5.1文件5.2人员培训人员培训签到及培训结果见附表1。
5.3设备、仪器、仪表确认6.验证内容6.1验证方法:经统计截止目前我公司库存的所有批次口服液体药用高密度聚乙烯瓶储存时间接近6个月,先对我公司库存的所有批次的口服液体药用高密度聚乙烯瓶再次进行微生物限度检测,经检验合格后方可使用,将检验结果作为6个月的考察数据,并抽取3批不同规格的口服液体药用高密度聚乙烯瓶作为储存期限验证的考察对象,继续进行第9个月、12个月、15个月、18个月的考察,以确定12个月储存期限数据的可靠性。
YBB20102012口服液体药用高密度聚乙烯瓶

YBB20102012口服液体药用高密度聚乙烯瓶Koufuyeti Yaoyong Gaomidujuyixi PingHDPE Bottles for Oral Liquid Preparation本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服液体制剂用塑料瓶。
本标准不适用于含铝塑封口垫片的塑料瓶。
【外观】取本品适量,在自然光线明亮处60 cm距离,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱* 取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB60342012)测定,应为0.935~0.965g/cm3。
【密封性】(1)取本品适量,用测力扳手(扭力见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
(2)取本品适量,分别在瓶内装入适量玻璃珠,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内均不得有进水或冒泡现象。
表1 瓶与盖的扭力盖直径(mm)扭力(N·cm)15~20 25~11021~30 25~14531~40 25~180 【抗跌落】取本品适量,加入水溶液至公称容量,从规定高度(表2)自然跌落至水平刚性光滑表面,应不得破裂。
表2 跌落高度规格(ml)跌落高度(m)<120 1.2≥120 1.0【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB60302012)第三法(1)实验条件B测定,不得过0.2%。
【炽灼残渣】取本品2.0g,依法(中国药典2010版二部附录ⅧN)测定,遗留残渣不得过0.1%(含遮光剂的瓶炽灼残渣不得过3.0%)。
口服液体药用聚酯瓶-质量标准
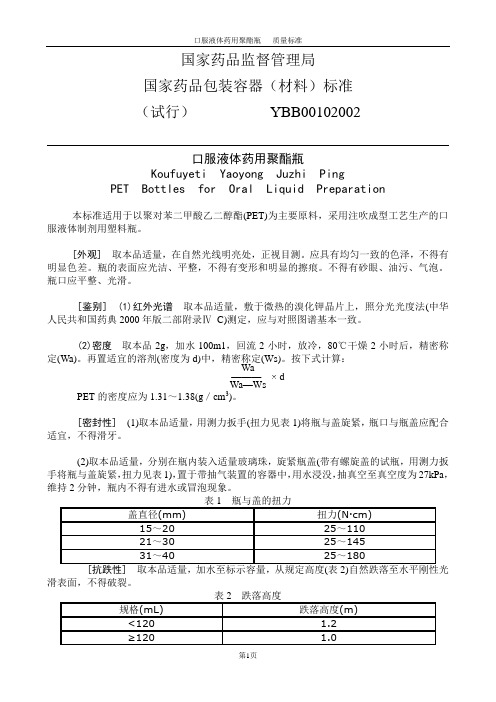
国家药品监督管理局国家药品包装容器(材料)标准(试行)YBB00102002口服液体药用聚酯瓶Koufuyeti Yaoyong Juzhi PingPET Bottles for Oral Liquid Preparation本标准适用于以聚对苯二甲酸乙二醇酯(PET)为主要原料,采用注吹成型工艺生产的口服液体制剂用塑料瓶。
[外观] 取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
[鉴别] (1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录ⅣC)测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100m1,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按下式计算:Wa———× dWa—WsPET的密度应为1.31~1.38(g/cm3)。
[密封性] (1)取本品适量,用测力扳手(扭力见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
(2)取本品适量,分别在瓶内装入适量玻璃珠,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
滑表面,不得破裂。
[水蒸气渗透]取本品适量,在瓶中加入水至标示容量,旋紧瓶盖,精密称重。
在相对湿度65%±5%和温度20℃±2℃条件下,放置14天,取出后,再精密称重。
按下式计算,重量损失不得过0.2%。
W1—W2—————×100%W1—W0W1:试验前液体瓶及水溶液的重量(g);W0:空液体瓶的重量(g);W2:实验后液体瓶及水溶液的重量(g)。
[乙醛 ] 照气相色谱法(中华人民共和国药典2000年版二部附录V E)测定,不得过千万分之二。
YBB药包材标准

YBB药包材标准YBB00012002 低密度聚乙烯输液瓶(试行)YBB00022002 聚丙烯输液瓶(试行)YBB00032002 钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002 药用氯化丁基橡胶塞(试行)YBB00052002 药用溴化丁基橡胶塞(试行)YBB00062002 低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002 聚丙烯药用滴眼剂瓶(试行)YBB00082002 口服液体药用聚丙烯瓶(试行)YBB00092002 口服液体药用高密度聚乙烯瓶(试行)YBB00102002 口服液体药用聚酯瓶(试行)YBB00112002 口服固体药用聚丙烯瓶(试行)YBB00122002 口服固体药用高密度聚乙烯瓶(试行)YBB00132002 药品包装用复合膜、袋通则(试行)YBB00142002 药品包装材料与药物相容性试验指导原则(试行)YBB00152002 药品包装用铝箔YBB00162002 铝质药用软膏管YBB00172002 聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002 聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002 双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋YBB00202002 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212002 聚氯乙烯固体药用硬片YBB00222002 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232002 聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00242002 聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002 聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002 口服固体药用聚酯瓶YBB00272002 钠钙玻璃药瓶YBB00282002 低硼硅玻璃管制口服液体瓶YBB00292002 硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2 YBB00302002 低硼硅玻璃管制注射剂瓶YBB00312002 钠钙玻璃模制注射剂瓶YBB00322002 硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002 低硼硅玻璃安瓿YBB00342002 多层共挤输液用膜、袋通则YBB00012003 细胞毒性检查法YBB00022003 热原检查法YBB00032003 溶血检查法YBB00042003 急性全身毒性检查法YBB00052003 皮肤致敏检查法YBB00062003 皮内刺激检查法YBB00072003 原发性皮肤刺激检查法YBB00082003 气体透过量测定法YBB00092003 水蒸气透过量测定法YBB00102003 剥离强度测定法YBB00112003 拉伸性能测定法YBB00122003 热合强度测定法YBB00132003 密度测定法YBB00142003 氯乙烯单体测定法YBB00152003 偏二氯乙烯单体测定法YBB00162003 内应力测定法YBB00172003 耐内压力测定法YBB00182003 热冲击和热冲击强度测定法YBB00192003 垂直轴偏差测定法YBB00202003 平均线热膨胀系数的测定法YBB00212003 线热膨胀系数的测定法YBB00222003 砷、锑、铅浸出量的测定法YBB00232003 三氧化二硼测定法YBB00242003 121℃内表面耐水性测定法和分级YBB00262003 硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003 低硼硅玻璃药用管YBB00282003 钠钙玻璃药用管YBB00292003 硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003 低硼硅玻璃模制药瓶YBB00312003 硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003 低硼硅玻璃模制注射剂瓶YBB00332003 钠钙玻璃管制注射剂瓶YBB00342003 药用玻璃成份分类及其试验方法YBB00352003 低硼硅玻璃管制药瓶YBB00362003 钠钙玻璃管制药瓶YBB00372003 抗生素瓶用铝塑组合盖YBB00382003 口服液瓶撕拉铝盖YBB00392003 外用液体药用高密度聚乙烯瓶YBB00402003 输液瓶用铝塑组合盖YBB00072003 原发性皮肤刺激检查法YBB00082003 气体透过量测定法YBB00092003 水蒸气透过量测定法YBB00102003 剥离强度测定法YBB00112003 拉伸性能测定法YBB00122003 热合强度测定法YBB00132003 密度测定法YBB00142003 氯乙烯单体测定法YBB00152003 偏二氯乙烯单体测定法YBB00162003 内应力测定法YBB00172003 耐内压力测定法YBB00182003 热冲击和热冲击强度测定法YBB00192003 垂直轴偏差测定法YBB00202003 平均线热膨胀系数的测定法YBB00212003 线热膨胀系数的测定法YBB00222003 砷、锑、铅浸出量的测定法YBB00232003 三氧化二硼测定法YBB00242003 121℃内表面耐水性测定法和分级YBB00262003 硼硅玻璃药用管YBB00272003 低硼硅玻璃药用管YBB00282003 钠钙玻璃药用管YBB00292003 硼硅玻璃输液瓶YBB00302003 低硼硅玻璃模制药瓶YBB00312003 硼硅玻璃模制注射剂瓶YBB00322003 低硼硅玻璃模制注射剂瓶YBB00332003 钠钙玻璃管制注射剂瓶YBB00342003 药用玻璃成份分类及其试验方法YBB00352003 低硼硅玻璃管制药瓶YBB00362003 钠钙玻璃管制药瓶YBB00372003 抗生素瓶用铝塑组合盖YBB00382003 口服液瓶撕拉铝盖YBB00392003 外用液体药用高密度聚乙烯瓶YBB00402003 输液瓶用铝塑组合盖YBB00012004 低硼硅玻璃输液瓶YBB00022004 硼硅玻璃管制口服液体瓶YBB00032004 钠钙玻璃管制口服液体瓶YBB00042004 硼硅玻璃管制药瓶YBB00052004 硼硅玻璃模制药瓶YBB00062004 预灌封注射器用硼硅玻璃针管YBB00072004 预灌封注射器用氯化丁基橡胶活塞YBB00082004 预灌封注射器用溴化丁基橡胶活塞YBB00092004 预灌封注射器用不锈钢注射针YBB00102004 预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004 预灌封注射器组合件(带注射针)YBB00122004 笔式注射器用硼硅玻璃珠YBB00132004 笔式注射器用硼硅玻璃套筒YBB00142004 笔式注射器用铝盖YBB00152004 笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004 笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004 口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004 铝/聚乙烯冷成型固体药用复合硬片YBB00192004 双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004 玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004 药品包装用铝塑封口垫片通则YBB00222004 口服制剂用硅橡胶胶塞、垫片YBB00232004 药用合成聚异戊二烯垫片YBB00242004 塑料输液容器用聚丙烯组合盖YBB00252004 胶囊用明胶YBB00262004 包装材料红外光谱测定法YBB00272004 包装材料不溶性微粒测定法YBB00282004 乙醛测定法YBB00292004 加热伸缩率测定法YBB00302004 挥发性硫化物测定法YBB00312004 包装材料溶剂残留量测定法。
微生物限度检查记录版
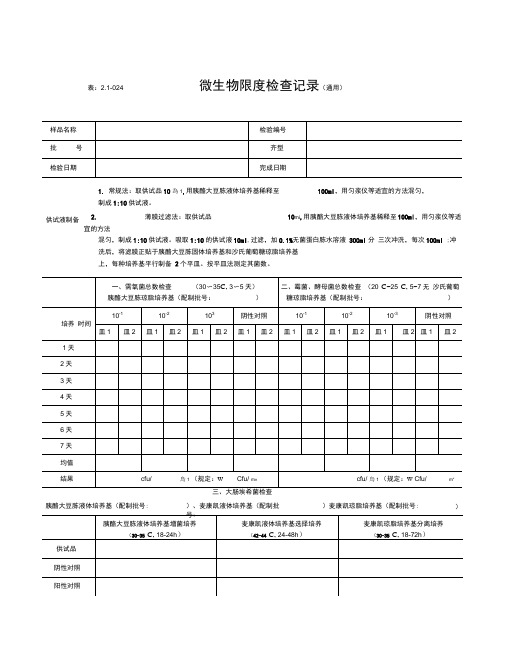
表:2.1-024微生物限度检查记录(通用)1. 常规法:取供试品10為1,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2. 薄膜过滤法:取供试品10mi ,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
吸取1:10的供试液10ml ,过滤,加0.1%无菌蛋白胨水溶液 300ml 分 三次冲洗,每次100ml ;冲洗后,将滤膜正贴于胰酪大豆胨固体培养基和沙氏葡萄糖琼脂培养基 上,每种培养基平行制备 2个平皿。
按平皿法测定其菌数。
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批)麦康凯琼脂培养基(配制批号: )供试液制备微生物限度检查记录、需氧菌总数检查30〜353〜5)、霉菌、酵母菌总数检查20C〜25C,5〜7天)三糖铁琼脂斜面穿刺接种 (18〜24h )三、控制菌检查 (30-35 C )检验者:表:2.1-024号:结论本品经按《中国药典》2015年版“非无菌产品微生物限度检查法”进行检验,结果审核者:微生物限度检查记录(丸剂)供试液制备供试液。
胰酪大豆胨增菌 (18〜24h )RV 沙门选择培养木糖赖氨酸脱氧胆酸分离培养(18〜48h )胰酪大豆胨液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)四、沙门菌检查 (30 °C 〜35C ) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:五、耐胆盐革兰阴性菌检杳胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:审核者:检验者: 表:2.1-024阴性对照阳性对照三、大肠埃希菌检查)、麦康凯液体培养基(配制批结果□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出/g)四、沙门菌检查(30°C〜35C)胰酪大豆东液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:、表: 2.1-024 微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)审核者:检验者:表:2.1-024 微生物限度检查记录(30〜353〜5天)、霉菌、酵母菌总数检查20C〜25C, 5〜7天)1、 口服液体药用聚酯瓶:取数个试瓶,加入1/2标示容量的氯化钠注射液,将盖旋紧,振摇1分钟,即得供试液。
口服液体药用高密度聚乙烯瓶质量鉴定依据YBB00092002

口服液体药用高密度聚乙烯瓶质量鉴定依据
YBB00092002
口服液体药用高密度聚乙烯瓶直接接触药品的包装容器是药品不可分割的一部分,它伴随药品生产、流通及使用的全过程。
由于口服液体药用高密度聚乙烯瓶所包装的药品的性质不同,在药品存储过程中可能会被所接触的药品溶出、或与药品发生互相作用、或被药品长期浸泡腐蚀脱片而直接影响药品的质量。
所以要用专业的实验室检测设备对口服液体药用高密度聚乙烯瓶质量进行鉴定。
YBB00092002-2015《口服液体药用高密度聚乙烯瓶》标准要求的口服液体药用高密度聚乙烯瓶质量鉴定依据:
1、外观质量应具有均匀色泽,无明显色差。
瓶表面应光洁、平整,无变形和明显的擦痕。
无砂眼、油污、气泡。
瓶口应平整、光滑。
2、鉴别主要通过红外光谱和密度的测定对材料进行定性
3、密封性去瓶适量,分别在试验瓶内装入适量玻璃珠,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧),置入带抽气装置的容器中,用水浸泡,抽真控至27kPa,维持2min,瓶内无进水或冒泡现象。
4、密封性每个试验瓶装入酸性水位标示剂,旋紧瓶盖后用溴酚蓝试纸(将滤纸稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶颈,至振荡器振荡30min后,溴酚蓝试纸不变色。
5、水蒸气渗透试验瓶内加入无水氯化钙干燥剂,在温度为25度、相对湿度为95%条件下放置72H,根据放置前后的质量变化,测量水蒸气渗透量,不超过100mg/(24h.L)。
济南三泉中石实验仪器有限公司始终坚持为用户提供真诚、专业、及。
YBB00102002《口服液体药用聚酶瓶》实验项目

YBB00102002《口服液体药用聚酶瓶》实验项目
药用聚酶瓶特点:具有高强力学承载能力、出色的耐磨、抗冲击性能和抗跌落性能,质量技术指标达到YBB00102002《口服液体药用聚酶瓶》质量技术标准,在口服液体瓶包装上的使用越来越广泛。
密封性测试仪
YBB00102002《口服液体药用聚酶瓶》实验项目
密封性:置于带抽气装置的容器中,用水浸没,抽真空至真空度为
27KPa,维持2分钟,瓶内不得有进水或冒泡现象。
瓶盖扭矩:用测力扳手(扭矩见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
抗跌落:从规定高度(表2) 自然跌落至水平刚性光滑表面,应不得破裂。
水蒸气透过量:在温度20℃±2℃对湿度65%±5% 的条件下,放置14天,重量损失不得过0.2%。
济南三泉中石实验仪器有限公司生产的执行YBB00102002《口服液体药用聚酶瓶》实验仪器有:密封性测试仪MFY-05A、瓶盖扭矩仪LY-05A、透湿杯、自动旋盖仪XGY-03、瓶跌落试验机DLJ-2000.
瓶盖扭矩仪
济南三泉中石实验仪器有限公司生产的满足YBB00102002《口服液体药用聚酶瓶》检测项目的设备具有用户分级管理权限,可以实验实验数据的溯源性。
YBB00102002《口服液体药用聚酶瓶》实验设备维护技巧;
1、确保设备周围没有干扰源。
口服液体药用聚乙烯瓶质量标准

1、 目的 为便于控制口服液体药用高密度聚乙烯瓶的质量,特制定本标准2、 依据 国家药品包装容器标准3、 适用范围 本标准适用于口服液体药用高密度聚乙烯瓶。
4、责任者 质量部对本标准的实施负责5、 内容【外观】 取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 密度 取本品2g ,加水100ml ,回流2小时,放冷,80℃干燥2小时后,精密称重(W a )。
再置适宜的溶剂(密度为d )中,精密称定(W b )。
按下式计算:d W W W ba a⨯-【密封性】 (1)取本品适量,用测力扳手(扭力见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜。
(2)取本品适量,分别在瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa ,维持2分钟,瓶内不得有进水或冒泡现象。
表1:瓶与盖的扭力:【抗跌性】 取本品适量,加水至标示容量,从规定高度(表2)自然跌落至水平刚性光滑表面,不得破裂。
【水蒸气渗透】 取本品适量,,在瓶中加水至标示容量,盖紧瓶盖,精密称重。
在相对湿度55%±5%和温度20℃±2℃条件下,放置14天,取出后,再精密称重。
按下式计算,重量损失不得过0.2%。
%W W W W 1000121⨯--W 1 实验前液体瓶及水溶液的重量(g ) W 0 空液体瓶的重量(g ) W 2 试验后液体瓶及水溶液的重量(g )【炽灼残渣】 取本品2.0g ,依法检查,遗留残渣不得过0.1%。
(含遮光剂的瓶炽灼残渣不得过3.0%)。
【溶出物实验】 溶出物试液的制备 分别取本品平整部分内表面积600cm 2(分割成长5cm ,宽0.3cm 的小片)三份置具塞锥形瓶中,加水适量。
振摇洗涤小片,弃去水,重复操作一次。
口服液体药用聚酯瓶及瓶盖质量标准
XXXXXXXXX有限公司
一、目的:建立口服液体药用聚酯瓶及瓶盖的质量标准,确保所用口服液体药用聚酯瓶及瓶盖的质量。
二、范围:本规定适用于口服液体药用聚酯瓶及瓶盖的质量控制。
三、责任:
四、内容:
1.标准来源:
国家药品包装容器(材料)标准YBB00102002-2015 口服液体药用聚酯瓶
2.技术要求
3.贮存条件:密封,存于清洁、通风处。
4.相关标准操作规程:口服液体药用聚酯瓶检验操作规程(SOP-ZL-JG(BC)-017)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:口服液体药用聚酯瓶。
6.内部使用的物料代码:详见产品所对应的口服液体药用聚酯瓶物料代码。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:见包装材料样稿。
9.注意事项:密封,遮光。
10.复验期:执行“物料有效期及复验期管理规程(SMP-WL-008)”相关规定。
11.文件附件:共0份。
12.修订及变更历史:。
口服液体药用聚酯瓶安全操作及保养规程

口服液体药用聚酯瓶安全操作及保养规程口服液体药用聚酯瓶是一种常见的药品包装容器,通常用于存放口服液体药品。
在使用这类瓶子时,我们需要注意一些安全操作和保养规程,以确保药品的质量和使用安全性。
本文将对口服液体药用聚酯瓶的安全操作和保养规程进行详细介绍。
安全操作1. 选择适当的瓶子首先,我们需要选择适当的口服液体药用聚酯瓶。
一般情况下,我们应该选择相应规格的瓶子,比如需要存放多少药品就选择多大的瓶子。
同时,我们应该注意瓶子的密封性和耐药品性。
如果瓶子不够密封或者不够耐药品,就容易导致药品变质或者污染。
2. 消毒清洗在使用新的口服液体药用聚酯瓶之前,我们需要先进行消毒和清洗。
具体的操作步骤如下:1.将瓶子、瓶盖、注射针等放入消毒器中进行高温消毒。
2.取出消毒器中的瓶子,放在洁净的工作台上。
3.用热水清洗瓶子和瓶盖,然后用干净的棉签或纱布擦干。
4.将注射针插入瓶盖中,放在紫外线灯下照射30分钟,以消毒瓶盖和注射针。
3. 储存在使用后的口服液体药用聚酯瓶,我们需要注意储存的方法。
一般来说,药品应该放在阴凉干燥、光线不直射的地方,避免长时间暴露在日光下或者高温环境中,以避免药品变质或者失效。
4. 使用在使用口服液体药用聚酯瓶时,我们需要注意以下方面:1.手部需清洁干净,手套操作更佳。
2.打开瓶盖前应摇匀,尤其是混悬剂的药品。
3.使用时,尽量不要触碰注射针头,以避免污染。
5. 处置在使用完口服液体药用聚酯瓶之后,我们需要对瓶子进行妥善处置。
一般来说,我们应将瓶子彻底倒空,并清洗干净。
然后,我们可以将瓶子和瓶盖分别放在垃圾桶中,并进行分类处理。
保养规程除了在安全操作方面的注意点,我们还需要了解口服液体药用聚酯瓶的保养规程。
如果能够做好瓶子的保养,可以提高瓶子的使用寿命,节约成本。
以下是口服液体药用聚酯瓶的保养规程:1. 避免阳光直接照射口服液体药用聚酯瓶最怕长时间暴露在阳光下,可以放在抽屉或柜子里。
2. 避免摔打口服液体药用聚酯瓶是一种易碎的物品,避免在使用、运输和储存过程中碰撞和摔打。
口服液体药用聚酯瓶易氧化物不确定度评定

·药物研发·口服液体药用聚酯瓶易氧化物不确定度评定姚琳张芳芳(上海市食品药品包装材料测试所上海 201203)摘要目的:建立药用口服液体药用聚酯瓶的易氧化物测定不确定度评定方法。
方法:依据标准YBB00102002-2015测定口服药用液体聚酯瓶的易氧化物并进行不确定评定。
结果:药用聚酯瓶的易氧化物合成不确定度为0.03 mL,扩展不确定度为0.06 mL,结果表示为:(0.46±0.06)mL(k=2)。
结论:口服液体药用聚酯瓶易氧化物测定不确定度主要来源于温度、取样面积、测量的重复性等的不确定度。
关键词聚酯瓶易氧化物不确定度中图分类号:R944.1 文献标志码:A 文章编号:1006-1533(2022)13-0107-03引用本文姚琳, 张芳芳. 口服液体药用聚酯瓶易氧化物不确定度评定[J]. 上海医药, 2022, 43(13): 107-109. Uncertainty evaluation of the reducing substances in polyethylene terephthalatebottles for oral liquid preparationYAO Lin, ZHANG Fangfang(Shanghai Food and Drug Packaging Material Control Center, Shanghai 201203, China) ABSTRACT Objective: To establish an uncertainty evaluation method for the determination of the reducing substances in the polyethylene terephthalate bottles for oral liquid preparation. Methods: The reducing substances in polyethylene terephthalate (PET) bottles for oral liquid preparation was determined and their uncertainty was evaluated based on YBB00102002-2015. Results: The combined uncertainty of reducing substances in the PET bottles was 0.03 mL and the expanded uncertainty was 0.06 mL. Uncertainty result was expressed as (0.46±0.06) mL (k=2). Conclusion: The uncertainty of reducing substances in PET bottles for oral liquid preparation is mainly derived from the uncertainty of temperature, sampling area and analysis repeatability.KEy wORDS PET bottles; reducing substances; uncertainty口服液体药用聚酯瓶被广泛应用于医药包装。
口服固体药用聚酯瓶质量标准_概述及解释说明

口服固体药用聚酯瓶质量标准概述及解释说明1. 引言1.1 概述本文主要介绍口服固体药用聚酯瓶质量标准的概况和解释。
口服固体药品广泛使用聚酯瓶进行包装,而聚酯瓶的质量标准对于保证药品质量和安全性至关重要。
因此,制定并严格执行口服固体药用聚酯瓶质量标准具有重要意义。
1.2 文章结构本文分为五个部分进行阐述。
首先是引言部分,介绍了文章的背景和目的。
其次是口服固体药用聚酯瓶质量标准的重要性,包括聚酯瓶在药品包装中的作用、使用优势和限制以及对质量与安全性需求的要求。
接下来是口服固体药用聚酯瓶质量标准的主要内容解释说明,包括外观要求、物理性能测试指标及其解释说明以及化学性能测试指标及其解释说明。
然后是口服固体药用聚酯瓶质量标准实施与监控,涵盖了质检流程与方法介绍、质检结果分析与评估方法说明以及问题及不合格品管理与处理步骤建议。
最后是结论与展望部分,总结文章的主要内容并提出未来需要进一步研究的方向。
1.3 目的本文的主要目的是介绍口服固体药用聚酯瓶质量标准的概述和解释说明。
通过对口服固体药用聚酯瓶质量标准重要性、主要内容以及实施与监控等方面进行详细阐述,旨在加强对该领域知识的了解和理解。
同时,也为相关行业提供指导和参考,促进聚酯瓶质量标准在口服固体药品包装中的有效应用,并提高药品质量和安全性的保障水平。
2. 口服固体药用聚酯瓶质量标准的重要性2.1 聚酯瓶在药品包装中的作用口服固体药用聚酯瓶广泛应用于制药领域,主要用于包装口服固体药物。
由于聚酯材料具有良好的透明度、耐腐蚀性和机械强度,因此被广泛选择作为药品包装容器。
聚酯瓶能够有效保护药物免受外界环境的影响,降低其中化学反应或微生物污染的风险,并延长了药物的保质期。
2.2 口服固体药用聚酯瓶使用的优势和限制使用口服固体药用聚酯瓶具有以下优势:首先,它们具有较高的耐用性和密封性能,可以确保内部药物不会泄漏或受到污染。
其次,与玻璃瓶相比,口服固体药用聚酯瓶更轻便、易于携带,并且不易碎裂。
中国药典中口服药用塑料瓶及组件质量标准制定的建议

·医药论坛·中国药典中口服药用塑料瓶及组件质量标准制定的建议陆维怡 吕杨格格(上海市食品药品包装材料测试所 上海 201203)摘要目前我国口服药用塑料瓶及组件质量标准在一定时期内对产品质量控制起到了积极作用,随着包材管理模式的变化和行业发展,也反映出一定的局限。
为更好保证药品质量,助力企业创新发展,对口服药用塑料瓶及组件质量标准发展方向进行探讨。
建议在中国药典药包材标准体系的建设中,借鉴各国药典的长处,结合我国现状和发展需求,形成有自身特色的口服药用塑料瓶及组件标准。
关键词口服药用塑料瓶包装系统质量标准中图分类号:R951 文献标志码:C 文章编号:1006-1533(2022)13-0067-03引用本文陆维怡, 吕杨格格. 中国药典中口服药用塑料瓶及组件质量标准制定的建议[J]. 上海医药, 2022, 43(13):67-69; 73.Suggestions on drafting standards for plastic bottles and componentsfor oral dosage forms in Chinese pharmacopoeiaLU Weiyi, LYU Yanggege(Shanghai Food and Drug Packaging Material Control Center, Shanghai 201203, China) ABSTRACT At present, the quality standards for oral medicinal plastic bottles and components in China have playeda positive role in product quality control within a certain period, however it also reflects certain limitations with the changes in the packaging management and industry development. The development direction of our standard is discussed in order to better ensure the quality of medicines and help enterprises to innovate and develop. It is suggested that in the process of formulating the standard system of pharmaceutical packaging in Chinese pharmacopoeia, the advantages of pharmacopoeia of various countries should be used for reference and the current situation and development needs of our country should be also considered so as to form a standard for plastic bottles and components for oral dosage forms with its own characteristics.KEy wORDS plastic bottles and components for oral dosage forms; packaging system; standard口服药用塑料瓶及组件是国内外广泛用于口服制剂的一种包装形式,一般采用高密度聚乙烯、聚丙烯、聚酯等材料制得,由瓶身、瓶盖组成,带或不带封口垫片,可不经清洗和灭菌直接用于包装口服药品,故其质量优劣直接关系到药品的安全。
口服液体药用聚酯瓶-质量标准
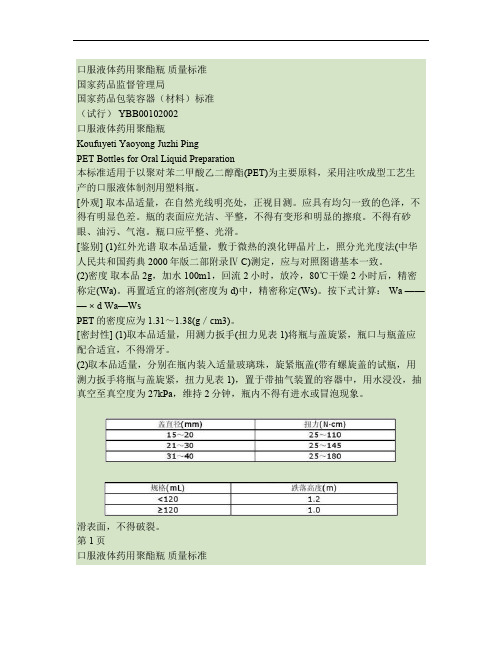
口服液体药用聚酯瓶质量标准国家药品监督管理局国家药品包装容器(材料)标准(试行) YBB00102002口服液体药用聚酯瓶Koufuyeti Yaoyong Juzhi PingPET Bottles for Oral Liquid Preparation本标准适用于以聚对苯二甲酸乙二醇酯(PET)为主要原料,采用注吹成型工艺生产的口服液体制剂用塑料瓶。
[外观] 取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
[鉴别] (1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录Ⅳ C)测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100m1,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按下式计算: Wa ——— × d Wa—WsPET的密度应为1.31~1.38(g/cm3)。
[密封性] (1)取本品适量,用测力扳手(扭力见表1)将瓶与盖旋紧,瓶口与瓶盖应配合适宜,不得滑牙。
(2)取本品适量,分别在瓶内装入适量玻璃珠,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
滑表面,不得破裂。
第1页口服液体药用聚酯瓶质量标准[水蒸气渗透] 取本品适量,在瓶中加入水至标示容量,旋紧瓶盖,精密称重。
在相对湿度65%±5%和温度20℃±2℃条件下,放置14天,取出后,再精密称重。
按下式计算,重量损失不得过0.2%。
W1—W2 —————×100% W1—W0W1:试验前液体瓶及水溶液的重量(g); W0:空液体瓶的重量(g); W2:实验后液体瓶及水溶液的重量(g)。
口服液体药用高密度聚乙烯瓶存放时限验证方案

目录1、概述2、验证目的3、验证小组成员及职责4、验证范围和时间安排5、验证前的准备6、验证内容7、验证检测结果记录8、偏差处理9、验证结果评价10、附表1.概述:我公司产品右旋布洛芬口服混悬液及对乙酰氨基酚口服溶液所用口服液体药用高密度聚乙烯瓶是以高密度聚乙烯为主要原料,采用注吹成型工艺生产而成,质量符合国家药品监督管理局国家药品包装容器(材料)标准YBB00092002规定。
质量管理部定期对该物料供应商“武汉环岛塑胶包装有限公司”进行审计,并进行了现场审计,该产品从投料生产至内包装完成均在洁净厂房内完成,内包装采用洁净的聚乙烯塑料袋密封。
按质量标准的要求储存于干燥清洁的环境中。
我公司物资管理部严格按计划采购物料,所购置口服液体药用高密度聚乙烯瓶存放于干燥通风的库房内,不具备微生物生长的条件,且存放时间均未超过12个月,使用该塑料瓶的产品药物相容性试验结果符合规定,批批产品均全检合格,每年进行的持续稳定性考察各项考察项目结果亦符合规定,为将微生物污染的风险降低,确保公司产品的质量,公司决定对口服液体药用高密度聚乙烯瓶的储存期进行验证,初步定为12个月,在该考察时间点合格后仍进行后续15个月、18个月的考察,以确保12个月储存期限数据的可靠性。
2.验证目的:通过本验证来确定我公司所用口服液体药用高密度聚乙烯瓶的储存期限。
从源头保证产品的质量,从而保障人民用药的安全有效。
3.验证小组成员及职责:4.验证范围和时间安排验证范围:口服液体药用高密度聚乙烯瓶储存期限的相关验证活动。
时间安排:验证小组计划于年月日至年月日按验证方案进行验证。
5.验证前的准备文件人员培训人员培训签到及培训结果见附表1。
设备、仪器、仪表确认6.验证内容验证方法:经统计截止目前我公司库存的所有批次口服液体药用高密度聚乙烯瓶储存时间接近6个月,先对我公司库存的所有批次的口服液体药用高密度聚乙烯瓶再次进行微生物限度检测,经检验合格后方可使用,将检验结果作为6个月的考察数据,并抽取3批不同规格的口服液体药用高密度聚乙烯瓶作为储存期限验证的考察对象,继续进行第9个月、12个月、15个月、18个月的考察,以确定12个月储存期限数据的可靠性。
