大连理工大学普通化学9
化学专业各校考试科目汇总

分子化学
成
配位化学
有机化学(一)
综合化学 有机合成
物理化学实验
有机化学(一)/高 聚合物结构表征/有机合
分子化学
成
二级学科 有机化学
物理化学
有机化学
有机合成
一级学科
二级学科
一级学科 一级学科 二级学科
化学
无机化学 分析化学 有机化学 物理化学 高分子化学
与物理
化学生物学 化学(方
向:01-03) 化学(方
源材料 分析化学/物 二级学科 理化学/环境 化学/食品安 全与药物化
学
有机化学
无机化学(A) 物理化学
二级学科 材料化学
无机化学 分析化学
物理化学(含结构
无机化学 分析化学 有机化学 无机化学/分析化学 有机化学/高分子物 理及化学 无机化学 有机化学/高分子物 理及化学
专业知识综合(物化) 专业知识综合(分析) 专业知识综合(有机) 专业知识综合(物化)
化学与生物 工程学院
化学与化工 学院
化学学院 化学与环境
工程学院 化学化工学
院 环境与化学
工程学院 六盘水师范 学院联合培
养项目
化工学院 (主校区)
招生方式 专业名称
业务课一
业务课二
复试科目
一级学科 化学
无机化学
物理化学
有机化学 化学综合
化学(方
向:01无机
化学/04物理 化学)
化学(方
一级学科
向:02分析 化学)
学 哈尔滨师范大
学 海南师范大学
化学系
高分子科学 系
生物医学研 究院
化学化工学 院
化学与药学 学院
化学与化工 学院
《普通化学及实验》课程教学大纲

《普通化学及实验》课程教学大纲一、课程的性质与任务本课程是非化学化工类理工科专业本科生的公共基础课程,同时是为非化学化工类理工科大学生开设的唯一的一门化学课程。
本课程的任务是使学生掌握大学层次的化学基本概念、基本原理、基本技能;同时传授给学生以化学的观点、化学的思维方法和研究方法,激发学生的创新意识,培养学生在未来工程实际中以化学观点审视和解决问题的能力。
二、课程内容、基本要求与学时分配(理论课32学时+实验课24学时)普通化学理论课:32学时(30学时理论课,2学时考试)(一)气体和稀溶液2学时1.理解理想气体的概念,掌握理想气体状态方程及其应用。
2.掌握混合气体中组分气体分压的概念和分压定律。
3.掌握稀溶液的依数性。
(二)化学反应的能量与方向4学时1.了解并掌握化学反应的计量式、化学计量数和反应进度的概念。
2.了解系统、环境、状态、状态函数、热和功等热力学常用术语,熟悉热力学第一定律。
3.了解焓、焓变的基本概念,掌握热化学方程式,掌握标准摩尔生成焓(Δf H m ),化学反应的标准摩尔焓变(Δr H m )和Hess定律及有关计算。
4.了解自发变化,了解化学反应熵变和吉布斯函数变在一般条件下的的意义。
掌握化学反应的标准摩尔熵变、标准吉布斯函数变的计算,了解非标准吉布斯函数变的计算,能够用非标准吉布斯函数变和标准吉布斯函数变判断反应进行的方向。
(三)化学反应速率与化学平衡5学时1.了解化学反应速率、(基)元反应、复合反应、反应速率方程式、速率系数、反应级数等概念。
2.掌握浓度、温度与化学反应速率的定量关系。
3.了解活化分子、活化能的概念,熟悉反应速率理论,会用活化分子的概念解释浓度、温度和催化剂对反应速率的影响。
4.掌握标准平衡常数、多重平衡规则,能够进行平衡组成的简单计算。
5.熟悉反应商判据和Le Chaterlier原理,掌握浓度、压力、温度对化学平衡移动的影响。
(四)酸碱平衡和沉淀溶解平衡5学时1.了解酸碱质子理论的基本概念。
普通化学第六版答案

普通化学第六版答案【篇一:大学普通化学(第六版大连理工)】普通化学习题答案一、是非题(用“+”、“—”表示正确和错误)第2、3、5、6、10、11、12题“+” 其它题“—” 二、选择题1-5b、c、d、d、a 6-9 d、bcd、ac、cd 三、填空题1 ②⑤①③⑥④2 ①>④>② = ③>⑤3 ①31②4 Ⅲa ③4s24p14 略5 分子或晶体中相邻原子之间的强烈相互吸引作用离子间、共价键和金属键 6 方向饱和7 sp3109。
28’sp2杂化3个平面三角形dsp2杂化 4个 90。
sp3杂化 4个 109。
28’11sp3杂化 4个 109。
28’正四面体形 d2sp3 6个 90。
正八面体形121318禁带宽度(eg)不同(半导体eg<2ev,绝缘体eg>6ev),导体有导带,绝缘体则无。
19 (不要求)错位粒子缺陷间隙离子缺陷杂质粒子缺陷空位缺陷四、简答题 1①该写法违背了洪特规则。
根据洪特规则,n相同的电子应尽先占据m不同的轨道,且自旋平行。
②该写法违背了泡力不相容原理。
3s只有一个轨道,只可容纳两个自旋相反的电子。
③该写法违背了能量最低原理。
n相同l不同的轨道,能量高低为ns<np。
3是指从la到lu的15个元素随着原子序数的递增原子半径依次缩小不明显的累积现象。
4①为非极性分子,在其同种分子之间只有色散力。
②均为非极性分子,它们之间只存在色散力。
③为极性分子,分子之间存在色散力、诱导力和取向力。
④为极性分子,且n与h之间能形成氢键,所以nh3分子间存在色散力、诱导力、取向力,还有氢键。
5沸点与分子间力关系一般为:分子间力越大,沸点越高。
所以沸点高的物质分子间力大。
分子间力大小:i2>br2>cl2>o2>n2>h2 6卤代烃hx虽然是极性分子,但分子间作用力仍以色散力为主。
对相同结构类型的物质色散力随相对分子质量的增大而增大。
hcl,hbr,hi 三者的相对分子质量依次增大,分子间力也依次增大,它们的熔沸点同样依次增高。
大连理工课程清单_建设工程学部 (1)
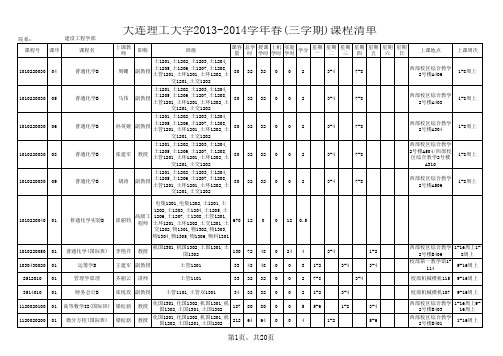
1110020010 D01
大学物理A1
常葆荣
56
56
0
0
3.5
7-8
3-4
西部校区综合教 学2号楼B103/西 部校区综合教学2 号楼B401
1-14周上
1110020010 D02大学物理A1荆亚玲
56
3-4 5-6
西部校区综合教 1-16周上9学2号楼B403 16周上 西部校区综合教 1-16周上 学2号楼B401
第1页,共20页
大连理工大学2013-2014学年春(三学期)课程清单
院系: 课程号 课序 建设工程学部 课程名 上课教 师 职称 班级 课容 总学 授课 上机 实验 星期 星期 星期 星期 星期 星期 星期 学分 量 时 学时 学时 学时 一 二 三 四 五 六 日 上课地点 上课周次 材1301,材1302,材1303,材1304, 材1305,材日1301,动1301,动 1302,动1303,动1304,动1305,动 1306,化1301,化1302,化1303,化 1304,化1305,化1306,化1307,化 副教 1308,化1309,化1310,化1311,化 210 112 104 授 1312,化创1301,化创1302,生 1301,生1302,土管1301,土环 1301,土环1302,土交1301,土交 1302,土木1301,土木1302,土木 1303,土水1301,土水1302,土水 1303,土水1304,土水1305 材1301,材1302,材1303,材1304, 材1305,材日1301,动1301,动 1302,动1303,动1304,动1305,动 1306,化1301,化1302,化1303,化 1304,化1305,化1306,化1307,化 副教 1308,化1309,化1310,化1311,化 210 112 104 授 1312,化创1301,化创1302,生 1301,生1302,土管1301,土环 1301,土环1302,土交1301,土交 1302,土木1301,土木1302,土木 1303,土水1301,土水1302,土水 1303,土水1304,土水1305 材1301,材1302,材1303,材1304, 材1305,材日1301,动1301,动 1302,动1303,动1304,动1305,动 1306,化1301,化1302,化1303,化 1304,化1305,化1306,化1307,化 1308,化1309,化1310,化1311,化 教授 210 112 104 1312,化创1301,化创1302,生 1301,生1302,土管1301,土环 1301,土环1302,土交1301,土交 1302,土木1301,土木1302,土木 1303,土水1301,土水1302,土水 1303,土水1304,土水1305
大连理工2014-2015学年大学生代表学校参赛成绩乘系数情况公示
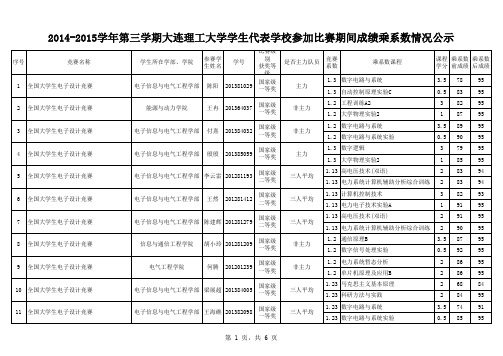
序号 竞赛名称 学生所在学部、学院 参赛学 生姓名 陈阳 学号 比赛级 别 获奖等 级 国家级 一等奖 国家级 一等奖 国家级 一等奖 国家级 一等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 国家级 一等奖 国家级 一等奖 国家级 一等奖 国家级 一等奖 是否主力队员 竞赛 系数 乘系数课程 课程 乘系数 乘系数 学分 前成绩 后成绩 3.5 0.5 3 1 3.5 0.5 3 1 2 2 3 1 2 2 3.5 0.5 2 2 2 2 3.5 0.5 78 83 82 87 89 90 79 85 83 83 82 91 91 90 87 92 86 86 68 84 74 85 95 95 95 95 95 95 95 95 94 94 93 95 95 95 95 95 95 95 84 95 91 95
11 全国大学生电子设计竞赛
电子信息与电气工程学部 王海礁 201382098
三人平均
第 1 页,共 6 页
2014-2015学年第三学期大连理工大学学生代表学校参加比赛期间成绩乘系数情况公示
序号 竞赛名称 学生所在学部、学院 参赛学 生姓名 张茜 比赛级 别 学号 获奖等 级 国家级 201381034 一等奖 国家级 一等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 国家级 二等奖 省级 一等奖 省级 一等奖 省级 一等奖 是否主力队员 竞赛 系数 乘系数课程 课程 乘系数 乘系数 学分 前成绩 后成绩 4 4 4 3 1 2 2 3.5 0.5 3 1 4 2 2 0.5 3.5 4 4 81 79 78 83 81 74 81 77 78 79 90 84 85 82 81 70 81 86 95 95 94 91 89 81 89 92 94 95 95 92 94 90 87 75 87 92
大连理工大学化学专业真题、初始复试考试科目

育明教育2015年考研指导方案考研最重要的就是方法、规划、模考大连理工大学专业初试考试科目一级学科、专业及隶属院(系、部)二级学科、专业0710703▲化学070305▲▲高分子化学与物理复试考试科目及参考书学科、专业代码及名称考试形式专业综合笔试内容参考书目070301无机化学面试加笔试无机元素化学《无机元素化学》,编者:刘新锦、朱亚先、高飞,科学出版社2005070302▲▲分析化学面试加笔试有机化学《有机化学》(第二版),主编:高占先,高等教育出版社《基础化学实验》(第二版),编者:孟长功、辛剑,高等教育出版社070303有机化学面试加笔试物理化学《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.070304▲▲物理化学(含化学物理)面试加笔试化学综合《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.070305高分子化学与物理面试加笔试高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社077621▲▲★药物工程面试加笔试药物合成反应《药物合成反应》,闻韧主编,第二版,化学工业出版社077901药物化学面试加笔试《天然药物化学》《天然药物化学》1、《天然药物化学》,吴立军主编,第五版,人民卫生出版社,2007年出版。
2、《天然产物化学》,徐任生主编,科学出版社,2004第二版080520▲▲★高分子材料面试加笔试高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社080704▲▲流体机械及工程080706▲▲化工过程机械081903安全技术与工程面试加笔试综合考试①过程机械、材料力学、化工原理及化工原理实验综合②工程热力学、工程流体力学、化工原理及化工原理实验综合③过程机械、材料力学、机械设计综合三选一《工程流体力学》,编者:黄卫星,化学工业出版社《化工原理》(上册),编者:王世广(下册)编者:樊希山,高等教育出版社《过程机械》,编者:李志义主编,石油化工出版社《工程热力学》,编者:毕明树化工出版社《材料力学》(上、下册),编者:刘鸿文,高等教育出版社,第三版《机械设计》,编者:濮良贵、纪名刚,高等教育出版社081701☆▲▲化学工程面试加笔试①物理化学及实验②化工原理及实验①②任选一,但所选科目不能与初试科目相同《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材081721▲▲★水科学与技术081702☆▲▲化学工艺面试加笔试①物理化学及实验②化工原理及实验①②任选一,但所选科目不能与初试科目相同《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材081724▲▲★能源化工081704☆▲▲应用化学面试加笔试①物理化学及实验②精细化工产品合成原理①②任选一《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.《精细化工产品合成原理》,编者:姚蒙正、程侣柏、王家儒,中国石化出版社2000第二版081722▲▲★精细化工081705☆▲▲工业催化面试加笔试物理化学及实验或化工原理及实验或催化三选一(所选科目不能与初试科目相同)《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.《化工原理及实验》,同初试科目参考教材《催化剂与催化作用》,编者:王桂茹,大连理工大学出版社,2004年修订版081720▲▲★膜科学与技术面试加笔试①高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)②物理化学及实验或化工原理及实验任选一(所选科目不能与初始科目相同)报考研究方向1必考①,其余方向必考②《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社;化工原理及实验同初试科目参考教材081723▲▲★功能材料化学与化工面试加笔试材料科学基础《材料科学基础》,编者:潘金生清华大学出版社1998年版083100▲生物医学工程面试加笔试笔试:物理化学及实验或化工原理及实验或生物化学及实验(所选科目不能与初试科目相同)《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材生物化学及实验同初试科目参考教材学科、专业代码及名称考试形式复试笔试内容参考书目080502▲▲材料学(建筑材料部分)面试加笔试建筑材料综合 1.《胶凝材料学》,武汉理工大学出版社,袁润章编著2.《混凝土学》,中国建筑工业出版社,重庆大学等编著081401▲▲岩土工程面试加笔试土力学(60%)基础工程学(30%)工程地质学(10%)《土力学》(第二版),郭莹等编著,大连理工大学出版社,2003;《基础工程设计原理》,袁聚云等编著,同济大学出版社,2001;《工程地质》(第二版),孙家齐编著,武汉理工大学出版社,2003。
大连理工普通化学考试样题(含解答)

大 连 理 工 大 学课程名称:普通化学 试卷:A(少) 考试形式: 闭卷 授课院 (系): 化工学院 考试日期:2006年6月11日 试卷共 6 页一. 是 非 题对的在题末括号内填“+”、错的填“—”。
(本大题分10小题, 每小题1分)1.标准状态下,等温等压不作非体积功时,某反应的∆r H <0, ∆r S <0,则该反应 在任何温度下都能自发进行。
( — )(因为:∆G=∆H-T ∆S, ∆G<0才能自发进行)2. 三个量子数的合理组合可以确定一个波函数。
( — ) (因为:n, l, m 三个量子数的合理组合才可以确定一个波函数,自旋量子数m s 与波函数无关)3. 配合物都是由内界和外界两部分组成的。
(— ) (因为:还存在中性配合物,如Fe(CO)5, 没有内界和外界)4. 已知反应N 2(g)+2O 2(g)=2NO 2(g)的∆r H (298K)=67.7kJ .mol -1,则∆f H ( NO 2,g,298K)= 67.7kJ .mol -1。
(— ) (因为:生成一摩尔NO 2(g)的∆r H (298K)才是∆f H ( NO 2,g,298K))5. 吸热反应的活化能总大于反应热。
(+ ) (因为:∆H=Ea(+)-Ea(-),吸热反应∆H>0,所以Ea(+)>∆H )6. 电化学抛光时,要抛光的工件做阴极。
(— )(因为电化学抛光时要抛光的工件需要溶解,做阳极时,M=M n+ + ne 发生溶解)7. 电极极化总是使阳极产物的实际析出电势小于理论析出电势。
(— ) (因为电极极化是使阳极产物的实际析出电势大于理论析出电势)8. 主量子数n=3时,有3s,3p,3d,3f 四种原子轨道。
(— ) (因为主量子数n=3时,只有3s,3p,3d 三种原子轨道,n=4时,才有4s,4p,4d,4f 四种原子轨道)名:号:系:级 班装订线9. 相同温度下,同一种物质的溶液浓度越大,溶液的渗透压越小。
全国有机化学考研学校排名及所需考的专业课

全国有机化学考研学校排名及所需考的专业课以下为全国所有招收有机化学专业研究生的学校〔不包括中科院〕,对其考试科目进行分类,分为要考:物化和无机、物化和分析、物化和综合化学、有机和无机、有机和物化、有机和分析、有机和综合化学、综合化学Ⅰ和综合化学Ⅱ,以及其他等。
注意:1、“985”代表“985”工程大学,“211”代表“211”工程大学郑重声明:本文几乎全部信息来源于中国研究生招生信息网要考数学的学校:1、大连理工大学{985、211、考试科目:①数学二②有机〔含有机实验〕}2、南京理工大学{211、考试科目:①高等数学②有机或①高等数学②分析或①高等数学②无机}3、江苏工业学院{考试科目:①理学数学②有机或①综合化学②有机}4、陕西科技大学{考试科目:①数学二②有机或①有机②物化或①有机②无机与分析化学〔?无机及分析化学?〕}5、沈阳药科大学{考试科目:①高等数学②无机或①高等数学②物化或①生物化学②无机或①生物化学②物化或①有机②无机或①分析②无机或①分析②物化}要考物化和分析的学校:1、南京大学{985、211、考试科目:①物化②仪器分析}2、东北大学{985、211、考试科目:①物化②分析}3、南昌大学{211、考试科目:①物化②分析}4、河北大学{考试科目:①物化②分析}5、中南民族大学{考试科目:①物化②分析}6、沈阳药科大学{考试科目:①物化②分析}要考物化和无机的学校:1、厦门大学{985、211、考试科目:①物化②根底化学}2、南京大学{985、211、考试科目:①物化②大学化学}3、南京航空航天大学{211、考试科目:①物化②无机}4、南京师范大学{211、考试科目:①物化②无机}5、南昌大学{211、考试科目:①物化②无机}6、华南师范大学{211、考试科目:①物化②无机}7、中南民族大学{考试科目:①物化②无机}8、云南师范大学{考试科目:①物化②无机}注意:由于根底化学和大学化学和无机化学的内容几乎一样,故把根底化学和大学化学归为无机化学!!!要考物化和综合化学的学校:1、复旦大学{985、211、考试科目:①物化〔含结构化学〕②无机和分析}2、华中科技大学{985、211、考试科目:①物化②无机及分析}3、安徽大学{211、考试科目:①物化②综合化学}4、西北大学{211、考试科目:①物化②普通大学〔无机和化学分析〕}5、宁夏大学{211、考试科目:①物化②综合化学〔有机、?无机化学与化学分析?〕}6、河南大学{考试科目:①物化②无机和有机}7、浙江师范大学{考试科目:①物化②普通化学〔有机、分析、仪器分析〕}8、烟台大学{考试科目:①物化②化学综合〔分析、无机、有机〕}9、黑龙江大学{考试科目:①物化②综合化学〔无机、有机、分析〕}注意:?无机化学与化学分析?为参考书。
大连理工大学无机化学课件完整版

机 化
xB — 溶液中溶质B的摩尔分数。
学
拉乌尔定律:在一定温度下,难挥发
基 础
非电解质稀溶液的蒸气压下降与溶质的摩
教 尔分数成正比。
程
在稀溶液中:nA远大于nB,nA+nB≈ nA
无 机
xB
nB nA nB
nB nA
nB mA
MA
bBM A
化 学
∆ p = pA* xB = pA*MAbB =kbB
nNH3
n
p
0.320 133.0kPa 35.5kPa 1.200
p(O2 )
n(O2 ) n
p
无
0.180 133.0kPa 20.0kPa
机
1.200
化
学
基 p(N2) = p- p(NH3)-p(O2)
础
教
= (133.0-35.5-20.0) kPa
程
= 77.5 kPa
分体积:
无 透膜向对方运动,净结果使溶剂进入溶液的
机 化
现象称为渗透。
学
基
半透膜:只允
础 教
许溶剂分子通过,
程 不允许溶质分子通
过的薄膜。
为使渗透现象
不发生,必须在液
面上施加一个额 无 外压力(示意图)。
机
化 为维持只允许溶剂 学 分子通过的膜所隔
基
础 开的两种溶液之间 教 的渗透平衡而需要 程 的额外压力,定义
程
T — 热力学温度,K
若水溶液的浓度很小,则cB≈bB ,
= bBRT
van’t Hoff方程说明:在一定温度下, 非电解质稀溶液的渗透压力仅取决于单位体
化 学
通常所说的沸点是指大气压为101.325kPa
大连理工大学化工学院有硕士学位授权学科_专业一览表

大连理工大学学校代码:10141
一级学科、专业及隶属院系
二级学科、专业
院系代码、名称
一级学科、专业代码及名称
代码
名称
007
化工学院
0703▲化学
070301
▲▲无机化学
070302
▲▲分析化学
070303
▲▲有机化学
070304
▲▲物理化学(含化学物理)
标有“▲▲”为专业有博士学位授予权
标有“☆”为国家重点学科
标有“★”为自主设置的二级学科、专业
081705
▲▲工业催化
081720
▲▲★膜科学与技术
081721
▲▲★水科学与技术
081722
▲▲★精细化工
081723
▲▲★功能材料化学与化工
081724
▲▲★能源化工
0819矿业工程
081903
安全技术及工程
0831▲生物医学工程
083100
▲生物医学工程
077621
▲▲★药物工程
注:标有“▲”为一级学科有博士学位授予权
070305
▲▲高分子化学与物理
0779药学
077901
药物化学
0805▲材料科学与工程
080520
▲▲★高704
▲▲流体机械及工程
080706
▲▲化工过程机械
0817▲化学工程与技术
081701
▲▲化学工程
081702
▲▲化学工艺
081704
☆▲▲应用化学
大工普通化学公开课一等奖优质课大赛微课获奖课件

第31页
如钢铁工件抛光
电解液由H2SO4 、H3PO4、CrO3等构成 ( 阳极工件) : Fe – 2e- = Fe2+
6Fe2+ +Cr2O72– +14H+ = 6Fe3+ +2Cr3+ + 7H2O
Fe2(HPO4) 3 、Fe2(SO4)3 浓度大时,在金属 表面形成液膜
(阴极铅板) : 2H+ + 2e- = H2
正好与外加电源电子流方向相反,即形成
了一个与外加电压相反电动势,称反向电
动势(back electromotive force)。
8
第8页
形成氢-氧原电池
正极反应: O2 + 2H2O + 4e- = 4OH– 负极反应: 2H + + 2e - = H2 电动势: E = E(+) - E(-)
试验证实: E实分 > E理分
11
第11页
E理分和E实分计算: E理分= E阳 理 — E阴 理
E实分= E阳 实 — E阴 实
12
第12页
4.4.3 超电压
由 E实分 > E理分 可知: 在阴阳极上析出 产物时,实际电极电势(或称析出电势)与理 论电极电势(或称平衡电势)有偏差。这种偏 差称电极极化(polarization)。把某一电流密 度下实际析出电势与平衡电势之差绝对值称
E=E(+) – E(–) = 0.46V–(–0.77V) =1.23 V
10
第10页
理论计算反向电动势称理论分解电压 (theory decomposition voltage), 用E理分 表示。
大连理工大学附属中学化学初三化学上册期末化学试卷

大连理工大学附属中学化学上册期末化学试卷一、九年级化学上册选择题1.分类是我们在研究过程中常用的重要方法,根据研究目的,采用不同的分类表中进行分类,下列说法错误的是( )A.A B.B C.C D.D2.在实验室中,下列实验操作能达到实验目的的是A.A B.B C.C D.D3.下列实验设计合理的是()A.测定空气中氧气含量B.探究燃烧的条件C.验证质量守恒定律D.氧气验满4.下列问题的研究中,没有利用....对比实验思想方法的是()A.研究空气中氧气含量B.比较金属活动性C.研究燃烧的条件D.研究二氧化碳与水反应5.将过氧化氢溶液平均分成两等份a和b,只向b中加入少量二氧化锰,另一份微微加热。
则放出氧气的质量(m)与反应时间(t)的关系的图象正确的是()A.B.C.D.6.已知固体氯酸钾在加热条件下可以分解,生成氧气.如果用二氧化锰作催化剂则可以加快其分解速度.已知a为固体氯酸钾,b为混有少量二氧化锰的固体氯酸钾,且a和b的质量相等,当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是()A.B.C.D.7.有氧化镁和另一种金属氧化物组成的混合物共 4g,经测定其中含有氧元素 1.8g,则另一种金属氧化物是()A.Al2O3B.CuO C.CaO D.Fe2O38.将25克甲物质跟5克乙物质发生反应,所得混合物中有10克甲,11克丙,还有另一种新物质丁,若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,化学式分别为A、B、C、D。
则下列化学方程式正确的是A.2A + B ═ C + 2D B.A + 2B ═ 2C + DC.A + 2B ═ C + 2D D.2A + B ═ 2C + D9.依据下图进行实验(夹持仪器略去)。
实验步骤如下:①通入N2一段时间后,点燃酒精灯,a、b中均无明显现象;②改通O2片刻,加热一段时间后,熄灭酒精灯,a中红磷不燃烧,b中红磷燃烧。
大连理工分析化学习题答案

第三章习题解答1.有含氯的质量分数为34.31%的标准试样,某学生测得结果为34.58%,计算: (1)绝对误差 (2)相对误差 解: ①绝对误差%27.0%31.34%58.34=-=-=μx E②相对误差 =μE=%79.0%100%31.34%27.0=⨯2.用重量法测定某物质的含量,三次测定结果为:0.3417g ,0.3426g 及0.3342g ,计算:(1)平均值; (2) 平均偏差; (3)标准偏差; (4)用Q 法检验,是否有应该舍弃的数据(置信度90%)。
解: ① 3395.033342.03426.03417.0=++=x②d=33395.03342.03395.03426.03395.03417.0-+-+-=0035.030104.0=③1)(2--∑=n x x s 0046.0=④ 设0.3342为可疑值89.03342.03426.03342.03417.0=--=Q94.0=表Q表即Q Q <∴无可舍弃的数据3.有一可溶性氯化物试样,经8次测定氯的质量分数为34.34%,34.31%,34.34%,34.39%,34.43%,34.36%,34.58%及34.24%。
计算测定结果的标准偏差。
解:1)(2--∑=n x x s=0.1%4.某学生测定试样中氯的质量分数为:47.64%,47.69%,47.52%及47.55%,用四倍法检验是否有应舍弃的数据。
解:设47.52%为可疑值,则不包括47.52%的平均值和平均偏差为:%63.473%55.47%69.47%64.47=++=x3)%63.4755.4763.4769.4763.4764.47(-+-+-=d =0.05%%20.04=d可疑值与平均值的偏差为:%11.0%63.47%52.47=-=ddd 4< ∴47.52%应该保留若设47.69%为可疑值,则有%57.473%52.47%55.47%64.47=++=x%047.03)%57.4752.4757.4755.4757.4764.47(=-+-+-=d%19.04=d%12.0%57.4769.47=-=ddd 4< ∴无可舍弃的数据5.有粗盐试样,经测定其氯的质量分数为56.66%,56.66%,56.68%,56.59%,56.58%,56.63%及56.59%,计算:(1)用Q 法检验是否有应舍弃的数据(置信度为90%)。
2020大连理工大学化工专硕考研经验分享

2020大连理工大学化工专硕考研经验分享在考研的时候,看到学长学姐们发的各种经验贴,就想着等我考完了一定要写一个经验贴,来帮助学弟学妹们。
现在,终于考完了,将我这一年备考的经验与教训写下来,希望可以给大家帮助,少走点弯路。
专业课我初试选的化工原理。
这几年,物化难度不一,化工原理比较稳妥,几乎不会有低分,都在120左右。
所以我建议,本科物化就不太好的选化原,至少不拉分。
暑假之前,快速把课本大致看一遍,主要是自己能有个化原的框架,这个时间段内多看看学姐整理的笔记或者公式,自己也要适当整理笔记,做做课后题。
我找的学姐是报名了爱考宝典专业课辅导班之后他们给我安排的,所以这个大工的学姐把资料笔记都送我了,顺便帮我补充新增的一些内容,整理重点。
暑假开始全面学习指导上的内容,每一道例题习题都要做,都要研究。
这个阶段有些煎熬,但好在学姐能在线给我答疑,还一直鼓励我,真的很感谢她。
题目都是大题,一道题大概需要一个小时,但要坚持下来,同时保证速度。
最好10月就把学习指导做完一遍,然后开始做真题。
重复刷,学习指导也至少两遍。
这个时候还要开始学实验,主要就是整理+背诵,自己没时间整理的,建议跟我一样,找个直系的学姐带着,人家毕竟是有经验的人,而且高分上岸,肯定会给我们很多帮助。
数学二数学的几门课确实难度有些大,但是花时间好好钻研,做题也没那么难。
刚开始的时候建议跟着每门课讲的比较好的老师的网课学习,可能会比较费时间,但是对于理解数学上的一些疑难杂点、打基础是非常好的。
暑假主要开始强化班的学习,题目再接着做,书上的习题首先得搞透。
开学后我也开始做660,练练手感和做题的速度。
当然,数学的错题是非常重要的,一定要找个笔记本把它们整理在一起,多看多做争取都会做了。
暑假时间一定要好好把握,是和其他同学拉开差距的好时候。
10月开始做真题,不过早开始真题比较好,此外,数学真题留几套给自己做最后的测验。
最后阶段出的模拟题也可以去做做看的,万一押到了题呢。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属簇合物: 多个金属中心原子间存在 金属-金属键
多核配合物中各金属离子价电子间通
过桥联配体传递会产生一定的相互作
用,从而使它们表现出许多独特的不
同于单金属离子化合物的化学性质。
py
O
N N N Cr N
H O O H
OH2 Gd OH2
H2O H2O H2O H2O
O
H2O O O O O Fe O Fe
2.3
[18]冠-6立体结构
H H N NH H H HN N
H H
CO2(CH2)2
CO2(CH2)2
O
N Fe N N N
N
N Mg N N
O O O O
H H
卟啉
血红素
叶绿素a
卟啉及其衍生物就是一类生物体中 常见的大环配体
3 配位聚合物 配位聚合物(coordination polymer):多齿配体 与金属离子间通过配位键交替连接,形成有序
H2
N
N
H2
CH2
通常具有五元环或六元环结构
螯合效应:生成螯合物的反应比生成普通非
螯合配合物的反应在能量上更有利
螯合配体或螯合剂(chelate ligand):
能与中心原子形成螯合物的配体
H2 C H2 C N C H2 COOH
HOOC
H2C
CH2
COOH
N
HOOC C H2
乙二胺四乙酸及其钠盐(EDTA) EDTA几乎可和所有金属离子形成1:1稳定螯合物,
由具有低氧化值的金属原子和中性CO配体
所组成的中性配合物
50o C + 4CO 101.325kPa
Ni
[Ni(CO)4 ] 读作五羰合铁
200o C Fe + 5CO 101.325kPa
[Fe(CO)5 ] 读作四羰合镍
9.1.2 配合物的命名
1. 配合物化学式的书写
写出中心 原子元 列出阴离子、 将整个配离
中心原子 (形成体),多为金属离子和原子,也可是
非金属元素,如:Cu2+,BⅢ,PⅤ 空价电子轨道 电子接受体 配 位 键
[Cu(NH3)4]2+
孤对电子 电子给予体
配体: 与中心原子结合,通常是阴离子或分子,
如:F-, Cl-, OH-, H2O, CO
3. 关于配位原子:
配体中直接与中心原子配位的原子称为配位原子
(coordination atom) 常见的配位原子有N、O、C、S、P、卤素等 单原子配体:配位原子就是其本身 F-,Cl-,Br-,I多原子配体:配位原子通常是含孤对电子的原子 NH3中的N原子 H2O中的O原子
4. 配合物 组成:
[Cu(NH3)4]SO4 ¦ ¦ 中 ¦ 心 配 ¦ 体 原 ¦ 子 内界 外界
含两个以上配位原子的
配体可称为多齿配体
单齿配体
双齿配体 2配位原子
三齿配体
1配位原子
1配位键
3配位原子
H2
N:
:NH3 :CN:F-
N
2,2’-联吡啶
:
N:
:
N
H2
N:
二乙基三胺
7. 螯合物:中心离子与含两个或两个以上配位
原子的配体成键,形成环状结构配合物
H2
H2C N
H2
N CH2
2+
Pt
H2C
O
O OH2 Fe O O O O
py HO
Cu Cu py OH
OH py py Cu O H py
OH2
py Cu py
OH H3C
+
H2O
催化剂
H3C CH3
12-钨硅酸 H4[SiW12O40]
许多金属蛋白和金属酶的
活性中心都具有桥联多核结构
His-N OH2 Cu His-N N-His N N-His Zn N N-His O-Asp
南京大学教授
1980年学部委员
1913年获诺贝尔奖
2. 定义:
配合物:是由可给出孤对电子或多个不定域 电子的一定数目的离子或分子(称为配位体,
简称配体, ligand, 常用L表示)和具有接受
孤对电子或多个不定域电子的空位的原子或离
子(统称为中心原子),通过配位键
(coordination bond)连接,按一定的组成和 空间构型所形成的复杂化合物
一些配合物命名举例
K 3 Fe(NCS)6
H 2 PtCl6
六异硫氰根合铁(Ⅲ)酸钾 六氯合铂(Ⅳ)酸 氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾 三氯化五氨•水合钴(Ⅲ) 五羰(基)合铁
Cu(NH3 ) 4 (OH)2
KPtCl5 (NH3 )
Co(NH3 )5 (H2 O)Cl 3
配体的孤对电子进入金属离子内层d轨道
高自旋配合物(外轨型): 未发生变化。
中心金属离子的电子结构
配体的孤对电子占据最外层的ns,np,nd轨道。
根据磁矩变化判断内、外轨型配合物的形成
Fe(CO)5
Co(NO2 )3 (NH3 )3
Ca(EDTA)
三硝基•三氨合钴(Ⅲ) (乙二胺四乙酸根)合钙(Ⅱ)配离子
2
9.1.3 配合物的异构
几何异构(geometrical isomerism) : 因配体在空间位置不同而导致两个化学组成相 同的配合物空间结构不同的现象 常见于配位数为4的平面正方形配合物 为6的八面体
中性分子配
体 紧靠中心原 子位置为最先,然后 按命名原则依次
子或分子的化
学式加[ ]
素符号
对配离子加 外界离子
[CoCl2(NH3)3]Cl
排列书写
2. 配合物的命名 配酸:×××酸
配碱:氢氧化×××
配盐:先阴离子后阳离子,简单酸根加
“化”字,复杂酸根加“酸”字。 配合物的命名原则: 配体数 配体名称 以二、 不同配 三、四 表示 体“•” 分开 合 中心原子名称(氧化值) 罗马数字或带正、 负号的阿拉伯数字
表示其氧化值
配体命名次序:
(1) 先离子后分子,例如:
K[PtCl3NH3]:三氯•氨合铂(Ⅱ)酸钾
(2) 同是离子或同是分子,按配位原子元素
符号的英文字母顺序排列,例如:
[Co(NH3)5H2O]Cl3:氯化五氨•水合钴(Ⅲ); (3) 先无机后有机,书写时须将有机配体置于
圆括号中, 例如: K[PtCl3(C2H4)]:三氯•(乙烯)合铂(Ⅱ)酸钾。
过渡金属离子配合物磁性的强弱可用磁矩表
示,单位为B.M.,称玻尔磁子
根据 n(n 2) 可用未成对电子数目
n估算磁矩µ 。
n µ /B.M. 0 0 1 2 3 3.87 4 5
1.73 2.83
4.90 5.92
实例:
[Ti(H2O)6]3+ Ti3+: 3d1 µ =1.73 n=1
-
Cu-Zn超氧化物歧化酶的活性中心
金属簇合物具有离域的多中心金属-金属键, 一般第5、6周期过渡金属元素容易形成金属簇合物 金属-金属键对化合物性质具有重要影响
Ir4(CO)12
Pb Pb Pb Pb
[Mn3(CO)14]-
Pb
[Nb6Cl18]2-
Pb52-
OC OC OC
CO CO
Co
OC
Cl Pt Cl NH3
H 3N
NH2
Cl Pt Cl
NH2
cis-[PtCl2(NH3)2] 顺-二氯二氨合铂(II)
trans-[PtCl2(NH3)2] 反-二氯二氨合铂(II)
抗癌药
八面体 配合物
NH3
[Ma2b4]型 [Ma3b3]型
顺式 (cis-) 反式 (trans-)
面式 (facial)
[Ni(CN)4]2-: 磁矩为零
4s 4p
3d Ni2+
பைடு நூலகம்4s
4p
+ CN-
dsp2杂化
[NiCl4]2-的空间构型为四面体,μ=2.83B.M.
4s 4p
3d Ni2+
sp3杂化
+ Cl-
低自旋配合物(内轨型): 中心金属离子的电子结构在 形成配合物前后发生变化,电子发生重排,未成对 电子减少。
§ 9.2 配合物的空间构型和化学键理论
9.2.1. 配合物的空间构型 9.2.2. 配合物的磁性 9.2.3. 配合物的价键理论
9.2.4. 配合物的晶体场理论
9.2.1. 配合物的空间构型
空间构型与配 配体围绕中心原子在空 间分布形成的几何构型
配位数 2 空 间 构 型 4 位数密切相关 6
K2[Hg I4] ¦ ¦ 中配 心体 原 子 外界 内界
配合物
配合物
配离子:内界带电荷。内、外界间离子键结合
配合物分子:内界不带电荷,
如: [PtCl4(NH3)2], [CoCl3(NH3)3]
5. 配位数:与中心原子键合的配位原子数 [Ag(NH3)2]+ [Cu(NH3)4]2+ Ag+配位数:2 Cu2+配位数:4
Co
CO CO
Co2(CO)8
CHO R
+
CO
+
H2
催化剂
R CH3
加氢甲酰化反应可以由端烯烃制备醛
2 大环配合物
大环配体:环状的多齿配体
大环配合物:大环配体与金属离子形成的化合物
大环效应:不仅具有螯合效应,而且比相应 非环螯合物稳定性还高
O O K O O O
O O O
O
O K
