医疗器械临床试验备案表
关于发布医疗器械临床试验机构条件和备案管理规定的公告第

关于发布医疗器械临床试验机构条件和备案管理规定的公告第文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)2017年11月24日发布根据《中共中央办公厅、国务院办公厅印发〈关于深化审评审批制度改革鼓励药品医疗器械创新的意见〉的通知》(厅字〔2017〕42号)和《国务院关于修改〈医疗器械监督管理条例〉的决定》(中华人民共和国国务院令第680号)规定,医疗器械临床试验机构由资质认定改为备案管理。
国家食品药品监督管理总局会同国家卫生和计划生育委员会制定了《医疗器械临床试验机构条件和备案管理办法》,现予发布,自2018年1月1日起施行。
食品药品监管总局国家卫生计生委2017年11月15日医疗器械临床试验机构条件和备案管理办法第一章总则第一条为了加强和规范医疗器械临床试验机构管理,根据《医疗器械监督管理条例》的规定,制定本办法。
第二条本办法所指的医疗器械临床试验机构备案,是指医疗器械临床试验机构按照本办法规定的条件和要求,将机构概况、专业技术水平、组织管理能力、伦理审查能力等信息提交食品药品监督管理部门进行存档、备查的过程。
第三条本办法适用于在中华人民共和国境内开展医疗器械临床试验的机构备案管理工作。
第二章备案条件第四条医疗器械临床试验机构应当符合医疗器械临床试验质量管理规范的要求,具备开展医疗器械临床试验相应的专业技术水平、组织管理能力、伦理审查能力等以下条件:(一)具有医疗机构执业资格;(二)具有二级甲等以上资质;(三)承担需进行临床试验审批的第三类医疗器械临床试验的,应为三级甲等医疗机构;(四)具有医疗器械临床试验管理部门,配备适宜的管理人员、办公条件,并具有对医疗器械临床试验的组织管理和质量控制能力;(五)具有符合医疗器械临床试验质量管理规范要求的伦理委员会;(六)具有医疗器械临床试验管理制度和标准操作规程;(七)具有与开展相关医疗器械临床试验相适应的诊疗科目,且应与医疗机构执业许可诊疗科目一致;(八)具有能够承担医疗器械临床试验的人员,医疗器械临床试验主要研究者应当具有高级职称,其中开展创新医疗器械产品或需进行临床试验审批的第三类医疗器械产品临床试验的主要研究者应参加过3个以上医疗器械或药物临床试验;(九)已开展相关医疗业务,能够满足医疗器械临床试验所需的受试人群要求等;(十)具有防范和处理医疗器械临床试验中突发事件和严重不良事件的应急机制和处置能力;(十一)国家食品药品监督管理总局、国家卫生和计划生育委员会规定的其他条件。
医疗器械临床试验机构汇总表

医疗器械临床试验机构汇总表1.北京协和医院北京协和医院,成立于1921年,是中国著名的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有先进的医疗设备和临床试验研究团队,为科研人员和医疗器械企业提供临床试验的场地和平台。
2.北京大学人民医院北京大学人民医院是国内一流的综合性医院之一,其临床试验中心设备先进,临床试验团队经验丰富。
医院积极参与临床试验,为患者提供更多、更好的医疗器械选择。
3.上海交通大学医学院附属瑞金医院上海交通大学医学院附属瑞金医院是上海市的综合性医院之一,也是医疗器械临床试验机构中的重要一员。
医院拥有完善的设备和专业的临床试验团队,为医疗器械的研究和开发提供支持。
4.广州中山大学附属第一医院中山大学附属第一医院是广州市的综合性医院之一,也是医疗器械临床试验机构的成员之一、医院拥有一流的设备和临床试验团队,为医疗器械的临床试验提供优质的环境和支持。
5.复旦大学附属华东医院复旦大学附属华东医院是上海市的综合性医院之一,具有临床试验资质。
医院设备先进,专业临床试验团队经验丰富,为医疗器械临床试验提供专业支持。
6.浙江大学医学院附属第一医院浙江大学医学院附属第一医院是杭州市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院积极参与临床试验工作,为医疗器械的研发和临床应用提供支持。
7.南京医科大学附属第一医院南京医科大学附属第一医院是江苏省的综合性医院之一,拥有完善的设备和专业的临床试验团队。
医院参与多项临床试验,为医疗器械的发展和应用提供支持。
8.四川大学华西医院四川大学华西医院是成都市的综合性医院之一,也是医疗器械临床试验机构的一员。
医院设备齐全,临床试验团队经验丰富,为医疗器械的研究和应用提供支持。
9.中山大学附属第三医院中山大学附属第三医院是广州市的综合性医院之一,也是医疗器械临床试验机构的重要成员之一、医院设备先进,临床试验团队经验丰富,为医疗器械的研究和应用提供专业支持。
医疗器械临床试验保存文件目录

保存
8
伦理委员会审查意见
保存原件
保存
9
伦理委员成员表
保存原件
保存
10
临床试验申请表(若有)
保存原件
11
临床前实验室资料(若有)
保存原件
12
国家食品药
13
研究者履历及相关文件
保存
保存原件
14
临床试验有关的实验室检测正常值范围
保存
保存
15
医学或实验室操作的质控证明(若有)
保存
23
其他文件(方案、病例报告表、知情同意书、书面情况通知)的更新(若有)
保存
保存
24
新研究者的履历(若有)
保存
保存原件
25
医学、实验室检查,操作的正常值范围更新(若有)
保存
保存
26
试验用医疗器械与试验相关物资的交接单
保存
保存
27
新批号试验用医疗器械自检证明(若有)
保存
保存原件
28
监查员访视报告
保存原件
29
已签名的知情同意书
保存原件
30
原始医疗文件
保存原件
31
病例报告表(已填写,签名,注明日期)
保存原件
保存
32
严重不良事件报告(若有)
保存原件
保存
33
申办者致监管部门、伦理委员会的未预期的严重医疗器械不良事件报告(若有)
保存
保存原件
34
受试者鉴认编码表
保存原件
35
受试者筛选表与入选表
保存
36
研究者签名样张
保存
保存
三、临床试验终止或完成后
临床试验保存文件
临床试验审批表(医疗器械类)

临床试验审批表(医疗器械类)
项目名称:
申请科室:
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、医疗器械分类:
1、□境内II类□境内III类□进口II类□进口III类
2、□有源□无源□体外诊断试剂
3、□植入□非植入
4、需进行临床试验审批的第三类医疗器械:□是□否
二、检验报告编号:
三、试验目的:
四、组长单位:负责人
五、适应症:
禁忌症:
六、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
七、试验样品
1、名称型号及规格批号
有效期
2、提供单位:
八、对照样品
1、名称型号及规格批号
有效期
2、提供单位:
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
医疗器械临床试验检查要点及判定原则〔2018〕45号

国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知药监综械注〔2018〕45号2018年11月28日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局),核查中心:为加强医疗器械临床试验过程的监督管理,指导监管部门开展医疗器械临床试验监督检查工作,根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》要求,国家药品监督管理局组织制定了《医疗器械临床试验检查要点及判定原则》,现予以发布。
国家药监局综合司2018年11月19日医疗器械临床试验检查要点及判定原则根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》等要求制定本检查要点及判定原则,用于指导医疗器械临床试验现场检查工作。
一、检查要点二、判定原则根据检查发现的问题,检查结果按以下原则判定:(一)有以下情形之一的,判定为存在真实性问题:1.编造受试者信息、主要试验过程记录、研究数据、检测数据等临床试验数据,影响医疗器械安全性、有效性评价结果的;2.临床试验数据,如入选排除标准、主要疗效指标、重要的安全性指标等不能溯源的;3.试验用医疗器械不真实,如以对照用医疗器械替代试验用医疗器械、以试验用医疗器械替代对照用医疗器械,以及以其他方式使用虚假试验用医疗器械的;4.瞒报与临床试验用医疗器械相关的严重不良事件和可能导致严重不良事件的医疗器械缺陷、使用方案禁用的合并用药或医疗器械的;5.注册申请的临床试验报告中数据与临床试验机构保存的临床试验报告中的数据不一致,影响医疗器械安全性、有效性评价结果的;6.注册申请的临床试验统计分析报告中数据与临床试验统计数据库中数据或分中心临床试验小结中数据不一致,影响医疗器械安全性、有效性评价结果的;7.其他故意破坏医疗器械临床试验数据真实性的情形。
(二)未发现真实性问题的,但临床试验过程不符合医疗器械临床试验相关规定要求的,判定为存在合规性问题。
(三)未发现上述问题的,判定为符合要求。
医疗器械临床试验机构备案

9
已开展相关医疗业务,能够 满足医疗器械临床试验所需 的受试人群要求等
10
具有防范和处理医疗器械临 床试验中突发事件和严重不 良事件的应急机制和处置能 力
11
国家食品药品监督管理总局、 国家卫生和计划生育委员会 规定的其他条件
《备案管理办法》重点(备案程序)
1
评估
机构对自身条件进 行评估
2
注册
注册资料填写并提 交(审核通过后获 得注册账号)
作并遵从法规,不能因为不审核就麻痹大意
感谢您的耐心观看
汇报人: 时间:2019年1月
3
备案
备案资料填写并提 交
4
内审
机构内审人“通过”
5
完成
完成备案,获得备 案号
C目录 ONTENTS
01 背景介绍 资格认定制到备案制的过程
√ 操作流程 03 备案系统的操作流程
02 法规解读 《创新意见》和《备案管理办法》 注意事项
04 几个需注意问题
1|
操
2 作
流
|
程
3|
注册 (填写注册资料,邮寄符合性声明) 备案(填写备案资料,提交内审) 内审(审核通过,获得备案号,完成备案)
备案流程(注册资料)
A
机构社会组织代码/信 用代码扫描件
B
执业资格证书(资质、 许可证)
C
营业执照
D
法人代表(医院负责 人)身份证/护照扫描 件
E
联系人授权书扫描件
F
联系人身份证/护照扫 描件
G
医疗机构级别证明文 件
备案流程(备案)
• 注册审核通过后,食品药品审核查验中心邮件通知机构,机构获得两个账号:机构填报人 员账号、机构内审人员账号
医疗器械临床试验备案机构目录

21 械临机构备 201800295 北京市房山区中医医院
22 械临机构备 201800323 北京大学第三医院
23 械临机构备 201800328 北京大学人民医院(北京大学第二临床医学院)
24 械临机构备 201800343 首都医科大学附属北京妇产医院
25 械临机构备 201800371 首都医科大学附属北京朝阳医院
11 械临机构备 201800128 首都医科大学附属北京潞河医院
12 械临机构备 201800183 北京回龙观医院
13 械临机构备 201800192 首都医科大学附属北京儿童医院
14 械临机构备 201800232 中国医学科学院阜外医院
15 械临机构备 201800245 北京爱尔英智眼科医院
49 械临机构备 201800663 首都医科大学附属北京安贞医院
50 械临机构备 201900052 首都医科大学附属北京天坛医院
51 械临机构备 201900067 中国中医科学院广安门医院
52 械临机构备 201900073 航天中心医院
53 械临机构备 201900147 北京市海淀医院
54 械临机构备 202000081 北京中医药大学第三附属医院
16 械临机构备 201800250 首都医科大学附属北京同仁医院
1
序号
备案号
机构名称
17 械临机构备 201800252 北京中医药大学东直门医院
18 械临机构备 201800254 首都医科大学附属北京友谊医院
19 械临机构备 201800291 北京大学国际医院
20 械临机构备 201800294 首都医科大学宣武医院
43 械临机构备 201800555 北京大学第一医院
医疗器械临床试验备案攻略

医疗器械临床试验备案攻略1、省局备案的开始时间与法规要求2015年07月03日,CFDA颁布了《国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告》(2015年第87号)。
一、开展医疗器械临床试验,申办者应当在试验项目经伦理审查通过并与临床试验机构签订协议或合同后,填写《医疗器械临床试验备案表》(附件1),提交备案表中列出的相关材料,其中境内医疗器械向申办者所在地省级食品药品监督管理部门备案,进口医疗器械向代理人所在地省级食品药品监督管理部门备案。
二、接受备案的省级食品药品监督管理部门,对《医疗器械临床试验备案表》填写完整且提交材料齐全的,应当当场备案。
备案号编排方式为:X1械临备XXXX2XXXX3,其中X1为备案部门所在地简称,XXXX2为年份,XXXX3为流水号。
注意:1、备案部门为申办方或者代理人所在地省局;2、申办方省局通知医院所在地省局和卫计委 3、对于2015年7月3日之前的项目,可以补报。
2、备案表模板及填写2.1 医疗器械临床试验:需要以下文件:1.医疗器械临床试验备案表;2.营业执照复印件3.拟开展临床试验机构伦理委员会意见扫描件;4.申办者与临床试验机构实施临床试验协议或合同扫描件;5.医疗器械临床试验批件复印件(需进行临床试验审批的第三类医疗器械)3、备案表变更与变化医疗器械省局备案不要求递交临床试验方案,仅提供方案版本即可。
方案变更,无需再次提交备案。
申办者完成临床试验备案后,对试验项目起止日期有变化的,应当于变化后10个工作日内告知原备案管理部门并留有信息变更的记录。
4、近年来困点与难点由于医疗器械实行多中心临床试验,困点在于省局备案只能备案一次。
各中心文件筹备时间较长,等所有临床试验伦理批件、合同都准备好,浪费了很长的临床试验时间。
2017年7月31,CFDA发布了《医疗器械临床试验质量管理相关问题解读》。
明确了关于医疗器械临床试验备案问题:申办者与每家临床试验机构签订协议或合同后,均可向申办者/代理人所在地省级食品药品监督管理部门备案。
国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知

国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2018.11.19•【文号】药监综械注〔2018〕45号•【施行日期】2018.11.19•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知药监综械注〔2018〕45号各省、自治区、直辖市食品药品监督管理局(药品监督管理局),核查中心:为加强医疗器械临床试验过程的监督管理,指导监管部门开展医疗器械临床试验监督检查工作,根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》要求,国家药品监督管理局组织制定了《医疗器械临床试验检查要点及判定原则》,现予以发布。
国家药监局综合司2018年11月19日医疗器械临床试验检查要点及判定原则根据《医疗器械注册管理办法》和《医疗器械临床试验质量管理规范》等要求制定本检查要点及判定原则,用于指导医疗器械临床试验现场检查工作。
一、检查要点序号现场检查要点检查内容1临床试验前准备1.1 临床试验机构应具有开展相关医疗器械产品临床试验的资质检查药物临床试验机构资格证明或医疗器械临床试验机构备案证明1.2 需要进行临床试验审批的第三类医疗器械应获得批准检查医疗器械临床试验批件,且批件日期不晚于临床试验开始日期1.3 临床试验项目按相关规定备案检查省局出具的《医疗器械临床试验备案表》,备案日期不晚于临床试验开始日期1.4 临床试验应获得临床试验机构伦理委员会批准检查伦理审查批件,批准日期不晚于临床试验开始入组日期1.5 试验用医疗器械研制符合适用的医疗器械质量管理体系相关要求检查试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明1.6 试验用医疗器械有自检报告和具有资质的检验机构出具的一年内的产品注册检验合格报告检查相应检验报告1.7 临床试验机构设施和条件与临床试验项目相适应检查试验方案中涉及的主要仪器设备及设施条件1.8 临床试验机构具有医学或实验室操作的质控证明(若有)临床检验室开展临床检验室内质量控制,检查有效的临床检验室间质量评价合格证书1.9 试验相关仪器和设备应定期维护和校准检查试验相关仪器和设备维护、校准记录序号现场检查要点检查内容1.10 研究者应具有执业资格、临床试验的专业特长、资格和能力检查研究者的执业资格、职称证书、履历等。
医疗器械临床试验项目总结报告盖章申请表
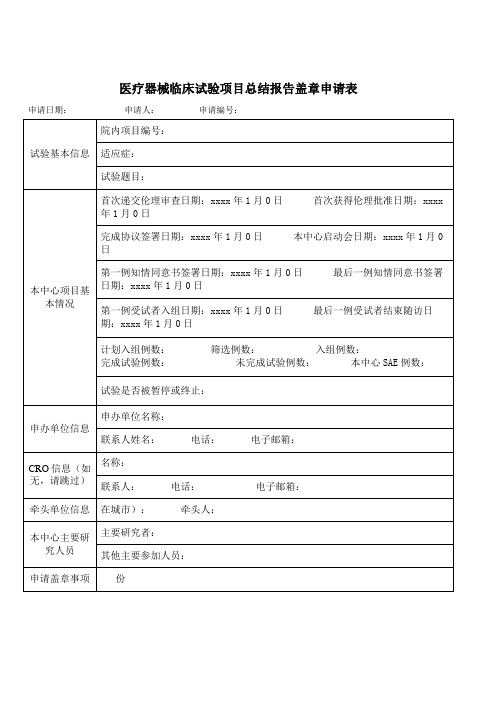
计划入组例数: 筛选例数: 入组例数: 完成试验例数: 未完成试验例数: 本中心E例数:
试验是否被暂停或终止:
申办单位信息
申办单位名称:
联系人姓名: 电话: 电子邮箱:
CRO信息(如无,请跳过)
名称:
联系人: 电话: 电子邮箱:
医疗器械临床试验项目总结报告盖章申请表
申请日期:申请人: 申请编号:
试验基本信息
院内项目编号:
适应症:
试验题目:
本中心项目基本情况
首次递交伦理审查日期:xxxx年1月0日 首次获得伦理批准日期:xxxx年1月0日
完成协议签署日期:xxxx年1月0日 本中心启动会日期:xxxx年1月0日
第一例知情同意书签署日期:xxxx年1月0日 最后一例知情同意书签署日期:xxxx年1月0日
牵头单位信息
在城市): 牵头人:
本中心主要研究人员
主要研究者:
其他主要参加人员:
申请盖章事项
份
申请人意见
(简述本临床试验的实施是否遵守了临床试验方案、GCP、赫尔辛基宣言,以及数据是否真实可靠、结论是否客观、科学。)
签名 日期 年 月 日
专业主任意见
签名 日期 年 月 日
机构办公室意见
签名 日期 年 月 日
机构主任意见
签名 日期 年 月 日
医疗器械临床试验试和说明书备案

相关法规、规章、规范性文件
《医疗器械注册管理办法》(国家食品药品监督管 理总局局令第4号)
• 第二十三条 开展医疗器械临床试验,应当按照医疗器械临床 试验质量管理规范的要求,在取得资质的临床试验机构内进行。 临床试验样品的生产应当符合医疗器械质量管理体系的相关要 求。
相关法规、规章、规范性文件
监督检查要求
《关于开展医疗器械临床试验监督抽查工作的通告》 (国家食品药品监督管理总局通告2016年第98号)
•检查结论判定: (一)有以下情形之一的判定为存在真实性问题: 1.注册申请提交的临床试验资料与临床试验机构保存的相应 临床试验资料不一致的; 2.临床试验数据不能溯源的; 3.受试产品/试验用体外诊断试剂或试验用样本不真实的。 (二)未发现真实性问题,但临床试验过程不符合医疗器械 相关规定要求的,判定为存在合规性问题。 (三)未发现真实性和合规性问题的,判定为符合要求。 •检查结果处理:对存在真实性问题的,依据法规等相关规
• 产品是否有具备资质的检测机构出具的结论合格的产品检验报 告
• 受试产品的管理记录是否完整,数量是否相符 • IVD:仪器设备是否具有使用记录,使用记录与临床试验是否吻
合
监督检查中常见问题
8.申报资料的情况 • 问题:
• 注册申请的临床试验方案/报告版本及内容是否与临床试验机构 保存的版本及内容一致
医疗器械临床试验质量管理规范
《规范》与原规定的主要不同点
• 取消了“医疗器械临床试验分医疗器械临床试用和医疗器械临 床验证”要求。
• 明确了监管职责:备案、审批。 • 明确了“试验用医疗器械的研制应当符合适用的医疗器械质量
管理体系相关要求”。 • 特别注重对受试者权益的保护,在制度和要求上进行了完善。 • 提出多中心临床试验的概念,并对多中心临床试验的方案设计
医疗器械临床试验备案机构目录

械临机构备
沈阳中心血站(辽宁省血液中心)
吉林省:20个
1
械临机构备
吉林大学第一医院
2
械临机构备
长春市儿童医院
3
械临机构备
吉林省中医药科学院第一临床医院
4
械临机构备
四平市中心人民医院
5
械临机构备
通化市中心医院
6
械临机构备
吉林省人民医院
7
械临机构备
吉林大学中日联谊医院
8
械临机构备
长春中医药大学附属医院
18
械临机构备
沈阳何氏眼科医院(有限公司)
19
械临机构备
中国医科大学附属盛京医院
20
械临机构备
丹东市第一医院
21
械临机构备
大连市第六人民医院
22
械临机构备
沈阳市第四人民医院
23械临机构备锦州医科大学附 Nhomakorabea第三医院
24
械临机构备
大连大学附属新华医院
25
械临机构备
沈阳兴齐眼科医院
26
械临机构备
鞍钢集团公司总医院
械临机构备
赤峰市医院
辽宁省:27个
1
械临机构备
大连医科大学附属第二医院
2
械临机构备
辽宁中医药大学附属第二医院
3
械临机构备
锦州医科大学附属第一医院
4
械临机构备
大连大学附属中山医院
5
械临机构备
大连医科大学附属第一医院
6
械临机构备
沈阳市骨科医院
7
械临机构备
中国医科大学附属第一医院
8
械临机构备
沈阳爱尔眼视光医院
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械临床试验备案表
试验项目名称
中国境内同类产品
□有
□无
试验目的:
试验方案编号
临床试验较高风险医疗器械目录
□是
□否
多中心试验
□是
□否
临床试验机构(起止
日期:
年月日——年月日
试验用医疗
器械名称
分类
1.□境内Ⅱ类 □.境内Ⅲ类 □.进口Ⅱ类 □.进口Ⅲ类 2.□有源 □.无源 3.□植入 □.非植入
□ 是 □ 否
8
所有研究者姓名、联系方式及相关信息
□ 是 □ 否
9
监查员姓名、联系方式及相关信息
□ 是 □ 否
10
项目概要说明
□ 是 □ 否
11
SFDA批件(适用时)
□ 是 □ 否
12
申办者保证所提供资料真实性的声明
□ 是 □ 否
申请人签名:
年 月 日
备案号:
经办人签名:
年 月 日
申办者单位
联系人
电话
申办者地址
邮编
监查员姓名
电话
需提交的材料
1
企业生产许可证复印件及相关信息
□ 是 □ 否
2
结论合格的自测报告
□ 是 □ 否
3
结论合格的型式检测报告
□ 是 □ 否
4
申办者营业执照、法人证书复印件
□ 是 □ 否
5
伦理委员会批件
□ 是 □ 否
6
最新的研究者手册
□ 是 □ 否
7
所有临床试验机构信息
