人教版化学选修三讲义:第2章 第2节 第1课时 价层电子对互斥理论 Word版含答案
第2章 第2节 第1课时 分子空间结构与价层电子对互斥理论

分子结构与性质
第二节 分子的立体构型
第1课时 分子空间结构与价层电子对互斥理论
1 2 3 4 5 6 7
新课情境 呈 现 课前新知 预 习 预习自我 检 测 课堂探究 研 析 学科核心 素 养 课堂达标 验 收 课时作业
• 在宏观世界中,花朵、蝴蝶、冰晶等诸多 物质展现出规则与和谐的美。科学巨匠爱 因斯坦曾感叹:“在宇宙的秩序与和谐面 前,人类不能不在内心里发出由衷的赞叹, 激起无限的好奇。”实际上,宏观的秩序 与和谐源于微观的规则与对称。 • 通常,不同的分子具有不同的空间构型。 例如,甲烷分子是正四面体形的、氨分子 是三角锥形的、苯是正六边形的。那么, 这些分子为什么具有不同的空间构型呢?
知识点一 价层电子对互斥理论——确定分子空间构型
• 1.价层电子对互斥理论的基本要点 • (1)在AXm型分子中,中心原子A的周围配置 的原子或原子团的几何构型,主要决定于 中心原子价电子层中电子对(包括成键电子 对和未成键的孤电子对)的互相排斥作用, 分子的几何构型总是采取电子对相互排斥 作用最小的那种结构。 • (2)AXm分子中,A与X之间通过两对或三对 电子(即通过双键或三键)结合而成,则价层 电子对互斥理论把双键或三键作为一个电
离子 CO2 子对数 2 对数 0 及名称
直线形
构型及名称
直线形
________
________
分子或 离子
σ 键电 子对数
孤电子 对数
VSEPR 模型 及名称
分子的立体 构型及名称
- CO2 3
3
0
平面三角形
________
平面三角形
________
CH4
4
0
正四面体形
人教版高中化学选修三课件:第二章 第二节 第一课时 价层电子对互斥理论(26张PPT)

•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
实例
2
0
2
3
0
3
2
1
直线形
直线形
HgCl2、 BeCl2、
CO2
三角形
平面三角形 V形
BF3、 BCl3 SnBr2、 PbCl2
σ键电 孤电子 价层电 电子对的 VSEP 分子或离子 实例
子对数 对数 子对数 排列方式 R模型 的立体构型
4
0
3
1
4
四面 体形
正四面体形 三角锥形
CH4、 CCl4 NH3、 NF3
VSEPR模型 的立体构型 体构型名称
NH3
_三__角__锥__形
HCN
_直__线__形
H3O+
_三__角__锥__形
SO2
_V_形
[特别提醒] VSEPR模型与分子的立体构型不一定一致,分子的 立体构型指的是成键电子对的立体构型,不包括孤电子 对(未用于形成共价键的电子对)。两者是否一致取决于 中心原子上有无孤电子对,当中心原子上无孤电子对 时,两者的构型一致;当中心原子上有孤电子对时,两 者的构型不一致。
2
2
V形
H2O
1.用价层电子对互斥理论判断SO3的分子构型为 ( )
A.正四面体形 B.V形
C.三角锥形
D.平面三角形
解析:SO3中S原子的价层电子对数为3,其全部用于形
高中化学 选修3 第二章 分子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学生使用

选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。
选修3第2章第2节第1课时 一些典型分子的空间构型

碳原子的其他杂化类型sp2杂化
栏目导航
↓
栏目导航
栏目导航
Hale Waihona Puke 目导航杂化轨道只能形成σ键 或容纳未成键的孤电 子对,不能形成π键
栏目导航
苯分子的空间构型
栏目导航
栏目导航
苯分子的空间构型 根据杂化轨道理论,形成苯分子时每个碳原子的价电子原子轨道发生 _s_p_2杂化(如 s、px、py),由此形成的三个 sp2 杂化轨道在同一平面内。这样, 每个碳原子的两个 sp2 杂化轨道上的电子分别与邻近的两个碳原子的 sp2 杂化轨道上的电子配对形成 σ 键,于是六个碳原子组成一个正六边形 的 碳环;每个碳原子的另一个 sp2 杂化轨道上的电子分别与一个氢原子的 1s 电子配对形成 σ 键。与此同时,每个碳原子的一个与碳环平面垂直的未参
一不变:轨道数目不变 3、只有原子形成分子时才会发生轨道杂化,单个原子是不会杂化的 4、只有能量相近的轨道才会相互杂化
栏目导航
如何确定某原子成键时的杂化类型?
ABn型分子或离子
杂化轨道数=中心原子 的价层电子对数
杂化类型
sp 1
sp 2
sp 3
中心原子的价层电
?
?
?
子对中数心原子采取s_p__2_杂化,形成的__分__子一定是平面__三__角形吗?
杂化轨道的数目
__2__
杂化轨道间的夹角 __1_8__0__°__
_3___ __1_2__0_°___
4____ 10__9_._5__°___
空间构型
__直__线__型___ 平_面__三___角__形___ 正四__面__体__型_____
实例
C O 2、C 2H 2
2024年高中化学第二章分子结构与性质第二节第1课时价层电子对互斥理论教案新人教版选修3

答案:因为N有一个孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,导致键角缩小。
3. 请画出CH4和NH3的分子结构,并标注键角。
答案:CH4的键角为109.5°,NH3的键角约为107°。
4. 给出两个分子结构相同但分子性质不同的例子,并解释原因。
- 八面体:6个电子对
3. 电子对排布与分子形状
- 成键电子对:中心原子与周围原子之间的共价键
- 孤电子对:中心原子上的未成键电子对
4. VSEPR模型应用
- 预测分子几何结构
- 解释分子性质与结构的关系
5. 实例分析
- BeCl2、CH4、NH3、H2O、SF6等分子的结构分析
(五)拓展延伸(预计用时:3分钟)
知识拓展:
介绍与分子结构相关的拓展知识,拓宽学生的知识视野。引导学生关注学科前沿动态,培养学生的创新意识和探索精神。
情感升华:
结合分子结构内容,引导学生思考学科与生活的联系,培养学生的社会责任感。鼓励学生分享学习心得和体会,增进师生之间的情感交流。
(六)课堂小结(预计用时:2分钟)
5. 能够通过分子模型和多媒体资源,提高空间想象能力,将抽象的化学概念具体化,加深对分子结构空间排列的理解。
6. 在巩固练习中,能够自我检测对价层电子对互斥理论的理解程度,通过错题订正,识别并纠正自己的知识盲点。
7. 拓展知识视野,了解分子结构在科学研究和技术应用中的重要性,激发学生对化学学科的兴趣和探究欲望。
在教学过程中,我尽力营造了一个积极的学习氛围,鼓励学生提问和分享观点,这有助于提高他们的交流能力和批判性思维。但我也意识到,在课堂管理上,我需要更加精细化,确保每个学生都能在讨论中有所收获,避免个别学生游离于课堂之外。
人教版高中化学选修三2.2.1 价层电子对互斥理论 (2)

价层电 子对数
问题导学 第 15 页 ABn 型分子VSEPR模型 和立体结构 立体结构
实 例
VSEPR 成键电 孤对电 分子 模型 子对数 子对数 类型
电子对排布 模型
2
直线形 平面 三角形
2
3 2
0
0 1
AB2
AB3 AB2
直线形
CO2
3
平面三角形 BF3 V形 SO2
- -
: :
价层电子对互斥理论
知识点二、价层电子对互斥理论
1、基本要点 (又称VSEPR模型) σ键电子对和 孤对电子对
问题导学 第 10 页
ABn 型分子(或离子)中的中心原子A周围的价电子对的几何构型,主要
取决于价电子对数(n),价电子对尽量远离,使它们之间斥力最小,
能量最低,物质最稳定。 价层电子对数目 VSEPR模型:
形和 V
三角锥 形,大多数四原子分子采取 平面三角 形和 ___
化学 · 选修 3《物质结构与性质》
价层电子对互斥理论
价层电子对互斥理论
知识点一、形形色色的分子 1、双原子分子 直线型
O2
看图整理 第2 页
HCl
2、三原子分子 直线型或V型
CO2
H2O
价层电子对互斥理论
知识点一、形形色色的分子
看图整理 第3 页
3、四原子分子(直线形、平面三角形、三角锥形、正四面体)
价层电子对互斥理论
知识点二、价层电子对互斥理论
思考 通过电子式分析CH4为什么是 交流 正四面体,NH3三角锥型?
问题导学 第9 页
109°28’
..
107°
高中化学选修3第2章第2节第1课时价层电子对互斥理论

第二节分子的立体构型第1课时价层电子对互斥理论[随堂演练]1.下列说法正确的是A.所有的分子都是由两个或两个以上的原子构成B.所有的三原子分子都是直线形结构C.所有的四原子分子都是平面三角形结构D.五原子分子不一定是正四面体形结构解析稀有气体为单原子分子,H2O为V形,SO3是平面三角形,NH3是三角锥形,CH3Cl、CH2Cl2、CHCl3等都是四面体形,但不是正四面体形结构。
答案 D2.下列分子的立体构型为正四面体形的是①P4②NH3③CCl4④CH4⑤H2S⑥CO2A.①③④⑤B.①③④⑤⑥C.①③④D.②④⑤解析NH3是三角锥形,H2S是V形,CO2是直线形。
答案 C3.科学家研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。
已知该分子中N—N—N键角都是108.1°。
下列有关N(NO2)3的说法正确的是A.分子中N、O原子间形成的共价键是非极性键B.分子中四个氮原子共平面C.该物质既有氧化性又有还原性D.分子中四个氮原子围成一个空间正四面体解析N和O两种原子属于不同的非金属元素,它们之间形成的共价键应该是极性键,A错误;因为该分子中N—N—N键角都是108.1°,所以该分子不可能是平面形结构,而是三角锥形,B、D都是错误的;由该分子的化学式N4O6可知,分子中氮元素的化合价是+3价,处于中间价态,化合价既可以升高又可以降低,所以该物质既有氧化性又有还原性,因此C 正确。
答案 C4.用价层电子对互斥模型判断下列分子或离子的构型。
①CS2________,②NH-2________,③CHCl3________,④PH3________。
解析CS2、NH-2、CHCl3、PH3中心原子的成键电子对数分别为2、2、4、3,中心原子的价层电子对数分别为2、4、4、4,中心原子含有的孤电子对数分别为0、2、0、1,其立体构型分别为直线形、V形、四面体形、三角锥形。
答案①直线形②V形③四面体形④三角锥形[能力提升]一、选择题1.若AB n的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,下列说法正确的是A.若n=2,则分子的立体构型为V形B.若n=3,则分子的立体构型为三角锥形C.若n=4,则分子的立体构型为正四面体形D.以上说法都不正确解析若中心原子A上没有未用于成键的孤电子对,则根据斥力最小的原则,当n=2时,分子的立体结构为直线形;n=3时,分子的立体结构为平面三角形;n=4时,分子的立体结构为正四面体形。
2019-2020学年人教版选修3第2章 第2节 第1课时 价层电子对互斥理论作业

课时分层作业(六)(建议用时:40分钟)[基础达标练]1.下列分子中,所有原子不可能共处于同一平面上的是()A.H2O B.CO2C.CH2O D.CH4[答案] D2.下列分子中键角最大的是()A.H2O B.CO2C.CH2O D.NH3[答案] B3.下列分子或离子的中心原子,带有一对孤电子对的是()①BeCl2②CH4③NH3④CH2O⑤SO2⑥H2S⑦CO2-3⑧NH+4 A.②③⑤⑥⑦B.③⑦⑧C.④⑥⑧D.③⑤D[根据孤电子对数=12(a-xb),可以计算出各微粒中心原子的孤电子对数分别为0、0、1、0、1、2、0、0,故含有一对孤电子对的是③⑤。
] 4.下列分子的立体结构模型正确的是()A.CO2的立体结构模型B.PH3的立体结构模型C.H 2S的立体结构模型D.CH4的立体结构模型D[CO2分子的构型是直线形,A不正确;PH3与N H3的构型相同,为三角锥形,B不正确;H2S与H2O的构型相似,均为V形,C不正确;CH4的构型为正四面体形,D正确。
]5.下列分子中,所有原子不可能共处在同一平面上的是( )A .C 2H 4B .CS 2C .NH 3D .C 6H 6C [C S 2分子为直线形;C 2H 4、C 6H 6分子中所有原子共平面;而N H 3分子为三角锥形,所有的原子不可能在同一平面上。
]6.能说明CH 4分子的5个原子不在同一平面而为正四面体结构的是( )A .任意两个键之间夹角为109°28′B .C —H 键为极性共价键C .4个C —H 键的键能、键长相同D .碳的价层电子都形成共价键A [A 项,CH 4分子的空间构型由化学键之间的夹角决定,只有是正四面体结构时,C 位于正四面体中心,键角才为109°28′。
B 项,分子的空间构型与共价键的极性无关。
C 项,因为同为C —H 键,不论分子构型如何,它们的键能、键长都相等。
D 项,碳原子价电子都成键无法说明分子构型。
高中化学第二章分子结构与性质第2节第1课时价层电子对互斥模型讲义+精练含解析新人教版选修3

第1课时 价层电子对互斥模型[知 识 梳 理]一、形形色色的分子1.三原子分子立体构型⎩⎪⎨⎪⎧直形线,如CO 2分子V 形,如H 2O 分子2.四原子分子立体构型⎩⎪⎨⎪⎧平面三角形,如甲醛分子三角锥形,如氨分子3.五原子分子立体构型:最常见的是正四面体,如CH 4,键角为109°28′。
【自主思考】下列分子根据其分子立体构型连线。
分子A :H 2O B :CO 2C :NH 3D :CH 2OE :CH 4分子的立体构型①直线形②V形③平面三角形④三角锥形⑤正四面体形答案 A —② B —① C —④ D —③ E —⑤二、价层电子对互斥理论 1.价层电子对互斥理论分子的立体构型是“价层电子对”相互排斥的结果。
2.价层电子对互斥模型(VSEPR模型)与分子(离子)的立体结构【自主思考】如何确定AB n型分子空间构型?答案(1)确定中心原子(A)的价层电子对数。
(2)根据计算结果找出理想的VSEPR模型。
(3)略去孤电子对在价层电子对互斥模型中占有的空间,剩下的便是分子的立体构型。
[效果自测]1.判断正误,正确的打“√”;错误的打“×”。
(1)所有的三原子分子都是直线形结构。
()(2)所有的四原子分子都是平面三角形结构。
()(3)五原子分子的空间构型都是正四面体。
()(4)P4和CH4都是正四面体分子且键角都为109°28′。
()(5)NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强。
()(6)VSEPR模型和分子的立体构型,二者可能是不同的。
()答案(1)×(2)×(3)×(4)×(5)√(6)√2.H2O的中心原子上有对孤电子对,与中心原子上的键电子对相加等于,它们相互排斥形成形VSEPR模型。
略去VSEPR模型中的中心原子上的孤电子对,因而H2O分子呈形。
答案 2 σ 4 四面体V3.用价层电子对互斥模型预测下列粒子的立体结构。
化学人教选修3配套课件:第2章 第2节 第1课时 分子空间结构与价层电子对互斥理论

CO2Leabharlann O===C===O __1_8_0_°____
__直__线__形____
H2O
__1_0_5_°____
__V_形____
• 2.四原子分子大多数采取___平_面__三__角____形和三__角__锥______形两种立体 构型。如
化学式 电子式 结构式
键角
立体构型 立体构型名称
CH2O
约___1_2_0_°___
构型及名称
H2O
4
2
__正__四__面__体__形____
__V_形____
SO2
3
1
__平__面__三__角__形____
__V_形____
预习自测·初试牛刀
• 1.思考辨析:
• (1)价电子对之间的夹角越小,排斥力越小。×( ) • (2)NH3分子的VSEPR模型与分子构型不一致。√ ( ) • (3)五原子分子的立体结构都是正四面体形。×( )
___平__面__三__角__形___
NH3
___1_0_7_°___
___三__角__锥__形___
• 3.五原子分子的可能立体构型更多,最常见的是__正__四__面__体____形。如
化学式 电子式 结构式
键角
立体构型 立体构型名称
CH4
__1_0_9_°__2_8_′__
___正__四__面__体__形___
分子或离子 σ 键电子对数 孤电子对数 VSEPR 模型及名称
分子的立体 构型及名称
CO23-
3
0 ___平__面__三__角__形___ ___平__面__三__角__形___
CH4
4
0 ___正__四__面__体__形___ ___正__四__面__体__形___
高中化学选修3第2章第2节第1课时价层电子对互斥理论
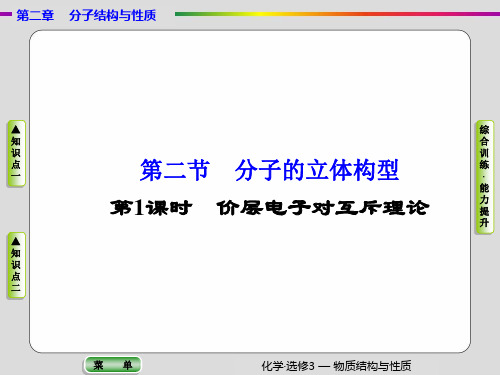
直线形 平面三角形 正四面体形
提 升
▲
知
识
点 二
分子立体构型名称 直线形 平面三角形 三角锥形
菜单
化学·选修3 — 物质结构与性质
第二章 分子结构与性质
核心探究·重难突破 ◎探究思考
1.NH3 的 VSEPR 模型与分子的立体构型有什 么不同?
▲
综
知
合
识
训
点 一
提示 VSEPR 模型指的是中心原子价层电子对
知 识
分子 CH4 _体__形___
1__0_9_°__2_8_′ _
点
二
菜单
化学·选修3 — 物质结构与性质
第二章 分子结构与性质
题组冲关·演练应用
1.下列物质的立体结构与 NH3 相同的是
▲ 知
A.H2O
识 点
C.CH4
B.H3O+
综 合
D.CO2
训 练
一
·
能
解析 NH3 是四原子分子,与其立体结构相似的也
数。
能
(1)σ 键电子对数的确定
力 提
▲ 知
由分子式确定 σ 键的电子对数。例如,H2O 分子的中 心原子为 O 原子,O 有 2 对 σ 键电子对;NH3 分子的中心
升
识 点
原子为 N 原子,N 有 3 对 σ 键电子对。
二
菜单
化学·选修3 — 物质结构与性质
第二章 分子结构与性质
(2)中心原子上的孤电子对数的确定
合 训
点 一
型是“价层电子对”相互排斥的结果。价层电子对是
练 ·
指分子中的中心原子上的电子对,包括σ键电子对和
能
力
中心原子上的孤电子对。
第二章 第二节 第1课时 价层电子对互斥理论(教师版)

第二节 分子的立体构型 第1课时 价层电子对互斥理论一、形形色色的分子1.三原子分子的立体构型有直线形和V 形两种,如化学式 电子式结构式 键角 立体构型立体构型名称 CO 2O==C==O180°直线形H 2O105°V 形2.大多数四原子分子采取平面三角形和三角锥形两种立体构型,如化学式电子式结构式键角立体构型立体构型名称CH 2O约120°平面三角形NH 3107°三角锥形3.五原子分子的可能立体构型更多,最常见的是正四面体形,如化学式电子式结构式键角立体构型立体构型名称CH 4109°28′正四面体形CCl 4109°28′正四面体形判断正误(1)CS 2分子的立体构型是V 形( ) (2)NF 3分子的立体构型是四面体形( ) (3)键长、键角不同是导致分子构型不同的主要原因( ) (4)正四面体形分子一定是五原子分子( ) 答案 (1)× (2)× (3)√ (4)×应用体验1.下面四种说法①两个键之间的夹角为109°28′ ②C—H 键为极性共价键 ③4个C—H 键的键能、键长相同 ④碳原子的价电子都参与成键能说明CH 4分子中的五个原子不在同一平面而呈正四面体结构的是__①__(填序号)。
2.下列分子构型与分子中共价键键角对应一定正确的是( )A .直线形分子:180°B .平面正三角形:120°C .三角锥形:109°28′D .正四面体形:109°28′ 答案 B 解析 A 项,HCl 是直线形分子,因只有一个共价键,故不存在键角,A 项错误;氨分子呈三角锥形,键角为107°,C 项错误;甲烷与白磷分子均是正四面体形分子,但键角分别为109°28′、60°,D 项错误。
特别提醒(1)四原子分子不一定都是平面三角形或三角锥形。
人教版高中化学选修3课件-价层电子对互斥理论

应用价层电子对互斥模型如何将分子分类?
【点拨】 应用价层电子对互斥模型将分子分成两大类:一 类是中心原子上的价电子都用于形成共价键,如 CO2、CH2O、 CH4 等分子中的 C 原子,它们的立体构型可应用中心原子周围 的原子数来预测;一类是中心原子上有孤电子对(未用于形成共 价键的电子对)的分子,如 H2O 和 NH3 中心原子上的孤电子对也 要占据中心原子周围的空间,并参与互相排斥,因而 H2O 分子 呈 V 形,NH3 分子呈三角锥形。
( C) A.CH4、CS2、BF3 B.CO2、H2O、NH3 C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
解析:题中的 CH4 和 CCl4 为正四面体形分子,NH3 和 PH3 为三角锥形分子,这几种分子的所有原子不可能都在同一平面 上,CS2、CO2、C2H2 和 BeCl2 为直线形分子,C2H4 为平面形分 子,C6H6 为平面正六边形分子,这些分子都是平面形结构,故 选 C。
6.下列说法中正确的是( D ) A.NO2、SO2、BF3、NCl3 分子中没有一个分子中原子的 最外层电子都满足了 8 电子稳定结构 B.P4 和 CH4 都是正四面体形分子,且键角都为 109°28′
2.四原子分子(AB3 型)
3.五原子分子(AB4 型) 最常见的为 正四面体 109°28′ 。
形,如
CH4、CCl4 等,键角为
二、价层电子对互斥理论
1.内容
价层电子对互斥理论认为,分子的立体结构是 “价层电子对”相互排斥的结果。价层电子对是指分子中的
中心原子 上的电子对,包括 中心原子上的孤电子对 。
第三步:分子或离子的立体构型的确定 确定分子或离子的中心原子上的价层电子对数后,再依据 上表,即可确定分子或离子的立体构型。 (2)用价层电子对互斥理论判断共价分子结构的实例
高中化学第二章第二节第1课时价层电子对互斥理论教案新人教版选修3
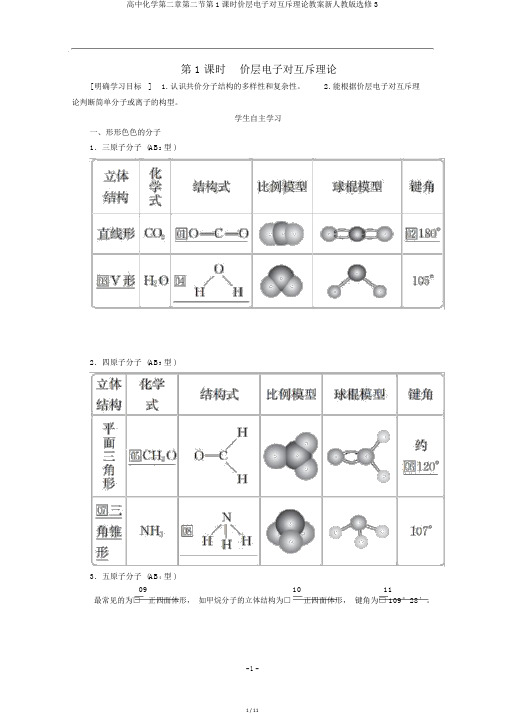
第 1 课时价层电子对互斥理论[ 明确学习目标] 1. 认识共价分子结构的多样性和复杂性。
2. 能根据价层电子对互斥理论判断简单分子或离子的构型。
学生自主学习一、形形色色的分子1.三原子分子 (AB2型 )2.四原子分子 (AB3型 )3.五原子分子 (AB4型 )09 10 11最常见的为□ 正四面体形,如甲烷分子的立体结构为□正四面体形,键角为□ 109°28′。
二、价层电子对互斥理论1.价层电子对互斥理论(VSEPR)010203 分子中的价层电子对( 包括□σ键电子对和中心原子上的□孤电子对)由于□ 相互排斥而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。
2.价层电子对的确定方法σ 键电子对数可由分子式确定。
a 表示中心原子的价电子数,对于主族元素来说,04a=原子的□ 最外层电子数;对于阳离子来说, a=中心原子的□05价电子数-离子电荷数;对于阴离子来说,a=中心原子的□06价电子数+ | 离子电荷数 | 。
x 表示与中心原子结合的□07原子数。
b 表示与中心原子结合的原子□08最多能接受的电子数,氢为1,其他原子=□098-该原子的价电子数。
3.VSEPR模型预测分子或离子的立体构型(1)中心原子上的价电子都用于形成共价键的分子- 2 -(2)中心原子上有孤电子对的分子对于中心原子上有孤电子对 ( 未用于形成共价键的电子对 ) 的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。
1.五原子的分子空间构型都是正四面体吗?提示: 不是,只有中心原子所连四个键的键长相等时才为正四面体。
如CH 3Cl 因 C — H 键和 C — Cl 键键长不相等,故CH 3Cl 分子的四面体不再是正四面体。
2.VSEPR 模型和分子的立体构型二者相同吗?提示: 不一定相同。
(1)VSEPR 模型指的是包括 σ 键电子对和孤电子对在内的空间构型;分子的立体构型指的是组成分子的所有原子( 只考虑分子内的 σ 键 ) 所形成的空间构型。
2019-2020学年人教版化学选修三讲义:第2章 第2节 第1课时 价层电子对互斥理论 Word版含答案
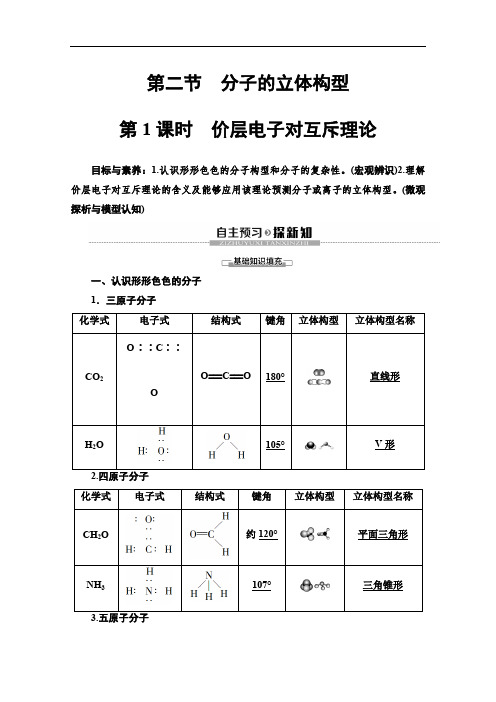
第二节 分子的立体构型 第1课时 价层电子对互斥理论目标与素养:1.认识形形色色的分子构型和分子的复杂性。
(宏观辨识)2.理解价层电子对互斥理论的含义及能够应用该理论预测分子或离子的立体构型。
(微观探析与模型认知)一、认识形形色色的分子 1.三原子分子 O ∶∶C ∶∶O1.价层电子对互斥理论分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,由于电子对的排斥作用,而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。
2.价层电子对的确定方法(1)a 表示中心原子的价电子数对主族元素:a =最外层电子数;对于阳离子:a =价电子数-离子电荷数; 对于阴离子:a =价电子数+离子电荷数。
(2)x 表示与中心原子结合的原子数。
(3)b 表示与中心原子结合的原子最多接受的电子数。
氢为1,其他原子=8-该原子的价电子数。
3.价层电子对互斥模型与分子(离子)的立体构型 (1)中心原子价电子全部参与形成共价键的分子价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。
微点拨:VSEPR 模型与分子或离子的立体构型不一定一致,分子的立体构型指的是成键电子对的立体构型,不包括孤电子对(未用于形成共价键的电子对)。
两者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,两者的构型一致;当中心原子上有孤电子对时,两者的构型不一致。
1.判断正误(正确的打“√”,错误的打“×”)(1)NH 3分子中心原子孤电子对为1,分子为三角锥形,键角为109°28′( ) (2)CO 2和SO 2都是直线形分子( )(3)正四面体结构的分子中键角一定是109°28′( ) (4)SO 2的VSEPR 模型与分子立体构型相同( )[答案] (1)× (2)× (3)× (4)×2.若AB n 分子的中心原子A 上没有未用于形成共价键的孤电子对,根据价层电子对互斥理论,下列说法正确的是( )A .若n =2,则分子的立体构型为V 形B .若n =3,则分子的立体构型为三角锥形C .若n =4,则分子的立体构型为正四面体形D .以上说法都不正确 [答案] C 3.填表4 1 四面体形 三角锥形 4 0 正四面体形 正四面体形 3 0 平面三角形 平面三角形价层电子对互斥理论预测立体结构在确定了分子中σ键电子对数和中心原子上的孤电子对数后,可以依据下面的方法确定相应的较稳定的分子立体构型。
人教版高中化学选修三课件:第二章 第二节 第1课时 价层电子对互斥理论

σ 键电子对数+孤电子对数=价层电子对数 分子立体构型。
VSEPR 模型
价层电 子对数
2
VSEPR 模型名称
直线形
成键电 孤电子对
分子立体
电子对的排列方式
子对数 数
构型名称
2
0
直线形
实例
BeCl2 CO2
3
0
3 平面三角形
平面三角形 BF3 BCl3
2
1
V形
SO2
价层电 子对数
VSEPR 模型名称
3.VSEPR 模型和分子的立体构型 H2O 的中心原子上有 2 对孤电子对,与中心原子上的 σ 键电子对相加等于 4 ,它们相 互排斥形成四面体形 VSEPR 模型。略去 VSEPR 模型中的中心原子上的孤电子对,因 而 H2O 分子呈V 形。
[微思考] 根据价层电子对互斥理论,判断 NH+ 4 的 VSEPR 模型和 NH+ 4 的立体构型。 [提示] NH+ 4 中心氮原子上的弧电子对数为12(a-xb)=12(5-1-4×1)=0,即 NH+ 4 的孤电子对数 为 0;σ 键数为 4,所以 NH4+的 VSEPR 模型与立方构型均为正四面体形。
简单分子或离子的构型。
解决复杂化学问题的思维框架。
01 基础 自主落实 02 要点 系统认知 03 检测 课堂达标 04 演练 效果检测
一、形形色色的分子
1.三原子分子的立体构型有直线形和 V 形两种
化学式
电子式
结构式键角
立体构型
立体构型名称
CO2
180°
直线形
H2O
105°
V形
2.四原子分子大多数采取平面三角形和三角锥形两种立体构型
2.VSEPR 模型——价层电子对的立体构型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO2 O∶∶C∶∶O O===C===O 180°
直线形
H2O
105°
V形
2.四原子分子 化学式 电子式
结构式
键角 立体构型 立体构型名称
CH2O
约 120°
平面三角形
NH3
3.五原子分子
化学式
电子式
107°
三角锥形
结构式 键角 立体构型 立体构型名称
-1-
CH4
109°28′
正四面体形
价层电子对互斥理论
σ 键电子对数+孤电子对数=价层电子对数
――→
VSEPR 模型
略去孤电子对 ――→ 分子立体构型。
1 (1)孤电子对数= (a-xb)。
2 (2)价层电子对数与 VSEPR 模型关系
-4-
价层电子对数
2
3
4
VSEPR 模型
直线形
平面三角形
四面体形
(3)价层电子对之间相互排斥作用大小的一般规律:孤电子对孤电子对>孤电
B.BF3 键角为 120°
C.BF3 是平面三角形分子
D.PCl3、NH3 都是三角锥形分子
A [SO2
的价层电子对数为
2+1(6-2×2)=3,VSEPR 2
模型为平面三角形,
分子构型为 V 形。]
3.请填写下表:
分子或离子
价层电子对数
中心原子上 的孤电子对数
分子或离子 的立体构型
OF2 ClF+2
,离子呈平面正方形结构
D.NH3 分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D [NCl3 分子的电子式为
,分子中各原子都满足 8 电子稳定结
构,A 错误;P4 为正四面体形分子,但其键角为 60°,B 错误;NH +4 为正四面体
形结构而非平面正方形结构,C 错误;NH3 分子电子式为
-8-
价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并
互相排斥使分子呈现不同的立体构型。
化学式
含孤电子对的 VSEPR 模型
分子或离子的立体 分子或离子的立体
构型
构型名称
H2O
V形
NH3 HCN H3O+
SO2
三角锥形 直线形
三角锥形 V形
微点拨:VSEPR 模型与分子或离子的立体构型不一定一致,分子的立体构型 指的是成键电子对的立体构型,不包括孤电子对(未用于形成共价键的电子对)。两 者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,两者 的构型一致;当中心原子上有孤电子对时,两者的构型不一致。
-3-
2.若 ABn 分子的中心原子 A 上没有未用于形成共价键的孤电子对,根据价 层电子对互斥理论,下列说法正确的是( )
A.若 n=2,则分子的立体构型为 V 形 B.若 n=3,则分子的立体构型为三角锥形 C.若 n=4,则分子的立体构型为正四面体形 D.以上说法都不正确 [答案] C 3.填表 分子或离子 价层电子对数 孤电子对数 VSEPR 模型 粒子构型
子对成键电子对>成键电子对成键电子对。随着孤电子对数目的增多,成键电子
对与成键电子对之间的斥力减小,键角也减小。如 CH4、NH3 和 H2O 分子中的键 角依次减小。
1.下列粒子的价层电子对(点“.”的原子为中心原子)数正确的是( )
A.C· H4 4
B.C· O2 1
C.B· F3 2
D.S· O3 2
-7-
子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式: ________________; ________________。
[解析] (2)AB3 型,中心原子无孤电子对的呈平面三角形,有一对孤电子对的 呈三角锥形,所以分别是 CH+3 、CH-3 。
[答案] (1)正四面体形 直线形 平面三角形 (2)CH+3 CH-3
H2S NH3 NH+4 CO2-3 [答案] 4 2 四面体形 V 形 4 1 四面体形 三角锥形 4 0 正四面体形 正四面体形 3 0 平面三角形 平面三角形
价层电子对互斥理论预测立体结构
在确定了分子中 σ 键电子对数和中心原子上的孤电子对数后,可以依据下面
的方法确定相应的较稳定的分子立体构型。
2 依次为 2、0、0、1。]
2.下列分子的立体构型是正四面体形的是( )
A.CH4
B.NH3
C.H2O
D.C2H4
A [氨分子是三角锥形,水分子是 V 形,乙烯分子是平面形。]
3.下列分子中,价层电子对互斥模型与分子的立体结构模型相同的是( )
①CH2O ②CO2 ③NCl3 ④H2S
A.①②
1.判断正误(正确的打“√”,错误的打“×”) (1)NH3 分子中心原子孤电子对为 1,分子为三角锥形,键角为 109°28′( ) (2)CO2 和 SO2 都是直线形分子( ) (3)正四面体结构的分子中键角一定是 109°28′( ) (4)SO2 的 VSEPR 模型与分子立体构型相同( ) [答案] (1)× (2)× (3)× (4)×
第二节 分子的立体构型
第 1 课时 价层电子对互斥理论
目标与素养:1.认识形形色色的分子构型和分子的复杂性。(宏观辨识)2.理解 价层电子对互斥理论的含义及能够应用该理论预测分子或离子的立体构型。(微观 探析与模型认知)
一、认识形形色色的分子
1.三原子分子
化学式
电子式
结构式
键角 立体构型 立体构型名称
,有一对未成
键电子,由于未成键电子对成键电子的排斥作用,使其键角为 107°,呈三角锥形,D 正确。]
5.(1)利用 VSEPR 推断分子或离子的立体结构。 PO3-4 ________________;CS2________________; AlBr3(共价分子)________________。 (2)有两种活性反应中间体粒子,它们的粒子中均含有 1 个碳原子和 3 个氢原
B.BeCl2
C.CH4
D.PCl3
D [方 法 一 : 选 项 中 四 种 物 质 的 电 子 式 依 次 为 :
。H2O 有 2 对孤电子对,BeCl2 和
CH4 没有孤电子对,PCl3 有一对孤电子对。
方法二:将选项中各物质的数据代入公式:Fra bibliotek-6-
1 中心原子上的孤电子对数= (a-xb),经计算知,选项中原子上的孤电子对数
-5-
PCl3 SiCl4 NH+4
[答案] 分子或离子
OF2 ClF+2
PCl3 SiCl4 NH+4
价层电子对数
中心原子上 的孤电子对数
4
2
分子或离子 的立体构型
V形
4
2
V形
4
1
三角锥形
4
0
正四面体形
4
0
正四面体形
1.下列分子或离子的中心原子,带有一对孤电子对的是( )
A.H2O
B.②③
C.③④
D.①④
A [两种模型相同,说明中心原子的价电子均参与成键,无孤电子对存在。]
4.下列说法中正确的是( )
A.NO2、BF3、NCl3 分子中没有一个分子中原子的最外层电子都满足 8 电子 稳定结构
B.P4 和 CH4 都是正四面体形分子且键角都为 109°28′
C.NH +4 的电子式为
CCl4
109°28′
正四面体形
二、价层电子对互斥理论 1.价层电子对互斥理论 分子中的价层电子对包括 σ 键电子对和中心原子上的孤电子对,由于电子对 的排斥作用,而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小 斥力。 2.价层电子对的确定方法
(1)a 表示中心原子的价电子数
对主族元素:a=最外层电子数;
A [价层电子对数为:A.4+1(4-4×1)=4;B.2+1×(4-2×2)=2;C.3+1
2
2
2
×(3-3×1)=3;D.3+1(6-3×2)=3。故 A 正确。] 2
2.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有
时也能用来推测键角大小,下列判断错误的是( )
A.SO2、CS2、HI 都是直线形分子
对于阳离子:a=价电子数-离子电荷数;
对于阴离子:a=价电子数+离子电荷数。
(2)x 表示与中心原子结合的原子数。
(3)b 表示与中心原子结合的原子最多接受的电子数。氢为 1,其他原子=8-该
原子的价电子数。
3.价层电子对互斥模型与分子(离子)的立体构型
(1)中心原子价电子全部参与形成共价键的分子
ABn 价层电子对数
n=2 2
n=3 3
n=4 4
成键电子对数
2
3
4
电子对立体构型
直线形
平面三角形
正四面体形
-2-
(VSEPR 模型)
分子立体构型
直线形
平面三角形
正四面体形
实例
CO2、BeCl2 BF3、BCl3、BBr3 CH4、CCl4、SiF4
(2)中心原子上有孤电子对的分子:对于中心原子上有孤电子对(未用于形成共
