高考化学第一轮复习--物质的量 课件(共54张PPT)
合集下载
2025届高三化学一轮复习 第6讲 物质的量+气体摩尔体积 课件

原子、分子、离子、原子团、质子、电子、中子或某些特定微粒组合等
③必须用化学式指明粒子的种类。 1mol氧
×
④摩尔的标准:以0.012kg12C中所含的碳原子数为1mol,约为6.02×1023
考点一 物质的量 摩尔质量
2. 阿伏加德罗常数(NA)
(1)含义:1mol任何粒子的粒子数叫做阿伏加德罗常数,符号为 NA
=36.966
24.23%
Mr(Cl)=34.969×75.77% +36.966×24.23% =35.453
Mr(Cl)=35×75.77%+37×24.23% =35.485
考点一 物质的量 摩尔质量
3. 摩尔质量
(5)数值关系:以 g·mol-1 为单位时,任何粒子的摩尔质量在数值上
都等于该粒子的 相对分子(原子)质量 。
35Cl
37Cl
中子数
18
20
质量数
35
37
绝对原子质量(Kg)
5.8088×10-26
6.1405×10-26
同位素的
相对原子质量
5.8088×10-26
=34.969
1.9927×10-26×1/12
原子个数百分比
氯元素的
相对原子质量
氯元素的
近似相对原子质量
75.77%
6.1405×10-23×6.02×1023
反应,生成H2体积为V2 L。下列说法错误的是(
A.X、Y生成H2的物质的量之比一定为
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由
一定能确定产物中X、Y的化合价
2023版高考化学一轮总复习第二章第三节物质的量课件

答案:B
考向2 物质的量、摩尔质量与质量 【练 3】(2021 年佛山检测)设 NA 为阿伏加德罗常数的值。 已知反应:Na2S+(x-1)S===Na2Sx(x≤5),下列说法正确的是 () A.1 mol S2-所含电子数为 8NA B.1 mol·L-1 Na2S 溶液中,S2-的数目为 NA C.7.8 g Na2S 固体所含离子数为 0.3NA D.1 mol Na2S 最多溶解 S 原子的数目为 5NA
摩尔质量、相对分子质量、质量是三个不同的物理量,具 有不同的单位,含义不同。如 H2O 的摩尔质量为 18 g·mol-1, H2O 的相对分子质量为 18,1 mol H2O 的质量为 18 g。
考向1 物质的量、阿伏加德罗常数与粒子 【练1】(2021 年广东适应性测试)设阿伏加德罗常数的值 为 NA。下列说法正确的是( ) A.1 mol Cl2 和足量 Fe 充分反应,转移电子数为 3NA B.标准状况下,1.12 L 苯含有 C—H 键的个数为 3NA C.0.5 mol CO2 和足量 Na2O2 反应,产生的气体的分子数为 0.25NA D.0.5 mol 乙酸乙酯在酸性条件下水解,生成乙醇的分子数
B.离子结构示意图
既可以表示 35Cl-,也可以表示
37Cl-,1 mol Fe 与 1 mol Cl2 充分反应,转移电子数为 2NA C.标准状况下,22.4 L 乙炔中含π键数目为 3NA
D.1 mol 雄黄(As4S4),结构如图: S—S
,含有 2NA 个
解析:1 个碳正离子(CH+ 3 )中含有 8 个电子,则 1 mol 碳正 离子(CH+ 3 )所含的电子总数为 8NA,A 错误;离子结构示意图
2.(教材必修第一册P57 第3 题改编题)现有100 mL 1 mol·L-1 稀盐酸,欲将其浓度变为 2 mol·L-1,可以采取的措施为( )
考向2 物质的量、摩尔质量与质量 【练 3】(2021 年佛山检测)设 NA 为阿伏加德罗常数的值。 已知反应:Na2S+(x-1)S===Na2Sx(x≤5),下列说法正确的是 () A.1 mol S2-所含电子数为 8NA B.1 mol·L-1 Na2S 溶液中,S2-的数目为 NA C.7.8 g Na2S 固体所含离子数为 0.3NA D.1 mol Na2S 最多溶解 S 原子的数目为 5NA
摩尔质量、相对分子质量、质量是三个不同的物理量,具 有不同的单位,含义不同。如 H2O 的摩尔质量为 18 g·mol-1, H2O 的相对分子质量为 18,1 mol H2O 的质量为 18 g。
考向1 物质的量、阿伏加德罗常数与粒子 【练1】(2021 年广东适应性测试)设阿伏加德罗常数的值 为 NA。下列说法正确的是( ) A.1 mol Cl2 和足量 Fe 充分反应,转移电子数为 3NA B.标准状况下,1.12 L 苯含有 C—H 键的个数为 3NA C.0.5 mol CO2 和足量 Na2O2 反应,产生的气体的分子数为 0.25NA D.0.5 mol 乙酸乙酯在酸性条件下水解,生成乙醇的分子数
B.离子结构示意图
既可以表示 35Cl-,也可以表示
37Cl-,1 mol Fe 与 1 mol Cl2 充分反应,转移电子数为 2NA C.标准状况下,22.4 L 乙炔中含π键数目为 3NA
D.1 mol 雄黄(As4S4),结构如图: S—S
,含有 2NA 个
解析:1 个碳正离子(CH+ 3 )中含有 8 个电子,则 1 mol 碳正 离子(CH+ 3 )所含的电子总数为 8NA,A 错误;离子结构示意图
2.(教材必修第一册P57 第3 题改编题)现有100 mL 1 mol·L-1 稀盐酸,欲将其浓度变为 2 mol·L-1,可以采取的措施为( )
高三化学一轮复习课件第6讲:物质的量、气体摩尔体积

知识点一 物质的量 摩尔质量
对点练通
计算判断物质中所含指定微粒数目的技巧 弄清楚微粒与所给物质的关系:原子(电子)的物质的量=分子(或特定组合)的 物质的量×1个分子(或特定组合)中所含这种原子(电子)的个数
知识点二 气体摩尔体积 阿伏加德罗定律
自主梳理
对点练通
知识点二 气体摩尔体积 阿伏加德罗定律
知识点一 物质的量 摩尔质量
对点练通
3.硫酸钠可用来制硫化钠、纸浆、玻璃、水玻璃、瓷釉,也用作缓泻剂和钡盐 中毒的解毒剂等,已知硫酸钠晶体(Na2SO4·10H2O)为1 mol,请计算填空: (1)钠离子的物质的量是__2_m__o_l __。 (2)所含硫酸根离子的物质的量是__1_m__o_l __,硫酸根离子的数目是___N_A____。 (3)所含结晶水的物质的量是_1_0__m_o_l__,所含氧原子的物质的量是_1_4__m_o_l__。
知识点一 物质的量 摩尔质量
对点练通
(一)物质的量及其相关概念
1.下列有关说法中正确的是( D )
A.原子、电子、质子、凳子等都可用物质的量来描述 B.青蒿素的分子式为C15H22O5,它的摩尔质量为282 C.1 mol CO2中含1 mol碳和2 mol氧 D.“物质的量”表示含有一定数目粒子的集合体,是七个基本物理量之一
知识点二 气体摩尔体积 阿伏加德罗定律
对点练通
(3)在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),若所得气体
对H2的相对密度为d,则该混合气体的平均相对分子质量为___2_d____,混合气体 m
的物质的量为__2_d__m__o_l ,NH4HCO3的摩尔质量为___6_d__g_·m__o_l-__1 __(用含m、d的
高考化学一轮复习专题二物质的量课件

1.定律:同温同压下,相同体积的任何气体都含有相同数目的粒子。可总结 为“三同”推“一同”,适用对象为气体。 2.推论
(1)相同T、p时: V1 = n1 、 ρ1 = M1 =D(相对密度)。
V2 n2 ρ2 M 2
(2)相同T、V时: p1 = n1 。
)。 2.配制步骤:计算、称量(或量取)、⑦ 溶解(或稀释) 、移液、洗涤、⑧
定容 。
3.注意事项:只能配制一定体积的溶液,即不能配制任意体积的一定物质的 量浓度的溶液;转移溶液时,溶液的温度应为⑨ 室温 ;玻璃棒要靠在瓶 颈刻度线以下;如果加水定容时超过了刻度线,不能将超出的部分倒出,必 须重新配制,否则会使配制的溶液浓度 偏低 ;溶质溶解再转移至容 量瓶后,必须洗涤烧杯和玻璃棒,洗涤液也转移到容量瓶中,否则会造成所 配溶液的浓度 偏低 ;在用移液管(或滴定管)量取溶液时,量取液体之前 应用待量取的溶液润洗;用胶头滴管定容到液体凹液面与刻度线相切时,盖 上瓶塞后摇匀,出现液面低于刻度线时不要再加水定容。
重点突破 配制一定物质的量浓度溶液的误差分析 根据c= n = m 判断:
V MV
1.移液后若没有洗涤烧杯,则使n减小,结果偏小。 2.若容量瓶中有少量蒸馏水或定容反复摇匀后发现液面低于刻度线,对结 果无影响。 3.仰视、俯视对结果的影响
(1)仰视刻度线:由于操作时以刻度线为基准,故加水量增多,导致溶液 体积偏大,c偏小。 (2)俯视刻度线:加水量减少,则溶液体积偏小,故c偏大。
考点清单
考点一 物质的量、气体摩尔体积
考点基础 一、重要概念 1.物质的量 物质的量是表示含有一定数目粒子的集合体的物理量,符号是① n ,其 单位为摩尔(符号是mol)。使用该单位时,应指明对象,它的对象是所有微 观粒子,如分子、原子、离子、质子、中子、电子等。
(1)相同T、p时: V1 = n1 、 ρ1 = M1 =D(相对密度)。
V2 n2 ρ2 M 2
(2)相同T、V时: p1 = n1 。
)。 2.配制步骤:计算、称量(或量取)、⑦ 溶解(或稀释) 、移液、洗涤、⑧
定容 。
3.注意事项:只能配制一定体积的溶液,即不能配制任意体积的一定物质的 量浓度的溶液;转移溶液时,溶液的温度应为⑨ 室温 ;玻璃棒要靠在瓶 颈刻度线以下;如果加水定容时超过了刻度线,不能将超出的部分倒出,必 须重新配制,否则会使配制的溶液浓度 偏低 ;溶质溶解再转移至容 量瓶后,必须洗涤烧杯和玻璃棒,洗涤液也转移到容量瓶中,否则会造成所 配溶液的浓度 偏低 ;在用移液管(或滴定管)量取溶液时,量取液体之前 应用待量取的溶液润洗;用胶头滴管定容到液体凹液面与刻度线相切时,盖 上瓶塞后摇匀,出现液面低于刻度线时不要再加水定容。
重点突破 配制一定物质的量浓度溶液的误差分析 根据c= n = m 判断:
V MV
1.移液后若没有洗涤烧杯,则使n减小,结果偏小。 2.若容量瓶中有少量蒸馏水或定容反复摇匀后发现液面低于刻度线,对结 果无影响。 3.仰视、俯视对结果的影响
(1)仰视刻度线:由于操作时以刻度线为基准,故加水量增多,导致溶液 体积偏大,c偏小。 (2)俯视刻度线:加水量减少,则溶液体积偏小,故c偏大。
考点清单
考点一 物质的量、气体摩尔体积
考点基础 一、重要概念 1.物质的量 物质的量是表示含有一定数目粒子的集合体的物理量,符号是① n ,其 单位为摩尔(符号是mol)。使用该单位时,应指明对象,它的对象是所有微 观粒子,如分子、原子、离子、质子、中子、电子等。
高三化学第一轮复习物质的量PPT课件
标准状况:0℃、 1.01×105 Pa
② 对象:纯气体或混合气体 ,不适用于固体、气体。 3)气体的物质的量为1mol时,体积约为22.4L。
(4)气体摩尔体积大小的影响因素
决定气体摩尔体积大小的主要因素是:气体分
子间的平均距离。其影响因素主要有温度、压强。
第13页/共65页
【例3】下列说法正确的是 (
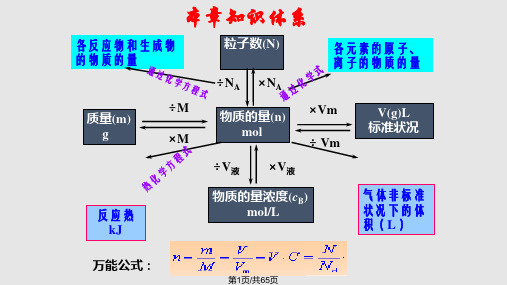
本章知识体系
各反应物和生成物 的物质的量
÷M 质量(m)
g
×M
粒子数(N)
÷NA ×NA 物质的量(n)
mol
各元素的原子、 离子的物质的量
×Vm ÷ Vm
V(g)L 标准状况
反应热 kJ
÷V液
×V液
物质的量浓度(cB) mol/L
气体非标准 状况下的体 积(L)
万能公式:
第1页/共65页
一、理解几个重要的概念
(4)物质的量与微粒个数的关系:n=N/NA
[思考] 6.02 × 1023 等于阿伏加德罗常数吗?
第6页/共65页
1mol粒子的粒子数
阿伏加德罗常数
约为
6.02×1023
0.012Kg12C中所含原子数
第7页/共65页
练习:
(1)9.03×1023个氨分子含____1__.5___mol氨分子,
VL
÷ Vm
× Vm
物质的质量
mg
÷M 物质的量
× M n mol
× NA ÷ NA
粒子数目
N
第15页/共65页
6.阿伏加德罗定律
1).阿伏加德罗定律:___________________________________
2).阿伏加德罗定律推论
高三化学一轮复习全套ppt课件

不同体积的KCl溶液 相同体积的上述两种溶液
c(溶质)
相同
相同
ρ(溶液)
相同
不同
n(溶质)
不同
相同
m(溶质)
不同
不同
c(Cl-)
相同
不同
11
一、溶液的浓度
例:实验室里需用480mL0.1mol/L的硫酸铜溶液,以下操作 正确的是: D A.称取7.68g硫酸铜,加入500mL水 B.称取12.0g胆矾配成500mL溶液 C.称取8.0g硫酸铜,加入500mL水 D.称取12.5g胆矾配成500mL溶液
偏大的有___A_C____。
18
三、一定物质的浓度溶液的配置
例:以配制480 mL 1 mol·L-1 NaOH溶液为例 (1)所需容量瓶规格:__5_0_0__m_L_容__量__瓶__。 (2)溶解过程中玻璃棒的作用为:__搅__拌__,__加__速__溶__解__。 (3)移液 ①移液前需要将溶液冷却至室温。 ②移液中玻璃棒的作用为_引__流__。 ③移液时需要进行的操作为:将烧杯中溶液注入容量瓶, _将__烧__杯__和__玻__璃__棒__洗__涤__2_~__3_次__,__并__将__洗__涤__液__注__入__容__量__瓶__中_,轻 轻摇动容量瓶,使溶液混合均匀。 (4)定容 ①当液面距瓶颈刻度线_1_~__2__c_m_时改用_胶__头__滴__管__滴加蒸馏水。 ②定容时要平视刻度线,直到_溶__液__凹__液__面__与__刻__度__线__相__切__。
A.三种气体质量相等 B.三种气体的物质的量之比为16∶2∶1
C
C.三种气体压强比为16∶2∶1
D.三种气体体积比为1∶8∶16
8
四、阿伏加德罗定律与理想气体状态方程
高三化学一轮复习《物质的量》课件

新课标人教版2012届高三化学第一轮复习
第1讲 物质的量
13 June 2018
高三化学第一轮复习要求
1、听:认真、积极、专注、勤写。 2、做:及时完成指定作业(30分钟左右) 3、思:反思并解决(有疑必问) 4、纠错:分类纠错(7班朱丽萍) 从头再来,须脚踏实地!能否上本科,
物质的量(n) mol ÷V液
×V液
气体非标准 状况下的体 积(L)
反应热 kJ 万能公式:
物质的量浓度(cB) mol/L
1.物质的量〔n〕 :国际上规定的一个基本物理量。
物理意义:含有一定数目粒子的集体。
单位:摩尔,符号“ mol”,简称“摩”。 1mol任何粒子具有阿伏加德罗常数个微粒 与0.012kg碳-12所含有的碳原子数相同数目的微粒
摩尔体积、气体体积、溶液浓度(质量分数和物质 的量浓度)的关系及计算。
存在的问题:
有关概念模糊 公式没记牢、单位乱用 计算能力有待加强
本专题知识体系:
各反应物和生成物 的物质的量 粒子数(N)
÷NA 质量(m) g ÷M ×M ×NA ×Vm ÷ Vm V(g)L 标准状况 各元素的原子、 离子的物质的量
① 1mol H2O恰好含有6.02×1023个水分子( ×) ② 12g碳所含的原子数就是NA个(× ) ③ 3mol NH3中含有3mol N原子,9mol H原子(√ ) ④ 2.4 g Mg变成Mg2+时失去的电子数目为0.1NA (× )
⑤ 0.5mol Al2(SO4)3溶液中的n(SO42-)是1.5mol(√ )
C、12b/a
D、12a/b
课堂练习
ABEFH
1、 用NA表示阿伏加德罗常数。下列说法正确的是 A. 常温常压下,1mol碳烯(:CH2) 所含的电子数为8NA
第1讲 物质的量
13 June 2018
高三化学第一轮复习要求
1、听:认真、积极、专注、勤写。 2、做:及时完成指定作业(30分钟左右) 3、思:反思并解决(有疑必问) 4、纠错:分类纠错(7班朱丽萍) 从头再来,须脚踏实地!能否上本科,
物质的量(n) mol ÷V液
×V液
气体非标准 状况下的体 积(L)
反应热 kJ 万能公式:
物质的量浓度(cB) mol/L
1.物质的量〔n〕 :国际上规定的一个基本物理量。
物理意义:含有一定数目粒子的集体。
单位:摩尔,符号“ mol”,简称“摩”。 1mol任何粒子具有阿伏加德罗常数个微粒 与0.012kg碳-12所含有的碳原子数相同数目的微粒
摩尔体积、气体体积、溶液浓度(质量分数和物质 的量浓度)的关系及计算。
存在的问题:
有关概念模糊 公式没记牢、单位乱用 计算能力有待加强
本专题知识体系:
各反应物和生成物 的物质的量 粒子数(N)
÷NA 质量(m) g ÷M ×M ×NA ×Vm ÷ Vm V(g)L 标准状况 各元素的原子、 离子的物质的量
① 1mol H2O恰好含有6.02×1023个水分子( ×) ② 12g碳所含的原子数就是NA个(× ) ③ 3mol NH3中含有3mol N原子,9mol H原子(√ ) ④ 2.4 g Mg变成Mg2+时失去的电子数目为0.1NA (× )
⑤ 0.5mol Al2(SO4)3溶液中的n(SO42-)是1.5mol(√ )
C、12b/a
D、12a/b
课堂练习
ABEFH
1、 用NA表示阿伏加德罗常数。下列说法正确的是 A. 常温常压下,1mol碳烯(:CH2) 所含的电子数为8NA
高中化学《物质的量》完整完整PPT课件

例题2 1.5molH2SO4 的质量是多少? 解: 由m=n×M
m n (H2SO4)= (H2SO4)×M(H2SO4)
=1.5mol ×98g/mol =147.0g 答:1.5molH2SO4 的质量是147.0g。
.
例题3 0.01mol某物质的质量为1.08g,
此物质的摩尔质量是多少?
Na2SO4 —————Na+————— SO42- ————— O
1
2
1
4
NA
2NA
NA
4NA
1mol 2mol
1mol
.
4 mol
练习2、计算并填空:
⑴ 3.01×1024个硫酸分子的物质的量为5 mol; ⑵2 mol H2O中含 4 mol H和 2 mol O,
含有 1. 204×1024 个H2O。
质量为 0.85 g
.
练习
2.求下列物质的质量: ⑴1摩碳酸钙100克 ;⑵2molH2 4克 ; ⑶0.5摩硫酸49克 ; ⑷2molCO2 88克 . 3.求下列物质的物质的量:
⑴10g碳酸钙 0.1mol; ⑵1.2g氢气 0.6mo;l
⑶9.8gH2SO4 0.1mol ; ⑷66gCO21.5mol; ⑸含NA个氢原子的水:. 0.5mol .
① NA个微观粒子所形成的微粒集体的质量在几 克 到几百克之间,质量大小适宜,可以称量,便
于换算。
② 有利于借助相对原子质量,确定不同种类粒
子集体 的质量。
.
物质所含微粒数
物质的质量
阿佛加德罗常数 = 阿佛加德罗常数个微的粒质量
= 物质的量(mol)
当物质的量等于1mol时: 物质所含微粒数=阿佛加德常数 物质的质量=阿佛加德罗常数个微粒的质量
2023届高考化学一轮复习 第1讲 物质的分类 物质的量 课件(106张PPT)

等。
(5) 结构式:
、H—O—Cl 等。
(6) 结构简式:CH2===CH2、CH3COOH 等。
(7) 键线式:
等。
(8) 原子、离子结构示意图:Cl:
;Na+:
(9) 电子排布式:基态 24Cr 原子核外电子排布式: 1s22s22p63s23p63d54s1 或[Ar] 3d54s1; 基态 29Cu 原子核外电子排布式: 1s22s22p63s23p63d104s1 或[Ar] 3d104s1。
考点透视
元素化合价
标出下列加点元素的化合价: F·eS2、 NaB·H·4、 Cu·H·、 N·2H4、 LiF·ePO4、 O·C·N·-、 H2C·2O4、 Na2S·2O3、 LiC·oO2 [答案] F+·e2 S2、Na+B·3-H·14、C+u·1-H·1、-N·22H4、LiF+·e2 PO4、-O·2+C·4-N·3-、 H2+C·32O4、Na2+S·22O3、LiC+·3oO2
轨道上的 4 个电子分占 3 个轨道,D 错误。
3. (2021·淮安 5 月模拟)氮氧化铝(AlON)是新型透明高硬度防弹铝材料,属于共价晶 体,主要用于装甲车辆防弹窗户、战场光学设备的透镜、望远镜穹顶以及覆盖于导弹传 感器顶部的透明圆窗等。下列说法不正确的是( C )
A. 基态铝原子的价电子排布式为 3s23p1 B. AlON 和水晶的化学键类型相同 C. 制备 AlON 的原料 NH3 中含非极性键
知识体系
课前思考
问题 1 判断下列说法的正误,并做出合理解释。 (1) 标准状况下,11.2 L CCl4 中含有的分子数为 0.5 mol。 (2) 1 L 0.1 mol/L CH3COOH 溶液中所含 H+的数目为 0.1 mol。 [答案] (1) 错误。标准状况下,CCl4 不是气体。 (2) 错误。CH3COOH 是弱电解质,不能完全电离,H+的数目小于 0.1 mol。 问题 2 配制 100 mL 1.00 mol/L NaCl 溶液,现有量筒、玻璃棒、烧杯, 还需要什么玻璃仪器? [答案] 100 mL 容量瓶和胶头滴管。
高三化学一轮复习物质的量..ppt课件

D.等压等体积的N2和CO2 .
14
高考命题分析:
“设NA表示阿伏加德罗常数,下列说法正确的 是……”,这类题目自1987年开始,成为高考试 题中的必考题。这类题目考查的是学生对阿伏加 德罗常数、物质的量、气体摩尔体积、阿伏加德 罗定律的认识与理解,涉及知识细致而广阔,对 学生思维的严密性是一个很好的考查与判断。
高三化学一轮复习
第三章
物质的量
.
1
一 物质的量
◆考纲要求 1. 了解物质的量的单位——摩尔(mol),摩尔质
量的涵义。 2. 理解阿伏加德罗常数的涵义。 3. 掌握物质的量与微粒(原子、分子、离子
等)数目,气体体积(标准状况下)之间的相 互关系。
.
2
◆教材导读
一.物质的量及其单位
1.概念:物质的量是国际单位制基本物理量之一,它实
子的摩尔质量以g/mol为单位时,在数值上等 于 相对分子质量 。
➢摩尔质量与相对分. 子质量的区别与联系4
二 气体摩尔体积
◆考纲要求 1.了解影响物质体积大小的因素 2.了解气体摩尔体积的涵义 3.掌握有关气体摩尔体积、气体密度、相对密
度的计算
.
5
◆教材导读 一.决定物质体积大小的因素 物质体积大小主要取决于 粒子多少 、 粒子间距、
(A)物质的量
(B)质子总数
(C)分子总数
(D)质量
.
10
高考零距离:
1、(06四川理综)在体积相同的两个密 闭容器中分别充满O2、O3气体,当这两 个容器内温度和气体密度相等时,下列说
法正确的是( D )
A、两种气体的压强相等
B、O2比O3的质量小 C、两种气体的分子数目相等
D、两种气体的氧原子数目相等 下列条件下,两瓶气体
高三化学第一轮复习物质的量ppt课件

(4)注意:
①使用范围: A. 对象:微粒 ② 一物质M为定值与条件、状态、用量都无关 ③与相对分子(原子)质量(Mr)或
1mol物质的质量的关系: 三者数值相等,相对分子质量的单位是1, 摩尔质摩尔质量 如D2O、T2O、18O2
46gNO2与N2O4中含O原子数为NA
32gO2与O3中含O原子数为2NA
32gS2、S4和S6中含S原子数为NA
•M相同(给质量)例题 28g CO与N2 组成的混合气体中原子数
•
为2NA
原子数相同(给物质的量)
标况下22.4LO2 与NO2组成的混合气体中氧原子数为2NA
平均摩尔质量相关计算(无共性)求其比
2、气体摩尔体积
(1)定义: 单位物质的量的气体的体积 (2)符号与单位:
符号:Vm 单位:L·mol-1 或 m3·mol-1 (3)标准状况下的气体摩尔体积:
约 22.4 L·mol-1 (近似值)
① 条件:标准状况:0℃、 1.01×105 Pa
② 对象:纯气体或混合气体
溴、水、酒精、SO3、CCl4、CHCl3、HF、 新戊烷标况下均非气态
4
【2013年高考广东理综化学】9.设nA为
阿佛加德罗常数的数值,下列说法正确
的是
A
(
)
A.常温常压下,8gO2含有4nA个电子
B.1L0.1molL-1的氨水中有nA个NH4+
C.标准状况下,22.4L盐酸含有nA个 HCl分子
D.1molNa被完全氧化生成Na2O2,失 去个2nA电子
【2013高考化学江苏试题】7.设NA 为阿 伏加德罗常数的值。下列说法正确的是 A.1 L 1 mol·L-1的NaClO 溶液中含有C ClO-的数目为NA
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②符号: n 常数个微粒
2.摩 尔:
①含义:物质的量的单位,是国际单位制的 7个基本单位之一
②符号:mol
国际单位制(SI)的7个基本单位
物理量 长度 质量 时间 电流 物质的量 热力学温度 发光强度
单位名称 米 千克 秒 安[培] 摩尔 开[尔文] 坎[德拉]
单位符号 m Kg S A mol K cd
约为
6.02×1023
0.012Kg12C中所含原子数
4、摩尔质量
①定义:单位物质的量的物质所具有的质量叫做摩
尔质量。
符号: M
②单位: g/mol或kg/mol
③数值:以g/mol为单位时,在数值上等于物质或粒 子的式量
注意:与相对原子质量(Ar)或相对分子质量 (Mr)的关系: 两者数值相等,摩尔质量有单 位( g·mol-1 )而相对原子质量或相对分子质量无 单位
÷NA ×NA
物质的量(n) mol
×Vm ÷ Vm
V(g)L 标准状况
÷V液 ×V液
物质的量浓度(cB) mol/L
气体非标准 状况下的体 积(L)
万能公式:
1. 物质的量:
①定义:是一个物理量,表示“含有一定数目
微粒的集体”。(是科学上用来衡量微观粒子 如分子、原子、离子、质子、中子、电子、原 子团的物理量)◆ 1mol任何粒子具有阿伏加德罗
3.阿伏加徳罗常数
①含义:1摩尔任何粒子所含有的粒子数。 (规定:12克12C中所含的碳原子的个数, 约为6.02×1023个。 )
②符号:NA ③单位:mol-1 ④形式:NA≈6.02×1023mol-1 ⑤使用范围:微观粒子
◆物质的量与微粒个数的关系:n=N/NA
阿伏加德罗常数、相对原子质
★★★应注意的问题:
1、物质的量是一个基本物理量,而摩尔是它的单位; 2、物质的量是专有名词,应整体理解,不能理解
为物质的数量和物质的质量; 3、阿伏加德罗常数是个真实值,而6.02×1023仅是NA的
近似值;
4、使用物质的量只适于表示构成物质的微观粒子(如分 子、离子、电子… )以及这些粒子的特定组合,如 1molO2,可以说含有1mol_氧__气__分_子 ,2mol _氧_原_ 子 或 含有 16 mol电子等。
化学基本概念
物质的量
2022/3/22
物质的量
一、概念(n、NA、M、Vm、c )的定义
二、概念计算的基本公式 三、根据所学知识点推导以下公式 四、配制物质的量浓度溶液的方法
及其误差分析
本章知识体系:
各反应物和生成物 的物质的量
÷M 质量(m)
g
×M
反应热 kJ
粒子数(N)
各元素的原子、 离子的物质的量
物质状态:常用在标准状况下非气态的物质来迷惑,如 H2O、SO3、已烷、辛烷、CHCl3等;
n 溶质的物质的量(mol) v 溶液的体积(L)
例:用NA表示阿伏加德罗常,下列说法正确的是 A、1mol氖气含有的原子数为NA B、1mol甲基中含有7NA个电子 C、62克的白磷中含p-p键为3NA D、1molC5H12分子中含有共价键的数目为16NA E、常温常压下n molHD含有的核外电子数为2nNA F、标况下,11.2L SO3中含有的分子数为0.5NA G、标况下,0. 1NAC5H12燃烧生成CO2 11.2L H、1mol/L的FeCl3溶液中含有氯离子数目3NA I、 1L1mol/L的FeCl3溶液中含有铁离子数目NA J、0.1molMg 在空气中燃烧,生成MgO和Mg3N2转移0.2NAeK、amolCl2与足量烧碱完全反应转移的电子数为aNA L、7.8gNa2O2与足量水反应中电子转移了0.2NA M、1molFeCl3完全转化为Fe(OH)3胶体生成NA个胶粒 N、标况下,含4nmolHCl的浓盐酸与足量MnO2共热
及希有气体He、Ne等为单原子组成,Cl2、 电离、水解:N2、O2、H2为双原子分子等;
弱电解质的电离,盐类水解方面的陷阱。
M:
以g/mol为单位时,在数值上等于物质或粒子的式量
公式三 n V Vm
公式四 n CV
状况条件:考查气体时经常给非标准状况如常温常压下 1.01×105Pa、25℃时等;
生成nNA个Cl2
三.阿伏加德罗定律
21..阿阿伏伏加加德德罗罗定定律律推:论_____________P__V______n__R__T______Mm____RT
(1)同温、同压下:
V1 V2
=______=________
(2)同温、同压下:
5. 气体摩尔体积:
①定义: 单位物质的量的气体所占的体积.
②符号: Vm ③单位: L·mol-1
Vm V n
注意:在标准状况下,1mol任何气体所占的体
积都约是22.4L。
理解此概念必须注意四个要点:
①必须是气体物质,不适用固体、液体;
②物质的量为1mol;③必须是标准状况; ④体积约是22.4L。
量的标准均是人为规定的,如果它 们发生了改变,则相对原子质量、 相对分子质量、阿伏加德罗常数、 摩尔质量、气体摩尔体积、物质的 量、物质的量浓度等“主观因素” 均会发生相应变化,而质量、微粒 数、一定质量的气体的体积、气体 的密度、物质的溶解度等“客观因 素”却不会改变。
1mol粒子的粒子数
阿伏加德罗常数
◆教材导读 决定物质体积大小的因素 物质体积大小主要取决于 粒子多少 、 粒子间距 、
粒子本身大小 。构成液态、固态物质的粒子间的距离是很 小的,在粒子数目一定时,固态、液态物质的体积主要决 定于 粒子本身大小 ,由于构成不同物质的粒子本身大小 是 不同的,所以,它们的体积也就有所不同。气体分子间有 __较_大____的距离,各种气体在一定温度和压强下,分子间 的_间__距___几乎是相等的,因此,在一定的温度和压强下, 气体体积的大小只随 分子 的多少而变化。
概念计算的基本公式
物质的 质量(g)
物质所含 微粒数目
标准状况下 (÷22.4L/mol) 物质的 ( ÷V(L) ) 物质的量浓度 气体体积(L)(×22.4L/mol) 量(mol) ( ×V(L) ) (mol/L)
公式一 n N
NA
公式二 n m
M
考查一定物质的量的物质中含有多少微粒 物质结构 (分子、原子、电子、质子、中子等)时常涉
2.摩 尔:
①含义:物质的量的单位,是国际单位制的 7个基本单位之一
②符号:mol
国际单位制(SI)的7个基本单位
物理量 长度 质量 时间 电流 物质的量 热力学温度 发光强度
单位名称 米 千克 秒 安[培] 摩尔 开[尔文] 坎[德拉]
单位符号 m Kg S A mol K cd
约为
6.02×1023
0.012Kg12C中所含原子数
4、摩尔质量
①定义:单位物质的量的物质所具有的质量叫做摩
尔质量。
符号: M
②单位: g/mol或kg/mol
③数值:以g/mol为单位时,在数值上等于物质或粒 子的式量
注意:与相对原子质量(Ar)或相对分子质量 (Mr)的关系: 两者数值相等,摩尔质量有单 位( g·mol-1 )而相对原子质量或相对分子质量无 单位
÷NA ×NA
物质的量(n) mol
×Vm ÷ Vm
V(g)L 标准状况
÷V液 ×V液
物质的量浓度(cB) mol/L
气体非标准 状况下的体 积(L)
万能公式:
1. 物质的量:
①定义:是一个物理量,表示“含有一定数目
微粒的集体”。(是科学上用来衡量微观粒子 如分子、原子、离子、质子、中子、电子、原 子团的物理量)◆ 1mol任何粒子具有阿伏加德罗
3.阿伏加徳罗常数
①含义:1摩尔任何粒子所含有的粒子数。 (规定:12克12C中所含的碳原子的个数, 约为6.02×1023个。 )
②符号:NA ③单位:mol-1 ④形式:NA≈6.02×1023mol-1 ⑤使用范围:微观粒子
◆物质的量与微粒个数的关系:n=N/NA
阿伏加德罗常数、相对原子质
★★★应注意的问题:
1、物质的量是一个基本物理量,而摩尔是它的单位; 2、物质的量是专有名词,应整体理解,不能理解
为物质的数量和物质的质量; 3、阿伏加德罗常数是个真实值,而6.02×1023仅是NA的
近似值;
4、使用物质的量只适于表示构成物质的微观粒子(如分 子、离子、电子… )以及这些粒子的特定组合,如 1molO2,可以说含有1mol_氧__气__分_子 ,2mol _氧_原_ 子 或 含有 16 mol电子等。
化学基本概念
物质的量
2022/3/22
物质的量
一、概念(n、NA、M、Vm、c )的定义
二、概念计算的基本公式 三、根据所学知识点推导以下公式 四、配制物质的量浓度溶液的方法
及其误差分析
本章知识体系:
各反应物和生成物 的物质的量
÷M 质量(m)
g
×M
反应热 kJ
粒子数(N)
各元素的原子、 离子的物质的量
物质状态:常用在标准状况下非气态的物质来迷惑,如 H2O、SO3、已烷、辛烷、CHCl3等;
n 溶质的物质的量(mol) v 溶液的体积(L)
例:用NA表示阿伏加德罗常,下列说法正确的是 A、1mol氖气含有的原子数为NA B、1mol甲基中含有7NA个电子 C、62克的白磷中含p-p键为3NA D、1molC5H12分子中含有共价键的数目为16NA E、常温常压下n molHD含有的核外电子数为2nNA F、标况下,11.2L SO3中含有的分子数为0.5NA G、标况下,0. 1NAC5H12燃烧生成CO2 11.2L H、1mol/L的FeCl3溶液中含有氯离子数目3NA I、 1L1mol/L的FeCl3溶液中含有铁离子数目NA J、0.1molMg 在空气中燃烧,生成MgO和Mg3N2转移0.2NAeK、amolCl2与足量烧碱完全反应转移的电子数为aNA L、7.8gNa2O2与足量水反应中电子转移了0.2NA M、1molFeCl3完全转化为Fe(OH)3胶体生成NA个胶粒 N、标况下,含4nmolHCl的浓盐酸与足量MnO2共热
及希有气体He、Ne等为单原子组成,Cl2、 电离、水解:N2、O2、H2为双原子分子等;
弱电解质的电离,盐类水解方面的陷阱。
M:
以g/mol为单位时,在数值上等于物质或粒子的式量
公式三 n V Vm
公式四 n CV
状况条件:考查气体时经常给非标准状况如常温常压下 1.01×105Pa、25℃时等;
生成nNA个Cl2
三.阿伏加德罗定律
21..阿阿伏伏加加德德罗罗定定律律推:论_____________P__V______n__R__T______Mm____RT
(1)同温、同压下:
V1 V2
=______=________
(2)同温、同压下:
5. 气体摩尔体积:
①定义: 单位物质的量的气体所占的体积.
②符号: Vm ③单位: L·mol-1
Vm V n
注意:在标准状况下,1mol任何气体所占的体
积都约是22.4L。
理解此概念必须注意四个要点:
①必须是气体物质,不适用固体、液体;
②物质的量为1mol;③必须是标准状况; ④体积约是22.4L。
量的标准均是人为规定的,如果它 们发生了改变,则相对原子质量、 相对分子质量、阿伏加德罗常数、 摩尔质量、气体摩尔体积、物质的 量、物质的量浓度等“主观因素” 均会发生相应变化,而质量、微粒 数、一定质量的气体的体积、气体 的密度、物质的溶解度等“客观因 素”却不会改变。
1mol粒子的粒子数
阿伏加德罗常数
◆教材导读 决定物质体积大小的因素 物质体积大小主要取决于 粒子多少 、 粒子间距 、
粒子本身大小 。构成液态、固态物质的粒子间的距离是很 小的,在粒子数目一定时,固态、液态物质的体积主要决 定于 粒子本身大小 ,由于构成不同物质的粒子本身大小 是 不同的,所以,它们的体积也就有所不同。气体分子间有 __较_大____的距离,各种气体在一定温度和压强下,分子间 的_间__距___几乎是相等的,因此,在一定的温度和压强下, 气体体积的大小只随 分子 的多少而变化。
概念计算的基本公式
物质的 质量(g)
物质所含 微粒数目
标准状况下 (÷22.4L/mol) 物质的 ( ÷V(L) ) 物质的量浓度 气体体积(L)(×22.4L/mol) 量(mol) ( ×V(L) ) (mol/L)
公式一 n N
NA
公式二 n m
M
考查一定物质的量的物质中含有多少微粒 物质结构 (分子、原子、电子、质子、中子等)时常涉
