微生物限度标准
洁净服微生物限度标准

洁净服微生物限度标准主要根据国家和地区的法规和条例制定,同时考虑以下因素:空气中的微生物限值:根据洁净区的级别,空气中微生物的限值也有所不同。
例如,一级洁净区的空气中微生物总菌落数限制在每立方米不超过10个。
表面微生物限值:洁净区内的表面微生物菌落数也需要监测,通常要求每平方厘米不超过100个菌落。
微生物检测时,通常按照SOP要求进行培养,根据不同的洁净级别和表面类型,确定取样点和取样量,以及培养基的类型和培养时间。
一般来说,洁净服在清洗后或灭菌后的保存时间应按照规定进行,已确定清洗后或者灭菌后的保存时间。
洁净服微生物限度标准

洁净服微生物限度标准
摘要:
1.洁净室设备表面微生物限度标准
2.人员手部微生物限度标准
3.相关规定及标准来源
正文:
洁净室设备表面微生物限度标准:
洁净室设备表面微生物限度标准是指在洁净室环境中,设备表面允许存在的微生物数量的最高限度。
这一标准旨在确保洁净室设备表面不会对洁净室环境产生污染,从而保证洁净室环境的洁净度。
在洁净室设备表面微生物限度标准中,通常会包括以下几类微生物:细菌、真菌、酵母菌和霉菌。
针对这些微生物,标准会规定它们在设备表面上的最大允许数量。
人员手部微生物限度标准:
人员手部微生物限度标准是指在洁净室环境中,人员手部允许存在的微生物数量的最高限度。
这一标准旨在确保洁净室人员手部不会对洁净室环境产生污染,从而保证洁净室环境的洁净度。
在人员手部微生物限度标准中,通常会包括以下几类微生物:细菌、真菌、酵母菌和霉菌。
针对这些微生物,标准会规定它们在手部皮肤上的最大允许数量。
相关规定及标准来源:
洁净室设备表面微生物限度标准和人员手部微生物限度标准通常由国家和行业的相关机构或组织制定。
在我国,这些标准主要由国家质量监督检验检疫总局(AQSIQ)和国家标准化管理委员会(SAC)制定。
具体而言,洁净室设备表面微生物限度标准主要参照《洁净室设备表面微生物限度》(GB/T 16292-2010)这一国家标准;人员手部微生物限度标准主要参照《洁净室人员手部微生物限度》(GB/T 16293-2010)这一国家标准。
综上所述,洁净室设备表面微生物限度标准和人员手部微生物限度标准是确保洁净室环境洁净度的重要措施。
微生物限度标准

微生物限度标准
微生物是指肉眼无法看见的微小生物体,包括细菌、真菌、病毒等。
在食品、
药品、化妆品等领域,微生物的存在往往会对产品的质量和安全性造成影响,因此对微生物的限度标准成为了一项重要的监管要求。
食品中的微生物限度标准是指在食品中允许存在的微生物数量的上限,它是根
据食品的种类、储存条件、加工工艺等因素而确定的。
微生物限度标准的制定旨在保证食品的卫生安全,防止因微生物污染而引发食品中毒事件。
食品中微生物限度标准的合理设定,可以有效地保护消费者的健康,保障食品的质量安全。
药品中的微生物限度标准则是指药品中允许存在的微生物数量和种类的规定。
药品是直接用于人体的特殊产品,因此对药品中微生物的限度要求更加严格。
合理的微生物限度标准可以有效地保证药品的质量和疗效,避免因微生物污染而引发药品安全事件,保障患者的用药安全。
化妆品中的微生物限度标准是指化妆品中允许存在的微生物数量和种类的规定。
化妆品是直接接触人体皮肤的产品,因此对化妆品中微生物的限度要求也非常严格。
合理的微生物限度标准可以有效地保证化妆品的安全性和稳定性,避免因微生物污染而引发皮肤过敏或感染等问题,保障消费者的健康和安全。
总的来说,微生物限度标准的制定和执行对于食品、药品、化妆品等产品的质
量和安全至关重要。
只有严格执行微生物限度标准,才能有效地保护消费者的健康和权益,保障产品的质量安全。
因此,相关部门和企业应当高度重视微生物限度标准的执行,加强对微生物的监测和控制,确保产品的质量和安全,为消费者提供放心的产品。
微生物限度标准
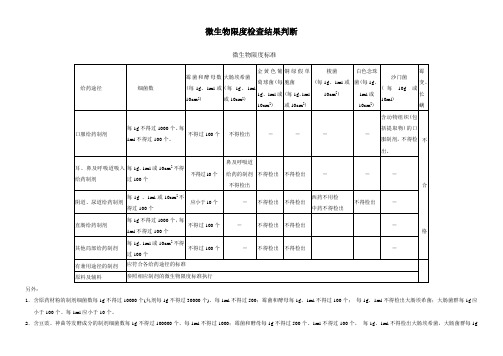
微生物限度检查结果判断
微生物限度标准
另外:
1.含原药材粉的制剂细菌数每1g不得过10000个(丸剂每1g不得过30000个)、每1ml不得过500;霉菌和酵母每1g、1ml不得过100个;每1g、1ml不得检出大肠埃希菌;大肠菌群每1g应小于100个、每1ml应小于10个。
2.含豆豉、神曲等发酵成分的制剂细菌数每1g不得过100000个、每1ml不得过1000;霉菌和酵母每1g不得过500个、1ml不得过100个,每1g、1ml不得检出大肠埃希菌,大肠菌群每1g
应小于100个、每1ml应小于10个。
3.用于表皮或黏膜不完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过1000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
4.用于表皮或黏膜完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过10000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
微生物限度标准

微生物限度标准微生物是一类微小而又广泛存在于自然界中的生物体,它们的存在对人类和动植物的生长、生活和生产活动都有着重要的影响。
然而,微生物也可能是一些疾病的致病因子,因此对微生物的数量和种类进行限制是非常必要的。
微生物限度标准是指在某种物质或产品中所允许存在的微生物数量和种类的标准,它是保证产品质量和安全的重要指标。
微生物限度标准的制定是基于对微生物生长、繁殖和致病能力的了解,同时也考虑了人体对微生物的耐受能力。
不同的产品或物质对微生物的要求也会有所不同,因此针对不同的产品和用途,微生物限度标准也会有所差异。
微生物限度标准的制定需要考虑以下几个方面的因素,首先是产品的特性,比如 pH 值、水分含量、营养成分等,这些因素会影响微生物的生长和繁殖;其次是产品的用途,比如食品、药品、化妆品等,不同的用途对微生物的要求也会有所不同;最后是人体对微生物的耐受能力,一些微生物对人体健康可能会造成危害,因此对这些微生物的限制会更为严格。
在食品行业,微生物限度标准是非常重要的,因为食品是直接与人体健康相关的产品。
食品中微生物的存在可能会导致食品变质、腐败甚至引发食物中毒,因此对食品中微生物的限制是非常严格的。
比如,牛奶和乳制品中的细菌总数、大肠埃希氏菌的数量等都有严格的标准,以保证食品的安全和卫生。
在药品行业,微生物限度标准同样是至关重要的。
药品作为治疗疾病的产品,如果受到微生物的污染,不仅会影响药品的疗效,还可能对人体健康造成危害。
因此,药品中微生物的限度标准也是非常严格的,通常会对细菌、霉菌、酵母菌等微生物进行限制。
除了食品和药品,化妆品、医疗器械、环境水质等领域也都有相应的微生物限度标准。
这些标准的制定和执行,不仅是对产品质量和安全的保障,也是对消费者健康的保护。
总的来说,微生物限度标准是保证产品质量和安全的重要手段,它的制定需要考虑产品特性、用途和人体健康等多方面因素。
各行业都需要严格执行微生物限度标准,以保证产品的质量和安全,同时也保护消费者的健康。
消毒剂微生物限度检测标准

消毒剂微生物限度的检测标准通常遵循相关的国家标准或行业标准。
在中国,消毒剂的微生物限度检测通常遵循《消毒技术规范》(2002年版)或《消毒产品卫生安全评价技术要求》(WS/T 668-2016)等标准。
这些标准规定了消毒剂在特定条件下,如一定时间内、一定浓度下,对微生物(如细菌、真菌、病毒等)的杀灭效果或抑制作用。
检测方法通常包括微生物培养法、荧光法、酶联免疫法等,以确定消毒剂的微生物限度。
具体的检测方法、标准限量、合格判定等要求会根据消毒剂的种类、使用范围和标准的不同而有所差异。
因此,在进行消毒剂微生物限度检测时,需要严格按照相应的标准和方法进行操作,并由具备相应资质和能力的检测机构出具检测报告。
生物制品原液微生物限度标准

生物制品原液微生物限度标准
生物制品原液的微生物限度标准主要依据《中国药典》和《药品生产质量管理规范》进行制定。
以下是具体的标准:
1. 对于非无菌的生物制品,其微生物限度标准通常包括细菌、霉菌和酵母菌总数以及控制菌的检查。
2. 细菌、霉菌和酵母菌总数的标准:对于每1ml生物制品原液,细菌数不
得超过100cfu,霉菌和酵母菌数不得超过100cfu。
同时,对于每1g生物
制品原液,细菌数不得超过1000cfu,霉菌和酵母菌数不得超过1000cfu。
3. 控制菌检查的标准:对于生物制品原液,应按照《中国药典》和《药品生产质量管理规范》的规定进行控制菌检查,如大肠杆菌、金黄色葡萄球菌等。
控制菌检查应为阴性。
4. 对于有特殊用途或规定的生物制品,如用于免疫治疗的制品、基因治疗制品等,其微生物限度标准应根据相关规定进行制定。
此外,在生物制品的生产过程中,应遵循无菌操作规程,采用经过验证的无菌工艺和设备,并进行严格的质量控制,确保产品的安全性和有效性。
微生物限度标准

药品微生物限度标准非无菌药品的微生物限度标准是基于药品的给药途径和对患者健康潜在的危害以及药品的特殊性而制订的。
药品生产、贮存、销售过程中的检验,化学药品原料药、中药提取物及辅料的检验,新药标准制订,进口药品标准复核,考察药品质量及仲裁等,除另有规定外,其微生物限度均以本标准为依据。
非无菌制剂的总需氧菌数、总霉菌及酵母菌数测定照附录×××检查;非无菌制剂的控制菌检查照附录×××检查。
本限度标准解释如下:101CFU:最大可接受限值=20;102CFU:最大可接受限值=200;103CFU:最大可接受限值=2000。
以此类推。
1.制剂通则、品种项下要求无菌的制剂及标示无菌的制剂应符合无菌检查法规定。
2.口服给药制剂2.1 不含药材原粉的口服给药制剂需氧菌总数每1g不得过103cfu。
每1ml不得过102cfu。
霉菌及酵母菌总数每1g不得过102cfu。
每1ml不得过101cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌含脏器提取物的口服给药制剂每10g或10ml不得检出。
2.2含药材原粉的口服制剂2.2.1不含豆豉、神曲等发酵原粉的口服给药制剂需氧菌总数每1g不得过10000cfu。
每1ml不得过100cfu。
霉菌及酵母菌总数每1g或1ml不得过100cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌每10g或10ml不得检出。
耐胆盐革兰阴性菌每1g应小于102个。
每1ml应小于101个。
2.2.2 含豆豉、神曲等发酵原粉的口服制剂需氧菌总数每1g不得过100000cfu。
每1ml不得过1000cfu。
霉菌和酵母菌总数每1g不得过500cfu。
每1ml不得过100cfu。
大肠埃希菌每1g或1ml不得检出。
沙门菌每10g或10ml不得检出。
耐胆盐革兰阴性菌每1g应小于102个。
每1ml应小于101个。
3.局部给药制剂3.1 用于手术、烧伤或严重创伤的局部给药制剂应符合无菌检查法规定。
药典微生物限度标准

药典微生物限度标准
药典微生物限度标准是指药典(如中国药典、美国药典等)规定的药品中允许存在的微生物数量的限制。
微生物限度是为了保证药品的质量和安全所设立的,合理的微生物限度可防止和减少可能在药品生产和贮存过程中引入的微生物污染。
药典微生物限度标准通常需要考虑以下几个方面:
1. 总微生物数:药典规定了应当检测的总微生物数的限制,表示制备过程中可能存在的各种微生物的总数量。
不同类别的药品对总微生物数的限制可能有所不同。
2. 霉菌和酵母菌:霉菌和酵母菌是一类常见的微生物,它们生长迅速,可以在药品中引起变质和腐败。
因此,药典通常规定了对霉菌和酵母菌的数量限制。
3. 大肠菌群:大肠菌群是常见的肠道致病菌,它们存在于环境中,如食品、水源等,可能通过生产过程中的污染进入药品中。
药典通常规定了对大肠菌群的数量限制。
4. 特定致病菌:药典对某些具有危害性的致病菌也可能设置了数量限制,如沙门氏菌、金黄色葡萄球菌等。
药典微生物限度标准的设定是为了确保药品的质量和安全,各国的药典对微生物限度标准可能会有所不同。
生产药品时,企业需要按照药典要求的微生物限度标准进行检测,并确保药品符合规定的标准。
灭菌前微生物限度监控标准

灭菌前微生物限度监控标准
灭菌前微生物限度监控标准是指在进行灭菌操作前,对制备完毕的产品进行微生物限度测试,以确保产品中微生物的数量符合卫生标准和安全规定,从而保证消费者的健康与安全。
具体的标准包括:
1.菌落总数限度:根据不同类型的产品及其应用领域,菌落总数限度也不尽相同。
一般来说,对于药品和食品来说,菌落总数要求极其严格,往往以CFU/g为单位,最大值一般在100-1000之间。
2.厌氧菌限度:防止产生有毒代谢物及恶臭气味。
这个值也根据应用领域不同,其限度也有所不同。
3.酵母和霉菌限度:这个值取决于产品的成分和使用情况,通常以CFU/g为单位。
4.大肠杆菌限度:大肠杆菌是一种肠道菌,它的存在会伴随着可能存在的其他细菌和病毒,因此限度非常严格,一般为未检出。
总之,灭菌前微生物限度监控标准对于保证产品的健康与安全非常重要,需要根据不同的产品应用领域和成分来确定相应的标准,并严格执行。
微生物限度内控样品检测标准

微生物限度内控样品检测标准
微生物限度内控样品检测标准通常包括以下内容:
1.菌落总数:每100ml样品中,菌落总数应控制在一定范围内,以保证样品的卫生质量。
2.大肠菌群:每100ml样品中,大肠菌群不得检出,以防止肠道致病菌的污染。
3.霉菌和酵母菌:每100ml样品中,霉菌和酵母菌的数量也应控制在一定范围内,以避免食品中腐败菌的滋生。
4.其他微生物:根据不同产品的要求,可能还需要对沙门氏菌、志贺氏菌等其他微生物进行检测,以确保产品的安全性。
在检测过程中,需要采用适当的检测方法,如常规法、培养基稀释法、高速离心集菌法等,以保证检测结果的准确性和可靠性。
同时,实验室环境、设备、操作规范等也需要符合相关规定,以确保检测结果的可靠性。
需要注意的是,不同的产品、不同的生产环境、不同的工艺流程都会影响微生物限度内控样品检测标准的具体要求,因此在实际操作中需要根据具体情况制定相应的检测标准。
药典 微生物限度标准

药典微生物限度标准微生物限度是指在药品中允许存在的微生物数量的标准,它是评价药品质量的重要指标之一。
微生物限度标准的制定是为了保证药品的安全性、有效性和稳定性,有效地控制微生物对药品的污染和变质。
微生物限度标准的制定需要考虑药品的性质、用途、生产工艺和储存条件等因素,以确保药品在整个生产和使用过程中都能保持良好的品质。
微生物对药品的污染可能会导致药品的变质和降低药品的有效性,甚至对人体健康造成危害。
因此,制定合理的微生物限度标准对于保障药品质量和人体健康具有重要意义。
微生物限度标准通常包括细菌总数、霉菌和酵母菌的数量限度。
细菌总数是指在一定数量的制剂中存在的细菌总数的限度,它反映了药品的卫生状况和生产过程的卫生控制水平。
霉菌和酵母菌是常见的微生物污染源,它们可能会导致药品的霉变和酵败,因此对其数量也有一定的限制标准。
在药典中,针对不同类型的药品和不同的用途,制定了相应的微生物限度标准。
例如,对于口服固体制剂,其微生物限度标准要求较为严格,因为口服固体制剂在服用过程中会直接进入消化道,对人体的影响较大。
而对于外用制剂,其微生物限度标准相对较宽松,因为外用制剂在使用过程中不会直接进入人体内部,对人体的影响较小。
此外,对于注射剂和眼科制剂等高风险药品,其微生物限度标准要求更为严格,以确保药品的安全性和稳定性。
在生产过程中,严格控制微生物的污染是确保药品质量的关键步骤之一。
生产企业需要建立健全的生产管理体系,包括良好的生产环境、严格的生产操作规程、有效的清洁消毒措施等,以确保药品在生产过程中不受微生物污染。
同时,生产企业还需要建立完善的微生物检测方法和检测体系,对原辅料、中间体和成品进行全面的微生物检测,确保药品符合微生物限度标准的要求。
总之,微生物限度标准是评价药品质量的重要指标之一,对于保障药品质量和人体健康具有重要意义。
生产企业应严格遵守药典中制定的微生物限度标准,建立健全的生产管理体系,确保药品在生产和使用过程中符合微生物限度标准的要求,为人体健康提供保障。
微生物限度标准cfu

微生物限度标准CFU
CFU是“Colony Forming Unit”的缩写,是一种用于评估微生物菌落数量的单位。
它是指一种微生物或一群微生物在培养基上形成的可见菌落。
CFU通常用于细菌和酵母菌等微生物的计数和定量。
微生物限度标准是指在某种产品或样品中允许存在的微生物菌落数量的上限。
这个限度标准通常根据产品的种类和用途来确定,以确保产品的质量和安全性。
微生物限度标准通常以CFU为单位进行计数,指定了特定微生物在样品中允许的最大菌落数量。
对于不同的微生物,其限度标准可能有所不同。
例如,在食品行业中,对于某些致病菌如大肠杆菌和沙门氏菌,微生物限度标准常常规定为零,即不允许检测到菌落。
而对于其他非致病菌如酵母菌和霉菌,微生物限度标准可以根据产品的特性和安全性要求进行具体的指定。
微生物限度标准的制定和执行有助于确保产品的卫生质量和安全性,避免潜在的微生物传播和感染风险。
四国药典有关药品微生物限度标准的比较

四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。
各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。
药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。
一、CP、USP、BP、JP的微生物限度要求的特点及其发展趋势⒈各国药典收载微生物限度检查法的时间不同(见表1)表1 各国药典收载微生物限度检查法的时间各国药典CP USP BP JP收载微生物限度检查法的时间1995版* 1975(19)1973---方法1988---品种**第十三改正版****1978年颁布第一个药品卫生标准;1986年颁布了修改的药品卫生标准;1989年下发药品卫生标准补充规定和说明,1995年版中国药典收载微生物限度检查法(标准仅为少数剂型)**品种98版43个,其中原料药品种38个,制剂品种仅5个。
***仅有6个品种。
⒉品种不断扩大USP版本19(1975)22(1990)23 24(2000)*217种包括原料药品种72个(占1/3);制剂品种(占2/3)。
⒊活菌数要求各有特点⒋控制菌的要求各有特点a 10g或10ml样品不得检出。
b 1g或1ml 样品不得检出。
c 仅为个别品种要求10~103/1g或1ml。
*d 不列在剂型项内而以说明提出,意即不作为常规检查,如有检出,以不合格处理的依据。
二、稀释剂的种类* pH7.0缓冲氯化钠-蛋白胨水:磷酸二氢钾3.56g,磷酸氢二钠4.30g,蛋白胨(肉胨或酪胨1.0g纯水1000ml/L。
溶解以上成份,加入1~10g 吐温-20或吐温-80。
121℃高压蒸汽灭菌30min。
作用:可调节供试液pH至近中性,其中蛋白胨对菌细胞有保护作用,有利于菌数及控制菌的测定。
吐温加入对含油性供试品的助溶具有作用。
** USP、BP微生物限度(污染)检查用稀释剂,除磷酸盐缓冲液、磷酸盐缓冲胨水外,尚采用以上两种培养基,直接稀释供试品并作增菌培养.。
微生物限度标准

• 大肠埃希菌 不得检出/ 1g或1ml 。
• 大肠菌群 • 细菌数 <100个/ 1g 。 <10个/ 1ml。 ≤100000个/ 1g; ≤1000个/ 1ml 。 ≤100个/ 1ml 。 不得检出/ 1g或1ml 。 含豆豉、神曲等发酵成分的制剂 • 霉菌和酵母菌数 ≤500个/ 1g ; • 大肠埃希菌 • 大肠菌群
原则性要求:丸剂、口服片剂、胶囊剂、颗粒剂。
2015-4-13 17
新增的无菌检查化学药品制剂
鼻用制剂:用于手术或创伤的鼻用制剂 .
凝胶剂:用于严重创伤的凝胶剂 . 乳膏剂:用于烧伤或严重创伤的乳膏剂 .
2015-4-13
18
2005版中药制剂通则项下的微生物限度要求
无菌检查:注射剂。
无菌检查及微生物限度检查:散剂*、软膏剂*、眼用 制剂*、鼻用制剂*、气雾剂*、喷雾剂*。 微生物限度检查:丸剂、颗粒剂、片剂、锭剂、煎膏 剂、胶剂、糖浆剂、合剂、滴丸剂、胶囊剂、酒剂、 酊剂、流浸膏剂、浸膏剂、露剂、茶剂、栓剂、贴膏 剂(贴剂)*、凝胶剂*、搽剂*、洗剂*、涂膜剂*. 不要求:膏药。
<100个/ 1g 。 <10个/ 1ml。
2015-4-13
7
大肠菌群
大肠菌群是指在37℃生长时能发酵乳糖,24h内产酸产气的一类 革兰阴性无芽孢杆菌。除大肠埃希菌属外,它还包括肠杆菌科的 肠杆菌属、枸橼酸菌属、克雷伯菌属,基本上包括了正常人畜肠 道内的全部需氧的革兰阴性杆菌,较大肠埃希菌更具代表性,且 存活时间较长,也较容易检出。故检出大肠埃希菌,一般认为 药品受粪便的近期污染;而检出大肠菌群,则表示药品受粪便 的近期或远期污染。以大肠菌群作为口服药品微生物限度标准 的控制菌,具有广泛的卫生学意义,更能反映药品的卫生质 量。国际上以大肠菌群作为药品、食品、饮水等的卫生指示 菌之一。
欧洲药典微生物限度标准

欧洲药典对微生物限度的标准通常包括以下几项:
1.细菌总数:每克或每毫升药品中含有的细菌总数不得超过10000个。
2.霉菌和酵母菌总数:每克或每毫升药品中含有的霉菌和酵母菌总数不得超过100个。
3.革兰阴性杆菌:每克或每毫升药品中不得检出革兰阴性杆菌。
4.沙门氏菌:每克或每毫升药品中不得检出沙门氏菌。
5.志贺氏菌:每克或每毫升药品中不得检出志贺氏菌。
6.金黄色葡萄球菌:每克或每毫升药品中不得检出金黄色葡萄球菌。
7.支原体和衣原体:每克或每毫升药品中不得检出支原体和衣原体。
8.病毒:每毫升药品中不得检出病毒。
这些标准旨在确保药品的安全性和有效性,防止因微生物污染而对使用者造成危害。
请注意,具体的微生物限度标准可能因不同的药品和用途而有所不同。
在实际操作中,应严格按照相关法规和标准进行药品的微生物限度检查。
超纯水微生物标准

超纯水微生物标准
超纯水微生物限度的标准限值为每升不超过10 CFU(菌落形成单位)。
一、什么是超纯水微生物限度
超纯水(Ultra-pure Water,UPW)是指经过特殊处理后,去除了多种离子、杂质和微生物的水。
在工业生产和实验室研究中,需要使用到极为纯净的水,以避免微生物的干扰和影响。
因此,超纯水微生物限度是指超纯水中允许存在的微生物数量的限制。
二、超纯水微生物限度测试方法
超纯水微生物限度的测试方法是通过采样,将水样放在适当的培养基上进行培养,然后观察菌落形成情况并进行计数。
常用的测试方法包括膜过滤法、直接计数法等。
在测试过程中,需要注意无菌操作,以避免外源微生物的干扰。
三、超纯水微生物限度标准限值
根据国家药品监督管理局发布的《纯化水制药用水质标准》,超纯水微生物限度的标准限值为每升不超过10 CFU。
此外,不同的行业和应用领域也可能会有不同的限制标准。
四、超纯水微生物限度的应用领域
超纯水微生物限度的应用领域主要涉及到制药、食品、化妆品、电子等行业。
在制药行业中,超纯水被广泛应用于药品制造的各个环节,如药品溶液的配制、注射液的生产等。
在电子行业中,超纯水被用作半导体、光学元件等精密器件的清洗和加工工艺中。
药包材微生物公式稿对比

药包材微生物公式稿对比
以下是对药包材微生物限度公式稿的对比分析:
在药包材微生物限度公式稿中,通常会涉及一系列的公式和标准,这些标准和公式都是用来评估药包材的微生物污染程度是否符合规定,以保证药品在使用过程中的安全性和有效性。
以下是对两个不同的药包材微生物限度公式稿进行比较和分析。
标准一:药包材微生物限度一般标准
菌落总数:每平方厘米药包材表面的菌落数应不超过10个。
大肠菌群:不得检出。
霉菌和酵母菌:每平方厘米药包材表面的霉菌和酵母菌数应不超过10个。
金黄色葡萄球菌:不得检出。
铜绿假单胞菌:不得检出。
标准二:更为严格的药包材微生物限度标准
菌落总数:每平方厘米药包材表面的菌落数应不超过5个。
大肠菌群:不得检出。
霉菌和酵母菌:每平方厘米药包材表面的霉菌和酵母菌数应不超过5个。
金黄色葡萄球菌:不得检出。
铜绿假单胞菌:不得检出。
对比分析:从上述两个标准中可以看出,标准二相对于标准一更为严格。
在菌落总数和霉菌、酵母菌数的限制上,标准二每平方厘米药包材表面的微生物数要比标准一少一半。
这意味着标准二对于药包材的清洁度和无菌程度要求更高,更能保证药品在使用过程中的安全性和有效性。
然而,这也增加了药包材生产和处理的难度和成本。
在实际应用中,企业可以根据自身产品的特性和质量要求选择合适的药包材微生物限度标准。
对于一些对清洁度和无菌度要求较高的药品,可以选择更为严格的微生物限度标准,以更好地保障患者的用药安全。
而对于一些对清洁度和无菌度要求较低的药品,可以选择较为宽松的微生物限度标准,以降低生产成本。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微生物限度检查结果判断
微生物限度标准
另外:
1.含原药材粉的制剂细菌数每1g不得过10000个(丸剂每1g不得过30000个)、每1ml不得过500;霉菌和酵母每1g、1ml不得过100个;每1g、1ml不得检出大肠埃希菌;大肠菌群每1g应小于100个、每1ml应小于10个。
2.含豆豉、神曲等发酵成分的制剂细菌数每1g不得过100000个、每1ml不得过1000;霉菌和酵母每1g不得过500个、1ml不得过100个,每1g、1ml不得检出大肠埃希菌,大肠菌群每1g
应小于100个、每1ml应小于10个。
3.用于表皮或黏膜不完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过1000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
4.用于表皮或黏膜完整的含原药粉的局部给药制剂:细菌数每1g或10cm2不得过10000个、每1ml不得过100个;霉菌和酵母每1g、1ml或10cm2不得过100个;每1g、1ml不得检出金黄色葡萄球菌、铜绿假单孢菌。
