最小抑菌浓度测定
mic测定方法

mic测定方法嘿,咱今儿就来聊聊 MIC 测定方法。
MIC 呢,就是最小抑菌浓度啦,这可是个很重要的东西呢!想象一下,就好像我们要去寻找一个刚刚好的平衡点,能把那些捣乱的细菌给镇住,但又不会太过火。
那怎么找这个点呢?这就需要一些特别的办法啦。
比如说肉汤稀释法,这就像是一场精细的调试过程。
把药液一点点地稀释,就像调鸡尾酒似的,然后把细菌放进去,看看在哪个浓度下,细菌就乖乖地不闹事了。
这就好比是给细菌设了个关卡,浓度低了,它们大摇大摆;浓度高了,又有点浪费。
得找到那个刚刚好能把它们拦住的浓度,那就是 MIC 啦。
还有琼脂稀释法,这就像是给细菌铺了个特别的“地毯”。
把含有不同浓度药液的琼脂准备好,然后让细菌在上面溜达。
它们能好好呆住的那个最低浓度,就是我们要找的 MIC 呀。
这些方法就像是我们手里的秘密武器,专门用来对付那些看不见的小捣蛋鬼。
你说,要是没有这些方法,我们怎么知道该用多少药才能把细菌打败呢?要是药量用少了,细菌没被制住,那不就麻烦啦;要是药量用多了,对身体也不好呀。
MIC 测定方法可不简单哦,得非常细心、非常认真才行。
就像一个大厨在调味,多一点少一点都会影响味道。
这需要专业的知识和经验,可不是随便谁都能做好的。
咱再想想,如果医生不知道 MIC,那开药不就像瞎蒙一样?那可不行!病人把自己的健康交到医生手里,医生就得靠这些准确的测定方法来给出最合适的治疗方案呀。
MIC 测定方法就像是黑暗中的一盏明灯,为我们指引着方向。
它让我们知道该怎么和细菌作战,怎么用最小的力气取得最大的胜利。
所以啊,MIC 测定方法真的超级重要!可不能小瞧它哦!它是医学领域里的一个宝贝,为我们的健康保驾护航呢!你说是不是呀?。
几种MIC的测定方法

几种测定抗菌药物最低抑菌浓度(MIC)的方法1浊度法1.1常量肉汤稀释法(试管)1.1.1.抗菌药物贮存液制备将抗菌肽稀释到无菌水中,制成1024μg/ml的原液,(也可以用0.22um滤膜进行过滤,但要去掉前面5 ml的过滤抗菌肽溶液)。
抗菌药物贮存液浓度按照不同梯度稀释。
1.1.2.药敏试验用抗菌药物浓度范围根据抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基推荐使用LB肉汤培养基,pH7.0~7.4。
指示菌为大肠杆菌或沙门氏菌。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的LB肉汤中,35℃孵育2-6 h。
增菌后的对数生长期菌液用生理盐水或LB肉汤培养基校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,推荐直接取培养18~24 h的菌落调配成0.5麦氏比浊标准的菌悬液。
用LB肉汤将上述菌悬液进行1∶100稀释后备用。
注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
1.1.5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入1.6ml LB肉汤外,其余每管加入LB肉汤1ml,在第1管加入抗菌药物原液(如1024μg/ml)0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。
此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml。
然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5×105CFU/ml。
第1管至第11管药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125μg/ml。
抗菌药物最小抑菌浓度的测定
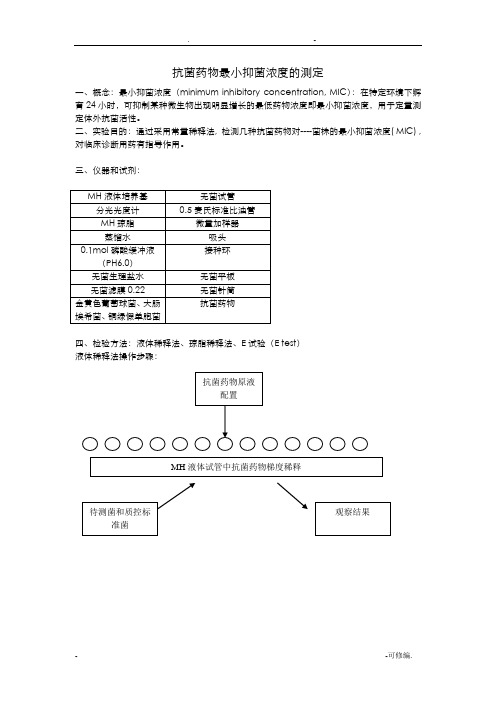
抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度X围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度X 围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
最低抑菌浓度测定方法

2.1.8 抗(抑)菌试验2.1.8.1 目的测定抗(抑)菌产品对细菌和真菌的抗(抑)菌作用。
常使用的方法有抑菌环试验、最小抑制浓度测定试验、滞留抑菌效果测定试验、洗衣粉抗菌效果测定试验、振荡烧瓶试验、浸渍试验与奎因试验,可视情况选用。
2.1.8.2 抑菌环试验2.1.8.2.1 原理利用抑菌剂不断溶解经琼脂扩散形成不同浓度梯度,以显示其抑菌作用。
试验通过抑菌环大小以判断其是否具有抑菌能力。
本试验适用于抑菌剂与溶出性抗(抑)菌产品的鉴定。
2.1.8.2.2 试验器材(1)金黄色葡萄球菌(ATCC 6538)、大肠杆菌(8099)、白色念珠菌(A TCC 10231) 菌悬液(见2.1.1.2)及根据抑菌剂特定用途所用的其他菌悬液。
(2)抑菌剂载体(5 mm 直径园形新华一号定性滤纸片,经压力蒸汽灭菌处理后,置120℃烤干2h,保存备用)。
(3)活菌培养计数所需器材(见2.1.1.3)。
(4)微量移液器(5μl~50μl,可调式)。
(5)游标卡尺。
(6)营养琼脂培养基、胰蛋白胨大豆琼脂培养基与沙堡琼脂培养基2.1.8.2.3 操作程序(1)抑菌片的制备:对液体抑菌剂,取无菌并干燥的滤纸片。
每片滴加实际使用浓度抑菌剂溶液20μl,然后将滤纸片平放于清洁的无菌平皿内,开盖置温箱(37℃) 中烤干,或置室温下自然干燥后备用。
溶出性抗(抑)菌产品,可直接制成直径为5mm,厚不超过4mm圆片(块),每4 片(块) 一组。
(2)阴性对照样片的制备:取无菌干燥滤纸片,每片滴加无菌蒸馏水20μl,干燥后备用。
溶出性抗(抑)菌产品的阴性对照样本,应取同种材质不含抑菌成份的样品,制成与试验组大小相同的样片(块)。
(3)试验菌的接种:用无菌棉拭子蘸取浓度为5×105cfu/ml~5×106cfu/ml 试验菌悬液,在营养琼脂培养基平板表面均匀涂抹3次。
每涂抹1次,平板应转动60°,最后将棉拭子绕平板边缘涂抹一周。
最小抑菌浓度的测定

几种测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基 NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
最低抑菌浓度(MIC)测定

word附件3.4最低抑菌浓度(MIC)测定1.菌悬液的制备刮取18~20小时的培养物,在管壁上充分研磨后混悬于1ml缓冲液中,借助比浊仪,调菌悬液浓度至104/ml,于1小时用多点接种仪接种(放置室温应大于25℃)。
2.MIC测定(1)抗菌药物储存液制备⏹抗菌药物称量及配制:根据各抗菌药物的纯度称取,以目前所用抗菌药物为例。
抗菌素纯度称量(mg)加溶剂(ml)储存液浓度(μg/ml)四环素100% 3.2 1 3200大观霉素63.4% 40.38 1 25600头孢曲松81.5% 2.45 1 2000环丙沙星84.4 3.8 1 3200⏹分装与保存:每管200μl,-70℃可保存一年。
(2)抗菌药物工作液制备青霉素:四环素:大观霉素:头孢曲松:环丙沙星:(3)抗菌药物梯度培养皿的制备⏹培养皿编号:按各抗菌药物浓度编号。
⏹将配制好的各抗菌药物工作液150μl加到各培养皿中,与15ml 50℃预温的培养基充分混匀,平放在超净台,半开培养皿盖至培养基凝固后,用塑料袋密封保存于4℃冰箱。
(4)菌悬液接种与培养⏹多头接种针以及菌液板用高压法灭菌处理,其他配件用酒精消毒处理;使用前必须确认完全烘干。
⏹按照仪器要求将菌悬液接种于各抗菌药物梯度培养皿,接种菌后置超净台直至菌悬液渗入。
⏹置35℃~36℃、5%~10% CO2一定湿度的环境中培养。
⏹记录放置时间。
⏹培养18~24小时观察结果。
(5)结果判读⏹观察细菌生长情况:-记录结果读取时间。
-在适宜的光线下,观察对照培养皿的菌落生长情况,并对所有菌株进行初步鉴定(涂片染色和氧化酶试验)。
-比较观察对照平皿和抗菌药物平皿,进行判读:接种点有1个以上菌落或呈菌苔状为生长;接种点无任何菌落或呈薄雾印迹为无生长。
⏹MIC判读与记录:-MIC是指抗菌药物能够抑制细菌生长的最小抑菌药物浓度,表示单位为 g/ml 。
-记录各抗菌药物浓度平皿上细菌生长情况,在《WHO参考菌株及MIC 实验结果记录表》用(+)表示生长,(-)表示无生长。
几种测定抗菌药物最低抑菌浓度(MIC)方法

几种测定抗菌药物最低抑菌浓度(MIC)方法近年来,随着抗生素的广泛使用以及细菌耐药性的增加,抗菌药物的最低抑菌浓度(MIC)的测定变得日益重要。
MIC是指抗菌药物能够抑制细菌生长的最低浓度,是评估抗菌药物对细菌耐药性的一种重要方法。
下面介绍几种测定抗菌药物MIC的方法。
1. 琼脂扩散法琼脂扩散法是一种经典的MIC测定方法。
该方法基于抗生素与菌株相互作用抑制菌株生长的原理。
实验中将不同浓度的抗生素溶液加入琼脂平板中,并在琼脂表面均匀涂布细菌悬液。
待菌株在琼脂表面生长形成克隆后,观察克隆周围清晰的无菌区域大小,根据无菌区域所对应的抗生素浓度计算MIC值。
该方法简单易行,但由于该方法目测判断,因此存在主观性差异和读片误差的问题。
2. 荧光素二磷酸盐3-(4,5-二苯基噻唑)(Alamar blue)法荧光素二磷酸盐3-(4,5-二苯基噻唑)法是一种高通量及准确性较高的MIC测定方法。
该方法基于菌株呼吸代谢消耗的荧光素二磷酸盐3-(4,5-二苯基噻唑)的发光信号变化来评估抗生素的MIC值。
实验中将不同浓度的抗生素溶液加入微孔板中,并添加细菌悬液及荧光素二磷酸盐3-(4,5-二苯基噻唑),经过一定时间后读取板上的荧光信号,测算MIC 值。
该方法准确性高,可用于筛选大量样本的抗菌药物敏感性,但需要特殊设备和耗费较多经费。
3. 壳聚糖纳米粒子微滴法壳聚糖纳米粒子微滴法是一种新兴的MIC测定方法。
该方法基于壳聚糖纳米粒子本身具有抑菌作用及微滴原理,实验中将不同浓度的抗生素与含菌液的溶液制成微滴,并添加壳聚糖纳米粒子,待微滴凝胶后进行观察,根据微滴内的细菌生长情况评估折射率值,进而计算MIC值。
这种方法具有较高的准确性和可靠性,但需要特殊仪器和技术支持。
4. 测序MIC法随着测序技术的发展,现已出现测序MIC法。
该方法基于高通量测序技术,对菌株进行全基因组测序,确定细菌株中抗生素耐药基因的编码序列,并进行序列比对和分析,确定抗生素的MIC值。
几种MIC的测定方法

几种测定抗菌药物最低抑菌浓度(MIC)的方法1浊度法1.1常量肉汤稀释法(试管)1.1.1.抗菌药物贮存液制备将抗菌肽稀释到无菌水中,制成1024μg/ml的原液,(也可以用0.22um滤膜进行过滤,但要去掉前面5 ml的过滤抗菌肽溶液)。
抗菌药物贮存液浓度按照不同梯度稀释。
1.1.2.药敏试验用抗菌药物浓度范围根据抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基推荐使用LB肉汤培养基,pH7.0~7.4。
指示菌为大肠杆菌或沙门氏菌。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的LB肉汤中,35℃孵育2-6 h。
增菌后的对数生长期菌液用生理盐水或LB肉汤培养基校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,推荐直接取培养18~24 h的菌落调配成0.5麦氏比浊标准的菌悬液。
用LB 肉汤将上述菌悬液进行1∶100稀释后备用。
注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
1.1.5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入1.6ml LB肉汤外,其余每管加入LB肉汤1ml,在第1管加入抗菌药物原液(如1024μg/ml) 0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。
此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml。
然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5×105CFU/ml。
第1管至第11管药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125μg/ml。
抗菌药物最小抑菌浓度的测定

抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵冇24 小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于泄量测立体外抗菌活性。
二、实验目的:通过采用常量稀释法,检测几种抗菌药物对--菌株的最小抑菌浓度(MIC), 对临床诊断用药有指导作用。
MH液体培养基无菌试管分光光度计0.5麦氏标准比浊管MH琼脂微量加样器蒸饰水吸头接种环0.1 mol磷酸缓冲液(PH6.0)无菌生理盐水无菌平板无菌滤膜0.22无菌针筒抗菌药物金黄色匍萄球菌、大肠埃希菌、铜绿假单胞菌四、检验方法:液体稀释法、琼脂稀释法、E试验(Etcst)液体稀释法操作步骤:抗菌药物原液配置0000000000000MH液体试管中抗菌药物梯度稀释观察结果1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000ug/ml(如1280ug/ml)或10倍于最高测左浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280ug/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750ixg/mgo用分析天平精确称取抗生素粉剂的量为182.6 mg.根据公式讣算所需稀释剂用量为:(182.6 mgX75O u g/ml)/1280 ug/ml= 107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20°C环境,并注意抗菌药物的保存期限。
表1稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范带|根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范国应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton (MH)肉汤,pH7.2~7.4。
最低抑菌浓度测定方法

2.1.8 抗(抑)菌试验2.1.8.1 目的测定抗(抑)菌产品对细菌和真菌的抗(抑)菌作用。
常使用的方法有抑菌环试验、最小抑制浓度测定试验、滞留抑菌效果测定试验、洗衣粉抗菌效果测定试验、振荡烧瓶试验、浸渍试验与奎因试验,可视情况选用。
2.1.8.2 抑菌环试验2.1.8.2.1 原理利用抑菌剂不断溶解经琼脂扩散形成不同浓度梯度,以显示其抑菌作用。
试验通过抑菌环大小以判断其是否具有抑菌能力。
本试验适用于抑菌剂与溶出性抗(抑)菌产品的鉴定。
2.1.8.2.2 试验器材(1)金黄色葡萄球菌(ATCC 6538)、大肠杆菌(8099)、白色念珠菌(A TCC 10231) 菌悬液(见2.1.1.2)及根据抑菌剂特定用途所用的其他菌悬液。
(2)抑菌剂载体(5 mm 直径园形新华一号定性滤纸片,经压力蒸汽灭菌处理后,置120℃烤干2h,保存备用)。
(3)活菌培养计数所需器材(见2.1.1.3)。
(4)微量移液器(5μl~50μl,可调式)。
(5)游标卡尺。
(6)营养琼脂培养基、胰蛋白胨大豆琼脂培养基与沙堡琼脂培养基2.1.8.2.3 操作程序(1)抑菌片的制备:对液体抑菌剂,取无菌并干燥的滤纸片。
每片滴加实际使用浓度抑菌剂溶液20μl,然后将滤纸片平放于清洁的无菌平皿内,开盖置温箱(37℃) 中烤干,或置室温下自然干燥后备用。
溶出性抗(抑)菌产品,可直接制成直径为5mm,厚不超过4mm圆片(块),每4 片(块) 一组。
(2)阴性对照样片的制备:取无菌干燥滤纸片,每片滴加无菌蒸馏水20μl,干燥后备用。
溶出性抗(抑)菌产品的阴性对照样本,应取同种材质不含抑菌成份的样品,制成与试验组大小相同的样片(块)。
(3)试验菌的接种:用无菌棉拭子蘸取浓度为5×105cfu/ml~5×106cfu/ml 试验菌悬液,在营养琼脂培养基平板表面均匀涂抹3次。
每涂抹1次,平板应转动60°,最后将棉拭子绕平板边缘涂抹一周。
抗菌中药mic测定的原理

抗菌中药mic测定的原理
抗菌中药MIC(最低抑菌浓度)测定的原理是通过确定抗菌药物对细菌生长的最低有效浓度来评估其抗菌活性。
MIC测定的常用方法是微量肉汤稀释法。
基本步骤如下:
1. 准备肉汤培养基:将饱和的肉汤培养基稀释到指定浓度,使得培养基中的营养物质和菌落形成所需的物质浓度适中。
2. 准备菌悬液:将待测的细菌菌株培养至对数生长期,然后用无菌生理盐水稀释,使得菌悬液中的细菌浓度适中。
3. 稀释药物:将待测的抗菌药物按一系列浓度进行稀释,通常以二倍递减的方式进行。
4. 配制试验管:将肉汤培养基和菌悬液按一定比例混合并置于试验管中,然后加入不同浓度的抗菌药物稀释液。
5. 孵育:将试验管放入恒温培养箱中,在适当的温度下孵育一定时间,促进细菌生长。
6. 判定MIC:观察试验管的结果,确定最低浓度的抗菌药物能够抑制细菌生长
的最小浓度即为MIC。
通过测定不同抗菌药物的MIC,可以对比不同药物的抑菌能力,评价抗菌药物的抗菌活性,并且可以提供合适的药物浓度来指导临床应用。
测定抗菌药物最低抑菌浓度方法

测定抗菌药物最低抑菌浓度方法抗菌药物最低抑菌浓度是一种测定药物对细菌的抑制能力的方法。
药物的最低抑菌浓度是指能够完全抑制细菌生长的最低药物浓度。
测定抗菌药物的最低抑菌浓度可以帮助医生选择最合适的药物治疗感染疾病,也可以用于判断细菌的耐药性。
下面将介绍一种常用的测定抗菌药物最低抑菌浓度的方法,稀释法。
稀释法是一种常见的测定抗菌药物最低抑菌浓度的方法。
其基本原理是通过将抗菌药物稀释成不同浓度,然后与已知浓度的细菌悬液共同培养,看最低浓度能够抑制细菌生长。
下面是稀释法的具体步骤:1.准备培养基:首先准备含有富集营养物的培养基,如米勒杆菌培养基。
将培养基制备成液体状态。
2.制备细菌悬液:选择已知浓度的细菌悬液,将其制备成适量悬液,浓度一般为约10^5CFU/mL。
3.准备药物浓度梯度:将抗菌药物按需要的浓度逐级稀释,通常是2倍递减。
最低浓度一般从药物的临床最低浓度开始。
4.混合药物和细菌悬液:将各浓度的药物与相同体积的细菌悬液混合,使其浓度达到希望的对数倍稀释。
5.接种培养:将混合液均匀地接种在含有富集营养物的培养基平板上,通常每个平板接种3个不同药物浓度的液滴。
6.培养:将接种的平板放入恒温培养箱中,通常在37℃温度下培养24小时。
7.观察结果:观察不同浓度液滴周围的菌落生长情况,可以看到浓度最低的液滴周围没有菌落生长,即为该抗菌药物的最低抑菌浓度。
稀释法测定抗菌药物的最低抑菌浓度具有简单、经济、易于操作等优点,被广泛应用于临床和科研实验室中。
然而,它也存在一些限制。
首先,该方法只能测定药物对细菌的直接抑制作用,不能反映体内药物对细菌的作用情况。
其次,稀释法只能测定其中一时间点的抗菌活性,不能直接反应细菌对药物的耐药性发展情况。
此外,不同细菌对药物的敏感性存在差异,因此测定结果应结合临床经验和文献数据进行解读和分析。
总之,测定抗菌药物最低抑菌浓度是一项重要的实验研究和临床实践中的方法。
通过稀释法可以有效评估药物对细菌的抑制能力,有助于选择适宜的药物治疗感染疾病,并且能够为研究细菌耐药性提供信息。
最小抑菌浓度

细菌含量测定
(1)用生理盐水将上述菌液做10倍梯度稀释(0.5ml菌液+4.5ml生理盐水)。
(2)取10-5、10-6、10-7三个滴度的菌液各0.1ml滴在琼脂平板中央,轻轻拍打,使其均匀摊开,不要接 触平皿边缘,每个梯度做2个平板,放入37℃温箱培养16~24h。
(3)计算菌落数:挑选长有30~300个菌落的平板来计数。两个平板的计数结果取其平均值为细菌浓度, 要求生长浊度达9×108个/ml。计算示例:10-6两个平板上生长菌落数分别为68、70个,平均69个/0.1ml,则 1ml含活菌落数690×106个/ml,即生长浊度为6.9×108个/ml。
最小抑菌浓度
用试管稀释法测定细菌对药物的敏感性
目录
01 浓度测定
02 两种菌介绍
基本信息
最小抑菌浓度(minimal inhibit concentration)指用试管稀释法测定细菌对药物的敏感性。完全抑制细 菌生长的最高稀释管1毫升所含的药量。亦即被测细菌对该药的敏感度。因药物和细菌的种类不同,需具体规定药 物的稀释范围使用培养基的种类、加菌量,培养条件和判定结果的时间。
方法与步骤
1、实验前的准备 (1)器具的清洗:将试管、平皿、锥形瓶、枪头等实验器具洗净、包好,121℃、20min高压灭菌,放烘箱 烘干备用。 96孔细胞培养板(不可高压灭菌)用洗液浸泡、超声、冲洗干净后,泡75%酒精备用(用前取出放超净台吹 干,紫外杀菌2h以上)。 (2)试剂的配制: 图1①磷酸缓冲液(PBS)的配制:见图1。 ②生理盐水的配制:称取0.9g NaCI于锥形瓶中,加入100ml蒸馏水,溶解。 ③MH琼脂、肉汤的配制:按照实际说明书的要求,称取一定量LB琼脂于锥形瓶中,加入100ml蒸馏水,溶解。 按照试剂说明书的要求,称取一定量MH肉汤粉于锥形瓶中,加入100ml蒸馏水,溶解。取琼脂和肉汤分装于小试 管中,每管2ml。 将配好的琼脂、肉汤包装好,121℃、20min高压灭菌。待琼脂稍冷后,在超净台倒平板(15~20ml琼脂平 板),凝固后置37℃恒温培养箱过夜做无菌检查,合格后和肉汤一起置于4℃冰箱保存备用。
最小抑菌浓度测定方法

最小抑菌浓度测定方法
嘿,咱今天来聊聊最小抑菌浓度测定方法!这可是个超级重要的事儿呢!
你知道吗,最小抑菌浓度就像是细菌的一道关卡。
它能告诉我们,到底用多少药物才能把那些调皮的细菌给制服。
这就好像我们要抓住一群小淘气,得知道用多大的力气才能抓住他们呀!
常见的测定方法有肉汤稀释法。
想象一下,把细菌放进不同浓度的药液“游泳池”里,然后观察它们能不能愉快地玩耍。
如果在某个浓度下,它们没法好好生长了,那这个浓度可就有讲究啦,这就是最小抑菌浓度啦!
还有琼脂稀释法呢,就像是给细菌们铺了一个有各种“待遇”的大床。
在不同的地方,药物浓度不一样,看看细菌会选择在哪里安营扎寨。
平板划线法也很有趣呀!把细菌在平板上划来划去,再给它们来点药,看看哪些地方细菌长不起来了。
这些方法都各有特点,就像不同的武器对付细菌这个“小怪兽”。
那我们为啥要这么重视最小抑菌浓度测定呢?这可太重要啦!如果不知道这个,我们怎么能精准地用药呢?用多了浪费,用少了又治不好病,对吧?而且,不同的细菌对药物的反应可不一样,就像每个人都有自己的脾气。
我们得了解它们,才能对症下药呀!所以,最小抑菌浓度测定真的是医学领域里的一把利剑,能帮我们更好地对抗疾病,保护我们的健康。
这难道还不值得我们好好去研究和掌握吗?。
最小抑菌浓度(MIC)及抑菌率的测定

最小抑菌浓度(MIC)及抑菌率的测定提纯蛋白质后,需要测定其最小抑菌浓度(MIC),有文献提到根据MIC测得的结果计算抑菌率:抑菌率(%)= (阳性对照OD值—试验OD值) / (阳性对照OD值—阴性对照OD值)X100样品的MIC与同性质药物和一些常用药物的MIC进行比较才有意义,不能单纯通过自己样品的结果就判断出高低,并且不能只用一种细菌。
要考虑用不同种类的细菌进行实验,还要做质控。
根据抑菌率大小可以判断是否具有抑菌能力。
可参考以下药敏介绍:诸多药敏试验方法中,肉汤稀释法是标准方法,琼脂稀释法也可认为属于标准方法。
其他任何方法必须与标准方法比较,才能确定可靠性。
其他方法之间相互比较没有太大价值。
比较须平行测定耐药菌株和敏感菌株。
耐药菌株,被评价方法与标准方法的误差称极重要误差,不得大于3%;敏感菌株,被评价方法的误差称重要误差,不大于7%。
不同的药敏试验方法,针对不同药物,可靠性不一样。
如测MRSA须高盐条件,有的试剂盒中不加盐,结果不准确,但这不影响肠球菌的测定结果。
所以,评价一种方法,应该是有针对性地验证一种细菌对一种药物测定结果的可靠性。
质量控制及其校准作用1、纸片法药敏试验用敏感菌株做质量控制。
此外,ATCC25923,ATCC25922,ATCC27853三个菌株还具备校准作用,此点往往被忽视。
在NCCLS有关文件中,质量控制一节的第一部分就是讲方法的校准。
由于培养基和操作的原因,国内大部分实验室的药敏试验没有经过校准,试验的准确度差异很大。
校准过程中,须注意用适合的参考菌株校准相应菌类的药敏试验。
如葡萄球菌药敏试验用ATCC25923校准;肠杆菌药敏试验用ATCC25922校准。
2、筛选法药敏试验必须用耐药菌株做质量控制,最好是低水平耐药菌株。
MRS筛选试验以ATCC43300控制。
万古霉素筛选试验,以ATCC51299控制。
3、稀释法药敏试验对质量控制要求较高,特别是微量稀释法,必须做质量控制,否则会出现较大误差。
卫生部2002年版《消毒技术规范》-2.1.8.4最小抑菌浓度试验(营养肉汤法)

2.1.8.4 最小抑菌浓度测定试验(营养肉汤稀释法)2.1.8.4.1 原理本试验将不同浓度的抑菌剂混合溶解于营养肉汤培养基中,然后接种细菌,通过细菌的生长与否,确定抗(抑)菌剂抑制受试菌生长的最低浓度,即最小抑菌浓度(Minimal Inhibitory Concentration,MIC)。
本方法式用于可溶性抑菌产品。
2.1.8.4.2 试验器材(1)试验菌株:金黄色葡萄球菌ATCC 6538 ,大肠杆菌8099 或ATCC 11229。
可根据抑菌剂的用途,选择特定的菌株。
(2)营养肉汤培养基,见附录A。
(3)稀释液,见附录A。
(4)吸管、试管(5)37℃培养箱。
2.1.8.4.3 操作步骤(1)按 2.1.1.2 所示方法制备的金黄色葡萄球菌、大肠杆菌悬液(2)含抗菌剂培养基配制:将抗(抑)菌溶液用蒸馏水做对倍系列稀释成不同浓度的受试液,取各稀释度受试液2.5ml 加入到含2.5ml 双倍浓度营养肉汤的试管中。
(3)取0.1ml 含菌量约为108cfu/ml 菌悬液接种于含抗(抑)菌剂的营养肉汤的试管中,作为试验组样本。
(4)以同样方法接种不含抗(抑)菌剂的营养肉汤的试管中,作为阳性对照组样本。
(5)取2 支含营养肉汤的试管中,作为阴性对照组样本。
(6)将试验组样本、阳性对照组样本及阴性对照组样本放置37℃培养箱中,培养48h,观察结果。
(7)试验中应将试验用菌悬液进行活菌培养计数,其作用浓度应为5×105cfu/ml~5×106cfu/ml。
2.1.8.4.4 评判规定当阳性对照管有细菌生长(混浊),阴性对照管无菌生长(透明),试验用菌悬液的作用浓度为5×105cfu/ml~5×106cfu/ml 时,试验组无菌生长的最高稀释度所对应的抗(抑)菌剂浓度,为该样品对受试菌的MIC。
2.1.8.4.5 注意事项接种时,应由低抗(抑)菌剂浓度向高浓度依次接种。
最小抑菌浓度测定方法

MIC试验方法
1.准备:
药物母液:1280旧/ml
培养基:MH液体,平板
2.步骤
1.于平板上挑去单个菌落,接种于MH液体,37C过夜培养。
2.调整OD600=0.5,用MH液体以1:1000稀释备用。
3.在96孔板第一孔加入180山稀释的菌液,2-11孔加入100此稀释的菌液,12孔 加入无菌MH液体作为对照。
4.在第一孔加入20丄药物母液,混匀。取100山至第二孔,依次至11孔,弃去100
山。使药液一次倍比稀释为128、64、32、、、、、、0.125用/ml。
5.于35 ±2C培养20h,观察结果。
6.每种药物做3个重复。以不生长细菌的最小药物Fra bibliotek度作为MIC值。
最小抑菌浓度定义测试方法

MIC是指在微生物过夜培养后(一般24小时),抗菌物质能抑制微生物生长的最低浓度,是对抗菌物质测定的最基本方法。
效价则是指将标准品和被检品放在同一条件下,比较它们的抗菌作用,从而算出被检品的效价单位。
通俗点说:MIC是对抗菌物质有无活性的初检,而效价则是对化合物的活性能力大小的定量化分析。
最小抑菌浓度科技名词定义中文名称:最小抑菌浓度英文名称:minimal inhibitory concentration;MIC定义:能够抑制细菌生长、繁殖的最低药物浓度。
应用学科:水产学(一级学科);水产生物病害及防治(二级学科)本内容由全国科学技术名词审定委员会审定公布最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
提纯蛋白质后,需要测定其最小抑菌浓度(MIC),有文献提到根据MIC测得的结果计算抑菌率:抑菌率(%)= (阳性对照OD值—试验OD值) / (阳性对照OD值—阴性对照OD值 )X100样品的MIC与同性质药物和一些常用药物的MIC进行比较才有意义,不能单纯通过自己样品的结果就判断出高低,并且不能只用一种细菌。
要考虑用不同种类的细菌进行实验,还要做质控。
根据抑菌率大小可以判断是否具有抑菌能力。
可参考以下药敏介绍:诸多药敏试验方法中,肉汤稀释法是标准方法,琼脂稀释法也可认为属于标准方法。
其他任何方法必须与标准方法比较,才能确定可靠性。
其他方法之间相互比较没有太大价值。
比较须平行测定耐药菌株和敏感菌株。
耐药菌株,被评价方法与标准方法的误差称极重要误差,不得大于3%;敏感菌株,被评价方法的误差称重要误差,不大于7%。
不同的药敏试验方法,针对不同药物,可靠性不一样。
如测MRSA须高盐条件,有的试剂盒中不加盐,结果不准确,但这不影响肠球菌的测定结果。
所以,评价一种方法,应该是有针对性地验证一种细菌对一种药物测定结果的可靠性。
MIC法测最小抑菌浓度

常量肉汤稀释法:1、抗菌药物储存液的制备:浓度不应低于1000ug/ml或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
配制好的药物储存液应贮存于-60度以下环境,保存期不超过6个月。
制备抗菌药物贮存液所用的溶剂和稀释剂2、药敏实验用抗菌药物浓度范围:根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3、培养基:NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4、接种物的制备:有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
用MH肉汤将上述菌悬液进行1∶100稀释后备用。
注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
5、MIC板制备:无菌操作,将倍比稀释后不同浓度的抗菌药物溶液分别加到灭菌的96孔聚苯乙烯板中,第1至第11孔加药液,每孔10μl,第12孔不加药作为生长对照,冰冻干燥后密封,-20℃以下保存备用。
6、接种物制备:将用生长法或直接菌悬液法制备的浓度相当于0.5麦氏比浊标准的菌悬液,经MH肉汤1∶1000稀释后,向每孔中加100μl,密封后置35℃普通空气孵箱中,孵育16~20h判断结果。
抗菌药物最小抑菌浓度的测定之欧阳家百创编

抗菌药物最小抑菌浓度的测定欧阳家百(2021.03.07)一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:MH液体培养基无菌试管分光光度计0.5麦氏标准比浊管MH琼脂微量加样器蒸馏水吸头0.1mol磷酸缓冲液接种环(PH6.0)无菌生理盐水无菌平板无菌滤膜0.22 无菌针筒抗菌药物金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100ml 浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg 。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
几种测定抗菌药物最低抑菌浓度(MIC)方法
1.1.常量肉汤稀释法
1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如
1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)
/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.
2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH 肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
用MH肉汤将上述菌悬液进行1∶100稀释后备用。
注意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
1.1.5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入1.6mlMH肉汤外,其余每管加入MH肉汤1ml,在第1管加入抗菌药物原液(如1280μg/ml)0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。
此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml。
然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5×105CFU/ml。
第1管至第11管药物浓度分别为128、64、32、16、8、4、2、1、05、0.25、0.125μg/ml。
1.1.6.孵育将接种好的稀释管塞好塞子,置35℃普通空气孵箱中孵育16~20h;嗜血杆菌和链球菌在普通空气孵箱中孵育20~24h;对可能的耐甲氧西林葡萄球菌和耐万古霉素肠球菌应持续孵育满24h。
1.1.7.结果判断与解释在读取和报告所测试菌株的MIC前,应检查生长对照管的细菌生长情况是否良好,同时还应检查接种物的传代培养情况以确定其是否污染,质控菌株的MIC值是否处于质控范围。
以肉眼观察,药物最低浓度管无细菌生长者,即为受试菌的MIC。
甲氧苄胺嘧啶或磺胺药物的肉汤稀释法终点判断,与阳性生长对照管比较抑制80%细菌生长管药物浓度为受试菌MIC。
根据NCCLS推荐的分界点值标准,判断耐药(resistant, R)、敏感(susceptible, S)或中介(intermediate, I)。
S表示被测菌株所引起的感染可以用该抗菌药物的常用剂量治疗有效,禁忌症除外。
R指该菌不能被抗菌药物的常用剂量在组织液内或血液中所达到的浓度所抑制,或属于具有特定耐药机理(如β-内酰胺酶),所以临床治疗效果不佳。
I是指MIC接近药物的血液或组织液浓度,疗效低于敏感菌。
还表示被测菌株可以通过提高剂量(如β-内酰胺类药物)被抑制,或在药物生理性浓集的部位(如尿液)被抑制。
另外,中介还作为“缓冲域”,以防止由微小的技术因素失控,所导致较大的错误解释。
1.2.微量肉汤稀释法
1.2.1.抗菌药物和培养基制备同常量肉汤稀释法。
1.2.2.MIC板制备无菌操作,将倍比稀释后不同浓度的抗菌药物溶液分别加到灭菌的96孔聚苯乙烯板中,第1至第11孔加药液,每孔10μl,第12孔不加药作为生长对照,冰冻干燥后密封,-20℃以下保存备用。
1.2.3.接种物制备将用生长法或直接菌悬液法制备的浓度相当于0.5麦氏比浊
标准的菌悬液,经MH肉汤1∶1000稀释后,向每孔中加100μl,密封后置35℃普通空气孵箱中,孵育16~20h判断结果。
当试验嗜血杆菌属,链球菌属时,孵育时间为20~24h,试验葡萄球菌和肠球菌对苯唑西林和万古霉素的药敏试验时孵育时间必须满24h。
此时,第1孔至第11孔药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125μg/ml。
1.2.4.结果判断以在小孔内完全抑制细菌生长的最低药物浓度为MIC。
当阳性对照孔(即不含抗生素)内细菌明显生长试验才有意义。
当在微量肉汤稀释法出现单一的跳孔时,应记录抑制细菌生长的最高药物浓度。
如出现多处跳孔,则不应报告结果,需重复试验。
通常对革兰阴性杆菌而言,微量肉汤稀释法测得的MIC 与常量肉汤稀释法测得的结果相同或低一个稀释度(1孔或2倍)。
2.琼脂稀释法琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
2.1.培养基制备使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH 琼脂(当试验磺胺药时,使用溶解的马血)。
2.2.含药琼脂平板制备根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。
2.3.接种物制备与接种制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
2.4.结果判断将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
3.E试验(E-test)E试验是指浓度梯度琼脂扩散试验,其原理基本同扩散法,即浓度呈连续梯度的抗菌药物从塑料试条中向琼脂中扩散,在试条周围抑菌浓度范围内受试菌的生长被抑制,从而形成透明的抑菌圈。
E试验综合了稀释法和扩散法的原理和特点,同时还弥补了二者的一些不足,可以像稀释法一样直接定量测出抗菌药物对受试菌的MIC。
3.1.培养基、菌液制备和接种同纸片扩散法。
3.2.贴E试验条同纸片扩散法,E试验条的刻度面朝上,不得贴反,一旦接触琼脂后不得再移动。
直径150mm的平皿内可放置6根E试验试条,90mm者一般只能放置1根。
3.3.孵育时间和温度同纸片扩散法。
3.4.结果阅读孵育后围绕试条可形成一个椭圆形的抑菌圈,在抑菌圈和试条的横切相交处试条上的读数刻度即是测定抗菌药物对受试菌的MIC。
阅读时应注意的问题见供应商的产品说明书。
