共轭效应
共轭效应介绍.

2、P-π共轭
如氯乙烯,当氯原子的p轨道的对称轴与
键中的p轨道对称轴平行时,电子发生离域。
3、超共轭(σ-π共轭)
超共轭效应是由一个烷基的C-
H键的σ键电子与相邻的半满 或全空的p轨道互相重叠而产 生的一种共轭现象。
效应(推电子),但两者均较弱,因此既不能 进行阴离子聚合,也不能进行阳离子聚合,只 能进行自由基聚合。如氯乙烯、氟乙烯、四氟 乙烯均只能按自由基聚合机理进行。
13
凡共轭体系上的取代基能降低体系的π电
子云密度,则这些基团有吸电子共轭效应, 用-C表示,如-COOH,-CHO,-COR;凡共 轭体系上的取代基能增高共轭体系的π电子云 密度,则这些基团有给电子共轭效应,用+C 表示,如-NH2,-OH,-R。
电子离域
如1,3-丁二烯,四个π电子不是
两两分别固定在两个双键碳原子之 间,而是扩展到了四个碳原子之间, 象这种现象称为电子离域。它体现 了分子内原子之间的相互影响。
二、分类:
共轭效应大致分为三类: 1、π-π共轭 2、P- π共轭
3、超共轭(σ-π共轭)
1、π-π共轭
非饱和键(双键或三键)与单键交替分 布,形成π键的P轨道在同一平面上相互重 叠而成共轭体系,称之为π-π共轭
如:1,3-丁二烯, CH2=CH-CH=CH2中,可以 看作两个孤立的双键重合在 一起,π电子的运动范围不 再局限在两个碳原子之间, 而是扩充到四个碳原子之间。
共轭效应的结果
ⁿ ⑴键长相对缩短,电子云重叠得越多,电子云密度 越大,两个原子结合得就越牢固,键长也就越短,单双 键产生了平均化
举例说明共轭效应对反应过程中反应中间体的稳定作用

共轭效应是有机化学中一种重要的分子内稳定效应,对于反应过程中的反应中间体来说,共轭效应能够起到一定的稳定作用。
下面我们将通过举例说明来详细解释共轭效应对反应中间体的稳定作用。
1. 什么是共轭效应?在有机化学中,共轭效应是指分子中含有共轭结构的化合物,通过共轭π电子体系的共享能够影响化合物的稳定性和反应性。
共轭结构通常指的是相邻的两个双键或者一个双键和一个孤对电子的相互作用。
共轭效应可以影响分子的光学性质、电子结构以及化学反应。
2. 共轭效应对反应中间体的稳定作用在有机化学反应中,反应中间体是指在反应过程中形成的、并不立即参与反应的中间物质。
共轭效应对反应中间体的稳定作用主要体现在以下几个方面:2.1 共轭效应对碳离子中间体的稳定作用当反应过程中生成了碳离子中间体时,共轭效应可以通过共轭π电子体系的电子云分布来稳定碳离子,使其形成共轭结构,减少电子孤对的紧张,降低中间体的能量,从而增加反应的速率和选择性。
1,3-丁二烯在发生负离子加成反应时,产生的负离子中间体比较稳定,主要是由于共轭效应的存在。
2.2 共轭效应对自由基中间体的稳定作用同样地,共轭效应也能够对自由基中间体的稳定起到一定作用。
通过共轭结构中π电子的共享,可以减少自由基的不稳定性,增加其稳定性。
这种稳定性不仅能够帮助中间体保存更长时间,也能影响反应的产率和选择性。
苯的自由基取代反应中,共轭效应使得苯环上生成的自由基更加稳定,也更容易与其他分子发生反应。
3. 共轭效应的应用举例在有机合成和药物化学领域,共轭效应的稳定作用得到了广泛的应用。
药物分子中的共轭结构可以增加化合物的稳定性,提高其在体内的代谢稳定性,延长其药效持续时间。
共轭效应还可以影响有机合成反应的产率和产物选择性,为有机合成化学提供了重要的理论基础和实际指导。
通过以上例子我们可以看出,共轭效应在有机化学反应中对于稳定反应中间体起到了重要的作用。
研究共轭效应对于理解有机化学反应的机理、提高合成效率以及设计合成新药物等方面具有重要意义。
共轭效应

离域现象H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
共轭效应CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
共轭效应这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
共共轭效应轭效应是指在共轭体系中电子离域的一种效应是有机化学中一种重要的电子效应.它能使分子中电子云密度的分布发生改变(共平面化),内能减少,键长趋于平均化,折射率升高,整个分子更趋稳定。
编辑本段基本介绍“共轭效应是稳定的”是有机化学的最最基本原理之一.但是,自30年代起,键长平均化,4N+2芳香性理论,苯共轭效应环D6h构架的起因,分子的构象和共轭效应的因果关系,π-电子离域的结构效应等已经受到了广泛的质疑.其中,最引人注目的是Vollhardt等合成了中心苯环具有环己三烯几何特征的亚苯类化合物,Stanger等合成了键长平均化,但长度在0.143~0.148nm的苯并类衍生物.最近(1999年),Stanger又获得了在苯环中具有单键键长的苯并类化合物.在理论计算领域,争论主要表现在计算方法上,集中在如何将作用能分解成π和σ两部分.随着论战的发展,作用能分解法在有机化学中的应用不断地发展和完善,Hückel理论在有机化学中的绝对权威也受到了挑战.为此,简要地介绍了能量分解法的发展史,对Kollma法的合理性提出了质疑.此外特别介绍了我们新的能量分解法,及在共轭效应和芳香性的研究中的新观点和新的思维模式。
共轭效应与超共轭效应的定义及特点

1.共轭效应与超共轭效应的定义及特点共轭效应不饱和的化合物中,有三个或三个以上互相平行的p轨道形成大π键,这种体系称为共轭体系.共轭体系中,π电子云扩展到整个体系的现象称为电子离域或离域键.共轭效应:电子离域,能量降低,分子趋于稳定,键长平均化等现象称为共轭效应,也叫做C效应共轭效应的结构特点:共轭体系的特征是各σ键在同一平面内,参加共轭的p轨道轴互相平行,且垂直于σ键在的平面,相邻p轨道间从侧面重叠发生键离域.共轭效应与诱导效应相比还有一个特点是沿共轭体系传递不受距离的限制.超共轭效应烷基上C原子与极小的氢原子结合,由于电子云的屏蔽效力很小,所以这些电子比较容易与邻近的π电子(或p电子)发生电子的离域作用,这种涉及到σ轨道的离域作用的效应叫超共轭效应.超共轭体系,比共轭体系作用弱,稳定性差,共轭能小.2.共轭效应共轭的类型2.1.1 π-π共轭通过形成π键的p轨道间相互重叠而导致π电子离域作用称为π-π共轭.参加共轭的原子数目等于离域的电子总数,又称为等电子共轭.我们可以简单地概括为双键,单键相间的共轭就是π-π共轭.例如:共轭体系的分子骨架称做共轭链.2.1.2 p-π共轭体系通过未成键的p轨道(包括全满,半满及全空轨道)与形成π键的p轨道的重叠而导致的电子离域作用,称为p-π共轭.包括富电子,足电子,缺电子三种p-π共轭类型.我们也可以简单地理解为:双键相连的原子上的p 轨道与π键的p轨道形成的共轭即为p-π共轭.例如:共轭方向及强弱判断共轭效应的方向及强弱直接影响物质的性质和稳定性,因此共轭方向及强弱的判断也就有着非常重要的作用.能够给出电子的称给电子共轭,用符号+C表示.相反,能接受电子的称吸电子共轭,用符号-C表示.卤素,羟基,氨基,碳负离子等与双键直接相连时,X. O. N .C等原子的孤对电子对与π键共轭.由于是由一个原子向共轭体系提供两个电子,相当于使π电子密度增大,所以有给出电子的能力,称为+C效应.一般富电子p-π共轭都属于给电子共轭.例如:中的都是+C效应.当参与共轭的O. N 只提供一个电子,而本身电负性大于C原子,所以有使共轭体系电子向O. N 转移的能力,因此有-C效应.电负性大于C的原子参与的等电子共轭是吸电子共轭.例如:都是-C效应.大多数共轭效应是由碳的2p轨道与其他原子的p轨道重叠所产生的,当某原子参与共轭的p轨道的形状大小,能量与碳的2p轨道越接近时,轨道重叠越,离域越易,共轭作用越强.即共轭效应的强弱与参与共轭的原子轨道的主量子数有关.n=2时有强的共轭,n>2有弱的共轭,n越大共轭越弱.另外,元素的电负性越小,越容易给出电子,有较强的+C效应.相反,元素的电负性越大,越容易吸引电子,有较强的-C效应.因此共轭效应也有周期性变化.同一类元素随n值增大,共轭减弱;同一周期n值相同,随原子序数增大,电负性增大,给电子共轭效应减弱;吸电子共轭主要有电负性决定,电负性越大,吸电子共轭越强.3. 超共轭效应超共轭效应视其电子电子转移作用分为σ-π.σ-p .σ-σ几种,以σ-π最为常见.σ-π超共轭丙烯分子中的甲基可绕C—Cσ键旋转,旋转到某一角度时,甲基中的C-Hσ键与C=C的π键在同一平面内, C-Hσ键轴与π键p轨道近似平行,形成σ-π共轭体系,称为σ-π超共轭体系.在研究有机反应时有着重要的应用,在学习不对称烯烃的HX加成反应时,我们以C正离子形成的稳定性来解释马尔科夫尼科夫规则,若应用σ-π超共轭效应,则不仅说明甲基是推电子的,同时加深了对这一经验规则的深入理解.再如,不饱和烯烃的a-H的特殊活泼性也可以用σ-π超共轭效应来理解.丙烯的甲基比丙烷的甲基活泼的多,在液氨中丙烯中甲基的H易被取代,丙烷中甲基的H不易被取代.σ-p超共轭当烷基与正离子或游离基相连时,C-H上电子云可以离域到空的p空轨道或有单个电子的p轨道上,使正电荷和单电子得到分散,从而体系趋于稳定,称做σ-p超共轭体系.简单的说就是C-H的σ键轨道与p轨道形成的共轭体系称做σ-p超共轭体系.如乙基碳正离子即为σ-p超共轭体系.参加σ-p超共轭的C-H数目越多,正电荷越容易分散,C正离子就越稳定.应用超共轭效应的应用也很广泛,可以应用于对碳正离子稳定性的解释,碳游离基稳定性的解释,甲苯是邻对位定位基的解释,羰基活性的解释等.。
共轭效应
4
04-06 共轭效应
三. 共轭效应在有机化学中的应用
判断或解释有机反应活性中间体的稳定性
碳正离子、碳负离子、自由基、不同取代的烯烃
例如:比较下列烯烃的稳定性
>
12个σ-π 超共轭 9个σ-π 超共轭
>
6个σ-π 超共轭Βιβλιοθήκη 504-06 共轭效应
例如:比较下列碳正离子的稳定性
>
p-π共轭
>
σ-p超共轭 6个C-H
04-06 共轭效应
二. 超共轭效应
1. 含义及分类
含义:一种特殊的共轭(-、-p) -超共轭效应: 键与C-H 键共轭产生的电子离域效应。
-p超共轭效应:C-H 键与p轨道共轭产生的电子离域效应。
-超共轭效应
-p超共轭效应
04-06 共轭效应
2. 产生的原因 原因:H原子体积小,C—H键电子云的形状及大小与碳原子的p轨 道相差不大,且近似平行,易与邻位的或p电子发生相互作用,形 成-、-p共轭体系。 3. 超共轭效应的特征 超共轭效应比共轭效应弱得多; 在超共轭效应中, 键一般是给电子的, C-H键越多超共轭效应越大。 -CH3 > -CH2R > - CHR2 > -CR3
>
σ-p超共轭 3个C-H
>
无共轭
σ-p超共轭 9个C-H
6
04-06 共轭效应
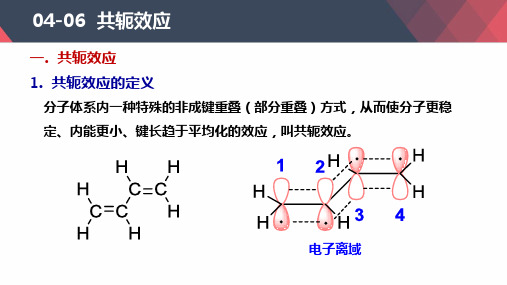
一. 共轭效应
1. 共轭效应的定义
分子体系内一种特殊的非成键重叠(部分重叠)方式,从而使分子更稳
定、内能更小、键长趋于平均化的效应,叫共轭效应。
电子离域
04-06 共轭效应
2. 共轭效应的分类 π- π p- π
共轭效应 诱导效应

共轭效应诱导效应
共轭效应和诱导效应是有机化学中非常重要的概念,它们在有机分子的结构和性质中起着关键作用。
共轭效应是指分子中共轭双键或环系统能够影响相邻原子或基团的化学性质的现象。
而诱导效应则是指分子中一个基团对另一个基团的电子密度分布产生影响的现象。
这两种效应在有机化学中常常相互作用,共同影响着分子的化学性质和反应活性。
共轭效应通常指的是共轭双键或环系统中的π电子的影响。
这些π电子能够通过共轭结构扩展到相邻的原子或基团上,从而影响它们的化学性质。
例如,苯环是一个典型的共轭系统,由于π电子的共轭作用,苯环具有稳定的化学性质和特殊的反应活性,如芳香性和亲电取代反应。
共轭效应还可以影响分子的光学性质,例如共轭双键的存在可以导致分子具有吸收紫外光的能力。
诱导效应则是由分子中原子或基团的电负性差异所导致的。
一个原子或基团的电负性越大,它对周围原子或基团的电子云的吸引力就越强,从而影响它们的电子密度分布。
例如,卤素原子对相邻碳原子的电子云产生诱导效应,使得相邻碳原子的电子密度增加,从而影响了碳原子的化学性质和反应活性。
共轭效应和诱导效应的相互作用使得有机分子具有复杂而丰富的化学性质。
科学家们通过研究和理解这些效应,可以设计和合成具有特定性质和功能的有机分子,从而在药物、材料和生物科学领域中发挥重要作用。
因此,对于有机化学研究来说,共轭效应和诱导效应是不可或缺的重要概念,它们的深入理解将推动有机化学领域的发展和创新。
共轭效应的定义

共轭效应的定义嘿,咱今儿个就来说说这共轭效应!啥是共轭效应呢?简单来说呀,就好比一群人一起干活儿,力量就更大啦!在化学的世界里呀,共轭效应就是原子或基团之间相互作用,让整个分子变得更稳定、更厉害呢!你看啊,就像拔河比赛,大家齐心协力往一个方向使劲儿,那力量可不一般。
共轭效应也是这样,让分子里的各个部分紧密合作,发挥出更大的作用。
比如说有些有机化合物,因为有了共轭效应,性质就发生了很大的变化。
想象一下,一个分子就像一个小团队,里面的原子和基团就是队员。
没有共轭效应的时候呢,大家各自为战,虽然也能做事,但总感觉少了点啥。
可一旦有了共轭效应,嘿,那就不一样啦!大家好像突然有了默契,劲儿往一处使,让这个小团队变得超级厉害。
共轭效应能带来很多好处呢!它可以让分子更稳定,就像给房子打了牢固的地基。
这意味着这些分子在各种环境下都能更坚强地存在着,不容易被破坏。
而且啊,它还能影响分子的反应活性,让分子在化学反应中表现得更出色。
咱再打个比方,共轭效应就像是给分子穿上了一件神奇的铠甲,让它变得更强大、更有魅力。
这铠甲不仅能保护分子,还能让它在各种场合都能展现出独特的风采。
生活中其实也有很多类似共轭效应的例子呢。
就拿一个乐队来说吧,各种乐器一起演奏,相互配合,才能奏出美妙的音乐。
如果各玩各的,那肯定乱套啦!这不就是一种“共轭”吗?大家一起努力,创造出更美好的东西。
共轭效应可真是个神奇的东西呀!它让化学世界变得更加丰富多彩,充满了各种奇妙的变化和可能性。
它就像一个隐藏在分子背后的魔法,默默地发挥着作用,让我们看到了那么多有趣的化学现象。
所以呀,可别小看了这共轭效应哦!它虽然看不见摸不着,但却实实在在地影响着我们的化学世界。
它让那些小小的分子变得不再平凡,拥有了属于自己的独特魅力和价值。
总之呢,共轭效应真的很重要,很有趣,也很神奇!我们得好好研究它,利用它,让它为我们的生活和科学研究带来更多的惊喜和进步!。
共轭效应

共轭效应共轭效应(conjugated effect) ,又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应。
凡共轭体系上的取代基能降低体系的π电子云密度,则这些基团有吸电子共轭效应,用-C表示,如-COOH,-CHO,-COR;凡共轭体系上的取代基能增高共轭体系的π电子云密度,则这些基团有给电子共轭效应,用+C表示,如-NH2,-OH,-R。
1离域现象共轭效应H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
如图,这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
2特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
①共轭能:形成共轭π键的结果使体系的能量降低,分子稳定。
例如CH2=CH—CH=CH2共轭分子,由于π键与π键的相互作用,使分子的总能量降低了,也就是说, CH2=CH—CH=CH2分子的能量比两个不共轭的CH2=CH2分子的能量总和要低。
所低的数值叫做共轭能。
②键长:从电子云的观点来看,在给定的原子间,电子云重叠得越多,电子云密度越大,两个原子结合得就越牢固,键长也就越短,共轭π键的生成使得电子云的分布趋向平均化,导致共轭分子中单键的键长缩短,双键的键长加长。
共轭效应共轭效应是电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
共轭效应又称离域效应

共轭效应又称离域效应(delocalization effect)。
存在于共轭体系中的一种极性(静态)和极化(动态的)现象。
是一个分子在“静止”状态以及在微扰状态(例如在反应过程中)的特性。
在单双键交替出现的共轭分子中,可以看做两个孤立的双键用一个单键联合在一起,π电子的运动范围由两个碳原子之间扩充到四个碳原子之间,因此称为离域现象。
在外界的影响下,共轭效应能使电子分布移并在化学特性上有所反映。
例如(1)电性:离域π键的形成增加了物质的电导。
(2)颜色:离域π键的形成扩大了π电子的活动范围,使体系能量降低,能级间隔变小,由σ键的紫外光区移至离域π键的可见光区。
含离域π键的化合物往往是染料、生色剂和指示剂等。
酚酞在碱性溶液中变红就是因为扩大了π电子的离域范围。
(3)酸碱性:苯酚呈酸性,苯胺呈碱性。
前者是因为电离掉H+后离域范围稳定存在;后者是因为本来分子中就有离域π键,不易电离,可接受H+。
(4)化学反应性能:芳香化合物的芳香性、游离基的稳定性,丁二烯类的1,4加成等都和离域π键的生成有关。
共轭效应在共轭体系分子中,由于原子间的相互影响和π电子云的离域,引起分子内能降低、体系趋向稳定、键长趋于平均化,以及某些性质的变化等效应,称为共轭效应。
产生共轭效应的必要条件是,组成共轭体系的各个原子必须处在同一平面上。
这样才能使参加共轭的每个原子的p轨道相互平行而发生侧面重叠。
反之,会减弱、甚至使共轭效应完全消失。
例如,1,3-丁二烯分子具有共轭效应,而环辛四烯由于组成环的八个碳原子不在同一平面上,因而使共轭效应受到影响。
红外光谱基团频率分析及应用基团频率和特征吸收峰物质的红外光谱是其分子结构的反映,谱图中的吸收峰与分子中各基团的振动形式相对应。
多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到。
这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律。
C等,都有自己的特定的红外吸收区域,分子的其它部分对其吸收位置影响较小。
共轭效应

共轭效应共轭效应(conjugated effect) ,又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应。
凡共轭体系上的取代基能降低体系的π电子云密度,则这些基团有吸电子共轭效应,用-C表示,如-COOH,-CHO,-COR;凡共轭体系上的取代基能增高共轭体系的π电子云密度,则这些基团有给电子共轭效应,用+C表示,如-NH2,-OH,-R。
H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
共轭效应这种分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
这种电子通过共轭体系的传递方式,叫做共轭效应。
特点沿共轭体系传递不受距离的限制。
共轭效应,由于形成共轭π键而引起的分子性质的改变叫做共轭效应。
共轭效应主要表现在两个方面。
①共轭能:形成共轭π键的结果使体系的能量降低,分子稳定。
例如CH2=CH-CH=CH2共轭分子,由于π键与π键的相互作用,使分子的总能量降低了,也就是说, CH2=CH-CH=CH2分子的能量比两个不共轭的CH2=CH2分子的能量总和要低。
所低的数值叫做共轭能。
②键长:从电子云的观点来看,在给定的原子间,电子云重叠得越多,电子云密度越大,两个原子结合得就越牢固,键长也就越短,共轭π键的生成使得电子云的分布趋向平均化,导致共轭分子中单键的键长缩短,双键的键长加长。
共轭效应是电子效应的一种。
组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、稳定性高、键长趋于平均化,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化,这些变化通常称为共轭效应。
有机共轭效应

有机共轭效应
有机化学中的共轭效应是指共轭双键或环中的π电子可以被相邻的单键或其他π电子所影响,从而改变化合物的结构和性质。
共轭效应包括共轭体系的稳定性、反应性和吸收光谱的变化等方面。
共轭体系的稳定性可以通过判断反应热和共轭体系中电子排布的方式来确定。
共轭体系的反应性也受到共轭效应的制约。
吸收光谱的变化可以通过共轭体系的大小、取代基的影响和电子密度的变化来解释。
共轭效应在化学合成、材料科学和生物化学等领域中都有重要应用。
- 1 -。
共轭效应与诱导效应

共轭效应与诱导效应一.共轭效应1、概念:共轭效应(conjugated effect) ,又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。
何为离域效应呢?对于H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
而CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
这种发生离域现象的分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
2、特点:共轭效应相对于诱导效应最特殊的特点是共轭效应沿共轭体系传递不受距离的限制,而诱导效应一般超过三个c原子之后就可以忽略不计了!其主要表现电子效应:组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、键长趋于平均化、折射率升高,整个分子更趋稳定,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化。
3、共轭效应的形式:(1)正常共轭效应:1、π-π共轭。
是指两个以上双键(或叁键)以单键相联结时所发生的π电子的离位作用。
具有共平面性、键长趋于平均化、共轭体系能量降低等特点!C.K.英戈尔德称这种效应为中介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p轨道的大小(或主量子数)决定的。
例如:--A=B-X=Y--,原子的电负性和它的p轨道半径愈大,则它吸引π电子的能力也愈大,愈有利于基团-X =Y-从基准双键A=B-吸引π电子的共轭效应。
与此相反,如果A原子的电负性和它的p轨道半径愈大,则它释放π电子使其向Y原子移动的能力愈小,愈不利于向-X=Y基团方向给电子的共轭效应。
中间原子B和X的特性也与共轭效应直接相关。
2、p-π,又称共轭多电子共轭效应。
在简单的多电子共轭体系中,Z为一个带有p电子对(或称n电子)的原子或基团。
共轭效应

C C F
C C Cl C C Br C C I
同族元素:电负性越大的电子,+C 效应越小
C C NR2 > C C OH > C C F
与杂原子相连的正碳离子p- π共轭结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,得到p- π共轭
CH3 O
CH2
CH3O
CH2
B对醌、循环式极化
在对子吸收光谱的分析后,在芳香族化合 物中,有循环式和对醌两种共轭极化式。
N O Me O
N OMe
O
Me2 N
N
O
Me2 N
N
O
多联苯系列直来联苯系列
...
...
间位和邻位多苯系列
...
...
C、并苯式极化
• 直链多并苯系列与直多并苯系列由对醌式共轭 极化产生的 • 并苯式极化是指各苯环的对醌式极化可以通过 侧并的苯环而传递,不限与直并的苯环。
类似地,羰基正离子:
R C O
R C
O
2.2.3 应用实例
a.苯酚分子中氧原子上的孤对电子与 苯环上的π电子形成 p- π共轭。 结果: 使羟基的邻、对位的碳原子 带有部分的负电荷。
δ
OH
δ δ
O R C OH
O R C O+ H
C C C Y
(I)
C C X
(II)
π电子转移用弧形 箭头表示
Y为吸电子基团时-吸电子共轭效应 (-C), X为供电子基团时-供电子共轭效应 (+C).
b动态:暂时的,被动的受外界因素的影响
-
+
CH2
CH
CH
共轭效应与超共轭效应的定义及特点

1.共轭效应与超共轭效应的定义及特点共轭效应不饱和的化合物中,有三个或三个以上互相平行的p轨道形成大π键,这种体系称为共轭体系.共轭体系中,π电子云扩展到整个体系的现象称为电子离域或离域键.共轭效应:电子离域,能量降低,分子趋于稳定,键长平均化等现象称为共轭效应,也叫做C效应共轭效应的结构特点:共轭体系的特征是各σ键在同一平面内,参加共轭的p轨道轴互相平行,且垂直于σ键在的平面,相邻p轨道间从侧面重叠发生键离域.共轭效应与诱导效应相比还有一个特点是沿共轭体系传递不受距离的限制.超共轭效应烷基上C原子与极小的氢原子结合,由于电子云的屏蔽效力很小,所以这些电子比较容易与邻近的π电子(或p电子)发生电子的离域作用,这种涉及到σ轨道的离域作用的效应叫超共轭效应.超共轭体系,比共轭体系作用弱,稳定性差,共轭能小.2.共轭效应共轭的类型2.1.1 π-π共轭通过形成π键的p轨道间相互重叠而导致π电子离域作用称为π-π共轭.参加共轭的原子数目等于离域的电子总数,又称为等电子共轭.我们可以简单地概括为双键,单键相间的共轭就是π-π共轭.例如:共轭体系的分子骨架称做共轭链.2.1.2 p-π共轭体系通过未成键的p轨道(包括全满,半满及全空轨道)与形成π键的p轨道的重叠而导致的电子离域作用,称为p-π共轭.包括富电子,足电子,缺电子三种p-π共轭类型.我们也可以简单地理解为:双键相连的原子上的p轨道与π键的p轨道形成的共轭即为p-π共轭.例如:共轭方向及强弱判断共轭效应的方向及强弱直接影响物质的性质和稳定性,因此共轭方向及强弱的判断也就有着非常重要的作用.能够给出电子的称给电子共轭,用符号+C表示.相反,能接受电子的称吸电子共轭,用符号-C表示.卤素,羟基,氨基,碳负离子等与双键直接相连时,X. O. N .C等原子的孤对电子对与π键共轭.由于是由一个原子向共轭体系提供两个电子,相当于使π电子密度增大,所以有给出电子的能力,称为+C效应.一般富电子p-π共轭都属于给电子共轭.例如:中的都是+C效应.当参与共轭的O. N 只提供一个电子,而本身电负性大于C原子,所以有使共轭体系电子向O. N 转移的能力,因此有-C效应.电负性大于C的原子参与的等电子共轭是吸电子共轭.例如:都是-C效应.大多数共轭效应是由碳的2p轨道与其他原子的p轨道重叠所产生的,当某原子参与共轭的p轨道的形状大小,能量与碳的2p轨道越接近时,轨道重叠越,离域越易,共轭作用越强.即共轭效应的强弱与参与共轭的原子轨道的主量子数有关.n=2时有强的共轭,n>2有弱的共轭,n越大共轭越弱.另外,元素的电负性越小,越容易给出电子,有较强的+C效应.相反,元素的电负性越大,越容易吸引电子,有较强的-C效应.因此共轭效应也有周期性变化.同一类元素随n值增大,共轭减弱;同一周期n值相同,随原子序数增大,电负性增大,给电子共轭效应减弱;吸电子共轭主要有电负性决定,电负性越大,吸电子共轭越强.3. 超共轭效应超共轭效应视其电子电子转移作用分为σ-π.σ-p .σ-σ几种,以σ-π最为常见.σ-π超共轭丙烯分子中的甲基可绕C—Cσ键旋转,旋转到某一角度时,甲基中的C-Hσ键与C=C的π键在同一平面内,C-Hσ键轴与π键p轨道近似平行,形成σ-π共轭体系,称为σ-π超共轭体系.在研究有机反应时有着重要的应用,在学习不对称烯烃的HX加成反应时,我们以C正离子形成的稳定性来解释马尔科夫尼科夫规则,若应用σ-π超共轭效应,则不仅说明甲基是推电子的,同时加深了对这一经验规则的深入理解.再如,不饱和烯烃的a-H的特殊活泼性也可以用σ-π超共轭效应来理解.丙烯的甲基比丙烷的甲基活泼的多,在液氨中丙烯中甲基的H易被取代,丙烷中甲基的H不易被取代.σ-p超共轭当烷基与正离子或游离基相连时,C-H上电子云可以离域到空的p空轨道或有单个电子的p轨道上,使正电荷和单电子得到分散,从而体系趋于稳定,称做σ-p超共轭体系.简单的说就是C-H的σ键轨道与p轨道形成的共轭体系称做σ-p超共轭体系.如乙基碳正离子即为σ-p超共轭体系.参加σ-p超共轭的C-H数目越多,正电荷越容易分散,C正离子就越稳定.应用超共轭效应的应用也很广泛,可以应用于对碳正离子稳定性的解释,碳游离基稳定性的解释,甲苯是邻对位定位基的解释,羰基活性的解释等.。
共轭效应详解

分子轨道理论认为共轭效应是轨道或电子 离域于整个共轭体系乃至整个分子所产生的一种 效应。
一
电子离域与共轭效应
[现象1] • 在CH2=CH—CH=CH2中的键长不是简单的单键 和双键的键长,存在着平均化的趋势。 • 普通: C—C单键键长 0.154nm C==C双键键长 0.134nm • 1,3-丁二烯:C—C单键键长 0.147nm C==C双键键长 0.137nm • 体系能量降低,化合物趋于稳定。
主量子数相同元素的p 轨道大小相近,可以更 充分地重迭,离域程度也较大。如果取代基中心原 子的主量子数与碳的主量子数不同,则轨道重迭程 度相对较小,离域程度相应减弱,而且主量子数差 值越大影响越明显。因此,一般讲,+C效应在同族 中随中心原子的原子序数增大而降低。
• 带负电荷的元素将具有相对更强的+C效应: —O– > —OR > —O+R2
CH2 CH Cl
-C效应: CH2
CH
CH
O
(1)+C效应
• 在同一周期中: 随原子序数的增大而减弱。 如: —NR2 > —OR > —F • 在同一族中: 随原子序数的增加而减小。 如: —F > —Cl > —Br > —I ; —OR > —SR > —SeR > TeR ; —O– > —S– > —Se– > —Te –
分子中各能级之间能量差减小,分子中电子激发能 低,以致使共轭体系分子的吸收光谱向长波方向移动。 随着共轭链增长,吸收光谱的波长移向波长更长的区 域,进入可见光区,这就是有颜色的有机化合物分子绝 大多数具有复杂的共轭体系的原因。 颜色 丁二烯 无 己三烯 无 二甲辛四烯 淡黄 蕃茄红素 红色 最大吸收峰波长(nm) 217 258 298 470
共轭效应

0.133
0.154
H
H
??:nm
双键与乙烯相比,变长了;单键与乙烷相比,变短了。总的说 来,是键长趋于平均化了。
10
氢化热
孤立和共轭体系的氢化热:
C H 2 C HC H 2 C HC H 2+ 2H 2 C H 3 C H C HC HC H 2+ 2H 2 所 以 1 , 3 - 戊 二 烯 的 共 轭 能 是 2 8 K J / m o l
分子中,每个碳原子都以sp2轨 道相互重叠或与氢原子的1s轨 道重叠,形成三个C-Cσ键和六 个C-Hσ键。这些σ键都处在同 一个平面上,它们之间的夹角 都接近120°,此外每个碳原子 还剩下一个来参加杂化的与这 个平面垂直的p轨道。四个p轨 道的对称轴互相平行侧面互相 重叠,形成了包含四个碳原子 的四个电子的共轭体系。 更多…..
8
1,3-丁二烯特点
ⁿ ⑴碳碳单键键长相对缩短,单双键产生了平均化 ⁿ 随构造式CH2=CH-CH=CH2,但单双键的键长已相当
接近,同样体现在环状共轭体系中。如,苯环C-C键 长是完全相等的。 ⑵化合物的能量显著降低,稳定性明显增加。决定内 能大小方法之一就是测量氢化热,氢化热越低,分子 内能越低。
C 5 H 1 2 C 5 H 1 2
H = -2 5 4K J /m o l H = -2 2 6K J /m o l
从能量图可以看出,共轭 二烯烃比孤立二烯烃能量 低了254-226=28KJ/mol 这部分低出来的能量叫共轭 能或离域能。1,3-丁二烯 的共轭能为15kJ/mol。
共轭效应
(conjugative effect )
1
共轭效应的产生 共轭效应的类型
2
共轭效应的产生
共轭效应单双键交替出现的体系称为共轭体系

共轭效应单双键交替出现的体系称为共轭体系。
在共轭体系中,由于原子间的相互影响而使体系内的π电子(或P电子)分布发生变化的一种电子效应称为共轭效应。
凡共轭体系上的取代基能降低体系的π电子密度,则这些基团有吸电子的共轭效应,用-C表示。
凡共轭体系上的取代基能增高共轭体系的π电子云密度,则这些基团有给电子的共轭效应,用+C表示。
共轭效应只能在共轭体系中传递,但无论共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
场效应取代基在空间可以产生一个电场,对另一头的反应中心有影响,这种空间的静电作用称为场效应。
诱导效应因分子中原子或基团的极性(电负性)不同而引起成键电子云沿着原子链向某一方向移动的效应称为诱导效应。
诱导效应的电子云是沿着原子链传递的,其作用随着距离的增长迅速下降,一般只考虑三根键的影响。
诱导效应一般以氢为比较标准,如果取代基的吸电子能力比氢强,则称其具有吸电子诱导作用,用-I表示。
如果取代基的给电子能力比氢强,则称其具有给电子诱导效应,用+I表示。
4超共轭效应:当C-Hσ键与π键(或P轨道)处于共轭位置时,也会产生电子的离域现象,这种C-H键σ-电子的离域现象叫做超共轭效应。
在超共轭体系中电子转移的趋向可用弧形箭头表示:超共轭效应的大小,与p轨道或π轨道相邻碳上的C-H键多少有关,C-H键愈多,超共轭效应愈大。
编辑本段区别诱导效应(I):是建立在定域键的基础上,是短程的,一般在四键以上(包括四键)此效应可视为零。
共轭效应(C):是建立在离域键的基础上,是远程的,效应存在于整个共轭体系中。
有机化合物分子中往往两种效应同时存在。
电子效应定义:分子特有的电子状态依赖于分子的几何构型,由分子的立体结构引起电子的轨道变化而产生的效应。
解释:例如环己酮占优势的构象为椅型,在亲核加成反应中,亲核试剂进攻羰基碳原子。
对于较大的亲核试剂,反应主要发生在平伏键位置,这是由于空间位置较有利;对于较小的亲核试剂,反应主要发生在直立键位置,这是由于除空间效应外,还需要考虑立体电子效应,即羰基的π*轨道与C2—C3和C5—C6的σ轨道之间的相互作用,使得π*变形,与键σ作用强的一边轨道伸展较大,有利于亲核试剂进攻直立键位置。
共轭效应

共轭效应又称离域效应,是指共轭体系中由于原子间的相互影响而使体系内的π电子(或p电子)分布发生变化的一种电子效应称为共轭效应。
共轭体系能降低体系π电子云密度的基团有吸电子的共轭效应,能增高共轭体系π电子云密度的基团有给电子的共轭效应。
单双建交替出现的体系或双键碳的相邻原子上有p轨道的体系均为共轭体系。
在共轭体系中,π电子(或p电子)的运动范围已经扩展到整个共轭体系,这种现象称为电子离域。
π电子的离域会降低体系的能量,降低的能量称为离域能。
共轭体系越大,离域能越大。
共轭效应方向判断,取代基的共轭效应和诱导效应方向有的一致,有的不一致。
氨基的共轭效应是给电子的,其诱导效应是吸电子的,其共轭效应大于诱导效应,总的电子效应是给电子的,而氯原子的共轭效应是给电子的。
其诱导效应是吸电子的,其共轭效应小于诱导效应,总的电子效应是吸电子的。
共轭效应的特点,只能在共轭体系中传递,无论共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
《共轭效应》

《共轭效应》共轭效应是有机化学中的一个重要概念,是指烯烃及其相关化合物的π电子系统内的多个共轭双键之间相互作用产生的影响。
在化学中,化学键的形成是由电子相互作用而形成的。
这种电子相互作用可以产生各种效应,其中共轭效应就是一种关于π电子体系的效应。
共轭系统是由一系列相互平行的双键构成的,这种共轭体系中电子的运动受到限制,而且能量分布更加均匀,这被视为共轭效应的一种体现。
共轭效应的ASPECTS共轭效应主要包括四个方面:1.电子推拉效应(Electronic Push-Pull Effect): 这个效应是由不饱和含氧或氮原子的基团引起的。
比如,酰基或硝基。
这些基团会在π电子纷乱的共轭体系内移动电子密度,因此推或拉π电子体系,产生一个电子富集或贫化的区域。
2.电荷分布改变(Change of Charge Distribution): 共轭体系通常会导致π电子体系成为一种不同于孤对电子和单键的新体系。
这种新体系有一个更加稳定的电荷分布。
当共轭体系中间增加一个电子密度较高的原子时,其原子轨道上的电子将向共轭体系中移动,使得单键周围的电子密度减少。
同样地,当共轭体系中间增加一个电子密度较低的原子时,其原子轨道上的空穴会从共轭体系中吸取π电子,使得单键周围的电子密度增加。
3.共振现象(Resonance Effect): 当共轭体系中存在一个解离或附加的基团时,其空间中π电子体系可以贡献到解离或附加反应中。
通过传递电子的方式,共轭体系中π电子体系可以在整个分子中进行共振。
比如,若在苯环上引入一个另一个含有π电子体系的基团,它们之间就会产生一种相互作用,共振现象在这种情况下就是非常明显的。
4.空间效应(Steric Effect): 共轭效应也涉及与π电子体系有关的空间效应。
有些基团可能会影响周围原子的空间取向,这样能影响π电子体系的大小和形状。
因此,共轭效应是有机化学中不可或缺的概念,对于理解各种有机分子的性质有着重要的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章 二烯烃的共轭效应§1、二烯烃一、二烯烃的分类和命名:二烯烃和炔烃是同分异构体,通式C n H 2n-2(一)分类:根据二个烯键在分子中的相对位置分:累积式的二烯烃Ë«¼ü»ýÀÛÔÚͬһCÉÏ ±û¶þÏ©C=C=CCH 2=C=CH 2共轭式二烯烃C=C-C=CCH 2=CH-CH=CH 2¶þ¸öË«¼ü±»Ò»¸öµ¥¼ü¸ô¿ª1£¬3¶¡¶þÏ©孤立式的二烯烃C=C-(CH 2)n-C=Cn > 1¶þ¸öË«¼ü±»¶þ¸öÒÔÉϵ¥¼ü¸ô¿ª其中:孤立式的二烯烃的性质和单烯烃相似。
每个双键各行其势,相互影响很小。
累积式的二烯烃数量少且实际应用也不多。
共轭式二烯烃在理论和实际应用上都很重要。
所以,我们讨论的是共轭二烯烃,它具有新的,特殊的性质。
(二)命名:和烯烃相似,主要是分别指出烯键的数目和位置就行2-¼×»ù-1£¬3-¶¡¶þÏ© 1£¬3£¬5-¼ºÈýÏ© | | λÖà ÊýÄ¿CH 2=C CH=CH 23CH 2=CH-CH=CH-CH=CH 2对多烯烃,每个烯键都可能有顺反构型问题,二个烯键有二个顺反问题,组合起来就有三个顺顺,顺反,反反三种异构体˳£¬Ë³-2¡¢4-¼º ¶þ Ï©(Z),(Z)-C=CCH 3HC=CCH 3H HH˳¡¢·´-2¡¢4¼º¶þÏ© £¨·´£¬Ë³£©(Z),(Z)-·´£¬·´-2¡¢4-¼º ¶þ Ï©(E),(E)-(三)1、3丁二烯的构象:CH 2=CH-CH=CH 2C2¡¢C3 Χ ÈÆ µ¥ ¼ü Ðý ת »á ²ú Éú ²» ͬ µÄ ¿Õ ¼ä ¹¹ ÏóCCCH 2CH 2H¶þ¸öË«¼üÔÚC2¡¢C3ͬ²àS-˳- 1¡¢3-¶¡¶þÏ© S-Sigle µ¥CC CH 2CH 2HHS-·´-1¡¢3¶¡¶þÏ©¶þ¸öË«¼üÔÚC2¡¢C3Ïà·´²à性质上都是围绕单键旋转产生的,从能量上说S-反稳定,但在化学反应中参加反应时,S-反→S-顺。
三. 共轭二烯烃的性质:具有烯烃的性质,此外也有烯烃所没有的特性 1. 1、4加成:CH 2=CHCH=CH 2 + Br 22CHCH=CH 2Br BrCH 2CH=CHCH 2BrBr一般1、2加成和1、4加成同时发生,试剂不仅可以加到一个双键上,而且也可以加到共轭体系的两端C 原子上,二者的比例决定于反应条件,也就是与溶剂、温度有关。
1、2 1、4 温度-80 80% 20% -40 20% 80% 溶剂CHCl 3/40 70% 环己烷/-150C 62%2.D-A 反应。
狄耳斯-阿尔德反应(Diel—Alder)1、3—丁二烯和丁二烯酸酐作用。
»·¼ºÏ©-4¡¢5-¶þËáôûOO+OOO ±¼£¬5h°× 90%反应特征:(1)一部分共轭体系,丁二烯,共轭体系的二双链打开,在C2、C3形成双链,二烯体。
(2) 另一部分是含不饱和双链的体系,叫亲二烯体 (3) 生成的都是环状化合物 (4) 顺式加成++COOHCOOHCOOH COOHË«Ï©Ìå Ç×Ë«Ï©ÌåÀý È磹用途:由链状化合物生成环状化合物的重要方法 §2电子离域和共轭效应一、二烯烃的结构:(一)累积式二烯烃: CH 2=C=CH2p ps s C 3H 4 ±û ¶þ Ï©½á ¹¹ £º缺图 所以,它有二个相互垂直的Π键[模型]性质:性质很活泼,双链可以一个个打开发生加成反应 (1) 水化反应:CH 2=C=CH 2 + H 2OCH 2=CCH 3CH 3OCH 3H +(2) 异构化:(H 的重排)(CH3)(CH 3)2CHCCH(二) 共轭二烯烃的结构共轭二烯烃在结构和性质上都表现出一系列特性。
1、 结构:CH 2CHCHCH 2sssC 4H 6ÿ ¸ö C Ô- ×Ó ¶¼ ÊÇ SP 2 ÔÓ »¯分子中:3个C -C σ SP 2- SP 26个C -H σ SP 2-S (1)丁二烯的所有原子共平面 键角-120度(2)C 2、C3的σ键键长为0.148nm ,小于一般单键0.154nm (3)氢化热值:单烯烃氢化热大约为125.5KJ/mol丁二烯实测值为238KJ/mol ,低了13 KJ/mol 说明丁二烯分子稳定,分子内能低了 2、用MO 说明丁二烯化学键的形成:丁二烯分子,共四个C 原子,所以丁二烯分子中有四个P 轨道,所以可以组成四个π电子分子轨道y yyy 1234µÍ·ßE特点:Ψ1无结点,Ψ2、Ψ3、Ψ4分别有1、2、3个结点,在节点处电子云密度很小,对成键不起作用,分子轨道能量越高,在基态时四个电子填充两个MO ,Ψ1、Ψ2。
看Ψ1:π键四个电子不是在C1、C2、C 3、C4之间而是在连接四个Cl 的分子轨道中运动;即四个π电子是包括四个C 原子的二个分子轨道中,这轨道叫做离域轨道,键叫离域键,所以C2、C 3之间也有部分π键看Ψ2:C1、C2 和C 3、C4间键又加强了,C2、C 3间键减弱,所以,结果是虽然所有 的键都具有π键的性质,但C2- C 3键所具有的π键性质小些。
VB 法不能解释共轭现象,因为C2、C 3重叠后,和旁的不能再重叠了。
二、共轭效应共轭就是离域、共用,轭:连起来的意思。
1、概念:由于键的离域,电子云分布发生变化,对性质产生影响。
这种效应叫~。
2、共轭体系的类型:π、π共轭:CH2=CH-CH=CH2 π键和π键链接起来这个π键不一定非是C=C、C=N、N=N……P-π共轭:π键和P轨道连接起来,有重叠,有覆盖:p34Cl 2S22P5ÓÃÓڳɻü类似的含有未共用电子对的O、N、Cl都可以发生P-π共轭,条件是P轨道和π键的P轨道平行。
p34+CH2CH CH2:CH2CH CH2:CH2CH CH3:-p33p32(存在空轨道)σ-π超共轭:σ键和π键连起来σ-P超共轭:σ键和P轨道连起来了(CH3)C3CH3+这里必须是α-H原子发生共轭,这种效应对分子性质的影响比较小,所以叫超共轭,又叫次级共轭,共轭作用的大小,看α-H数目。
所以-CH3 > -CH2R > -CHR2 > -CR2这样就可以解释各种稳定性问题。
例:(CH3)3C > (CH3)2CH > CH3CH2 > CH3(CH3)3C > (CH3)2CH > CH3CH2 > CH3++++也可以解释1、4-,1、2-,加成问题:这种加成和单烯烃亲电加成反应一样,Br σ+先加到双键上,从π键上取得电子,从新杂化形成SP 3σ键,这时有两种可能:CHCH 2CHCH2+BrBrCHCH 2CHCH2CH CH 2CHCH2++p -p ¸²éîÓÐÒº·öH µÄ³¬¸²éî超共轭分子能量没有共轭降的低,所以主选可能(1)动态共轭效应,又因为共轭体系极性是交替存在的,所以Br -可以进攻C 2,也可以进攻C 4,这样就分别有了1、4-和1、2-加成CHCH 2CHCH 2+Br CH CH 2CHCH2CHCH 2CHCH2¸² éî »Ó ³É-Br1、4-,1、2-加成二者比例不同,这是由于速度控制和平衡控制产生的。
