HER2与卵巢上皮性癌现状
HER2蛋白在卵巢上皮性癌中的表达状态及其临床病理意义

【 Ke y wo r d s 】 E p i t h e l i a l o v a i r a n c a r c i n o ma ; HE R 2 ; Hi s t o l o g i c a l s u b t y p e s ; T a r g e t t r e a t m e n t
・
论
著 ・
2 0 1 3年 1月第 1 0卷第 2期
状态 及其临床病理意义
詹 阳 梁 鑫 谷 玉春 朱 力
首 都 医科 大学 附属北 京妇 产 医 院病理 科 , 北 京 1 0 0 0 0 6 【 摘 要】目的 研究 HE R 2在卵 巢 上皮 性 癌 中的表 达情 况 及 临床 病理 特 征 ,探讨 其相 关 性 。 方法 免疫组 化 法 检 测3 2 2例 卵巢 上 皮性 肿瘤 组织 中 HE R 2和雌激 素 受体 ( E R) 、 孕 激素 受体 ( P R) 表 达 状态 ( 其 中 卵巢上 皮性 癌 2 4 2 例, 交界性 上 皮 性肿 瘤 6 5例 , 良性 上皮 性肿 瘤 1 5例 ) 。 结 果 HE R 2在 卵 巢交界 性 肿 瘤及 上 皮性 癌 中的 过表 达 率显 著高 于 良性 肿瘤 , 但前 两 者 问表 达差 异无 统 计 学意 义 ( P>0 . 0 5 ) ; 卵 巢上皮 性 癌 中 H E R 2在激 素受 体 表达 、 组 织 学分 型和组 织 学分 级 的各组 表 达率 中差 异 有 统计 学 意义 ( P<0 . 0 5 ) ; HE R 2在透 明细胞 腺癌 中表 达 率最 高 ( 4 2 . 1 l %) ; H E R 2表 达与 F I GO分 期 、 患者 年龄 、 淋 巴结 转 移 以及 肿瘤 发 生侧 别无 关 ( P >0 . 0 5 ) 。 结 论 HE R 2在 各 型卵巢 上皮 性 癌 中表达不 同 , HE R 2可 能成 为 卵巢 上皮 性癌 , 特别 是透 明细胞 腺 癌 的潜在 治 疗靶 点 。
腺病毒介导Her2/neu siRNA对卵巢癌细胞的生长抑制作用

I bi o um org owt va i n c nc r b i A e a e a n i ust r e ng t nhi t n oft i r h ofo r a a e y sI m di t d de ov r a g t o i
o ai a c rS v ra c n e KOV 3c l sifce y terc mbn t d n vr sv co e oHe2 i NA( et e n - el wa e tdb e o ia e o i e trAd n — r sR s n h n a u t i r h t
A src: jc v T bev eHe2iNA meit d n vrsd wnrg lt He2nu gn n b tat Obet e oo sret rs i h R da d ae o i o — uae r/e e ead e u e
s d h NAi f c n t e c l c c e a d t mo r wt f o a i n c c r S t y te R u e to h e l y l e n u rg o h o v ra a e KOV- e l. e h d T e n 3cl M to s s h
维普资讯
・ 4・ 9
1界时瘟 磊砉 l }
20 0 8年 第 7卷 第 2期
T mor ora o te r V lme , mb r ,u 0 8 u u unl fh l ou Nu e 2 Jn2 0 J Wo d 7
文 章 编 号 : l8 .3 2 (0 8 20 9 .4 6 304 介 导 H r/e R e2n us NA对 卵 巢 癌 细 胞 的生 长 抑 i 制 作 用
MUC4、HER2/neu和CA-125在卵巢上皮性癌中的研究进展

部. 早期病变不易 发现 . 确诊时 3 4的患 子 3和 4长 2 0 / 5o 0 j
展 、 润 和 转 移 关 系密 切 , 就 三 者 在 卵 卵 巢 组 织 中 MU 4表 达 阴 性 或 弱 表 达 , 结转移的敏感 性达 9 %。 ue k 浸 现 C 0 Jrt a等[ 等 z 1 4
巢癌 中的研究 进展综述如下。
1 M UC4
两 者 之 问 差 异 有 显 著 性 ,在 黏 液 性 卵 巢 回顾分析 了 2 1例卵巢癌 患者腹腔 化疗 4 癌中. C MU 4的 表 达 阳 性 率 为 10 , 前 行 二次探 查 术 时的 C .2 0% A 15值 ,发现
11 MU 4的基 因结 构 . C
黏蛋 白 ( C MU 1为 4 % . C 6 为 2 % . 同 时 C 一2 MU ) C 0 MU I 0 A 15小 于或 等 于 1 / L的 中位生 2U m
为 高度糖基 化的大分子糖 蛋 白.覆盖在 MU 4全部表达于 I C 期和 Ⅱ期病例 中 , 其 存 时间为 58年 ,大 于 1 / L的 中位 . 2U m
制细胞凋亡 , 促进 肿 瘤 生长 [。 9 ] 关 .有研究 表 明 .A一2 C 15半衰期在 2 0d 以内者 ,存 活期 明显长 于 2 0d以上者 。 C .2 A 15是 目前最常用的卵巢癌肿瘤 1 MU 4在 卵 巢 癌 中 的研 究 进 展 " . 3 C hu a 3例 i l 3 研 9例卵巢 癌患者 . 以术前 标志物 , 在卵巢癌 的诊断 、 筛查 、 病情监测 C a hn等 用 免疫 组 化 法 检 测 6 卵 Km 等_] 究 9
表皮生长因子受体及HER—2/neu在上皮性卵巢肿瘤中的表达

表皮生长因子受体及HER—2/neu在上皮性卵巢肿瘤中的
表达
陈淑珍;杨湛
【期刊名称】《湖南医科大学学报》
【年(卷),期】1993(018)004
【总页数】3页(P375-377)
【作者】陈淑珍;杨湛
【作者单位】不详;不详
【正文语种】中文
【中图分类】R737.310.3
【相关文献】
1.PTEN和HER-2/neu在上皮性卵巢癌组织中的表达及相关性 [J], 孙理
2.MUC4和HER2/neu在卵巢上皮性癌中的表达及临床意义 [J], 陈莹;易建平;刘海燕;赵洁
3.FAS和HER-2/neu蛋白在卵巢上皮性癌组织中的表达及其相关性研究 [J], 诸海燕;金纬纬;陈志文;郑飞云
4.上皮钙粘附素/连环素复合体在上皮性卵巢肿瘤中的表达及临床意义 [J], 刘鸣;汤春生;张水红;穆玉兰;马金龙
5.上皮性钙粘附素及其mRNA在上皮性卵巢肿瘤中的表达 [J], 刘鸣;汤春生;穆玉兰;马金龙
因版权原因,仅展示原文概要,查看原文内容请购买。
子宫和卵巢腺瘤样瘤的临床病理分析

子宫和卵巢腺瘤样瘤的临床病理分析子宫和卵巢腺瘤样瘤是一种较为常见的妇科恶性肿瘤,主要来源于子宫、卵巢的上皮或间质细胞,具有低度恶性和高度恶性的两种类型。
临床上,病人的症状主要表现为下腹部疼痛、异常阴道出血等。
为了更好地了解该病的临床病理变化,本文对其进行了详细的分析。
首先,对于低恶性腺瘤样瘤,其临床症状较为缓和,大多数病人的病程持续数年之久,且并不会出现显著的恶病质和淋巴转移现象。
其组织学表现为肿瘤细胞密度低,细胞排列较为规则,核分裂象较少,但仍存在不同程度的细胞异型性和轻度的核多形性。
免疫组化学检测结果显示,该类肿瘤细胞常与卵泡刺激素相关蛋白(AMH)、细胞角蛋白等标记物呈阳性反应。
此外,该类病人与健康群体相比,往往有较高的雌激素水平,体内的卵巢功能可能受到抑制。
另一方面,对于高度恶性腺瘤样瘤,其临床症状较为严重,常有腹水、肠梗阻等严重并发症,甚至可以直接侵犯到邻近器官引起相应的不适。
其肿瘤细胞密度高,细胞排列杂乱无序,出现各种程度的核分裂象,同时核多形性严重,细胞异型性高度增强。
免疫组化学检测结果常呈阳性反应的标记物包括ER、PR、HER2等,且该类病人往往与体内的雌激素和孕激素水平无明显相关性。
值得注意的是,子宫和卵巢腺瘤样瘤在临床上淋巴结转移率较低,但远处转移率较高,远处转移部位以肺、肝为主。
通过对该病的病理分析,发现多数病人的肿瘤起源于子宫或卵巢,但也有一部分肿瘤来自于输卵管、乳房等器官。
此外,子宫和卵巢腺瘤样瘤还具有较强的侵袭性和复发性,需要及时进行手术治疗或综合治疗。
总之,针对子宫和卵巢腺瘤样瘤的临床病理变化,需要全面了解其组织学和免疫组化学的特点,可以帮助临床医生更准确地诊断该类恶性肿瘤,提高治疗的准确性和有效性。
同时,预防该病的发生也非常重要,应注意减少卵巢和子宫刺激等因素,加强身体锻炼,保持良好的饮食习惯等。
女性生殖系统肿瘤的分子标志物

女性生殖系统肿瘤的分子标志物女性生殖系统肿瘤是指发生在女性生殖器官(如卵巢、子宫、宫颈和阴道等)的恶性肿瘤。
这些肿瘤的早期诊断对治疗和预后至关重要。
近年来,随着分子生物学技术的进展,人们发现了一些可作为女性生殖系统肿瘤的分子标志物,这些标志物可以帮助医生提高早期诊断率,并进行有效的治疗。
一、卵巢癌的分子标志物卵巢癌是最常见的女性生殖系统恶性肿瘤之一,也是最具侵袭性和致死率较高的恶性肿瘤之一。
目前,CA125已被广泛应用于卵巢癌筛查中。
CA125受体精细化剪接变异(FBOX7和CERK)的检测也对卵巢癌诊断有辅助作用。
此外,某些微小RNA(miRNA)如miRNA-21和miRNA-200家族在卵巢癌中也被认为是潜在的分子标志物。
二、乳腺癌的分子标志物乳腺癌是女性最常见的恶性肿瘤之一。
分子标志物HER2/neu已被广泛应用于乳腺癌筛查和治疗。
HER2/neu阳性乳腺癌患者可以接受靶向治疗,如使用经口给药的单抗药物Trastuzumab。
此外,雌激素受体(ER)和孕激素受体(PR)也是乳腺癌重要的分子标志物。
ER和PR在乳房细胞核内发挥调控作用,并与乳腺癌细胞增殖有关。
检测ER和PR水平有助于指导乳腺癌患者的治疗方案选择。
三、宫颈癌的分子标志物宫颈癌是全球女性生殖系统恶性肿瘤中发病率第四高的恶性肿瘤。
近年来,人们对宫颈癌的早期筛查方法进行了深入研究,其中HPV(人类乳头瘤病毒) DNA检测已成为主要手段之一。
此外,p16和Ki-67也作为宫颈上皮非典型增生、前期病变和宫颈癌的标志物被广泛应用。
p16是抑癌蛋白,其在细胞增殖过程中起着负调控作用。
Ki-67则是一个细胞周期特异性蛋白,主要在细胞分裂和有丝分裂过程中表达。
四、子宫内膜癌的分子标志物子宫内膜癌是女性生殖系统恶性肿瘤中最常见的一种。
目前,尚无特异性的分子标志物用于子宫内膜癌的筛查和诊断。
然而,人们已发现某些基因突变(如PTEN、PIK3CA和CTNNB1)与子宫内膜癌的发生密切相关。
Cancercell为卵巢癌提供新的治疗策略,PARG抑制剂或将为非BRCA突变型高级别浆液...
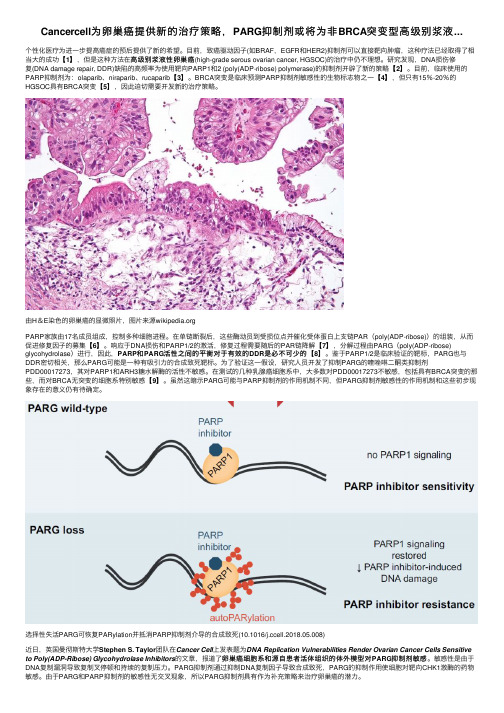
Cancercell为卵巢癌提供新的治疗策略,PARG抑制剂或将为⾮BRCA突变型⾼级别浆液...个性化医疗为进⼀步提⾼癌症的预后提供了新的希望。
⽬前,致癌驱动因⼦(如BRAF,EGFR和HER2)抑制剂可以直接靶向肿瘤,这种疗法已经取得了相⾼级别浆液性卵巢癌(high-grade serous ovarian cancer, HGSOC)的治疗中仍不理想。
研究发现,DNA损伤修当⼤的成功【【1】,但是这种⽅法在⾼级别浆液性卵巢癌【2】。
⽬前,临床使⽤的复(DNA damage repair, DDR)缺陷的⾼频率为使⽤靶向PARP1和2 (poly(ADP-ribose) polymerase)的抑制剂开辟了新的策略【PARP抑制剂为:olaparib、niraparib、rucaparib【3】。
BRCA突变是临床预测PARP抑制剂敏感性的⽣物标志物之⼀【【4】,但只有15%-20%的HGSOC具有BRCA突变【【5】,因此迫切需要开发新的治疗策略。
由H&E染⾊的卵巢癌的显微照⽚,图⽚来源PARP家族由17名成员组成,控制多种细胞进程。
在单链断裂后,这些酶动员到受损位点并催化受体蛋⽩上⽀链PAR(poly(ADP-ribose))的组装,从⽽【6】。
响应于DNA损伤和PARP1/2的激活,修复过程需要随后的PAR链降解【【7】,分解过程由PARG(poly(ADP-ribose)促进修复因⼦的募集【是必不可少的【【8】。
鉴于PARP1/2是临床验证的靶标,PARG也与glycohydrolase)进⾏,因此,PARP和PARG活性之间的平衡对于有效的DDR是必不可少的DDR密切相关,那么PARG可能是⼀种有吸引⼒的合成致死靶标。
为了验证这⼀假设,研究⼈员开发了抑制PARG的喹唑啉⼆酮类抑制剂PDD00017273,其对PARP1和ARH3糖⽔解酶的活性不敏感。
在测试的⼏种乳腺癌细胞系中,⼤多数对PDD00017273不敏感,包括具有BRCA突变的那【9】。
宫颈癌靶向治疗及疗效监测最新进展2024

宫颈癌靶向治疗及疗效监测愚新进展2024德曲妥珠单抗在HER2-表达实体瘤患者中的有效性和安全性研究:DESTINY-PanTumor02研究宫颈癌、子宫内膜癌和卵巢癌队列生物标志物和亚组分析目的:德曲妥珠单抗(T-DXd)已证明对表达HER2的乳腺癌和胃癌患者具有显着的生存益处。
在DESTINY-Pan Tumor02研究中,T-DXd在表达HER2的肿瘤(包括妇科肿瘤)中证明了具有临床意义的缓解率、无进展生存率和总生存率。
本次报告了子宫内膜癌、宫颈癌和卵巢癌队列的生物标志物和亚组分析。
方法这项开放标签II期研究NCT04482309评估了T-DXd:5.4 mg/kg Q3W)在HER2表达阳性(免疫组化IHC局部3+/2+i经过�1次全身治疗或未经替代治疗的局部晚期/转移性宫颈癌患者。
主要终点是研究者评估的确认客观缓解率(ORR)o子宫内膜癌、宫颈癌和卵巢癌队列的结果(包括确认的HER2IHC状态)既往已有报道。
该分析显示了与各个妇科队列相关的生物标志物组的ORR。
评估的生物标志物是在基线循环肿瘤DNA中检测到的BRCA1或BRCA2,同源重组复基因和错配修复突变(BRCA1/2m、HRRm,MMRm),I H C检测到的程序性死亡配体1(P D-L1) (SP263抗体;�1%个阳性免疫细胞)和血清肿瘤标志物C A-125。
还报告了每个妇科队列中通过既往治疗和通过使用既往HER2和拓扑异构酶I(TOP1)抑制剂治疗的ORR。
结果:在数据截止时(2023年6月),120例子宫内膜癌、宫颈癌和卵巢癌患者接受了治疗[中位随访19.94{0.8~31.1 i 12.60(0.9~31.0入13.13 (0.7~30.6)个月]。
总体而言,80.8%的患者既往接受过两种以上治疗。
在表达HER2的人群中,卵巢癌队列中BRCA1/2m和HRRm的发生率分别为18.4%(7/38)和21%(8/38);子宫内膜癌队列中MMRm的发生率为7.5%(3/40);子宫内膜癌和宫颈癌队列中PD-L1阳性的发生率分别为50%(19/38)和59%(23/391在120例患者中,54例(45.0%)发生了2::3级药物相关不良事件,13例(10.8%)发生了治疗相关的间质性肺病/肺炎(至2级12例,5级1例L结论:T-DXd在HER2表达阳性的妇科肿瘤患者中显示出临床意义的O RR,与既往治疗线数、既往使用HER2或TOP1抑制剂治疗、是否存在个体队列相关生物标志物无关。
2024卵巢癌的基本介绍及病理分型

2024卵巢癌的基本介绍及病理分型在我国,卵巢癌年发病率居女性生殖系统肿瘤第3位,位于子宫颈癌和子宫体恶性肿瘤之后,呈逐年上升的趋势,而病死率位于女性生殖道恶性肿瘤之首。
卵巢恶性肿瘤包括多种病理类型,其中最常见的是上皮性癌,约占卵巢恶性肿瘤的80%,其次是恶性生殖细胞肿瘤和性索间质肿瘤,各约占10%和5%,本指南主要针对卵巢上皮性癌和恶性生殖细胞肿瘤。
卵巢深处盆腔,卵巢病变处于早期时常无特异临床症状,因出现症状就诊时,70%的患者已处于晚期。
卵巢癌具有一定的遗传性和家族聚集特征,目前已知与卵巢癌相关的遗传易感基因中以乳腺癌易感基因(BRCA影响最为显著。
BR约有20个,其CAl和BRCA2胚系突变携带者在一生之中发生卵巢癌的累积风险分别达54%和23%,是卵巢癌的高危人群。
对于BRCA1/2胚系突变携带者,推荐从30-35岁起开始定期行盆腔检查、血CA125和经阴道超声的联合筛查。
止匕外,还有林奇综合征、利-弗劳梅尼综合征家族的女性都是卵巢恶性肿瘤的高危人群,需要检测的基因还包括ATM、RAD51C x RAD51D、MLH1、MSH2、MSH6、PSM2、EPCAM x STK11等。
卵巢上皮癌多见于绝经后女性。
由于卵巢深居盆腔,卵巢上皮性癌早期症状不明显,往往是非特异性症状,难以早期诊断,约2/3的卵巢上皮性癌患者诊断时已是晚期。
晚期时主要因肿块增大或盆腹腔积液而出现相应症状,表现为下腹不适、腹胀、食欲下降等,部分患者表现为短期内腹围迅速增大,伴有乏力、消瘦等症状。
也可因肿块压迫出现大小便次数增多的症状。
出现胸腔积液者可有气短.难以平卧等表现。
卵巢恶性生殖细胞肿瘤常见于年轻女性,临床表现与上皮癌有所不同,早期即出现症状,除腹部包块腹胀外,常可因肿瘤内出血或坏死感染而出现发热,或因肿瘤扭转.肿瘤破裂等而出现急腹症的症状。
约60%~70%的患者就诊时属早期。
组织病理组织学检查是卵巢癌诊断的金标准。
上皮性卵巢癌的免疫治疗现状与问题

实用妇产科杂志2020年2月第36卷第2期Journal of Practical Obstetrics and Gynecology2020Feb.Vol.36,No.2・93・文章编号:1003-6946(2020)02-0093-03上皮性卵巢癌的免疫治疗现状与问题宗丽菊,向阳(中国医学科学院北京协和医院肿瘤妇科中心,北京100730)中图分类号:R737.31文献标志码:B卵巢癌是病死率最高的妇科恶性肿瘤,全球每年约20万新发病例,超过15万的死亡病例。
上皮性卵巢癌是最常见的病理类型,主要治疗方式为肿瘤细胞减灭术和术后化疗。
然而,大部分上皮性卵巢癌在诊断时已为晚期,并且70%-80%患者复发,其5年生存率不足50%。
因此,上皮性卵巢癌患者,尤其是化疗耐药的患者,亟需新的治疗手段。
近年来,免疫治疗,尤其是免疫检查点抑制剂,在肿瘤领域取得了突破性的进展。
免疫治疗被写入2019年美国国家综合癌症网络(NCCN)卵巢癌临床实践指南,PD-1单克隆抗体Pembrolizumab(派姆单抗)可用于高度微卫星不稳定的或错配修复基因缺陷(microsatellite instability high/deficient mismatch repair,MSI-H/dMMR)的复发上皮性卵巢癌的治疗。
上皮性卵巢癌的免疫治疗策略主要包括免疫检查点抑制剂、肿瘤疫苗和过继细胞免疫疗法⑴□1免疫检查点抑制剂1.1原理及应用基础免疫检查点如CTLA4、PD-1及配体PD-L1,是人体免疫系统中抑制性的信号,通过调节外周组织中免疫反应的持续性和强度避免组织损伤,并参与维持对自身抗原的耐受。
在肿瘤免疫微环境中,PD-1/PD-L1可抑制T细胞的活化、抑制T细胞的功能,促进肿瘤免疫逃逸。
免疫检查点抑制剂可以通过阻断免疫检查点的功能,从而抑制肿瘤细胞免疫逃逸,调动自身免疫系统消除肿瘤。
多项研究表明,上皮性卵巢癌中免疫分子与预后有关,如肿瘤细胞中PD-L1的表达与上皮性卵巢癌的不良预后相关,这是上皮性卵巢癌免疫治疗的应用基础E o1.2治疗方案及疗效1.2.1单独用药一项I期临床试验(KEYNOTE-028)中,26例PD-L1阳性的复发上皮性卵巢癌患者接受Pembrolizumab的单药治疗,按照10mg/kg、每2周1次的剂量静脉用药,客观缓解率(objective response rate,ORR)为11.5%⑶。
肿瘤资讯卵巢癌基因变异与靶向药物

肿瘤资讯卵巢癌基因变异与靶向药物1卵巢癌概述卵巢癌为最常见的妇科恶性肿瘤之一。
中国2015年预计的卵巢癌发病人数为52,100例,位于妇科恶性肿瘤第三位;死亡人数为22,500例,位于妇科恶性肿瘤第二位。
目前卵巢癌的治疗还是以手术和化疗为主,但对于复发和难治性卵巢癌尚无很好的治疗方案。
卵巢癌中有很多基因存在变异,针对突变基因的靶向治疗可能为卵巢癌患者带来更多益处。
2卵巢癌基因变异概况1. 浆液性卵巢癌约90%的卵巢癌为上皮性卵巢癌,其余为卵巢生殖细胞肿瘤,性索间质肿瘤等非上皮性肿瘤。
上皮性卵巢癌包括浆液性卵巢癌,粘液性卵巢癌,透明细胞性卵巢癌和子宫内膜样卵巢癌。
浆液性卵巢癌在上皮性卵巢癌中约占70%,其中大于90%为高级别浆液性腺癌(high-grade serous ovarian cancer, HGSOC)。
TCGA(The Cancer GenomeAtlas)对489名HGSOC患者进行基因分析发现约96%的患者存在TP53突变[1]。
有文献将TP53的突变归为3类:明确致癌突变、功能缺失突变和意义未明突变[2]。
按此划分在HGSOC中TP53的明确致癌突变约占21%,意义未明突变约占59%。
此外,TCGA 的数据显示还有约22%的病例存在BRCA1/2突变。
BRCA突变与同源重组修复缺陷(homologous recombination deficient, HRD)有关,文献报道BRCA突变会导致约一半的细胞出现HRD。
其他同源重组修复(homologous recombination,HR)通路相关基因也在HGSOC中存在变异,如EMSY(8%),PTEN (7%),RAD51C(3%),ATM/ATR(2%)。
总的来说在HGSOC 有约50%的患者存在HR通路的改变。
除了基因突变,在HGSOC患者中还存在大量的DNA拷贝数变异。
TCGA数据表明有超过一半的HGSOC患者存在DNA拷贝数异常,涉及到的基因有CCNE1,MYC,MDS1等。
Her-2资料

1.Her-2结构:Her2位于染色体17q21,编码分子量为185KD的跨膜糖蛋白,由胞内酪氨酸激酶结构域、跨膜区和胞外结构域(extraeellular domain,ECD)三部分组成,是具有蛋白酪氨酸激酶(protein tyrosine kinace,PTK)活性的跨膜蛋白,属于表皮生长因子受体家族的成员。
2.Her-2功能:目前还没有发现能与Her2直接结合的配体,但HER-2与其他受体结合成异二聚体后能发挥信号转导功能,与不含Her2的二聚体相比其信号更强;另一方面,Her2的异二聚体使EGFR(表皮生长因子受体)在细胞膜过表达,加速了细胞的增殖,导致肿瘤形成和生长加快。
HER-2 + 其他受体→异二聚体→发挥信号转导功能HER2的异二聚体使EGFR(表皮生长因子受体)在细胞膜过表达→细胞的增殖↑→肿瘤形成和生长↑3.Her2分子的检测目前一般采用免疫组织化学(IHC)检测Her2受体蛋白过表达,应用荧光原位杂交(FISH)和显色原位杂交(CISH)法检测Her2基因扩增的水平。
4.Her2与肿瘤发生及发展(1)文献一:Her2受体胞内区有PTK活性,自身也具有若干酪氨酸残基磷酸化位点。
当生长因子与Herl、Her3或Her4结合后,诱导蛋白膜外区构象改变,与Her2受体分子形成异二聚体,使细胞膜内侧的活性显著增加,导致受体分子Tyr互相催化发生自身磷酸化。
进而引发瀑布式的连锁反应,信号转导经细胞膜和细胞间质至细胞核,激活基因,促进有丝分裂等,从而诱发肿瘤。
较多的研究发现Her2原癌基因通过其介导的主要信号通路如Ras—Raf—Mek—MAPK(丝裂原活化蛋白激酶通路、P13K—Akt(磷脂酰肌醇一3一激酶)通路等使细胞增殖周期缩短,恶性表现增强以及抗凋亡。
(2)文献二:HER2与肿瘤的发生及发展HER2基因扩增与增加细胞分化、迁移、肿瘤侵袭、局部及远处转移、加快血管发生和减少细胞凋亡密切相关。
卵巢癌的临床研究进展

卵巢癌的临床研究进展卵巢癌是女性生殖系统中最常见且致命的恶性肿瘤之一。
由于其早期症状不明显,多数患者确诊时已处于晚期,治疗难度大,预后较差。
然而,随着医学研究的不断深入,卵巢癌的临床研究在诊断、治疗和预防等方面都取得了显著的进展。
一、诊断方面的进展早期准确的诊断对于卵巢癌的治疗和预后至关重要。
传统的诊断方法包括妇科检查、超声检查、血清肿瘤标志物检测(如 CA125)等。
近年来,一些新的诊断技术和标志物逐渐崭露头角。
液体活检技术是一项具有潜力的诊断方法。
通过检测血液中的循环肿瘤细胞(CTC)、循环肿瘤 DNA(ctDNA)等,可以更早地发现肿瘤的存在,并监测疾病的进展和治疗效果。
多组学分析技术的应用也为卵巢癌的诊断提供了更全面的信息。
通过整合基因组学、转录组学、蛋白质组学和代谢组学等多方面的数据,可以更深入地了解卵巢癌的发生发展机制,发现新的诊断标志物和治疗靶点。
此外,影像学技术的不断改进,如增强磁共振成像(MRI)、正电子发射断层扫描(PET)等,提高了对卵巢癌的定位和分期的准确性。
二、治疗方面的进展(一)手术治疗手术仍然是卵巢癌治疗的重要手段。
随着手术技术的不断提高,早期卵巢癌患者可以接受保留生育功能的手术,在切除肿瘤的同时,最大程度地保留患者的生育能力。
对于晚期卵巢癌患者,肿瘤细胞减灭术的标准不断提高,力求达到无肉眼残留病灶,以提高患者的生存率。
(二)化疗化疗在卵巢癌的治疗中起着关键作用。
传统的化疗药物如紫杉醇和铂类药物仍然是一线治疗的主要选择。
然而,随着对化疗耐药机制的研究深入,新的化疗方案和药物组合不断涌现。
例如,脂质体阿霉素、拓扑替康等药物在复发性卵巢癌的治疗中显示出一定的疗效。
(三)靶向治疗靶向治疗是近年来卵巢癌治疗的研究热点。
抗血管生成药物如贝伐珠单抗,可以抑制肿瘤血管的生成,从而抑制肿瘤的生长和转移。
PARP 抑制剂(如奥拉帕利、尼拉帕利等)对于存在 BRCA 基因突变的卵巢癌患者具有显著的疗效,显著延长了患者的无进展生存期和总生存期。
her2妇科肿瘤病理评价标准

HER2(人表皮生长因子受体2)在妇科肿瘤的病理评价中是一个重要的指标。
HER2阳性意味着肿瘤细胞表面存在过多的HER2受体,这可能导致肿瘤的快速生长和扩散。
HER2阳性与HER2阴性的妇科肿瘤患者在治疗方案和预后方面可能存在显著差异。
HER2的病理评价标准主要基于免疫组化(IHC)和荧光原位杂交(FISH)两种方法:
1. 免疫组化(IHC):这是一种常用的检测HER2蛋白表达的方法。
通过使用特异性抗HER2抗体,可以在组织切片上检测HER2蛋白的存在和表达水平。
根据染色强度和肿瘤细胞中阳性细胞的比例,可以将结果分为0到3+级。
- 0和1+级:HER2阴性
- 2+级:不确定结果,需要进一步进行FISH检测
- 3+级:HER2阳性
2. 荧光原位杂交(FISH):这是一种用于检测HER2基因扩增的方法。
通过使用荧光标记的HER2探针,可以观察到肿瘤细胞中HER2基因的数量。
根据荧光信号的数量和比例,可以将结果分为阳性和阴性。
- HER2阳性:HER2基因扩增,通常定义为HER2基因与CEP17(一个正常细胞染色体)的比值大于等于2.0。
- HER2阴性:HER2基因未扩增,或者比值低于2.0。
在确定HER2状态时,通常采用IHC作为初筛方法,而FISH则用于确认阳性结果。
这两项技术通常结合使用,以确保准确性和可靠性。
总之,HER2的病理评价对于妇科肿瘤患者的治疗方案选择至关重要。
对于HER2阳性的患者,抗HER2治疗可能是一种有效的治疗手段,如曲妥珠单抗(Trastuzumab)等。
Her-2资料

1.Her-2结构:Her2位于染色体17q21,编码分子量为185KD的跨膜糖蛋白,由胞内酪氨酸激酶结构域、跨膜区和胞外结构域(extraeellular domain,ECD)三部分组成,是具有蛋白酪氨酸激酶(protein tyrosine kinace,PTK)活性的跨膜蛋白,属于表皮生长因子受体家族的成员。
2.Her-2功能:目前还没有发现能与Her2直接结合的配体,但HER-2与其他受体结合成异二聚体后能发挥信号转导功能,与不含Her2的二聚体相比其信号更强;另一方面,Her2的异二聚体使EGFR(表皮生长因子受体)在细胞膜过表达,加速了细胞的增殖,导致肿瘤形成和生长加快。
HER-2 + 其他受体→异二聚体→发挥信号转导功能HER2的异二聚体使EGFR(表皮生长因子受体)在细胞膜过表达→细胞的增殖↑→肿瘤形成和生长↑3.Her2分子的检测目前一般采用免疫组织化学(IHC)检测Her2受体蛋白过表达,应用荧光原位杂交(FISH)和显色原位杂交(CISH)法检测Her2基因扩增的水平。
4.Her2与肿瘤发生及发展(1)文献一:Her2受体胞内区有PTK活性,自身也具有若干酪氨酸残基磷酸化位点。
当生长因子与Herl、Her3或Her4结合后,诱导蛋白膜外区构象改变,与Her2受体分子形成异二聚体,使细胞膜内侧的活性显著增加,导致受体分子Tyr互相催化发生自身磷酸化。
进而引发瀑布式的连锁反应,信号转导经细胞膜和细胞间质至细胞核,激活基因,促进有丝分裂等,从而诱发肿瘤。
较多的研究发现Her2原癌基因通过其介导的主要信号通路如Ras—Raf—Mek—MAPK(丝裂原活化蛋白激酶通路、P13K—Akt(磷脂酰肌醇一3一激酶)通路等使细胞增殖周期缩短,恶性表现增强以及抗凋亡。
(2)文献二:HER2与肿瘤的发生及发展HER2基因扩增与增加细胞分化、迁移、肿瘤侵袭、局部及远处转移、加快血管发生和减少细胞凋亡密切相关。
乳腺癌HER-2表达与临床病理相关性分析

新疆医科大学硕士学位论文乳腺癌HER-2表达与临床病理相关性分析姓名:***申请学位级别:硕士专业:外科学指导教师:***2010-04摘 要乳腺癌Her-2表达与临床病理相关性分析研究生:李敏导师:郭丽英教授摘要目的:本文通过统计804例乳腺癌患者人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2),探讨乳腺癌Her-2表达与临床病理特征的相关性及临床意义。
方法:收集1995年1月-2009年12月于我院进行治疗,病理证实为原发性乳腺癌,Her-2资料完整的女性患者共804例。
采用回顾性分析的方法,统计804例乳腺癌患Her-2的表达,应用秩和检验及秩相关分析法,分析Her-2与多种相关因素,包括乳腺癌原发肿瘤的大小、淋巴结转移、病理分级、病理类型、分期、年龄、月经状态、雌激素受体ER、孕激素受体PR等临床病理特征相关性。
结果: 乳腺癌组织中Her-2表达在肿块大小、TNM分期分组间有统计学差异(P<0.05)。
以上结果进一步行秩相关检验,得出乳腺癌肿块大小、TNM分期、预后均与Her-2表达呈正相关。
Her-2表达在淋巴结转移数目、ER、PR不同有统计学差异(P<0.05)。
但进一步行秩相关检验无明显相关性。
Her-2表达不同年龄、月经状态、组织学分级与Her-2均无统计学差异(P>0.05)。
Her-2表达不同无瘤及复发转移有统计学差异(P<0.05)。
结论:Her-2基因表达在肿瘤大小、临床TNM分期、预后有关,通过Her-2检测能有效指导病情评估及判断预后。
Her-2表达在不同ER、PR表达中无明显相关性, 但Her-2过表达时ER、PR表达较弱。
Her-2与ER、PR两者的联合检测有利于乳腺癌的治疗方案的选择。
Her-2阳性表达、淋巴结无转移术后应给予加强辅助治疗。
关键词: 乳腺癌; 临床病理;Her-2基因表达新疆医科大学医学硕士学位论文Study on the relationship between Breast cancer Her-2 expression and clinical pathology featuresPostgraduate: Li Min Supervisor: Prof.Guo Li-yingAbstractObjective: In our experiment, the expression of Her-2 in breast cancer tissue of 804 cases were studied to analyze its correlation with tumor clinical pathology features and evaluate prognosis. Materials and methods: Collect the clinical data of 804 breast cancer cases who has treated in our hospital and final diagnosis is primary breast cancer by pathology result since 1995 to 2009. The correlation-ship of these three kinds of oncogenes with tumor biological behaviour such as the size, ER, PRl, ympho node metastasis、patho-histological type and rank, stage were studied in Kruskal Wallis test of statistics and analyzed in grade related data method. The correlation-ship among Her-2 was also studied in order to confirm correlation-ship of Her-2 with their clinical pathology features in identical breast cancer tissue.Result:Breast cancer specimens were positive for Her-2 ,which correlated with the factors such as TNM stage , prognosis and tumor size(P <0.05).norelated with hormone receptor status (ER、PR) patho-histological type and rank、lymphonodes metastasis、location、age、menstruate(P<0.05)。
PAX8、WT—1、HER2在不同转移方式的晚期卵巢上皮性癌中的差异表达

PAX8、WT—1、HER2在不同转移方式的晚期卵巢上皮性癌中的差异表达目的:探讨PAX8、WT-1、HER2在不同转移方式的晚期卵巢上皮性癌中的表达差异,为临床治疗提供一定的理论基础。
方法:收集临床样本,按照转移方式分为淋巴结转移组1例、混合转移组14例和盆腹腔转移组5例。
采用实时定量荧光PCR方法检测PAX8、WT-1、HER2在20例不同转移方式的晚期卵巢上皮性癌中的相对表达量。
结果:PAX8、WT-1、HER2在20例患者中均有表达;混合转移组PAX8、WT-1、HER2基因表达高于盆腹腔转移组。
结论:PAX8、WT-1、HER2基因的表达可能与肿瘤的转移方式有关,可能成为提示预后的基因指标并对临床有一定提示作用,但仍需扩大样本进一步验证。
卵巢上皮性癌是全球致死率最高的妇科恶性肿瘤之一,多见于中老年妇女,目前手术及化疗是其一线治疗方案。
尽管手术技术不断提高,化疗药物不断更新,卵巢上皮性癌患者的预后却仍未得到显著改善,原因主要是卵巢的解剖学结构。
卵巢癌起病隐匿,早期症状不明显,70%~80%的患者确诊时已是晚期,而晚期病例往往缺乏有效的治疗手段,出现转移和复发是其死亡的主要原因[1]。
近年来研究发现这与卵巢上皮性癌的异质性有关,异质性在临床上的体现主要是:即使是相同组织学类型的晚期卵巢上皮性癌,转移途径却截然不同,如部分病例以盆腹腔广泛播散转移为主,淋巴结无转移;部分病例已出现广泛的淋巴结转移,但盆腹腔无广泛的播散灶;另一些患者盆腹腔及淋巴结均可见广泛的肿瘤转移。
有研究发现PAX8、WT-1、HER2三种基因与卵巢上皮性癌的发生、发展、浸润和转移密切相关,本文旨在探讨PAX8、WT-1、HER2在不同转移类型的晚期卵巢上皮性癌中的表达含量的差异,从而为临床的诊断、治疗、预后评估提供一定的理论基础。
1 资料与方法1.1 一般资料收集北京大学第三医院临床病理诊断为Ⅲ期和Ⅳ期的20例卵巢上皮性癌患者的组织标本,并将其分为三组:其中仅1例患者只出现淋巴结转移,病灶局限在盆腔,无腹腔转移(淋巴结转移组);14例患者盆腹腔和淋巴结均有转移(混合转移组);5例患者盆腹腔广泛转移,而淋巴结转移为阴性(盆腹腔转移组)。
her2低表达定义_解释说明

her2低表达定义解释说明1. 引言1.1 概述引言部分旨在介绍文章的主题和重要性。
本文将探讨her2低表达的定义以及其在临床应用中的意义。
HER2(人类表皮生长因子受体-2)是一种膜受体,在多种肿瘤类型中起着关键的作用。
然而,对于her2表达水平较低的患者,我们需要更深入地了解其定义、机制及临床意义。
1.2 文章结构本文共分为五个部分。
除了引言外,还包括:her2低表达的定义、her2低表达的原因和机制、her2低表达在临床应用中的意义以及结论和展望。
1.3 目的本文旨在系统地探究并阐述her2低表达的相关问题,并提供临床上对于her2低表达患者处理和治疗策略方面的指导。
通过这篇长文,读者将能够全面了解her2低表达在乳腺癌等肿瘤类型中所扮演的角色,并为进一步研究和开发相应治疗方法提供新思路。
以上是“1. 引言”部分内容,旨在概述文章主题的重要性和结构,并明确本文的目标。
2. her2低表达的定义:2.1 her2基因及其作用:her2即人类表皮生长因子受体2(human epidermal growth factor receptor type 2),是一种细胞膜上的受体酪氨酸激酶,属于表皮生长因子受体家族。
her2的主要功能是参与细胞增殖、分化和存活等生物学过程,从而对肿瘤的形成和发展起着重要作用。
2.2 什么是her2低表达:Her2低表达指的是在某个特定组织或细胞中,her2基因的表达水平较低。
通常使用免疫组化技术来评估her2在肿瘤细胞膜上的表达情况。
根据国际癌症研究联合会(International Cancer Research Federation)制定的标准,当肿瘤组织中her2蛋白的免疫组化得分小于等于1+时,可以判断为her2低表达。
2.3 关于her2低表达的意义和影响:her2低表达通常与乳腺癌及其他类型肿瘤相关。
对于乳腺癌来说,her2低表达常常与预后较好的情况相关,患者的生存率相对较高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卵巢上皮性癌病死率居女性生殖肿瘤首位,目前各种传统治疗方法效果不显,处于“瓶颈”期,需要新的治疗途径来改善患者的长期生存率和清除耐药肿瘤细胞,个体化靶向治疗愈显重要。
HER2原癌基因通过扩增或转录异常而过表达,也可通过基因突变被激活,与多种上皮细胞起源的肿瘤发生关系密切,为抗肿瘤治疗提供了理想靶点。
近年来对HER2蛋白在卵巢上皮性癌中的过度表达及其意义成为临床与病理学关注的热点。
1HER2的概述HER2/neu/erbB2(human epidermal growth factor receptor-2)是一种原癌基因,属表皮生长因子受体(epidermal growth factor receptor,EGFR)家族成员之一,胞内区具有内在酪氨酸激酶活性,且含自身酪氨酸磷酸化位点[1],同属于受体酪氨酸激酶(RTK)超家族。
HER2主要在胚胎时开始表达,成年后在少数正常组织中低表达或不表达。
人类该基因定位于17q21,编码产物为185kD的跨膜糖蛋白p185。
当细胞表面HER2受体达到一定密度时,形成的同源二聚体或多聚体才能引起持续活化而无需配体结合[2],从而使得细胞无限生长和癌基因转化。
可溶性配体,如EGF和转化生长因子α(TGF-α)等与EGFR家族其他成员结合后,可导致受体形成同源二聚体或异源二聚体。
HER2蛋白是异源二聚体的首选伴侣分子,且异源二聚体介导的细胞增值信号比同源二聚体更强。
目前发现在配体或抗体作用下,细胞膜上对应RTK受体发生二聚体化(首选结合HER2蛋白),激活胞内酪氨酸激酶,同时HER2蛋白自身酪氨酸磷酸化,被下游一系列信号蛋白识别并特异结合,激活信号级联反应,最终使核内早期反应基因如c-fos、c-jun等转录水平增加,引起细胞增殖、分化、迁移及肿瘤形成[3]。
EGFR家族成员也可以通过非配体依赖机制被激活,包括被其他酪氨酸激酶受体、G-蛋白偶联受体和粘连蛋白等激活[4]。
受体二聚体化可激活TPK活性,使受体羧基端酪氨酸残基发生自身磷酸化,从而启动一系列信号转导通路(包括MAPK和PI3K-Akt通路等),介导细胞的增殖、分化、抗凋亡等过程。
HER3缺少细胞内酪氨酸激酶活性,HER2-HER3二聚作用导致酪氨酸激酶磷酸化,从而激活细胞内的信号通路[5],所以近期的研究结果将检测HER3作为HER2的相关因子。
HER2控制细胞增殖和能动性,其突变和扩增已被发现和许多肿瘤相关,如乳腺癌、卵巢癌、肺癌、前列腺癌和结肠癌[6]。
在多种恶性肿瘤组织中存在着扩增和(或)HER2蛋白的高表达状态,而HER2蛋白表达与否与肿瘤的不良预后有关,也与肿瘤对化疗、生物治疗的敏感性呈明显的负相关[7-10]。
其过度表达的肿瘤细胞对化疗不敏感;它参与了抑制细胞凋亡,促进肿瘤细胞存活;上调血管内皮生长因子(VEGF),促进肿瘤新生血管生成;增加肿瘤细胞的侵袭力,破坏机体组织抗侵袭屏障等。
在一些研究HER2过度表达已与进展期、分化不良、抗化疗和短生存率的肿瘤相关联[11]。
Villa-Moruzzi[12]研究发现,HER2调控的细胞能动性的酪氨酸激酶包括PTPN12、ERK5和FAK,这为HER2与细胞能动机制复杂的相关理论描述了新的方面。
因此,HER2是肿瘤免疫治疗研究的一个重要靶分子。
这些基础研究为以HER2为靶向的肿瘤治疗和针对其信号转导通路的信号转导干预治疗提供了理论基础和实验依据。
目前最常见的治疗方式是,单克隆抗体和酪氨酸激酶抑制剂。
2HER2表达与卵巢上皮性癌尽管HER2在卵巢上皮性癌中的具体作用还不十分清楚[13]。
但HER2由于在卵巢上皮性癌中的过度表达及其临床治疗意义成为临床与病理学关注的热点。
多数使用的免疫组化方法表明,HER2在卵巢上皮性癌HER2与卵巢上皮性癌研究现状詹阳朱力▲首都医科大学附属北京妇产医院病理科,北京100006[摘要]HER2在多种肿瘤中过表达和(或)突变,并与其发生发展及预后密切相关。
卵巢上皮性癌病死率居女性生殖肿瘤首位,目前传统治疗效果不佳。
本文对卵巢上皮性癌中HER2表达,以及针对其靶向的肿瘤治疗研究进行综述。
[关键词]HER2;卵巢上皮性癌;靶向治疗[中图分类号]R737[文献标识码]A[文章编号]1673-7210(2012)12(c)-0060-04Research status in HER2and epithelial ovarian carcinomaZHAN Yang ZHU Li▲Department of Pathology,Beijing Obstetrics Gynecology Hospital Affiliated to Capital Medical University,Beijing100006, China[Abstract]HER2is an overexpression and/or mutation in a variety of human tumors,and related with their occurrence,de-velopment and prognosis.Epithelial ovarian carcinoma is the leading cause of death from the female genital tumors,and the traditional therapies are less effective.Here,author reviews the HER2overexpression and related targeted cancer therapy research in epithelial ovarian carcinoma.[Key words]HER2;Epithelial ovarian carcinoma;Target treatment[基金项目]首都医科大学附属北京妇产医院科研基金资助项目(200903)。
▲通讯作者60中国医药导报CHINA MEDICAL HERALD中蛋白表达相对较低,多数为“1+”,且结论一直都不相一致。
近年来大宗病例研究结果总结,范围在5%~35%(表1)[14-22]。
HER2在卵巢上皮性癌中表达结果差异大的原因除了可能与不同实验室、种族、肿瘤临床病理分期评定标准、HER2阳性评定标准以及小样本量等相关,另外可能与HER2在众多病理类型的卵巢上皮性癌中表达有差异相关[23]。
部分研究认为透明细胞腺癌中HER2的表达较高,但又有研究否定了这一结果。
尽管研究结果的差异,多数研究表明其临床分期越高,表达越高[17,20,24-27]。
其中大多数研究认为HER2高表达患者5年生存率低,HER2是独立的不良预后因子[15,27]。
HER2基因扩增的比例也不高,约在10%(表1)[15,20,28-29]。
部分研究显示HER2主要表达于卵巢原发性黏液腺癌[30],而Tan[31]研究结果显示,卵巢透明细胞癌中14%病例具有HER2基因扩增。
而Mcalpine等[13]研究显示,HER2在黏液腺癌和交界性黏液性囊腺瘤中具有相似的基因扩增(18%)。
随着实验技术的提高,利用qRT-PCR方法HER2mRNA水平也得到了检测[32]。
在最近的489例卵巢上皮性癌中,HER2只在3.1%的病例中高度扩增,7%的病例中度扩增,HER2拷贝数和mRNA表达比值为0.59[33]。
关于HER2卵巢上皮性癌中基因突变的研究较少,浆液性腺癌中突变率为0.5%~4.0%[15,34-35],且突变位点重复率差。
Anglesio等[34]的研究显示6%卵巢交界性浆液性肿瘤HER2有突变,并证实,HER2在卵巢交界性浆液性肿瘤中,是继KRAS和BRAF突变之后第3个最常见突变的基因。
3以HER2蛋白为靶点的抗卵巢上皮性癌治疗药物及进展针对HER2蛋白的药物主要有:抗HER2蛋白抗体、肽疫苗和酪氨酸激酶抑制剂等。
3.1抗HER2蛋白抗体曲妥珠单抗(赫赛汀)Trastuzumab(Herceptin)是一种重组DNA衍生的人源化单克隆抗体,选择性的作用于人表皮生长因子受体-2(HER2)的细胞外部位。
此抗体属IgG1型,含人的框架区,及能与HER2结合的鼠抗-p185HER2抗体的互补决定区。
它是针对HER2受体的高纯度重组DNA衍生的人源化单克隆抗体,由美国旧金山基因技术公司和罗氏药厂联合研究和生产,1998年被美国食品和药品管理局(FDA)批准上市,目前主要用于治疗有HER2基因扩增和过表达的乳腺癌患者[12]。
近年来的研究显示,它的抑瘤机制可能为以下几种:①通过空间位阻效应阻碍异二聚体形成,下调HER2受体表达;②使G0/G1期细胞增加,进入S期的细胞减少,同时上调细胞周期蛋白依赖性激酶CDK抑制剂-p27的表达,造成细胞周期阻滞,诱导细胞凋亡;③下调血管内皮生长因子VEGF,抑制heregulin介导的血管形成及肿瘤细胞迁移、侵袭;④介导AuDCC和补体依赖的细胞毒作用CDC,启动体内天然免疫细胞杀伤肿瘤[36]。
曲妥珠单抗在HER2高表达的乳腺癌中单独或联合用药有效已被认可。
针对HER2的单克隆抗体曲妥珠单抗在卵巢上皮性癌化疗中的应用已进入Ⅱ期临床试验阶段。
临床效果还未进行广泛深入研究,部分研究显示单独使用Herceptin治疗复发性卵巢上皮性癌效果有限[26]。
帕妥珠单抗(Pertuzumab)是一种重组的单克隆抗体,与HER2受体胞外结构域Ⅱ区结合,抑制二聚体的形成,抑制受体介导的信号转导通路。
临床中帕妥珠单抗重要用于乳腺癌的治疗,其结果显示50%的HER2阳性乳腺癌患者受益于帕妥珠单抗和曲妥珠单抗的组合[37]。
在卵巢上皮性癌中,帕妥珠单抗比其他HER2靶向药物研究更广泛,包括帕妥珠单抗单药治疗的试验,以及帕妥珠单抗与其他药物组合的试验。
在帕妥珠单抗单独地使用于二期进展性难治型卵巢上皮性癌的临床试验中[38],获得了4.3%患者部分有效,6.8%的患者在6个月以上病情稳定,14.5%的患者血CA125降低。
而且经过部分患者活检ELISA检测磷酸化HER2(pHER2)结果显示,pHER2阳性患者的无进展生存期平均为20.9周,而pHER2阴性患者无进展生存期只有5.8周(未检测pHER2状态的为9.1周)。
在帕妥珠单抗与吉西他滨联合治疗铂类耐药的进展期卵巢上皮性癌患者,其反应率(13.8%)较单独使用吉西他滨(4.6%)高;在HER3mRNA低表达的肿瘤患者中,二者反应Cloven等,2004[14] Lassus等,2004[15]Nielsen等,2004[16] Lee等,2005[17] Dimova等,2006[28] Tuefferd等,2007[18] Pils等,2007[19] Steffensen等,2007[20]Gul等,2010[21] Farley等,2009[29]Ali-Fehmi等,2010[22]IHCIHCCISHIHCIHCFISHIHCIHCIHCFISHIHCFISHIHC1420390381783102100632012716014572133126染色≥1+膜染色2+or3+HER2基因拷贝数>5HER2基因拷贝数3~5膜或浆染色2+or3+染色≥1+HER2基因拷贝数≥3膜染色2+or3+膜染色2+or3+膜染色2+or3+膜染色1+HER2/17号染色体>2膜染色2+or3+HER2/17号染色体>2HER2基因拷贝数>4膜染色2+or3+16.017.07.014.035.05.08.013.028.011.024.07.018.17.09.029.0研究组方法例数阳性定义HER2阳性肿瘤比例(%)表1HER2在卵巢上皮性癌中的表达注:IHC为免疫组化;CISH为显色原位杂交;FISH为荧光免疫杂交61CHINA MEDICAL HERALD中国医药导报率差异具有统计学意义[39]。
