叶绿体色素的理化性质共29页
实验3 叶绿体色素的理化性质 叶绿素的定量测定 希尔反应

叶绿素a、b在 652 nm 处有相同的比吸收系数 (34.5),也可在此波长下测定一次光密度D652, 求出叶绿素a、b的总量。
D652X 1000 CT = 34.5
实验步骤
1. 提取: 称0.5 g菠菜叶片,剪碎置研钵中, 加少量碳酸 钙和石英砂,加入80% 2-3mL于研钵中, 研成匀浆,再加 入2-3 mL 80%丙酮,研磨充分,用丙酮湿润的滤纸过 滤(在漏斗上完成,注意石英砂尽量不要倒入漏斗中, 以免堵塞滤纸,影响过滤),并用少量丙酮将滤纸和研钵 冲洗干净,定容至25 mL试管中。 2. 稀释: 取5ml提取液于另一刻度试管中,加5 mL 80% 丙酮稀释(可根据具体情况调整稀释倍数,使OD值在 0.2-0.8范围内)。
四 思考题:
1.叶绿素a、b在蓝光区也有吸收峰,能否用这一吸 收峰波长进行叶绿素a、b进行定量分析?为什么?
苯倒入废液瓶中!
四 吸收光谱的观察
叶绿素吸收红光和兰紫光; 类胡萝卜素吸收兰紫光;
类胡萝卜素的吸收光谱
叶绿素的吸收光谱
画图并说明原因
五 氢和铜代叶绿素反应
叶绿素在弱 酸作用下,叶绿 素中镁可被H+取 代而成为褐色的 去镁叶绿素,后 者遇铜则成为绿 色的铜代叶绿素。
取叶绿体色素5ml,加浓 盐酸1滴摇匀,观察溶液 颜色的变化。
当溶液变褐色后,取 一半去镁叶绿素提取液, 投入少许醋酸铜粉末, 微微加热,观察溶液颜 色的变化。
不要盖试管盖!
色素提取
方法与步骤
荧光 皂化
代替
吸收
叶绿素的定量测定
叶绿体色素的提取分离和理化性质

叶绿体色素的提取分离和理化性质主讲:张海森博士一、实验目的因此,测定叶绿体色素含量便成为研究光合作用与氮代谢必不可少的手段,在实际生产中也有着广泛的应用。
1、学习叶绿体色素的提取方法。
2、了解叶绿素和类胡萝卜素的一些主要理化性质。
绿色植物的光合作用是离不开叶绿体色素的,了解叶绿体色素的组成和性质对于理解光合作用的本质很有帮助。
叶绿体色素分为叶绿素和类胡萝卜素两类。
它们与类囊体膜上的蛋白质相结合,成为色素蛋白复合体,不溶于水,溶于有机溶剂,因此,可用乙醇或丙酮等有机溶剂提取。
二、叶绿体色素的提取原理三、实验材料:菠菜叶片五、叶绿体色素的理化性质1.光对叶绿素的破坏作用叶绿素(a,b)的化学性质很不稳定,容易受强光的破坏,特别是当色素分子与蛋白质分离以后,破坏更快,而类胡萝卜素则较稳定。
水提取液暗光乙醇提取液暗光1) 取四支小试管,分别加入两种提取液2ml,稀释2-3倍;2) 各取两只试管放于暗处; 另两只试管置于强光下,进行光破坏;3) 30min后,对比观察光破坏的结果。
光对叶绿素破坏的操作步骤:2.提取液中各成分分离:用色层分析的原理加以分离因吸附剂对不同物质的吸附力不同,当用适当的溶剂推动时,混合物中各成分在流动相和固定相之间具有不同的分配系数,所以它们的移动速度不同,经过一定时间层析后,便将混合色素分离。
叶绿体色素的结构决定了它们极性的不同,因而在滤纸上的迁移速率不同。
叶绿体色素叶绿素类胡萝卜素叶绿素a 叶绿素b叶黄素胡萝卜素问题:请根据这四种色素分子的结构比较它们极性的大小。
步骤:(1)取圆形滤纸1张,用细头的吸管在其中心戳一圆形小孔。
(滤纸直径为11cm)(2)另取一张长方形滤纸条(5cm×1.5cm),沿纸条长边方向涂抹色素,风干后,重复涂抹数次。
十次涂抹之后,沿长边方向卷成纸捻。
(3)纸捻带有色素的一端插入圆形滤纸的小孔中,使之与滤纸刚刚平齐(勿凸出)。
(4)将康维皿置于培养皿内,向康维皿中央小室加入推动剂。
Chapter3叶绿体色素的化学性质
第第三三节节 光光合合作作用用的的机机 理制
• 光合作用二个反应阶段的发现
1920年warburg的小球藻闪光实验
同等光强 相同时间
连续照射, 光合效率小,放氧少
间歇照射(每次闪光0.0034S,间歇 0.0166S, 每秒50次),光合效率高,放氧多
结论:光合作用分两个阶段,前者需光,后者不需光。
0.02
0
660
680
700
720
740
Waverlength(nm) Nhomakorabea(1)光系统Ⅰ (PSI)
~80Å——~110Å,在类囊体垛叠和非垛叠区都有 分布,位于类囊体膜上朝向间质一侧。 PSI中心色素 P700 ,推动NADPH形成。
(2)光系统Ⅱ (PSⅡ)
~110Å——~145Å, 主要在类囊体膜的垛叠部分, 位于类囊体膜上朝向类囊体腔一侧。 PSⅡ中心色 素是P680,PSⅡ的功能常与放O2相联系。
h
• DPA
DP*A
DP+A—
D+PA—
光合单位:250-300个叶绿素和其它集光色素分 子构成的,能完成1个光量子吸收并转化的色素 蛋白复合体。
二、电子传递和光合磷酸化
电能变为活跃的化学能(ATP和NADPH)。
1、 两个光系统
小球藻红降现象和双光增益效应(爱默生效应)
0.14
相 0.12 对 量 0.1 子 0.08 产 0.06 额 0.04
蛋白), • ④偶联因子复合体(又名ATP合成酶)。
• PQ(质体醌或质醌), 担负着传递氢(H+和e-)的 任务。
• PQ穿梭当其接受QB或Cytb6传来的2个电子时, 必须向类囊体膜外侧吸收2个H+才能还原, 随 后 还 原 态 的 PQ ( PQH2 ) 把 电 子 传 给 FeS(或Cytb6) ,而把H+释放到类囊体腔,这一过程 称之。
叶绿素的理化性质名词解释

叶绿素的理化性质名词解释叶绿素是一种存在于植物和一些藻类生物体中的绿色色素,广泛参与光合作用的光捕获和能量转化过程。
它拥有丰富的理化性质,包括光吸收、荧光发射、氧化还原和光解等方面。
在本文中,我们将对叶绿素的理化性质进行解释和探讨。
首先,叶绿素的光吸收特性是其最基本的特点之一。
叶绿素分子拥有丰富的共轭双键结构,使得它能够吸收可见光谱范围内的蓝光和红光,而对绿光则表现出较弱的吸收。
这就解释了为什么叶绿素呈现出绿色的外观,因为它吸收了红光和蓝光,而将绿光反射出来。
其次,叶绿素的光解作用也是其重要的理化性质之一。
在光合作用中,光解作用指的是叶绿素分子中电子的激发和失去,这个过程包括两个步骤:光化作用和光解作用。
光化作用发生在光合作用的反应中心,叶绿素分子吸收到光能后,激发电子进入到高能态,从而产生能量。
而光解作用则是光能的转化过程,将光能转化为电能或化学能,用于ATP和NADPH的合成。
叶绿素的荧光发射能力也是其重要的性质之一。
当叶绿素分子吸收到光能后,一部分能量会被转化为热能释放出去,而另一部分能量则以荧光的形式发射出来。
这种荧光辐射可以被用来测量叶绿素的浓度,并且可以用来了解光合作用的活性和叶绿素分子与其他分子之间的相互作用。
此外,叶绿素还具有氧化还原性质。
在光合作用中,光能被叶绿素分子吸收后,通过一系列氧化还原反应,将原子和分子的电子转移和传递。
例如,在光合作用的光反应过程中,叶绿素分子通过光解作用失去电子,然后通过一系列电子传递链将电子转移到其他物质中,最终将能量储存为ATP和NADPH。
除了这些理化性质之外,叶绿素还可以参与其他许多生物过程。
例如,叶绿素可以参与光合作用的调节,当光线过强时,叶绿素可以起到光保护作用,防止光合反应受到过度损害。
此外,叶绿素还可以参与植物的光感应和生长发育过程。
总的来说,叶绿素的理化性质在植物生命中扮演着重要的角色。
光吸收、荧光发射、氧化还原和光解等性质,使其能够参与光合作用,并将光能转化为化学能和电能。
叶绿ww体色素理化性质

提取步骤: 提取步骤:
(1)取菠菜叶片洗净、擦干、剪碎、混匀, 取菠菜叶片洗净、擦干、剪碎、混匀, 放入研钵中。 称2.5g,放入研钵中。 加入少量石英砂及碳酸钙粉(目的? (2)加入少量石英砂及碳酸钙粉(目的?), 滴管95 乙醇,研磨至糊状; 95% 加2~3滴管95%乙醇,研磨至糊状;(3)再加 15ml 95%乙醇,提取约3 min, 15ml 95%乙醇,提取约3 min,过滤于三角瓶 中; (4)残渣用5-10ml 95%乙醇冲洗,一同过滤 残渣用5 10ml 95%乙醇冲洗, 于三角瓶中。 备用) 于三角瓶中。 (备用)
荧光与磷光现象产生的原理
退 激
透射光下 为绿色
反射光下为红色 荧光) (荧光)
如果提取液的浓度较低,无法观察到荧光。 (荧光强度太弱)
5、皂化作用(绿色素与黄色素的分离) 皂化作用(绿色素与黄色素的分离)
叶绿素是一种由叶绿酸和甲醇、叶绿醇形成 叶绿素是一种由叶绿酸和甲醇、 复杂酯(二羧酸酯) 可与碱起皂化反应, 的复杂酯(二羧酸酯),可与碱起皂化反应,生 成醇和叶绿酸的盐,产生的盐能溶于水, 成醇和叶绿酸的盐,产生的盐能溶于水,用此法 可将叶绿素与类胡萝卜素分开。 可将叶绿素与类胡萝卜素分开。
胡萝卜素与叶黄素主要 吸收蓝紫光, 吸收蓝紫光,基本上不吸 收黄光,从而呈现黄色。 收黄光,从而呈现黄色。 然后上层黄色部分对准 光孔, 光孔,观察光谱变化 注意试管要对准光孔) (注意试管要对准光孔)
7、H+和Cu++对Mg++的取代作用
只做方法一
Cu++
叶绿素中的 Mg++ 被 H+ 所 取 代 而成褐色的去镁 叶绿素。 叶绿素。 铜取代H 铜取代 H+ 形成 铜代叶绿素。 铜代叶绿素。 铜代叶绿素很 稳定, 稳定 , 在光下不 易破坏, 易破坏 , 故常用 此法制作绿色多 汁植物的浸渍标 本。
叶绿体色素的提取分离及其理化性质

标出各种色素名称
2.叶绿体色素的理化性质
(1).光对叶绿素的破坏作用
叶绿素(a,b)的化学性质很不稳定, 容易受强光的破坏,特别是当叶绿素与蛋白质分离 以后,破坏更快,而类胡萝卜素则较稳定。 (提取出叶绿素后先做这一步)
用15N研究燕麦叶片中色素的合成和分 解发现,72小时全部更新一遍。
(5)、H+和Cu2+对叶绿素分子中 Mg2+的取代作用
Cu2+ H+
叶绿素中的 可Mg2+被H+所取代 而成褐色的去镁 叶绿素,后者遇 铜则成为绿色的 铜代叶绿素,铜 代叶绿素很稳定, 在光下不易破坏, 故常用此法制作 绿色多汁植物的 浸渍标本。
步骤:
1#小试管
加乙醇色素提取液2ml
稀释3倍 加5%盐酸1滴
称2g,放入研钵中。 (2)加入少量石英砂及碳酸钙粉,加1~2滴
管95%乙醇,研磨至糊状;再加10~15ml 95%乙醇, 提取1~3min,过滤于三角瓶中;残渣用5ml 95%乙 醇冲洗,一同过滤于三角瓶中。
提取的操作步骤:
水研磨匀桨: 另取2g剪碎的新鲜叶片,放入少量石
英砂(不加碳酸钙粉),用水研磨。先加2 ml蒸馏水,研至糊状,再加蒸馏水20ml, 搅均,不过滤。
COOK COOK
步骤: 1、加入1.5ml 20%KOH-甲醇溶液,充分摇匀; 2、加入5ml苯,摇匀 ; 3、加入适量蒸馏水,沿管壁。
注意:如果分层后下部的溶液浑浊,可以剧烈摇动, 对试管加温,溶液很快分层,絮状物消失,溶液变得清 澈透明。原因,可能是温度较低引起的。
(4)、吸收光谱的观察
注意:
1、色素多涂抹几次,风干后再涂抹第二次。 细,匀,直,浓。
实验3、叶绿体色素的提取、分离理化性质 及光合速率测定

分离原理:分离色素的方法有多种, 分离原理:分离色素的方法有多种,纸层析法是用滤 纸作为支持物的层析方法。当层析液(流动相) 纸作为支持物的层析方法。当层析液(流动相)不断 地从层析滤纸(固定相)上流过时, 地从层析滤纸(固定相)上流过时,由于要分离的混 合物中的各种成分在两相间具有不同的分配系数( 合物中的各种成分在两相间具有不同的分配系数(不 同色素在层析液中的溶解度不同,因而随层析液的扩 同色素在层析液中的溶解度不同, 散速度也不同),所以它们移动速度也就不同, 散速度也不同),所以它们移动速度也就不同,经过 ),所以它们移动速度也就不同 一定时间后,便会使样品中的混合物得到分离。 一定时间后,便会使样品中的混合物得到分离。
V:体积流速(L/min) 体积流速(L/min) Ta:空气温度(K) 空气温度( p:大气压力(bar) 大气压力(bar) A:叶面积(cm2) 叶面积( Co:出气口CO2浓度(uL/L) 出气口CO 浓度(uL/L) Ci:进气口CO2浓度(Ul/l) 进气口CO 浓度(Ul/l)
可调整,可流量计读出 可调整, 待测 一般认为一个大气压 固定为叶室窗口面积 待测 待测
4.H+和Cu2+对叶绿色分子中Mg2+的取代作用 对叶绿色分子中Mg
(1)取两支试管,一支试管加叶绿体色素提取液 )取两支试管, 2ml,作为对照。另一支试管加叶绿体色素提取液 ,作为对照。 5ml,再加入 %HCl数滴摇匀,观察溶液颜色变化 数滴摇匀, ,再加入5% 数滴摇匀 小粒, (2)当溶液变褐后,再加醋酸铜晶体 小粒,微微 )当溶液变褐后,再加醋酸铜晶体1小粒 加热,观察记载溶液颜色变化情况, 加热,观察记载溶液颜色变化情况,并与对照试 管相比较。解释其颜色变化原因。 管相比较。解释其颜色变化原因。 (3)另取醋酸-醋酸铜溶液 )另取醋酸-醋酸铜溶液20ml,置于烧杯中。取 ,置于烧杯中。 新鲜植物叶两片,放入烧杯中,用酒精慢慢加热, 新鲜植物叶两片,放入烧杯中,用酒精慢慢加热, 随时观察并记录叶片颜色的变化, 随时观察并记录叶片颜色的变化,直至颜色不再 变化为止。解释原因。 变化为止。解释原因。
叶绿体色素的提取及理化性质的

3
叶绿体色素在酸性和碱性溶液中的溶解度不同, 因此可以通过调节pH值进行提取和分离。
稳定性
01
叶绿体色素对光、热、酸、碱等条件敏感,容易发生降解。
02
在酸性环境中,叶绿素a和叶绿素b容易被氧化成脱镁叶绿素,
导致颜色变化。
在光照条件下,叶绿体色素会发生光降解,导致颜色变淡。
03
荧光性质
叶绿体色素具有荧光性质,其 中叶绿素a的荧光强度最强,
其次是叶绿素b。
荧光光谱分析可用于研究叶 绿体色素的结构和组成,以 及其在不同环境条件下的变
化。
荧光性质可用于叶绿体色素的 定量分析,通过测量荧光强度 可以计算出样品中叶绿体色素
的浓度。
03 叶绿体色素的应用
在农业上的应用
促进光合作用
叶绿体色素能够吸收光能,并将其转化为化学能,用于植物的光 合作用,促进植物生长。
不同植物种类的叶绿体色 素组成和含量不同,影响 植物对不同光照环境的适 应性。
植物分类学
叶绿体色素的组成和含量 可作为植物分类的依据之 一。
提取原理
根据相似相溶原理:叶绿体色素易溶 于有机溶剂,如丙酮、乙醇等,而不 溶于水。因此,通过加入有机溶剂, 可以将叶绿体中的色素提取出来。
色素分子在有机溶剂中的溶解度与温 度、压力、有机溶剂的种类和浓度等 因素有关。
提取过程中要保持低温,防止色素降解。 过滤时选用合适的滤纸,确保色素完全收集。
研磨时要充分,以释放出更多的色素。
避免使用金属器具直接接触有机溶剂,以防发生化学反 应。
02 叶绿体色素的理化性质
溶解性
1
叶绿体色素不溶于水,易溶于酒精、丙酮、氯仿 等有机溶剂。
2
叶绿素a和叶绿素b在层析液中的溶解度不同,因 此可以通过纸层析法进行分离。
叶绿素色素理化性质

叶绿素
提取: 叶绿体中含有叶绿素(叶绿素a与b)和类胡萝卜素(胡萝卜素和叶黄素),这两类色素 均不溶于水,而溶于有机溶剂,故常用乙醇、丙酮等有机溶剂提取 分离: 当溶剂沿支持物不断向前推进时,由于叶绿体中不同色素分子结构不同,在两相( 流动相与固定相)间具有不同的分配系数,因此它们移动速率不同。对叶绿体色素进行层 析可将不同色素分离 理化性质的观察: 叶绿素是一种二羧酸酯,在碱作用下,发生皂化反应;在弱酸作用下, 叶绿素中镁可被氢原子取代而成为褐色的去镁叶绿素,后者遇铜则成为绿色的铜代叶绿素 ,叶绿素具有荧光,故从与入射光相垂直的方向观察叶绿素溶液呈血红色。叶绿素的化学 性质不稳定,易受强光氧化,特别是当叶绿素与蛋白质分离后,破坏更快
叶绿素
(1) 纸层析分离叶绿体色素 从上到下四条色素带依次是橙黄色、黄色、蓝绿色、黄绿色,对应的色素分别为胡萝卜素、 叶黄素、叶绿素a、叶绿素b。最宽的色素带是蓝绿色,相距最宽的是橙黄色和黄色的色素 带 (二)叶绿体理化性质的观察 荧光现象的观察 皂化作用 叶绿素分子中Mg2+的取代作用 左边的试管为对照组,右边的试管为实验组 实验组加入数滴5%HCl,摇匀后溶液由绿色变为黄褐色,溶液变褐后,再加入少量醋酸铜粉末, 并微微加热,溶液由黄褐色变为深绿色 溶液由绿色变为黄褐色是由于酸性条件下叶绿素分子中的镁离子被取代,变为去镁叶绿素, 加入醋酸铜粉末后,去镁叶绿素又与铜离子反应得到铜代叶绿素,溶液呈深绿色
NEXT
叶绿素
讨论
①研磨菠菜叶时加入石英砂、的量以及研磨的时间都应该适中,保证研磨充分的同时不破 坏叶绿素的结构,避免丙酮挥发。取叶片时还应该去掉叶脉,因为叶脉中色素含量很少而 且不易研磨 ②进行层析时注意点在纸上的叶绿素提取液不要与层析液接触并且滤纸应该减去两角, 否则会影响纸条上的色素分层结果,此次实验中两侧的层析液就扩散过度,色素带呈弧形
叶绿体色素的提取和理化性质的鉴定实验报告

叶绿体色素的提取和理化性质的鉴定实验报告
叶绿体是植物细胞中的一个重要细胞器,它含有丰富的叶绿体色素。
叶绿体色素是维
持植物正常生长和光合作用的必要物质,具有重要的生理和生化功能。
本实验旨在提取叶
绿体色素,并对其理化性质进行鉴定。
一、实验材料与方法
1.材料
5克菠菜叶、95%酒精、二氧化硅、氯仿、丙酮、乙醇、碳酸钠。
2.实验步骤
1)提取叶绿体色素
将5克菠菜叶放入搅拌器中,加入适量的二氧化硅和95%酒精,搅拌均匀,过筛去固体,接着用氯仿萃取上层液,得到浸提液。
将菠菜叶浸提液用离心机离心,收集上清液,加入适量碳酸钠后,用乙醇洗涤2-3次,离心去沉淀。
收集淀粉体沉淀,加入丙酮,用搅拌器搅拌均匀,过滤得到红褐色丙酮溶液,即为叶
绿体色素提取液。
取一些提取液,在紫外光下观察有无吸收,记录波长和最大吸收值,并通过取样加入
不同浓度的乙醇,绘制吸收光谱图。
二、实验结果与分析
1.提取结果
经过上述方法提取得到浸提液2毫升,离心得到上清液1.5毫升,并最终得到叶绿体
色素提取液0.5毫升。
2.鉴定理化性质结果
在紫外光下观察叶绿体色素提取液,发现呈现深绿色,并且在波长为663nm处有最大
吸收值。
绘制不同浓度叶绿体色素提取液光谱图,根据图像变化,可以得出吸收光谱具有典型
的三峰特征,并且在663nm处有最大吸收值,这与理论上的结果相符合。
三、实验结论。
叶绿体色素的提取理化性质与含量测定

2)取代反应
卟啉环中旳Mg处于不稳定旳状态,可被H+、Cu2+ 、Zn2+等离子取代。 稀酸:叶绿素溶液与稀酸作用,Mg能够被H+所取代而成褐色旳去镁叶绿 素,去镁叶绿素遇Cu2+则成为深绿色旳铜代叶绿素,铜代叶绿素很稳定, 在光下不易破坏(常用醋酸铜处理来保存绿色植物标本)。
7. 思索题
1)用不含水旳有机溶剂提取植物材料尤其是干材料旳叶绿 体色素往往效果不佳,原因何在?
2)研磨提取叶绿素时加入MgCO3,有什么作用? 3)叶绿素a、叶绿素b在蓝光区也有吸收峰,能否用这一吸
收峰波长进行叶绿素a、叶绿素b旳定量分析?为何?
加入少许碳酸钙旳目旳是为了预防在研磨过程中,叶绿素受到破坏。 详细旳情况是这么旳:叶绿体中旳色素所处旳环境具微碱性,试验中, 因为研磨会使细胞构造遭到破坏,细胞液(具微酸性)流出,酸性旳 细胞液就会直接接触叶绿体中色素,致使叶绿素旳分子构造遭到破坏, 使叶绿素失镁,呈黄褐色,所以加入少许碳酸钙是为了中和细胞液旳 酸性,可起到保护叶绿素旳作用 。
5. H+和Cu2+对叶绿素分子中Mg2+旳取代作用
1)吸收叶绿体色素提取液2ml放入试管中,逐滴加入36%乙酸数滴,摇 匀,观察溶液颜色旳变化。 (成果与分析4.1)
2)当溶液变褐色后,倾出二分之一于另一试管中,投入几粒醋酸铜粉, 水浴加热,观察溶液颜色变化,与未加醋酸铜(同步加热)旳一管相比 较。(成果与分析4.2)
试验 叶绿体色素旳提取、理化性 质与含量测定
1. 试验目旳及意义
➢ 提取叶绿体色素 ➢ 分析叶绿素旳物理、化学性质 ➢ 测定叶绿素旳含量 ➢ 提取和测定植物组织中旳光合色素是研究光
实验4 叶绿素的理化性质

实验4 叶绿素的理化性质一、实验目的:1、掌握叶绿体色素的提取、分离和含量的测定的方法。
2、掌握分光光度计的应用。
二、实验原理:理化性质:1.荧光现象:透射光下呈绿色,反射光下呈红色。
叶绿素吸收光量子→激发态→基态:发射出红光量子。
2.叶绿素分子的镁可被氢和铜替代镁→氢:褐色镁→铜:绿色3.皂化作用(绿色素与黄色素的分离)叶绿酸的酯+碱→醇+叶绿酸的盐三、实验用具及器材和药品:(1)天平、剪刀、研钵、烧杯、量筒、25ml容量瓶、滤纸、表面皿、漏斗、滴管、试管、酒精灯(2)石英砂、碳酸钙、80%丙酮、盐酸、醋酸铜晶体、乙醚、蒸馏水、30%KOH-甲醇溶液(3)菠菜叶四、实验步骤:1.叶绿素的提取:取菠菜(或其他植物)叶子2g,剪碎,放在研钵中,加石英砂和碳酸钙少许,80%丙酮约2-3ml,研磨成匀浆,再加80%丙酮定容至25ml,用漏斗过滤,即为色素提取液。
2. 叶绿素理化性质鉴定(1)叶绿素的荧光现象:观察在反射光和透射光下观察色素提取液的颜色有什么不同。
(2)氢和铜对叶绿素分子中镁的替代作用(稀释10倍后再做)取两支试管。
第一支试管加叶绿体色素提取液2毫升,作为对照。
第二支试管加叶绿体色素提取液2毫升,1滴1滴地加入盐酸,直至溶液出现橙色,此时叶绿素分子已遭破坏,形成去镁叶绿素。
然后加醋酸铜晶体1小粒,慢慢地在酒精灯上加热溶液,观察记录溶液颜色变化,并与对照试管比较。
(3)皂化作用(黄色素和绿色素的分离)将叶绿体色素提取液2毫升于试管中,加入4毫升乙醚,摇匀,沿试管壁慢慢加入5毫升左右的蒸馏水,轻轻混匀,静置片刻后,溶液即分为两层,色素已全部转入上层乙醚中。
用滴管吸取上层绿色层溶液,放入另一试管中。
在色素乙醚溶液中加入1-2毫升30%KOH-甲醇溶液,充分摇匀,静置。
溶液逐渐分为两层,下层是甲醇溶液皂化的叶绿素),上层是乙醚溶液(胡萝卜素和叶黄素)五、实验现象及结果:1. 叶绿素的荧光现象:在反射光下可以看到提取液呈黄绿色,在投射光下呈绿色。
实验一叶绿体色素的分离及理化性质测定

目录
• 实验目的 • 实验原理 • 实验步骤 • 结果分析 • 实验总结与展望
01
CATALOGUE
实验目的
掌握叶绿体色素的分离方法
叶绿体色素的提取
通过使用有机溶剂(如丙酮、乙醇等 )从植物组织中提取叶绿体色素。
叶绿体色素的分离
采用色谱法(如薄层色谱、高效液相 色谱等)将叶绿体色素中的不同组分 进行分离。
研磨与过滤
将叶片放入研钵中,加入 适量的石英砂和无水乙醇 ,研磨至匀浆。通过纱布 过滤,收集滤液。
离心分离
将滤液倒入离心管中,用 离心机离心,分离叶绿体 色素。
叶绿体色素的分离
制备滤纸条
将滤纸剪成长约5cm,宽约1cm的纸条,标明起点。
点样与展开
用毛细管将色素提取液点在滤纸条的起点线上,然后将其放入展开 剂中(如石油醚、乙醚、丙酮等)进行展开。
色素组成
02
实验结果显示,叶绿体色素主要由叶绿素a、叶绿素b、胡萝卜
素和叶黄素组成。
含量变化
03
实验中观察到不同植物或同一植物不同部位叶绿体色素含量存
在差异。
叶绿体色素理化性质测定结果分析
溶解性
实验结果表明,叶绿体色素易溶 于有机溶剂,如丙酮、氯仿等, 难溶于水。
稳定性
在一定温度和光照条件下,叶绿 体色素稳定性较高,但在高温和 强光下易分解。
学习叶绿体色素的应用价值
生物指示剂
叶绿体色素可以作为生物指示剂,用于监测环境污染 和生态变化。
食品添加剂
叶绿体色素可用于食品加工中,如绿色饮料、果蔬汁 等,增加食品的色泽和营养价值。
生物燃料
叶绿体色素可以作为生物燃料的原料,通过微生物发 酵技术转化为生物燃料,如乙醇、生物柴油等。
叶绿体色素的提取分离与理化性质实验报告

叶绿体色素的提取分离与理化性质
二、实验原理:
叶绿体中主要成分为叶绿素a、叶绿素b、胡萝卜素、叶黄素,这些色素不溶于水而易溶于有机溶剂,所以用乙醇做提取剂。
提取液用薄层层析法加以分离。
由于硅胶对不同色素的吸附性不同,在展开剂带动各种色素向上移的过程中,有的速度慢有的速度快,从而彼此分开成单独的色带。
叶绿素可与碱起皂化反应而生成甲醇和叶绿醇及叶绿酸盐,盐能溶于水,可用此法将叶绿素与类胡萝卜素分开。
叶绿素吸收光量子而转变为激发态,变回基态时可发射出红光量子,因而产生荧光。
叶绿素容易受强光破坏,而类胡萝卜素较稳定。
叶绿素中的镁可被氢离子取代而成褐色的去镁叶绿素,去镁叶绿素遇铜则成为铜代叶绿素。
三、实验仪器和材料:
1.菠菜叶
2.体积分数为95%的乙醇,碳酸钙粉末,展开剂,苯,醋酸铜粉末,质量分数为5%的稀盐酸,醋酸—醋酸铜溶液,氢氧化钾—甲醇溶液。
3.天平,研钵,漏斗,三角瓶,剪刀,点样毛细管,层析缸,硅胶预制板,滤纸,刻度试管,小试管,试管架,水浴锅,10ml移液管。
四、实验步骤:。
叶绿体色素的提取分离和理化性质实验报告

生物学导论实验报告叶绿体色素的提取分离和理化性质一、提取与分离1、实验目的学习应用薄层色谱法分离叶绿体色素的实验方法。
2、实验原理提取:叶绿体色素为有机酯类化合物,根据相似相容原理,常用有机溶剂提取。
如酒精、丙酮、乙酸乙酯、氯仿等。
分离:薄层层析法是将吸附剂均匀的涂抹在玻璃板上形成一薄层,将此吸附剂薄层作为固定相,把待测分离的样品溶液点在薄层板的下端,然后用一定量的溶剂作流动相,将薄层板的下端浸入到展开剂中。
流动相通过毛细管作用由下而上逐渐浸润薄层板,并带动样品在板上也向上移动,样品中各组成分在吸附剂和展开剂之间发生连续不断的吸附、脱吸附、再吸附……的过程。
由于吸附剂对不同物质的吸附能力大小不同,吸附能力强的物质相对移动慢一些,儿媳妇能力弱的物质相对移动快一些,从而使各组分有不同移动速度而彼此分开。
3、实验材料与试剂(1)新鲜的菠菜叶;(2)体积分数为95%的乙醇,碳酸钙粉末、展开剂(3)钵体、漏斗、三角瓶、剪刀、点样本、毛细管、层析缸、硅胶预制板、滤纸。
4、实验步骤(1)色素提取液的制备取叶4~5片新鲜叶片,洗净,擦干叶表面,去中脉剪碎,放入钵体中。
加入少量碳酸钙,加2~3ml体积分数为95%的乙醇,研磨至糊状,再加入10ml乙醇,上清液过滤,残渣再用10ml乙醇冲洗过滤。
(2)叶绿体色素的分离取硅胶预制板一个,用点样毛细管取上述提取液,平行于硅胶板的短边,距下边缘1cm处用毛细管划线,风干,重复操作3~4次;在干燥的层析缸中加入适量展开剂,高度0.5cm,将硅胶预制板带有色素一端放入,使其下端浸入展开剂中;当色素较好分离,展开剂前沿接近硅胶预制板的上端边缘时,取出,画线。
Rf=斑点中心到原点距离/溶剂前沿到原点距离5、实验结果与分析从上至下为胡萝卜素(橙色):Rf=6.95/7.35=0.946叶绿素a(蓝绿色):Rf=5.35/7.35=0.728叶绿素b(黄绿色):Rf=4.95/7.35=0.673叶黄素(黄色):Rf=4.10/7.350.558可知,胡萝卜素、叶绿素a、叶绿素b、叶黄素极性依次增大,与硅胶吸附能力依次增强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.2 皂化作用
在观察过荧光现象的色素提取液中加入1ml 20%KOH-甲醇溶 液,充分摇匀,静置片刻,再加入5ml苯,混匀,然后用滴管 沿着管壁缓缓加入1ml蒸馏水。静置片刻,溶液慢慢分为三 层:上层为苯,其中的色素为类胡萝卜素和叶黄素;下层为 乙醇溶液,其中的色素为已经皂化的叶绿素a、b素和少量叶 黄素;试管底部同时出现白色沉淀。另取4ml色素提取液做 对照,其他步骤都一样,只是不加KOH-甲醇溶液。
叶绿体色素的理化性质
6、纪律是自由的第一条件。——黑格 尔 7、纪律是集体的面貌,集体的声音, 集体的 动作, 集体的 表情, 集体的 信念。 ——马 卡连柯
8、我们现在必须完全保持党的纪律, 否则一 切都会 陷入污 泥中。 ——马 克思 9、学校没有纪律便如磨坊没有水。— —夸美 纽斯
10、一个人应该:活泼而守纪律,天 真而不 幼稚, 勇敢而 鲁莽, 倔强而 有原则 ,热情 而不冲 动,乐 观而不 盲目。 ——马 克思
一. 实验原理
1.1 叶绿素: 主要包括叶绿素a和b
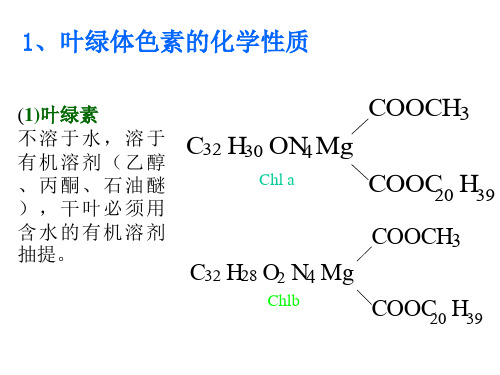
分子式: Chla C55H72O5N4Mg Chlb C55H70O6N4Mg
结构式: 卟啉环化合物 四个吡咯环与四个=CH-组成一 个大环,共轭双键形成一个大π键,环中央有一个镁原子, 卟啉环决定叶绿素颜色,也是吸收可见光,并以诱导共振 方式传递光能的根本所在,叶醇尾是由四个异戊二烯单 位组成的双萜
Chla 蓝绿色 Chlb 黄绿色
脂溶性: 难溶于水,仅溶于酒精、丙酮、已醚、已烷等有 机溶剂
卟啉环头部呈极性, 具亲水性; 叶醇尾部具亲脂性
皂化反应: Chla、Chlb 是双羧酸的酯
一个羧基被甲基酯化
可发生皂化反应
另一个羧基被叶醇基酯化
C32H30ON4Mg
COOCH3 +2KOH
COOC20H39 COOK
叶绿素的用途
造血功能 诺贝尔得奖人Dr.Richard Willstatter和Dr.Hans Fisher发现:叶
绿素的分子与人体的红血球分子在结构上很是相似,唯一的 分别就是各自的核心为镁原子与铁原子。因此,饮用叶绿素 对产妇与因意外失血者会有很大的帮助。
帮助解除体内杀虫剂与药物残渣 营养学家Bernard Jensen博士指出,叶绿素能除去杀虫剂与药
的存在而决定了叶绿素分子的脂溶性,使之 溶于丙酮、酒精、乙醚等有机溶剂中。由于 在结构上的差别,叶绿素a呈蓝绿色,b呈黄 绿色。在光下易被氧化而退色。
叶绿素不很稳定,光、酸、碱、氧、氧化剂等 都会使其分解。酸性条件下,叶绿素分子很容 易失去卟啉环中的镁成为去镁叶绿素。叶绿素 溶液能进行部分类似光合作用的反应,在光下 使某些化合物氧化或还原。人工制备的叶绿素 膜在光下能产生光电位和光电流,也能催化某 些氧化还原反应。
C32H30ON4Mg
+CH3OH+C20H39OH
COOK
取代反应:卟啉环中的Mg2+可被H2+、Cu2+、 Zn2+取代,被Cu2+、Zn2+取代后仍保持绿色
•光学特性:
(1)吸收光谱:色素溶液随波长改变而发生光吸收 变化的图谱 Chla Chlb的吸收光谱有二个强吸收峰 640——660nm 红光部分 叶绿素特有 410——470nm 蓝紫光部分 卟啉环化合物共有 (2)荧光和磷光 荧光现象:Chl溶液在透射光下呈绿色,而反射 光下呈红色的现象。强度大,寿命短(10-9秒) 磷光: Chl溶液停止光照后,仍能在一定时间内 放出暗红色的光。 寿命长(10-2秒——10-3秒)
一般情况下,叶片中叶绿素与类胡萝卜素的比 值约为3:1,所以正常的叶子呈现绿色。秋天, 叶片中的叶绿素较易降解,数量减少,而类胡 萝卜素比较稳定,所以叶片呈现黄色。
全部的叶绿素和类胡萝卜素都包埋在类囊体膜 中,并以非共价键与蛋白质结合在一起,组成 色素蛋白复合体(pigment protein complex), 各色素分子在蛋白质中按一定的规律排列和取 向,以便于吸收和传递光能。
↓
↓
2mL丙酮提取液 余下的色素提取液用石油醚萃取
↓
↓↓
↓↓
加入6N HCl
纸层析 荧光 皂化反应 光破坏
(脱镁叶绿素) ↓
↓
分离色素
Cu取代
四. 实验内容 4.1 叶绿素的荧光现象观察:
取叶绿体色素提取液少许于1支试管中,用反射光和 透射光观察提取液的颜色有何不同,反射光下观察 到的提取液颜色即为叶绿素产生的荧光颜色。
二. 试剂与材料
2.1 英砂、碳酸镁、氯化钠、 醋酸铜。
2.2 仪器和器皿: 分光光度计、台秤、剪刀、 研钵、移液
管、漏斗、大试管、层析缸
2.3 材料: 新鲜菠菜叶片,不同颜色的花和果实。
三.实验操作
丙酮研磨提取叶绿素
↓过滤、洗研钵及残渣
叶绿体色素的性质鉴定
卟啉环中的镁原子可被氢离子、铜离子、锌 离子所置换。用酸处理叶片,氢离子易进入 叶绿体,置换镁原子形成去镁叶绿素,使叶 片呈褐色。去镁叶绿素易再与铜离子结合, 形成铜代叶绿素,颜色比原来更稳定。人们 常根据这一原理用醋酸铜处理来保存绿色植 物标本。 叶绿醇是亲脂的脂肪族链,由于它
1.2 类胡萝卜素
类胡萝卜素 胡萝卜素 橙黄色 不溶于水 叶黄素 鲜黄色 溶于有机溶剂
分子式、结构式: 胡萝卜素:C40H56 有α、β、γ三种同分异构体 叶黄素是胡萝卜素的衍生物,其两端的紫罗兰酮环 第四位C上的H被OH取代,分子式为C40H56O2
类胡萝卜素吸收光谱都在蓝紫光部分,所吸收的光 能传递给叶绿素用于光合作用,保护叶绿素分子不 被氧化或阳光破坏
物残渣的毒素,并能与辐射性物质结合而将之排出体外。此 外,他也发现一般上健康的人会比病患者拥有较高的血球计 数,但通过吸收大量的叶绿素之后,病患者的血球计数就会 增加,健康状况也会有所改善。
2. 类胡萝卜素
类胡萝卜素(carotenoid)是一类由八个异戊二烯单 位组成的,含有40个碳原子的化合物,不溶于水而 溶于有机溶剂。叶绿体中的类胡萝卜素含有两种色 素,即胡萝卜素(carotene)和叶黄素(lutein),前者 呈橙黄色,后者呈黄色。胡萝卜素是不饱和的碳氢 化合物,分子式是C40H56,有α、β、γ三种同分异 构体。在一些真核藻类中还含有ε-类胡萝卜素。叶 子中常见的是β-胡萝卜素,它在动物体内水解后即 转变为维生素A。叶黄素是由胡萝卜素衍生的醇类, 分子式是C40H56O2。
