无机化学 分子间作用力
《无机化学》第7章.化学键理论与分子结构

(2)方向性
①根据原子轨道最大重叠原理,形成共价键时,原 子间总是尽可能沿着原子轨道最大重叠的方向成 键,原子轨道重叠越多,两核间电子概率密度越 大,形成的键越牢固。
②在形成共价键时,除s轨道能在任何方向最大重叠 外,其它p、d、f 轨道只能沿一定方向才能最大重 叠成键。所以,当一个 A原子与其它一个或几个 B 原子形成共价分子时,B原子在A原子周围的成键 方位是一定的,这就是共价键的方向性。
激发
2p
2s
(激发态)
杂 化
p (杂化态)
sp2
3个sp2杂化轨道
杂化轨道理论
+
σ 2 sp -p
F
F
σ 2 sp -p
+
- + - +
B
F
120° F
-
F +
B
+F
-
平面三角形
图9-8 sp2杂化轨道的空间取向和BF3分子构型
sp2杂化
BF3分子形成时中心B原子的轨道杂化情况 和分子的空间构型。
对于同核双原子分子和多原子分子,如 H2 , O2,P4,S8等,由于成键原子的电负性相同, 共用电子对不发生偏移,核间的电子云密集区 域在两核的中间位置,两原子核正电荷所形成 的正电荷重心和成键电子对的负电荷重心恰好 重合,这种键叫非极性共价键。
极性共价键
NH3 等,成键原子的电负性不同,共用电子对 发生偏移,核间的电子云密集区域偏向电负性 较大的原子一端,使之带部分负电荷,电负性 较小的原子一端则带部分正电荷,键的正负电 荷重心不重合,这种键叫极性共价键。
BF3分子的空间构型
(3) sp3杂化: 杂化轨道间夹角109.5 º ,正四面体结构。
无机化学-分子间作用力和氢键

He、Ne、Ar、Kr、Xe从左到右原子半径(分子半径)依次增大,变形 性增大,色散力增强,分子间结合力增大,故b. p. 依次增高。可见,范 德华力的大小与物质的m. p.,b. p.等物理性质有关。
同类分子型物质熔、沸点比较
熔点/K
沸点/K
F2
53.6
85
Cl2
(1) 与电负性大且 r 小的原子 ( F,O, N ) 相连的 H ; (2) 在附近有电负性大,r 小的原子 ( F,O,N ) 。
4、 氢键的特点
(a)氢键存在饱和性和方向性 ➢ 氢键的饱和性指的是每一个 X—H 只能与一个Y原子形成氢键。 只是因为H的体积较小,当形成 X—H…Y 氢键后,X和Y原子电 子云的斥力使得其它极性分子很难靠近。(H的配位数一般为2) ➢ 氢键的方向性指的是Y原子与X—H形成氢键后, X—H…Y 尽 量位于一条直线上,这样可使X和Y原子距离最远,斥力最小。
CH3CH2CH3 b.p. -44.5℃
CH3CH2CH2CH3 b.p. -0.5℃
CH3CH2CH2CH2CH3 b.p. 36℃
●正戊烷、异戊烷和新戊烷三种异构体的相对分子质量相同, 色 散力随分子结构密实程度的增大而减小,导致沸点按同一顺序下降
CH3CH2CH2CH2CH3 b.p.36 ℃
总作用力
8.5 8.75 26.00 23.11 21.14 29.60 47.31
对大多数分子来说,以色散力为主 (除极性很大且存在氢键的 分子,如H2O外)
色散力的大小既依赖于分子的大小,也依赖于分子的形状
●丙烷、正丁烷和正戊烷均为直链化合物(忽略分子形状的影响 ), 色散力随分子体积的增大而增大, 导致沸点按同一顺序升高
化学分子间力的作用

化学分子间力的作用化学是一门研究物质的性质、组成、结构、变化以及与能量的关系的科学。
在化学领域中,分子间力是一种十分重要的概念。
分子间力是指分子之间相互作用的力量,它对物质的性质、状态转变和分子级反应都有着重要影响。
本文将探讨分子间力的几种常见类型及其在化学中的作用。
一、范德华力范德华力是一种最常见的分子间力。
它是由于永久或暂时荷电的分子之间的电荷不均引起的。
在非极性分子中,范德华力是分子间作用的主要形式。
范德华力的大小与分子的极化程度有关,极化程度越大,范德华力越强。
范德华力的作用使得分子能够更紧密地结合在一起,形成固态物质。
二、氢键氢键是一种较强的分子间相互作用力,它主要存在于氢原子与高电负性原子之间,如氮、氧和氟等。
氢键的存在使得分子之间的吸引力增强,有利于物质的溶解和反应。
氢键在生物体系中起着重要的作用,如DNA的双螺旋结构就是由氢键相互作用维持的。
三、离子键离子键是由正负电荷之间的吸引力引起的分子间力。
它主要存在于离子晶体中,是由金属离子和非金属离子之间的电荷吸引造成的。
离子键具有很高的结合能,因此离子晶体具有很高的熔点和热稳定性。
离子键在无机化学和材料科学中有着广泛的应用,如制备陶瓷材料和电解质等。
四、共价键共价键是由于原子间电子的共享而产生的分子间力。
共价键是化学反应中最为常见的一种分子间力。
共价键的强度取决于共享电子的数量和共享的程度。
共价键的形成使得分子能够通过化学反应进行重组和转化。
在有机化学中,共价键的形成和断裂是化学反应的基础,为各种有机化合物的合成提供了依据。
五、其他分子间力类型除了以上几种常见的分子间力之外,还存在着其他一些分子间力。
如疏水力是由于非极性分子间的亲疏水性引起的相互作用。
π-π相互作用是由于π电子云的重叠而产生的作用力。
静电相互作用是由于带电粒子之间的电场相互作用引起的分子间力。
综上所述,分子间力是化学中不可忽视的重要概念,它对物质的性质、状态转变和反应有着重要影响。
分子结构与晶体结构—分子间力与氢键(无机化学课件)

三、化学键与作用力比较
作用力 化学键
化学键与分子间作用力的比较
存在
原子间 离子间
强弱 强
分子间作用性质
物理性质 (熔沸点)
课程小结
本节重点
分子间存在着(微弱的)将分子聚 在一起的作用力称为分子间作用力。
分为范德华力和氢键两大类。其中, 氢键是一种特殊的分子间作用力。
按照能量大小来排序:化学键> 氢键 >分子间作用力。
无机化学
˝
氢键
目录
CONTENTS
01 氢键的定义及表示方法
02 氢键的形成条件及特点
03 氢键对物质性质的影响
01
氢键的定义及表示方法
一、氢键的定义及表示方法
氢键:
分子内几乎“裸露”的氢核与另一分子中带负电荷的原子产生的静电作用
定义:当氢原子与电负性大的X原子以共价键结合时,它们之
三、化学键与作用力比较
在通常情况下,将水加热到100℃,水便会沸腾;而要使水分解成氢气和氧气, 却需要将水加热至1000℃,这样的高温才会有水部分分解。由此我们能得出什 么结论?
想一想
三、化学键与作用力比较
H-O-H分解需要破坏共价键;而使水沸腾需要克服分子 间作用力,它们所需的能量不同,说明了分子间作用力比化 学键弱。
具有方向性与饱和性
03
氢键对物质的性质的影响
三、氢键对物质的性质的影响
类型:
1. 分子间氢键
F —— H ····F —— H
2. 分子内氢键
H O
OH
CO
三、氢键对物质的性质的影响
氢键对物质性质的影响:
1.氢键对物质熔、沸点的影响 分子间氢键增大了分子间的作用力使物质的熔、沸点升高。分子内氢键使物质的 熔沸点降低。例:对羟基苯甲酸高于邻羟基苯甲酸。
分子间力

Compound
AgF
r+/r-
Crystalline type Coordination number
0.85 NaCl
6:6
AgCl
0.63 NaCl 6:6
AgBr
0.57 NaCl 6:6
AgI
0.51 ZnS 4:4
Compound
CuF
CuCl
CuBr
CuI
r+/r-
0.72
0.53
0.49
氢键(hydrogen band)
● 氢键存在的证明 氢键和分子间作用力一样,
也是很弱的力. 与同系物性质的不同就是
由氢键引起的.
The structure of ice
● 氢键的结构特点
rH
d
θ
X
Y
R
Represent of hydrogen bond
这种方向与富电子 氢化物中孤对电子占 据的轨道在空间的伸 展方向有关.
,Be2+离子半径最小,又是2电子构型,因此Be2+有很大的极化能 力,使Cl-发生比较显著的变形,Be2+和 Cl-之间的键有较显著的 共价性。因此BeCl2具有较低的熔、沸点。BeCl2、MgCl2、CaCl2的 熔点依次为410℃、714℃、782℃。
● 溶解度降低 离子极化使离子键逐步向共价键过渡,根据相似
● 偶极矩 (dipole moment, µ) 表示分子中电荷分布状况的物理量,定义为正、负电重心间的
距离与电荷量的乘积. 分子电偶极矩是个矢量. 对双原子分子而言
,分子偶极矩等于键的偶极矩;对多原子分子而言,分子偶极矩则
等于各个键的偶极矩的矢量和.
● 双原子分子的极性取决于键的极性。
弱共价相互作用——不可忽略的分子间作用力

弱共价相互作用——不可忽略的分子间作用力王稼国;荆西平【摘要】现有的化学教科书中将物质间的作用力分为化学键和分子间作用力。
分子间作用力被描述为分子永久偶极和瞬间偶极引起的弱静电相互作用力。
随着研究的深入,许多新的化学现象不能用现有的化学键和分子间作用力进行解释,而可以用原子轨道或分子轨道(用波函数描述)的弱重叠加以理解。
文献中把这种既不同于普通化学键,又有别于教科书中所描述的分子间作用力的作用形式称为二级化学键,强调只在某些特别的物质中出现。
本文通过对几种典型分子的结构和性质进行分析,认为二级化学键存在普遍性,可以看成是分子间的弱共价作用力,并认为这种弱共价作用是分子间作用力的重要组成部分。
本文探讨了这种弱共价作用向化学键转化的可能性。
【期刊名称】《大学化学》【年(卷),期】2012(027)004【总页数】7页(P83-89)【关键词】弱共价相互作用;轨道弱重叠;二级化学键;分子间作用力【作者】王稼国;荆西平【作者单位】温州大学化学与材料工程学院,浙江温州325035;北京大学化学与分子工程学院,北京100871【正文语种】中文【中图分类】O641.3在现有的无机化学和普通化学教科书中[1-2],将原子、离子和分子层次的相互作用力分为两大类,即化学键和分子间作用力,前者作用距离短而强,后者作用距离长而弱。
分子间作用力对物质的许多物理化学性质(如溶解度、熔沸点、硬度、导电性、晶体结构与聚集方式等)产生重要影响,是化学教学中的重要内容。
一般认为分子间的弱相互作用力是由分子的永久偶极和瞬间偶极引起的弱静电相互作用。
随着研究的深入,发现了许多用现有分子间作用力的作用机理无法说明的现象,如Kiefer等[3]在研究有机汞卤化物时观察到分子内卤素原子与汞原子之间存在长距离弱的共价相互作用力,并引入二级价键力(secondary valence forces)的概念;金松寿等系统研究了分子基团间的相互作用,并提出了分子选择力学的概念[4];赖城明等在对同类化合物氯乙烯基氯化汞的研究中发现[5-7],能够提供原子或基团近距离相互作用的顺式结构具有更高的稳定性;对汞的配位化合物也观察到了分子内的类似相互作用[8]。
无机化学 分子晶体和分子间作用力 PPT课件

瞬间偶极和分子的变形性大 小有关。
永久偶极 诱导偶极 瞬间偶极
只属于极性分子
属于
极性分子 非极性分子
属于
极性分子 非极性分子
6. 3. 2 分子间的范德华力
化学键的结合能一般在 1.0 102 kJ•mol-1 数量级。
而分子间力的结合能只 有个几个千焦每摩。
1. 取向力
极性分子之间的永久偶极 —— 永久偶极作用称为取向力。
它仅存在于极性分子之间。 取向力的大小与偶极矩的平方成
正比, F 2
2. 诱导力
诱导偶极 —— 永久偶极 之间的作用称为诱导力。
极性分子作为电场,使非极性 分子产生诱导偶极
极性分子作为电场,使极性分 子的偶极增大,产生诱导偶极
这时诱导偶极与永久偶极之间 产生诱导力。
因此诱导力存在于 极性分子 —— 非极性分子 也存在于 极性分子 —— 极性分子
(2) 氢键的强度
氢键的强度介于化学键和分子 间作用力之间。
氢键的强度大小和氢原子两侧 的原子所属元素的电负性有关。
见下列氢键的键能数据
E / kJ•mol-1 F-H····F O-H····O N-H····N
28.0
18.8
5.4
(3) 分子内氢键
上述氢键均在分子间形成。 若氢原子两侧的电负性大的 元素的原子属于同一分子,这种 氢键为分子内氢键。
非极性分子偶极矩为零,但 各键矩不一定为零,如 BCl3
2. 诱导偶极和瞬间偶极
非极性分子在外电场的作用下,可 以变成具有一定偶极矩的极性分子。
+ _+
=0
而极性分子在外电场作用下,其 偶极矩也可以增大。
+
无机化学:分子间作用力1

➢ 色散力是非极性分子之间唯一的作用力 17 ➢ 色散力存在于所有的分子之间
不同分子间作用力在同一物质中的大小
kJ/mol
取向力
诱导力
色散力
Ar CO HCl NH3 H2O
0 0.003 3.305 13.31 36.38
0 0.008 1.104 1.548 1.929
8.49 8.74 16.82 14.94 8.996
21
氢键(hydrogen band)
● 氢键存在的证明
22
H2O、 HF、NH3与同系物性质的不同就是由氢键引起的。 氢键和分子间作用力一样,也是很弱的力。
The structure of ice
23
氢键: 氢键是一种特殊的分子间作用力 1936年 Pauling
氢键:氢原子与电负性 大的X原子以共价键结 合以后,它还可以和另 一个电负性大的X’原 子产生吸引力。这种吸 引力叫做氢键。
粘度:
丙醇 < 丙二醇 < 甘油
33
➢ 生命科学:
C=O…H-N氢键使蛋白质形成a螺旋
34
-螺旋
反平行-折片 反平行-折片
35
➢ 生命科学:碱基配对,DNA基因转录
36
主槽 次槽
37
➢ 水的特殊性质:
高沸点 高热容 密度的变化 水的高表面张力 树木中水的输送 良好的溶解能力 可燃冰
色散力dispersionforces伦敦力londonforces瞬时偶极诱导偶极相互作用瞬时偶极瞬时偶极不断的存在消失16色散力dispersionforces分子间作用力中相当最弱的一种110kjmol随着分子变形性的增多而增大分子量表面积色散力存在于所有的分子之间17不同分子间作用力在同一物质中的大小kjmol取向力诱导力色散力ar849co00030008874hcl330511041682nh133115481494363819298996什么最弱的色散力在同一分子中总分子间力的比重通常比较大
大学无机化学第六章试题及答案

大学无机化学第六章试题及答案第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)A.KClO3B.Na2O2C.Na2OD.KI2.下列分子或离子中键能最大的是()A.O2B.O2-C.O22+D.O22-3.下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)A.LiIB.CIC.BeI2D.MgI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5.下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)A.FeCl3B.AlCl3C.SiCl4D.PCl56.对下列各组稳定性大小判断正确的是()A.O2+>O22-B.O2->O2C.NO+>NOD.OF->OF7.下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)A.H2O2B.NaCO3C.Na2O2D.KO38.下列各对物质中,是等电子体的为()A.O22-和O3B.C和B+C.He和LiD.N2和CO9.中心原子采取p2杂化的分子是()(《无机化学例题与习题》吉大版)A.NH3B.BCl3C.PCl3D.H2O10.下列分子中含有两个不同键长的是()A.CO2B.SO3C.SF4D.某eF411.下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A.H2OB.H3O+C.NH3D.NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C.氢键D.熔点的差别13.下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)l4B.CH3OCH3C.BCl3D.PCl514.下列哪一种物质只需克服色散力就能使之沸腾()A.HClB.CH3Cll4D.NH315.下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)A.NCl3B.SF4C.CHCl3D.H2O16.下列哪一种物质既有离子键又有共价键()2A.NaOHB.H2OC.CH3ClD.SiO217.下列离子中,中心原子采取不等性杂化的是()(《无机化学例题与习题》吉大版)A.H3O+B.NH4+C.PCl6-D.BI4-18.下列哪一种分子的偶极矩最大()A.HFB.HClC.HBrD.HI19.下列分子中,属于非极性分子的是()(《无机化学例题与习题》吉大版)A.SO2B.CO2C.NO2D.ClO220.下列分子或离子中,中心原子的杂化轨道与NH3分子的中心原子轨道最相似的是()(《无机化学例题与习题》吉大版)A.H2OB.H3O+C.NH4+D.BCl321.下列分子或离子中,构型不为直线形的是()(《无机化学例题与习题》吉大版)A.I3+B.I3-C.CS2D.BeCl222.下列分子不存在Ⅱ键的是()(《无机化学例题与习题》吉大版)A.COCl2B.O3C.SOCl2D.SO323.下列分子中含有不同长度共价键的是()(《无机化学例题与习题》吉大版)A.NH3B.SO3C.KI3D.SF424.下列化合物肯定不存在的是()(《无机化学例题与习题》吉大版)A.BNB.N2H4C.C2H5OHD.HCHO二填空题1.比较大小(《无机化学例题与习题》吉大版)(1)晶格能AlF3AlCl3NaClKCl(2)溶解度CuF2CuCl2Ca(HCO3)NaHCO32.NO+、NO2、NO2-的几何构型分别是、、、其中键角最小的是3.给出晶宝包中离子总数:立方ZnS;NaCl;CCl(《无机化学例题与习题》吉大版)4.CO2是分子;SO2是分子;BF3是分子;NF3是分子;PF5是分子。
基于“阶梯任务驱动+多维度输出”模式的无机化学课程教学设计与实施——以分子间作用力为例

大 学 化 学Univ. Chem. 2024, 39 (3), 122收稿:2023-09-04;录用:2023-09-14;网络发表:2023-09-22*通讯作者,Emails:*******************.cn(孟爽);**********************(戎梅竹)基金资助:国家一流本科课程建设项目-云南师范大学无机化学(1) (2022年);云南师范大学本科教学成果立项培育项目;云南师范大学课程思政建设项目-无机化学(2) (2023年)•教学研究与改革• doi: 10.3866/PKU.DXHX202309008 基于“阶梯任务驱动+多维度输出”模式的无机化学课程教学设计与实施——以分子间作用力为例孟爽*,龙海鑫,周舟,戎梅竹*云南师范大学化学化工学院,昆明 650500摘要:无机化学是大学化学专业一门基础学科,针对知识点分散、教学方式单一、学科思维培养不足等痛点,探索“阶梯任务驱动+多维度输出”模式,以分子间作用力为例进行教学设计与实施,评价方式采用多元交互式并引入Rubrics 评价量规。
教学实践结果表明,这种模式有助于学生个性化发展,提升学生自主参与意识,增强专业认同感,培养学科素养。
关键词:阶梯任务;多维度输出;无机化学;分子间作用力中图分类号:G64;O6Inorganic Chemistry Curriculum Design and Implementation of Based on “Stepped-Task Driven + Multi-Dimensional Output” Model: A Case Study on Intermolecular ForcesShuang Meng *, Haixin Long, Zhou Zhou, Meizhu Rong *College of Chemistry and Chemical Engineering, Yunnan Normal University, Kunming 650500, China.Abstract: Inorganic chemistry serves as a fundamental subject in university chemistry disciplines. To address the issues of fragmented knowledge points, monotonous teaching method and insufficient training in disciplinary thinking, we explored a “stepped-task driven + multi-dimensional output” model. Focusing on intermolecular forces as a case study, this approach incorporates diverse and interactive evaluation methods, including the use of Rubrics assessment scales. The practical implementation of this teaching model has shown promising outcomes, effectively facilitating personalized student development, enhancing active engagement, strengthening professional identification and cultivating disciplinary literacy.Key Words: Stepped-task; Multi-dimensional output; Inorganic chemistry; Intermolecular forces无机化学(1)是大学化学专业学生入学学习的第一门专业基础必修课,是四大化学(无机化学、物理化学、有机化学、分析化学)的基础,对后续的专业学习有重要的支撑作用,也是树立化学学科思维最重要的时期[1,2]。
无机化学知识梳理
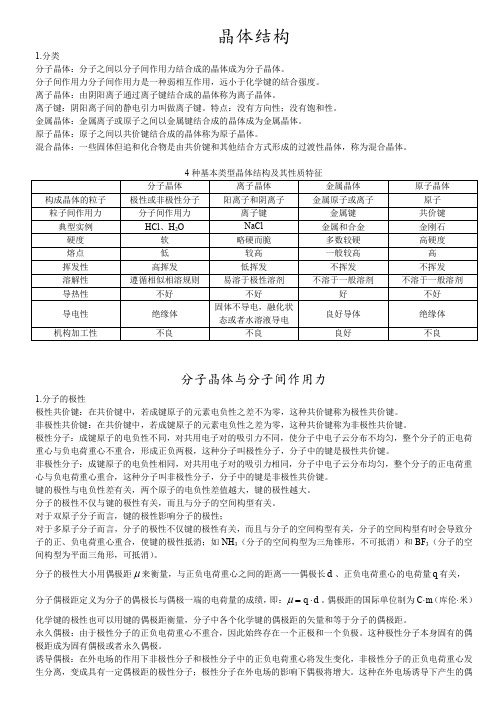
晶体结构1.分类分子晶体:分子之间以分子间作用力结合成的晶体成为分子晶体。
分子间作用力分子间作用力是一种弱相互作用,远小于化学键的结合强度。
离子晶体:由阴阳离子通过离子键结合成的晶体称为离子晶体。
离子键:阴阳离子间的静电引力叫做离子键。
特点:没有方向性;没有饱和性。
金属晶体:金属离子或原子之间以金属键结合成的晶体成为金属晶体。
原子晶体:原子之间以共价键结合成的晶体称为原子晶体。
混合晶体:一些固体但追和化合物是由共价键和其他结合方式形成的过渡性晶体,称为混合晶体。
分子晶体与分子间作用力1.分子的极性极性共价键:在共价键中,若成键原子的元素电负性之差不为零,这种共价键称为极性共价键。
非极性共价键:在共价键中,若成键原子的元素电负性之差为零,这种共价键称为非极性共价键。
极性分子:成键原子的电负性不同,对共用电子对的吸引力不同,使分子中电子云分布不均匀,整个分子的正电荷重心与负电荷重心不重合,形成正负两极,这种分子叫极性分子,分子中的键是极性共价键。
非极性分子:成键原子的电负性相同,对共用电子对的吸引力相同,分子中电子云分布均匀,整个分子的正电荷重心与负电荷重心重合,这种分子叫非极性分子,分子中的键是非极性共价键。
键的极性与电负性差有关,两个原子的电负性差值越大,键的极性越大。
分子的极性不仅与键的极性有关,而且与分子的空间构型有关。
对于双原子分子而言,键的极性影响分子的极性;对于多原子分子而言,分子的极性不仅键的极性有关,而且与分子的空间构型有关,分子的空间构型有时会导致分子的正、负电荷重心重合,使键的极性抵消;如NH 3(分子的空间构型为三角锥形,不可抵消)和BF 3(分子的空间构型为平面三角形,可抵消)。
分子的极性大小用偶极距μ来衡量,与正负电荷重心之间的距离——偶极长d 、正负电荷重心的电荷量q 有关, 分子偶极距定义为分子的偶极长与偶极一端的电荷量的成绩,即:d q ⋅=μ。
偶极距的国际单位制为C·m (库伦·米) 化学键的极性也可以用键的偶极距衡量,分子中各个化学键的偶极距的矢量和等于分子的偶极距。
分子间作用力

分子间作用力
分子间作用力是分子之间相互作用的力量,它对物质的性质和行为产生重要影响。
这些作用力影响着液体的表面张力、气体的压强、固体的熔点和沸点等物理性质。
在化学反应中,分子间作用力也扮演着重要角色,影响反应速率和产率。
分子间作用力可以分为几种主要类型:范德华力、氢键、离子键和共价键。
范德华力是非极性分子之间的弱作用力,它是由于电子在空间中的不均匀分布而产生的。
氢键是一种特殊的静电相互作用力,它发生在一个电负性较高的氢原子与一个电负性较低的原子之间。
离子键则是由正负电荷之间的相互吸引力产生的。
共价键则是由原子之间共享电子形成的。
这些分子间作用力的强弱决定了物质的性质。
例如,范德华力较弱,因此非极性物质通常具有较低的沸点和熔点。
氢键较强,使得水具有较高的沸点和熔点,以及较大的表面张力。
离子键较强,导致离子晶体具有高熔点,而共价键通常具有较高的强度和熔点。
在化学反应中,分子间作用力也可以影响反应的进行。
例如,在溶剂中,分子间作用力可以使溶质分子离解,促进化学反应的发生。
此外,在催化剂的作用下,分子间作用力可以调节反应的速率和选择性。
总而言之,分子间作用力是决定物质性质和化学反应过程的重要因素,它们的强弱和类型对物质的性质和行为产生重要影响。
武汉大学版无机化学课后习题答案(第三版)第11章分子结构

分子结构1. 试用离子键理论说明由金属钾和单质氯反应,形成氯化钾的过程?如何理解离子键没有方向性和饱和性?答:KCl 的形成表示如下: K(s)→K +(g)+e12Cl 2→Cl(g)Cl (g) +e → Cl -(g) K +(g) + Cl -(g) =KCl (s)离子键的本质是静电作用力,由于离子的电荷分布是球形对称的,因此它对异号离子的引力可以是任何方向,也就是没有方向性;一个离子的周围,能容纳多少个异离子,是随离子的半径变化而变化的,它没有固定的配位数,所以说离子键没有饱和性。
2.用下列数据求氢原子的电子亲和能。
()()K s K g → 1183H kJ mol -∆=⋅ ()()K g K g e +→+ 12419H kJ mol -∆=⋅ 21()()2H g H g → 13218H kJ mol -∆=⋅ ()()()K g H g KH S +-+→ 14742H kJ mol -∆=-⋅21()()()2K s H g KH S +→ 1559H kJ mol -∆=-⋅答:电子亲和能为下列反应的焓变,它由(5)-(4)-(3)-(2)-(1)得到: ()()H g e H g -+→543211597422184198337H H H H H H kJ mol -∆=∆-∆-∆-∆-∆=-+---=-⋅3. ClF 的解离能为1246kJ mol -⋅,ClF 的生成热为-56kJ/mol-1,Cl 2的解离能为238kJ/mol -1,试计算F 2(g)的解离能。
解:据题意:(1) ClF(g) = Cl(g) +F(g) ΔH 1 = 246 kJ ·mol -1(2)12Cl 2(g) +12F 2(g) = ClF(g) ΔH 2 = -56kJ/mol-1(3)Cl2(g) = 2Cl(g) ΔH3 = 238kJ/mol-12⨯(1)+2⨯(2)-(3)得F2 (g) = 2 F (g)ΔH =2 ΔH1+2ΔH2-ΔH3=2⨯246-2⨯56-238=142 kJ / mol-14. 试根据晶体的构型与半径比的关系,试判断下列AB型离子化合物的晶体构型:BeO NaBr CaS RbI BeS CsBr AgCl解:查表求各离子的Pauling半径如下表:Pauling半径(pm)计算各物质的正负离子半径比以及相应晶体构型如下表:5.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少?NaF AgBr RbF HI CuI HBr CsCl解:查表求出各元素的Pauling电负性数据如下表:各物质的电负性差和相应的离子性百分数如下表:6. 如何理解共价键具有方向性和饱和性?解:共价键是指两个原子间的化学键力通过共享电子而达到的稳定饱和结构的结合力。
分子间的作用

分子间的作用分子间的作用是指不同分子之间发生的相互作用和影响。
这些作用在化学、生物学和物理学等领域中起着重要作用,决定了物质的性质和相互之间的关系。
下面将从分子间的三种主要作用力——范德华力、氢键和离子键开始,探讨它们的特点和应用。
范德华力是分子间最常见的作用力之一。
它是由于分子中电子的运动而产生的瞬时偶极矩引起的。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
范德华力在生物体系中起着至关重要的作用,例如蛋白质的折叠、酶的催化等。
此外,在化学反应中,范德华力也会影响反应速率和平衡常数。
氢键是一种特殊的分子间作用力。
它是指氢原子与带有电负性较强的原子(如氧、氮和氟)之间的相互作用。
氢键的能量较强,使得氢键形成的分子具有特殊的物理和化学性质。
例如,水的氢键使得水分子具有较高的沸点和熔点,这对地球上的水循环起到重要作用。
另外,氢键也在生物分子的结构和功能中发挥着重要的作用,如DNA的双螺旋结构中的碱基配对。
离子键是由正负离子之间的静电相互作用形成的。
它是分子间作用力中最强的一种,能够形成稳定的晶体结构。
离子键在无机化学中起着重要的作用,如盐的结晶、金属与非金属的化合物等。
此外,离子键还在生物学中发挥着重要的作用,如细胞膜的形成和维持等。
除了范德华力、氢键和离子键,还有其他一些分子间作用力,如疏水作用和π-π相互作用等。
疏水作用是指非极性分子之间的相互作用,它是由于非极性分子互相排斥而产生的。
疏水作用在生物体系中起着重要的作用,如脂质的自组装和蛋白质的折叠。
π-π相互作用是指含有π电子体系的分子之间的相互作用,它是由于π电子云的重叠而产生的。
π-π相互作用在有机化学和药物设计中具有重要的应用价值。
分子间的作用力不仅仅是理论研究的对象,还具有广泛的应用价值。
例如,在药物设计中,了解分子间的作用力可以帮助研发出更安全、更有效的药物。
在材料科学中,通过调控分子间的作用力可以获得具有特殊性能的材料,如高强度的纳米材料和具有特定形状的分子筛。
分子间作用力概述

分子间作用力概述分子间作用力是指分子之间相互作用的力量,它是物质宏观性质的基础。
在化学和物理学中,分子间作用力可以分为三种类型:范德华力、氢键和离子键。
这些力量在分子之间产生各种不同的相互作用,从而决定了物质的性质和行为。
范德华力是一种临时性的、非极性的分子间相互作用力。
它是由于电子在分子内运动而产生的。
范德华力可以分为三种类型:分散力、取向力和诱导力。
分散力是由于分子间电子云的相互排斥而产生的,它是所有范德华力中最常见的一种。
取向力是由于分子间的极性相互作用而产生的,它是极性分子之间的相互作用力。
诱导力是由于分子间非极性分子的电子云在其他分子的影响下发生极化而产生的。
氢键是一种特殊的分子间相互作用力,它是由于氢原子与高电负性的原子(如氧、氮和氟)之间的相互作用而产生的。
氢键通常比范德华力更强,因此在很多情况下,氢键是决定分子间相互作用的主要力量。
氢键在生物化学、药物化学和物理化学等领域中起着重要的作用,它可以影响物质的溶解性、化学反应速率和分子结构等性质。
离子键是由于正负电荷之间的静电相互作用而产生的。
它通常发生在带正电荷的金属离子和带负电荷的非金属离子之间。
离子键是非常强的分子间作用力,因此离子化合物通常具有高熔点和高沸点。
离子键在无机化学和材料科学中起着重要的作用,它决定了盐的性质和晶体结构等。
除了范德华力、氢键和离子键之外,还有其他一些分子间作用力,如极性-极性相互作用、极性-非极性相互作用和离子-极性相互作用等。
极性-极性相互作用是由于两个极性分子之间的相互作用而产生的,它通常比范德华力更强。
极性-非极性相互作用是由于带正或负电荷的极性分子与非极性分子之间的相互作用而产生的。
离子-极性相互作用是由于离子与极性分子之间的相互作用而产生的。
总之,分子间作用力是物质中分子之间相互作用的力量。
它们可以影响物质的物化性质和行为。
范德华力是临时性的、非极性的相互作用力,氢键是由于氢原子与高电负性原子之间的相互作用而产生的,离子键是由于正负电荷之间的静电相互作用而产生的。
物理化学中的分子间力

物理化学中的分子间力物理化学是研究物质的性质和变化规律的学科,其中一个重要的概念就是分子间力。
分子间力是指分子之间相互作用的力,它决定了物质的性质和行为。
在物理化学中,我们常常会遇到分子间力的概念和应用。
本文将从分子间力的定义、种类和应用等方面进行探讨。
首先,我们先来了解一下分子间力的定义。
分子间力是指分子之间由于电荷分布不均匀而产生的相互作用力。
这种力可以分为三种类型:范德华力、氢键和离子力。
范德华力是由于分子中电子云的不均匀分布而产生的吸引力,它是一种弱的力,但是在大量分子的作用下可以产生显著的效果。
氢键是一种特殊的范德华力,它是由于氢原子与氮、氧、氟等电负性较高的原子之间的相互作用而产生的。
离子力是由于正负电荷之间的相互作用而产生的力,它是一种强的力,常常用于解释盐类的溶解性和晶体的结构。
接下来,我们来看一下这些分子间力在物质中的应用。
首先,范德华力在分子聚集和固体结构中起着重要的作用。
例如,范德华力可以使非极性分子相互吸引,从而形成液体或固体。
另外,范德华力还可以影响物质的沸点和溶解度等性质。
其次,氢键在生物化学和有机化学中有着广泛的应用。
例如,氢键可以稳定蛋白质和核酸的结构,影响生物分子的功能。
此外,氢键还可以影响有机化合物的性质和反应性。
最后,离子力在无机化学和电化学中有着重要的应用。
例如,离子力可以解释盐类的溶解性和晶体的结构。
此外,离子力还可以影响电解质的电导率和电化学反应的速率。
除了这些基本的分子间力之外,还有一些其他的相互作用力也在物理化学中起着重要的作用。
例如,静电力可以由于分子中正负电荷之间的相互作用而产生。
此外,疏水力可以由于分子中非极性部分的排斥而产生。
这些相互作用力在物质的性质和行为中也起着重要的作用。
总之,物理化学中的分子间力是研究物质性质和变化规律的重要概念。
分子间力可以分为范德华力、氢键和离子力等类型,它们在物质中起着不同的作用。
范德华力可以影响物质的聚集和固体结构,氢键可以稳定生物分子的结构,离子力可以解释盐类的溶解性和晶体的结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(b)NO分子不对称,而O2、N2都是对称分子,所以NO的取向力特别大,沸点高于O2、N2。
2、在乙醇、二甲醚、联氨中存在氢键的是乙醇和联氨。这是因为二甲醚是对称性分子,而且碳氧键处于中间位置。而乙醇和联氨的氢氧键、氮氢键在分子的一端。
3、H2分子间主要有色散力、诱导力,CCl4分子间主要也有色散力、诱导力,NH3分子ቤተ መጻሕፍቲ ባይዱ除了色散力、诱导力之外还有取向力。
