不饱和羧酸和取代羧酸
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
南昌大学有机化学16 不饱和羧酸和取代羧酸

戴延凤博士 yfdai@
1
16.1 不饱和羧酸
一、不饱和羧酸的制法 芳醛的缩合反应
PhCHO + CH2(COOH)2
吡吡, 六六吡吡 回回
phCH
CHCO2H
PhCHO + (CH3CO)2O
PhCHO + CH3COOEt
CH3CO2Na 180 C
16.9 碳酸衍生物
20
练习: 练习: CH2COOH 1. 以丙二酸二乙酯为原料,合成 以丙二酸二乙酯为原料,
CH2COOH
T.M
(1) EtONa EtOH CH(CO Et) (1) NaOH 分 2 2 CH2(CO2Et)2 (2) ClCH2COOC2H5 CH COOC H (2) H O + 析 3
O CH2CH2OC2H5OC C COOC2H5 CH CH O2 2
C2H5ONa
CH2(CO2Et)2 O
EtONa 0.5 C
o
o
phCH
CHCO2H
5h
phCH
2h
CHCO2Et
2
二、α,β-不饱和羧酸的反应 不饱和羧酸的反应 1,4-加成(共轭体系) 加成(共轭体系) 加成
CH2 CHCOOH
狄尔斯-阿德尔反应(亲双烯体系) 狄尔斯 阿德尔反应(亲双烯体系) 阿德尔反应
三、α,β-不饱和羧酸的用途 不饱和羧酸的用途 甲基丙烯酸甲酯: 甲基丙烯酸甲酯:有机玻璃的原料 丙烯腈 丙烯腈:合成纤维原料
2 2 5
2.以丙二酸二乙酯为原料,合成 CH2CH2COOH 以丙二酸二乙酯为原料, 以丙二酸二乙酯为原料
CH2CH2COOH
羧酸及取代羧酸

CH3 CH CH2 COOH
OH
3–羟基丁酸
β–羟基丁酸
HO CH COOH
CH2 COOH
羟基丁二酸 (苹果酸)
HO CH COOH
HO CH COOH
2,3–二羟基丁二酸 (酒石酸)
CH2 COOH HO C COOH
3–羟基C–H32–羧C基OO戊H二酸 (柠檬酸)
2、酚酸:羟基和羧基连在芳环上
CH CH COOH CH3 CH3
2,3-二甲基丁酸
(2)脂肪族二元羧酸的系统命名:选择包含两个羧基的最长
碳链作为主链,根据碳原子数称为“某二酸”。
HOOC COOH HOOC CH2 COOH HOOC CH2 CH2 COOH
乙二酸(草酸) 丙二酸 丁二酸(琥珀酸)
CH3 CH COOH
CH2 COOH 甲基丁二酸
一 、羟基酸的结构分类和命名
羟基酸分子中含有羟基和羧基,羟基酸可分为:
1、醇酸:羟基和羧基均连在脂肪链上,醇酸可根据羟基 与羧基的相对位置分为: α-羟基酸、β-羟基酸、γ-羟基酸,羟
基连在碳链末端时,称为ω–羟基酸
命名时以羧酸为母体,羟基作为取代基。(一般以俗名为主)
CH3 CH COOH
OH 2–羟基丙酸
元酸易溶。 3.熔点:有一定规律,随着分子中碳原子数目的增加呈锯齿
状的变化。乙酸熔点16.6℃,当室温低于此温度时 4.沸点:比相应的醇的沸点高。原因:通过氢键形成二聚体
羧酸的化学性质 根据羧酸的结构,它可发生的一些主要反应如下所示
脱羧反应
O
羟基被取代的反应
R CH C O H 酸性和成盐反应
H
α-氢的反应
不饱和羧酸和取代羧酸

CH 3
• 2.芳醛的缩合反应(普尔金和脑文格反应)
• 三. a,β-不饱和羧酸的反应 • a,β-不饱和羧酸及其衍生物分子中含有共轭双键体系,与 a,β-不饱和醛酮相似,容易起1,4-加成反应。例如:
OHCCOOH
乙醛酸能形成稳定的水合物 (HO) 2CHCOOH
• 丙酮酸由相应的腈水解得到,能还原土伦试剂,用硝 酸氧化则生成草酸,与稀硫酸加热脱酸生成乙醛,与 浓硫酸加热则生成乙酸,这是a-酮酸的特性反应.
O O O
CH 3CCl
O
NaCN
CH 3CCN
H3O+
CH 3CCOOH
Ag(NH3)2+
O H3C C O H CH2 CH3COH + CO2 O H3C O H O CH3CCH3 + CO2 O O
有的多环β –酮酸加热时不脱羧,可能是由于脱羧生成的烯 醇含有张力很大的桥头双键,不容易生成。 β –酮酸酯是稳 定的。
• 三. γ-酮酸 • 4-戊酮酸是最简单的γ-酮酸,加热容易脱水:
2-羟基丙酸 羟基丙酸 乳酸
COOH OH
2-羟基苯甲酸 邻羟基苯甲酸 水杨酸
COOH HO OH OH
3,4,5-三羟基苯甲酸 没食子酸
COOH CHOH CHOH COOH
2,3-¶¶¶¶¶¶ ¶ ù á , '¶¶¶¶¶¶ ¶ ù á ¶¶á ¶
COOH CHOH CH2 COOH
2-¶¶¶¶¶ ¶ù á ¶¶¶¶¶ ¶ù á ¶¶¶ á
CH2COOH HO-C-COOH CH2COOH
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
不饱和羧酸和取代羧酸

4
C
3
C
2
OH
+ HL
1,4 加成
OH C L C C C OH L CH C
O OH
HX
XCH2CH2COOH
卤代
H2O CH2 CH COOH HCN
OHCH2CH2COOH
羟基 氰基 氨基
CNCH2CH2COOH
NH3
NH2CH2CH2COOH
CH2
CH COOH + HN(CH2CH2COOH)2
方法改进: 碱性强,位阻大的LDA使烯醇化完全,而其本身又不与酯反应
O CH3COEt + [(CH3)2CH]2NLi
-+
THF
OLi CH2 C OEt
+ [(CH3)2CH]2NH
二异丙氨基锂(LDA) Li
O (CH3)2C CH2
OH
+
O C OEt OLi
O (CH3)2CCH2COEt H2O
3. 羟基睛的水解 分子中同时含有-OH 和-CN, 如何制备?
O CH3CH2CCH3 NaHSO3, NaCN
CH3 CH3CH2C CN OH
H+ CH3 CH3CH2C COOH OH
CH2 CH2 NaCN OH Cl
CH2 CH2 H+ OH CN
CH2CH2COOH OH
4. Reformatsky 反应
COOH OH
COOH
COOH
COOH
>
OH
>
H O O C
>
OH
pKa = 2.69
OH COOH
-
羟基和羧基邻位效应;共轭
16-不饱和羧酸和取代羧酸

成酮水解 1) OH-,H2O 2) H3O+
1) EtONa , EtOH 2) H3O+
成酸水解
O O
O O OH
例五
O
O
1) EtONa , EtOH
2) CH3CCl OEt
O
O
O
成酮水解 1) OH-,H2O 2) H3O+
O
O
OEt
H3CC O
1) EtONa , EtOH
O
O
2) H3O+
O
C CH3
O C CH2
EtONa OEt
O
O
-O
O
-
O
O
C
C
C
C
C
C
Na+
-
CH3 CH
OEt CH3 CH
OEt CH3 CH
OEt
Na+
O
O
O
-
RX
C
C
C
CH3 C
OEt
CH3 CH
H
R
O
OR
+
C
C
OEt CH3 CH
O C + NaX
OEt
C-烃化产物
O-烃化产物
Na+
O
O
-
C
C
CH3 C
n-C5H11
COOEt CH
COOEt
1) EtONa , EtOH 2) CH3I
H3C
n-C5H11
COOEt C
COOEt
NaOH , H2O H3O+
n-C5H11
CH3
第十五章不饱和羧酸和取代羧酸分析

COOH
cyclohexa-1,4-diene-1,2-dicarboxylic acid
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
三、 卤代酸 halocarboxylic acid
• 1、 卤代酸的制备: • 1)酰氯与HX NBS催化,再水解得α-卤酸; • 卤素红磷催化制备α-卤代酸。
2、卤代羧酸的性质 1)卤代羧酸的酸性 • 卤原子吸电子,酸性增强。 2)亲核取代反应(类似于卤代烃)
Br O NuR OH R OH Nu O
• Nu = 氢氧根、氰根、胺基。
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
3)用卤代羧酸制备其它取代羧
• 用不同试剂取代可以制备不同的取代羧酸。
Br O HO R Br OH O CN R Br OH O NH3 R OH R OH R H2N OH O
O HBr H5 C6 Cl NBS H5 C6 Cl Br O
H2O
Br
O
H5 C6
OH
O
Br
O
Br Br
H 5 C6 OH
P
H 5 C6
OH
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
2)β—位卤代酸的制备 α ,β-不饱和羧酸与卤化氢加成。
R HBr Br
OH O
R
OH
O
华中农业大学理学院
O
Br CH3
OH
O
AgO H2O
δ-hexanoic lactone
CH3
CH3
O O AgO H2O OH
O
ε-庚内酯 ε-heptanoic lactone
华中农业大学理学院
不饱和羧酸和取代羧酸

不饱和羧酸和取代羧酸
(Unsaturated carboxylic acid and Substituted carboxylic acid )
第十六章
不饱和羧酸和取代羧酸 (Unsaturated carboxylic acid and Substituted carboxylic acid )
H+ HO( CH2)5COO H
ε– 羟基己酸
K2CO 3
Br(CH 2)10COOH CH3COOE t
Br(CH 2)10COO
ω–卤代酸 (碳数在9以上)
O
C
(CH2)10 O
在极稀的溶液中进行
85%
大环内酯
24
2). 达让(Darzer)反应 指α-卤代酸酯在醇钠或氨基钠作用下与醛酮发生的 羟醛缩合反应,产物为αβ-环氧酸酯。
C6H5CHC Cl
ROH
Br
O
C6H5CHC OR
Br
20
2). β– 卤代酸
ቤተ መጻሕፍቲ ባይዱ
O
CH2 CH C OH + HX
CH2 CH2 COOH X
3). γ, δ 等卤代酸用二元羧酸的单酯发生汉斯狄克反应
O
AgNO 3 , KOH
O
ROC CH 2 n COOH
ROC CH 2 n COOA g
Br2 , CCl4
C6H5
H
CC
H
COOH
(E )–3–苯基丙烯酸 (肉桂酸)
H
H
CC
C6H5
COOH
(Z )–3–苯基丙烯酸
(异肉桂酸)
3
CH3(CH2)7CH CH( CH2)7COOH
有机化学讲义--第十三章羧酸和取代羧酸

羧酸和取代羧酸
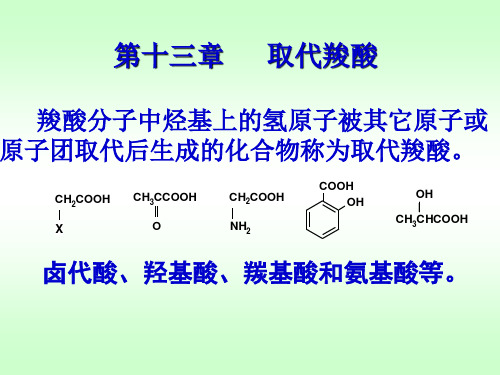
羧酸(carboxylic acids):分子中含有羧基 (carboxyl)(-COOH)的有机化合物。羧酸 的官能团是羧基,除甲酸( HCOOH)外,都 可以看作烃中的氢被羧基取代的烃衍生物。
取代羧酸(substituted carboxylic acids): 羧酸分子中的烃基上的氢被其他原子或原子 团取代后的化合物。
一、分类和命名
羧酸是由烃基和羧基两部分构成。
1 、按照与羧基相连的烃基不同:脂肪酸、脂环酸和 芳香酸
2 、按照羧基数目不同:一元酸、二元酸和多元酸
3 、按照烃基饱和程度不同:饱和酸和不饱和酸;不 饱和酸又可分为烯酸和炔酸。 4 、取代羧酸包括卤代酸、羟基酸、氧代酸(羰基酸) 和氨基酸等。各类取代羧酸又可根据取代基和羧基的 相对位置,分为α-,β-,γ-,δ-等取代羧酸。
多官能团化合物的优先次序为: (优先,作母体)羧酸 > 磺酸 > 酸酐 > 酯 > 酰卤 > 酰胺 > 腈 > 醛>酮>醇>酚>胺>醚>烃 (后者作取代基)。
二、羧酸的制备
1、醇、醛的氧化:KMnO4, CrO3, 子中其他不饱和键没有影响) Ag2O(用于醛且对分
( O ) R C H O H R C O O H 2 ( O ) R C H O R C O O H
+ ( O H )
O R C O H+H L
H R C N R C O O H H O 2
三、物理性质
溶解性:丁酸以下与水混溶,5-11碳部分溶解;羧酸盐 溶解性好(表面活性剂)。 熔点呈锯齿状上升,偶数碳原子的熔点比它前后相邻两 个奇数碳原子同系物的熔点高,
第16章 不饱和羧酸和取代羧酸

16.3.3.2 三氟乙酸 工业上由乙酰氯,氟化氢和氟化钠的混合物电解生 产三氟乙酰氯,再水解得到三氟乙酸。
三氟乙酸为无色液体,沸点:71.8℃。能与水、全氟代烃和多数有机物 混溶,蛋白质和聚酯树脂也能溶于其中。
三氟乙基对许多常用试剂是稳定的。例如:三氟乙酸用氢化铝锂还原, 生成三氟乙醛和三氟乙醇:
O CF3COH 三氟乙酸 1. LiAlH4 2. H2O O CF3CH + CF3CH2OH 三氟乙醛 三氟乙醇
为什 么?
三氟乙酸的酯和酰胺比一般的羧酸酯和酰胺更容易水解 。因
此,三氟乙基可用做氨基和羟基的保护基,反应完毕后容易水解除去。
三氟乙酸和三氟乙酐是有机合成中有用的试剂。例如下面反应中,用三 氟乙酸作试剂,可以使反应在温和的条件下进行。
H (CH2)7CO2H 反油酸 mp: 51℃ HO2C H
HO2C
H CO2H 富马酸 mp: 287℃
H H 马来酸 mp: 130℃
反式异构体分子比顺式异构体能够紧密地排列在晶格中,因此, 一般具有较高的熔点,而顺式异构体在水中的溶解度则大于反式。
16.1.2 不饱和羧酸的制法
饱和羧酸的一些制备方法也适用于不饱和羧酸。例如:
3 4 5
§16.1 不饱和羧酸
不饱和羧酸是分子中含有不饱和键的羧酸,包括烯酸和炔酸。根据羧基 与重键的相对位臵,可分为α,β-不饱和羧酸,β,γ-不饱和羧酸等。
16.1.1 不饱和羧酸的结构
α,β-不饱和羧酸中烯键与羧基组成共轭体系,比β,γ-不饱和羧酸稳定。 一些不饱和羧酸酯的生成热为:
CH2 CH CH2 CO2Et kJ/mol 385.6± 2.6 H H C C CH3 H3C H C C H H H C C Et CO2Et Et H C C H CO2Et
《有机化合物的分类和命名》羧酸命名规则

《有机化合物的分类和命名》羧酸命名规则有机化合物的分类和命名——羧酸命名规则在有机化学的广袤世界中,有机化合物的分类和命名是我们理解和研究这些物质的基础。
而羧酸作为一类重要的有机化合物,其命名规则有着独特的规律和特点。
接下来,让我们一同深入探索羧酸的命名规则。
首先,我们需要了解羧酸的结构特点。
羧酸是由羧基(COOH)与烃基相连所构成的有机化合物。
羧基是羧酸的官能团,它决定了羧酸的化学性质和命名方式。
对于简单的羧酸,其命名通常是根据所含的碳原子数来命名。
例如,含有一个碳原子的羧酸称为甲酸,含有两个碳原子的羧酸称为乙酸,含有三个碳原子的羧酸称为丙酸,以此类推。
当羧酸分子中的烃基是直链烃基时,命名是将相应的烃名改为“某酸”。
例如,CH₃CH₂CH₂COOH 被命名为丁酸。
如果烃基是支链烃基,那么我们需要按照一定的规则来确定主链。
主链应是包含羧基的最长碳链。
编号时,从羧基的碳原子开始,给主链上的碳原子依次编号。
例如,被命名为 2-甲基丁酸。
对于含有多个羧基的羧酸,我们在命名时要使用数字来表示羧基的数目。
例如,HOOCCOOH 被称为乙二酸,HOOC(CH₂)₄COOH 被称为己二酸。
当羧酸分子中还含有其他官能团时,羧基始终作为主官能团,其他官能团作为取代基。
命名时,按照取代基的位置、名称和数目依次列出。
例如,被命名为 3-氯丁酸。
此外,还有一些常见的羧酸具有特定的俗名。
比如,苯甲酸又称为安息香酸,草酸是乙二酸的俗称。
在复杂的羧酸命名中,我们还可能会遇到环羧酸的情况。
对于环羧酸,如果羧基直接连在环上,一般以“环某酸”来命名。
例如,被称为环己烷羧酸。
如果环上还有其他取代基,编号则从羧基所连的碳原子开始。
另外,不饱和羧酸的命名也有其特点。
如果羧酸分子中含有碳碳双键或三键,那么在命名时要标明双键或三键的位置。
例如,被命名为3-丁烯酸。
总之,羧酸的命名规则虽然看似复杂,但只要我们掌握了其中的规律和要点,就能够准确地对各种羧酸进行命名。
12-1第十二章 羧酸

可逆反应
脱水方式
2、成酰卤(acyl halide)反应
所用的试剂为: PX3 、PX5 、SOCl2 等。
低沸点酰卤制备 高沸点酰 卤制备 低、高沸点 的酰氯制备
3、成酸酐(acid anhydride)反应
羧酸在脱水剂如五氧化二磷的存在下,加热。两 分子羧酸失去一分子水而形成酸酐。
R-C OH R-C OH O
△
O CH3-C- CH2COOH
- -
Cl3CH + CO2↑ O CH3-C-CH3 + CO2 ↑ = HOOC-CH3 + CO2 ↑
△ △
HOOC-CH2-COOH
=
羧酸自由基很容易脱羧放出CO2。
O O O -C-O ·
· +CO2
-C-O-O-C-
柯尔伯反应---羧酸碱金属盐电解制备烷烃。 2RCOOK+2H2O
C10 以上 蜡状固体,没有气味
芳香族羧酸(Ar-COOH) 和脂肪族二元羧酸为结晶的固体
⒉ 沸点
液态脂肪酸以二聚体形式存在。所以羧酸的沸点比相对分 子质量相当的醇高。 H-O O R-C C-R O-H O 氢键
⒊ 熔点
饱和一元酸的熔点随碳链的增长而升高,显锯齿状变 化,即含偶数碳原子羧酸的熔点比前后两个相邻的含奇数 碳原子酸的熔点要高。(分子的对称性)
CH2-OH + H2O
NaOH
O CH-OH + 3R-C-ONa
CH2-OH
甘油
H+
高级脂肪酸主要是: 软脂酸(十六烷酸) 硬脂酸(十八烷酸) 油 酸(十八碳-9-烯酸)
O R-C-OH
脂肪酸
从发酵制取的食醋中可获得乙酸。 不少羧酸目前仍用发酵法生产,例 如:苹果酸、酒石酸、柠檬酸等。
羧酸和取代羧酸

羧酸的系统命名法与醛相似。对于简单的脂肪 酸也常用 a、b、g 等希腊字母表示取代基的位次;
CH3 CH3-CH2-CH-CH2-CO2H
54 3 2 1 gb a
3-甲基戊酸 b-甲基戊酸
CH3 Br-CH2-CH2-CH-CO2H
4321 g ba
2-甲基-4-溴丁酸 a-甲基-g-溴丁酸
6
Cl
Cl
Cl
pKa 2.84
4.06
4.52
4.82
(4) HO2C-CO2H HO2C-CH2-CO2H HO2C-CH2CH2-CO2H
Ka1 5.9×10-2
1.6×10-3
6.8×10-5
电离后的羧基负离子对第二个羧基有斥电子 诱导效应,因此第二个羧基比第一个难离解。
15
(5)
COOH
COOH
20
21
(3) 酯(ester)的生成
O C6H5-C—OH + H O-CH3
H2SO4
D
O C6H5-C—O-CH3 + H2O
85-95%
HO2C(CH2)4CO2H+C2H5OH
H2SO4
甲苯/D
OO C2H5O-C(CH2)4C-OC2H5+H2O
95%
该反应可逆,必须在催化剂及加热下才能较快进
1. 羧酸的结构 羰基与羟基通过p-p共轭构成一个整体 2. 命名 俗名; 系统命名 3. 性质 酸性;生成羧酸衍生物;二元酸脱羧 4. 羟基酸 酸性;氧化;脱水;酚酸脱羧 5. 酮酸 酸性;脱羧
29
合物称羧酸衍生物(derivatives of carboxylic acid)。
O R C OH
第16章 不饱和羧酸和取代羧酸

第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢 α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O② Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C CHCOHOO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法① α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2O HBr,NBSCHCCl O CHCOR O② β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起S N 2反应,生成α-取代羧酸。
ClCH 2COR O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
不饱和羧酸和取代羧酸

第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
b5E2RGbCAP C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O②Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C OHXO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法①α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2OHBr,NBSCHCCl O CHCOR O Br②β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC CHCOH O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起反应,生成α-取代羧酸。
p1EanqFDPw ClCH 2O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
第十六章不饱和羧酸和取代羧酸

CH C COH 3
O O
2 4 CH C COH 3
2 4 CH C COH 3
乙醛酸;存在于未成熟的果实中。
=
O O
O O
=
n=0,1,2……,α,β,γ……
= =
与水混溶
Ag(NH ) 3 2
O
= == == =
CH C OH 还原吐伦试剂 + 2 CO 3
O +2 CO CH C H 3
H SO (dil.)
NaCN
O NCCH COH 2
=
=
O O NaCN BrCH COC H NCCH COC H 2 2 5 2 2 5
=
=
=
β-卤代酸
1 ) O H R C H C H C O O H R C H = C H C O O H 2 + 2 ) H B r
脱 HX 成 内 酯
γ ,δ -卤代酸
=
作为配体与过渡金属离子形成络合物 γ - 极易形成内酯
+ H H O C H C H C H C O O H 2 2 2
O
O
δ - 形成内酯,但较难
H O ( C H ) C O O H 2 4
+ H
O
O
O
O
n 1
S b O 2 3 [ ] n H O ( C H ) C O O H n H O ( C H ) C O ( C H ) C O H + H O 2 8 2 8 2 8 2
=
机理
CH (CO H) 2 2 2
OH
O
=
N H
PhCH CH(CO H) 2 2
O
COOH PhCH-CH COOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HO
CH3
H
CH3
(1) B2H6 (2) H2O2 , OH
O CF3COOH
O O
OH CH3
O
CrO3
CH3
CH3
1. NaOH , EtOH 2. H3O
O CH3CH(CH2)4COH OH
练习:完成下列转化
CH3CHCH 2CH2OH CH3 CH3CHCH 2CHCOOH CH3 OH
C6H5CHO + (CH3CH2CO)2O
CH3CH2COONa
C6H5CH C COOH CH3
α–甲基肉桂酸 5). 诺文葛耳(Knoevenagel)反应
指具有活泼亚甲基的化合物,在碱性试剂存在
下和醛发生的加成-消去反应。
含有活泼亚甲基的化合物:
Y CH2 Y'
(Y 、 Y' 可为
O
CO2C2H5
③可制备β–醇酸酯,β–醇酸,α,β–不饱和羧酸。 练习:
1.
2. 答案:1.
O
+
BrCH2CO2Et
1. Zn 醚 2. H H2O
CHO
+
OH
BrCH2CO2Et
1. Zn 醚 2. H H2O
1. OH , H2O
2. H
CH2CO2C2H5
OH
2.
CHCH 2CO2C2H5
CH CHCOOH
O CH2 CH C OH +
HX
CH2 CH2 COOH X
O CH2 CH C O CH2 CH C O CH2 CH C OH + NH 3
CH2 CH2 COOH NH2
OH +
H2O
CH2 CH2 COOH OH
OH + HCN
CH2 CH2 COOH CN
2).
D–
2. 卤代酸的反应 1). 与碱反应
O R CH X C OH
O
OH H 2O H
R CH OH
C OH
α-卤代酸
O R CH X CH2 C OH
OH H 2O
H
β-卤代酸
R CH CH COOH
有 -H,在碱作用下,生成 ,β-不饱和酸。
CH2 R CH X
CH3 CH3
1. KOH , H2O 2. H
O CHCCH3 CH3
O CHCCH3 CH3
练习:以苯为原料通过 Darzer 反应合成
三. 醇酸 (hydroxy–acid) 定义: 羟基连在饱和碳原子上的羧酸。
HOOCCH CHCOOH OH OH
HOOCCH 2CHCOOH OH
酒石酸
CH3CHCOOH OH
苹果酸
COOH HOOCCH 2 C CH2COOH OH
乳酸 柠檬酸 很多醇酸作为生化过程的中间产物存在于天然 产物中,例:肌肉中:L-(+)-乳酸,葡萄糖 发酵得R-(+)-酒石酸,蔗糖发酵得D-(–)-乳 酸。
1. 醇酸的制备 1). α–卤代酸水解制备α– 醇酸 * R CH
一. 不饱和羧酸 二. 卤代酸
三. 醇 四. 酚 酸 酸
五. 羰基酸 六. β– 酮酸酯 七. 乙酰乙酸乙酯和丙二酸酯合成法 八. 碳酸衍生物
一. 不饱和羧酸 (Unsaturated carboxylic acid ) 定义:羧酸分子中含有不饱和键(双键、叁键)的羧酸。 烯酸
不饱和羧酸
炔酸 烯酸:C6H5CH
C6H5CH CH COOH
N H
CH3CHO + CH2(COOH) 例: 2
CH3CH CH COOH
(CH3)2N 例:
CHO
+
N H
CH3NO2
CH CHNO 2
(CH3)2N
CHO
+
NH HOAc
H5C2OOCCH2SO2CH3
CH CSO2CH3 COOC2H5
3. α,β– 不饱和羧酸的反应 1). 共轭加成
O
EtONa
C CH3
CHCO 2Et
O
NaOH H2O
O
H CHCO 2Na
O CH C O H
C CH3
C CH3
CO2
C CH3
CH OH
CH CHO CH3
O
例:
+
O
ClCH2CO2Et
(CH3)3COK
COOC2H5
O RCR(H) + 总之:
1. KOH , H2O 2. H
1. KOH , H2O 2. H
O CH3COC(CH 例: 3)3
LDA , THF
O
H3O
OH O CH2COC(CH 3)3
制备β– 醇酸还可用如下方法:
例:2 RCH2CHO
OH
OH RCH2CHCHCHO R OH Ag2O H
例: HOCH2CH2Cl
NaCN
RCH2CHCHCOOH R
HOCH 2CH2CN
H H2O
α,β– 二溴丁酸 2,3 – 二溴丁酸 ω– 溴戊酸 5 – 溴戊酸 性质比较特殊。
CH2CH2CH2CH2COOH Br
COOH X
1. 卤代酸的制法 1). α – 卤代酸
O
P
O
Br2
RCH2COH
O C6H5CH2CCl
RCHCOH Br
O
HBr , NB S
C6H5CHCCl Br
ROH
H2O
CH2
CH
COOH
CH3CHCOOH Br
CH3CH2COOH
4). 佩金(Perkin)反应 指芳香醛和酸酐在相应羧酸钠(或钾)盐存在 下发生的类似于羟醛缩合的反应,最终得到 α,β– 不饱和羧酸。
O O
C6H5CHO
+ CH3COCCH 3
CH3COONa
C6H5CH CH COOH
肉桂酸
Br(CH2)10COO
Br(CH2)10COOH CH COOEt 3
ω–卤代酸 (碳数在9以上)
O C
在极稀的溶液中进行
(CH2)10
O
85% 大环内酯
2). 达让(Darzer)反应
指α-卤代酸酯在醇钠或氨基钠作用下与醛 酮发生的羟醛缩合反应,产物为αβ-环氧 酸酯。
O R C R'(H)
+ ClCH2CO2Et
X
OOC
O C OH
+
OH
H 2O
* R CH
OH
O C OH
例:
H H3C
浓 OH
Br
COOH
S N2
H H2O
HO H CH3
S-2-溴丙酸
OOC
R-乳酸
HOOC
例:
H H3C
g2O 稀 OH , A
Br
邻 基 参 与 机 理
H H2O
OH H H3C
S-2-溴丙酸
S-乳酸
2). α– 羟基腈水解制备α– 醇酸
O C6H5CHC OR Br
2). β– 卤代酸
O CH2 CH C OH
+ HX
CH2 CH2 COOH X
3). γ, δ 等卤代酸用二元羧酸的单酯发生汉 斯狄克反应
O O AgNO3 , K OH ROC CH2 n COOAg ROC CH2 n COOH
Br2 , CC l4
O H+ , H2O ROC CH2 n Br
EtONa
α-氯代酸酯
O R C (H)R' CHCO 2Et
α,β-环氧酸酯
机理:
ClCH2CO2Et
EtONa
O R C R'(H)
ClCHCO 2Et
O R C CHCO 2C2H5
O R C (H)R' CHCO 2Et
R'(H) Cl
α,β- 环氧酸酯
在合成上的应用:
O C CH3 + BrCH2CO2Et
CN R C H OH
H H2O
R CHCOOH OH
3). 瑞佛尔马斯基(Reformatsky)反应 (用于制备β– 醇酸及其衍生物) 指α– 溴代酸酯与醛或酮在惰性溶剂中和锌粉 反应,产物水解得β– 醇酸酯的反应。
R O (H)R'
+
BrCH2CO2Et
1. Zn, Et2O 2. H , H2O
C6H5 C H C COOH
C6H5
CHCO 2H
H
H C C
H COOH
(E )–3–苯基丙烯酸 (Z )–3–苯基丙烯酸 (异肉桂酸) (肉桂酸)
CH3(CH2)7CH
CH( CH2)7COOH
OH
C H
C H
O
(Z )-9-十八碳烯酸 (油酸)
H C H C O OH
( E )-9-十八碳烯酸 (反油酸)
CO2CH3
1 , 3-丁二烯 丙烯酸甲酯
3-环己烯甲酸甲酯
练习: 以环戊二烯和4C以下有机物为原料合成:
HOOC COOH
COOH
COOH
解:
+
COOH
1. KMnO 4 2. H2O
HOOC
COOH
COOH
练习: 用不超过3C的有机化合物及必要的试剂合成:
COOH
O
解:2 CH3CCH3
Al2O3
比较新的制备β– 醇酸酯, β– 醇酸的方法:
O CH3COEt
