《醇的性质与应用》公开课课件
合集下载
醇的性质和应用上课ppt课件
饱和一元醇通式:
CnH2n+1OH或 CnH2n+2O
阅读教材第71页有关甲醇、乙二醇 和丙三醇的介绍,总结三种醇的 物理性质和常见用途。
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
新
知
可上网查看相 关危害新闻哦!
思考
⑴如何区分乙醇溶液和无水乙醇?
取少量酒精,加入无水硫酸铜, 若出现蓝色,则证明是工业酒精.
⑵如何实现由乙醇溶液向无水乙醇转化?
乙醇溶液 加CaO生成Ca(OH)2 无水乙醇
(96%)
蒸馏
(99.5%)
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
3CH3CH2OH+2K2Cr2O7+8H2SO4→
(橙红色)
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(绿色)
= =
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
知识拓展
(1). 2R—CH2—OH + O2
认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依 次加入2 mL蒸馏水、4 mL浓硫酸、 2 mL 95%的乙醇和3 g 溴化钠粉末, 在试管II中注入蒸馏水,烧杯中注入 自来水。加热试管I至微沸状态数分 钟后,冷却,观察并描述实验现象。
2.在该反应中,采用蒸馏水、浓硫 酸和溴化钠固体的目的是获得与乙 醇作用的氢溴酸。根据上述实验现 象,你能判断出乙醇与氢溴酸反应 的产物吗?请设计实验证明试管II中 收集到的是卤代烃吗?
醇的性质与应用 PPT课件

[问题4]下图为乙醇和氢溴酸反应的实验装置,该实验 过程中并没有直接加入氢溴酸,氢溴酸是如何获得的? 实验中可观察到试管I中的溶液由无色变橙黄色、试管II 中溶液分层,下层为无色油状液体。推测可能的原因?
[问题5]实验时为什么需要往试管I、试管II中加入少量 蒸馏水?及烧杯中注入的自来水有何作用?设计实验证 明该实验过程中有溴乙烷生成?
有机化学基础
专题4、烃的衍生物
第二单元 醇 酚 第一部分、醇的性质和应用
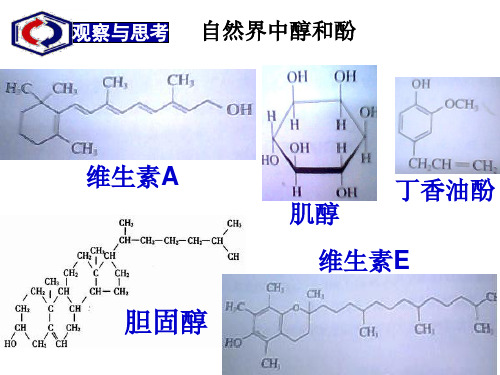
[问题1]分别写出胆固醇、维生素A、丁香油酚三种有 机化合物的分子式以及结构中具有的官能团名称?
[问题2]三只烧杯中分别加入乙醚、无水乙醇、水,从 煤油中取出一块金属钠,切去表层后分成三等份,分别 放入三只烧杯中,观察现象?推测乙醚、乙醇、水中氢 原子的活泼性强弱?实验中产生的气体成分?如何证明?
反应物
反应条件
Na
不需要
与O2催化氧化 Cu或Ag、加热 CH3COOH 浓硫酸、加热
HX
加热
脱水
浓硫酸、1400C
反应
浓硫酸、1700C
反应类型
断键方式
[问题11]饱和一元醇的通式?写出最简单的饱和一元 醇的分子式?阅读教材第70页了解这种物质性质?
[问题12]阅读教材第71页了解根据醇羟基的分类方式, 并了解几种常见的多元醇的物理性质。
[问题6]在下列试管中将乙醇和浓硫酸混合后,加热至 1400C可生成乙醚,试写出反应的化学方程式,判断 该反应的反应类型,分析反应中可能的断键方式?
[问题7]若将乙醇与浓硫酸混合液加热至1700C,可观 察到KMnO4溶液最终完全褪色,若证实使溶液褪色的 是乙烯气体,写出反应的方程式,反应类型?分析反 应中可能的断键方式?
《醇的性质与应用》课件

醇中的互变异构
不含双键的单一醇分子 会出现结构互变,分子 中的氢原子可以在醇分 子的羟基之间移动,形 成不同的同分异构体。
醇的物理性质
1
溶解性
由于醇分子中含有羟基,与水分子
密度和熔点
2
之间有氢键作用,因此醇在水中非 常容易溶解。
较短的醇一般是无色液体,密度比
水轻,而较长的醇则为无色固体。
3
沸点
随着碳链长度的增加,醇的沸点也
黏度
4
逐渐升高。
由于醇分子间有氢键作用,因此醇 的黏度通常比烃类高,黏稠度也相
应增加。
醇的应用领域
消毒剂
醇常用于口腔消毒、医疗器械和生活用品消毒 等领域。
燃料和能源
乙醇是一种重要的替代燃料,可以替代剂等都是 以醇为原料制造的。
饮品工业
醇是酒精饮料的重要成分,如啤酒、葡萄酒等。
醇的生产方法
合成法
不同的醇可以通过醇醚 法、加氢还原法、合成 气法等多种方法生产。
自然法
一些天然植物和动物中 也含有少量的醇,如蜂 蜜中的甘油、水果中的 乙醇等。
蒸馏法
蒸馏是最基本的分离纯 化方法之一,可以用于 提取和纯化醇。
醇的安全使用注意事项
1 易燃易爆
醇是易燃易爆的化合物,携带、储存和使用过程中要非常小心。
是一种无色黏稠液体,在化妆品、香水、口香 糖和食品等众多领域有着广泛用途。
苯酚
是一种无色晶体,在合成树脂、染料、农药和 香料等方面有着广泛应用。
醇的化学性质
醇对酸的反应
当醇与酸反应时,醇分 子中的氢离子被酸分子 中的阴离子取代,生成 酯和水。
醇对卤素的反应
在醇的存在下,卤素可 以通过亲电取代反应与 醇发生反应,生成卤代 烷和水。
化学课件《醇的性质与应用》优秀ppt 苏教版30页PPT

45、自己的饭量自己知道。——苏联
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
化学课件《醇的性质与应用》 优秀pp 苏教版26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
化学课件《醇的性质与应用》 优秀pp 苏教版26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
【公开课课件】《醇的性质和应用》课件

反应现象比较
钠与水 浮 钠与乙醇 先下沉后上浮 先块状后熔成小球 先静止后游动 后来有响声 加酚酞变红色
熔
游 响 红 2Na+2H2O= 2 NaOH +H2↑
1、烷烃的C-H键上的氢原子不能被钠原子所取代; 2、乙醇和水的O-H键上的氢原子都能被钠原子所取 代,羟基决定乙醇能和钠生成H2; 3、氢原子的活泼性:烷烃<乙醇<水, H2O与钠的反应比乙醇与钠反应要剧烈得多。
C2H5OH+NaBr+H2SO4 →C2H5Br+NaHSO4+H2O
请结合课本P68[观察与思考],探究归纳以下问题:
(1)为什么实验中的硫酸不能使用98%的浓硫酸,而用蒸馏水稀释 过的浓硫酸? 提示:98%的浓硫酸具有强氧化性,而HBr有还原性,会发生副反
应生成溴单质。
(2)加入浓硫酸和溴化钠的作用是什么?试用化学方程式加以解 释。 提示:制HBr。方程式为2NaBr+H2SO4(浓) ==== Na2SO4+2HBr (3) 长导管、试管II和烧杯中的水起到了什么作用?
催化氧化
现象: 铜丝黑色又变为红色,液体产生特殊气味 练习写出下列有机物催化氧化的反应方程式 : O (乙醛的气味) Cu 2 CH3CH2CH2OH → 2CH3CH2C-H +2 H2O △ + O2 △ 2Cu + O2 2CuO O △ CH CH OH + CuO → CH CHO + Cu + H O
(二)乙醇与金属钠反应(取代反应)
2C2H5OH+2Na 2C2H5ONa+H2
乙醇钠
此反应中,乙醇哪 些键断裂?
⑤
三、乙醇的化学性质
醇的性质和应用--上课41页PPT

谢谢!
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。—法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温厚善良的美 德。— —伯克
3、最大限度地行使权力总是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
高中化学课件《醇的性质和应用》

3.组成
一元醇的分子通式为 □ R—OH,饱和一元醇的分子通式为 02 CnH2n+1OH。
学生自主学习
师生课堂互动
学习效果检测
课时作业
4.化学性质与乙醇相似
(1)与活泼金属发生 □03 置换 反应。
(2)氧化反应(燃烧、催化氧化、被酸性 KMnO4 溶液氧化等)。
(3)消去反应。
(4)与 HX、羧酸等的 □04 取代 反应等。
的凝固点很低,用于制造硝化甘油。
学生自主学习
师生课堂互动
学习效果检测
课时作业
1.醇和卤代烃发生消去反应时有什么异同?
提示:相同点:①醇和卤代烃发生消去反应的规律类似,对有机物结构 的要求均为:醇(或卤代烃)分子所含碳原子数必须大于 1;与—OH(或—X) 相连的碳原子的邻位碳原子上有氢原子。②醇和卤代烃的消去反应均有烯烃 生成。
学生自主学习
师生课堂互动
学习效果检测
课时作业
[对点练习] 1.乙醇分子中不同的化学键如图所示,关于乙醇在各种不同反应中断裂 的键说明不正确的是( )
A.和金属钠反应时键①断裂
B.和浓 H2SO4 共热到 170 ℃时断键②和④ C.在银催化条件下与 O2 反应时断键①和③
D.和浓 H2SO4 共热到 140 ℃时断键②,其他键不变化
醇的性质和应用
[明确学习目标] 1.了解醇类的分类。2.掌握醇类的化学性质。3.理解醇 类催化氧化反应、消去反应机理与规律。
学生自主学习
师生课堂互动
学习效果检测
课时作业
23
学生自主学习
一、乙醇的结构和化学性质 1.分子结构
学生自主学习
师生课堂互动
学习效果检测
课时作业
一元醇的分子通式为 □ R—OH,饱和一元醇的分子通式为 02 CnH2n+1OH。
学生自主学习
师生课堂互动
学习效果检测
课时作业
4.化学性质与乙醇相似
(1)与活泼金属发生 □03 置换 反应。
(2)氧化反应(燃烧、催化氧化、被酸性 KMnO4 溶液氧化等)。
(3)消去反应。
(4)与 HX、羧酸等的 □04 取代 反应等。
的凝固点很低,用于制造硝化甘油。
学生自主学习
师生课堂互动
学习效果检测
课时作业
1.醇和卤代烃发生消去反应时有什么异同?
提示:相同点:①醇和卤代烃发生消去反应的规律类似,对有机物结构 的要求均为:醇(或卤代烃)分子所含碳原子数必须大于 1;与—OH(或—X) 相连的碳原子的邻位碳原子上有氢原子。②醇和卤代烃的消去反应均有烯烃 生成。
学生自主学习
师生课堂互动
学习效果检测
课时作业
[对点练习] 1.乙醇分子中不同的化学键如图所示,关于乙醇在各种不同反应中断裂 的键说明不正确的是( )
A.和金属钠反应时键①断裂
B.和浓 H2SO4 共热到 170 ℃时断键②和④ C.在银催化条件下与 O2 反应时断键①和③
D.和浓 H2SO4 共热到 140 ℃时断键②,其他键不变化
醇的性质和应用
[明确学习目标] 1.了解醇类的分类。2.掌握醇类的化学性质。3.理解醇 类催化氧化反应、消去反应机理与规律。
学生自主学习
师生课堂互动
学习效果检测
课时作业
23
学生自主学习
一、乙醇的结构和化学性质 1.分子结构
学生自主学习
师生课堂互动
学习效果检测
课时作业
醇的性质与应用课件

储存与运输。
在储存与运输过程中,应建立完 善的安全管理制度和应急预案, 以应对可能发生的事故和危险情
况。
06
CATALOGUE
醇的发展趋势与展望
醇的应用前景展望
01
醇在化工、医药、食品、能源 等领域的应用越来越广泛,随 着科技的进步,醇的应用前景 将更加广阔。
02
随着环保意识的提高,醇作为 可再生能源的代表,未来在替 代传统化石能源方面将发挥重 要作用。
醇的实验室制备方法
酯水解法
01
酯类物质在酸性或碱性条件下水解生成醇。
卤代烃水解法
02
卤代烃与碱反应生成醇。
烷基化反应
03
芳烃与卤代烷在催化剂作用下生成醇。
醇的生产安全与环保
安全措施
生产过程中应采取必要的安全措 施,如穿戴防护服、定期检查设 备等,以防止事故发生。
环保要求
醇的生产过程中会产生废气、废 水等污染物,应采取有效的环保 措施,如处理废水、回收废气等 ,以减少对环境的污染。
药物合成
醇是许多药物合成的中间体或原料,如抗生素、镇痛药等。
药用辅料
某些醇类物质可作为药用辅料,如甘油常用于制作栓剂、软膏等 。
生物活性分子
某些醇类物质具有生物活性,如多酚类化合物具有抗氧化、抗炎 等作用。
醇在化学工业中的应用
1 2
有机合成
醇是许多有机合成反应ຫໍສະໝຸດ 中间体或原料,如酯化 反应、氧化反应等。
醇的通式为R-OH, 其中R代表烃基。
醇的分类
一元醇
多元醇
只有一个羟基的醇,如乙醇、甲醇等 。
含有多个羟基的醇,如甘油、葡萄糖 等。
二元醇
含有两个羟基的醇,如乙二醇、丙二 醇等。
在储存与运输过程中,应建立完 善的安全管理制度和应急预案, 以应对可能发生的事故和危险情
况。
06
CATALOGUE
醇的发展趋势与展望
醇的应用前景展望
01
醇在化工、医药、食品、能源 等领域的应用越来越广泛,随 着科技的进步,醇的应用前景 将更加广阔。
02
随着环保意识的提高,醇作为 可再生能源的代表,未来在替 代传统化石能源方面将发挥重 要作用。
醇的实验室制备方法
酯水解法
01
酯类物质在酸性或碱性条件下水解生成醇。
卤代烃水解法
02
卤代烃与碱反应生成醇。
烷基化反应
03
芳烃与卤代烷在催化剂作用下生成醇。
醇的生产安全与环保
安全措施
生产过程中应采取必要的安全措 施,如穿戴防护服、定期检查设 备等,以防止事故发生。
环保要求
醇的生产过程中会产生废气、废 水等污染物,应采取有效的环保 措施,如处理废水、回收废气等 ,以减少对环境的污染。
药物合成
醇是许多药物合成的中间体或原料,如抗生素、镇痛药等。
药用辅料
某些醇类物质可作为药用辅料,如甘油常用于制作栓剂、软膏等 。
生物活性分子
某些醇类物质具有生物活性,如多酚类化合物具有抗氧化、抗炎 等作用。
醇在化学工业中的应用
1 2
有机合成
醇是许多有机合成反应ຫໍສະໝຸດ 中间体或原料,如酯化 反应、氧化反应等。
醇的通式为R-OH, 其中R代表烃基。
醇的分类
一元醇
多元醇
只有一个羟基的醇,如乙醇、甲醇等 。
含有多个羟基的醇,如甘油、葡萄糖 等。
二元醇
含有两个羟基的醇,如乙二醇、丙二 醇等。
《醇的性质与应用》公开课课件

日化产品
化妆品
醇类化合物常用于化妆品中,如保湿霜、香水 等。
清洁剂
醇类化合物可用作清洁剂的成分,如洗手液、 洗洁精等。
口腔护理
某些醇类具有抗菌作用,可用于口腔护理产品,如漱口水、牙膏等。
05 醇的安全与防护
醇的毒性
醇的毒性分类
根据醇的毒性,可以分为低毒、中毒和高毒 三类。
毒性作用机制
醇的毒性作用机制主要与其代谢产物和影响 细胞代谢有关。
01
根据烃基的不同,醇可以分为脂肪醇和芳香醇。
02
根据醇分子中羟基的数目,可以分为一元醇、二元 醇和多元醇。
03
根据醇的来源,可以分为天然醇和合成醇。
醇的结构与性质
01
醇的结构特点是含有羟基,这使得醇具有一些独特的
性质,如亲水性、能与水形成氢键等。
02
醇的化学性质主要包括取代反应、氧化反应和酯化反
感谢您的观看
03
醇可以与酰氯反应生成酯。
脱水反应
1 2
分子内脱水
醇在一定条件下可以发生分子内脱水,生成烯烃。
分子间脱水
醇在一定条件下可以发生分子间脱水,生成醚。
3
氧化脱水
醇在一定条件下可以发生氧化脱水,生成醛或酮。
04 醇的应用
工业生产
燃料添加剂
醇可作为燃料添加剂,提高燃料的燃烧效率,减少污染物排放。
溶剂
影响因素
除了碳原子数,醇在水中的溶解度还受到其他因素的影响,如羟基的数目、温度等。一般来说,羟基数目越多, 溶解度越大;温度越高,溶解度越大。
03 醇的化学性质
酸性
酸性较弱
醇的酸性较弱,其电离常数通常在10^-10至10^-13 之间,远弱于水。
《醇的性质和应用》课件

储存醇类物质时应远离火源和热 源,使用防爆电气设备,并配备 灭火器材。
个人防护措施
1 2
佩戴防护服
在处理醇类物质时,应穿戴化学防护眼镜、化学 防护服和化学防护手套。
通风
保持良好的通风条件,以降低醇蒸汽在空气中的 浓度。
3
使用个人防护器材
根据需要选择合适的个人防护器材,如呼吸器、 护目镜等。
THANK YOU
溶剂
醇可用作有机合成中的溶剂,用于溶解和提取各种物质。
化学原料
醇可用于合成多种化学品,如酯类、醚类、醛类等。
食品和饮料
01
02
03
调味料
某些醇具有特殊的风味, 可作为食品和饮料的调味 料。
香料
醇是许多香精和香料的主 要成分,用于增加食品和 饮料的香气。
防腐剂
某些醇具有抗菌和防腐作 用,可用于延长食品的保 质期。
03
醇的化学性质
氧化反应
叔醇可以被氧化生成羧酸 。
氧化生成羧酸
仲醇可以被氧化生成醛。
在催化剂的作用下,伯醇 可以被氧化生成酮。
氧化生成醛 氧化生成酮
酯化反应
与羧酸反应
醇可以与羧酸反应生成酯和 水。
与羧酸酐反应
醇可以与羧酸酐反应生成酯 和水。
与酰氯反应
醇可以与酰氯反应生成酯和 氯化氢。
取代反应
醇的毒性主要与其代谢产物和干 扰细胞代谢有关,长期接触高浓 度醇可能导致肝肾损伤、神经元 死亡等。
毒性症状
接触醇后可能出现头痛、恶心、 呕吐、腹痛、乏力等症状,严重 时可能导致昏迷或死亡。
防火和防爆
01
燃烧特性
醇类物质是易燃的,其闪点较低 ,一般在21℃以下。
爆炸条件
醇的性质和应用4(课件PPT)

和100mL乙醚,再分别向三支试管中放入一小块金属 钠,观察实验现象
用上面的方案可判断出乙醇与钠反应中乙醇分子中 断裂的是氧氢键,而不是碳氢键,其原理是什么?
2CH3CH2 O H+2Na→2CH3CH2ONa+H2↑
煤油
H—O—H
钠沉在底部、有气泡冒出
浮、熔、游、有“嘶嘶” 声
无明显现象
结论:
乙醇与钠反应时,乙醇分子中氧氢键断裂
课堂练习
1.写出下列反应的化学方程式
(1)乙醇与金属钾的反应
(2)
与金属钠的反应
(3)2-丙醇与HCl的反应
【课堂练习】
2.A、B、C三种醇同足量的金属钠完全反 应,在相同的条件下,产生相同体积的氢气, 消耗这三种醇的物质的量之比为2:6:3 ,则A、
B、C三种醇分子里羟基数之比是( B )
A.3:2:1 B.3:1:2 C.2:1:3 D.2:6:3
3.已知一氯戊烷有8种同分异构体,可推知戊
醇(属醇类)的同分异构体的数目是( D )
A.5种 B.6种 C.7种 D.8种
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基
用上面的方案可判断出乙醇与钠反应中乙醇分子中 断裂的是氧氢键,而不是碳氢键,其原理是什么?
2CH3CH2 O H+2Na→2CH3CH2ONa+H2↑
煤油
H—O—H
钠沉在底部、有气泡冒出
浮、熔、游、有“嘶嘶” 声
无明显现象
结论:
乙醇与钠反应时,乙醇分子中氧氢键断裂
课堂练习
1.写出下列反应的化学方程式
(1)乙醇与金属钾的反应
(2)
与金属钠的反应
(3)2-丙醇与HCl的反应
【课堂练习】
2.A、B、C三种醇同足量的金属钠完全反 应,在相同的条件下,产生相同体积的氢气, 消耗这三种醇的物质的量之比为2:6:3 ,则A、
B、C三种醇分子里羟基数之比是( B )
A.3:2:1 B.3:1:2 C.2:1:3 D.2:6:3
3.已知一氯戊烷有8种同分异构体,可推知戊
醇(属醇类)的同分异构体的数目是( D )
A.5种 B.6种 C.7种 D.8种
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基
醇的性质与应用课件

醇的沸点通常在60-150°C之间,随着碳原子数的增加而升高。一元醇的沸点 随着碳原子数的增加而逐渐升高,但碳原子数相同时,支链越多,沸点越低。
影响因素
醇的沸点主要受分子间作用力和分子内氢键的影响。分子间作用力越大,沸点 越高;分子内氢键的存在也会增加沸点。
熔点
熔点范围
醇的熔点一般在-78°C至100°C之 间。一元醇的熔点随着碳原子数 的增加而升高,碳原子数相同的 情况下,支链越多,熔点越低。
溶解度
溶解度范围
醇在水中的溶解度通常较大,但在有机溶剂中的溶解度较小。一元醇的溶解度随 着碳原子数的增加而减小。
影响因素
溶解度主要受分子极性和溶剂性质的影响。极性溶剂对极性物质的溶解度较大, 非极性溶剂对非极性物质的溶解度较大。
03 醇的化学性质
醇的氧化
氧化生成酮
氧化生成醛
氧化生成羧酸
氧化生成酯
燃料
某些醇类化合物如乙醇可作为燃料, 用于替代传统的化石燃料,减少环境 污染。
食品添加 剂
01
02
03
调味
醇类化合物具有芳香味道, 常被用作食品添加剂,如 香精、香料等,增加食品 的口感和香味。
防腐
某些醇类化合物具有抗菌、 防腐作用,如丙二醇、山 梨醇等,可用于食品保鲜 和防腐。
营养强化
乙醇可以作为维生素和矿 物质的载体,用于食品营 养强化,提高食品的营养 价值。
醇的卤化
直接卤化
醇与卤素或卤化氢发生直接卤化反应, 生成卤代烃。
间接卤化
醇先进行氧化或酯化等反应,再与卤 素或卤化氢发生卤化反应,生成卤代 烃。
04 醇的应用
工业生产
溶剂
化工原料
醇类化合物由于其良好的溶解性能, 常被用作工业生产的溶剂,如甲醇、 乙醇等。
影响因素
醇的沸点主要受分子间作用力和分子内氢键的影响。分子间作用力越大,沸点 越高;分子内氢键的存在也会增加沸点。
熔点
熔点范围
醇的熔点一般在-78°C至100°C之 间。一元醇的熔点随着碳原子数 的增加而升高,碳原子数相同的 情况下,支链越多,熔点越低。
溶解度
溶解度范围
醇在水中的溶解度通常较大,但在有机溶剂中的溶解度较小。一元醇的溶解度随 着碳原子数的增加而减小。
影响因素
溶解度主要受分子极性和溶剂性质的影响。极性溶剂对极性物质的溶解度较大, 非极性溶剂对非极性物质的溶解度较大。
03 醇的化学性质
醇的氧化
氧化生成酮
氧化生成醛
氧化生成羧酸
氧化生成酯
燃料
某些醇类化合物如乙醇可作为燃料, 用于替代传统的化石燃料,减少环境 污染。
食品添加 剂
01
02
03
调味
醇类化合物具有芳香味道, 常被用作食品添加剂,如 香精、香料等,增加食品 的口感和香味。
防腐
某些醇类化合物具有抗菌、 防腐作用,如丙二醇、山 梨醇等,可用于食品保鲜 和防腐。
营养强化
乙醇可以作为维生素和矿 物质的载体,用于食品营 养强化,提高食品的营养 价值。
醇的卤化
直接卤化
醇与卤素或卤化氢发生直接卤化反应, 生成卤代烃。
间接卤化
醇先进行氧化或酯化等反应,再与卤 素或卤化氢发生卤化反应,生成卤代 烃。
04 醇的应用
工业生产
溶剂
化工原料
醇类化合物由于其良好的溶解性能, 常被用作工业生产的溶剂,如甲醇、 乙醇等。
醇的性质和应用公开课苏教选修吴登运.pptx

H
H
分子式 C2H6O
结构式
HH H—C—C—O—H
HH
结构简式
CH3CH2OH 或C2H5OH
第3页/共31页
官能团
—OH (羟基)
3、乙醇的物理性质
无 色、 芳香气味、 易 挥发、密度比水 小 、能溶解多种有机物 和 无机物 ,能与 水 以任意比例互溶 。
4、乙醇的化学性质 (1)乙醇与活泼金属反应(反应现象:填表, 与水、乙醚进行对比)
长期喝酒,会使醛脱氢酶活性降低,使肝脏乙 醛浓度过高,损伤肝脏,引起疾病。
第16页/共31页
世界卫生组织的事故调查 显示,大约50%-60%的交 通事故与酒后驾驶有关。
交警判断驾驶员是否酒 后驾车的方法
2CrO3(红色)+ 3C2H5OH + 3H2SO4 Cr2(SO4)3(绿色)+ 3CH3CHO + 6H2O 16
溶
消毒剂 (75%的
剂 乙醇溶
第27页/共31页
饮料
【问题检测】
1.下列醇中,能发生消去反应,也能氧化成醛的是 ( )
A.CH3OH
B. CH3CH2OH
C. 1—丙醇
D. 2,2二甲基丙醇
2.可以检验乙醇中是否含有水的试剂是 ( )
A.无水硫酸铜 B.生石灰
C.金属钠
D.胆矾
第28页/共31页
第22页/共31页
实验探究2 P69 活动与探究
A.乙醇的消去反应
乙醇和浓硫酸混合加热 到170℃左右
H HC
H
H
C
H
浓H2SO4
1700C
CH2=CH2
OH
+H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结论: ①相对分子质量相近的醇和烷烃,醇的沸点
远远高于烷烃。 ②碳原子数相同的醇,羟基越多,沸点越高。
为什么(1)相对分子质量相近的醇和烷烃,醇 的沸点远远高于烷烃。
(2)醇的羟基数越多,沸点越高?
R
R
R
O HH
O H
O
O
H
H
H
O
O
氢键
R
R
R
醇分子间形成氢键的示意图
9
分子间氢键增大了分子间的作用力使物质的溶、沸 点升高。 羟基数越多,醇分子间形成的氢键就相应的增多增 强,所以沸点越高。
2—丁醇
CH2 - OH CH2 - OH
1,2-乙二醇
CH2 - OH
CH - OH
CH2 - OH 1,2,3-丙三醇(甘油)
CH2OH
苯甲醇
3. 醇的分类 B.CH3-CH-CH3 C. CH2 - OH
A. CH3CH2CH2OH
OH
CH2 - OH
E. CH2OH F. CH2 - OH
分子间存在氢键使得溶质分子和溶剂分子间的作用力增 大,溶质在溶剂中的溶解度增大 。甲醇、乙醇、丙醇可 以跟水以任意比互溶,溶于水后,它们与水分子之间也 可以形成氢键。
10
5. 乙醇的结构
乙醇的分子式为: C2H6O 羟基 HH
结构式:H C C OH
乙醇分子的比例模型
HH HH
结构简式:CH3CH2OH 或 C2H5OH HH
先沉后浮 仍为块状 没有声音 放出气泡 缓慢
?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
15
(2)氧化反应
① 燃烧 (淡蓝色火焰)
CH3CH2OH + 3O2 点燃 2CO2 + 3H2O ②催化氧化 实验
现象: Cu丝黑色又变为红色,液体产生特殊 气味(乙醛的气味)
羟基(—OH)与苯环直接相连的化合物称为酚。
①
CH3CH2OH 醇
③
CH2OH
②
CH3CHCH3 醇
OH 醇
OH ④
酚
OH ⑤
CH3
酚
2. 醇的命名
主链尽可能多的包含羟基或连接羟基的碳原子。
【练习】 写出下列醇的名称
CH3
CH3—CH—CH2—OH 2—甲基—1—丙醇
OH CH3—CH2—CH—CH3
2Cu + O2 △ 2CuO 红色变为黑色
CH3CH2OH + CuO →△ CH3CHO + Cu + H2O
Cu是催化剂,但实际起氧化作用的是CuO。
醇的催化氧化也可以用银作催化剂。
16
醇被氧化的机理:
②①
①-③位断键
R1
R1
2 R2—C—O③—H + O2
Cu △
2 R2—C=O + 2H2 O
18
(3)酯化反应 (取代反应)
O CH3—C—OH+H—1O8 —C2H5 浓H2SO4
O CH3—C—18O—C2H5 + H2O
实质:酸脱羟基、醇脱羟基上的氢原子。 注意:可逆反应
醇还可以与一些无机含氧酸(如 H2SO4、HNO3等)发 生酯化反应。
如:
C2H5OH + HO—NO2 浓H2SO4 C2H5O—NO2 + H2O
乙醇有一种同分异构体:H C O C
讨论:-OH 与OH- 有何区别?
CH3CH2OH与 NaOH 都有碱性吗?
H
甲醚
5.乙醇的物理性质
颜 色 : 无色透明 挥发性:易挥发 气 味 : 特殊香味 密 度: 比水小 状 态: 液态 溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
工业酒精 约含乙醇96%以上(质量分数) 无水酒精 99.5%以上(质量分数) 医用酒精 75%(体积分数)
Cu △
O 2R—C—H + 2H2O
= =
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛
(2). 2
R1 R2
CH—OH + O2
Cu △
O 2R1—C—R2 + 2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
R1 (3). R2 C OH
R3
叔醇(—OH在叔碳——碳原子上没 有H),则不能去氢氧化。
大家好
1
单元教学建议:
1.认识醇、酚典型代表物的组成和结构特点; 2.知道醇、酚与其他烃衍生物之间的相互转化关系; 3.知道乙醇的组成和主要性质,认识其在日常生活中
的应用; 4.依据乙醇分子的分子式和性质,确定乙醇分子结构; 5.乙醇的主要化学性质; 6.苯酚的化学性质及其检验; 7.酚醛树脂的合成; 8.苯酚等在生产生活中的应用,以及对键康的危害; 9.通过苯、乙醇、苯酚性质比较,说明有机分子中基
现象:试管中有无色气体生成,可以燃烧,烧 杯内壁出现水滴,加澄清石灰水不变浑浊。
HH ① H C C O H ①处O-H键断开
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
HH
钠与水、与乙醇反应现象的异同
浮在水面 熔成球形 发出嘶声 放出气泡 剧烈
2Na+2H2O=2 NaOH +H2↑
如何检验酒精是否含水? 用无水硫酸铜检验 .变蓝色.
12
乙醇的结构式:
②①
HH
H—C—C—O—H
④
③
HH
交流与讨论:
我们已经学习过乙醇的一些性质。请与 同学交流你所知道的乙醇的化学性质,试列 举乙醇发生的化学反应,并指出在反应过程 中乙醇分子中的哪些化学键发生了断裂?
13
7. 乙醇的化学性质
(1)与活泼金属反应(如Na、K、Mg)
H
生成醛或酮
★连接-OH的碳原子上必须有H, 才发生去氢氧 化(催化氧化)。
练习写出下列有机物催化氧化的反应方程式:
O
= =
2CH3CH2CH2OH + O2 C→△u CH3CH2C-H + H2O
O
2CH3CH(OH)CH3+
O2
C→△u
CH3-C-CH3
+
H2O 17
Байду номын сангаас
催化氧化类型小结 :
(1). 2R—CH2—OH + O2
团之间存在相互影响。
一、醇的性质和应用
教学目标:
1.掌握乙醇的主要化学性质 2.掌握乙醇 的工业制法和用途 3.了解醇的分类和命名 4.了解醇类一般通性和典型醇的用途 重点:乙醇的化学性质 难点:乙醇的化学性质
3
第二单元 醇 酚
1. 醇、酚的区别
羟基(—OH)与烃基或苯环侧链上的碳原子相连 的化合物称为醇。
D. CH2=CHCH2OH
CH - OH
CH2 - OH 分类的依据: (1)所含羟基的数目 (2)分子中烃基是否饱和
一元醇:只含一个羟基 二元醇:含两个羟基 多元醇:多个羟基
饱和醇:如A、B、C、F 不饱和醇:如D、E
4. 醇的重要物理性质
表1 相对分子质量相近的醇与烷烃的沸点比较 表2 含相同碳原子数、不同羟基数的醇的沸点比较
远远高于烷烃。 ②碳原子数相同的醇,羟基越多,沸点越高。
为什么(1)相对分子质量相近的醇和烷烃,醇 的沸点远远高于烷烃。
(2)醇的羟基数越多,沸点越高?
R
R
R
O HH
O H
O
O
H
H
H
O
O
氢键
R
R
R
醇分子间形成氢键的示意图
9
分子间氢键增大了分子间的作用力使物质的溶、沸 点升高。 羟基数越多,醇分子间形成的氢键就相应的增多增 强,所以沸点越高。
2—丁醇
CH2 - OH CH2 - OH
1,2-乙二醇
CH2 - OH
CH - OH
CH2 - OH 1,2,3-丙三醇(甘油)
CH2OH
苯甲醇
3. 醇的分类 B.CH3-CH-CH3 C. CH2 - OH
A. CH3CH2CH2OH
OH
CH2 - OH
E. CH2OH F. CH2 - OH
分子间存在氢键使得溶质分子和溶剂分子间的作用力增 大,溶质在溶剂中的溶解度增大 。甲醇、乙醇、丙醇可 以跟水以任意比互溶,溶于水后,它们与水分子之间也 可以形成氢键。
10
5. 乙醇的结构
乙醇的分子式为: C2H6O 羟基 HH
结构式:H C C OH
乙醇分子的比例模型
HH HH
结构简式:CH3CH2OH 或 C2H5OH HH
先沉后浮 仍为块状 没有声音 放出气泡 缓慢
?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
15
(2)氧化反应
① 燃烧 (淡蓝色火焰)
CH3CH2OH + 3O2 点燃 2CO2 + 3H2O ②催化氧化 实验
现象: Cu丝黑色又变为红色,液体产生特殊 气味(乙醛的气味)
羟基(—OH)与苯环直接相连的化合物称为酚。
①
CH3CH2OH 醇
③
CH2OH
②
CH3CHCH3 醇
OH 醇
OH ④
酚
OH ⑤
CH3
酚
2. 醇的命名
主链尽可能多的包含羟基或连接羟基的碳原子。
【练习】 写出下列醇的名称
CH3
CH3—CH—CH2—OH 2—甲基—1—丙醇
OH CH3—CH2—CH—CH3
2Cu + O2 △ 2CuO 红色变为黑色
CH3CH2OH + CuO →△ CH3CHO + Cu + H2O
Cu是催化剂,但实际起氧化作用的是CuO。
醇的催化氧化也可以用银作催化剂。
16
醇被氧化的机理:
②①
①-③位断键
R1
R1
2 R2—C—O③—H + O2
Cu △
2 R2—C=O + 2H2 O
18
(3)酯化反应 (取代反应)
O CH3—C—OH+H—1O8 —C2H5 浓H2SO4
O CH3—C—18O—C2H5 + H2O
实质:酸脱羟基、醇脱羟基上的氢原子。 注意:可逆反应
醇还可以与一些无机含氧酸(如 H2SO4、HNO3等)发 生酯化反应。
如:
C2H5OH + HO—NO2 浓H2SO4 C2H5O—NO2 + H2O
乙醇有一种同分异构体:H C O C
讨论:-OH 与OH- 有何区别?
CH3CH2OH与 NaOH 都有碱性吗?
H
甲醚
5.乙醇的物理性质
颜 色 : 无色透明 挥发性:易挥发 气 味 : 特殊香味 密 度: 比水小 状 态: 液态 溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
工业酒精 约含乙醇96%以上(质量分数) 无水酒精 99.5%以上(质量分数) 医用酒精 75%(体积分数)
Cu △
O 2R—C—H + 2H2O
= =
伯醇(—OH在伯碳——首位碳上),去氢氧化为醛
(2). 2
R1 R2
CH—OH + O2
Cu △
O 2R1—C—R2 + 2H2O
仲醇(—OH在仲碳——中间碳上),去氢氧化为酮
R1 (3). R2 C OH
R3
叔醇(—OH在叔碳——碳原子上没 有H),则不能去氢氧化。
大家好
1
单元教学建议:
1.认识醇、酚典型代表物的组成和结构特点; 2.知道醇、酚与其他烃衍生物之间的相互转化关系; 3.知道乙醇的组成和主要性质,认识其在日常生活中
的应用; 4.依据乙醇分子的分子式和性质,确定乙醇分子结构; 5.乙醇的主要化学性质; 6.苯酚的化学性质及其检验; 7.酚醛树脂的合成; 8.苯酚等在生产生活中的应用,以及对键康的危害; 9.通过苯、乙醇、苯酚性质比较,说明有机分子中基
现象:试管中有无色气体生成,可以燃烧,烧 杯内壁出现水滴,加澄清石灰水不变浑浊。
HH ① H C C O H ①处O-H键断开
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
HH
钠与水、与乙醇反应现象的异同
浮在水面 熔成球形 发出嘶声 放出气泡 剧烈
2Na+2H2O=2 NaOH +H2↑
如何检验酒精是否含水? 用无水硫酸铜检验 .变蓝色.
12
乙醇的结构式:
②①
HH
H—C—C—O—H
④
③
HH
交流与讨论:
我们已经学习过乙醇的一些性质。请与 同学交流你所知道的乙醇的化学性质,试列 举乙醇发生的化学反应,并指出在反应过程 中乙醇分子中的哪些化学键发生了断裂?
13
7. 乙醇的化学性质
(1)与活泼金属反应(如Na、K、Mg)
H
生成醛或酮
★连接-OH的碳原子上必须有H, 才发生去氢氧 化(催化氧化)。
练习写出下列有机物催化氧化的反应方程式:
O
= =
2CH3CH2CH2OH + O2 C→△u CH3CH2C-H + H2O
O
2CH3CH(OH)CH3+
O2
C→△u
CH3-C-CH3
+
H2O 17
Байду номын сангаас
催化氧化类型小结 :
(1). 2R—CH2—OH + O2
团之间存在相互影响。
一、醇的性质和应用
教学目标:
1.掌握乙醇的主要化学性质 2.掌握乙醇 的工业制法和用途 3.了解醇的分类和命名 4.了解醇类一般通性和典型醇的用途 重点:乙醇的化学性质 难点:乙醇的化学性质
3
第二单元 醇 酚
1. 醇、酚的区别
羟基(—OH)与烃基或苯环侧链上的碳原子相连 的化合物称为醇。
D. CH2=CHCH2OH
CH - OH
CH2 - OH 分类的依据: (1)所含羟基的数目 (2)分子中烃基是否饱和
一元醇:只含一个羟基 二元醇:含两个羟基 多元醇:多个羟基
饱和醇:如A、B、C、F 不饱和醇:如D、E
4. 醇的重要物理性质
表1 相对分子质量相近的醇与烷烃的沸点比较 表2 含相同碳原子数、不同羟基数的醇的沸点比较
