第六章 相平衡习题
相平衡习题

物理化学第六章相平衡习题一、选择题1. 若A和B能形成二组分理想溶液,且T B*>T A*,则A和B在达平衡的气、液相中的物质的量分数()。
(A)y A>x A,y B<x B;(B)y A<x A,y B>x B;(C)y A>x A,y B>x B;(D)y A<x A,y B<x B。
2. 液态完全互溶的两组分A、B组成的气液平衡系统中,在外压一定下,于该气液平衡系统中加入组分B(l)后,系统的沸点下降,则该组分在平衡气相中的组成y B()它在液相中的组成x B。
(A)大于(B)小于(C)等于(D)无法确定3. 在温度T下,CaCO3(s),CaO(s)及CO2的平衡系统压力为p,已知它们之间存在CaCO3(s)==CaO(s)+CO2(g)反应,若往该平衡系统中加入CO2(g), 当重新达到平衡时,系统的压力()。
(A)变大;(B)变小;(C)不变;(D)可能变大也可能变小。
4. A(低沸点)与B(高沸点)两种纯液体组成的液态完全互溶的气液平衡系统。
在一定温度下,将B(l) 加入平衡系统中时,测得系统的压力增大,说明此系统()。
(A)一定具有最大正偏差;(B)一定具有最大负偏差;(C)有可能是最大正偏差也有可能是最大负偏差;(D)数据不够,无法确定。
5. 组分A(s)与组成B(s)组成的凝聚系统相图中,若己知形成以下四种化合物:A2B(稳定),AB(稳定),AB2(不稳定),AB3(稳定)则该相图中有()最低共熔点和()条三相线。
(A) 3,3 (B)4,4 (C) 3,4;(D) 4,5。
6. 将克拉佩龙方程应用于H2O(s)和H2O(l)两相平衡,随着压力的增长,H2O的凝固点将()(A)升高(B)降低(C)不变(D)无法判断7. 将过量的NaHCO3(s)放入一真空密闭容器中,在50℃下,NaHCO3按下式进行分解:2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(s),系统达平衡后,则其组分数C=();F=()。
物化第六章 - 答案
第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x B 呈线性关系。
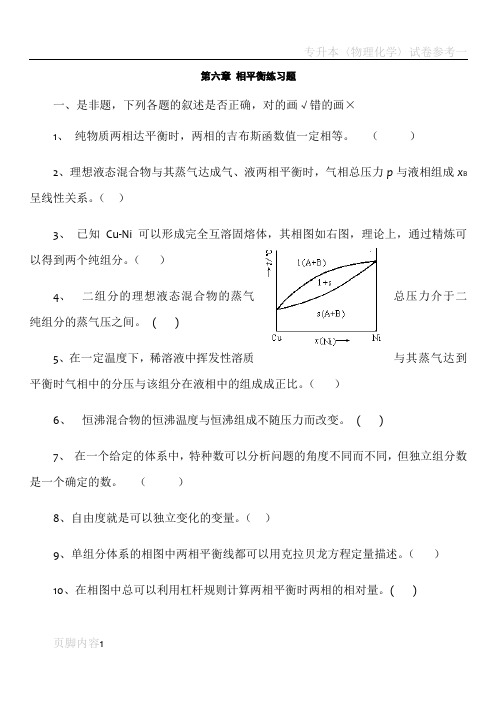
()3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于373.2 K;(2)必高于373.2 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(1) 3种;(2) 2种;(3) 1种;(4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的?(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
第六章-相平衡习题课

6
2
S(A2B)+ S(AB2)
7
2
8
2
9
2
S(A2B)+ S(B)
L L+S(A) S(A)+S(A2B)
L+S(AB2) L+S(B)
F’
2
1
1
1
1
1
1
1
1
( 2) e——化合物A2B的熔点; f——化合物A2B和化合物AB2的低共
熔点(低共熔混合物组成点);
(3)
g——化合物AB2分解时的液相组成点。
五、苯酚(A)的熔点40OC,-萘胺(B)的熔点50OC。该凝聚系统 的相平衡数据如下:
A和B形成一个等分子的相合熔点化合物,其熔点为28oC;
xB=0.25为一个低共熔混合物,其低共熔点为17oC; xB=0.65为一个低共熔混合物,其低共熔点为23oC; (1)画出该系统的相图; (2)表明各相区,并指出其自由度数;
)
答案: (B)
(2)FeCO3和H2O形成四种水合物FeCO36H2O(s), 2FeCO37H2O(s), 2FeCO35H2O(s),和FeCO32H2O(s),则系统的组分数为:( )
A 、2
B、 3
C、 4
D、 5
答案: (A ) (3)如同上题的系统,在恒定温度和压力下平衡共存的最多的相 数为( )。
23
MN, PQ:
F=0
N 0.5 xB
S (C ) S ( B)
0.25
0.65
1
(4)xB=0.6溶液:
(5) xB=0.6的混合物1kg,冷却到23oC时,析出纯C(s)最多。
C(s) l
化学工业出版社物理化学答案第6章 相平衡

第六章相平衡思考题解答1、答:可能平衡。
相平衡的条件是任一组分在各相的化学势相等。
2、答:不等于零,约为水的饱和蒸气压。
3、答:不变,因为根据相律有:F=C-P+2=1,即蒸气压只是温度的函数。
4、答:是两相,因为二者的物理性质不同。
5、答:是两相,因为从微观的角度来看,粒子之间仍存在界面。
6、答:是一相,因为形成了固溶体(合金)。
7、答:都等于1。
因为C=S-R-R’=3-1-1=1。
8、答:在冰点的自由度不为零。
对于单组分体系C=1,F+P=3,冰点时P=2,故F=1。
9、答:有液体。
根据其相图可知液态存在的条件是T:216.6~304.3K;P:5.11~73pθ。
10、答:是的,此时是三相平衡。
习题解答1. 解:① C=5,P=4,F=3 ② C=5,P=2,F=5 ③ C=2,P=1,F=2 ④ C=2,P=2,F=2 ⑤ C=3,P=2,F=3 2. 解:因甲苯和苯形成理想液态混合物,故两者蒸气分压均可以用拉乌尔定律进行计算。
(1)原来系统为液态,当开始出现气相时,其量极少,可以认为液相组成不变,此时系统的压力p :B A p p p +=B B A A x p x p p ∗∗+=,而1=+B A x x ,联解、整理可得)1(A B A A x p x p p −+=∗∗设甲苯为A ,苯为B ,则459.0)114.78(0.200)078.92(0.200)078.92(0.200)()(111=⋅+⋅⋅=+=−−−mol g g mol g g mol g g M m M m M m x B B A AA A A所以,p=54.22kP a×0.459+136.12kP a×(1-0.459)=98.53kPa 又253.053.98/459.022.54//=×===∗kPa kPa p x p p p y A A A A 故747.0253.011=−=−=A B y y(2)压力降低,液体不断气化,当压力降至某一数值时,则系统内产生极小的一液滴,此时气相组成与未气化前的液体组成相同,即y A =0.459。
第六章相平衡的大题和选择题有答案

第六章相平衡一、判断说明题:1. 对于一个含有N种化学物质所组成的体系,若体系中不存在化学反应,则N与C存在什么关系? 又若其中某一种化学物质在某一项中实际不存在,试推导出该体系的相律形式仍然是f=C-P+2。
[提示:请考虑描述体系组成的变量数与各种物质在各相间化学势相等的等式数应该作怎样的修正?]答:化学物质数N是一指相平衡体系内能够出现的不同化学性质的物质数;组分数C是指该平衡体系内所需的最少物质数,即该相平衡体系中物种数减去化学平衡数,再减去浓度限制条件数,C=N-R-R'。
如果体系中不存在化学反应,则C=N-R',如果体系中不存在化学反应,也不存在浓度限制条件,则C=N。
C种物质在P个相中都存在,则描述体系组成的变量数为P(C-1),化学势相等的关系式数为C(P -1),描述体系最少变量数,即自由度f=P(C-1)-C(P-1)+2 =C-P+2;若某种物质在其中某一相中不存在,则描述体系组成的变量数为(P -1)+(C-2)=P (C-1)-1,化学势相等的关系式数为:C(P -2)+(C-1)=C(P -1)-1,自由度f=[P (C-1)-1]-[C(P -1)-1]+2=P-C+2。
因此体系的相律形式是同一形式。
2. 对于纯水,当水气、水与冰三相共存时,其自由度为多少?你是怎样理解的?答:根据相律,水纯物质,C=1,T=273.16 K,p=611 Pa,温度压力确定,其自由度f=1-3+2=0,说明该体系的组成、温度与压力均不能任意改变。
3. 由水气变成液态水是否一定要经过两相平衡态,是否还有其它途径。
答:不一定要经过两相平衡。
从水的相图上可知,将水汽先升温,使温度超过647.2 K,后再加压,使压力超过 2.2×107Pa,然后再先降温后降压,便可不经过气液两相平衡态,使水汽转变成液态水。
4. 右图是CO2的相图,试与水的相图比较,两者有何异同,图中有哪处f=0?根据相图你如何理解在高压钢瓶内可以储存液态CO2,而将液态CO2从钢瓶口快速喷至空气中,在喷口上装一尼龙袋,在袋内得到的是固态CO2(干冰),而不能得到液态CO2?答:与水的相图比较,显著的差别是固液二相平衡线的倾斜方向不同,水的液固二相平衡线斜率d p/d T<0,而CO2的d p/d T>0。
物理化学《相平衡》习题及参考答案

物理化学《相平衡》习题及答案2-3 选择题1、水煤气发生炉中共有)()()()(22g CO g CO g O H s C 、、、及)(2g H 5种物质,它们能发生下述反应:)(2)()(2g CO s C g CO ⇒+,)()()()(222g O H g CO g H g CO +⇒+,)()()()(22g CO g H s C g O H +⇒+,则此体系的组分数、自由度为( C )A.5、3B.4、3C.3、3D.2、22、物质A 与B 可形成低共沸混合物E ,已知纯A 的沸点小于纯B 的沸点,若将任意比例的A+B 混合在一个精馏塔中精馏,则塔顶的馏出物是( C )A.纯AB.纯BC.低共沸混合物D.都有可能3、克拉贝隆-克劳修斯方程适用于( C )A.)()(22g I s I ⇔B.)()(金刚石石墨C C ⇔C.),,(),,(222112p T g I p T g I ⇔D.)()(22l I s I ⇔4、将一透明容器抽成真空,放入固体碘,当温度为50℃时,可见到明显的碘升华现象,有紫色气体出现。
若温度维持不变,向容器中充入氧气使之压力达到100kPa 时,将看到容器中( C )A.紫色变深B.紫色变浅C.颜色不变D.有液态碘出现5、在一定温度下,水在其饱和蒸汽压下汽化,下列各函数增量中那一项为零( D )A.U ∆B.H ∆C.S ∆D.G ∆6、在一定外压下,多组分体系的沸点( D )A.有恒定值B.随组分而变化C.随浓度而变化D.随组分及浓度而变化7、压力升高时,单组份体系的沸点将( A )A.升高B.降低C.不变D.不一定8、进行水蒸气蒸馏的必要条件是( A )A.两种液体互不相容B.两种液体蒸汽压都较大C.外压小于101kPaD.两种液体的沸点相近9、液体A 与液体B 不相混溶。
在一定温度T ,当有B 存在时,液体A 的蒸汽压为( B )A.与体系中A 的摩尔分数成比例B.等于T 温度下纯A 的蒸汽压C.大于T 温度下纯A 的蒸汽压D.与T 温度下纯B 的蒸汽压之和等于体系的总压力10、氢气和石墨粉在没有催化剂时,在一定温度下不发生化学反应,体系的组分数是( A )A.2B.3C.4D.511、上述体系中,有催化剂存在时可生成n 种碳氢化合物,平衡是组分数为( A )A.2B.4C.n+2D.n12、相率适用于( D )A.封闭体系B.敞开体系C.非平衡敞开体系D.以达到平衡的多向敞开体系13、某物质在某溶剂中的溶解度( C )A.仅是温度的函数B.仅是压力的函数C.同是温度和压力的函数D.除了温度压力以外,还是其他因素的函数14、在实验室的敞口容器中装有单组份液体,对其不断加热,则看到( A )A.沸腾现象B.三项共存现象C.临界现象D.生化现象15、相图与相率之间的关系是( B )A.相图由相率推导得出B.相图由实验结果绘制得出,不能违背相率C.相图决定相率D.相图由实验结果绘制得出,与相率无关16、下述说法中错误的是( C )A.通过相图可确定一定条件下体系由几相构成B.相图可表示出平衡时每一相的组成如何C.相图可表示达到相平衡所需时间的长短D.通过杠杆规则可在相图上计算各相的相对含量17、三组分体系的最大自由度及平衡共存的最大相数为( D )A.3;3B.3;4C.4;4D.4;518、定容条件下)(4s HS NH 的分解压力为1θp 时,反应)()()(234g S H g NH s HS NH +⇔的标准平衡常数是( C )A.1B.1/2C.1/4D.1/819、水的三相点附近其蒸发热为44.821-⋅mol kJ ,熔化热为5.991-⋅mol kJ ,则在三相点附近冰的升华热约为( B )A.38.831-⋅mol kJB.50.811-⋅mol kJC.-38.831-⋅mol kJD.-50.811-⋅mol kJ20、在相图上,当物系点处于哪一点时,只存在一个相( C )A.恒沸点B.熔点C.临界点D.最低共沸点21、具有最低恒沸温度的某两组份体系,在其T-x 相图的最低点有( A )A.l g x x f ==;0B.l g x x f ==;1C.l g x x f >=;0D.l g x x f >=;122、80℃时纯苯的蒸汽压为0.991θp ,纯甲苯的蒸汽压为0.382θp ,若有苯-甲苯气、液平衡混合物在80℃时气相中苯的摩尔分数为30.0=苯y 则液相组成苯x 接近于( D )A.0.85B.0.65C.0.35 D0.1423、体系处于标准状态时,能与水蒸气共存的盐可能是: CA. Na 2CO 3B. Na 2CO 3 Na 2CO 3•H 2O Na 2CO 3•7H 2OC. Na 2CO 3 Na 2CO 3•H 2OD. 以上全否24.一个水溶液共有S 种溶质,相互之间无化学反应。
材料物理化学 第六章 相平衡 习题

第六章 相平衡与相图1、什么是平衡状态?影响平衡的因素有哪些?解:平衡态:不随时间而发生变化的状态称为平衡状态。
影响平衡的因素有:温度、压力、组分浓度等。
2、什么是凝聚系统?什么是介稳平衡?解:凝聚系统:不含气相或气相可以忽略的系统。
介稳平衡:即热力学非平衡态,能量处于较高状态,经常出现于硅酸盐系统中。
3、简述一致熔化合物与不一致熔化合物各自的特点。
解:一致熔化合物是指一种稳定的化合物。
它与正常的纯物质一样具有固定的熔点,熔化时,所产生的液相与化合物组成相同,故称一致熔融。
不一致熔化合物是指一种不稳定的化合物。
加热这种化合物某一温度便发生分解,分解产物是一种液相和一种晶相,二者组成与化合物组成皆不相同,故称不一致熔融。
4、比较各种三元无变量点(低共熔点、双升点、双降点、过渡点和多晶转变点)的特点,写出它们的相平衡关系。
解:低共熔点:是一种无变量点,系统冷却时几种晶相同时从熔液中析出,或加热时同时融化。
E L A S C →++双升点:处于其相应的副三角形的交叉位的单转熔点。
PL A B S +→+ 双降点:处于其相应的副三角形的共轭位的双转熔点。
RL A B S++→ 5、简述SiO2的多晶转变现象,说明为什么在硅酸盐产品中SiO2经常以介稳状态存在?解:在573℃以下的低温,SiO2的稳定晶型为b -石英,加热至573℃转变为高温型的 a -石英,这种转变较快;冷却时在同一温度下以同样的速度发生逆转变。
如果加热速度过快,则a -石英过热而在1600℃时熔融。
如果加热速度很慢,则在870℃转变为a -鳞石英。
a -鳞石英在加热较快时,过热到1670℃时熔融。
当缓慢冷却时,在870℃仍可逆地转变为a -石英;当迅速冷却时,沿虚线过冷,在163℃转变为介稳态的b -鳞石英,在117℃转变为介稳态的g -鳞石英。
加热时g -鳞石英仍在原转变温度以同样的速度先后转变为b -鳞石英和a -鳞石英。
a -鳞石英缓慢加热,在1470℃时转变为a -方石英,继续加热到1713℃熔融。
物理化学课后习题第六章答案

第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2 常见的Na2CO3(s)水合物有Na2CO3∙H2O(s),Na2CO3∙7H2O(s)和Na2CO3∙10H2O(s).(1)101.325kPa下,与Na2CO3水溶液及冰平衡共存的水合物最多能有几种?(2)20℃时,与水蒸气平衡的水合物最多可能有几种?解:(1)C = S – R - R' = 2 – 0 – 0 =2F = C–P + 1 =2 –P + 1= 3 – P ≥0,即P-2≤1,那么能与Na2CO3水溶液及冰平衡共存的水合物最多只有一种。
(2)C = S – R - R' = 2 – 0 – 0 =2F = C–P + 1 =2 –P + 1= 3 – P ≥0,即P-1≤2,那么与水蒸气平衡的水合物最多可能有两种。
6.4 单组分系统碳的想吐(示意图)如附图所示。
6-相平衡 习题

解: 相区
1 2 3 4
相态 l1+ l2 l l+g g
自由度F 1 2 1 2
1: 液相l
F=2
2:液相l + A(s) F=1
1
3:液相l + C(s) F=1
2
4:液相l + B(s) F=1
5:A(s) + C(s)
F=1
3 5
4
6: B(s) + C(s)
F=1
6
C(s) 、 液相l 、 A(s)三相平衡 F=0
+
Q
三相线LS1S2: l β 冷 加却 热 α
Hg
w%
Cd
杠杆规则:
横坐标为xB
nL xM xL nG xG xM
再结合
nL nG n总
横坐标为wB
mL (wM wL ) mG (wG wM )
1) 在单组分系统的相图中,最多只能存在一个三相点。( ) 2) 若恒沸混合物的恒沸点在沸点--组成图上为最低点,则 在压力--组成图上为最高点。( ) 3) 在通常情况下,对于三组分系统能平衡共存的最多相数 为4。( ) 4) 恒沸混合物不是化合物。( ) 5) 二元恒沸混合物的组成随温度而变。( )
xB 0.25
xB,0 0.3
yB 0.4556
nL
nG
nG ( yB xB,0 ) nL (xB,0 xB ) ①
nL nG 5mol ②
解得 nL =3.784mol nG =1.216mol
【6.4】
(1)各点、线和面的相平衡关系 及自由度数? (2)25℃,101.325kPa下,碳以 什么状态稳定存在。 (3)增加压力可以使石墨转变成 金刚石,已知石墨的摩尔体积大 于金刚石的摩尔体积,那么加压 是石墨转变为金刚石的过程是吸 热还是放热?
物理化学课后答案 第六章 相平衡

第六章相平衡6.1指出下列平衡系统中的组分数C,相数P及自由度F。
(1)I2(s)与其蒸气成平衡;(2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;(3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;(4)取任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。
(5)I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(2)C = 3 – 1 = 2, P = 3, F = C–P + 2 = 2 – 3 + 2 = 1.(3)C = 3 – 1 – 1 = 1, P = 2, F = C–P + 2 = 1 – 2 + 2 = 1.(4)C = 3 – 1 = 2, P = 2, F = C–P + 2 = 2 – 2 + 2 = 2.(5)C = 3, P = 2, F = C–P + 1 = 3 – 2 + 1 = 2.6.2已知液体甲苯(A)和液体苯(B)在90 C时的饱和蒸气压分别为=和。
两者可形成理想液态混合物。
今有系统组成为的甲苯-苯混合物5 mol,在90 C下成气-液两相平衡,若气相组成为求:(1)平衡时液相组成及系统的压力p。
(2)平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此(2)系统代表点,根据杠杆原理6.3单组分系统的相图示意如右图。
试用相律分析途中各点、线、面的相平衡关系及自由度。
解:单相区已标于图上。
二相线(F = 1):三相点(F = 0):图中虚线表示介稳态。
6.4已知甲苯、苯在90 ︒C下纯液体的饱和蒸气压分别为54.22 kPa和136.12 kPa。
两者可形成理想液态混合物。
取200.0 g甲苯和200.0 g苯置于带活塞的导热容器中,始态为一定压力下90 ︒C的液态混合物。
物化第六章 - 答案

第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x呈线性关系。
()B3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于 K;(2)必高于 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种; (2) 2种; (3) 1种; (4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
物理化学核心教程(第二版)沈文霞编科学出版社_课后习题详解第六章

第六章 相平衡三.思考题参考答案1.硫氢化铵4NH HS(s)的分解反应:① 在真空容器中分解;② 在充有一定3NH (g)的容器中分解,两种情况的独立组分数是否一样?答: 两种独立组分数不一样。
在①中,C =1。
因为物种数S 为3,但有一个独立的化学平衡和一个浓度限制条件,所以组分数等于1。
在②中,物种数S 仍为3,有一个独立的化学平衡,但是浓度限制条件被破坏了,两个生成物之间没有量的限制条件,所以独立组分数C =2。
2.纯的碳酸钙固体在真空容器中分解,这时独立组分数为多少?答: 碳酸钙固体的分解反应为 32CaCO (s)CaO(s)CO (g)+物种数为3,有一个平衡限制条件,但没有浓度限制条件。
因为氧化钙与二氧化碳不处在同一个相,没有摩尔分数的加和等于1的限制条件,所以独立组分数为2。
3.制水煤气时有三个平衡反应,求独立组分数C ?(1) H 2O(g)+ C(s)= H 2(g)+ CO(g)(2) CO 2(g)+ H 2(g)= H 2O(g)+ CO(g)(3) CO 2(g)+ C(s)= 2CO(g)答: 三个反应中共有5个物种,5S =。
方程(1)可以用方程(3)减去(2)得到,因而只有2个独立的化学平衡,2R =。
没有明确的浓度限制条件,所以独立组分数3C =。
4.在抽空容器中,氯化铵的分解平衡,43NH Cl(s)NH (g)HCl(g)+。
指出该系统的独立组分数、相数和自由度数?答:反应中有三个物种,一个平衡限制条件,一个浓度限制条件,所以独立组分数为1,相数为2。
根据相律,自由度为1。
即分解温度和分解压力两者之中只有一个可以发生变化。
5.在含有氨的容器中氯化铵固体分解达平衡,43NH Cl(s)NH (g)HCl(g)+。
指出该系统的独立组分数、相数和自由度?答: 反应中有三个物种,一个平衡限制条件,没有浓度限制条件。
所以独立组分数为2,相数为2,自由度为2。
6.碳和氧在一定条件下达成两种平衡,指出该系统的独立组分数、相数和自由度数。
化学工业出版社物理化学答案第6章 相平衡

第六章相平衡思考题解答1、答:可能平衡。
相平衡的条件是任一组分在各相的化学势相等。
2、答:不等于零,约为水的饱和蒸气压。
3、答:不变,因为根据相律有:F=C-P+2=1,即蒸气压只是温度的函数。
4、答:是两相,因为二者的物理性质不同。
5、答:是两相,因为从微观的角度来看,粒子之间仍存在界面。
6、答:是一相,因为形成了固溶体(合金)。
7、答:都等于1。
因为C=S-R-R’=3-1-1=1。
8、答:在冰点的自由度不为零。
对于单组分体系C=1,F+P=3,冰点时P=2,故F=1。
9、答:有液体。
根据其相图可知液态存在的条件是T:216.6~304.3K;P:5.11~73pθ。
10、答:是的,此时是三相平衡。
习题解答1. 解:① C=5,P=4,F=3 ② C=5,P=2,F=5 ③ C=2,P=1,F=2 ④ C=2,P=2,F=2 ⑤ C=3,P=2,F=3 2. 解:因甲苯和苯形成理想液态混合物,故两者蒸气分压均可以用拉乌尔定律进行计算。
(1)原来系统为液态,当开始出现气相时,其量极少,可以认为液相组成不变,此时系统的压力p :B A p p p +=B B A A x p x p p ∗∗+=,而1=+B A x x ,联解、整理可得)1(A B A A x p x p p −+=∗∗设甲苯为A ,苯为B ,则459.0)114.78(0.200)078.92(0.200)078.92(0.200)()(111=⋅+⋅⋅=+=−−−mol g g mol g g mol g g M m M m M m x B B A AA A A所以,p=54.22kP a×0.459+136.12kP a×(1-0.459)=98.53kPa 又253.053.98/459.022.54//=×===∗kPa kPa p x p p p y A A A A 故747.0253.011=−=−=A B y y(2)压力降低,液体不断气化,当压力降至某一数值时,则系统内产生极小的一液滴,此时气相组成与未气化前的液体组成相同,即y A =0.459。
物理化学 第六章 相平衡 习题

相 平 衡
基本要求及主要公式 一、相律:在多组分平衡系统中,相变化过程 所遵守的规律。
f C 2
C S R R'
相图:用图形表示体系的状态随浓度、压力、 温度等强度变量而变化的图形。
读懂相图包括以下几点: 1.图中点、线、面的含义 2.确定体系点和相点的位置 3.能描述当温度、压力、浓度等强度变量改 变时,体系的相数、相态、组成的变化情况。 4.用杠杆规则计算两相平衡时两相的物质量
yB 0.491
4.
2.如碳的相图所示,回答下列问题 (1)O点由哪几相组成?自由度为多 少? (2)曲线OA、OB、OC分别代表什 么? (3)常温常压下石墨与金刚石何者 稳定? (4)在2000K时将石墨变成金刚石 需要多大压力? (5)已知石墨变成金刚石是一放热 过程,由图说明此过程中碳的密度是 增加还是减少? (6)由此图能否判断金刚石的密度 与液态碳的密度的大小关系
(有一个电荷平衡)
'
2 4
HPO H PO
H 2O H OH
2 4
3 4
(4)
4.如图所示二元凝聚系相图中,属稳定单相区 的是 (1)1区 (2)1、2区 (3)1、4区 (4)1、2、5区 (4)
5.二组分理想溶液的总蒸气压是 (1)与溶液的组成无关 (2)介于纯的二组分蒸气压之间
四、计算 1、已知CCl4(A)的蒸气压方程为
3637.1 ln p / Pa C T /K
其正常沸点为350K.若CCl4(A)与SnCl4(B) p 组成理想液体混合物(100℃时 (SnCl4) =66.66kPa)。假定以某一配比的混合物在 100 kPa下加热到100℃时开始沸腾。 (1)计算CCl4的摩尔汽化热,正常沸点时的 摩尔汽化熵。 (2)计算该混合物的液相组成和第一个气泡 的组成。 (3)绘出二元液系的p-x图
物理化学习题-第六章、相平衡合并

6 把NaHCO3放在一抽空的容器中, 加热分解并达到平衡: 2NaHCO3(s) = Na2CO3(s) + CO2(g) + H2O(g), 该系统的独立组
分数 C = _S_-__R_-__R___=__4_-__1_-__1_=__2_; 相数 P = ___3__; 自由度数
F = _C_-__P__+__2_=__1__.
(2) CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡; (3) NH4HS(s)在真空容器中与分解产物NH3(g)和H2S (g)成平衡; (4) 取任意量NH3(g)和H2S(g) 与NH4HS(s) 成平衡; (5) I2 在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统).
C = S- R- R´= 4- 1 - 1=2 F = C -P+2 = 2- 3 + 2 = 1
.
12
相律 例 在25℃时, A, B和C三种物质(不能互相发生反应)所形成
的溶液与固相 A 和由 B 与 C 组成的气相同时呈平衡. (1)试计算此系统的自由度数? (2)试计算此系统中能平衡共存的最大相数?
力为 65 108 Pa. (5)OA线斜率 dp / dT = H/(T V) 0,
B. 仅是压力的函数
C. 同时是压力和温度的函数函
D. 是压力和其它因素的函数
00-7-15
.
6
7 某种物质在某溶剂中的溶解度 __C___. A. 仅是温度的函数 B. 仅是压力的函数
C. 同时是温度和压力的函数 F = C-P + 2
D. 是温度, 压力及其它因素的函数当 C = 2; P = 2时, F = 2 (温度,压力)
第06章 相平衡习题

第6章相平衡思考题1.硫氢化铵的分解反应:(1)在真空容器中分解,(2)在充有一定氨气的容器中分解,两种情况的独立组分数是否一样?2.纯的碳酸钙固体在真空容器中分解,这时独立组分数为多少?3.制水煤气时有三个平衡反应,求独立组分数C?(1)H2O(g) + C(s) =H2(g) + CO(g)(2)CO2(g) + H2(g) =H2O(g) + CO(g)(3)CO2(g) + C(s) =2CO(g)4.在抽空容器中,氯化铵的分解平衡为:NH4Cl(s) =NH3(g) + HCl(g)。
指出该系统的独立组分数、相数和自由度。
5.在含有氨的容器中氯化铵分解达平衡:NH4Cl(s) =NH3(g) + HCl(g)。
指出该系统的独立组分数、相数和自由度。
6.碳和氧在一定条件下达成两种平衡:(1)C(s) + 1/2O2(g) =CO(g),(2)CO(g) + 1/2O2(g) =CO2(g)。
指出该系统的独立组分数、相数和自由度。
7.水的三相点与冰点是否相同?8.沸点和恒沸点有何不同?9.恒沸混合物是不是化合物?10.在汞面上加一层水能降低汞的蒸气压吗?11.单组分系统的三相点与低共熔点有何异同点?12.低共熔物能不能看作是化合物?概念题1.NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,有:(A)C=2,P=2,f=2(B)C=1,P=2,f=1(C)C=3,P=2,f=3(D)C=1,P=3,f=02.某系统存在C(s),H2O(g),CO(g),CO2(g)和H2(g)五种物质,相互建立了下述三个平衡:(1)H2O(g) + C(s) =H2(g) + CO(g)(2)CO2(g) + H2(g) =H2O(g) + CO(g)(3)CO2(g) + C(s) =2CO(g)则该系统的独立组分数C为:(A)3(B)2(C)1(D)43.在100kPa的压力下,I2在液态水和CCl4中达到分配平衡(无固态碘存在),则该系统的条件自由度数为:(A)f*=1(B)f*=2(C)f*=0(D)f*=44.CuSO4与水可生成CuSO4·H2O,CuSO4·3H2O和CuSO4·5H2O三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为:(A)3种(B)2种(C)1种(D)不可能有共存的含水盐5.某一物质X,在三相点时的温度是20℃,压力是200kPa。
第六章 相平衡

第六章 相平衡例 题6-1 确定下列已达化学平衡体系的独立组元数、相数和自由度数。
(1)加热到2273.15K 的水蒸汽,气体中还有H 2、O 2、OH 、O 与H ; (2)HgO (s ),Hg (s )和O 2(g );(3)Fe (s ),FeO (s ),CO (g )和CO 2(g )。
解:(1)水蒸汽加热到2273.5K ,气相中建立的平衡关系为2221H O (g)H (g)O (g)2+体系中能独立存在的物种为H 2O (g ),H 2(g )和O 2(g ),存在浓度关系满足H O 222P P =条件,所以体系的独立组元数为1,相数为1,自由度数为2,如果温度恒定则自由度数为1。
(2)在HgO (s ),Hg (s )和O 2(g )的体系中存在下面的平衡关系:21H gO (s)H g(g)O (g)2+气相中浓度关系满足H g O 22P P =条件。
因此体系的独立组元数为1,相数为2,自由度数为1。
(3)在Fe (s ),FeO (s ),CO (g )和CO 2(g )体系中存在下面反应:2FeO(s)CO(g)Fe(s)CO (g)++因此独立组元数为3,相数为3,自由度数为2。
6-2 请用相律说明下列结论是否严谨,为什么? (1)纯物质在一定压力下的熔点是一定值; (2)纯物质在一定温度下的蒸气压为定值;(3)纯物质在一定温度下,固、气、液三相可以平衡共存。
解:(1)根据相律F =C -P +2,C =1。
熔化时P =2,F =1-2+2,当压力确定后温度就确定了,所以一定压力下的熔点是一定值的结论正确。
(2)用同样的分析方法,此体系确定温度时其蒸汽压随之确定,结论也是正确的。
(3)固、气、液三相平衡时,自由度F =0,这时外界条件(温度和压力)都是确定的特定值,不能随意变化,因此温度不能任意指定。
题意的结论是错误的。
6-3 求高山上大气压为66661Pa 时水的沸点。
第六章 相平衡习题

第六章相平衡选择题1. 二元恒沸混合物的组成(A)固定 (B) 随温度而变 (C) 随压力而变 (D) 无法判断答案:C2. 一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0答案:B。
此为可逆过程故ΔG=0。
5. 以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物 (B) 漂白粉(C) 大小不一的一堆单斜硫碎粒 (D) 墨汁答案:C。
6. NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7. 如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
7. 对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统(B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变(D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B8. 关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点(B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变(D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D9. 用相律和Clapeyron•方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1(B) 在每个单相区, 自由度F=2(C) 在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D) 在水的沸点曲线上任一点, 压力随温度的变化率都小于零答案:D10. 二组分系统的最大自由度是(A) F=1 (B) F=2 (C) F=3 (D) F=4答案:C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章相平衡选择题1、二元恒沸混合物得组成(A)固定 (B) 随温度而变 (C) 随压力而变 (D) 无法判断答案:C2、一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态得独立变量数应为(A) 3个 (B) 4个 (C) 5个 (D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存得最多相为(A) 1 (B) 2 (C) 3 (D) 4答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体得过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0答案:B。
此为可逆过程故ΔG=0。
5、以下各系统中属单相得就是(A) 极细得斜方硫与单斜硫混合物 (B) 漂白粉(C) 大小不一得一堆单斜硫碎粒 (D) 墨汁答案:C。
6、 NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统得自由度(A) F=0 (B) F=1 (C) F=2 (D) F=3答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7、如果只考虑温度与压力得影响, 纯物质最多可共存得相有(A) P=1 (B) P=2 (C) P=3 (D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
7、对于相律, 下面得陈述中正确得就是(A) 相律不适用于有化学反应得多相系统(B) 影响相平衡得只有强度因素(C) 自由度为零意味着系统得状态不变(D) 平衡得各相中, 系统包含得每种物质都不缺少时相律才正确答案:B8、关于三相点, 下面得说法中正确得就是(A) 纯物质与多组分系统均有三相点(B) 三相点就就是三条两相平衡线得交点(C) 三相点得温度可随压力改变(D) 三相点就是纯物质得三个相平衡共存时得温度与压力所决定得相点答案:D9、用相律与Clapeyron•方程分析常压下水得相图所得出得下述结论中不正确得就是(A) 在每条曲线上, 自由度F=1(B) 在每个单相区, 自由度F=2(C) 在水得凝固点曲线上, ΔHm(相变)与ΔVm得正负号相反(D) 在水得沸点曲线上任一点, 压力随温度得变化率都小于零答案:D10、二组分系统得最大自由度就是(A) F=1 (B) F=2 (C) F=3 (D) F=4答案:C。
F=C-P+2=2-P+2=4-P,当P=1时F=3。
11、关于杠杆规则得适用对象, 下面得说法中不正确得就是(A) 不适用于单组分系统(B) 适用于二组分系统得任何相区(C) 适用于二组分系统得两个平衡相(D) 适用于三组分系统得两个平衡相答案:B12、区别单相系统与多相系统得主要根据就是(A) 化学性质就是否相同 (B) 物理性质就是否相同(C) 物质组成就是否相同 (D) 物理性质与化学性质就是否都相同答案:D13、 Clapeyron方程不适用于(A) 纯物质固(α)=纯物质固(β)可逆相变(B) 理想溶液中任一组分得液-气可逆相变(C) 纯物质固-气可逆相变(D) 纯物质在等温等压下得不可逆相变答案:D14、对于三组分系统, 在相图中实际可能得最大自由度数就是(A) f=1 (B) f=2 (C) f=3 (D) f=4答案:C。
F=C-P+2=3-P+2,P最小为1,F=3-1+2=4。
因三组分系统相图无法表达出4个自由度,故取答案C。
15、关于等边三角形座标得特点, 不正确得说法就是(A) 在过三角形某一顶点得任一直线上各点所代表得系统中, 另外两组分得浓度比都相同(B) 任意两点代表得系统组成新系统时, 新系统得物质点必在原来两点得连接线上(C) 任意三点代表得系统组成新系统时, 新系统得物质点必在原来三点连成得三角形内(D) 由三角形内任一点向三边作垂线, 三垂线之与等于三角形得高, 且等于100%答案:D16、三组分水盐系统得相图常用来分离或提纯盐类, 处理时必须使物系点进入所需要得相区。
为此配合使用得操作很多,但一般不包括(A) 加水稀释 (B) 加入另一种盐或盐溶液(C) 升高或降低温度 (D) 水蒸汽蒸馏答案:D17、分配定律不适用于(A) 浓度小得系统 (B) 溶质难挥发得系统(C) 分子在两相中形态相同得系统(D) 溶质在一相中全部电离得系统答案:D18、对于下述结论, 正确得就是(A) 在等压下有确定沸点得液态系统一定就是纯物质(B) 任何纯固体物质都有熔点(C) 在一定温度下, 纯液体得平衡蒸气压与液体所受外压力无关(D) 纯固体物质得熔点可以有很多个答案:D。
因熔点就是与压力有关。
19、下面得表述中不正确得就是(A) 在定压下, 纯固体物质不一定都有确定得熔点(B) 在定压下, 纯液态物质有确定得唯一沸点(C) 在定压下, 固体混合物都不会有确定得熔点(D) 在定温下, 液体得平衡蒸气压与外压有关答案:C。
共熔混合物在定压下有确定得熔点。
20、涉及化合物得分解压力得下列表述中正确得就是(A) 各化合物都有特定得分解压力(B) 化合物分解时, 其分解压力必须等于外界压力(C) 化合物分解压力越大, 它越不易分解(D) 化合物得分解压力与温度有关答案:D21、体系中含有H2O、H2SO4·4H2O、H2SO4·2H2O、H2SO4·H2O、H2SO4 ,其组分数C为:(A) 1 (B) 2 (C) 3 (D) 4答案:B22、在410 K,Ag2O(s)部分分解成Ag(s)与O2(g), 此平衡体系得自由度为:(A) 0 (B) 1 (C) 2 (D)-1答案:A。
F=C-P+1=2-3+1=0。
23、一个水溶液包含n个溶质,该溶液通过一半透膜与纯水相平衡,半透膜仅允许溶剂水分子通过,此体系得自由度为:(A)n(B) n-1 (C)n+1 (D)n+2答案:D。
F=C-P+2=n+1-1+2。
24、绝热条件下,273、15K得NaCl加入273、15K得碎冰中, 体系得温度将如何变化?(A)不变(B)降低(C)升高(D)不能确定答案:B。
冰熔化吸热。
25、下图中,从P点开始得步冷曲线为:图 1答案:D26、图1中,生成固体化合物得经验式为:(A) CCl4·C4H10O2(B) CCl4·(C4H10O2)2(C) (CCl4)2·C4H10O2(D) CCl4(C4H10O2)3答案:C27、图1中,区域H得相态就是:(A)溶液(B)固体CCl4 (C)固体CCl4 +溶液(D)固体化合物+溶液答案:C28、 CaCO3(s), CaO(s), BaCO3(s), BaO(s)及CO2(g)构成得平衡物系,其组分数为:(A) 2 (B) 3 (C) 4 (D) 5答案:B。
C=S-R-R’=5-2-0=3、29、由CaCO3(s), CaO(s), BaCO3(s), BaO(s)及CO2(s)构成得平衡体系其自由度为:(A)F=2 (B)F=1 (C)F=0 (D)F=3答案:C。
共5种物质,2个化学反应,故C=5-2=3,有5个相,F=C-P+2=0。
30、三相点就是:(A)某一温度,超过此温度,液相就不能存在(B)通常发现在很靠近正常沸点得某一温度(C)液体得蒸气压等于25℃时得蒸气压三倍数值时得温度(D)固体、液体与气体可以平衡共存时得温度与压力答案:D31、某一固体在25℃与p∃压力下升华,这意味着:(A)固体比液体密度大些(B)三相点得压力大于p∃(C)固体比液体密度小些 (D)三相点得压力小于p∃答案:B。
32、N2得临界温度就是124K,室温下想要液化 N2,就必须:(A)在恒温下增加压力(B)在恒温下降低压力(C)在恒压下升高温度(D)在恒压下降低温度答案:D33、对于与本身得蒸气处于平衡状态得液体,通过下列哪种作图法可获得一直线:(A)p对T(B) lg(p/Pa) 对T (C) lg(p/Pa) 对1/T(D) 1/p对lg(T/K)答案:C。
由克劳修斯_克拉贝龙方程可以瞧出:34、当克劳修斯_克拉贝龙方程应用于凝聚相转变为蒸气时,则:(A)p 必随T 之升高而降低(B)p 必不随T 而变(C)p必随T之升高而变大(D)p随T之升高可变大或减少答案:C35、水得三相点附近,其蒸发热与熔化热分别为44、82与5、994kJ·mol-1。
则在三相点附近冰得升华热约为:(A) 38、83 kJ·mol-1 (B) 50、81 kJ·mol-1(C) -38、83 kJ·mol-1(D) -50、81 kJ·mol-1答案:B36、已知苯一乙醇双液体系中,苯得沸点就是353、3K, 乙醇得沸点就是351、6K, 两者得共沸组成为:含乙醇47、5%(摩尔分数),沸点为341、2K。
今有含乙醇77、5%得苯溶液,在达到气、液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。
下列结论何者正确?(A)y2 >x2 (B)y2 =x2 (C)y2<x2 (D)不确定答案:C37、如上题, 若将上述溶液精馏,则能得到:(A)纯苯(B)纯乙醇(C)纯苯与恒沸混合物(D)纯乙醇与恒沸混合物答案:D38、当用三角形坐标来表示三组分物系时,若某物系其组成在平行于底边BC得直线上变动时,则该物系得特点就是:(A) B得百分含量不变(B) A得百分含量不变(C) C得百分含量不变(D) B与C得百分含量之比不变答案:B39、如图所示,当物系点在通过A点得一条直线上变动时,则此物系得特点就是:(A) B与C得百分含量之比不变(B) A得百分含量不变(C) B得百分含量不变(D) C得百分含量不变答案:A40、 H2O-NaCl-Na2SO4得三元系中,Na2SO4与H2O能形成水合物Na2SO4·10H2O(D),在DBC 区中存在得就是:(A)水合物D与溶液(B)水合物D与Na2SO4 及NaCl三相共存(C)水合物D、NaCl与组成为G得溶液(D)纯NaCl,纯Na2SO4与水溶液答案:B41、 H2O-KNO3-NaNO3得相图如下,则BEC相区内就是:(A)纯NaNO3与其饱与溶液(B)纯KNO3与其饱与溶液(C)含有NaNO3与KNO3得不饱与溶液与溶液得单相区(D) KNO3,NaNO3与组成为E得饱与溶液三相共存答案:D问答题1.指出下列体系分别有几相:(1)空气;(2)冰雹;(3)金刚石与石墨混合物;(4)白色得冰与盐得共晶体;(5)一块黄铜(30%得锌-铜合金);(6)酒精水溶液;(7)油与水得混合物;(8)密闭容器中让碳酸钙分解并达平衡;(9)牛奶答:(1)、(2)、(5)、(6)只有一个相,(3)、(4)、(7)、(9)有两个相,(8)有三个相。
