第六章 相平衡与相图
合集下载
第六章 相平衡与相图

•
•
b .转变速度慢,由表面开始逐渐向内部进行
c .体积变化对生产影响不大
•
由于转变速度缓慢,则高温型SiO2变体常以介
稳状态在常温下存在,而不发生转变。
2.相图分析
• ⑴ 常温下SiO2稳定态是什么?其稳定的温度范围是多少? • β-石英,573℃以下。 • ⑵ β-石英加热过程中如何变化?(快热,慢热) • β-石英 转变为α-石英(慢热)
称为变体(晶型);当热力学条件改变时,变体
之间发生转变称为多晶转变。
• 2.可逆多晶转变: • 两种晶型在一定条件下可以互相转变; • 忽略压力对熔点和转变点的
影响,将晶型Ⅰ加热到T3时 转变成晶型Ⅱ;晶型Ⅱ高温 冷却又可在T3时转变为晶型 Ⅰ。若晶型Ⅰ转变为晶型Ⅱ 后继续升温到T2时将熔化成 熔体。可以下式表示:
• (二)Al2O3-SiO2系统 • 存在一个化合物: 3Al2O3· 2SiO2( A3S2 ) • 组成:72wt%Al2O3, • • • 28wt%SiO2 60mol%Al2O3 40mol%SiO2 少量Al2O3(约3mol%) 形成固溶体。
• 在A3S2的晶格中可溶于
• 1.相图分析 • • (1)A3S2为不一致熔化合物(试样纯度不高),
相。
• 2.相数 • 一个系统中所含相的数目称为相数,以P 表示—— • 单相系统(P=1) • 二相系统(P=2) • 三相系统(P=3) • 含有两个相以上的系统,统称为多相系统。
• (四)独立组元(独立组分) • 物种(组元):系统中每一个能单独分离出来 并能独立存在的化学纯物质。 • 独立组元:足以表示形成平衡系统中各相组成 所需要的最少数目的物种(组元)。 • 独立组元数:独立组元的数目,以C表示。 • n元系统:具有n个独立组元系统—— • 单元系统(C=1) • 二元系统(C=2) • 三元系统(C=3)
第六章相平衡与相图第二讲

液相点: 固相点:
4 P ( E F 0,L相消失)
F 2 F 1
C
D J H
A C
L%=
FG 100% PF
B%=
PG 100% PF
L%=
DG 100% PD
AmBn%=
PG 100% PD
小结: 至此,我们遇到两种二元无变量点,即低共熔点E和 转熔点P,在这两个无变量点上都表示一个液相与两个固 相之间的三相平衡,但它们的区别在于: 低共熔点E的相平衡关系是:
终点,F=0
p
转熔(加热)
(3) 析晶路线分析
熔体1析晶过程分析:
图中的1、2、3、4、5点
1 K b M
T a L+A E A+C
C的组成为AmBn 在转熔点P处,
L
P L+C
D
L+B
F
Lp B C
J C+B B
L p B C
L和B同时消失 P点是回吸点 也是析晶终点
3、生成一个不一致熔融化合物的二元相图
不一致熔化合物:是不稳定化合物。加热这种化合物到某一 温度
便分解成一种液相和一种晶相,二者组成与化 合物组成皆不相同。
(1) 相图特点:组分A与组分B生成化合物AmBn;
T a L+A E b L+B T
P
且AmBn的组成点位于其液相线的组成范围以外
L
P L+ AmBn
A+AmBn
L +AmBn
整个相图可分解成两个具有 低共熔点的二元系统,即:
A Am Bn和Am Bn B
E1是A Am Bn分二元系统的低共熔点 , 。 B E2是Am Bn B分二元系统的低共熔点
第六章相平衡与相图(5)-三元系统-2012中南大学无机材料科学基础课件

资源加工与生物工程学院
(二)相图特点
1.液相互溶
2.固相完全不互溶
3.不生成化合物
4.只有一个三元低共熔点
(三)投影图
投影图是将无变量点及界
线向浓度三角形投影而成。
第六章 相平衡相图——6.5 三元系统
资源加工与生物工程学院
立体图与平面投影图的关系
(1) 立体图的空间曲面(液相面)
→平面上的初晶区
资源加工与生物工程学院
第六章
6.1 概 述
相平衡与相图
6.2 相平衡及其研究方法 6.3 单元系统 6.4 二元系统 6.5 三元系统
第六章 相平衡相图——6.5 三元系统
资源加工与生物工程学院
6.5
一 、基本原理
三元系统
二、基本类型
1、具有一个低共熔点的三元相图 2、具有一个一致熔融二元化合物的三元相图 3、具有一个一致熔融三元化合物的三元相图 4、具有一个不一致熔融二元化合物的三元相图
第六章 相平衡相图——6.5 三元系统
资源加工与生物工程学院
一 基本原理
(一)三元系统组成表示方法和浓度三角形性质
1.组成表示法 (1)浓度三角形 ——等边三角形:表示 三元系统的组成
第六章 相平衡相图——6.5 三元系统
资源加工与生物工程学院
三个顶点 ——三个纯组分A、B、C; 三条边(AB、BC、AC) ——三个二元系统组成;
无论在哪种三角形中,任何一点的组成都可采用
作双线法求得,反过来已知组成也可在图中找到 相应的点。
第六章 相平衡相图——6.5 三元系统
资源加工与生物工程学院
2.浓度三角形性质 (1)等含量规则:平行于三角形 一边的直线,线上任意一个组成 点所含对面顶点组分的含量不变, 如MN线上,C%=常数 (2)定比例规则:三角形一顶点
材料物理化学-第六章 相平衡与相图

材料物理化学
湖南工学院
料。⑤碳纤维、石墨、金刚石与C6 。⑥计算机模拟与材料设计。⑦用新材料科 学技术武装改造传统材料产业。 GRM—巨磁电阻(Giant Magnetoresistance),通常作传感器使用,主要应 用于探测磁场、电流、位移、角速度等领域。探测微弱磁场的GM R 传感器最早 被商业化应用在磁记录领域, 作为硬盘的读出磁头。 薄膜集成的GMR磁头体积变 小, 磁记录介质的存储单元也随之变小, 这样存储密度就大大提高了。 至2000年, 存储密度为56. 3Gb/in2 的GMR 的磁头已经在日本的富士通制作所研制出来。 在21世纪初,我国的水泥产量就已跃居世界第一,但是,水泥工业的结构优 化和产品升级是当前要务。大量利用废弃的粉煤灰、矿渣、钢渣、硫酸铁渣、废 石膏、污泥等作为水泥的原料和掺合料是我国的特色,几乎占水泥产量的1/3, 这是“资源循环利用”的重大举措。研制的抗氯盐腐蚀、水化热低、抗微收缩和 后期强度高的水泥,已成功应用于我国几个超大型的海工工程中。在混凝土中, 除水泥、黄沙、石子、水和添加剂(如减水剂)的5组分外,为获得更为优异的 性能,第六组分的研究也是一个研究热点。 黄伯云:粉末冶金专家,中南大学校长,中国工程院院士。1945年11月生于 湖南益阳南县, 1969年毕业于中南矿冶学院特种冶金系,1980年至1986年在美国 依阿华州立大学获硕士、 博士学位,随后进入美国田纳西大学和橡树岭国家实验 室从事博士后研究工作。1988年回国,1997年任中南工业大学校长,2001年任中 南大学校长, 1999年当选为中国工程院院士。黄伯云是我国材料科学领域的战略 科学家,他率领团队历时20年研制出的“高性能碳/碳航空制动材料的制备技 术”,打破了国外的技术垄断,使我国成为世界上有能力生产碳/碳复合材料飞 机刹车片的四个国家之一。也正是这项技术,在2005年荣获了已连续空缺6年的 国家技术发明一等奖。 C/C复合材料的密度仅为钢的1/4在波音747——400飞机上使用了C/C复合材 料刹车盘后, 使飞机机身大约减重816.5Kg。
湖南工学院
料。⑤碳纤维、石墨、金刚石与C6 。⑥计算机模拟与材料设计。⑦用新材料科 学技术武装改造传统材料产业。 GRM—巨磁电阻(Giant Magnetoresistance),通常作传感器使用,主要应 用于探测磁场、电流、位移、角速度等领域。探测微弱磁场的GM R 传感器最早 被商业化应用在磁记录领域, 作为硬盘的读出磁头。 薄膜集成的GMR磁头体积变 小, 磁记录介质的存储单元也随之变小, 这样存储密度就大大提高了。 至2000年, 存储密度为56. 3Gb/in2 的GMR 的磁头已经在日本的富士通制作所研制出来。 在21世纪初,我国的水泥产量就已跃居世界第一,但是,水泥工业的结构优 化和产品升级是当前要务。大量利用废弃的粉煤灰、矿渣、钢渣、硫酸铁渣、废 石膏、污泥等作为水泥的原料和掺合料是我国的特色,几乎占水泥产量的1/3, 这是“资源循环利用”的重大举措。研制的抗氯盐腐蚀、水化热低、抗微收缩和 后期强度高的水泥,已成功应用于我国几个超大型的海工工程中。在混凝土中, 除水泥、黄沙、石子、水和添加剂(如减水剂)的5组分外,为获得更为优异的 性能,第六组分的研究也是一个研究热点。 黄伯云:粉末冶金专家,中南大学校长,中国工程院院士。1945年11月生于 湖南益阳南县, 1969年毕业于中南矿冶学院特种冶金系,1980年至1986年在美国 依阿华州立大学获硕士、 博士学位,随后进入美国田纳西大学和橡树岭国家实验 室从事博士后研究工作。1988年回国,1997年任中南工业大学校长,2001年任中 南大学校长, 1999年当选为中国工程院院士。黄伯云是我国材料科学领域的战略 科学家,他率领团队历时20年研制出的“高性能碳/碳航空制动材料的制备技 术”,打破了国外的技术垄断,使我国成为世界上有能力生产碳/碳复合材料飞 机刹车片的四个国家之一。也正是这项技术,在2005年荣获了已连续空缺6年的 国家技术发明一等奖。 C/C复合材料的密度仅为钢的1/4在波音747——400飞机上使用了C/C复合材 料刹车盘后, 使飞机机身大约减重816.5Kg。
6相平衡与相图

线(或延长线〕的交点是该晶体的熔点。 ②两种晶型的升华曲线的交点是两种晶型的多晶
转变点。 ③在同一温度下,蒸气压低的相更加稳定。所以,
介稳平衡的虚线,总是在稳定平衡的实线上方 。
④交汇于三相点的三条平衡曲线互相之间 的位置遵循下面两条准则:
a、每条曲线越过三相点的延长线必定在另 外两条曲线之间。
b、同一温度时,在三相点附近比容差最大 的两相之间的单变量曲线或其介稳延长 线居中间位置。
晶型的升华曲线; CF线:是α-晶型和液相两相平衡共存线,即α-
晶型的熔融曲线;
BE线:是α-晶型和β-晶型两相平衡共存线,即 两种晶型之间的多晶转变曲线。
特性点: B点:是α-晶型、β-晶型和气相三相平衡共存
点,也叫多晶转变点; C点:是α-晶型、液相和气相三相平衡共存点,
也是α-晶型的熔点。
(2)介稳相平衡部分(虚线部分) 相区: FCGH:是过冷液体的介稳状态区; EBGH:是过热β-晶型的介稳相区; EBK:是过冷α-晶型的介稳相区。
C=1,代入公式,则f=0,∴温度不能改变。 而二元合金凝固时,也是二相共存,P=2,
C=2,则 f=C-P+1=1,即存在一个变量。对 于给定成分的合金,其温度可以变化。
三、相平衡的研究方法 1、动态法
最普通的动态法是热分析法。这种方法主 要是观察系统中的物质在加热和冷却过程中所 发生的热效应。
一个系统中所含相的数目,叫做相 数,以符号P表示。
按照相数的不同,系统可以分为: 单相系统(P=1),二相系统(P=2), 三相系统(P=3)等等。
含有两个相以上的系统,统称为多 相系统。
几点规律: (1)一种物质可以有几个相。 (2)相是一个抽象的概念,它一般不涉及
转变点。 ③在同一温度下,蒸气压低的相更加稳定。所以,
介稳平衡的虚线,总是在稳定平衡的实线上方 。
④交汇于三相点的三条平衡曲线互相之间 的位置遵循下面两条准则:
a、每条曲线越过三相点的延长线必定在另 外两条曲线之间。
b、同一温度时,在三相点附近比容差最大 的两相之间的单变量曲线或其介稳延长 线居中间位置。
晶型的升华曲线; CF线:是α-晶型和液相两相平衡共存线,即α-
晶型的熔融曲线;
BE线:是α-晶型和β-晶型两相平衡共存线,即 两种晶型之间的多晶转变曲线。
特性点: B点:是α-晶型、β-晶型和气相三相平衡共存
点,也叫多晶转变点; C点:是α-晶型、液相和气相三相平衡共存点,
也是α-晶型的熔点。
(2)介稳相平衡部分(虚线部分) 相区: FCGH:是过冷液体的介稳状态区; EBGH:是过热β-晶型的介稳相区; EBK:是过冷α-晶型的介稳相区。
C=1,代入公式,则f=0,∴温度不能改变。 而二元合金凝固时,也是二相共存,P=2,
C=2,则 f=C-P+1=1,即存在一个变量。对 于给定成分的合金,其温度可以变化。
三、相平衡的研究方法 1、动态法
最普通的动态法是热分析法。这种方法主 要是观察系统中的物质在加热和冷却过程中所 发生的热效应。
一个系统中所含相的数目,叫做相 数,以符号P表示。
按照相数的不同,系统可以分为: 单相系统(P=1),二相系统(P=2), 三相系统(P=3)等等。
含有两个相以上的系统,统称为多 相系统。
几点规律: (1)一种物质可以有几个相。 (2)相是一个抽象的概念,它一般不涉及
第六章 相平衡与相图3

四、三元系统相图的基本类型 生成一个不一致熔融 2、生成一个不一致熔融 二元化合物的三元系统 二元化合物的三元系统
(1)相图一般介绍 ) 相图上的特点: 相图上的特点: 特点 化合物组成点不在其 化合物组成点不在其 初晶区范围内。 初晶区范围内。 e1E线: 共熔线;L↔A+S 线 共熔线; Pp线:转熔线 L+B↔S 线 转熔线; E点:重心位;LE↔A+S+C 点 重心位; P点:交叉位;LP+B↔C+S 点 交叉位;
A A L+A e1 C e4 E S
C
P
m
e3
B p S B
e1’
L+S p/ S/ L+B
A/
B/
(2) 几条重要规则
A 连线规则:用来判断界线的温度走向; 用来判断界线的温度走向; 界线的温度走向
定义:将界线 或延长线 相应的连线相交 定义:将界线(或延长线 与相应的连线相交, 或延长线)与 相交, 其交点是该界线上的温度最高点; 其交点是该界线上的温度最高点; 温度走向是背离交点。 温度走向是背离交点。
A M1 M P M3 B C
M2
M1+M2=M+M3 +
从M1+M2中取出 3愈多,则M点离 3愈远。 中取出M 愈多, 点离M 点离 愈远。
6、共轭位置规则
在三元系统中,物质组成点 在 在三元系统中,物质组成点M在 角顶之外, ∆的一个角顶之外,这需要从物质 的一个角顶之外 M3中取出一定量的混合物质 1+ 中取出一定量的混合物质M M2,才能得到新物质 ,此规则称 才能得到新物质M, 为共轭位置规则。 为共轭位置规则。
4、重心规则
在三元系统中,若有三种物质M1、M2、M3合成混合 在三元系统中,若有三种物质 的组成点在连成的∆ 物M,则混合物 的组成点在连成的∆M1M2M3之内,M ,则混合物M的组成点在连成的 点的位置称为重心位置。 点的位置称为重心位置。 当一种物质分解成三种物质 ,则混合物组成点也在 三物质组成点所围的三角形内。 三物质组成点所围的三角形内。
第六章相平衡与相图

上式表明:如果一个相分解为两个相,则生 成相的数量与原始相的组成点到两个新生相的组 成点之间的线段成反比。此关系式与力学上的杠 杆很相似。M点相当于杠杆的支点,M1和M2则 相当于两个力点,因此称为杠杆规则。
2.杠杆规则的含义
可以看出:
系统中平衡共存的两相的含量与两相状态点到系统 总状态点的距离成反比。
M2 B G•b%= G1•b1%+ G2•b2%(2)
将(1)式代入,得
(G1+G2)b%= G1•b1%+ G2•b2% G1(b-b1)=G2(b2-b)(3)
所以 G1(M1-M)=G2(M-M2)两个新相M1和M2在系统中的含量则为:
G1=(M-M2/M1+M2)%
G2=(M1-M/M1+M2)%
b2
b
b1
A
M1
M
若组成为M的原始混合物含B为 b%,总质量为G;新相M1含B为 b1%,质量为G1;新相M2含B 为b2%,质量为G2。因变化前、 后的总量不变,所以
G = G1+G2 (1) 原始混合物中B的质量为G•b%, 新相M1中B的质量为G1•b1%。 新相M2中B的质量为G2•b2%。 所以:
(2)熔体的冷却析晶过程
所谓熔体的冷却析晶过程是指将一定组成的 二元混合物加热熔化后再将其平衡冷却而析晶的 过程。
通过对平衡冷却析晶过程的分析律。
TA
M
TB
TC
C
L
A+L TD
TE
ME
D B+L
E
A+B
A
M′
B%
B
M(熔体) L p=1 f=2
L A
TAE线、TBE线都称之为液相线, 通过E点的水平线GH称为固相线。
《无机材料》 第6章 相平衡与相图(2)-单元系统(2学时)

线上两相平衡共存,P=2, F=3-P=l,则在线上温度和 压力两个变量中只有一个是 独立可变。
三相点: B-多晶转变点(点上α-晶型、β-晶型和气相平衡
并存) C-α-晶型的熔点(点上的是α-晶型、液相和气相
平衡共存)
点上三相平衡共存,P=3, F=0,故单元系统中的三相点 无自由度,为无变量点,即要 维持三相平衡共存,必须严格 保持温度和压力不变,否则会 有相的消失。
转变。 特点:a. 结构变化小,体积变化小
b. 转变速度快,于全部晶体内发生 c. 【注意】多晶转变时的体积效应在无机材料制备和
使用过程中需特别注意。
SiO2多晶转变时的体积变化理论计算值
一级变体间的转变
计算采取 在该温度下 的温度 转变时体积 (℃) 效应(%)
二级变体间的转变
计算采取 在该温度下 的温度 转变时体积 (℃) 效应(%)
晶型Ⅱ蒸气压在高温和低温阶段都比晶型Ⅰ蒸 气压高,则晶型Ⅱ处于介稳型Ⅰ熔融为 熔体,熔体冷却到T1又结晶 为晶型Ⅰ。而要获得晶型Ⅱ,
须使熔体过冷,而不能直接
加热晶型Ⅰ得到。
晶型Ⅰ
熔体
晶型Ⅱ
即晶型Ⅰ和晶型Ⅱ之间转变为不可逆(单向), 晶型Ⅰ和熔体之间转变为可逆。
相图指导:
u 确定合理烧成温度和烧成制度; u 加入少量矿化剂(杂质:如FeO、Mn2O3、 CaO等),促
进α-石英转变为α-鳞石英; 矿化剂:在反应过程中,为能促进或控制结晶化合物的形 成或反应而加入的少量物质,有利于烧成和改善制品性能。 作 用:(1)形成液相(5~7%),促进α-鳞石英形成;
P
冰 D B O
C 水 A
O 蒸汽
T
O点—— 水、冰、气三相共 存的三相点:
三相点: B-多晶转变点(点上α-晶型、β-晶型和气相平衡
并存) C-α-晶型的熔点(点上的是α-晶型、液相和气相
平衡共存)
点上三相平衡共存,P=3, F=0,故单元系统中的三相点 无自由度,为无变量点,即要 维持三相平衡共存,必须严格 保持温度和压力不变,否则会 有相的消失。
转变。 特点:a. 结构变化小,体积变化小
b. 转变速度快,于全部晶体内发生 c. 【注意】多晶转变时的体积效应在无机材料制备和
使用过程中需特别注意。
SiO2多晶转变时的体积变化理论计算值
一级变体间的转变
计算采取 在该温度下 的温度 转变时体积 (℃) 效应(%)
二级变体间的转变
计算采取 在该温度下 的温度 转变时体积 (℃) 效应(%)
晶型Ⅱ蒸气压在高温和低温阶段都比晶型Ⅰ蒸 气压高,则晶型Ⅱ处于介稳型Ⅰ熔融为 熔体,熔体冷却到T1又结晶 为晶型Ⅰ。而要获得晶型Ⅱ,
须使熔体过冷,而不能直接
加热晶型Ⅰ得到。
晶型Ⅰ
熔体
晶型Ⅱ
即晶型Ⅰ和晶型Ⅱ之间转变为不可逆(单向), 晶型Ⅰ和熔体之间转变为可逆。
相图指导:
u 确定合理烧成温度和烧成制度; u 加入少量矿化剂(杂质:如FeO、Mn2O3、 CaO等),促
进α-石英转变为α-鳞石英; 矿化剂:在反应过程中,为能促进或控制结晶化合物的形 成或反应而加入的少量物质,有利于烧成和改善制品性能。 作 用:(1)形成液相(5~7%),促进α-鳞石英形成;
P
冰 D B O
C 水 A
O 蒸汽
T
O点—— 水、冰、气三相共 存的三相点:
相图与相平衡基础知识

推导过程
假设一个平衡系统中有C个组分,P个相, 如果C个组分在每个相中都存在,那么对每 一个相来讲,只要任意指定(C-1)个组分 的浓度就可以表示出该相中所有组分的浓度, 因为余下的一个组分的浓度可以从100中减去 (C-1)个组分的浓度之和求得。由于系统 有P个相,所以需要指定的浓度数总共有P (C-1)个,只要才能确定体系中各相浓度。
相律 吉布斯根据前人的实验素材,用严谨的热力学作 为工具,于1876年导出了多相平衡系统中,系统的 自由度数(F),独立组元数(C),相数(P)和 对系统的平衡状态能够发生影响的外界影响因素 (n)之间的关系,相律的数学表达式为: F=C-P+n 一般情况下,只考虑温度和压力对系统的平衡状态的 影响,即n=2,则相律表达式为 F=C-P+2
总之,气相只能一个相,无论多少种气体混在一起 都一样,形成一个气相,液体可以是一个相,也可 以是两个相(互溶程度有限时)。固体如果是连续 固溶体为一相;其他情况下,一种固体物质是一个 相。
一个系统中所含有相的数目,叫做相数,以符号P 表示,按照相数的不同,系统可分为单相系统 (P=1),二相系统(P=2),三相系统(P=3)等。 含有两个相以上的系统,统称为多相系统。
第六章 相平衡和相图
什么是相图
相图的研究方法有哪些 相图的应用
相图的定义
在一个多相体系中,随温度、压力和浓度的
变化,相的种类、数量及含量都要相应地发 生变化,对于变化情况可用几何图形来描绘, 这个图形就可以反映出该系统在一定组成、 温度和压力下,达到平衡时所处的状态,这 个几何图形就是相图,也叫相平衡图、状态 图。
相平衡研究方法
动态法 热分析法 差热分析法(DTA) 溶解度法 静态法(淬冷法)
相平衡和相图
材料科学基础
30
第六章 相平衡和相图
C 例:根据下列相图 (1) 用连线规则划分副三角形。 (2) 用箭头标出界线上温度变化方向及界线性质。 C (3) 判断S、S1、S2化合物的性质。 (4) 写出各无变量点的性质及反应式。 (5)在相图下侧画出A-B二元系统相图。 u v (6) 分析熔体M1、M2的析晶路程。 S (M1在SO连线上)
第六章 相平衡和相图
13
3、背向线规则
在浓度三角形中,一个三元系统的组成点愈靠近某个顶点,
该顶点所代表的组分的含量就愈高;反之,愈少。
C 若熔体在冷却时析出某一
顶点所代表的组元,则液
相中组成点必定沿着该顶 点与熔体组成点的连线向 背离该顶点的方向 A
材料科学基础
D
B
第六章 相平衡和相图
14
4、杠杆规则
C C
b L .2 N
a
e2
K
1
.
B
x B
z y
熔体1
L LB 1[B,(B)] a[B,B+(A)] f=3 f=2
L B+N f=1
L B+A K[x,B+A+(N)] f=1
e1
L+AB+N f=0
K[y(A消失),N+B]
LN+B+C L[z,N+B+(C)] f=0
L(液相消失)[1,N+B+C]
所谓一致熔融化合物是一种稳定 的化合物。它与正常的纯物质一 样具有固定的熔点,融化时,所
产生的液相与固相的化合物组成 相同,故称一致熔融
材料科学基础
2
第六章 相平衡和相图
2、不一致熔融化合物: 一种不稳定的化合物,加热这种 化合物到某一温度便发生分解, 分解产物是一种液相和一种晶相, 二者组成与原来化合物组成完全 不同。 点:纯物质熔点;低共熔点; 转熔点等 线:液相线(3条)固相线等;
30
第六章 相平衡和相图
C 例:根据下列相图 (1) 用连线规则划分副三角形。 (2) 用箭头标出界线上温度变化方向及界线性质。 C (3) 判断S、S1、S2化合物的性质。 (4) 写出各无变量点的性质及反应式。 (5)在相图下侧画出A-B二元系统相图。 u v (6) 分析熔体M1、M2的析晶路程。 S (M1在SO连线上)
第六章 相平衡和相图
13
3、背向线规则
在浓度三角形中,一个三元系统的组成点愈靠近某个顶点,
该顶点所代表的组分的含量就愈高;反之,愈少。
C 若熔体在冷却时析出某一
顶点所代表的组元,则液
相中组成点必定沿着该顶 点与熔体组成点的连线向 背离该顶点的方向 A
材料科学基础
D
B
第六章 相平衡和相图
14
4、杠杆规则
C C
b L .2 N
a
e2
K
1
.
B
x B
z y
熔体1
L LB 1[B,(B)] a[B,B+(A)] f=3 f=2
L B+N f=1
L B+A K[x,B+A+(N)] f=1
e1
L+AB+N f=0
K[y(A消失),N+B]
LN+B+C L[z,N+B+(C)] f=0
L(液相消失)[1,N+B+C]
所谓一致熔融化合物是一种稳定 的化合物。它与正常的纯物质一 样具有固定的熔点,融化时,所
产生的液相与固相的化合物组成 相同,故称一致熔融
材料科学基础
2
第六章 相平衡和相图
2、不一致熔融化合物: 一种不稳定的化合物,加热这种 化合物到某一温度便发生分解, 分解产物是一种液相和一种晶相, 二者组成与原来化合物组成完全 不同。 点:纯物质熔点;低共熔点; 转熔点等 线:液相线(3条)固相线等;
第六章 相平衡状态图

体系中具有同样成分、结构和性能、与数量无关的部 分(或体),相与相之间有分界面。例如:冰——水:两 相是液态水和固态冰(结构、性能不同);两块冰:一相 是固态冰。
2.相图
——物质的组成、物相、物相平衡随温度、压力以及其 他外界条件改变而改变的关系状态图,x--P;x--T等。 注意:相图只是表明在一定条件下稳定相是什么,而不能 给出关于不稳定相转化为稳定相的任何信息。
图 6.3连续互溶体系
➢ 最低熔点互溶体系 液相线与固相线相切于
最低点。
图6.4 最低熔点互溶体系
➢最高熔点互溶体系 液相线与固相线相切于
最高点。
图 6.5 最高熔点互溶体系
注意:相应于切点成分的晶体,熔化与凝固是在同一温度, 固体与液体成分相同的情况下进行的。
❖共晶体系:A和B两种组元在气相和液相是能够相互溶
图6.11 形成熔化不分解的化合物体系
化合物γ相的两条液相线相 交于最大值,并在最大值 相切成一定角度。
非同成分熔化的化合物体系
图6.12包晶反应化合物体系
这是由包晶反应形成的化合物体系,化合物γ熔化 为液相和α固溶体。
❖ 液态分层体系
这种体系在液态不完全互溶。
➢ 偏晶体系 如图所示的是在高温区有偏
四相平衡共存。
6.2 二元系相图
一、二元相图的表示和建立方法
❖二元系:k=2,f=k-P+2=4-P;
P=1,f=3,(T,p,x) 相图是三维的
若压力一定:T-x
相图是二维的
❖目前研究最多的二元相图是p=1.01×105Pa,此相图采 用两个坐标轴,纵坐标用来表示温度T,横坐标用来表 示成分Xi。
第二,结线必须起自一平衡曲线而终止于另一平衡曲线;
2.相图
——物质的组成、物相、物相平衡随温度、压力以及其 他外界条件改变而改变的关系状态图,x--P;x--T等。 注意:相图只是表明在一定条件下稳定相是什么,而不能 给出关于不稳定相转化为稳定相的任何信息。
图 6.3连续互溶体系
➢ 最低熔点互溶体系 液相线与固相线相切于
最低点。
图6.4 最低熔点互溶体系
➢最高熔点互溶体系 液相线与固相线相切于
最高点。
图 6.5 最高熔点互溶体系
注意:相应于切点成分的晶体,熔化与凝固是在同一温度, 固体与液体成分相同的情况下进行的。
❖共晶体系:A和B两种组元在气相和液相是能够相互溶
图6.11 形成熔化不分解的化合物体系
化合物γ相的两条液相线相 交于最大值,并在最大值 相切成一定角度。
非同成分熔化的化合物体系
图6.12包晶反应化合物体系
这是由包晶反应形成的化合物体系,化合物γ熔化 为液相和α固溶体。
❖ 液态分层体系
这种体系在液态不完全互溶。
➢ 偏晶体系 如图所示的是在高温区有偏
四相平衡共存。
6.2 二元系相图
一、二元相图的表示和建立方法
❖二元系:k=2,f=k-P+2=4-P;
P=1,f=3,(T,p,x) 相图是三维的
若压力一定:T-x
相图是二维的
❖目前研究最多的二元相图是p=1.01×105Pa,此相图采 用两个坐标轴,纵坐标用来表示温度T,横坐标用来表 示成分Xi。
第二,结线必须起自一平衡曲线而终止于另一平衡曲线;
二元系统

不同组成二元系统在Tl(或T2)温度下发生固相反 应时可能有三种不同结果:
① 组成在A-AmBn范围内,A组元含量较高,冷却到T1(或
加热到 T2)时,固相反应结果是B晶相消失,剩余A晶相和新 生成化合物AmBn。
② 组成在AmBn-B范围内,冷却到T1(或加热到T2)时,固 相反应结果是A晶相消失,剩余B晶相和新生成化合物AmBn。
58 56 50.8 37.9 34.0 34.0 ≈28.6 28.1 27.2 ≈11 28.1
③组成刚好为AmBn二元系统,冷却到Tl(或加热T2)时,固 相反应结果是A、B全部化合生成化合物AmBn。
注意: ➢ 固态物质之间反应速度很慢,因而达到平衡状态
需要时间很长。尤其在低温下难以达到平衡状态, 系统往往处于A、AmBn、B三种晶体同时存在的非 平衡状态。 ➢ 水泥熟料中的C3S即是在1250~2150℃范围内稳定 存在化合物,只不过该化合物到2150℃时发生不 一致熔融,分解为液相和CaO。
40mol%SiO2
在A3S2的晶格中可溶于少量Al2O3
(约3mol%)形成固溶体。
60
1.相图介绍
(1)A3S2为不一致熔化合物(试样纯度不高), A3S2的转熔点为1828℃。
(2)A3S2为一致熔化合物(试样纯度高变并防止 SiO2挥发),A3S2熔点为1850℃。
2.相图应用 对铝、硅质耐火材料的研究和生产具有指导意义
LC LD+A,即冷却时从
a
b
液相LC中析出A晶相,同时
液相LC转变为液相LD;加
热时过程反向进行。
M点冷却析晶过程:
三 专业二元系统相图
(一)Al2O3-SiO2系统 存在一个化合物:
第六章 相平衡和相图

转变很慢,要加 快转变,必须加入矿化剂。
同类转变:-、-和 -型晶体,转变速度非常快。
2、不同的晶型有不同的比重, -石英的最大。 3、 SiO2的多晶转变的体积效应(见表6-1)
结论:同级转变V大,-石英 -鳞石英的
VMAX=16% 同类转变V小,鳞石英V最小,为0.2%;
方石英V最大,为2.8%。 同类转变速度快,因而同类转变的危害大。
组分数 = 化学物质数 - 在稳定条件下的化
学反应数。
在硅酸盐系统中经常采用氧化物作为系统的组分。 如:SiO2一元系统
Al2O3-SiO2二元系统 CaO-Al2O3-SiO2三元系统
注意区分:2CaO.SiO2(C2S) ;
CaO-SiO2;
K2O.Al2O3..4SiO2 -SiO2
3、自由度 (f) 定义: 温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内改变而不会引起旧相消失新相产生的 独立变量的数目 具体看一个二元系统的自由度。
采取的措施:
1、在870℃适当保温,促使鳞石英生成; 2、在1200~1350℃小心加快升温速度避免生成α- 方
石英; 3、在配方中适当加入Fe2O3、MnO2、CaO或Ca(OH)2
等矿化剂,在1000℃左右产生一定量的液相, α石英、α- 方石英在此液相中的溶解度大,而α-鳞 石英的溶解度小,因而 α- 石英、α- 方石英不断 溶入液相,而α-鳞 石英则不断从液相中析出。
2、组分、独立组分 (组元)组分:组成系统的物质。 独立组分:足以表示形成平衡系统中各相所需要的最少数目的 组分: c = 组分数-独立化学反应数目-限制条件 例如:
CaCO3 CaO CO2 c = 3-1-0 = 2
系统中化学物质和组分的关系: 当物质之间没有化学反应时,化学物质数目=组分数; 当物质之间发生化学反应时,
同类转变:-、-和 -型晶体,转变速度非常快。
2、不同的晶型有不同的比重, -石英的最大。 3、 SiO2的多晶转变的体积效应(见表6-1)
结论:同级转变V大,-石英 -鳞石英的
VMAX=16% 同类转变V小,鳞石英V最小,为0.2%;
方石英V最大,为2.8%。 同类转变速度快,因而同类转变的危害大。
组分数 = 化学物质数 - 在稳定条件下的化
学反应数。
在硅酸盐系统中经常采用氧化物作为系统的组分。 如:SiO2一元系统
Al2O3-SiO2二元系统 CaO-Al2O3-SiO2三元系统
注意区分:2CaO.SiO2(C2S) ;
CaO-SiO2;
K2O.Al2O3..4SiO2 -SiO2
3、自由度 (f) 定义: 温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内改变而不会引起旧相消失新相产生的 独立变量的数目 具体看一个二元系统的自由度。
采取的措施:
1、在870℃适当保温,促使鳞石英生成; 2、在1200~1350℃小心加快升温速度避免生成α- 方
石英; 3、在配方中适当加入Fe2O3、MnO2、CaO或Ca(OH)2
等矿化剂,在1000℃左右产生一定量的液相, α石英、α- 方石英在此液相中的溶解度大,而α-鳞 石英的溶解度小,因而 α- 石英、α- 方石英不断 溶入液相,而α-鳞 石英则不断从液相中析出。
2、组分、独立组分 (组元)组分:组成系统的物质。 独立组分:足以表示形成平衡系统中各相所需要的最少数目的 组分: c = 组分数-独立化学反应数目-限制条件 例如:
CaCO3 CaO CO2 c = 3-1-0 = 2
系统中化学物质和组分的关系: 当物质之间没有化学反应时,化学物质数目=组分数; 当物质之间发生化学反应时,
材料科学基础课件第六章--相平衡与相图

F = C-P+n
自由 度数
独立组 元数
F = C-P+2
对凝聚态体系, 压力恒定或影响 较小,其相律为:
F = C-P+1
组元数C多,自 由度F大;相数P 多,自由度小
6.1.3 相平 衡研究方法
动态法
静态法 (淬冷法)
热分 析法
差热分 析法
T/℃
(1ቤተ መጻሕፍቲ ባይዱ 热分析法
1
2
3
原理:根据系统在冷却
ab c
100 80Bi 60Bi 20Bi 100 Bi 20Cd 40Cd 80Cd Cd
T/℃
ab c d e
t/s
Bi-Cd合金冷却曲线
546.15K
596.15K
L
L+Bi(s) ●
L+Cd(s)
20 40 Bi(s)+Cd(s) 80
0 Bi
WCd/%
100 Cd
Bi-Cd系统相图
液相线:由凝固开始温度连接起来的相界线 固相线:由凝固终结温度连接起来的相界线
元系统相图
P ●:熔点
■:转变点
2
L
●
Ⅱ
3
■
1
●
Ⅰ
O T0 T2 T1 T3
T
图 6-7 具有不可逆多晶转变的
单元系统相图
晶体I T3 晶体II
晶体Ⅰ 晶体Ⅱ 液相
(1) 晶体I、Ⅱ有稳定区 (2) 转变温度T3<T1 、T2(熔点)
T1 液 相 T2
(1)晶体Ⅱ无稳定区 (2)T3>T1、T2
6.2.2 单元系统专业相图
G
E
H
A+B
A
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 无气相或虽有气相但其影响可忽略不计的系统称
为凝聚系统:如合金、硅酸盐系统
•
对于某些硅酸盐系统,气相不可忽略,则不能按
一般凝聚系统对待。
• (三)相 • 系统中物理与化学性质相同且完全均匀部分的总和。
•
1.特点
质突变;
• (1)相之间有界面,可用机械方法分离,越过界面时性
• (2)一个相在物理和化学性质上都是微观尺度的均匀,
4.形成固溶体的二元系统相图
• ⑴ 连续(或完全互溶、无限 互溶)固溶体:溶质和溶剂 能以任意比例相互溶解的固 溶体。 • 特点:无二元无变量点。 • 液相线:aL2b , • P=2,F=1。 • 固相线:aS2b , • P=2,F=1。 • 此系统内只有液相和固溶 体两相,不会出现三相平衡 状态 。
•
•
b .转变速度慢,由表面开始逐渐向内部进行
c .体积变化对生产影响不大
•
由于转变速度缓慢,则高温型SiO2变体常以介
稳状态在常温下存在,而不发生转变。
2.相图分析
• ⑴ 常温下SiO2稳定态是什么?其稳定的温度范围是多少? • β-石英,573℃以下。 • ⑵ β-石英加热过程中如何变化?(快热,慢热) • β-石英 转变为α-石英(慢热)
• 但在固态时则完全不互溶, 两个组分各自从液相中分 别析晶; • 组分间不生成新化合物。
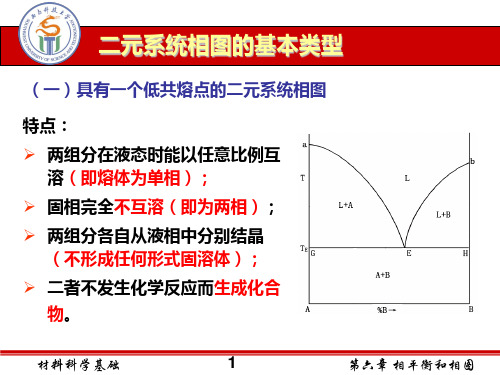
• • • • • • • • • •
(1)相图分析 液相线aE、bE:P=2,F=1 固相线GH 相区:液相单相区L:P=1, F=2 固液共存区(L+A),(L+B) 固相区(A+B):P=2,F=1 低共熔点E:LE A+ B P=3,F=0 (2)熔体的冷却析晶过程 指将一定组成的二元混合 物加热熔化后再将其平衡冷却 而折晶的过程。
• ⑶ 却析晶过程中各相含量的计算
• M熔体冷却到TD时, A晶相(F点)和液相(D点)平 衡共存,系统总状态点在O点。根据杠杆规则:
2.生成化合物的二元系统相图
• ⑴ 生成一个一致熔融化合物的二元系统相图
• ⑵ 生成一个不一致熔融化合物的二元系统相图
• ⑶ 低共熔点下有化合物生成的二元系统相图
时都有向晶型Ⅰ转变的倾向。
• 升温到T1,晶型Ⅰ熔融为 熔体,熔体冷却到T1又结晶
为晶型Ⅰ。而要获得晶型Ⅱ,
须使熔体过冷,而不能直接 加热晶型Ⅰ得到。
• 即晶型Ⅰ和晶型Ⅱ之间转变为不可逆(单 向),晶型Ⅰ和熔体之间转变为可逆。 • 相图特点:多晶转变的温度高于两种晶型 的熔点,即:T3>T1、T2
§6.3 二元系统相图
• 一、相图的表示方法及相律
• 二、二元系统的相图类型
• 三、专业二元系统相图举例
• 一、相律及相图表示方法 • 二元凝聚系统:含有二个组元(C=2)的系统 • 可以不考虑压力的改变对系统相平衡的影响 • 1. 相律
•
• •
F=C-P+1 =3-P
当 Pmin=1时 Pmax=3时 Fmax=2 (T ,X ) Fmin=0
• H2O相图
• 最简单的单元系统相图
• 相图分析:
• 单相区
• 两相平衡共存的线
• 三相点 • 在单元系统中, • 相同温度下蒸气压 小的相比较稳定。
二、可逆与不可逆多晶转变
• 1. 同质多晶现象 • 同一种化学组成的物质,在不同热力学条件
下结晶形成结构不同的晶体的现象称为同质多晶
现象;由此而产生的组成相同,结构不同的晶体
• 相图为温度-组成图
• 2. 相图表示方法
• 横坐标——系统组成, 称为组成轴; • 两个端点——分别表示两
个纯组元;
• 中间任意一点——由这两 个组元组成的一个二元系 统。
• 二、基本类型 • 1. 具有一个低共熔点的简 单二元系统相图 • 特点:两个组分在液相时 能以任意比例互溶,形成
单相溶液;
A3S2的转熔点为1828℃。 • • (2)A3S2为一致熔化合物(试样纯度高变并防
止SiO2挥发),A3S2熔点为1850℃。
• • • • • •
2.相图应用 对铝、硅质耐火材料的研究和生产具有指导意义 1.硅铝质耐火材料分类及相应矿物组成 2.Al2O3含量对硅铝质耐火材料性能的影响 为什么Al2O3含量在15%以下不作为配料点? 根据杠杆规则,在1595℃以下,若石英中加入1 %的Al2O3,就会产生18.2%的液相,使硅砖的耐 火度大大降低。 • 3.由组成估计其液相量 • 4.由液相线的倾斜程度,判断液相量随温度变化 • 的情况
• (二)Al2O3-SiO2系统 • 存在一个化合物: 3Al2O3· 2SiO2( A3S2 ) • 组成:72wt%Al2O3, • • • 28wt%SiO2 60mol%Al2O3 40mol%SiO2 少量Al2O3(约3mol%) 形成固溶体。
• 在A3S2的晶格中可溶于
• 1.相图分析 • • (1)A3S2为不一致熔化合物(试样纯度不高),
• ⑷低共熔点下有化合物生成并分解的二元系统
相图
一致熔融化合物
不一致熔融化合物
低共熔点下有化合物生成
固相中化合物生成并分解
3. 具有多晶转变的二元系统相图
• TP:多晶转变温度 • TE:低共熔温度 • (1)TP>TE • 即多晶转变在液相中 发生
• (2)TP<TE • • 即多晶转变在 固相中发生。
称为变体(晶型);当热力学条件改变时,变体
之间发生转变称为多晶转变。
• 2.可逆多晶转变: • 两种晶型在一定条件下可以互相转变; • 忽略压力对熔点和转变点的
影响,将晶型Ⅰ加热到T3时 转变成晶型Ⅱ;晶型Ⅱ高温 冷却又可在T3时转变为晶型 Ⅰ。若晶型Ⅰ转变为晶型Ⅱ 后继续升温到T2时将熔化成 熔体。可以下式表示:
也称高低温型转变。 • 特点:a. 结构变化小,体积变化小 • • b. 转变速度快,于全部晶体内发生 c. 体积变化对生产影响大:炸裂 和使用过程中需特别注意。
• 【注意】多晶转变时的体积效应在无机材料制备
• 重建型转变:不同系列如石英、鳞石英、方石英 和熔体之间的相互转变,即:各高温型态的相互 转变。 • 特点:a .结构变化大,体积变化大
但不一定只含有一种物质; • (3)一种物质可有几个相; • (4)相与物质数量的多少无关,也与物质是否连续无关。
• (5)气体:不论多少种气体混合都是一个气相; • 液体:可为单相(真溶液:完全互溶), 或多相(视互溶程度); • 固体:形成固溶体为单相;其它情况下, 一种固体物质为一个相。 • ① 形成机械混合物:有几种物质就有几个相; • ② 生成化合物:产生新相; • ③ 形成固溶体:为一个相; • ④ 同质多晶现象:有几种变体,即有几个
• 四、应用相图时需注意的几个问题
• 1. 实际生产过程与相图表示的平衡过程有差别;
• 2. 相图是根据实验结果绘制,多采用将系统升至
高温再平衡冷却的方法,而实际生产则是由低温
到高温的动态过程; • 3. 相图是用纯组分做实验,而实际生产中所用的 原料都含有杂质。
§6.2 单元系统
• • • • • 相律特点: C=1 F=C一P十2=3一P, 当 Pmin=1时 Fmax=2(T、P) Pmax=3时 Fmin=0 单元系统相图为用温度和压力作坐标的平面图,
• 三、相平衡研究方法 •
系统发生相变时,其结构发生变化,必然引起能量
或物化性质的变化,用各种实验方法准确测出相变温度,
如对应于液相线和固相线温度、多晶转变、化合物分解和 形成等的温度,即可作出相图。
• 方法:
• 动态法:加热或步冷曲线法、差热分析法、热重
分析法、热膨胀曲线法、电导(电阻)法。
• 静态法:淬冷法
即:T-P图。
• 一 、 单元系统相图简介 • (一)三相点 P=3 F=0 • 同一物质在不同温度、压力下可以气、液或
固态存在,固态中还可产生晶型转变 。但只能在
唯一温度和唯一压强下三相共存,在T-P图中称
为三相点,该点必是三条平衡曲线的交点。
•
该点周围可以是三个固相,二个固相一个液
相,或气、液、固三相共存。
• β-石英转变为介稳态(快热)
• ⑶ 573℃、870 ℃ 、1470 ℃转变属何种类型? • 573℃ β-石英转变为α-石英,位移型可逆转变 • 870 ℃ 、1470 ℃,重建型、可逆转变 • ⑷图中有不可逆转变吗?
• α-石英与β-鳞石英 、γ-鳞石英、 β-方石英的转变
• SiO2相图在硅质耐火材料的生产中的使用 • 硅砖生产:97~98%天然石英或砂岩 • 2~3%的CaO(作矿化剂) • 粉碎成一定颗粒级配,混合成型,经高温烧成。 • 【要求】含有尽可能多鳞石英,而方石英晶体越少越好ห้องสมุดไป่ตู้ 以获得稳定致密的制品。 • 相图指导: • a. 确定合理烧成温度和烧成制度; • b. 加入少量矿化剂(杂质:如FeO、Mn2O3、 CaO 等),促进α-石英转变为α-鳞石英; • c. 在使用有硅砖砌筑的新窑点火时,制订合理的烘炉 升温制度,以防止砌砖炸裂。
三、专业单元系统相图举例
• (一) SiO2的多晶转变
• SiO2共有23种变体,其中20种晶型,3种无定形。
• 常压和有矿化剂(或杂质)存在时,SiO2有七种 晶型,分为三个系列,每个系列中又有高、低温 型变体,即α、β-石英,α、β、γ-鳞石英,α、 β-方石英。
• 1.晶型转变类型
• 位移型转变:同系列中的α、β、γ形态之间转变,
• 则晶型Ⅰ和晶型Ⅱ之间转变为可逆(双向)转变。 • 相图特点:多晶转变温度低于两种晶型熔点,即: T3<T1、T2 • SiO2各种变体之间转变大多属于这种类型。
• 3. 不可逆多晶转变: • 某一晶型有可能转变另一晶型,而相反的 转变则不能实现。
