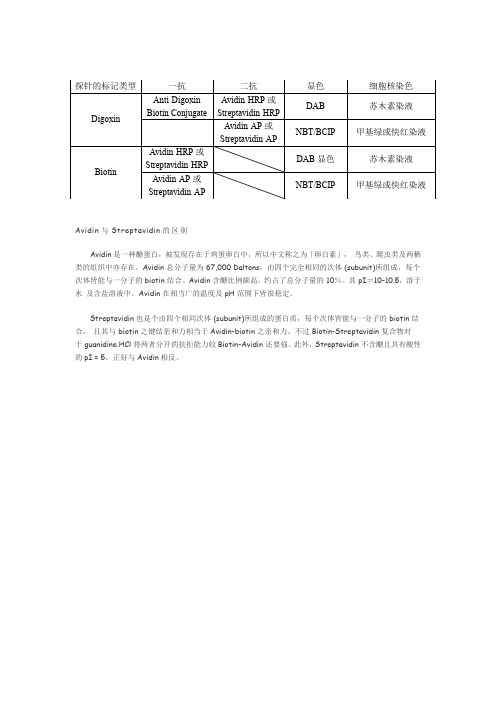
地高辛标记系统
ISH探针地高辛(digoxin) 生物素 (biotin) 一抗 二抗 显色系统
Avidin与Streptavidin的区别
Avidin是一种醣蛋白,被发现存在于鸡蛋卵白中,所以中文称之为「卵白素」,鸟类、爬虫类及两栖类的组织中亦存在。
Avidin 总分子量为 67,000 Daltons,由四个完全相同的次体 (subunit)所组成,每个次体皆能与一分子的 biotin 结合。
Avidin 含醣比例颇高,约占了总分子量的 10%。
其 pI=10-10.5,溶于水及含盐溶液中。
Avidin 在相当广的温度及 pH 范围下皆很稳定。
Streptavidin 也是个由四个相同次体 (subunit)所组成的蛋白质,每个次体皆能与一分子的 biotin 结合,且其与 biotin 之键结亲和力相当于Avidin-biotin 之亲和力。
不过Biotin-Streptavidin 复合物对
于 guanidine.HCl 将两者分开的抗拒能力较Biotin-Avidin 还要强。
此外,Streptavidin 不含醣且具有酸性的pI = 5,正好与Avidin相反。
[生物学]地高辛标记系统
![[生物学]地高辛标记系统](https://img.taocdn.com/s3/m/7cdf6708bceb19e8b8f6ba9d.png)
DIG-dUTP:dTTP的理想比例1:3 20-25bp 可插入一个DIG-dUTP
随机引物法标记的探针是基于模板的不同 区段、不同长度的DNA 片段
可以探测0.03-0.1pgDNA
标记步骤(20µl)
将10ng-1µg 模板DNA用无菌去离子水补足至16µ l。 沸水浴或干浴98 ºC 10分钟,使DNA变性成单链并
Maleic acid buffer: 0.1M Maleic acid, 0.15M NaCl; adjust with NaOH(solid) to pH 7.5(20℃)0 15-25℃ stable. Dilution of Blocking solution.
Detection buffer: 0.1M Tris-HCl, 0.1M NaCl, pH 9.5(20℃). 15-25℃ stable. Ajustment of pH to 9.5.
用作探针模板的DNA应是线型的,大于100bp,如果模板 DNA >5kb则应用4碱基的限制性内切酶切割成较小片段 (切割后要纯化)
模板的量:10ng-3μg,如果要检测复杂基因组中的单拷贝 基因,标记模板的最低量要300ng(探针浓度:25ng/ml 杂交液)
如果做基因组DNA southern blotting, 应将克隆倒载体上 的DNA 酶切后琼脂糖电泳分离或PCR扩增,得到的片段 都需要用试剂盒纯化
操作基本要求
工作环境及试剂要干净:(1)试剂要高 压灭菌;(2)含有SDS 的试剂要过滤灭 菌;(3)TWEEN20应加到预先灭菌过的 试剂中
用具要干净:用之前一定要清洗得非常干 净
操作尼龙膜时要小心(1)戴无尘手套; (2)用干净的镊子夹取膜的边缘
地高辛标记核酸探针的标记方法

地高辛标记核酸探针的标记方法Last revision on 21 December 2020地高辛标记核酸探针的标记方法核酸探针已被广泛用于筛选重组克隆、基因多样性的种性检测和真菌种群内及种群之间的系统发育关系评价。
最早使用的放射性同位素标记核酸探针具有敏感性高、特异性好、分辨力强的特点,但放射性同位素标记也存在着一系列令人困扰的问题,如成本高、探针半衰期短、放射性物质危害人体健康等。
而且在进行放射性同位素标记实验时,需要有专门的实验室及相应的实验保护设施,还需要由经过培训的专业人员来操作,因而限制了在普通实验室进行分子生物学实验。
近几年发展起来的非放射性核酸探针大多通过酶促、光化学和化学手段掺入一种报道基团,这种报道基团可通过高灵敏度的冷光、荧光或金属沉淀等检测系统检测。
另外,应用pH电极或感应器技术的电化学检测系统也有报道。
在这些检测系统中,灵敏度最高的是生物素- 亲合素检测系统和半抗原-抗半抗原地高辛检测系统。
由于生物样品中常含有内源性生物素及生物结合蛋白,生物素标记的核酸探针会发生一些非特异性结合,从而影响实验效果。
与生物素-亲合素系统同样具有高灵敏度,却减少了非特异性结合的地高辛检测系统,已为人们所接受,并得到广泛的应用。
地高辛(Digoxigenin ,DIG) 又称异羟基洋地黄毒甙元,是一种类固醇半抗原分子。
其化学结构如图1 所示。
采用人工方法可以将地高辛的线型间隔臂与dUTP 连接起来,形成DIG-11-dUTP,通过随机引物法或PCR法将其掺入到DNA探针中。
RNA探针的标记是使用噬菌体信息编码的RNA聚合酶,通过体外转录将DIG-11-dUTP掺入到RNA探针中。
寡核苷酸探针的标记则是通过末端转移酶催化,在3'末端加上DIG-11-dUTP/dATP 或DIG-11-ddUTP 尾巴。
对于目的DNA 或RNA 来说,分子杂交后,杂交部分可通过ELISA 实验程序加以检测,即加入一种结合有碱性磷酸酶的地高辛-特异性抗体,它与地高辛半抗原分子形成酶联抗体-半抗原(DIG) 复合物,再加入相应的显色底物,使杂交部分得以显示。
地高辛标记及检测试剂盒说明书

仅仅研究于生命科学,不适合在诊断过程使用只能在体外使用地高辛DNA标记和检测试剂盒1和NBT/BCIP一起用于颜色检测通过酶联免疫法采用地高辛-dUTP进行随机引物DNA标记,碱性标记和检测货号:11 745 832 910此试剂盒储存条件-15o C—-25o C此试剂盒可对10ng-3ugDNA进行12次标记反应可检测100cm2面积的杂交膜24张指导手册2009.11版1前言1.1内容表1前言 (2)1.1内容表 (2)1.2试剂盒内容 (3)2简介 (5)2.1产品概述 (5)3步骤和所需材料 (8)3.1开始之前 (8)3.2地高辛DNA标记 (9)3.3 标记效率的测定 (11)3.4 DNA 的转移和固定 (14)3.5杂交 (16)3.6免疫检测 (18)3.7 DNA印记的洗脱和再杂交 (20)4结果 (21)4.1典型的结果 (21)5附录 (23)5.1故障排除 (23)5.2引用 (24)5.3订购信息 (25)1.2 试剂盒内容附加仪器与所需试剂除了上表中列出的试剂外,你必须准备一些溶液。
在下表中,你可以找到不同操作程序需要准备的设备概要。
*标记的产品可以从Roche Applied Science 获得2 介绍2.1 产品概况实验原则此试剂盒采用地高辛(DIG),一种甾类半抗原,去标记DNA探针从而通过酶免疫分析应用地高辛标记DNA探针可以用于:所有类型的滤膜杂交总基因组DNA中单拷贝基因的检测,甚至对于高度复杂的生物也可以进行检测,如人,大麦和小麦。
样品材料至少100bp的DNA片段线性的质粒,cos质粒或者λDNA超螺旋的DNA实验时间此表格列出了每一步实验所需的反应时间检测数量一个试剂盒足够用于:不超过3ug的模板DNA的12个标准的标记反应和100cm2有24个斑点的检测质量控制根据操作步骤中的描述,对未标记的对照品DNA(PBR328)进行标记,0.1pg同源DNA 在点杂交中通过16h的显色来检测(1pg同源DNA可以通过1小时的显色进行检测)。
地高辛标记dna探针原理

地高辛标记dna探针原理
地高辛标记DNA探针是一种通过标记染色体上的特定DNA序列用于鉴定、检测和定位目标DNA的技术。
其原理主要涉及两方面,一是DNA杂交,二是标记检测。
首先,标记DNA探针通过与目标DNA发生杂交反应,将DNA探针上的特定DNA序列与目标DNA上的互补序列结合,使探针与靶标DNA 形成双链DNA杂交物。
这种杂交反应通常在高温下进行,以便将DNA 双链分离,随后在低温下进行,以便使探针和目标DNA结合。
其次,标记检测通过将探针的DNA序列与荧光染料等标记物进行连接,以获得可见的信号。
在探针杂交反应后,如果探针成功与目标DNA结合,则标记物也会随之结合,反之则不会结合。
通常通过显微镜或荧光成像系统观察标记信号来确定目标DNA的存在。
因此,地高辛标记DNA探针的原理主要基于DNA杂交和标记检测技术,可以用于检测和定位目标DNA,为分子生物学等领域的研究提供了有力的支持。
地高辛标记系统

随机引物标记
利用随机引物标记的方法将 Digoxigenin11-dUTP掺入到新合成的DNA 链中。 反应体系中包含六碱基随机引物、dNTP(含 有碱性条件下不稳定的Digoxigenin-11dUTP,Klenow 酶及反应所需的Buffer
DIG-dUTP:dTTP的理想比例1:3 20-25bp 可插入一个DIG-dUTP 随机引物法标记的探针是基于模板的不同 区段、不同长度的DNA 片段 可以探测0.03-0.1pgDNA
备注:
含有探针的DiG Easy Hyb杂交液可重复 利用,杂交结束后放入离心管中于-20 ºC 保存,可重复使用几次,只需在使用前 于68 ºC处理10分钟即可 不要煮沸DiG Easy Hyb杂交液
定量结果分析
染色至0.1pg的Control DNA出现斑点,比较 标记的探针与Control DNA 染色情况计算出 地高辛标记的DNA 的量。
如果0.1pg的探针及对照稀释点都显色,则探针标记理想 如果0.1pg的对照显色, 0.1pg的标记探针没显色,但0.3pg显 色,则计算探针浓度(约为理想浓度的1/3)以确定杂交时加多 少探针(25ng探针/ml杂交液) 如果0.1pg的对照显色,但标记探针0.3pg的斑点没显色,则 应重新标记探针
地高辛标记与检测的原理
利用不同的方法将Digoxigenin-11-dUTP掺入到新 合成的探针DNA 或RNA链中或寡核苷酸的末端 探针与目标DNA杂交后,用连接有碱性磷酸酶或 其它偶联物的地高辛的抗体检测地高辛标记的探 针 根据地高辛抗体连接的偶合物不同,利用荧光检 测(anti-DIG-fluorescein,rhodamine)、化学发 光检测(anti-DIG-AP and CSPD or CPD-star)或显 色(anti-DIG-AP and NBT/BCIP or other substrates))的方法将探针杂交的位置显现出来
地高辛标记原理及步骤

地高辛标记原理及步骤地高辛(Digoxin)是一种植物来源的药物,常用于治疗心脏病和心律失常。
在临床实验室中,地高辛也可用于标记其他物质,以便进行研究和诊断。
本文将介绍地高辛标记的原理及步骤。
一、地高辛标记的原理地高辛标记是一种共价标记方法,通过将地高辛与待标记物质结合,使其能够被检测出来。
该方法基于地高辛的特殊结构和与其他物质之间的化学反应。
地高辛的结构包含一个呈环状的核苷苷酸结构,其中有一个活性位点。
这个活性位点可以与其他分子中的羟基或氨基等活性基团发生化学反应。
在地高辛标记中,我们利用这个活性位点将地高辛与待标记物质连接起来。
二、地高辛标记的步骤1. 准备地高辛标记试剂首先,我们需要准备地高辛标记的试剂,包括地高辛分子和反应条件。
根据不同的实验需要,地高辛可以选择单独标记或与其他分子共同标记。
2. 标记反应的进行将待标记物质与地高辛标记试剂加入反应体系中,控制好反应时间和温度。
反应条件的选择需要根据实验的具体要求来确定。
3. 纯化标记产物完成标记反应后,需要对反应产物进行纯化,以去除未反应的地高辛和其他杂质。
常见的纯化方法包括色谱层析、电泳等。
4. 检测标记效果对纯化后的标记产物进行检测,确定地高辛与待标记物质的结合情况。
常用的检测方法包括光谱分析、质谱分析、核磁共振等。
5. 应用标记产物纯化并验证了标记产物后,可以将其应用到相应的实验或诊断中。
根据实验的目的和需求,地高辛标记产物可以被用于免疫染色、荧光探针等多个领域。
总结:地高辛标记是一种常用的药物标记方法,其原理是通过地高辛与待标记物质的共价结合。
标记步骤包括准备试剂、标记反应、纯化产物、检测效果和应用标记产物。
掌握地高辛标记原理及步骤对于科研和临床实验室中的药物研究和诊断具有重要意义。
地高辛标记核酸探针的标记方法

地高辛标记核酸探针的标记方法地高辛标记核酸探针的标记方法核酸探针已被广泛用于筛选重组克隆、基因多样性的种性检测和真菌种群内及种群之间的系统发育关系评价。
最早使用的放射性同位素标记核酸探针具有敏感性高、特异性好、分辨力强的特点,但放射性同位素标记也存在着一系列令人困扰的问题,如成本高、探针半衰期短、放射性物质危害人体健康等。
而且在进行放射性同位素标记实验时,需要有专门的实验室及相应的实验保护设施,还需要由经过培训的专业人员来操作,因而限制了在普通实验室进行分子生物学实验。
近几年发展起来的非放射性核酸探针大多通过酶促、光化学和化学手段掺入一种报道基团,这种报道基团可通过高灵敏度的冷光、荧光或金属沉淀等检测系统检测。
另外,应用pH电极或感应器技术的电化学检测系统也有报道。
在这些检测系统中,灵敏度最高的是生物素- 亲合素检测系统和半抗原-抗半抗原地高辛检测系统。
由于生物样品中常含有内源性生物素及生物结合蛋白,生物素标记的核酸探针会发生一些非特异性结合,从而影响实验效果。
与生物素-亲合素系统同样具有高灵敏度,却减少了非特异性结合的地高辛检测系统,已为人们所接受,并得到广泛的应用。
地高辛(Digoxigenin ,DIG) 又称异羟基洋地黄毒甙元,是一种类固醇半抗原分子。
其化学结构如图1 所示。
采用人工方法可以将地高辛的线型间隔臂与dUTP 连接起来,形成DIG-11-dUTP,通过随机引物法或PCR法将其掺入到DNA探针中。
RNA探针的标记是使用噬菌体信息编码的RNA聚合酶,通过体外转录将DIG-11-dUTP掺入到RNA探针中。
寡核苷酸探针的标记则是通过末端转移酶催化,在3,末端加上DIG-11-dUTP/dATP 或DIG-11-ddUTP 尾巴。
对于目的DNA 或RNA 来说,分子杂交后,杂交部分可通过ELISA 实验程序加以检测,即加入一种结合有碱性磷酸酶的地高辛-特异性抗体,它与地高辛半抗原分子形成酶联抗体-半抗原(DIG) 复合物,再加入相应的显色底物,使杂交部分得以显示。
地高辛标记核酸探针的标记方法

地高辛标记核酸探针的标记方法地高辛标记核酸探针的标记方法核酸探针已被广泛用于筛选重组克隆、基因多样性的种性检测和真菌种群内及种群之间的系统发育关系评价。
最早使用的放射性同位素标记核酸探针具有敏感性高、特异性好、分辨力强的特点,但放射性同位素标记也存在着一系列令人困扰的问题,如成本高、探针半衰期短、放射性物质危害人体健康等。
而且在进行放射性同位素标记实验时,需要有专门的实验室及相应的实验保护设施,还需要由经过培训的专业人员来操作,因而限制了在普通实验室进行分子生物学实验。
近几年发展起来的非放射性核酸探针大多通过酶促、光化学和化学手段掺入一种报道基团,这种报道基团可通过高灵敏度的冷光、荧光或金属沉淀等检测系统检测。
另外,应用pH电极或感应器技术的电化学检测系统也有报道。
在这些检测系统中,灵敏度最高的是生物素- 亲合素检测系统和半抗原-抗半抗原地高辛检测系统。
由于生物样品中常含有内源性生物素及生物结合蛋白,生物素标记的核酸探针会发生一些非特异性结合,从而影响实验效果。
与生物素-亲合素系统同样具有高灵敏度,却减少了非特异性结合的地高辛检测系统,已为人们所接受,并得到广泛的应用。
地高辛(Digoxigenin ,DIG) 又称异羟基洋地黄毒甙元,是一种类固醇半抗原分子。
其化学结构如图1 所示。
采用人工方法可以将地高辛的线型间隔臂与dUTP 连接起来,形成DIG-11-dUTP,通过随机引物法或PCR法将其掺入到DNA探针中。
RNA探针的标记是使用噬菌体信息编码的RNA聚合酶,通过体外转录将DIG-11-dUTP掺入到RNA探针中。
寡核苷酸探针的标记则是通过末端转移酶催化,在3,末端加上DIG-11-dUTP/dATP 或DIG-11-ddUTP 尾巴。
对于目的DNA 或RNA 来说,分子杂交后,杂交部分可通过ELISA 实验程序加以检测,即加入一种结合有碱性磷酸酶的地高辛-特异性抗体,它与地高辛半抗原分子形成酶联抗体-半抗原(DIG) 复合物,再加入相应的显色底物,使杂交部分得以显示。
地高辛标记原理及步骤

斑点杂交实验【实验原理】用的高辛标记的HCV RNA探针检测HCV RT-PCR产物。
【实验步骤】1.处理:将尼龙膜浸泡于20×SSC中吸足液体后,夹在两层滤纸中37℃烘烤20—30 min。
(将尼龙膜置入烤箱后立即进行下一步操作)2.变性:将待测DNA样品(HCV经RT-PCR扩增产物;HBV的PCR扩增产物作为阴性对照,每组两种样品各10μL)置于PCR仪中100℃加热10min,立即置冰中,并置于-20℃冰箱中骤冷5min。
(每一排共三组的样品点在同一张尼龙膜上)【原理】使DNA样品变性,即双链DNA→单链DNA。
3.点样:将上述变性后的样品各2μL点在尼龙膜的毛面上,室温下风干后,于烤箱中120℃烘烤30 min。
【原理】使样品中的DNA与膜结合牢固。
4.预杂交:将杂交膜封入杂交袋中(每两组的膜背靠背封在一个杂交袋中),做好剪角标记(勿过大)。
用1000μL加样器,加入预杂交液(Dig Easy Hyb),每组5mL全部加完,使尼龙膜恰恰漂起即可,若5mL预杂交液不足,可适当补加。
除去气泡,置42℃恒温摇床上,轻轻振摇30min-60min。
【原理】封闭杂交膜上多余的非特异性DNA结合位点。
5.杂交液制备:用预杂交液将探针按100ng/mL浓度稀释,即为杂交液。
(已准备好)6.杂交:剪开杂交袋一个小角,倾去预杂交液,加入杂交液2-3mL,除去气泡,封口。
置50℃恒温摇床上,轻轻振荡过夜。
7.洗膜:(1)回收杂交液;(2)室温下,用2×wash solution洗膜两次,每次5min;(3)将0.1×wash solution预热到50℃洗膜两次,每次15min。
【原理】洗去未结合的探针,否则会导致过高的本底。
8. 封闭:取出膜,在含有30mL BufferⅠ的培养皿中浸泡1分钟平衡后,转入30mL BufferⅡ中,室温作用30-60min。
【原理】封闭杂交膜上非特异性的蛋白结合位点。
地高辛标记系统

地高辛标记系统
常用标记物分类
放射性同位素标记
非放射性标记 荧光素标记 生物素标记 地高辛标记
地高辛(DIG)是灵敏度高、非放射性核酸 标记检测体系。DIG检测灵敏度接近同位素 而无放射性危险、相比荧光则不需要特殊 检测设备,相比生物素则没有样本内源干 扰之苦,很适合用于核酸非放标记检测。
地高辛标记的dUTP
地高辛标记系统的特点
标记和检测技术安全 标记的探针稳定可以保存一年 杂交液可以反复使用数次
与放射性同位素标记方法相同之处
标记和杂交技术相似 高灵敏度 低背景 可以标记DNA、RNA 或Oligonucleotides
与放射性同位素标记方法不同之处
无害,安全 产生的废物不需特殊处理 需要分析的时间短 探针稳定
探针标记效率低的原因及解决办法
1. 标记条件不合适
重新标记,但将标记时间延长至过夜 用相同量的模板标记,但体系放大,体系 中的其它成分相应放大 模板放在沸水中变性
2. 模板不纯
只用高纯度模板
用推荐的试剂盒准备模板
纯化模板:用苯酚/氯仿抽提后用酒精沉淀
DNA 的转移和固定
固定:2 × 的SSC短暂洗涤膜后 120º C 30 min 或80º C 2h;或者将膜放在用10× 的 SSC 浸湿的滤纸中UV-Crosslinkering 不马上使用的尼龙膜放在2-8 º C干燥保存
将试剂盒提供的control DNA稀释到1ng/μl (原始浓度是5ng /μl)
Tube From tube# 1 Diluted orginal
DNA (µl) DNA
dilution buffer(μl)
地高辛标记系统

加热10分钟。
地高辛标记系统
本次实验标记步骤(10µl)
将300ng 模板DNA用无菌去离子水补足至8 µ l。 沸水浴或干浴98 ºC 10分钟,使DNA变性成单链
探针的标记
地高辛标记系统
地高辛标记系统
常用标记物分类
放射性同位素标记
非放射性标记 荧光素标记 生物素标记 地高辛标记
地高辛标记系统
地高辛(DIG)是灵敏度高、非放射性核酸 标记检测体系。DIG检测灵敏度接近同位素 而无放射性危险、相比荧光则不需要特殊 检测设备,相比生物素则没有样本内源干 扰之苦,很适合用于核酸非放标记检测。
与放射性同位素标记方法不同之处
无害,安全 产生的废物不需特殊处理 需要分析的时间短 探针稳定
地高辛标记系统
地高辛标记与检测的原理
利用不同的方法将Digoxigenin-11-dUTP掺入到新 合成的探针DNA 或RNA链中或寡核苷酸的末端
探针与目标DNA杂交后,用连接有碱性磷酸酶或 其它偶联物的地高辛的抗体检测地高辛标记的探 针
地高辛标记系统
Dig-High Prime DNA标记及检测试 剂盒理想条件下标记产量
Template DNA 10 ng 30 ng 100 ng 300 ng 1000 ng 3000 ng
1h 45 ng 130 ng 270 ng 450 ng 850 ng 1350 ng
20 h 600 ng 1050 ng 1500 ng 2000 ng 2300 ng 2650 ng
120ºC固定30分钟或紫外交链3-5分钟 将膜放入装有20ml Maleic acid buffer 的塑料器皿中,室
[生物学]地高辛标记系统
![[生物学]地高辛标记系统](https://img.taocdn.com/s3/m/7cdf6708bceb19e8b8f6ba9d.png)
操作基本要求
工作环境及试剂要干净:(1)试剂要高 压灭菌;(2)含有SDS 的试剂要过滤灭 菌;(3)TWEEN20应加到预先灭菌过的 试剂中
用具要干净:用之前一定要清洗得非常干 净
操作尼龙膜时要小心(1)戴无尘手套; (2)用干净的镊子夹取膜的边缘
探针模板DNA的要求
质粒DNA纯度要高。最好用高纯度的质粒DNA 分离和纯 化试剂盒纯化质粒模板或用苯酚/氯仿抽提去除残留的蛋 白质。纯化后的模板用H2O 溶解
Antibody solution(Ab) solution : 将4#试剂离心,按1: 5000或1:10000加入Blocking solution,2-8 ºC可放12小 时。(每10ml Blocking solution 加1ul Ab抗体即可).与 地高辛标记的探针结合。
Color-substrate solution(显色液):从试剂 5#(NBT/BCIP)中取100ul到5ml Detection buffer,要避光, 现配现用。显示抗体结合的位点
120ºC固定30分钟或紫外交链3-5分钟 将膜放入装有20ml Maleic acid buffer 的塑料器皿中,室
温2分钟 将膜放入10ml Blocking solution中室温温育30分钟 将膜放入10ml Antibody solution 中室温温育30分钟 用10ml Washing buffer 洗2次,每次15分钟 在10ml Detection buffer 平衡2-5分钟 将膜放入2ml 新配制的Color substrate solution 中暗室条
为防止尼龙膜干燥,在准备好下一步处理用试剂 之前不要倒掉正在用的溶液
使用合适的探针浓度 探针用之前68ºC 变性 如果探针与靶DNA 的同源性低于80%,热洗时应
地高辛标记原理及步骤

斑点杂交实验【实验原理】用的高辛标记的HCV RNA探针检测HCV RT-PCR产物。
【实验步骤】1.处理:将尼龙膜浸泡于20×SSC中吸足液体后,夹在两层滤纸中37℃烘烤20—30 min。
(将尼龙膜置入烤箱后立即进行下一步操作)2.变性:将待测DNA样品(HCV经RT-PCR扩增产物;HBV的PCR扩增产物作为阴性对照,每组两种样品各10μL)置于PCR仪中100℃加热10min,立即置冰中,并置于-20℃冰箱中骤冷5min。
(每一排共三组的样品点在同一张尼龙膜上)【原理】使DNA样品变性,即双链DNA→单链DNA。
3.点样:将上述变性后的样品各2μL点在尼龙膜的毛面上,室温下风干后,于烤箱中120℃烘烤30 min。
【原理】使样品中的DNA与膜结合牢固。
4.预杂交:将杂交膜封入杂交袋中(每两组的膜背靠背封在一个杂交袋中),做好剪角标记(勿过大)。
用1000μL加样器,加入预杂交液(Dig Easy Hyb),每组5mL全部加完,使尼龙膜恰恰漂起即可,若5mL预杂交液不足,可适当补加。
除去气泡,置42℃恒温摇床上,轻轻振摇30min-60min。
【原理】封闭杂交膜上多余的非特异性DNA结合位点。
5.杂交液制备:用预杂交液将探针按100ng/mL浓度稀释,即为杂交液。
(已准备好)6.杂交:剪开杂交袋一个小角,倾去预杂交液,加入杂交液2-3mL,除去气泡,封口。
置50℃恒温摇床上,轻轻振荡过夜。
7.洗膜:(1)回收杂交液;(2)室温下,用2×wash solution洗膜两次,每次5min;(3)将0.1×wash solution预热到50℃洗膜两次,每次15min。
【原理】洗去未结合的探针,否则会导致过高的本底。
8. 封闭:取出膜,在含有30mL BufferⅠ的培养皿中浸泡1分钟平衡后,转入30mL BufferⅡ中,室温作用30-60min。
【原理】封闭杂交膜上非特异性的蛋白结合位点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
试剂准备(2)
Blocking solution :用Maleic acid buffer 10×稀释试剂6# (10×Blocking solution ),成1×的工作液,即每9ml Maleic acid buffer中加入1ml 10×Blocking solution 混匀, 现配现用。封闭膜上非特异性结合位点 Antibody solution(Ab) solution : 将4#试剂离心,按1: 5000或1:10000加入Blocking solution,2-8 º C可放12小 时。(每10ml Blocking solution 加1ul Ab抗体即可).与 地高辛标记的探针结合。 Color-substrate solution(显色液):从试剂 5#(NBT/BCIP)中取100ul到5ml Detection buffer,要避光, 现配现用。显示抗体结合的位点
随机引物标记
利用随机引物标记的方法将 Digoxigenin11-dUTP掺入到新合成的DNA 链中。 反应体系中包含六碱基随机引物、dNTP(含 有碱性条件下不稳定的Digoxigenin-11dUTP,Klenow 酶及反应所需的Buffer
DNA的地高辛标记和检测步骤
探针DNA 的标记及标记效率测定 DNA的转移和固定 杂交 免疫测定 洗去膜上探针再次杂交
将试剂盒提供的control DNA稀释到1ng/μl (原始浓度是5ng /μl)
Tube From tube# 1 2 3 4 5 6 7 8 9
DNA (µl) DNA Dilution Final dilution concentration buffer(μl) Diluted 1ng/µl orginal 1 2 2 3 4 5 6 2 15 5 5 5 5 5 0 198 35 45 45 45 45 45 50 1:100 1:3.3 1:10 1:10 1:10 1:10 1:10 10 pg/µl 3 pg/µl 1 pg/µl 0.3 pg/µl 0.1 pg/µl 0.03 pg/µl 0.01 pg/µl 0
探针标记效率检测
目的是确定杂交中使用正确的探针量,探 针用量太多会引起背景太深,用量太少则 无杂交或杂交很弱
检测流程
将地高辛标记好的探针系列稀释,点到一 条尼龙膜上,同时用地高辛标记的control DNA作对照标准,120º C固定30分钟; 用地高辛抗体免疫检测,按BNT/BCIP显色 步骤显色; 比较显色结果,选择带有可以接受的背景 的最高探针浓度做正式的杂交。
Dig-High Prime DNA标记及检测试 剂盒理想条件下标记产量
Template DNA 10 ng 30 ng 1h 45 ng 130 ng 20 h 600 ng 1050 ng
100 ng
300 ng 1000 ng 3000 ng
270 ng
450 ng 850 ng 1350 ng
DIG-dUTP:dTTP的理想比例1:3 20-25bp 可插入一个DIG-dUTP 随机引物法标记的探针是基于模板的不同 区段、不同长度的DNA 片段 可以探测0.03-0.1pgDNA
标记步骤(20µl)
将10ng-1µg 模板DNA用无菌去离子水补足至16µ l。 沸水浴或干浴98 º 10分钟,使DNA变性成单链并 C 迅速冰浴冷却。 充分混匀DiG-high Primer (1#管),并取4 µ l至 变性DNA管,混匀并离心。 37 º C温育1小时或过夜(最大到不超过20小时)。 停止反应,加2 µ l 0.2M EDTA(pH 8.0)或65 º C 加热10分钟。
本次实验标记步骤(10µl)
将300ng 模板DNA用无菌去离子水补足至8 µ l。 沸水浴或干浴98 º 10分钟,使DNA变性成单链 C 并迅速冰浴冷却。 充分混匀DiG-high Primer (1#管),并取2 µ l 至变性DNA管,混匀并离心。 37 º C温育1小时或过夜(最大到不超过20小 时)。 停止反应,65 º C加热10分钟。
杂交和杂交后洗膜时注意事项
使用正确的杂交温度(使用DIG EasyHyb,DNA:DNA37—
42º C,RNA:RNA 68º C,RNA:DNA 50º C)
为防止尼龙膜干燥,在准备好下一步处理用试剂 之前不要倒掉正在用的溶液 使用合适的探针浓度 探针用之前68º 变性 C 如果探针与靶DNA 的同源性低于80%,热洗时应 使用较低的温度(如60º C) 热洗之前应将洗膜液预热到热洗所需温度Biblioteka 电泳、转膜、预杂交注意事项
电泳时最好点上约5µl的地高辛标记的marker 电泳时DNA 的量不要过大,否则部分降解的DNA 片段就会与探针杂 交引起背景很深 电泳时不要将EB 加到凝胶或缓冲液中 变性和中和步骤中的处理30min可以分成2×15min 任何时候操作尼龙膜时都要戴着无尘手套用镊子接触膜的边缘 转膜时严防短路,不要让吸水纸全部湿透,重物根据膜的大小从 200g-500g 不等 面积较小的膜可直接放到胶上,如果尼龙膜较大,可以先在水中浸湿 再放入20×SSC平衡, 转膜后2×SSC 短暂漂洗尼龙膜以免杂交时有背景 预杂交及杂交时保证buffer覆盖膜 如果尼龙膜要多次探测,务必保证在任何时候都不要让尼龙膜干燥
地高辛标记的dUTP
地高辛标记系统的特点
标记和检测技术安全 标记的探针稳定可以保存一年 杂交液可以反复使用数次
与放射性同位素标记方法相同之处
标记和杂交技术相似 高灵敏度 低背景 可以标记DNA、RNA 或Oligonucleotides
与放射性同位素标记方法不同之处
无害,安全 产生的废物不需特殊处理 需要分析的时间短 探针稳定
操作基本要求
工作环境及试剂要干净:(1)试剂要高 压灭菌;(2)含有SDS 的试剂要过滤灭 菌;(3)TWEEN20应加到预先灭菌过的 试剂中 用具要干净:用之前一定要清洗得非常干 净 操作尼龙膜时要小心(1)戴无尘手套; (2)用干净的镊子夹取膜的边缘
探针模板DNA的要求
质粒DNA纯度要高。最好用高纯度的质粒DNA 分离和纯 化试剂盒纯化质粒模板或用苯酚/氯仿抽提去除残留的蛋 白质。纯化后的模板用H2O 溶解 用作探针模板的DNA应是线型的,大于100bp,如果模板 DNA >5kb则应用4碱基的限制性内切酶切割成较小片段 (切割后要纯化) 模板的量:10ng-3μg,如果要检测复杂基因组中的单拷贝 基因,标记模板的最低量要300ng(探针浓度:25ng/ml 杂交液) 如果做基因组DNA southern blotting, 应将克隆倒载体上 的DNA 酶切后琼脂糖电泳分离或PCR扩增,得到的片段 都需要用试剂盒纯化
探针的标记
地高辛标记系统
常用标记物分类
放射性同位素标记
非放射性标记 荧光素标记 生物素标记 地高辛标记
地高辛(DIG)是灵敏度高、非放射性核酸 标记检测体系。DIG检测灵敏度接近同位素 而无放射性危险、相比荧光则不需要特殊 检测设备,相比生物素则没有样本内源干 扰之苦,很适合用于核酸非放标记检测。
地高辛标记与检测的原理
利用不同的方法将Digoxigenin-11-dUTP掺入到新 合成的探针DNA 或RNA链中或寡核苷酸的末端 探针与目标DNA杂交后,用连接有碱性磷酸酶或 其它偶联物的地高辛的抗体检测地高辛标记的探 针 根据地高辛抗体连接的偶合物不同,利用荧光检 测(anti-DIG-fluorescein,rhodamine)、化学发 光检测(anti-DIG-AP and CSPD or CPD-star)或显 色(anti-DIG-AP and NBT/BCIP or other substrates))的方法将探针杂交的位置显现出来
定量结果分析
染色至0.1pg的Control DNA出现斑点,比较 标记的探针与Control DNA 染色情况计算出 地高辛标记的DNA 的量。
如果0.1pg的探针及对照稀释点都显色,则探针标记理想
如果0.1pg的对照显色,
0.1pg的标记探针没显色,但0.3pg显 色,则计算探针浓度(约为理想浓度的1/3)以确定杂交时加多 少探针(25ng探针/ml杂交液) 如果0.1pg的对照显色,但标记探针0.3pg的斑点没显色,则 应重新标记探针
杂交液的准备和杂交温度的计算
DiG Easy Hyb:将64ml 无菌去离子水分两 部分倒入试剂7#瓶(DiG Easy Hyb Granules),37 º C摇动溶解5分钟 计算杂交温度:通常为37 º -42 º C C Tm=49.82+0.41(%G+C)- (600/I)(I=length of hybrid in base pairs)。 Topt.=Tm-20 to 25 º C
1500 ng
2000 ng 2300 ng 2650 ng
探针定量
根据上表探针标记的理想产量将标记的探 针稀释到1ng/μl. 例如:起始模板用1µg,20μl体
系1h 后,查前表可知其理想标记量是850ng,则探针的理 想标记浓度为850ng/20 μl =42.5ng/μl; 则取1μl标记产物 +41.5μl H2O 混匀后即得到1ng/μl探针稀释液.
试剂准备(1)
Washing buffer: 0.1M Maleic acid, 0.15M NaCl; pH 7.5(20℃); 0.3%(v/v) Tween20. 15-25℃ stable. Removal of unbound antibody. Maleic acid buffer: 0.1M Maleic acid, 0.15M NaCl; adjust with NaOH(solid) to pH 7.5(20℃)0 15-25℃ stable. Dilution of Blocking solution. Detection buffer: 0.1M Tris-HCl, 0.1M NaCl, pH 9.5(20℃). 15-25℃ stable. Ajustment of pH to 9.5. TE buffer: 10mM Tris-HCl, 1mM EDTA, pH 8.0. 15-25℃ stable. Stopping color reaction.
