地舒单抗注射液生物类似物临床试验(恶性肿瘤适应症)指导原则(征求意见稿)
地舒单抗使用指南解读

地舒单抗使用指南解读地舒单抗是一种常用的药物,广泛用于治疗多种疾病和症状。
它属于抗组胺药物,通过阻断组胺的作用来减轻过敏反应和相关症状。
在本篇文章中,我们将对地舒单抗的使用指南进行解读,帮助读者更好地理解和正确使用该药物。
首先,我们需要了解地舒单抗的适应症。
地舒单抗主要用于治疗过敏性鼻炎、过敏性皮肤病、变应性皮炎等过敏症状。
它可以缓解过敏引起的鼻塞、流涕、皮肤瘙痒等症状,提高患者的生活质量。
使用地舒单抗的剂量和用法要根据疾病的类型和严重程度来确定。
一般情况下,成人每次口服剂量为10-20毫克,每天1-3次。
儿童的服用剂量应根据年龄、体重和病情来确定。
请务必遵循医生的建议和药物说明书上的用药指导。
在使用地舒单抗时,我们需要注意一些禁忌和注意事项。
首先,地舒单抗不能和一些药物同时使用,如中枢神经系统抑制剂、酒精等,因为它们可能会增加药物的副作用。
同时,孕妇和哺乳期妇女应遵循医生的建议在使用地舒单抗前咨询医生的意见。
对于存在肝功能和肾功能不全的患者,地舒单抗的剂量可能需要调整。
副作用是使用地舒单抗时需要了解和注意的一点。
常见的副作用包括头痛、嗜睡、口干、消化不良等。
在使用地舒单抗时,如果出现严重的不良反应,如过敏反应、皮疹、呼吸困难等,应立即停药并咨询医生。
此外,长期使用地舒单抗可能会导致耐药性,因此在医生的指导下正确使用药物,避免滥用。
在使用地舒单抗时,我们还需要了解一些注意事项。
首先,不要超过建议的用药剂量或用药频率,以避免副作用的增加。
其次,避免与其他药物同时使用,以免发生不良反应。
同时,尽量避免饮酒或使用中枢神经系统抑制药物,以免增加地舒单抗的镇静效应。
最后,儿童、孕妇和哺乳期妇女在使用地舒单抗前要咨询医生的意见。
总之,地舒单抗是一种常用的抗过敏药物,用于治疗多种过敏症状。
在使用地舒单抗时,应根据医生的建议和药物说明书的指导正确使用,避免药物的滥用和副作用的发生。
如果出现严重的不良反应,应立即停药并咨询医生。
托珠单抗注射液生物类似药临床试验指导原则(征求意见稿)

1托珠单抗注射液生物类似药临床试验指导原则2(征求意见稿)34一、前言5托珠单抗注射液(Tocilizumab)由罗氏公司研发,采用哺乳动物6细胞(CHO)表达的抗人白介素6受体单克隆抗体制剂,商品名为:7雅美罗®/Actemra®。
通过阻断白介素6与可溶性及膜结合的白介素6 8受体结合,抑制白介素6的信号转导,从而减少病理性炎症反应。
托9珠单抗自2009年2月起陆续在欧盟、美国、日本等多个国家和地区10获准上市,获批的适应症包括:成人类风湿关节炎(RA),多关节型11幼年特发性关节炎(pJIA)、全身型幼年特发性关节炎(sJIA)、巨细12胞动脉炎(GCA)和细胞因子释放综合征(CRS)等。
目前,托珠单13抗在我国获批的适应症包括RA和sJIA[1]。
14托珠单抗注射液原研产品序列专利已到期[2],国内外众多制药企15业纷纷加入其生物类似药的研发过程中。
为了更好地推动生物类似药16的开发,在原国家食品药品监督管理总局已发布的《生物类似药研发17与评价技术指导原则(试行)》[3]基础上,我们结合该品种的特点及18研发企业相关问题的沟通交流情况,讨论形成了托珠单抗生物类似药19临床试验研究设计要点,以期为业界提供参考。
20二、托珠单抗生物类似药临床研究总体要求21原则上,药代动力学比对试验需要进行1项健康受试者单次给药22药代动力学生物等效性研究,验证候选药与原研药PK特征的相似性。
1临床比对研究建议选择原研进口获批RA适应症人群,与原研药进行21项“头对头”比较的临床等效性研究以支持其按生物类似药注册上3市。
4三、临床研究设计考虑要点5生物类似药临床比对研究设计应当以证明候选药与原研药的相6似性为目的,进行科学合理的研究设计。
7(一)健康受试者药代动力学比对研究8试验设计:参照一般生物等效性研究的设计,结合托珠单抗生物9类似药半衰期较长(稳态浓度下,每四周给药一次,4mg/kg时为11 10天,8 mg/kg时为13天),具有免疫原性等特点,建议采用随机、双11盲、平行对照、单次给药的试验设计。
《托珠单抗注射液生物类似药临床试验指导原则(征求意见稿)》起草说明

《托珠单抗注射液生物类似药临床试验指导原则(征求意见稿)》起草说明为鼓励生物类似药研发,进一步规范和指导托珠单抗生物类似物的临床试验设计,提供可参照的公开技术要求,药品审评中心组织起草了托珠单抗注射液生物类似药临床试验指导原则(征求意见稿)。
现将有关情况说明如下:一、背景和目的托珠单抗注射液(Tocilizumab)由罗氏公司研发,采用哺乳动物细胞(CHO)表达的抗人白介素6受体单克隆抗体制剂,通过阻断白介素6与可溶性及膜结合的白介素6受体结合,抑制白介素6的信号转导,从而减少病理性炎症反应。
目前,托珠单抗原研品已在国内获批上市。
目前国内外尚无托珠单抗生物类似物获批上市,国外也无可参考的单品种指导原则。
国内多家制药企业均在开展托珠单抗生物类似药的研发,因此现阶段需明确和统一国内托珠单抗生物类似药临床试验要求。
药品审评中心组织起草了《托珠单抗注射液生物类似药临床试验指导原则(征求意见稿)》。
二、起草过程本指导原则由化药临床一部牵头,统计与临床药理学部参与撰写。
本项工作自2020年2月启动,2020年4月形成初稿,并根据药审中心内部相关专业的反馈意见进行了修订,形成本次征求意见稿。
三、主要内容与说明本指导原则对托珠单抗注射液生物类似药的临床试验设计、终点选择和等效性界值提出建议。
主要有以下部分:在“概述”部分,介绍了原研品的上市情况及本指导原则的适用范围及撰写目的。
在“托珠单抗生物类似药临床研究总体要求”部分,介绍了目前对于该品种生物类似药临床研发的基本考虑。
在“临床研究设计考虑要点”部分,详细介绍了健康受试者药代动力学比对研究、患者临床有效性比对研究的研究设计和终点选择以及免疫学性和患者药代动力学研究需要关注问题等。
地舒单抗注射液生物类似药骨质疏松适应症临床试验设计指导原则

地舒单抗注射液生物类似药(骨质疏松适应症)临床试验设计指导原则(征求意见稿)目录一、概述 (3)二、地舒单抗生物类似药临床研究策略 (4)三、地舒单抗临床研究设计要点 (4)(一)健康受试者药代动力学比对研究 (4)(二)临床有效性比对研究 (5)(三)其他需要重点关注的问题 (7)1. 安全性和免疫原性研究 (7)2. 患者药代动力学研究 (8)四、小结 (8)五、参考文献 (8)一、概述1地舒单抗注射液是全人源化单克隆抗体(IgG2类),以2高特异性和高亲和力结合并中和RANK配体(RANKL)的3活性,阻止RANKL与其同源受体RANK结合,从而抑制破4骨细胞末端分化和活化。
地舒单抗注射液由美国安进公司研5发上市,具有两种不同规格:60 mg(1.0 ml)/支和120 mg 6(1.7 mL)/瓶,商品名分别为:Prolia®和XGEV A®,其中60 7Prolia®用于骨质疏松适应症的治疗。
本文仅讨论地舒单抗注8射液用于“骨折高风险的绝经后妇女的骨质疏松症”的生物9类似物临床试验设计相关问题。
10随着地舒单抗原研产品各项专利陆续到期,国内多家制11药企业开始启动地舒单抗生物类似药的研发。
截至目前全球12尚无地舒单抗生物类似药获批上市。
13本文在原国家食品药品监督管理总局发布的《生物类似14药研发与评价技术指导原则(试行)》[1](以下简称“生物类15似药指导原则”)基础上,结合地舒单抗的特点,重点探讨当16前普遍关注的临床研究策略和临床试验设计问题,以期为国17内地舒单抗生物类似药的临床研发提供参考。
18本指导原则仅代表药品监管部门当前的观点和认识,不19具有强制性的法律约束力。
随着科学研究的进展,本指导原20则中的相关内容将不断完善与更新。
21二、地舒单抗生物类似药临床研究策略22原则上,地舒单抗生物类似药应以在我国上市的原研药23Prolia®为参照药,开展药代动力学比对试验和临床安全有效24性比对试验。
安进(AMGN.US)地舒单抗注射液在中国获批新适应症(安进地舒单抗研发历程)

安进()地舒单抗注射液在中国获批新适应症中英文两版安进()地舒单抗注射液在中国获批新适应症Amgen's Romosozumab Injection Approved for New Indication in ChinaAmgen, a leading biotechnology company based in the United States, has achieved a significant milestone with its drug Romosozumab Injection, marketed as Evenity. Recently, this osteoporosis treatment received approval from Chinese regulatory authorities for a new indication, marking a pivotal moment in Amgen's global expansion strategy.Romosozumab, administered via injection, has been widely recognized for its efficacy in treating osteoporosis by increasing bone formation and reducing bone loss. Its new approval in China extends its usage beyond the initial indications, potentially benefiting a larger population grappling with bone health issues.In response to the approval, Amgen's executives expressed optimism about the drug's impact on public health in China. The company plans to collaborate closely with local healthcare providers to ensure widespread availability and educate both physicians and patients about the treatment's benefits and usage.The approval process in China involved rigorous evaluation of clinical trial data, safety profiles, and efficacy results specific to the Chinese population. This meticulous approach underscores China's commitment to ensuring that only high-quality and effective medications reach patients.With osteoporosis becoming a growing concern globally, including in China where aging demographics are increasing, the approval of Romosozumab for broader indications aligns with national healthcare priorities. It reflects ongoing efforts to enhance treatment options and improve the quality of life for individuals susceptible to bone-related conditions.Looking ahead, Amgen anticipates continued growth in international markets, leveraging its innovative therapies to address unmet medical needs. The company remains dedicated to advancing scientific research and delivering transformative treatments that make a meaningful difference in patients' lives worldwide.As Amgen prepares to introduce Romosozumab Injection for its new indication in China, healthcare professionals and patients alike await the potential benefits this expanded approval may bring. This milestone not only highlights advancements in osteoporosis management but also signifies Amgen's commitment to global healthcare innovation.。
地舒单抗注射液生物类似药(骨质疏松适应症)临床试验设计指导原则(征求意见稿)

地舒单抗注射液生物类似药(骨质疏松适应症)临床试验设计指导原则(征求意见稿)目录一、概述 (3)二、地舒单抗生物类似药临床研究策略 (4)三、地舒单抗临床研究设计要点 (4)(一)健康受试者药代动力学比对研究 (4)(二)临床有效性比对研究 (5)(三)其他需要重点关注的问题 (7)1. 安全性和免疫原性研究 (7)2. 患者药代动力学研究 (8)四、小结 (8)五、参考文献 (9)一、概述1地舒单抗注射液是全人源化单克隆抗体(IgG2类),以2高特异性和高亲和力结合并中和RANK配体(RANKL)的3活性,阻止RANKL与其同源受体RANK结合,从而抑制破4骨细胞末端分化和活化。
地舒单抗注射液由美国安进公司研5发上市,具有两种不同规格:60 mg(1.0 ml)/支和120 mg 6(1.7 mL)/瓶,商品名分别为:Prolia®和XGEV A®,其中60 7Prolia®用于骨质疏松适应症的治疗。
本文仅讨论地舒单抗注8射液用于“骨折高风险的绝经后妇女的骨质疏松症”的生物9类似物临床试验设计相关问题。
10随着地舒单抗原研产品各项专利陆续到期,国内多家制11药企业开始启动地舒单抗生物类似药的研发。
截至目前全球12尚无地舒单抗生物类似药获批上市。
13本文在原国家食品药品监督管理总局发布的《生物类似14药研发与评价技术指导原则(试行)》[1](以下简称“生物类15似药指导原则”)基础上,结合地舒单抗的特点,重点探讨当16前普遍关注的临床研究策略和临床试验设计问题,以期为国17内地舒单抗生物类似药的临床研发提供参考。
18本指导原则仅代表药品监管部门当前的观点和认识,不19具有强制性的法律约束力。
随着科学研究的进展,本指导原20则中的相关内容将不断完善与更新。
21二、地舒单抗生物类似药临床研究策略22原则上,地舒单抗生物类似药应以在我国上市的原研药23Prolia®为参照药,开展药代动力学比对试验和临床安全有效24性比对试验。
地舒单抗注射液生物类似物临床试验(恶性肿瘤适应症)指导原则(征求意见稿)

附件112地舒单抗注射液生物类似药(恶性肿瘤适应症)临床3试验指导原则(征求意见稿)45一、概述6地舒单抗(Denosumab)是在中国仓鼠卵巢细胞中表达的全人单克隆免疫球78蛋白G2 (IgG2) 抗体,作用于核因子κB受体激活因子(RANK)配体。
该品种由美国安进公司研发上市,根据适应症不同,有两个规格的产品,商品名分别为:9XGEV A®(70mg/ml,120mg:1.7ml)和PROLIA®(60mg/ml,60mg:1ml)。
在全1011球范围内,地舒单抗以商品名XGEVA®(以及在日本以商品名RANMARK®)12获批用于多发性骨髓瘤和实体肿瘤骨转移患者中骨相关事件(skeletal-related 13event,SRE)的预防,以及骨巨细胞瘤(giant cell tumor of bone,GCTB) 成人和14骨骼成熟的青少年患者的治疗。
在一些国家,XGEV A®还被批准用于双膦酸盐难治的恶性肿瘤高钙血症的治疗[1]。
地舒单抗以商品名称PROLIA®获批用于绝经1516后骨质疏松症。
2019年5月地舒单抗在中国大陆获批上市[2],商品名为安加维®,批准的适1718应症为:用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞19瘤,包括成人和骨骼发育成熟(定义为至少1处成熟长骨且体重≥45 kg)的青20少年患者。
21地舒单抗序列的中国专利将于2022年到期,国内制药企业纷纷加入其生物22类似药的研发。
本文在原国家食品药品监督管理总局已发布的《生物类似药研发23与评价技术指导原则(试行)》[3](以下简称“指导原则”)基础上,结合地舒单24抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为25国内地舒单抗生物类似药的临床研发提供参考。
本文仅讨论应用于肿瘤患者的XGEV A®生物类似药的研发考虑。
曲妥珠单抗注射液生物类似药临床试验指导原则

曲妥珠单抗注射液生物类似药临床试验指导原则(征求意见稿)一、概述曲妥珠单抗(Trastuzumab)是由瑞士罗氏公司研发的一种重组DNA衍生的人源化单克隆抗体,含人IgG1亚型框架,互补决定区源自鼠抗p185 HER2 抗体,能够特异性地作用于人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)的细胞外部位第IV亚区,竞争性阻断人体表皮生长因子与HER2的结合,从而抑制肿瘤细胞的生长。
罗氏公司的注射用曲妥珠单抗(Herceptin®,赫赛汀®)最早于1998年9月25日获得美国FDA批准上市,2002年进口中国,目前获批的适应症为:单药用于治疗HER2阳性转移性乳腺癌;联合紫杉醇或者多西他赛用于HER2阳性转移性乳腺癌;HER2阳性的早期乳腺癌;HER2阳性的转移性胃癌[1]。
曲妥珠单抗在欧盟和美国的专利已到期,其生物类似药的研发成为热点,目前FDA和欧盟已批准多个曲妥珠单抗生物类似药上市。
本指导原则在NMPA已发布的《生物类似药研发与评价技术指导原则(试行)》[2]基础上,结合该品种的特点,对曲妥珠单抗生物类似药的临床研究策略和方案设计要点进行探讨,以期为研发相关人员提供参考。
二、曲妥珠单抗生物类似药临床研究策略生物类似药研发总体思路是以比对试验证明其与参照药的相似性为基础,支持其安全、有效和质量可控。
采用逐步递进的顺序,分阶段开展药学、非临床、临床比对试验。
根据前期比对试验结果设计后续比对试验研究。
根据前期药学和药理毒理比对试验结果,曲妥珠单抗生物类似药的临床研发,药学和药理毒理试验证明候选药与赫赛汀相似,申请人继续按照生物类似药的路径开展药代动力学比对试验和临床安全有效性比对试验。
鉴于赫赛汀在国内获批多个适应症,临床安全有效性比对试验可能会出现以下几种选择:a. 选择国内批准适应症:“未接受过化疗的HER2阳性转移性乳腺癌(metastatic breast cancer,MBC)”为研究人群,开展与赫赛汀“头对头”比较的等效性研究,主要终点选择敏感的疗效指标客观缓解率(objective response rate,ORR)作为替代终点。
地舒单抗治疗特定疾病的指导原则及疗效评估

地舒单抗治疗特定疾病的指导原则及疗效评估地舒单抗(Denosumab)是一种广泛应用于临床的单克隆抗体药物,被用于治疗特定疾病,包括骨质疏松症、骨转移瘤和巨细胞瘤等。
本文将介绍地舒单抗治疗特定疾病的指导原则以及疗效评估方法。
地舒单抗的治疗指导原则包括以下几个方面:1. 适应症选择:地舒单抗主要适用于已经确诊的骨质疏松症患者、骨转移瘤以及巨细胞瘤患者。
在开展治疗前,医生应对患者进行全面的评估,确认是否符合地舒单抗的治疗适应症。
2. 剂量和给药方案:地舒单抗的剂量和给药方案取决于患者的具体情况和疾病类型。
对于骨质疏松症患者,一般建议每6个月注射一次地舒单抗,剂量为60 mg。
对于骨转移瘤和巨细胞瘤患者,地舒单抗的剂量和给药方案会有所调整,需根据医生的建议进行操作。
3. 给药途径和注射技巧:地舒单抗通过皮下注射给药。
在进行注射前,医生应对注射部位进行消毒和局部麻醉,注射时应使用针头长短适中、直径适当,并且尽量避免损伤神经和血管。
4. 治疗疗程和监测:地舒单抗治疗一般需根据医生的指导进行长期治疗。
同时,定期进行疗效评估和监测是非常重要的,可以通过检测骨密度、骨代谢标志物等指标来评估治疗的效果与患者的病情进展。
在进行地舒单抗治疗后,疗效评估是必不可少的一项工作。
以下是一些常用的疗效评估方法:1. 骨密度检测:骨密度是评估骨质疏松症治疗效果的重要指标。
可以通过双能X射线吸收法(DXA)检测患者骨密度的变化,来评估地舒单抗的疗效。
2. 骨代谢标志物检测:血液或尿液中的骨代谢标志物可以反映骨组织的生理状态。
常用的标志物包括血清骨碱性磷酸酶(BALP)、钙离子(Ca2+)和碱性磷酸酶等。
通过检测这些指标的变化,可以评估地舒单抗治疗的效果。
3. 影像学检查:对于骨转移瘤和巨细胞瘤等疾病,影像学检查如X射线、CT 和MRI等是评估治疗效果的重要方法。
通过观察病变的缩小或消失,来评估地舒单抗的疗效。
4. 临床症状评估:患者的症状改善也是评估地舒单抗治疗效果的重要指标。
地舒单抗的适应症及用药原则

地舒单抗的适应症及用药原则
地舒单抗是一种非处方药,主要成分为头孢氨苄颗粒。
下面我将为您介绍地舒单抗的适应症及用药原则。
地舒单抗是一种广谱抗生素,适用于治疗感染性疾病,特别是呼吸道感染、泌尿系统感染、皮肤软组织感染等。
适应症:
1. 呼吸道感染:地舒单抗适用于上呼吸道感染(如咽炎、扁桃体炎)和下呼吸道感染(如支气管炎、肺炎)。
2. 泌尿系统感染:地舒单抗可治疗尿路感染,如膀胱炎、尿道炎等。
3. 皮肤软组织感染:地舒单抗可用于治疗轻至中度的皮肤感染,如脓肿、疖痈等。
4. 其他感染性疾病:地舒单抗还可以用于治疗消化道感染、儿科感染等。
用药原则:
1. 使用前请仔细阅读药品说明书,并严格按照医嘱或说明书的用药剂量和用药频率进行服用。
2. 儿童用药需遵医嘱,并注意调整剂量。
3. 一般地舒单抗可在饭后或空腹服用,但如果胃不适,可选在饭后服用。
4. 禁止使用过期药物,过敏体质者慎用。
5. 严禁超量使用地舒单抗,以免出现药物不良反应。
6. 在服用地舒单抗期间,请避免同时使用其他抗生素,以避免相互作用。
7. 注意观察用药期间的副作用和不良反应,如出现严重不良反应,应立即停药
并就医。
总体而言,地舒单抗是一种安全有效的抗生素,适用于多种感染性疾病的治疗。
但使用地舒单抗时,仍需遵循医嘱和药品说明书的指导,注意用药剂量和频率,并留意可能出现的副作用和不良反应。
如果有任何疑问或不适,请及时咨询医生或药师。
希望以上内容能够解决您的问题,祝您健康!。
从临床角度解读地舒单抗指南

从临床角度解读地舒单抗指南地舒单抗(DDA)指南是一份临床指南,旨在提供临床医生在使用地舒单抗治疗相关疾病时的参考依据。
本文从临床角度对地舒单抗指南进行解读,包括其适应症、用药方法、疗效评估以及不良反应等方面。
首先,地舒单抗作为一种免疫抑制剂,主要用于治疗自身免疫性疾病,如类风湿性关节炎、强直性脊柱炎以及银屑病关节炎等。
根据地舒单抗指南的推荐,患者需要符合特定的诊断标准方可使用该药物。
临床医生应仔细评估患者的病情和临床指征,确保地舒单抗的使用是合适且符合指南的要求。
地舒单抗的用药方法是通过皮下注射的方式给药。
根据指南,初始剂量为25毫克,每两周一次,连续12周;然后根据患者的疾病活动情况和耐受性,可以调整剂量和给药间隔。
医生需要对患者进行密切的随访,监测疗效和不良反应。
在评估疗效方面,地舒单抗指南提供了一系列的评估指标。
疾病活动指数(Disease Activity Index),如DAS28、BASDAI等,是评估疾病活动程度的常用指标。
根据指南,临床医生应以这些指标为基础,综合评估患者的疾病活动程度、关节疼痛、功能障碍等。
同时,疾病相关指标,如血沉、CRP等,也可以用来衡量治疗的效果。
医生需要根据患者的具体情况,进行系统、综合的评估,以确保地舒单抗的治疗效果。
除了疗效评估,地舒单抗的不良反应也需要临床医生密切关注。
根据指南,地舒单抗的常见不良反应包括注射部位反应(如疼痛、红肿等)、感染、过敏反应等。
临床医生应告知患者并监测其注射部位的情况,同时密切关注患者是否出现感染症状如发热、咳嗽等。
在治疗过程中,医生需要根据患者的具体情况,评估风险和益处,并做好不良反应的处理和防范工作。
总之,地舒单抗指南是临床医生在使用地舒单抗时的重要参考依据。
通过从临床角度对其进行解读,我们了解到了地舒单抗的适应症、用药方法、疗效评估以及不良反应等重要方面。
临床医生需要根据指南的要求,评估患者的病情和临床指征,做出合理决策,并进行随访和监测,以确保地舒单抗的治疗效果和安全性。
地舒单抗指南在临床应用中的价值和作用

地舒单抗指南在临床应用中的价值和作用地舒单抗(Denosumab)是一种抗骨吸收剂,广泛应用于骨质疏松症和骨转移瘤的治疗中。
地舒单抗指南是临床医生在应用地舒单抗时的参考文件,对于指导和规范地舒单抗的使用具有重要的价值和作用。
首先,地舒单抗指南规范了地舒单抗的适应症和使用原则。
根据指南,地舒单抗适用于骨质疏松症高危人群的预防和治疗,以及骨转移瘤的骨损害的治疗。
在地舒单抗的应用中,按照指南的指引,医生可以明确地选择合适的患者,避免不必要的用药,使得地舒单抗的应用更加准确和有效。
其次,地舒单抗指南提供了地舒单抗的用药剂量和给药频次的建议。
根据指南,骨质疏松症的预防和治疗通常使用每年两次皮下注射的剂量,而骨转移瘤的骨损害治疗则通常使用每月一次或每三个月一次的剂量。
这些建议能够帮助医生在给予患者地舒单抗时确定合理的剂量和给药频次,提高治疗效果,防止过量给药或给药不足导致的效果不佳。
此外,地舒单抗指南还强调了地舒单抗的监测和不良反应处理。
根据指南,地舒单抗的应用需要定期监测患者的骨密度和血钙水平,以及评估治疗效果和不良反应的发生。
如果患者出现不良反应,指南也提供了相应的处理方法和注意事项,如骨坏死、低钙血症等。
这些监测和处理的建议有助于及时发现和处理不良反应,保障患者的安全和治疗效果。
此外,地舒单抗指南还强调了地舒单抗与其他药物的联用应用。
地舒单抗可与其他药物如激素、化疗药物等联合使用,以提高治疗效果。
指南提供了地舒单抗与其他药物联合应用的指导原则和注意事项,帮助医生合理选择和搭配药物,提高联用治疗的效果和安全性。
最后,地舒单抗指南还涉及了特殊人群的用药建议。
指南指出了孕妇、哺乳期妇女、老年人等特殊人群的地舒单抗使用原则和注意事项,帮助医生在特殊情况下做出适当的决策。
综上所述,地舒单抗指南在临床应用中具有重要的价值和作用。
它规范了地舒单抗的适应症和使用原则,指导了地舒单抗的剂量和给药频次,强调了对不良反应的监测和处理,提供了与其他药物联用的指导,以及特殊人群的用药建议。
地舒单抗在不同癌症类型中的应用效果

地舒单抗在不同癌症类型中的应用效果地舒单抗是一种针对肿瘤细胞特异性抗原(TAA)的抗体,通过抑制肿瘤细胞的生长和扩散,以及激活免疫系统来对抗癌症。
它已经在多种癌症类型中展示了显著的应用效果。
对于乳腺癌患者,地舒单抗已经成为标准的治疗方法之一。
乳腺癌细胞经常过度表达一种受体蛋白HER2,这导致肿瘤细胞的过度生长和扩散。
地舒单抗可以结合HER2受体,抑制乳腺癌细胞的生长和扩散,同时也促使免疫系统攻击肿瘤细胞。
临床试验显示,与传统化疗相比,在接受地舒单抗治疗的乳腺癌患者中,生存率显著提高。
在结直肠癌患者中,地舒单抗也取得了较好的效果。
结直肠癌细胞常常表达一种受体蛋白EGFR,此受体的过度表达与肿瘤细胞的生长和迁移相关。
地舒单抗可以靶向结合EGFR受体,使癌细胞无法继续生长和迁移。
多项研究发现,在地舒单抗治疗下,结直肠癌患者的生存期得到延长,并且有助于减少晚期转移。
对于非小细胞肺癌(NSCLC)患者,地舒单抗也显示出良好的疗效。
在NSCLC细胞中,常见的肿瘤抗原是PD-L1。
PD-L1可以通过与免疫细胞上的PD-1受体结合,从而避免被免疫系统攻击。
地舒单抗可以阻断PD-L1和PD-1之间的结合,使免疫细胞能够攻击肿瘤细胞。
临床试验表明,地舒单抗可大幅度提升NSCLC患者的生存率,并显著减少肿瘤的复发风险。
除了上述几种癌症类型,地舒单抗还显示出在其他癌症类型中的应用潜力。
例如,它在胃癌、卵巢癌和黑色素瘤等恶性肿瘤中也取得了一定的疗效。
随着进一步的研究和临床试验的展开,我们可以预见地舒单抗可能在更多类型的癌症治疗中发挥重要作用。
需要注意的是,地舒单抗并不适用于所有癌症类型。
在选择治疗方案时,医生会根据患者的具体情况以及癌症的分型和分级来决定是否适合使用地舒单抗。
此外,地舒单抗也可能引起一些副作用,如免疫相关的不良反应。
因此,在使用地舒单抗治疗时,患者应密切关注身体的变化,并及时报告给医生。
总之,地舒单抗在多种癌症类型中都表现出良好的应用效果。
《注射用奥马珠单抗生物类似药临床试验指导原则(征求意见稿)》起草说明

《注射用奥马珠单抗生物类似药临床试验指导原则(征求意见稿)》起草说明为鼓励生物类似药研发,进一步规范和指导奥马珠单抗生物类似药的临床试验设计,提供可参照的技术规范,药品审评中心组织起草了《注射用奥马珠单抗生物类似药临床试验指导原则》。
现将有关情况说明如下:一、背景和目的注射用奥马珠单抗(Omalizumab)是一种重组的人源化抗IgE(免疫球蛋白E)单克隆抗体,是全球首个批准治疗IgE介导的中至重度过敏性哮喘的靶向生物制剂。
原研药于2002年首先在澳大利亚上市,已在超过90个国家或地区获得批准,包括美国、欧盟、日本等。
我国于2017年批准进口注射用奥马珠单抗原研药(商品名:茁乐/Xolair,剂型:冻干粉针剂),用于IgE介导的中至重度过敏性哮喘。
目前已有多家企业申请按生物类似药路径进行研发,为了更好地规范奥马珠单抗生物类似药的临床试验设计,药品审评中心组织起草了《注射用奥马珠单抗生物类似药临床试验指导原则》。
二、起草过程本指导原则由化药临床一部牵头,统计与临床药理学部参与撰写。
本项工作自2020年1月启动,2020年5月形成初稿,经中心内部各专业讨论,2020年7月形成修订稿。
经部门讨论、技术委员会审核,并征求部分业内专家和研发企业意见后,形成征求意见稿。
三、主要内容与说明本指导原则对于注射用奥马珠单抗生物类似药的临床试验设计、受试人群选择、终点指标和等效性界值提出建议。
主要有以下部分:在“概述”部分,介绍了参照药品的上市情况及本指导原则的适用范围及撰写目的。
在“注射用奥马珠单抗生物类似药的临床研究路径”部分,介绍了开发生物类似药的共性考虑。
在“注射用奥马珠单抗生物类似药的临床试验设计要点”部分,详细介绍了药代动力学比对研究和临床有效性比对研究的、受试者选择、终点选择、评价标准和免疫原性考察等建议。
地舒单抗注射液生物类似药(骨质疏松适应症)临床试验设计指导原则(征求意见稿)

地舒单抗注射液生物类似药(骨质疏松适应症)临床试验设计指导原则(征求意见稿)目录一、概述 (3)二、地舒单抗生物类似药临床研究策略 (4)三、地舒单抗临床研究设计要点 (4)(一)健康受试者药代动力学比对研究 (4)(二)临床有效性比对研究 (5)(三)其他需要重点关注的问题 (7)1. 安全性和免疫原性研究 (7)2. 患者药代动力学研究 (8)四、小结 (8)五、参考文献 (9)、概述 地舒单抗注射液是全人源化单克隆抗体( IgG2 类),以 高特异性和高亲和力结合并中和 RANK 配体( RANKL )的 活性,阻止 RANKL 与其同源受体 RANK 结合, 从而抑制破 骨细胞末端分化和活化。
地舒单抗注射液由美国安进公司研 发上市,具有两种不同规格: 60 mg (1.0 ml ) /支和 120 mg (1.7 mL )/瓶,商品名分别为: Prolia ?和 XGEVA ?,其中 60 Prolia ?用于骨质疏松适应症的治疗。
本文仅讨论地舒单抗注 射液用于“骨折高风险的绝经后妇女的骨质疏松症”的生物 类似物临床试验设计相关问题。
随着地舒单抗原研产品各项专利陆续到期,国内多家制 药企业开始启动地舒单抗生物类似药的研发。
截至目前全球 尚无地舒单抗生物类似药获批上市。
本文在原国家食品药品监督管理总局发布的《生物类似 药研发与评价技术指导原则(试行) 》[1](以下简称“生物类 似药指导原则” )基础上, 结合地舒单抗的特点, 重点探讨当 前普遍关注的临床研究策略和临床试验设计问题,以期为国 内地舒单抗生物类似药的临床研发提供参考。
本指导原则仅代表药品监管部门当前的观点和认识,不 具有强制性的法律约束力。
随着科学研究的进展,本指导原 则中的相关内容将不断完善与更新。
12345678910 1112131415161718192021二、地舒单抗生物类似药临床研究策略 原则上,地舒单抗生物类似药应以在我国上市的原研药 Prolia ? 为参照药,开展药代动力学比对试验和临床安全有效 性比对试验。
恶性肿瘤骨转移治疗的新选择--地舒单抗(Denosumab)
恶性肿瘤骨转移治疗的新选择--地舒单抗(Denosumab)骨是大部分实体肿瘤的常见转移部位,晚期癌症患者中40%-80%都会出现骨转移,而骨转移者有70%- 80%伴有剧烈的骨痛,尤其是晚期肺癌、乳腺癌、前列腺癌等患者骨转移比较常见。
恶性肿瘤骨转移可导致严重骨相关事件 (skeletal related event,SRE)发生,SRE在病变局部表现为骨痛、病理性骨折、脊椎压缩性骨折,膀胱、直肠及生殖系统的功能障碍等,全身性改变包括高钙血症及肾衰竭等。
地舒单抗作为中国首个且唯一获批的RANKL抑制剂,2010年地舒单抗率先在欧盟获批,被称作精准的骨靶向药物。
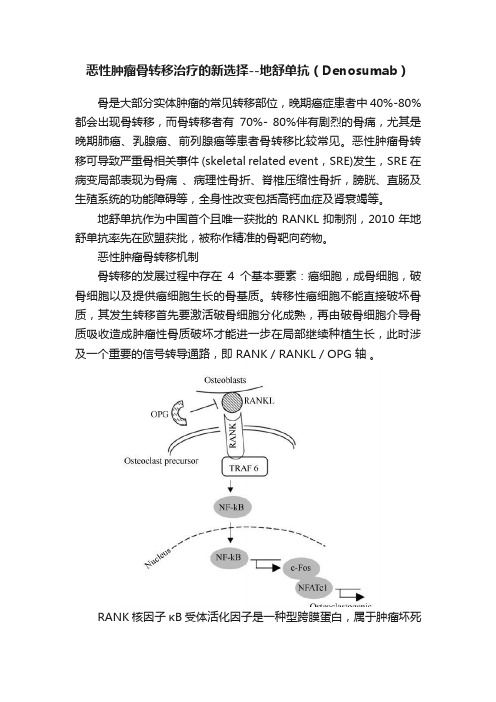
恶性肿瘤骨转移机制骨转移的发展过程中存在4个基本要素:癌细胞,成骨细胞,破骨细胞以及提供癌细胞生长的骨基质。
转移性癌细胞不能直接破坏骨质,其发生转移首先要激活破骨细胞分化成熟,再由破骨细胞介导骨质吸收造成肿瘤性骨质破坏才能进一步在局部继续种植生长,此时涉及一个重要的信号转导通路,即 RANK/RANKL/OPG 轴。
RANK核因子κB受体活化因子是一种型跨膜蛋白,属于肿瘤坏死因子(tumor necrosis factor,TNF)受体家族,表达于许多细胞表面,如破骨细胞前体、成熟的破骨细胞、树突状细胞、乳腺上皮细胞、乳腺癌细胞、前列腺癌细胞等。
RANKL是RANK的相关配体,可由成骨细胞及其前体、T 细胞、B细胞和巨核细胞产生。
RANK与RANKL的结合在破骨细胞存活,分化和活化中起着至关重要的作用。
在恶性肿瘤骨转移时,骨组织破坏的主要机制是肿瘤细胞上调破骨细胞的活性,促进骨吸收,导致骨组织发生溶骨性的破坏,而被破坏的骨基质释放出多种细胞因子,这些细胞因子反过来又促进肿瘤细胞在骨基质中生长,进而促进肿瘤细胞在骨组织中侵袭性生长,释放出更多的细胞因子,形成恶性循环。
在恶性肿瘤骨转移的过程中,破骨细胞的激活是关键步骤,而其中RANK/RANKL/OPG 轴发挥了重要的作用。
2020年《地舒单抗在骨质疏松症中临床合理用药中国专家建议》解读(全文)

2020年《地舒单抗在骨质疏松症中临床合理用药中国专家建议》解读(全文)骨质疏松症是一种以骨量减少,骨组织微结构破坏,导致骨脆性增加,易发生骨折为特征的全身性疾病。
骨质疏松症多见于绝经后女性和老年男性,但可发生于任何年龄。
我国50 岁以上女性人口已达 2.3 亿,而该年龄段女性骨质疏松症患病率则高达32.1%。
骨质疏松症已成为我国面临的重要健康问题。
作为全球首个且唯一上市的RANKL 抑制剂,地舒单抗于2020 年6 月在国内的获批上市,为绝经后妇女的骨质疏松症治疗提供了一种新的「武器」,然而我国临床工作者对地舒单抗的应用经验尚不多。
为此,中华医学会骨质疏松和骨矿盐疾病分会前任主任委员夏维波教授和现任主任委员章振林教授组织国内20 余位骨松领域的专家对地舒单抗在抗骨质疏松症治疗中的作用机制、循证医学证据、应用注意事项等进行总结。
经过多次讨论修改,最终完成《地舒单抗在骨质疏松症中临床合理用药中国专家建议》(以下简称专家建议),为其在临床合理规范使用提供参考。
该专家建议已正式发表在《中华骨质疏松和骨矿盐疾病杂志》上。
今天,特别邀请到中国医师协会骨科医师分会副会长、山西白求恩医院骨科主任医师刘强教授就该专家建议,给大家仔细讲讲地舒单抗在临床中该如何合理应用。
地舒单抗的作用机制及临床疗效1. 地舒单抗的作用机制RANKL/RANK/OPG 信号通路对于调节骨重建有重要作用,也是抗骨质疏松药物研发的重要靶点。
地舒单抗是一种全人源单克隆抗体,是目前可用于人体治疗的活性最强的RANKL 抑制剂。
其以高亲和力与RANKL 结合,抑制RANKL 与RANK 的相互作用,抑制破骨细胞的生成与功能,从而减少骨吸收、增加骨量、改善骨强度(图1)。
图1 地舒单抗的作用机制2. 地舒单抗的临床疗效地舒单抗已在全球82 个国家和地区获批上市,国外应用已超过10 年,积累了丰富的临床证据。
目前全球已完成10 多项关于地舒单抗治疗绝经后骨质疏松症的关键临床研究(见表1),其中规模最大的是FREEDOM 3 年研究及其10 年延长研究,为地舒单抗的临床疗效和安全性提供了重要证据。
地舒单抗注射液治疗骨质疏松症的临床效果

地舒单抗注射液治疗骨质疏松症的临床效果钟丽颖;李顺东;王聪【期刊名称】《临床合理用药杂志》【年(卷),期】2024(17)14【摘要】目的观察地舒单抗注射液治疗骨质疏松症的临床效果。
方法选取2022年1—8月长沙市第三医院收治的骨质疏松症患者80例,采用随机数字表法分为观察组和对照组,每组40例。
2组患者均予常规对症治疗,观察组在此基础上联合地舒单抗注射液治疗。
治疗12个月后比较2组治疗效果,治疗前后疼痛[视觉模拟评分法(VAS)]评分、Oswestry功能障碍指数(ODI)、骨密度[股骨颈、第2~4腰椎(L_(2~4))]、骨相关血清标志物[血清钙、磷、碱性磷酸酶(ALP)、抗酒石酸酸性磷酸酶-5b(TRACP-5b)、胰岛素样生长因子-1(IGF-1)、Ⅰ型前胶原氨基末端前肽(PⅠNP)、β-胶原特殊序列(β-Crosslaps)]、生活质量评分(OQOLS)的变化及不良反应。
结果观察组患者治疗总有效率为97.50%,高于对照组的82.50%(χ^(2)=5.000,P=0.025);治疗12个月后,2组VAS评分、ODI、TRACP-5b、PⅠNP、β-Crosslaps水平均较治疗前降低,股骨颈、L2、L3、L4骨密度,血清钙、磷、ALP、IGF-1水平及OQOLS评分均较治疗前升高,且观察组降低或升高的程度大于对照组(P<0.05或P<0.01);观察组与对照组不良反应总发生率(12.50%vs. 17.50%)比较差异无统计学意义(χ^(2)=0.392,P=0.531)。
结论地舒单抗注射液治疗骨质疏松症的临床效果肯定,可改善患者骨密度与骨相关血清标志物水平,减轻疼痛症状,缓解功能障碍程度,改善患者的生活质量,同时治疗安全性较高。
【总页数】4页(P110-113)【作者】钟丽颖;李顺东;王聪【作者单位】长沙市第三医院老年病科【正文语种】中文【中图分类】R58【相关文献】1.地舒单抗注射液治疗骨质疏松症的单中心回顾性分析2.地舒单抗治疗绝经后骨质疏松症患者的临床疗效研究3.地舒单抗注射液对比唑来膦酸注射液治疗绝经后骨质疏松症的系统评价及成本-效果分析4.地舒单抗联合唑来膦酸钠治疗老年骨质疏松症患者的效果及对骨密度、骨代谢指标及炎症因子的影响5.地舒单抗治疗绝经后女性骨质疏松症的成本-效果分析因版权原因,仅展示原文概要,查看原文内容请购买。
地舒单抗指南解读

地舒单抗指南解读什么是地舒单抗?地舒单抗是一种抗癌药物,主要用于治疗多种肿瘤,包括非小细胞肺癌、胃癌、乳腺癌等。
它属于一类新型的免疫治疗药物,通过激活患者自身的免疫系统,抑制肿瘤生长和扩散。
地舒单抗的作用机制地舒单抗的作用机制是通过抑制PD-1(程序性死亡1)受体,增强患者的免疫细胞对癌细胞的识别和攻击能力。
PD-1受体是一种调节免疫系统的蛋白质,当PD-1受体与其配体PD-L1结合时,会抑制免疫细胞的活性,使癌细胞可以逃避免疫攻击。
地舒单抗通过与PD-1受体结合,阻断PD-1与PD-L1的结合,从而恢复免疫细胞对癌细胞的攻击能力。
这种作用机制可以帮助患者的免疫系统主动识别和攻击癌细胞,抑制肿瘤生长和扩散。
地舒单抗的临床应用地舒单抗已经被广泛用于多种肿瘤的治疗中。
根据临床实践和研究,地舒单抗在以下方面表现出显著的疗效:1.非小细胞肺癌:地舒单抗可用于治疗晚期非小细胞肺癌,特别是那些表达PD-L1的患者。
研究表明,与化疗相比,地舒单抗单药治疗可以显著延长患者的生存时间。
2.胃癌:地舒单抗也可以用于治疗晚期胃癌。
研究显示,地舒单抗联合化疗相比化疗单药治疗,可以提高患者的生存率和缓解症状。
3.乳腺癌:地舒单抗在乳腺癌的治疗中也显示出潜力。
初步研究结果表明,地舒单抗可以有效抑制HER2阳性乳腺癌的生长和扩散,并提高患者的生存率。
地舒单抗的用法和用量地舒单抗的用法和用量应根据具体情况由医生确定,并遵循药品说明书的建议。
通常,地舒单抗作为静脉注射给药,每隔几周一次,疗程一般需持续数个月。
具体的用量会根据患者的病情、年龄、体重等因素而有所不同。
因此,在使用地舒单抗前,应首先咨询专业医生并进行全面评估。
地舒单抗的不良反应和注意事项虽然地舒单抗在治疗肿瘤中表现出良好的疗效,但它也可能引发一些不良反应。
常见的不良反应包括疲劳、皮疹、恶心和呕吐等。
严重的不良反应可能导致免疫系统的异常激活,引发免疫相关性的炎症反应,甚至导致器官损伤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1
1
2
地舒单抗注射液生物类似药(恶性肿瘤适应症)临床3
试验指导原则(征求意见稿)
4
5
一、概述
6
7
地舒单抗(Denosumab)是在中国仓鼠卵巢细胞中表达的全人单克隆免疫8
球蛋白G2 (IgG2) 抗体,作用于核因子κB受体激活因子(RANK)配体。
该品9
种由美国安进公司研发上市,根据适应症不同,有两个规格的产品,商品名分别10
为:XGEVA®(70mg/ml,120mg:1.7ml)和PROLIA®(60mg/ml,60mg:1ml)。
11
在全球范围内,地舒单抗以商品名XGEVA®(以及在日本以商品名RANMARK®)12
获批用于多发性骨髓瘤和实体肿瘤骨转移患者中骨相关事件(skeletal-related 13
event,SRE)的预防,以及骨巨细胞瘤(giant cell tumor of bone,GCTB) 成14
人和骨骼成熟的青少年患者的治疗。
在一些国家,XGEVA®还被批准用于双膦酸15
盐难治的恶性肿瘤高钙血症的治疗[1]。
地舒单抗以商品名称PROLIA®获批用于16
绝经后骨质疏松症。
2019年5月地舒单抗在中国大陆获批上市[2],商品名为安加维®,批准的适
17
18
应症为:用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞19
瘤,包括成人和骨骼发育成熟(定义为至少1处成熟长骨且体重≥45 kg)的青少年患者。
20
1
21
地舒单抗序列的中国专利将于2022年到期,国内制药企业纷纷加入其生物
22
类似药的研发。
本文在原国家食品药品监督管理总局已发布的《生物类似药研发
23
与评价技术指导原则(试行)》[3](以下简称“指导原则”)基础上,结合地舒单
24
抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为
25
国内地舒单抗生物类似药的临床研发提供参考。
本文仅讨论应用于肿瘤患者的
26
XGEVA®生物类似药的研发考虑。
二、地舒单抗生物类似药临床研究策略
27
28
根据《指导原则》,生物类似药研发总体思路是通过系统的比对试验为基础,
证明候选药与原研药的相似性,支持其安全、有效和质量可控等方面与原研药的29
30
相似性。
依据逐步递进的原则,分阶段进行药学、非临床、临床比对研究。
进行
31
地舒单抗生物类似药临床研发的首要前提是已通过前期药学和非临床比对试验
32
证明候选药与原研药相似,在此基础上方可按照生物类似药的路径开展药代动力
33
学(PK)比对试验和临床安全有效性比对试验。
34
原则上,药代动力学比对试验需要进行1项健康受试者单次给药药代动力学
35
比对研究,验证候选药与原研药PK特征的相似性。
临床比对研究需选择国内已
36
经获批适应症人群,与原研药进行1项“头对头”比较的临床等效性研究以支持
37
其注册上市。
按此临床研发思路,完成单个适应症的临床比对研究,可寻求外推
38
其它相同作用机制适应症,同时应考虑其与原研药的整体相似性。
三、地舒单抗临床研究设计要点
39
40
生物类似药临床比对研究设计应当以证明候选药与原研药的相似性为目的,
41
进行科学合理的研究设计。
临床研究中应采用与国内进口相同来源的原研药作为
1。
