固体中的相结构.
材料科学基础期末模拟试题集

简答题(每题5分,共30分)1.已知fcc晶体的致密度比bcc晶体的大,请解释为什么fcc的固溶度仍比bcc的大?答:间隙分为四面体间隙和八面体间隙。
在fcc中八面体间隙较大,而bcc中因八面体间隙为扁八面体间隙,故其四面体间隙较大。
因此fcc晶体能够容纳更多的溶质原子。
2.请简述影响固溶体固溶度的因素有哪些。
答:1)原子尺寸因素:置换固溶体的溶质与溶剂原子尺寸越相近固溶度越大。
间隙固溶体的溶质原子与溶剂间隙尺寸越相近固溶度越大。
2)晶体结构因素:置换固溶体溶质溶剂的晶体结构相似固溶度越大。
3)电负性因素:溶质与溶剂的电负性越相近固溶度越大。
4)电子浓度因素:电子浓度越低固溶度越大。
3.均匀形核与非均匀形核具有相同的临界晶核半径,非均匀形核的临界形核功也等于三分之一表面能,为什么非均匀形核比均匀形核容易?答:非均匀形核与均匀形核的临界晶核半径相等,但非均匀形核的临界晶核体积小。
非均匀形核的临界形核功也等于三分之一表面能,但非均匀形核的表面能小于均形核的表面能,即非均匀形核的临界形核功小。
因此非均匀形核比较容易。
4.原子的热运动如何影响扩散?答:原子热运动越强烈,原子的跃迁距离增大,跃迁频率增大,跃迁几率增大,将使得扩散系数增大,即促进扩散。
5.如何区分金属的热变形和冷变形?答:冷、热变形温度的分界是再结晶温度。
6.基体、增强体和界面在复合材料中各起什么作用?答:基体:1)固定和粘附增强体2)保护增强体免受物理化学损伤3)隔离和阻断损伤。
增强体:1)承担载荷;2)阻碍基体变形。
界面:协调变形二、作图计算题(每题10分,共40分)1.请分别计算简单立方晶体与面心立方晶体(100)、(110)和(111)晶面的间距。
晶面(100)(110)(111)简单立方(1分)(2分)(2分)面心立方(1分)(2分)(2分)2.已知某晶体在500℃时,每1010个原子中可以形成有1个空位,请问该晶体的空位形成能是多少?(已知该晶体的常数A=,波耳滋曼常数K=×10-23 J / K)答:3.请判定在fcc中下列位错反应能否进行:答:几何条件:能量条件:满足几何条件和能量条件,反应可以进行。
固体中的相结构分类和形成规律

2)ΔX>0.4~0.5,倾向于形成稳定的化合物,其电负性差值越大
,固溶体中固溶度越小。
7
二、影响置换固溶体固溶度的因素
3.电子浓度因素(原子价因素) 电子浓度是合金中价电子数目与原子数目的比值
e/aV(100x)ux 100
例 溶剂IB
不同溶质的溶解度(at%)
4周期Cu Zn(IIB) Ga(IIIA)Ge(IVA) As(VA)
构 1、Cu3Au型
14
四、长程有序固溶体(超结构)在fcc固溶体中形成超结构
2、CuAuI型
Cu Au
15
四、长程有序固溶体(超结构)在fcc固溶体中形成超结
构 2、CuAuII型
16
四、长程有序固溶体(超结构)在fcc固溶体中形成超结
构 4、CuPt型
17
四、长程有序固溶体(超结构) 在体心立方中形成超结
③ 温度低于某一温度下;
④ 冷却速度;
⑤
塑性变形使合金有序度下降。
22
4.长程有序参数
用来衡量有序度
定义
SPAXA PBXB 1XA 1XB
其 中 : PA、PB:表示A、B原子出现在正确位置上的几 率
XA、XB:A或B原子的摩尔分数 S=1,PA=PB=1,完全有序 S=0,PA=XA,PB=XB,完全无序
固体中的相结构分 类和形成规律
固体中的相结构分类:
合金相可归纳为 ·固溶体
·中间相
陶瓷晶体相
玻璃相
分子相
2
固溶体
一、固溶体的类型
固溶体 按溶质原子所占 间 置位 隙 换置 固 式溶 固:有 体 溶 按 按 限 体原 固 固子 溶 溶排 度 体 有 无 列 分限 限 的固 固 程溶 溶 序 有 无体 体 性 序 序分 固 固溶 溶 按基体类次 端 型级 际固 固溶 溶:以体 体金初属极间 :以 固化纯 溶合金 体物属 固 为为 溶 基基 体 的的固溶体
合金在固体状态的相结构

合金的相结构是指在固体状态下,合金中结构和成分均一的组成部分。
根据合金中各组元间相互作用不同,固态合金中的相可分为固溶体和金属化合物两类。
固溶体是指固态合金组元间互相溶解而形成的均匀相。
固溶体中保持原来晶格结构的组元称为溶剂,其含量较多;其他溶入且晶格结构消失了的组元称为溶质,其含量较少。
固溶体是合金的一种基本相结构,其晶格与溶剂组元晶格相同。
按溶质原子在溶剂晶格中所占位置不同,可分为间隙固溶体和置换固溶体两类。
间隙固溶体:溶质原子处于溶剂原子的间隙中而形成的固溶体。
由于溶剂晶格空隙有限,故间隙固溶体能溶解的溶质原子的数量也是有限的。
由于溶剂晶格空隙尺寸很小,因此能形成间隙固溶体的溶质原子,通常是一些半径很小的非金属元素,如碳、氮、硼等非金属元素溶于铁中形成的固溶体。
置换固溶体:单胞中的原子数目保持与纯溶剂相同,由一种元素替代另一种元素或替代一个化合物中的某一元素,或一个化合物替代另一个化合物。
形成置换固溶体的条件是:相互替代的组元应该具有相同的晶胞形状,原子半径差不超过15%,电负性和电子结构相近。
此外,金属化合物是指合金中的各组元通过相互作用,形成了与组元性质完全不同的新相。
金属化合物一般具有复杂的晶体结构,其晶格结构与单一组元相的晶格结构均不相同。
金属化合物在合金中以脆性相形式存在,降低合金的力学性能。
综上所述,相是组织的基本单元,组织是相的综合体。
如需了解更多关于合金在固体状态的相结构的信息,建议查阅金属学书籍或咨询材料学家获取。
西南工业大学材料科学与基础第三版(刘智恩)习题解析

第一章原子排列1. 作图表示立方晶系中的(123),(012),(421)晶面和[102],[211],[346]晶向.附图1-1 有关晶面及晶向2. 分别计算面心立方结构与体心立方结构的{100},{110}和{111}晶面族的面间距, 并指出面间距最大的晶面(设两种结构的点阵常数均为a).解由面心立方和体心立方结构中晶面间的几何关系, 可求得不同晶面族中的面间距如附表1-1所示.附表1-1 立方晶系中的晶面间距显然, FCC中{111}晶面的面间距最大, 而BCC中{110}晶面的面间距最大.注意: 对于晶面间距的计算, 不能简单地使用公式, 应考虑组成复合点阵时, 晶面层数会增加.3. 分别计算fcc和bcc中的{100},{110}和{111}晶面族的原子面密度和<100>,<110>和<111>晶向族的原子线密度, 并指出两种结构的差别. (设两种结构的点阵常数均为a)解原子的面密度是指单位晶面内的原子数; 原子的线密度是指晶面上单位长度所包含的原子数. 据此可求得原子的面密度和线密度如附表1-2所示.附表1-2 立方晶系中原子的面密度和线密度可见, 在BCC 中, 原子密度最大的晶面为{110}, 原子密度最大的晶向为<111>; 在FCC 中, 原子密度最大的晶面为{111}, 原子密度最大的晶向为<110>. 4. 在(0110)晶面上绘出[2113]晶向. 解 详见附图1-2.附图1-2 六方晶系中的晶向5. 在一个简单立方二维晶体中, 画出一个正刃型位错和一个负刃型位错. 试求: (1) 用柏氏回路求出正、负刃型位错的柏氏矢量.(2) 若将正、负刃型位错反向时, 说明其柏氏矢量是否也随之反向.(3) 具体写出该柏氏矢量的方向和大小.(4) 求出此两位错的柏氏矢量和.解 正负刃型位错示意图见附图1-3(a)和附图1-4(a).(1) 正负刃型位错的柏氏矢量见附图1-3(b)和附图1-4(b).(2) 显然, 若正、负刃型位错线反向, 则其柏氏矢量也随之反向.(3) 假设二维平面位于YOZ坐标面, 水平方向为Y轴, 则图示正、负刃型位错方向分别为[010]和[010], 大小均为一个原子间距(即点阵常数a).(4) 上述两位错的柏氏矢量大小相等, 方向相反, 故其矢量和等于0.6. 设图1-72所示立方晶体的滑移面ABCD平行于晶体的上下底面, 该滑移面上有一正方形位错环. 如果位错环的各段分别与滑移面各边平行, 其柏氏矢量b // AB, 试解答:(1) 有人认为“此位错环运动离开晶体后, 滑移面上产生的滑移台阶应为4个b”, 这种说法是否正确? 为什么?(2) 指出位错环上各段位错线的类型, 并画出位错移出晶体后, 晶体的外形、滑移方向和滑移量. (设位错环线的方向为顺时针方向)图1-72 滑移面上的正方形位错环附图1-5 位错环移出晶体引起的滑移解 (1) 这种看法不正确. 在位错环运动移出晶体后, 滑移面上下两部分晶体相对移动的距离是由其柏氏矢量决定的. 位错环的柏氏矢量为b, 故其相对滑移了一个b 的距离.(2) A ′B ′为右螺型位错, C ′D ′为左螺型位错, B ′C ′为正刃型位错, D ′A ′为负刃型位错. 位错运动移出晶体后滑移方向及滑移量见附图1-5.7. 设面心立方晶体中的(111)晶面为滑移面, 位错滑移后的滑移矢量为[110]2a.(1) 在晶胞中画出此柏氏矢量b 的方向并计算出其大小.(2) 在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线方向, 并写出此二位错线的晶向指数.解 (1) 柏氏矢量等于滑移矢量, 因此柏氏矢量的方向为[110], /2. (2) 刃型位错与柏氏矢量垂直, 螺型位错与柏氏矢量平行, 晶向指数分别为[112]和[110], 详见附图1-6.附图1-6 位错线与其柏氏矢量、滑移矢量 8. 若面心立方晶体中有[101]2ab =的单位位错及[121]6ab =的不全位错, 此二位错相遇后产生位错反应.(1) 此反应能否进行? 为什么?(2) 写出合成位错的柏氏矢量, 并说明合成位错的性质. 解 (1) 能够进行. 因为既满足几何条件:[111]3abb==∑∑后前, 又满足能量条件: .22222133ba ba =>=∑∑后前.(2) [111]3ab =合, 该位错为弗兰克不全位错.9. 已知柏氏矢量的大小为b = 0.25nm, 如果对称倾侧晶界的取向差θ = 1° 和10°, 求晶界上位错之间的距离. 从计算结果可得到什么结论? 解 根据bD θ≈, 得到θ = 1°,10° 时, D ≈14.3nm, 1.43nm. 由此可知, θ = 10° 时位错之间仅隔5~6个原子间距, 位错密度太大, 表明位错模型已经不适用了. 第二章 固体中的相结构1. 已知Cd, In, Sn, Sb 等元素在Ag 中的固熔度极限(摩尔分数)分别为0.435, 0.210, 0.130, 0.078; 它们的原子直径分别为0.3042 nm, 0.314 nm, 0.316 nm, 0.3228 nm; Ag 的原子直径为0.2883 nm. 试分析其固熔度极限差异的原因, 并计算它们在固熔度极限时的电子浓度.答: 在原子尺寸因素相近的情况下, 熔质元素在一价贵金属中的固熔度(摩尔分数)受原子价因素的影响较大, 即电子浓度e/a 是决定固熔度(摩尔分数)的一个重要因素, 而且电子浓度存在一个极限值(约为1.4). 电子浓度可用公式A B B B (1)c Z x Z x =-+ 计算. 式中, ZA, ZB 分别为A, B 组元的价电子数; xB 为B 组元的摩尔分数. 因此, 随着熔质元素价电子数的增加, 极限固熔度会越来越小.Cd, In, Sn, Sb 等元素与Ag 的原子直径相差不超过15%(最小的Cd 为5.5%, 最大的Sb 为11.96%), 满足尺寸相近原则, 这些元素的原子价分别为2, 3, 4, 5价, Ag 为1价, 据此推断它们的固熔度极限越来越小, 实际情况正好反映了这一规律; 根据上面的公式可以计算出它们在固熔度(摩尔分数)极限时的电子浓度分别为1.435, 1.420, 1.390, 1.312.2. 碳可以熔入铁中而形成间隙固熔体, 试分析是α-Fe 还是γ-Fe 能熔入较多的碳. 答: α-Fe 为体心立方结构, 致密度为0.68; γ-Fe 为面心立方结构, 致密度为0.74. 显然, α-Fe中的间隙总体积高于γ-Fe, 但由于α-Fe的间隙数量多, 单个间隙半径却较小, 熔入碳原子将会产生较大的畸变, 因此, 碳在γ-Fe中的固熔度较α-Fe的大. 3. 为什么只有置换固熔体的两个组元之间才能无限互熔, 而间隙固熔体则不能? 答: 这是因为形成固熔体时, 熔质原子的熔入会使熔剂结构产生点阵畸变, 从而使体系能量升高. 熔质原子与熔剂原子尺寸相差越大, 点阵畸变的程度也越大, 则畸变能越高, 结构的稳定性越低, 熔解度越小. 一般来说, 间隙固熔体中熔质原子引起的点阵畸变较大, 故不能无限互熔, 只能有限熔解.第三章凝固1. 分析纯金属生长形态与温度梯度的关系.答: 纯金属生长形态是指晶体宏观长大时固-液界面的形貌. 界面形貌取决于界面前沿液相中的温度梯度.(1) 平面状长大: 当液相具有正温度梯度时, 晶体以平直界面方式推移长大. 此时, 界面上任何偶然的、小的凸起深入液相时, 都会使其过冷度减小, 长大速率降低或停止长大, 而被周围部分赶上, 因而能保持平直界面的推移. 长大过程中晶体沿平行温度梯度的方向生长, 或沿散热的反方向生长, 而其它方向的生长则受到限制.(2) 树枝状长大: 当液相具有负温度梯度时, 晶体将以树枝状方式生长. 此时, 界面上偶然的凸起深入液相时, 由于过冷度的增大, 长大速率越来越大; 而它本身生长时又要释放结晶潜热, 不利于近旁的晶体生长, 只能在较远处形成另一凸起. 这就形成了枝晶的一次轴, 在一次轴成长变粗的同时, 由于释放潜热使晶枝侧旁液体中也呈现负温度梯度, 于是在一次轴上又会长出小枝来, 称为二次轴, 在二次轴上又长出三次轴……由此而形成树枝状骨架, 故称为树枝晶(简称枝晶).2. 简述纯金属晶体长大机制及其与固-液界面微观结构的关系.答: 晶体长大机制是指晶体微观长大方式, 即液相原子添加到固相的方式, 它与固-液界面的微观结构有关.(1) 垂直长大方式: 具有粗糙界面的物质, 因界面上约有50%的原子位置空着, 这些空位都可以接受原子, 故液相原子可以进入空位, 与晶体连接, 界面沿其法线方向垂直推移, 呈连续式长大.(2) 横向(台阶)长大方式: 包括二维晶核台阶长大机制和晶体缺陷台阶长大机制, 具有光滑界面的晶体长大往往采取该方式. 二维晶核模式, 认为其生长主要是利用系统的能量起伏, 使液相原子在界面上通过均匀形核形成一个原子厚度的二维薄层状稳定的原子集团, 然后依靠其周围台阶填充原子, 使二维晶核横向长大, 在该层填满后, 则在新的界面上形成新的二维晶核, 继续填满, 如此反复进行.晶体缺陷方式, 认为晶体生长是利用晶体缺陷存在的永不消失的台阶(如螺型位错的台阶或挛晶的沟槽)长大的. 第四章 相图1. 在Al-Mg 合金中, xMg 为0.15, 计算该合金中镁的wMg 为多少.解 设Al 的相对原子量为MAl, 镁的相对原子量为MMg, 按1mol Al-Mg 合金计算, 则镁的质量分数可表示为Mg MgMg Al Al Mg Mg100%x M w x M x M =⨯+.将xMg = 0.15, xAl = 0.85, MMg = 24, MAl = 27代入上式中, 得到wMg = 13.56%.2. 根据图4-117所示二元共晶相图, 试完成:(1) 分析合金I, II 的结晶过程, 并画出冷却曲线.(2) 说明室温下合金I, II 的相和组织是什么, 并计算出相和组织组成物的相对量.(3) 如果希望得到共晶组织加上相对量为5%的β初 的合金, 求该合金的成分.图4-117 二元共晶相图 附图4-1 合金I 的冷却曲线 附图4-2 合金II 的冷却曲线解 (1) 合金I 的冷却曲线参见附图4-1, 其结晶过程如下:1以上, 合金处于液相;1~2时, 发生匀晶转变L →α, 即从液相L 中析出固熔体α, L 和α的成分沿液相线和固相线变化, 达到2时, 凝固过程结束;2时, 为α相;2~3时, 发生脱熔转变, α→βII.合金II 的冷却曲线参见附图4-2, 其结晶过程如下:1以上, 处于均匀液相;1~2时, 进行匀晶转变L →β;2时, 两相平衡共存, 0.50.9L β;2~2时,剩余液相发生共晶转变0.50.20.9L βα+;2~3时, 发生脱熔转变α→βII.(2) 室温下, 合金I 的相组成物为α + β, 组织组成物为α + βII.相组成物相对量计算如下:αβ0.900.20100%82%0.900.050.200.05100%18%0.900.05w w -=⨯=--=⨯=-组织组成物的相对量与相的一致.室温下, 合金II 的相组成物为α + β, 组织组成物为β初 + (α+β).相组成物相对量计算如下:αβ0.900.80100%12%0.900.050.800.05100%88%0.900.05w w -=⨯=--=⨯=-组织组成物相对量计算如下:β(α+β)0.800.50100%75%0.900.500.900.80100%25%0.900.50w w -=⨯=--=⨯=-初(3) 设合金的成分为wB = x, 由题意知该合金为过共晶成分, 于是有β0.50100%5%0.900.50x w -=⨯=-初所以, x = 0.52, 即该合金的成分为wB = 0.52.3. 计算wC 为0.04的铁碳合金按亚稳态冷却到室温后组织中的珠光体、二次渗碳体和莱氏体的相对量, 并计算组成物珠光体中渗碳体和铁素体及莱氏体中二次渗碳体、共晶渗碳体与共析渗碳体的相对量.解 根据Fe-Fe3C 相图, wC = 4%的铁碳合金为亚共晶铸铁, 室温下平衡组织为 P + Fe3CII + Ld ′, 其中P 和Fe3CII 系由初生奥氏体转变而来, 莱氏体则由共晶成分的液相转变而成, 因此莱氏体可由杠杆定律直接计算, 而珠光体和二次渗碳体则可通过两次使用杠杆定律间接计算出来. Ld ′ 相对量: dL 4 2.11100%86.3%4.3 2.11w '-=⨯=-.Fe3CII相对量:3II Fe C 4.34 2.110.77100% 3.1%4.3 2.11 6.690.77w --=⨯⨯=--.P相对量:P 4.34 6.69 2.11100%10.6%4.3 2.11 6.690.77w --=⨯⨯=--.珠光体中渗碳体和铁素体的相对量的计算则以共析成分点作为支点, 以wC = 0.001%和wC = 6.69%为端点使用杠杆定律计算并与上面计算得到的珠光体相对量级联得到. P 中F 相对量:F P 6.690.77100%9.38%6.690.001w w -=⨯⨯=-.P 中Fe3C 相对量:3Fe C 10.6%9.38% 1.22%w =-=.至于莱氏体中共晶渗碳体、二次渗碳体及共析渗碳体的相对量的计算, 也需采取杠杆定律的级联方式, 但必须注意一点, 共晶渗碳体在共晶转变线处计算, 而二次渗碳体及共析渗碳体则在共析转变线处计算. Ld ′ 中共晶渗碳体相对量: dCm L 4.3 2.11100%41.27%6.69 2.11w w '-=⨯⨯=-共晶Ld ′ 中二次渗碳体相对量: dCm L 6.69 4.3 2.110.77100%10.2%6.69 2.11 6.690.77w w '--=⨯⨯⨯=--IILd ′ 中共析渗碳体相对量:dCm L 6.69 4.3 6.69 2.110.770.0218100% 3.9%6.69 2.11 6.690.77 6.690.0218w w '---=⨯⨯⨯⨯=---共析4. 根据下列数据绘制Au-V 二元相图. 已知金和钒的熔点分别为1064℃和1920℃.金与钒可形成中间相β(AuV3); 钒在金中的固熔体为α, 其室温下的熔解度为wV = 0.19; 金在钒中的固熔体为γ, 其室温下的熔解度为wAu = 0.25. 合金系中有两个包晶转变, 即1400V V V 1522V V V (1) β(0.4)L(0.25)α(0.27)(2) γ(0.52)L(0.345)α(0.45)w w w w w w =+===+==℃℃解 根据已知数据绘制的Au-V 二元相图参见附图4-3.附图4-3 Au-V 二元相图 第五章 材料中的扩散1. 设有一条直径为3cm 的厚壁管道, 被厚度为0.001cm 的铁膜隔开, 通过输入氮气以保持在膜片一边氮气浓度为1000 mol/m3; 膜片另一边氮气浓度为100 mol/m3. 若氮在铁中700℃时的扩散系数为4×10-7 cm2 /s, 试计算通过铁膜片的氮原子总数. 解设铁膜片左右两边的氮气浓度分别为c1, c2, 则铁膜片处浓度梯度为7421510010009.010 mol /m 110c c c c x x x --∂∆-≈===-⨯∂∆∆⨯根据扩散第一定律计算出氮气扩散通量为722732410(10)(9.010) 3.610 mol/(m s)cJ Dx---∂=-=-⨯⨯⨯-⨯=⨯∂于是, 单位时间通过铁膜片的氮气量为3-22-63.610(310) 2.5410 mol/s4J A π-=⨯⨯⨯⨯=⨯最终得到单位时间通过铁膜片的氮原子总数为-62318-1A () 2.5410 6.02102 3.0610 s N J A N =⨯=⨯⨯⨯⨯=⨯第六章 塑性变形1. 铜单晶体拉伸时, 若力轴为 [001] 方向, 临界分切应力为0.64 MPa, 问需要多大的拉伸应力才能使晶体开始塑性变形?解 铜为面心立方金属, 其滑移系为 {111}<110>, 4个 {111} 面构成一个八面体, 详见教材P219中的图6-12.当拉力轴为 [001] 方向时, 所有滑移面与力轴间的夹角相同, 且每个滑移面上的三个滑移方向中有两个与力轴的夹角相同, 另一个为硬取向(λ = 90°). 于是, 取滑移系(111)[101]进行计算.ks cos cos cos cos 0.64 1.57 MPa.m mϕλϕλτσ=========即至少需要1.57 MPa 的拉伸应力才能使晶体产生塑性变形.2. 什么是滑移、滑移线、滑移带和滑移系? 作图表示α-Fe, Al, Mg 中的最重要滑移系. 那种晶体的塑性最好, 为什么?答: 滑移是晶体在切应力作用下一部分相对于另一部分沿一定的晶面和晶向所作的平行移动; 晶体的滑移是不均匀的, 滑移部分与未滑移部分晶体结构相同. 滑移后在晶体表面留下台阶, 这就是滑移线的本质. 相互平行的一系列滑移线构成所谓滑移带. 晶体发生滑移时, 某一滑移面及其上的一个滑移方向就构成了一个滑移系.附图6-1 三种晶体点阵的主要滑移系α-Fe具有立方体心结构, 主要滑移系可表示为{110}<111>, 共有6×2 = 12个; Al 具有面心立方结构, 其滑移系可表示为{111}<110>, 共有4×3 = 12个; Mg具有密<>, 共有1×3 = 3个. 晶体的塑性与其滑排六方结构, 主要滑移系可表示为{0001}1120移系的数量有直接关系, 滑移系越多, 塑性越好; 滑移系数量相同时, 又受滑移方向影响, 滑移方向多者塑性较好, 因此, 对于α-Fe, Al, Mg三种金属, Al的塑性最好, Mg 的最差, α-Fe居中. 三种典型结构晶体的重要滑移系如附图6-1所示.3. 什么是临界分切应力? 影响临界分切应力的主要因素是什么? 单晶体的屈服强度与外力轴方向有关吗? 为什么?答: 滑移系开动所需的作用于滑移面上、沿滑移方向的最小分切应力称为临界分切应力.临界分切应力τk的大小主要取决于金属的本性, 与外力无关. 当条件一定时, 各种晶体的临界分切应力各有其定值. 但它是一个组织敏感参数, 金属的纯度、变形速度和温度、金属的加工和热处理状态都对它有很大影响.如前所述, 在一定条件下, 单晶体的临界分切应力保持为定值, 则根据分切应力与外加轴向应力的关系: σs = τk / m, m为取向因子, 反映了外力轴与滑移系之间的位向关系, 因此, 单晶体的屈服强度与外力轴方向关系密切. m越大, 则屈服强度越小, 越有利于滑移.4. 孪生与滑移主要异同点是什么? 为什么在一般条件下进行塑性变形时锌中容易出现挛晶, 而纯铁中容易出现滑移带?答: 孪生与滑移的异同点如附表6-1所示.附表6-1 晶体滑移与孪生的比较锌为密排六方结构金属, 主要滑移系仅3个, 因此塑性较差, 滑移困难, 往往发生孪生变形, 容易出现挛晶; 纯铁为体心立方结构金属, 滑移系较多, 共有48个, 其中主要滑移系有12个, 因此塑性较好, 往往发生滑移变形, 容易出现滑移带. 第七章 回复与再结晶1. 已知锌单晶体的回复激活能为8.37×104 J/mol, 将冷变形的锌单晶体在-50 ℃进行回复处理, 如去除加工硬化效应的25% 需要17 d, 问若在5 min 内达到同样效果, 需将温度提高多少摄氏度?解 根据回复动力学, 采用两个不同温度将同一冷变形金属的加工硬化效应回复到同样程度, 回复时间、温度满足下述关系:122111exp t Q t R T T ⎛⎫⎛⎫=-- ⎪ ⎪ ⎪⎝⎭⎝⎭整理后得到221111ln T t RT Q t =+.将41211223 K,/5/(172460),8.3710 J/mol, 8.314 J/(mol K)4896T t t Q R ==⨯⨯==⨯=⋅代入上式得到2274.7 K T =.因此, 需将温度提高21274.722351.7 T T T ∆=-=-=℃.2. 纯铝在553 ℃ 和627 ℃ 等温退火至完成再结晶分别需要40 h 和1 h, 试求此材料的再结晶激活能.解 再结晶速率v 再与温度T 的关系符合阿累尼乌斯(Arrhenius)公式, 即exp()Q v A RT=-再其中, Q 为再结晶激活能, R 为气体常数.如果在两个不同温度T1, T2进行等温退火, 欲产生同样程度的再结晶所需时间分别为t1, t2, 则122112122111exp[()]ln(/)t Q t R T T RT T t t Q T T =--⇒=- 依题意, 有T1= 553 + 273 = 826 K, T2 = 627 + 273 = 900 K, t1 = 40 h, t2 = 1 h, 则58.314826900ln(40/1)3.0810J/mol900826Q ⨯⨯⨯=⨯-3. 说明金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别.答: 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能特点与主要区别详见附表7-1.附表7-1 金属在冷变形、回复、再结晶及晶粒长大各阶段的显微组织、机械性能。
西北工业大学材料科学基础考研08-11试题与答案

2008年西北工业大学硕士研究生入学试题参考答案一、简答题(每题10分,共60分)1.固态下,无相变的金属,如果不重熔,能否细化晶粒?如何实现?答:可以。
.通过进行适当冷变形,而后在适当温度再结晶的方法获得细晶(应主意避开临界变形度和避免异常长大)。
或进行热加工,使之发生动态再结晶。
2.固体中有哪些常见的相结构?答:固体中常见的相结构有:固溶体(单质)、化合物、陶瓷晶体相、非晶相、分子相。
3.何谓平衡结晶?何谓非平衡结晶?答:平衡结晶是指结晶速度非常缓慢,液相和固相中扩散均很充分的情况下的结晶。
非平衡结晶是指结晶速度比较快,扩散不充分的情况下的结晶。
4.扩散第一定律的应用条件是什么?对于浓度梯度随时间变化的情况,能否应用扩散第一定律?答:扩散第一定律的应用条件是稳态扩散,即与时间无关的扩散。
对于非稳态扩散的情况也可以应用扩散第一定律,但必须对其进行修正。
5.何为织构?包括哪几类?答:织构是晶体中晶面、晶向趋于一致现象。
织构包括再结晶织构和变形织构。
其中变形织构又包括丝织构和板织构。
6.什么是成分过冷?如何影响固溶体生长形态?答:凝固过程中,随液固界面的推进,液固界面附近液相一侧产生溶质原子富集,导致液相的熔点发生变化,由此产生的过冷现象称为成分过冷。
无成分过冷时,固溶体以平面状生长,形成等轴晶;有较小过冷度时,形成胞状组织;有较大成分过冷时,形成树枝晶。
二、作图计算题(每题15分,共60分)1.请分别写出FCC、BCC和HCP晶体的密排面、密排方向,并计算密排面间距和密排方向上原子间距。
答:2.请绘出面心立方点阵晶胞,并在晶胞中绘出(110)晶面;再以(110)晶面平行于纸面,绘出(110)晶面原子剖面图,并在其上标出[001],,晶向。
答:1.已知H70黄铜在400℃时完成再结晶需要1小时,而在390℃下完成再结晶需2小时,请计算在420℃下完成再结晶需要多长时间?答:在两个不同的恒定温度产生相同程度的再结晶时,两边取对数,并比之得t3 = 0.26 h2.一个FCC晶体在方向在2MPa正应力下屈服,已测得开动的滑移系是,请确定使该滑移系开动的分切应力τ。
材料科学基础作业详细答案
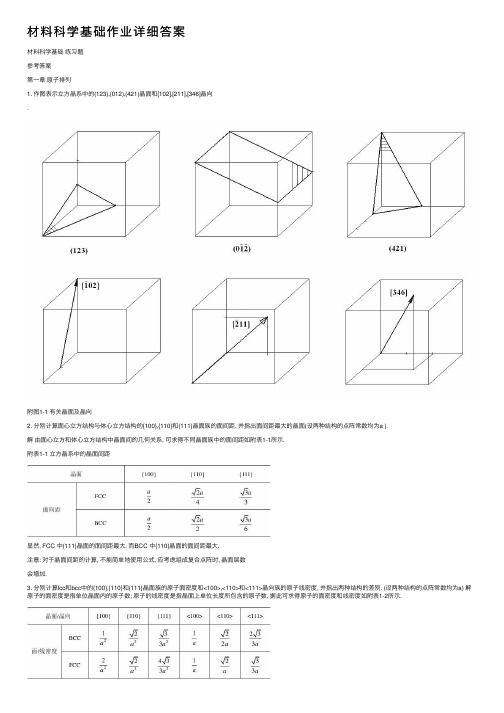
材料科学基础作业详细答案材料科学基础练习题参考答案第⼀章原⼦排列1. 作图表⽰⽴⽅晶系中的(123),(012),(421)晶⾯和[102],[211],[346]晶向.附图1-1 有关晶⾯及晶向2. 分别计算⾯⼼⽴⽅结构与体⼼⽴⽅结构的{100},{110}和{111}晶⾯族的⾯间距, 并指出⾯间距最⼤的晶⾯(设两种结构的点阵常数均为a ).解由⾯⼼⽴⽅和体⼼⽴⽅结构中晶⾯间的⼏何关系, 可求得不同晶⾯族中的⾯间距如附表1-1所⽰.附表1-1 ⽴⽅晶系中的晶⾯间距显然, FCC 中{111}晶⾯的⾯间距最⼤, ⽽BCC 中{110}晶⾯的⾯间距最⼤.注意: 对于晶⾯间距的计算, 不能简单地使⽤公式, 应考虑组成复合点阵时, 晶⾯层数会增加.3. 分别计算fcc和bcc中的{100},{110}和{111}晶⾯族的原⼦⾯密度和<100>,<110>和<111>晶向族的原⼦线密度, 并指出两种结构的差别. (设两种结构的点阵常数均为a) 解原⼦的⾯密度是指单位晶⾯内的原⼦数; 原⼦的线密度是指晶⾯上单位长度所包含的原⼦数. 据此可求得原⼦的⾯密度和线密度如附表1-2所⽰.可见, 在BCC中, 原⼦密度最⼤的晶⾯为{110}, 原⼦密度最⼤的晶向为<111>; 在FCC 中, 原⼦密度最⼤的晶⾯为{111}, 原⼦密度最⼤的晶向为<110>.4. 在(0110)晶⾯上绘出[2113]晶向.解详见附图1-2.附图1-2 六⽅晶系中的晶向5. 在⼀个简单⽴⽅⼆维晶体中, 画出⼀个正刃型位错和⼀个负刃型位错. 试求:(1) ⽤柏⽒回路求出正、负刃型位错的柏⽒⽮量.(2) 若将正、负刃型位错反向时, 说明其柏⽒⽮量是否也随之反向.(3) 具体写出该柏⽒⽮量的⽅向和⼤⼩.(4) 求出此两位错的柏⽒⽮量和.解正负刃型位错⽰意图见附图1-3(a)和附图1-4(a).(1) 正负刃型位错的柏⽒⽮量见附图1-3(b)和附图1-4(b).(2) 显然, 若正、负刃型位错线反向, 则其柏⽒⽮量也随之反向.(3) 假设⼆维平⾯位于YOZ坐标⾯, ⽔平⽅向为Y轴, 则图⽰正、负刃型位错⽅向分别为[010]和[010], ⼤⼩均为⼀个原⼦间距(即点阵常数a).(4) 上述两位错的柏⽒⽮量⼤⼩相等, ⽅向相反, 故其⽮量和等于0.6. 设图1-72所⽰⽴⽅晶体的滑移⾯ABCD平⾏于晶体的上下底⾯, 该滑移⾯上有⼀正⽅形位错环. 如果位错环的各段分别与滑移⾯各边平⾏, 其柏⽒⽮量b // AB, 试解答:(1) 有⼈认为“此位错环运动离开晶体后, 滑移⾯上产⽣的滑移台阶应为4个b”, 这种说法是否正确? 为什么?(2) 指出位错环上各段位错线的类型, 并画出位错移出晶体后, 晶体的外形、滑移⽅向和滑移量. (设位错环线的⽅向为顺时针⽅向)图1-72 滑移⾯上的正⽅形位错环附图1-5 位错环移出晶体引起的滑移解 (1) 这种看法不正确. 在位错环运动移出晶体后, 滑移⾯上下两部分晶体相对移动的距离是由其柏⽒⽮量决定的. 位错环的柏⽒⽮量为b , 故其相对滑移了⼀个b 的距离.(2) A ′B ′为右螺型位错, C ′D ′为左螺型位错, B ′C ′为正刃型位错, D ′A ′为负刃型位错. 位错运动移出晶体后滑移⽅向及滑移量见附图1-5.7. 设⾯⼼⽴⽅晶体中的(111)晶⾯为滑移⾯, 位错滑移后的滑移⽮量为[110]2a .(1) 在晶胞中画出此柏⽒⽮量b 的⽅向并计算出其⼤⼩.(2) 在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线⽅向, 并写出此⼆位错线的晶向指数.解 (1) 柏⽒⽮量等于滑移⽮量, 因此柏⽒⽮量的⽅向为[110], /2.(2) 刃型位错与柏⽒⽮量垂直, 螺型位错与柏⽒⽮量平⾏, 晶向指数分别为[112]和[110], 详见附图1-6.附图1-6 位错线与其柏⽒⽮量、滑移⽮量8. 若⾯⼼⽴⽅晶体中有[101]2a b =的单位位错及[121]6a b =的不全位错, 此⼆位错相遇后产⽣位错反应.(1) 此反应能否进⾏? 为什么?(2) 写出合成位错的柏⽒⽮量, 并说明合成位错的性质.解 (1) 能够进⾏.因为既满⾜⼏何条件:[111]3a b b ==∑∑后前,⼜满⾜能量条件: . 22222133b a b a =>=∑∑后前. (2) [111]3a b =合, 该位错为弗兰克不全位错. 9. 已知柏⽒⽮量的⼤⼩为b = 0.25nm, 如果对称倾侧晶界的取向差θ = 1° 和10°, 求晶界上位错之间的距离. 从计算结果可得到什么结论?解根据bD θ≈, 得到θ = 1°,10° 时, D ≈14.3nm, 1.43nm. 由此可知, θ = 10° 时位错之间仅隔5~6个原⼦间距, 位错密度太⼤, 表明位错模型已经不适⽤了.第⼆章固体中的相结构1. 已知Cd, In, Sn, Sb 等元素在Ag 中的固熔度极限(摩尔分数)分别为0.435, 0.210, 0.130, 0.078; 它们的原⼦直径分别为0.3042 nm, 0.314 nm, 0.316 nm, 0.3228 nm; Ag 的原⼦直径为0.2883 nm. 试分析其固熔度极限差异的原因, 并计算它们在固熔度极限时的电⼦浓度.答: 在原⼦尺⼨因素相近的情况下, 熔质元素在⼀价贵⾦属中的固熔度(摩尔分数)受原⼦价因素的影响较⼤, 即电⼦浓度e /a 是决定固熔度(摩尔分数)的⼀个重要因素, ⽽且电⼦浓度存在⼀个极限值(约为1.4). 电⼦浓度可⽤公式A B B B (1)c Z x Z x =-+计算. 式中, Z A , Z B 分别为A, B 组元的价电⼦数; x B 为B 组元的摩尔分数. 因此, 随着熔质元素价电⼦数的增加, 极限固熔度会越来越⼩.Cd, In, Sn, Sb 等元素与Ag 的原⼦直径相差不超过15%(最⼩的Cd 为5.5%, 最⼤的Sb 为11.96%), 满⾜尺⼨相近原则, 这些元素的原⼦价分别为2, 3, 4, 5价, Ag 为1价, 据此推断它们的固熔度极限越来越⼩, 实际情况正好反映了这⼀规律; 根据上⾯的公式可以计算出它们在固熔度(摩尔分数)极限时的电⼦浓度分别为1.435, 1.420, 1.390, 1.312.2. 碳可以熔⼊铁中⽽形成间隙固熔体, 试分析是α-Fe 还是γ-Fe 能熔⼊较多的碳.答: α-Fe 为体⼼⽴⽅结构, 致密度为0.68; γ-Fe 为⾯⼼⽴⽅结构, 致密度为0.74. 显然, α-Fe 中的间隙总体积⾼于γ-Fe, 但由于α-Fe 的间隙数量多, 单个间隙半径却较⼩, 熔⼊碳原⼦将会产⽣较⼤的畸变, 因此, 碳在γ-Fe 中的固熔度较α-Fe 的⼤.3. 为什么只有置换固熔体的两个组元之间才能⽆限互熔, ⽽间隙固熔体则不能?答: 这是因为形成固熔体时, 熔质原⼦的熔⼊会使熔剂结构产⽣点阵畸变, 从⽽使体系能量升⾼. 熔质原⼦与熔剂原⼦尺⼨相差越⼤, 点阵畸变的程度也越⼤, 则畸变能越⾼,结构的稳定性越低, 熔解度越⼩. ⼀般来说, 间隙固熔体中熔质原⼦引起的点阵畸变较⼤, 故不能⽆限互熔, 只能有限熔解.第三章凝固1. 分析纯⾦属⽣长形态与温度梯度的关系.答: 纯⾦属⽣长形态是指晶体宏观长⼤时固-液界⾯的形貌. 界⾯形貌取决于界⾯前沿液相中的温度梯度.(1) 平⾯状长⼤: 当液相具有正温度梯度时, 晶体以平直界⾯⽅式推移长⼤. 此时, 界⾯上任何偶然的、⼩的凸起深⼊液相时, 都会使其过冷度减⼩, 长⼤速率降低或停⽌长⼤,⽽被周围部分赶上, 因⽽能保持平直界⾯的推移. 长⼤过程中晶体沿平⾏温度梯度的⽅向⽣长, 或沿散热的反⽅向⽣长, ⽽其它⽅向的⽣长则受到限制.(2) 树枝状长⼤: 当液相具有负温度梯度时, 晶体将以树枝状⽅式⽣长. 此时, 界⾯上偶然的凸起深⼊液相时, 由于过冷度的增⼤, 长⼤速率越来越⼤; ⽽它本⾝⽣长时⼜要释放结晶潜热, 不利于近旁的晶体⽣长, 只能在较远处形成另⼀凸起. 这就形成了枝晶的⼀次轴, 在⼀次轴成长变粗的同时, 由于释放潜热使晶枝侧旁液体中也呈现负温度梯度, 于是在⼀次轴上⼜会长出⼩枝来, 称为⼆次轴, 在⼆次轴上⼜长出三次轴……由此⽽形成树枝状⾻架, 故称为树枝晶(简称枝晶).2. 简述纯⾦属晶体长⼤机制及其与固-液界⾯微观结构的关系.答: 晶体长⼤机制是指晶体微观长⼤⽅式, 即液相原⼦添加到固相的⽅式, 它与固-液界⾯的微观结构有关.(1) 垂直长⼤⽅式: 具有粗糙界⾯的物质, 因界⾯上约有50% 的原⼦位置空着, 这些空位都可以接受原⼦, 故液相原⼦可以进⼊空位, 与晶体连接, 界⾯沿其法线⽅向垂直推移,呈连续式长⼤.(2) 横向(台阶)长⼤⽅式: 包括⼆维晶核台阶长⼤机制和晶体缺陷台阶长⼤机制, 具有光滑界⾯的晶体长⼤往往采取该⽅式. ⼆维晶核模式, 认为其⽣长主要是利⽤系统的能量起伏, 使液相原⼦在界⾯上通过均匀形核形成⼀个原⼦厚度的⼆维薄层状稳定的原⼦集团, 然后依靠其周围台阶填充原⼦, 使⼆维晶核横向长⼤, 在该层填满后, 则在新的界⾯上形成新的⼆维晶核, 继续填满, 如此反复进⾏.晶体缺陷⽅式, 认为晶体⽣长是利⽤晶体缺陷存在的永不消失的台阶(如螺型位错的台阶或挛晶的沟槽)长⼤的.第四章相图1. 在Al-Mg 合⾦中, x Mg 为0.15, 计算该合⾦中镁的w Mg 为多少.解设Al 的相对原⼦量为M Al , 镁的相对原⼦量为M Mg , 按1mol Al-Mg 合⾦计算, 则镁的质量分数可表⽰为Mg MgMg Al Al Mg Mg 100%x M w x M x M =?+.将x Mg = 0.15, x Al = 0.85, M Mg = 24, M Al = 27代⼊上式中, 得到w Mg = 13.56%.2. 根据图4-117所⽰⼆元共晶相图, 试完成:(1) 分析合⾦I, II 的结晶过程, 并画出冷却曲线.(2) 说明室温下合⾦I, II 的相和组织是什么, 并计算出相和组织组成物的相对量.(3) 如果希望得到共晶组织加上相对量为5%的β初的合⾦, 求该合⾦的成分.图4-117 ⼆元共晶相图附图4-1 合⾦I的冷却曲线附图4-2 合⾦II的冷却曲线解(1) 合⾦I的冷却曲线参见附图4-1, 其结晶过程如下:1以上, 合⾦处于液相;1~2时, 发⽣匀晶转变L→α, 即从液相L中析出固熔体α, L和α的成分沿液相线和固相线变化, 达到2时, 凝固过程结束;2时, 为α相;2~3时, 发⽣脱熔转变, α→βII.合⾦II的冷却曲线参见附图4-2, 其结晶过程如下:1以上, 处于均匀液相;1~2时, 进⾏匀晶转变L→β;2时, 两相平衡共存, 0.50.9L β ;2~2′时, 剩余液相发⽣共晶转变0.50.20.9L βα+ ;2~3时, 发⽣脱熔转变α→βII .(2) 室温下, 合⾦I 的相组成物为α + β, 组织组成物为α + βII .相组成物相对量计算如下:αβ0.900.20100%82%0.900.050.200.05100%18%0.900.05w w -==--==- 组织组成物的相对量与相的⼀致.室温下, 合⾦II 的相组成物为α + β, 组织组成物为β初 + (α+β).相组成物相对量计算如下:αβ0.900.80100%12%0.900.050.800.05100%88%0.900.05w w -==--==- 组织组成物相对量计算如下:β(α+β)0.800.50100%75%0.900.500.900.80100%25%0.900.50w w -==--==-初 (3) 设合⾦的成分为w B = x , 由题意知该合⾦为过共晶成分, 于是有β0.50100%5%0.900.50x w -==-初所以, x = 0.52, 即该合⾦的成分为w B = 0.52.3. 计算w C 为0.04的铁碳合⾦按亚稳态冷却到室温后组织中的珠光体、⼆次渗碳体和莱⽒体的相对量, 并计算组成物珠光体中渗碳体和铁素体及莱⽒体中⼆次渗碳体、共晶渗碳体与共析渗碳体的相对量.解根据Fe-Fe 3C 相图, w C = 4%的铁碳合⾦为亚共晶铸铁, 室温下平衡组织为 P + Fe 3C II + L d ′, 其中P 和Fe 3C II 系由初⽣奥⽒体转变⽽来, 莱⽒体则由共晶成分的液相转变⽽成, 因此莱⽒体可由杠杆定律直接计算, ⽽珠光体和⼆次渗碳体则可通过两次使⽤杠杆定律间接计算出来.L d ′相对量: d L 4 2.11100%86.3%4.3 2.11w '-==-.Fe 3C II 相对量: 3II Fe C 4.34 2.110.77100% 3.1%4.3 2.11 6.690.77w --=??=--. P 相对量: P 4.34 6.69 2.11100%10.6%4.3 2.11 6.690.77w --=??=--. 珠光体中渗碳体和铁素体的相对量的计算则以共析成分点作为⽀点, 以w C = 0.001%和w C = 6.69%为端点使⽤杠杆定律计算并与上⾯计算得到的珠光体相对量级联得到.P 中F 相对量: F P 6.690.77100%9.38%6.690.001w w -=??=-. P 中Fe 3C 相对量: 3Fe C 10.6%9.38% 1.22%w =-=.⾄于莱⽒体中共晶渗碳体、⼆次渗碳体及共析渗碳体的相对量的计算, 也需采取杠杆定律的级联⽅式, 但必须注意⼀点, 共晶渗碳体在共晶转变线处计算, ⽽⼆次渗碳体及共析渗碳体则在共析转变线处计算.L d ′中共晶渗碳体相对量: d Cm L4.3 2.11100%41.27%6.69 2.11w w '-=??=-共晶 L d ′中⼆次渗碳体相对量: d Cm L 6.69 4.3 2.110.77100%10.2%6.69 2.11 6.690.77w w '--==--IIL d ′中共析渗碳体相对量: d Cm L 6.69 4.3 6.69 2.110.770.0218100% 3.9%6.69 2.11 6.690.77 6.690.0218w w '---==---共析 4. 根据下列数据绘制Au-V ⼆元相图. 已知⾦和钒的熔点分别为1064℃和1920℃. ⾦与钒可形成中间相β(AuV 3); 钒在⾦中的固熔体为α, 其室温下的熔解度为w V = 0.19; ⾦在钒中的固熔体为γ, 其室温下的熔解度为w Au = 0.25. 合⾦系中有两个包晶转变, 即1400V V V 1522V V V (1) β(0.4)L(0.25)α(0.27)(2) γ(0.52)L(0.345)β(0.45)w w w w w w =+===+== ℃℃解根据已知数据绘制的Au-V ⼆元相图参见附图4-3.附图4-3 Au-V ⼆元相图第五章材料中的扩散1. 设有⼀条直径为3cm 的厚壁管道, 被厚度为0.001cm 的铁膜隔开, 通过输⼊氮⽓以保持在膜⽚⼀边氮⽓浓度为1000 mol/m 3; 膜⽚另⼀边氮⽓浓度为100 mol/m 3. 若氮在铁中700℃时的扩散系数为4×10-7 cm 2 /s, 试计算通过铁膜⽚的氮原⼦总数.解设铁膜⽚左右两边的氮⽓浓度分别为c 1, c 2, 则铁膜⽚处浓度梯度为7421510010009.010 mol /m 110c c c c x x x --??-≈===- 根据扩散第⼀定律计算出氮⽓扩散通量为722732410(10)(9.010) 3.610 mol/(m s)c J D x---?=-=--?=?? 于是, 单位时间通过铁膜⽚的氮⽓量为 3-22-63.610(310) 2.5410 mol/s 4J A π-==?最终得到单位时间通过铁膜⽚的氮原⼦总数为-62318-1A () 2.5410 6.02102 3.0610 s N J A N =?==?第六章塑性变形1. 铜单晶体拉伸时, 若⼒轴为 [001] ⽅向, 临界分切应⼒为0.64 MPa, 问需要多⼤的拉伸应⼒才能使晶体开始塑性变形?解铜为⾯⼼⽴⽅⾦属, 其滑移系为 {111}<110>, 4个 {111} ⾯构成⼀个⼋⾯体, 详见教材P219中的图6-12.当拉⼒轴为 [001] ⽅向时, 所有滑移⾯与⼒轴间的夹⾓相同, 且每个滑移⾯上的三个滑移⽅向中有两个与⼒轴的夹⾓相同, 另⼀个为硬取向(λ = 90°). 于是, 取滑移系(111)[101]进⾏计算.ks cos cos cos cos 0.64 1.57 MPa.m m ?λ?λτσ========= 即⾄少需要1.57 MPa 的拉伸应⼒才能使晶体产⽣塑性变形.2. 什么是滑移、滑移线、滑移带和滑移系? 作图表⽰α-Fe, Al, Mg 中的最重要滑移系. 那种晶体的塑性最好, 为什么?答: 滑移是晶体在切应⼒作⽤下⼀部分相对于另⼀部分沿⼀定的晶⾯和晶向所作的平⾏移动; 晶体的滑移是不均匀的, 滑移部分与未滑移部分晶体结构相同. 滑移后在晶体表⾯留下台阶, 这就是滑移线的本质. 相互平⾏的⼀系列滑移线构成所谓滑移带. 晶体发⽣滑移时, 某⼀滑移⾯及其上的⼀个滑移⽅向就构成了⼀个滑移系.附图6-1 三种晶体点阵的主要滑移系α-Fe具有体⼼⽴⽅结构, 主要滑移系可表⽰为{110}<111>, 共有6×2 = 12个; Al具有⾯⼼⽴⽅结构, 其滑移系可表⽰为{111}<110>, 共有4×3 = 12个; Mg具有密排六⽅结构, 主要滑移系可表⽰为{0001}1120<>, 共有1×3 = 3个. 晶体的塑性与其滑移系的数量有直接关系, 滑移系越多, 塑性越好; 滑移系数量相同时, ⼜受滑移⽅向影响, 滑移⽅向多者塑性较好, 因此, 对于α-Fe, Al, Mg三种⾦属, Al的塑性最好, Mg的最差, α-Fe居中. 三种典型结构晶体的重要滑移系如附图6-1所⽰.3. 什么是临界分切应⼒? 影响临界分切应⼒的主要因素是什么? 单晶体的屈服强度与外⼒轴⽅向有关吗? 为什么?答:滑移系开动所需的作⽤于滑移⾯上、沿滑移⽅向的最⼩分切应⼒称为临界分切应⼒.临界分切应⼒τk的⼤⼩主要取决于⾦属的本性, 与外⼒⽆关. 当条件⼀定时, 各种晶体的临界分切应⼒各有其定值. 但它是⼀个组织敏感参数, ⾦属的纯度、变形速度和温度、⾦属的加⼯和热处理状态都对它有很⼤影响.如前所述, 在⼀定条件下, 单晶体的临界分切应⼒保持为定值, 则根据分切应⼒与外加轴向应⼒的关系: σs= τk/ m, m为取向因⼦, 反映了外⼒轴与滑移系之间的位向关系, 因此, 单晶体的屈服强度与外⼒轴⽅向关系密切. m越⼤, 则屈服强度越⼩, 越有利于滑移.4. 孪⽣与滑移主要异同点是什么? 为什么在⼀般条件下进⾏塑性变形时锌中容易出现挛晶, ⽽纯铁中容易出现滑移带?答:孪⽣与滑移的异同点如附表6-1所⽰.锌为密排六⽅结构⾦属, 主要滑移系仅3个, 因此塑性较差, 滑移困难, 往往发⽣孪⽣变形, 容易出现挛晶; 纯铁为体⼼⽴⽅结构⾦属, 滑移系较多, 共有48个, 其中主要滑移系有12个, 因此塑性较好, 往往发⽣滑移变形, 容易出现滑移带.第七章回复与再结晶1. 已知锌单晶体的回复激活能为8.37×104 J/mol, 将冷变形的锌单晶体在-50 ℃进⾏回复处理, 如去除加⼯硬化效应的25% 需要17 d, 问若在5 min 内达到同样效果, 需将温度提⾼多少摄⽒度?解根据回复动⼒学, 采⽤两个不同温度将同⼀冷变形⾦属的加⼯硬化效应回复到同样程度, 回复时间、温度满⾜下述关系:122111exp t Q t R T T =-- ? ?整理后得到221111ln T t R T Q t =+. 将41211223 K,/5/(172460),8.3710 J/mol, 8.314 J/(mol K)4896T t t Q R ==??==?=?代⼊上式得到2274.7 K T =.因此, 需将温度提⾼21274.722351.7 T T T ?=-=-=℃.2. 纯铝在553 ℃和627 ℃等温退⽕⾄完成再结晶分别需要40 h 和1 h, 试求此材料的再结晶激活能.解再结晶速率v 再与温度T 的关系符合阿累尼乌斯(Arrhenius)公式, 即exp()Q v A RT=-再其中, Q 为再结晶激活能, R 为⽓体常数.如果在两个不同温度T 1, T 2进⾏等温退⽕, 欲产⽣同样程度的再结晶所需时间分别为t 1, t 2, 则122112122111 exp[()]ln(/)t Q t R T T RTT t t Q T T =--?=- 依题意, 有T 1 = 553 + 273 = 826 K, T 2 = 627 + 273 = 900 K, t 1 = 40 h, t 2 = 1 h, 则58.314826900ln(40/1) 3.0810J/mol 900826Q =?-3. 说明⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能特点与主要区别.答: ⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能特点与主要区别详见附表7-1.附表7-1 ⾦属在冷变形、回复、再结晶及晶粒长⼤各阶段的显微组织、机械性能第⼋章固态相变。
固体中的相结构及形成规律

其中:PA、PB:表示A、B原子出现在正确位置上的几 率
XA、XB:A或B原子的摩尔分数 S=1,PA=PB=1,完全有序 S=0,PA=XA,PB=XB,完全无序
22
5.有序化对性能的影响: ① 通常提高硬度、强度、降低塑性——有序
强化; ② 电阻降低; ③ 影响铁磁性; ④ 影响弹性性质
23
五、固溶体的性质
1.固溶强化:固溶体的强度总是比组成它的纯组元高, 且随溶质原子浓度增加,强度也增加。
2.改变物理、化学性质 3.改变点阵常数
24
§2 金属间化合物(中间相) 一、正常价化合物:
由两种电负性差值较大的元素按通常的化学价 规律形成的化合物,其稳定性与两组元的电负性差值大小有
关,电负性差值越大,稳定性越高,愈接近离子键合,反之趋向于金属 键合。正常价化合物包括从离子键、共价键过渡到金属键为主的一系列 化合物,通常具有较高的强度和脆性,固溶度范围极小,在相图上为一 条垂直线。
三、原子尺寸因素化合物
2.拓扑密排相(TCP相) 如果用大小不同的两种原子进行最紧密堆垛,通过合
理搭配,就有可能获得全部或主要由四面体堆满整个 空间,达到空间利用率和配位数都更高的密堆结构, 但这些四面体不一定都是等棱四面体,这种密排结构 称“拓扑密堆结构”,配位数可达12、14、15、16。 典型的TCP相有: σ相,Laves相,x相和μ相。
链节。
47
48
链节的结构和成分代表高分子化合物的结构和 成分,当高分子化合物只有一种单体组成时, 单体的结构即为链节的结构,也是整个高分子 化合物的结构。
聚合度:高分子化合物的大分子链由链节组成, 链节的重复次数为聚合度n。设链节的相对分 子量为m,则 M=n×m
第二章 固溶体

2021/4/4
部完偏分完全聚有全有:序无A序-:序:有A全:原基部子本达 序到间分不有结布存序合在分能短布大距微状于观态 离—A小不长-范均B程原围匀有子内序间存,结原子 在达合—到能短一程定有原序子分数
第二章 固体中的相结构
10
§2.1 固溶体—有序固溶体
有序固溶体有确定的化学成分
Cu-Au合金:
部分合金元素在铁中的溶解度(质量分数)
元素 V Cr Mn Co Ni
晶体结构 体心立方 体心立方 面心立方(-Mn) 面心立方 面心立方
电负性 1.63 1.66 1.55 1.88 1.91
-Fe 1.4 12.8 100 100 100
-Fe 100 100 ~3 76 ~10
2021/4/4
36
§2.5 分化子合相物 —大分子相及对其分子构质成量
铁
55.8(相对原子质量)
低 无机 分
水 石英
18 60
子 有机
甲烷 苯
16 78
三硬脂酸甘油酯
890
天然纤维素
高 天然 分
丝蛋白 天然橡胶
子
合成
聚氯乙烯 聚甲基丙烯酸甲酯
尼龙66
~570,000 ~150,000 200,000~500,000
符合原子价规则.
间隙化合物—尺寸因素起主要作用.
主要影响因素:
电负性、电子浓度、原子尺寸
2021/4/4
第二章 固体中的相结构
13
§2.2 金属间化合物—正常价化合物
形成:金属元素+ⅤA,ⅥA,VIIA族元素构成,电 负性差起主要作用,对AmBn有: mec=n(8-eA).
键型:随电负性差的减小,分别形成离子键、 共价键、金属键; 电负性差越大,稳定性越高.
《材料科学基础》习题及参考答案

答案
2.试从晶体结构的角度,说明间隙固溶体、间隙相及
间隙化合物之间的区别。
答案
返回
3. 何谓玻璃?从内部原子排列和性能上看,
非晶态和晶态物质主要区别何在?
答案
4.有序合金的原子排列有何特点?这种排列
和结合键有什么关系?为什么许多有序合金
在高温下变成无序?
答案
5. 试分析H、N、C、B在Fe和Fe中形成固熔
6.离异共晶
答案
7.伪共晶
答案
8.杠杆定理
答案
返回
二、综合题
1.在图4—30所示相图中,请指出: (1) 水平线上反应的性质; (2) 各区域的组织组成物; (3) 分析合金I,II的冷却过程; (4) 合金工,II室温时组织组成物的相对量表达式。
答案
返回
2.固溶体合金的相图如下图所示,试根据相图确定: ①成分为ω(B)=40%的合金首
答案
返回
7. 根据图7-9所示的A1-Si共晶相图,试分析图中(a),(b),(c)3个金相组 织属什么成分并说明理由。指出细化此合金铸态组织的途径。
答案
返回
8. 青铜( Cu-Sn)和黄铜C Cu--fin)相图如图7-15(a),(b)所示:
①叙述Cu-10% Sn合金的不平衡冷却过程,并指出室温时的 金相组织。
化时是否会出现过热,为什么?
答案
3.欲获得金属玻璃,为什么一般选用液相线很陡,
从而有较低共晶温度的二元系?
答案
4.比较说明过冷度、临界过冷度、动态过冷度等
概念的区别。
答案
5.分析纯金属生长形态与温度梯度的关系。 答案
返回
6.简述纯金属晶体长大的机制。
西北工业大学材料科学基础考研课程试题集_百度文库

《材料科学基础》考试大纲一、考试内容1.工程材料中的原子排列(1)原子键合,工程材料种类;(2)原子的规则排列:晶体结构与空间点陈,晶向及晶面的特点及表示,金属的晶体结构,陶瓷的晶体结构。
(3)原子的不规则排列:点、线、面缺陷的类型及特征,位错的弹性性质,实际晶体中的位错。
2.固体中的相结构(1)固溶体的分类、性能及特征(2)金属间化合物的分类、性能及特征;(3)玻璃相性能及特征。
3.凝固与结晶(1)结晶的基本规律、基本条件;(2)晶核的形成与长大;(3)结晶理论的应用。
4.二元相图(1)相图的基本知识;(2)二元匀晶相图及固溶体的结晶,共晶相图及共晶转变,包晶相图及包晶转变;(3)二元相图的分析方法,其他类型二元相图及其应用,相图的热力学基础。
5.固体中的扩散:(1)扩散定律及其应用;(2)扩散的微观机理,影响扩散的因素;(3)扩散的热力学理论;(4)反应扩散。
6.塑性变形:(1)单晶体的塑性变形;(2)多晶体的塑性变形;(3)合金的塑性变形;(4)冷变形金属的组织与性能,超塑性。
7.回复与与结晶:(1)冷变形金属在加热时的变化;(2)回复机制;(3)再结晶及再结晶后的晶粒长大;(4)金属的热变形。
二、参考书目1. 《材料科学基础》(第二版),刘智恩,西北工业大学出版社,20032. 《材料科学基础》,胡庚祥,蔡珣,上海交通大学出版社,20003. 《材料科学基础》,石德珂,西安交通大学出版社,20004. 《材料科学基础》,潘金生,仝健民,清华大学出版社,19982004年西北工业大学硕士研究生入学试题一、简答题:(共40分,每小题8分)1、请简述间隙固溶体、间隙相、间隙化合物的异同点?2、请简述影响扩散的主要因素有哪些。
3、临界晶核的物理意义是什么?形成临界晶核的充分条件是什么?4、有哪些因素影响形成非晶态金属?为什么?5、合金强化途径有哪些?各有什么特点?二、计算、作图题:(共60分,每小题12分)1、求[11]和[20]两晶向所决定的晶面,并绘图表示出来。
2 固体中的相结构

(1)晶格畸变。 (2)偏聚与有序:取决于同类原子和异类原子间结合力 的相对大小。(EAA EBB EAB) 完全无序、偏聚、部分有序、完全有序。
图
固溶体中溶质原子分布示意图 b)偏聚 c)部分有序 d)完全有序
18
a)完全无序
固溶体中溶质的分布与同类原子(EAA、EBB)和 异类原子(EAB)的结合能有关: (1)如果EAA≈EBB ≈ EAB,则溶质原子趋向无序分 布; (2)如果(EAA+EBB )/2<EAB, 则溶质原子偏聚; (3)如果(EAA+EBB )/2>EAB, 则溶质原子呈部分有序 或完全有序;
23
2 电子化合物(电子相) (1)形成:电子浓度起主要作用,电子浓度相同, 则具有相同晶体结构,不符合原子价规则。 (教材P:48) (2)键型:金属键(金属-金属),有金属特性。 (3)组成:电子浓度对应晶体结构,可用化学式 表示,可形成以化合物为基的固溶体。 如:NiAl、FeAl等。
二、 金属间化合物(中间相)
氧化物陶瓷是典型的离子化合物。 有AB,AB2,A2B3,ABO3,AB2O4等结构。
第 三 节 陶 瓷
化钠是一种立方面心格子。其中阴离子按立方最紧密方式堆积,阳离子填充 于全部的八面体空隙中,阴、阳离子的配位数都为6。 闪锌矿型结构,如立方ZnS, 为立方晶系,ZnS是面心立方格子, 阴离子位于立方面心格子的节点位置, 而阳离子交错分布于立方体内的1/8 小立方体的中心。阳离子的配位数是 4,阴离子的配位数也是4。
8
一、 固溶体
按溶质原子位置不同,可分为 置换固溶体 和 间隙
固溶体。
溶质原子
溶剂原子
9
一、 固溶体
第2章 《材料科学》固体中的相结构

•在计算电子浓度时,各元素的原子价与其在周期表中的族数是一致 的,此数值与在化学反应中该元素所表现出来的化合价不完全一致, •在计算过渡族元素的原子价时遇到了困难和分歧,一般定为0价,也 有人认为在0~2价范围内变化。
§2.1.3 间隙固熔体
2.1.3 间隙固溶体
组成:原子半径较小(小于0.1nm)的非金属元素 (氢、硼、碳、氮、氧等)溶入金属晶体的间隙。 影响因素:
氧 化 铝 陶 瓷
§2.3.1 氧化物结构
(1)AB型化合物的结构
NaCl型、闪锌矿(立方ZnS)结构、硫锌矿(立方ZnS) 结构。
Zn Zn Cl 图 NaCl矿结构 Na 图 闪锌矿结构 S
S
图 硫锌矿结构
§2.3.1 氧化物结构
(2)AB2型化合物的结构
荧石(CaF2)(面心立方结构)、ThO2 、 UO2 、 CeO2 、 BaF2 、 PbF2 、 CrF2 。此外,还有金红石结构(TiO2 )。 萤石的熔点低,是陶瓷材料中的助熔剂,UO2是陶瓷核燃料。
(5)AB2O4型化合物的结构
主要结构是尖晶石(MgAl2O4型化合物),尖晶石属立方晶系。 在该型化合物中,A为二价正离子(例如Mg2+ 、Mn2+ 、Fe2+、 Co2+ 、Zn2+ 、Cd2+、Ni2+),B代表三价正离子(A13+ 、Cr3+ 、 Ga3+ 、Fe3+ 、Co3+ 等)。 正离子A和B的总电价为8,氧离子作面心立方最紧密排列, Mg2+进入四面体空隙,A13+则占据八面体空隙。
1
第二章 固体中的相结构
固体中的相结构

随溶质原子的增多,电阻升高。
例题2.1.1:p59
§2.2 金属间化合物
第
二
• 金属间化合物(中间相):金属与金属或金属与类金属之间所形成的化合物。
节
• 类型:
金 属
正常价化合物:符合原子价规则的化合物,AmBn
间
电子化合物(电子相):按照一定电子浓度值形成。
化
间隙化合物:受原子尺寸因素控制。
合
物
一
节 • 间隙固溶体:原子半径小于0.1nm的非金属元素溶入到溶剂金属晶体点阵的间隙中形成的
固
固溶体。
溶 体
• 溶解度一般都很小,只能形成有限固溶体。 • 典型间隙固溶体:
碳溶于γ-Fe、α-Fe形成固溶体
§2.1.4 有序固溶体
第 一
• 有序固溶体有确定的化学成
节
分,可用化学式表示。
固
• 有序化、有序化温度
§2.5.2 高聚物的结构
第 五
• 大分子链的构象
节
• 大分子的聚集态结构
分
无定形:
子 相
晶态:
§2.2.3 间隙化合物
第 二
• 受原子尺寸因素控制
节 • 形成元素:过渡族金属与原子半径很小的非金属元
金
素。
属
➢ 简单间隙化合物(间隙相):Rx/RM<0.59, 结
间 化
构简单。
合
金属原子呈现新结构,非金属原子位于其间隙,结
物
构简单。如面心立方VC
➢ 复杂间隙化合物: Rx/RM>0.59, 结构复杂。主
均加聚反应:由一种单体参与的加聚反应。生成均聚物。
共加聚反应:由两种或两种以上单体参与的加聚反应,生成共聚物。
相名词解释材料科学基础

相名词解释材料科学基础
在材料科学领域,"相"是一个基本概念,指的是具有相同晶体结构、化学成分和物理性质的微观区域。
相这个概念帮助我们理解和描述材料内部的均匀性和稳定性。
以下是关于材料科学基础中"相"的相关名词解释。
1.晶体相:指的是组成物质的原子、分子或离子按照一定的规律周期性排列,形成具有长程有序的固体结构。
晶体相具有固定的熔点,且其物理性质(如电导率、折射率等)具有各向异性。
2.非晶体相:是指原子没有长程的周期排列,无固定的熔点,物理性质各向同性的固体。
非晶体相的原子排列是无规则的,但在局部区域可能存在短程有序。
3.中间相:当两种元素组成的合金在冷却过程中,除了形成以某一元素为基的固溶体外,还可能形成晶体结构与两种元素均不相同的新相,这些相通常称为中间相。
它们在二元相图中位于两种基固溶体之间。
4.配位数:是指晶体结构中任一原子周围最近邻且等距离的原子数。
配位数反映了原子在晶体中的连接方式。
5.有序固溶体:是指当一种元素的原子溶解在另一种元素的晶体中时,溶质原子能够有序地排列在溶剂晶格中,形成的一种固溶体。
6.置换固溶体:溶质原子取代溶剂原子,占据溶剂晶格的阵点,形成的固溶体。
7.间隙固溶体:溶质原子分布于溶剂晶格间隙而形成的固溶体。
8.点阵畸变:指原子局部偏离其在理想晶格中的位置,造成点阵的畸变。
点阵畸变会影响材料的物理性质。
9.晶胞:是从点阵中取出的具有代表性的基本单元,用于描述晶体结构的基本单元。
这些名词是材料科学中描述相的基本术语,有助于我们深入理解材料的微观结构和性质。
固体中的相结构

二、异常长大
1. 基本原理
பைடு நூலகம்
(二次再结晶、三次再结晶)
细小弥散的第二相粒子——钉扎晶界——晶界迁移阻力↑
冷变形—变形织构—再结晶织构—位向差小——晶界迁移能力↓
热蚀沟——钉扎晶界——晶界迁移阻力↑
多数晶粒长大受阻
少数第二相溶解的晶界
少数再结晶织构中,非择优取向的晶粒 少数热蚀沟钉扎,但表面能较低的晶粒(某些位向) 少数再结晶后较大的晶粒
晶界迁移能力 ↑↑
少数晶粒快速长大
异常粗大的晶粒组织 性能恶化
镍基耐蚀合金Hastelloy G3合金二次再结晶
高纯Fe-3Si箔材 1200℃真空退火的二次再结晶
Mg-3Al-0.8Zn合金退火组织 a .正常再结晶,b. 晶粒长大,c. 二次再结晶
2.异常长大热力学及动力学
1)热力学 驱动力 —— 体系自由能下降 —— 总晶界能下降 + 总表面能下降 (某些特殊位向的晶粒表面自由能较低) 2)动力学 纯长大过程——先快后慢
3)再结晶织构
现象:
冷变形 形变织构
再结晶
保持原织构
材料中相的定义

材料中相的定义材料中相是指在固态材料中具有一定结构和组织的区域。
相是由一种或多种组分组成的,在微观尺度上呈现出一定的形态、结构和性质。
在晶体学中,相是具有相同结晶结构的物质区域。
在非晶态材料中,相可以被认为是无规则分布的结构区域。
相的存在对材料的性能、结构和行为具有重要的影响。
材料中相的分类材料中的相可以根据不同的特征进行分类,以下是一些常见的分类方式:1. 晶体相和非晶相晶体相是具有长程有序结构的材料相,它们的原子或分子按照规则的精确排列。
晶体相的特点是具有明确的晶体结构、定量的晶格参数和高度可重复的晶体平面。
非晶相则是指没有明确晶体结构的材料相,它们的原子或分子具有无规则的排列。
2. 同质相和异质相同质相是指材料中相同组分、相同结构的区域。
在同质相中,原子或分子的排列、结构和性质均相同。
异质相则是指在材料中不同的区域具有不同的组分、结构和性质。
3. 均匀相和非均匀相均匀相是指材料中各相的组分、结构和性质在微观尺度上均匀分布的相。
均匀相的存在使得材料具有均匀的性能。
非均匀相则是指材料中不同相的组分、结构和性质在微观尺度上不均匀分布的相。
非均匀相常常导致材料的非均匀性能。
4. 固溶相和相分离固溶相是指固态合金中的均匀相。
在固溶相中,不同组分的原子或分子相互溶解,并形成固溶体。
相分离则是指合金中的组分在固态下出现分离的现象。
相分离会导致合金的组织和性能发生变化。
5. 在位相变和回火相变在位相变是指材料中相变发生在原位的相变过程。
在位相变通常伴随着晶体结构的变化和相间界面的移动。
回火相变则是指材料在加热或冷却过程中经历的相变。
回火相变常常伴随着晶体结构和性能的变化。
材料中相的形成和演变材料中相的形成和演变受到多种因素的影响,以下是一些常见的影响因素:1. 温度和压力温度和压力是影响相稳定性和相变行为的重要因素。
在不同温度和压力条件下,相的形成和演变过程会发生变化。
温度和压力的变化使得相变的平衡条件和动力学过程发生改变。
材料学中相的定义

材料学中相的定义相是材料学中一个重要的概念,它指的是一种在物质中具有特定结构和组织的区域。
在材料的微观结构中,相是由具有相同物理和化学性质的原子、分子或离子组成的。
相的存在对于材料的性质和性能具有重要的影响,因此对相的研究是材料学的重要内容之一。
相的定义是指在材料中具有一定组织结构和成分的区域。
材料中的相可以是固相、液相或气相。
在固体材料中,相的形成是由于原子、离子或分子在空间上有序排列。
不同的相具有不同的晶体结构和组成,因此具有不同的物理和化学性质。
相的存在对于材料的性质和性能具有重要的影响。
例如,金属材料中晶粒的尺寸和形状会影响材料的力学性能和导电性能。
陶瓷材料中不同相的含量和分布会影响材料的热传导性能和机械强度。
在合金材料中,相的存在会影响材料的硬度、耐腐蚀性和热稳定性。
相的形成和变化是材料科学研究的重要内容之一。
相的形成是由于材料中的原子或分子之间的相互作用和排列方式。
在材料制备过程中,通过控制材料的组成和加工条件,可以控制相的形成和分布。
例如,通过合金化、热处理和机械变形等方法,可以在金属材料中形成不同的相结构,从而改变材料的性能。
相的变化是指在材料中相的组成、形状和分布发生改变的过程。
相的变化可以通过改变材料的温度、压力和成分来实现。
相的变化会导致材料的性质和性能发生变化。
例如,在金属材料中,通过改变温度可以引发固相相变,从而改变材料的硬度和强度。
在陶瓷材料中,相的变化可以影响材料的烧结和致密化过程,从而改变材料的力学性能和导电性能。
相的研究方法主要包括显微镜观察、X射线衍射、电子显微镜和热分析等技术。
通过这些方法,可以观察和分析材料中相的形貌、组成和分布,从而揭示相与材料性能之间的关系。
相是材料学中一个重要的概念,它指的是一种在物质中具有特定结构和组织的区域。
相的存在和变化对于材料的性质和性能具有重要的影响。
因此,对相的研究是材料学的重要内容之一。
通过研究相的形成和变化机制,可以为材料的设计和制备提供理论依据,进而实现材料性能的优化和改进。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6
7
8
9
2018/9/17
2
§2.1.2 置换固溶体
以 Cu 为 基 加入元素 化合价 固熔度 Zn 2 38.4 Gn 3 19.3 Ge 4 11.8 As 5 7 Cd 2 42 以 Ag 为 基 In 3 20 Sn 4 12 Sb 5 7
(6)
第 一 节 固 溶 体
当溶剂为一价面心立方金 属时,不同溶质的最大固 溶度对应的电子浓度具有 一定的极限值; 溶质元素原子价愈高,固 溶度愈小。
(8)
第 一 节 固 溶 体
1
3
4
5
6
7
8
9
2018/9/17
2
§2.1.4 有序固溶体
(9)
第 一 节 固 溶 体
有序固溶体有确定的化学成分,可用化学式表示。 有序化:从无序或短程有序状态转变为长程有序状态 的过程。 有序化温度:有序化的临界转变温度称为。
1
3
4
5
6
7
8
9
2018/9/17
• 相:任一给定的物质系统中,具有同一化学成分、 同一原子聚集态和性质的均匀连续组成部分。
相的分类:固溶体、化合物、陶瓷晶体相、玻璃相、 分子相。
1
3
4
5
6
7
8
9
2018/9/17
2
§2.1.1 什么是固溶体
(3)
第 一 节 固 溶 体
固溶体:固态下一种组元溶解在另一种组元中形成的 新相。晶格与溶剂晶格类型相同。 溶剂:晶格与固溶体相同的组元。 溶质: 固溶度:溶质原子在溶剂中的最大含量(极限溶解 度)。 固溶体基本特征: 保持原溶剂的晶体结构; 有一定的成份范围; 具有比较明显的金属性质。具有一定的导电和导热 性和一定的塑性等等。这表明,固溶体中的结合键 主要是金属键。
1 3 4 5
6
7
8
9
2018/9/17
2
§2.1.1 什么是固溶体
固溶体分类: 按溶质原子在溶剂点阵中的位置分: 置换固溶体、间隙固溶体 按溶解度分:无限固溶体、有限固溶体 按原子在点阵中排列的秩序性分: 无序固溶体、有序固溶体
(4)
第 一 节 固 溶 体
1
3
4
5
6
7
8
9
2018/9/17
2
§2.1.2 置换固溶体
(5)
第 • 置换固溶体:溶质原子位于晶格点阵位置的固溶体。 一 • Hume-Rothery三大经验规律: 节 溶剂、溶质原子半径之差与溶剂原子半径比超过14%~ 15%时,固溶度极为有限。 固 溶 溶剂和溶质的电化学性质相近。 体 固溶度与元素的原子价有关。 • 影响固溶度的因素 原子尺寸因素:原子半径差越小,固溶度越大。(表2-1) 晶体结构因素:结构相同,溶解度大;间隙原子在FCC中 溶解度大于BCC中溶解度。 负电性因素(化学亲和力):负电性差越大,溶解度大。 (负电性差很大时,形成化合物) 电子浓度因素:电子浓度e/a越大,溶解度越小。 c=e/a=xu +(1-x)v(电子浓度:合金中两个组元的价电子 总数和原子总数之比。)
• 性能特点:熔点、硬 度及脆性较高。
1
3
4
5
6
7
8
9
2018/9/17
2
§2.2.2 电子化合物
(13)
第 二 节 金 属 间 化 合 物
• 不遵守化合价规律,按一定电子浓度值形成。电子浓 度不同,晶格类型不同。 相: β γ ε 电子浓度: 3/2 21/13 21/12 结构: bcc 复杂立方 密排六方 • 键型:金属键(金属-金属),有金属特性。 • 可用化学式表示,但成分可在一定范围内变化,可以 形成以化合物为基的固溶体。 • 形成元素:ⅠB族或过渡族金属元素与ⅡB、ⅢA、 ⅣA族元素。 对含过渡族元素的电子化合物,计算电子浓度时,过 渡族元素的价电子数常视为零。
1 3 4 5
6
7
8
9
2018/9/17
2
§2.2 金属间化合物
(11)
第 二 节 金 属 间 化 合 物
• 金属间化合物(中间相):金属与金属或金属与类金 属之间所形成的化合物。 • 影响因素:电负性,电子浓度,原子尺寸 • 类型: 正常价化合物:符合原子价规则的化合物,AmBn 电子化合物(电子相):按照一定电子浓度值形成。 间隙化合物:受原子尺寸因素控制。
1
3
4
5
6
7
8
9
2018/9/17
2
§2.2.1 正常价化合物
(12)
第 二 节 金 属 间 化 合 物
• 符合原子价规则的化合物。AmBn,mec=n(8-eA) 有一定成分,可用化学分子式表示, 一般表示为AB或 AB2(A2B)。 • 电负性差对其形成其主要作用,差值越大,稳定性越 高。 • 键型:随电负性差的减小,分别形成离子键、共价键、 金属键。 • 形成元素:金属元素与ⅣA、ⅤA、ⅥA族元素。 • 结构:不同于组元。NaCl结构,CaF2结构
2
第二章 固体中的相结构
(1)
1
3
4
5
6
7
8
9
2018/9/17
2
基本概念
(2)
2 固 体 中 的 相 结 构
• 合金:两种或两种以上的金属,或金属与非金属经 一定方法合成的具有金属特性的物质。 • 组元:组成合金最基本的物质。(如一元、二元、 三元合金〕,可以是元素,也可以是化合物。 • 合金系:给定合金以不同的比例而合成的一系列不 同成分合金的总称。如Fe-C,Fe-Cr等。
1
3
4
5
6
7
8
9
2018/9/17
2
§2.1.3 间隙固溶体
(7)
第 一 •间隙固溶体:原子半径小于0.1nm的非金属元素溶 节 入到溶剂金属晶体点阵的间隙中形成的固溶体。 固 非金属元素:H, N, C , B, O 溶 •溶解度一般都很小,只能形成有限固溶体。 体 •典型间隙固溶体:
碳溶于γ-Fe(八面体间隙)、α-Fe形成固溶体
2
§2.1.5 固溶体的性能
(10)
第 一 固溶体的强度和硬度高于纯组元,塑性则较低。 节 • 固溶强化:由于溶质原子的溶入而引起的强化效应。 固 溶 体
间隙固溶体的强化效果高于置换固溶体 原因:柯氏气团钉扎位错 溶质和溶剂原子尺寸相差越大或固溶度越小,固溶 强化越明显。 • 有序强化:有序状态的强度高于无序状态。 EAB>EAA或EBB • 物理性能的变化: 随溶质原子的增多,电阻升高。 例题2.1.1:p59
1
3
4
5
6
7
8
92018/9ຫໍສະໝຸດ 172§2.1.4 有序固溶体
固溶体宏观上均匀,微观上 不均匀 出现偏聚,部分有序,完全 有序等情况。 取决于同类原子结合能(EAA , EBB)和异类原子间结合能 (EAB)的相对大小。
若EAA , EBB >EAB时,则有同 类原子的偏聚区; 若 EAA ,EBB <EAB时,则溶质 原子B在点阵中趋向于按 一定规 则呈有序分布。达到一定浓度时, 形成有序固溶体。
