化工反应工程答案_第二章
反应工程1,2章答案

若将A 的初始浓度均为3mol/h 若将A和B的初始浓度均为3mol/h 的原 料混合后进行反应,求反应4 min时 料混合后进行反应,求反应4 min时A的 转化率。 转化率。
习题2.4解题思路 习题2.4解题思路 2.4
习题2.1解题思路及答案 习题2.1解题思路及答案 2.1
利用反应时间与组分 的浓度变化数据, 先作出 CA~t的关系曲线,用镜面法求 得反应时间下的切线,即为水解速率, 切线的斜率 α。再由 rA=-dCA/dt求得水 解速率。 答案: 水解速率
习题2 习题2.2
在一管式反应器中等温下进行甲烷化反应: 在一管式反应器中等温下进行甲烷化反应:
习题2.4答案 习题2.4答案 2.4
A的转化率 XA=82.76%
习题2.5 习题2.5
氨合成塔入口的气体组成为3.5% 氨合成塔入口的气体组成为3.5%的 3.5 ,20.87% ,62.6% ,7.08% NH3,20.87%的 N2,62.6%的 H2,7.08% Ar,及5.89% CH4。该塔是在30 的Ar,及5.89%的CH4。该塔是在30 MPa 压力下操作。 压力下操作。已知催化剂床层中某处的 温度为490℃ 反应气体中氨含量为10 490℃, 温度为490℃,反应气体中氨含量为10 %(mol)。试计算该处的反应速率 mol)。试计算该处的反应速率。 %(mol)。试计算该处的反应速率。 Fe催化剂上氨合成反应速率式为 催化剂上氨合成反应速率式为: 在Fe催化剂上氨合成反应速率式为:
习题1.1 习题1.1
在银催化剂上进行甲醇氧化为甲醛的反应:
化学反应工程第二章习题答案

化学反应工程第二章习题答案化工103班2-1银催化剂上进行甲醇氧化为甲醛的反应2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇转化率达72%,甲醛的收率为69.2%,试计算:(1)反应的总选择性;(2)反应器出口组成。
解:根据甲醇:空气:水蒸气=2:4:1.3(摩尔比),以100mol进料为基准设χy分别为HCOH和co2生成量2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O对上式积分(n1)kct1cn1kcAcn1AOn111cn1n1AcA①0①式为无量纲对数形式可判别出kc的单位molm3n1kt111同理pn1pn1n1kn11ApAp的单位pa02-4在间歇反应器中进行等温二级、一级、零级均相反应,求出转化率由0变为0.9所需的时间,与转化率由0.9变为0.99所需时间之比。
解:等温二级反应111kt1ckt21AcA0cA2cA某A0.9某A0.999t190A0kcA0t1:t21:10等温一级反应ktlncA0cAln10同上解得t1t2kt1:t21:1等温零级反应ktcA0cA同上解得t10.9cA0A0kt20.09ck10:12-5某一反应在间歇反应器中进行,经8min后反应物转化了80%,经过18min后转化了90%,求表达此反应的动力学方程。
解dnrAAVdt积分后:tcA0dcArACcA0dcAcAcAn111n1n1AkcAkn1cA0cAt8min某A180%t18min某A290%28111kn1cn1cn1n1A0A01某A11811kn1cn11n1n1A0cA01某A2n2r2AkcA2-6某一气相一级反应A2RS,在恒温、恒压的实验反应器中进行,原料含75%A及25%惰性气体(摩尔比),经8min后其体积增加一倍。
求此时的转化率及该反应在此温度下的速率常数。
(完整版)化学反应工程课后习题答案.

积分之
2.10在催化剂上进行三甲基苯的氢解反应:
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。在0.1Mpa及523K下等温反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1)(1)此时反应器出口的气体组成。
(2)(2)若这两个反应的动力学方程分别为:
组分
摩尔分率yi0
摩尔数ni0(mol)
CH3OH
2/(2+4+1.3)=0.2740
27.40
空气
4/(2+4+1.3)=0.5479
54.79
水
1.3/(2+4+1.3)=0.1781
17.81
总计
1.000
100.0
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
组分
摩尔质量
摩尔分率yi
CO
28
15.49
H2
2
69.78
CO2
44
0.82
CH4
16
3.62
N2
28
10.29
总计
100
其中冷凝分离后气体平均分子量为
M’m=∑yiMi=9.554
又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A)
20
30
40
50
60
70
试求当进口原料气体流量为50ml/min时CO的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示
化学反应工程第二章答案

因 为 是 绝 热 放 热 反 应 , 非 等 温 反 应
VCSTR=10.5L
图HW2-6 polymath计算结果输出: CSTR体积V~X关系
X=0.68
(4) 如果在一个7.2L的P FR后面串联一个2.4L的CST R反应器, 可达到的转化率是多少 ? 解法1: 试差法 据(1)可知, P FR出口的转化率X 0.4, 即CST R反应器的入口转化率 in 0.4, X 所以CST R的出口转化率为 : X out V (rA ) out X in FA0 0.8 0.6 12.5 50 得 (1) 0.7 0.6 (rA ) out 50
(3) 在一个 .5L的CST R反应器中, 能达到的最大转化率是 10 多少? 解: 先将表格用 polymath 自动转换成以下形式
X 0 0.2 0.4 0ห้องสมุดไป่ตู้5
?
0.6 0.8 0.9
-rA (mol/L.min)
u=-1/rA (L.min/mol) V/FA0 (L.min/mol) VCSTR (L)
(采用P OLYMAT H )
CA0 VCSTR v0 r ( X 2 X 1 ) 15 (0.7 0.3)v0 6v0 A 2 V 15v0 由此可见, P FR在前时, 体积较小。
(2) 如果体积流率为 L/ min, 最小的总体积是多少 50 ? 解: Vmin 15v0 15 50L/ min 750L/ min (3) 有无比上述两个体系更 好的方案( 即不用上述两种方案 达到70%转化率时的 , 最小总体积) ? 解: 从图2 - 8a可知, 欲使总的反应器体积最 , 应采用P FR CST R P FR组合。 小 从图可知P FR1的出口转化率约为 .06, CST R出口转化率为 .65, P FR2 0 0 出口转化 率为0.7。 因此
2020年秋冬智慧树知道网课《化学反应工程》课后章节测试答案

第一章测试1【多选题】(20分)对化学工程师而言,化学反应工程知识非常重要,体现在A.化工新技术的前沿问题多集中于反应设备的开发和设计B.反应器的安全性和经济性往往决定着整套化工装置的成败C.通过化学反应过程,将廉价的原料转化为高价的产品D.反应器是化工生产过程的核心设备2【多选题】(20分)下列属于非均相催化反应的有A.煤在空气中的燃烧反应B.烃类的蒸汽裂解反应C.以钴基催化剂催化的合成气费托合成反应D.石油的流化催化裂化反应3【多选题】(20分)关于恒容反应和变容反应,以下说法正确的是A.温度、压力条件变化范围不大的液相反应可视为恒容反应B.在刚性容器中进行的气相反应属于恒容反应C.气相反应都是变容反应D.恒温、恒压变摩尔数的气相反应属于变容反应4【判断题】(10分)非基元反应是指的反应需要由至少2个计量方程描述的反应A.错B.对5【判断题】(10分)反应的计量方程都反映了实际的反应历程A.错B.对6【判断题】(10分)反应速率有多种定义方式,其间没有任何关系A.对B.错7【判断题】(10分)某反应的反应级数和反应的计量系数一致,表明其为基元反应A.错B.对第二章测试1【多选题】(10分)本章所学习的理想反应器包括哪几种?A.流化床反应器B.全混流反应器C.平推流反应器D.固定床反应器E.理想的间歇式反应器F.鼓泡床反应器2【多选题】(10分)关于一个反应器的物料衡算方程,以下说法正确的是:A.对着眼组分i的物料衡算方程表达为:单位时间内i组分流入控制体积的摩尔数=单位时间内流出控制体积的i的摩尔数+单位时间内控制体积内因反应而生成的i组分的摩尔数+单位时间内控制体积内累积的i组分的摩尔数B.方程中i组分累积的速率是指控制体积中i组分单位时间内增加的摩尔数C.对于任何反应器进行物料衡算,衡算控制体积可以随便选取。
化学反应工程习题答案

后
答
dcA ,有什么条件? dt
w.
案
网
co
m
1
《化学反应工程》第二版习题解答
A+C↔D 解
2 rA k1cA cB k2cC k3cA cC k4cD 2 rB 2k1cA cB 2k2cC
(1)
rD k3cA cC k4cD
2 rA k1cA cB k2cC 2 rB 2k1cA cB 2k2cC k3cBcC k4cD
p p rA k c c kc A B RT RT
ww
kP
kc 2.65 104 m 6 kmol 2s 1 ( RT )3 8.314kJ kmol1K 1 303K
kh
2
气 相 基 元 反 应 A+2B → 2P 在 30 ℃ 和 常 压 下 的 反 应 速 率 常 数 k c =2.65 × 104m6kmol-2s-1。现以气相分压来表示速率方程,即(−r A )=k P p A p B 2,求k P =? (假定气体为理想气体)
pA
3 pA0 2 pA
答
w.
25℃下测得下列数据,试确定该反应反 913.8 70.6 28.2 1188 65.3 22.9 ∞ 42.4 0 490.2 913.8 1188
5
ww
w.
以
解 由c A -c B =42.4 可知反应应按下列方式A+B→产物进行 设为二级反应
1 c c dcA ln A B0 kcA cB 积分得: kt cA0 cB0 cA0cB dt 1 c ln A 对 t 作图若为直线,则假设正确。 cA0 cB0 cB
《化学反应工程》(朱炳辰 第四版)课后习题第二章 答案详解

10
15
C
2 A
(
RT
)2
mol
/(g s)
7.696
10 15
8.314
2
773 2
10
12
C
2 A
3.1787
10
5
C
2 A
[
mol
/( g
s)]
k w 3.1787 10 5 [cm6 /(mol g s)]
kV P kw 0.8 3.1787105[cm3 /(mol s)]
2-7
西南科技大学应化 0902
2011-10-31
解:由
dcA dt
k cA K cA
可得, ( K
k
1 . cA
1 k )dcA
dt
即,
K k
lnc A
1 k
cA
t
代入表格中数据有, K ln 1 1 (1.0 10.0) 7.45103
k 10.0 k
K ln 0.25 1 (0.25 10.0) 9.56103 k 10.0 k
化学反应工程朱炳辰第四版课后习题第二章答案详解
西南科技大学应化 0902
2011-10-31
《化学反应工程》教材 P75-76 作业参考答案
2-5 解:(1)分别写出 a、c 为控制步骤的均匀吸附动力学方程;
(a) (1) rA=raA rdA=kaA pA0 kdA A
(2)
0=1+bA
1 pA+bB
1
n
yj yAN j / NA
n
y j 0.09
17 / M j
即 DAm
jA
DAj
jA
化学反应工程习题及答案二

1. 化学反应过程按操作方法分为_______、______、_______操作。
(分批式操作、连续式操作、半间歇式)2. 反应器的型式主要为(釜)式、(管)式、(塔)式、(固定)床和(流化)床。
3. 理想流动模型是指(平推流)模型和(全混流)模型。
5.间歇釜式反应器有效体积不但与(反应时间)有关,还与(非生产时间)有关。
6. 对于平行反应,提高反应物浓度,有利于(级数高)的反应,降低反应物浓度有利于(级数低)的反应。
化工生产中应用于均相反应过程的化学反应器主要有(釜式)反应器和(管式)反应器。
7. 平行反应AP(主)S(副)均为一级不可逆反应,若主E >副E ,选择性S p 与_______无关,仅是_______的函数。
(浓度、温度)主-副大于0,是吸热反应!8. 如果平行反应)()(副主S A P A →→均为一级不可逆反应,若主E >副E ,提高选择性P S 应_____。
(提高温度)9.理想反应器是指_______、_______。
[理想混合(完全混合)反应器、平推流(活塞流或挤出流)反应器]8.全混流反应器的返混_______。
(最大) 平推流反应器的返混为_______。
(零)9.对于循环操作的平推流反应器,当循环比β→0时为_______反应器,而当β→∞时则相当于_______反应器。
10.反应器物料的停留时间的分布曲线是通过物理示踪法来测定的,根据示踪剂的输入方式不同分为_______、_______、_______。
(脉冲法、阶跃法、周期示踪法)11.平推流管式反应器t t =时,E (t )=_______。
(∞)12.平推流管式反应器t t ≠时,E (t )=_______。
(0)13.平推流管式反应器t t ≥时,F (t )=_______。
(1)14.平推流管式反应器t <t 时,F (t )=_______。
(0)15.平推流管式反应器其E (θ)曲线的方差=2θσ_______。
化学反应工程基础课后习题答案

第二章化学反应工程基础1.说明聚合反应工程的研究内容及其重要性。
研究内容:①以工业规模的聚合过程为对象,以聚合反应动力学和聚合体系传递规律为基础;②将一般定性规律上升为数学模型,从而解决一般技术问题到复杂反应器设计,放大等提供定量分析方法和手段;③为聚合过程的开发,优化工艺条件等提供数学分析手段。
简而言之:聚合反应工程研究内容为:进行聚合反应器最佳设计;进行聚合反应操作的最佳设计和控制。
2.动力学方程建立时,数据收集方式和处理方式有哪些?收集方式:化学分析方法,物理化学分析方法处理方式:积分法,微分法。
3.反应器基本要求有哪些①提供反应物料进行反应所需容积,保证设备一定生产能力;②具有足够传热面积;③保证参加反应的物料均匀混合4.基本物料衡算式,热量衡算式①物料衡算:反应物A流入速度-反应物A流出速度-反应物A反应消失速度-反应物A积累速度=0(简作:流入量-流出量-消失量-积累量=0)②热量衡算:随物料流入热量-随物料流出热量-反应系统与外界交换热量+反应过程的热效应-积累热量=05.何谓容积效率?影响容积效率的因素有哪些工业上,衡量单位反应器体积所能达到的生产能力称之为容积效率,它等于在同一反应,相同速度、产量、转化率条件下,平推流反应器与理论混合反应器所需总体积比:η=Vp/Vm=τp/τm。
影响因素:反应器类型,反应级数,生产过程中转化率有关6.何为平推流和理想混合流?①反应物料在长径比很大的反应器中流动时,反应器内每一微元体积中流体均以同样速度向前移动,此种流动形态称平推流;②由于反应器强烈搅拌作用,使刚进入反应器物料微元与器内原有物料元瞬时达到充分混合,使各点浓度相等且不随时间变化,出口流体组成与器内相等此流动形态称理想混合流。
7.实现反应器的热稳定操作需满足哪些条件?①Qr=Qc,Qr体系放出热量;②dQc/dT>dQr/dT,Qc 除热量;③△T=T-Tw<RT2/E,E 反应活化能,T 反应器温度,Tw 冷却液温度8.何为返混?形成返混的主要原因有哪些?返混:指反应器中不同年龄的流体微元间的混合;原因:①由于物料与流向相反运动所造成,②由于不均匀的速度分布所引起的,③由于反应器结构所引起死角、短路、沟流、旁路等。
化学反应工程试题库和答案(精心整理)

化学反应工程考试题库(分三个部分)(一)(综合章节)复习题一、填空题:1.所谓“三传一反”是化学反应工程学的基础,其中“三传”是指质量传递、热量传递和动量传递,“一反”是指反应动力学。
2.各种操作因素对于复杂反应的影响虽然各不相同,但通常温度升高有利于活化能高的反应的选择性,反应物浓度升高有利于反应级数大的反应的选择性。
3.测定非理想流动的停留时间分布函数时,两种最常见的示踪物输入方法为脉冲示踪法和阶跃示踪法。
4.在均相反应动力学中,利用实验数据求取化学反应速度方程式的两种最主要的方法为积分法和微分法。
5.多级混合模型的唯一模型参数为串联的全混区的个数N ,轴向扩散模型的唯一模型参数为Pe(或Ez / uL)。
6.工业催化剂性能优劣的三种最主要的性质是活性、选择性和稳定性。
7.平推流反应器的E函数表达式为,()0,t tE tt t⎧∞=⎪=⎨≠⎪⎩,其无因次方差2θσ=0 ,而全混流反应器的无因次方差2θσ= 1 。
8.某反应速率常数的单位为m3 / (mol⋅ hr ),该反应为 2 级反应。
9.对于反应22A B R+→,各物质反应速率之间的关系为 (-r A):(-r B):r R= 1:2:2 。
10.平推流反应器和全混流反应器中平推流更适合于目的产物是中间产物的串联反应。
11.某反应的计量方程为A R S→+,则其反应速率表达式不能确定。
12.物质A按一级不可逆反应在一间歇反应器中分解,在67℃时转化50%需要30 min, 而在80 ℃时达到同样的转化率仅需20秒,该反应的活化能为 3.46×105 (J / mol ) 。
13.反应级数不可能(可能/不可能)大于3。
14. 对于单一反应,在相同的处理量和最终转化率条件下,选择反应器时主要考虑 反应器的大小 ;而对于复合反应,选择反应器时主要考虑的则是 目的产物的收率 ; 15. 完全混合反应器(全混流反应器)内物料的温度和浓度 均一 ,并且 等于(大于/小于/等于)反应器出口物料的温度和浓度。
反应工程第二版完整答案(可编辑)

反应工程第二版完整答案(可编辑)反应工程第二版完整答案1 绪论11在银催化剂上进行甲醇氧化为甲醛的反应进入反应器的原料气中甲醇空气水蒸气 2413摩尔比反应后甲醇的转化率达72甲醛的收率为692试计算1 反应的选择性2 反应器出口气体的组成解1由17式得反应的选择性为2进入反应器的原料气中甲醇空气水蒸气 2413摩尔比当进入反应器的总原料量为100mol时则反应器的进料组成为组分摩尔分率yi0 摩尔数ni0 mol CH3OH 22413 027402740 空气 42413 05479 5479 水132****17811781 总计 1000 1000 设甲醇的转化率为XA甲醛的收率为YP根据13和15式可得反应器出口甲醇甲醛和二氧化碳的摩尔数nAnP和nc分别为nA nA0 1-XA 7672 molnP nA0YP 1896 molnC nA0 XA-YP 07672 mol结合上述反应的化学计量式水nW氧气nO和氮气nN的摩尔数分别为nW nW0nP2nC 3830 molnO nO0-12nP-32nC 08788 molnN nN0 4328 mol所以反应器出口气体组成为组分摩尔数mol 摩尔分率 CH3OH 7672 6983 HCHO1896 1726 H2O 383 3487 CO2 07672 06983O2 08788 07999 N2 4328 39391 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇其主副反应如下由于化学平衡的限制反应过程中一氧化碳不可能全部转化成甲醇为了提高原料的利用率生产上采用循环操作即将反应后的气体冷却可凝组份变为液体即为粗甲醇不凝组份如氢气及一氧化碳等部分放空大部分经循环压缩机后与原料气混合返回合成塔中下图是生产流程示意图原料气 Bkgh 粗甲醇 Akmolh100kmol放空气体原料气和冷凝分离后的气体组成如下mol组分原料气冷凝分离后的气体 CO 2682 1549 H26825 6978 CO2 146 082 CH4 055 362N2 292 1029 粗甲醇的组成为CH3OH 8915 CH3 2O355C3H9OH 110H2O 620均为重量百分率在操作压力及温度下其余组分均为不凝组分但在冷凝冷却过程中可部分溶解于粗甲醇中对1kg粗甲醇而言其溶解量为CO2 982gCO 938gH2 176gCH4 214gN2538g若循环气与原料气之比为72摩尔比试计算1 一氧化碳的单程转换率和全程转化率2 甲醇的单程收率和全程收率解1设新鲜原料气进料流量为100kmolh则根据已知条件计算进料原料气组成以质量分率表示如下组分摩尔质量 yi0 mol Fi0 kmolh 质量分率xi0 CO 282682 2682 7205 H2 2 6825 6825 131 CO2 44146 146 6164 CH4 16 055 055 08443 N2 28292 292 7844 总计 100 100 100 其中xi yiMi?yiMi进料的平均摩尔质量Mm ?yiMi 1042kgkmol经冷凝分离后的气体组成亦即放空气体的组成如下组分摩尔质量摩尔分率yi CO 28 1549 H2 2 6978CO2 44 082 CH4 16 362 N2 28 1029 总计 100 其中冷凝分离后气体平均分子量为Mm ?yiMi 9554又设放空气体流量为Akmolh粗甲醇的流量为Bkgh对整个系统的N2作衡算得538B28×100001029A 292 A对整个系统就所有物料作衡算得100×1042 B9554A B联立AB两个方程解之得A 2691kmolhB 7852kgh 反应后产物中CO摩尔流量为FCO 01549A938B 28×1000将求得的AB值代入得FCO 4431 kmolh故CO的全程转化率为由已知循环气与新鲜气之摩尔比可得反应器出口处的CO摩尔流量为FCO0 100×0268272×100×01549 1384 kmolh所以CO的单程转化率为产物粗甲醇所溶解的CO2COH2CH4和N2总量D为粗甲醇中甲醇的量为B-D X甲Mm 7852-002848B ×0891532 2125 kmolh所以甲醇的全程收率为Y总 21252682 7924甲醇的单程收率为Y单 21251384 15362 反应动力学基础21在一体积为4L的恒容反应器中进行A的水解反应反应前 A的含量为1223重量混合物的密度为1gmL反应物A的分子量为88在等温常压下不断取样分析测的组分A的浓度随时间变化的数据如下反应时间h 10 20 30 40 50 60 70 80 90 CA molL 09061 042 028 017 012 008 0045 003 试求反应时间为35h的A的水解速率解利用反应时间与组分A的浓度变化数据作出CA,t的关系曲线用镜面法求得t 35h时该点的切线即为水解速率切线的斜率为由26式可知反应物的水解速率为22在一管式反应器中常压300?等温下进行甲烷化反应催化剂体积为10ml原料气中CO的含量为3其余为N2H2气体改变进口原料气流量Q0进行实验测得出口CO的转化率为Q0 mlmin 833 676 500 385 294 222 X20 30 40 50 60 70 试求当进口原料气体流量为50mlmin时CO的转化速率解是一个流动反应器其反应速率式可用27式来表示故反应速率可表示为用XA,VRQ0作图过VRQ0 020min的点作切线即得该条件下的dXAd VRQ0 值α VRQ0min 012 0148 020 026 034 045 XA 200300 400 500 600 700故CO的转化速率为23已知在Fe-Mg催化剂上水煤气变换反应的正反应动力学方程为式中yCO和yCO2为一氧化碳及二氧化碳的瞬间摩尔分率01MPa压力及700K时反应速率常数kW等于00535kmolkgh如催化剂的比表面积为30m2g堆密度为113gcm3试计算1 以反应体积为基准的速率常数kV2 以反应相界面积为基准的速率常数kg3 以分压表示反应物系组成时的速率常数kg4 以摩尔浓度表示反应物系组成时的速率常数kC解利用210式及228式可求得问题的解注意题中所给比表面的单位换算成m2m3 24在等温下进行液相反应AB?CD在该条件下的反应速率方程为若将A和B的初始浓度均为3moll的原料混合进行反应求反应4min时A的转化率解由题中条件知是个等容反应过程且A和B的初始浓度均相等即为15moll故可把反应速率式简化得由26式可知代入速率方程式化简整理得积分得解得XA 827625氨合成塔入口的气体组成为35NH3208N2626H2708Ar及589CH4该塔是在30MPa压力下操作已知催化剂床层中某处的温度为490?反应气体中氨含量为10mol试计算该处的反应速率在Fe催化剂上氨合成反应速率式为逆反应的活化能450?时且490?时Kp可按下式计算注m3为标准立方米解题中给出450?时的k2值而反应是在490?下故首先要求出490?时的k2值利用227试求出频率因子A490?的Kp值由题给公式计算出求k1值求各组分的分压值各组分的分率及分压值为NH3 10 pNH3 3MPa N2 1906 pN2 5718MPa H2 5718pH2 1715MPa Ar CH4 1379 pAr CH4 4137MPa 反应速率为26下面是两个反应的T-X图图中AB是平衡曲线NP是最佳温度曲线AM是等温线HB是等转化率线根据下面两图回答1 是可逆反应还是不可逆反应2 是放热反应还是吸热反应3 在等温线上ADOEM点中哪一点速率最大哪一点速率最小4 在等转化率线上HCROF及B点中哪一点速率最大哪一点速率最小5 在CR两点中谁的速率大6 根据图中所给的十点中判断哪一点速率最大解图21 图221可逆反应可逆反应2放热反应吸热反应3 M点速率最大A点速率最小 M点速率最大A点速率最小4 O点速率最大B点速率最小 H点速率最大B点速率最小5 R点速率大于C点速率 C点速率大于R点速率6 M点速率最大根据等速线的走向来判断HM点的速率大小27在进行一氧化碳变换反应动力学研究中采用B106催化剂进行试验测得正反应活化能为如果不考虑逆反应试问反应温度是550?时的速率比反应温度是400?时的速率大多少倍解从题中可知反应条件除了温度不同外其它条件都相同而温度的影响表现在反应速率常数k上故可用反应速率常数之比来描述反应速率之比28常压下在钒催化剂上进行SO2氧化反应原料气组成为7O2及82N2试计算转化率为80时的最佳温度二氧化硫在钒催化剂上氧化的正反应活化能为化学计量数等于2反应式为其平衡常数与温度的关系为该反应的热效应解1求出转化率为80时各组分的分压以100mol为基准x SO2 O2 SO3 N2 ? 0 70 110 0 820 1000080 7 1-080 14 11-56×05 82 560 820 9722求与上述组成对应的平衡常数KP值3 求平衡温度Te4 利用231式求逆反应活化能值5 利用231式求最佳温度TOP29在一恒容反应器中进行下列液相反应式中rRrD分别表示产物R及D的生成速率反应用的原料为A与B的混合物其中A的浓度为2kmolm3试计算A的转化率达到95时所需的反应时间解反应物A的消耗速率应为两反应速率之和即利用26式积分之210在催化剂上进行三甲基苯的氢解反应反应器进口原料气组成为6667H23333三甲基苯在01Mpa及523K下等温反应当反应器出口三甲基苯的转化率为80时其混合气体的氢含量为20试求1 此时反应器出口的气体组成2 若这两个反应的动力学方程分别为则出口处二甲基苯的生成速率是多少解以100mol为计算基准设X为三甲基苯的转化率Y为生成的甲苯摩尔数1 用物料衡算求出口气体组成组分名称 X 0时 X 08时三甲基苯 A 3333 33331-X氢B 6667 6667-3333X-Y 二甲基苯 C 0 3333X-Y甲烷 D 0 3333XY 甲基苯E 0 Y ? 10001000 由题给条件可知混合气中氢的含量为20所以有6667-3333X-Y 20解得Y 6667-3333×08-20 2001kmol甲苯量生成的二甲基苯量3333×08-2001 6654kmol生成的甲烷量3333×082001 4667kmol剩余的三甲基苯量3333×1-08 6666kmol氢气含量为20kmol故出口尾气组成为三甲基苯6666氢气20二甲基苯6654甲烷4667甲基苯20012 由题给条件可知三甲基苯的出口浓度为211在210?等温下进行亚硝酸乙脂的气相分解反应该反应为一级不可逆反应反应速率常数与温度的关系为若反应是在恒容下进行系统的起始总压为01013MPa采用的是纯亚硝酸乙脂试计算亚硝酸乙脂分解率为80时亚硝酸乙脂的分解速率及乙醇的生成速率若采用恒压反应乙醇的生成速率又是多少解1恒容过程其反应式可表示为反应速率式表示为设为理想气体反应物A的初始浓度为亚硝酸乙脂的分解速率为乙醇的生成速率为2恒压过程由于反应前后摩尔数有变化是个变容过程由249式可求得总摩尔数的变化由于反应物是纯A故有yA0 1由252式可求得组分的瞬间浓度乙醇的生成速率为212甲烷与水蒸气在镍催化剂及750?等温下的转化反应为原料气中甲烷与水蒸气的摩尔比为14若这个反应对各反应物均为一级已知k2lmols试求1 反应在恒容下进行系统的初始总压为01013MPa当反应器出口的CH4转化率为80时CO2和H2的生成速率是多少2 反应在恒压下进行其他条件如1CO2的生成速率又是多少解1由题意可将反应速率表示为对于恒容过程则有当XA0 08时2对于恒压过程是个变容反应过程由249式可求得总摩尔数的变化反应物A的原始分率由252式可求得转化率为80时的浓度213在473K等温及常压下进行气相反应123式中CA为反应物A的浓度moll原料中A和惰性气体各为一半体积比试求当A的转化率达85时其转化速率是多少解方法1先求出总摩尔变化数首先将产物的生成速率变为对应的反应物的转化速率总反应速率为以一摩尔反应物A为基准总摩尔变化数为初始浓度为则有方法2可将CA表示为方法3利用物料衡算可分别求出反应物A生成R及S的瞬间选择性SRSS因而可求出产物R及S的收率yRyS求得A转化率为85时的分率其中214在Pt催化剂上进行异丙苯分解反应以AB及R分别表示异丙苯苯及丙烯反应步骤如下 123若表面反应为速率控制步骤试推导异丙苯分解的速率方程解根据速率控制步骤及定态近似原理除表面反应外其它两步达到平衡描述如下以表面反应速率方程来代表整个反应的速率方程由于将代入上式得整理得将代入速率方程中其中215在银催化剂上进行乙烯氧化反应化作其反应步骤可表示如下1234若是第三步是速率控制步骤试推导其动力学方程解根据速率控制步骤及定态近似原理除表面反应步骤外其余近似达到平衡写出相应的覆盖率表达式整个反应的速率方程以表面反应的速率方程来表示根据总覆盖率为1的原则则有或整理得将代入反应速率方程得其中216设有反应其反应步骤表示如下 123若1速率控制步骤试推导其动力学方程解先写出各步的速率式由于1是速率控制步骤第2步是不可逆反应其反应速率应等于1的吸附速率故有整理得根据定态近似原则因为将代入上式化简后得最后将代入吸附速率式即为该反应的动力学方程式217一氧化碳变换反应在较低温度下其动力学方程可表示为试拟定该反应的合适的反应步骤解根据题意假设反应步骤如下并假设第二步是控制步骤其速率方程就代表了整个反应的速率方程其余的两步可认为达到平衡则有由于有将代入速率式得式中故上述假定与题意符合但上述假定的反应步骤不是唯一的 com试用积分法和微分法求其动力学方程解先用积分法求其动力学方程设为一级不可逆反应其速率表达式为积分得用,t作图t h 0 1 2 3 4 5 6 7 8 9 0044208311253160921082457286234383843 作图得一直线其斜率为0425h-1故假设一级反应是合理的其动力学方程可表示为用微分法求解动力学方程首先用CA,t曲线在曲线上取时间为0129h所对应点的切线为了准确可采用镜面法求得各切线的斜率即为对应的dCAdt之值然后再以dCAdt,CA作图所求的dCAdt值如下表所示t h 0 1 2 3 4 5 6 7 8 9 CA moll 140090 061 040 028 017 012 008 0045 003dCAdt mollh 070 045 0295 0191 0147 0095 0060033 0025 0015 设为一级不可逆反应用dCAdt,CA作图得一直线其斜率为05h-1其动力学方程可表示为或将速率方程直线化即两边取对数得可简化为y bax形式利用多元回归可求得反应级数n 1004?1反应速率常数值为k 04996还可用一数学公式来拟合CA,t曲线然后再将该数学公式对t求导求得dCAdt之值此法会比作图法来的准确219在Ni催化剂上进行甲烷化反应由实验测得200?时甲烷的生成速率RCH4及CO和H2的分压pCOpH 2的关系如下pCO MPa 010 018 0408 072 105 pH2 MPa01013 01013 01013 01013 01013 RCH4若该反应的动力学方程可用幂函数表示试用最小二乘法求一氧化碳的反应级数及正反应速率常数解由题意可写出速率方程式但由于氢的分压保持为01013MPa的恒定值反应速率式可简化为式中将速率式直线化或式中由残差平方和最小而导出最小二乘法的系数计算式序号 y x x2 xy 1 -4916 -2303 5302 1132 2-4328 -1715 2941 7421 3 -3507 -0897 0804 31444 -2941 -0329 0108 09665 -2564 -0049 0002 -0125-1826 -5293 9157 2273 将累加值代入ab系数式中得220在铂催化剂上乙烯深度氧化的动力学方程可表示为式中pApB分别表示乙烯及氧的分压在473K等温下的实验数据如下号pA×103MPa pB×103MPa r×104molgmin 1 89903230 0672 2 1422 3000 1072 3 8860 40800598 4 8320 2030 0713 5 4370 0890 06106 7750 1740 08347 7750 1820 0828 8 61701730 0656 9 6130 1730 0694 10 6980 15600791 11 2870 1060 0418 试求该温度下的反应速率常数k和吸附平衡常数KB解首先将动力学方程式直线化或y bax其中序号y x×103 x2×105 xy×103 r″×104 δ 10657 3320 1043 2123 0678 090 2 0631 30000900 1892 1126 50 3 0778 4080 1665 3172 056850 4 0487 2020 0412 0988 0829 163 5 02530890 0079 0225 0582 46 6 0402 1740 0303 07000833 01 7 0413 1820 0331 0751 0816 14 80403 1730 0299 0698 0665 14 9 0391 1730 02990676 0661 48 10 0371 1560 0243 0579 0787 0511 0270 1060 0112 0286 0369 117 ? 5056 22875668 1209平均偏差结果是令人满意的3 釜式反应器31在等温间歇反应器中进行乙酸乙酯皂化反应该反应对乙酸乙酯及氢氧化钠均为一级反应开始时乙酸乙酯及氢氧化钠的浓度均为002moll反应速率常数等于56lmolmin要求最终转化率达到95试问1 当反应器的反应体积为1m3时需要多长的反应时间2 若反应器的反应体积为2m3所需的反应时间又是多少解12 因为间歇反应器的反应时间与反应器的大小无关所以反应时间仍为283h32拟在等温间歇反应器中进行氯乙醇的皂化反应以生产乙二醇产量为20?h使用15重量的NaHCO3水溶液及30重量的氯乙醇水溶液作原料反应器装料中氯乙醇和碳酸氢钠的摩尔比为11混合液的比重为102该反应对氯乙醇和碳酸氢钠均为一级在反应温度下反应速率常数等于52lmolh要求转化率达到951 若辅助时间为05h试计算反应器的有效体积2 若装填系数取075试计算反应器的实际体积解氯乙醇碳酸氢钠和乙二醇的分子量分别为80584 和 62kgkmol每小时产乙二醇2062 03226 kmolh每小时需氯乙醇每小时需碳酸氢钠原料体积流量氯乙醇初始浓度反应时间反应体积2 反应器的实际体积33丙酸钠与盐酸的反应为二级可逆反应对丙酸钠和盐酸均为一级在实验室中用间歇反应器于50?等温下进行该反应的实验反应开始时两反应物的摩尔比为1为了确定反应进行的程度在不同的反应时间下取出10ml反应液用0515N的NaOH溶液滴定以确定未反应盐酸浓度不同反应时间下NaOH溶液用量如下表所示时间min 0 10 20 30 50 ? NaOH用量ml 522 321235 189 144 105 现拟用与实验室反应条件相同的间歇反应器生产丙酸产量为500kgh且丙酸钠的转化率要达到平衡转化率的90试计算反应器的反应体积假定1原料装入以及加热至反应温度50?所需的时间为20min且在加热过程中不进行反应2卸料及清洗时间为10min3反应过程中反应物密度恒定解用ABRS分别表示反应方程式中的四种物质利用当量关系可求出任一时刻盐酸的浓度也就是丙酸钠的浓度因为其计量比和投量比均为11为于是可求出A的平衡转化率现以丙酸浓度对时间作图由上图当CA 00515×147moll时所对应的反应时间为48min由于在同样条件下间歇反应器的反应时间与反应器的大小无关所以该生产规模反应器的反应时间也是48min丙酸的产量为500kgh 1126molmin所需丙酸钠的量为1126072 1564molmin原料处理量为反应器体积实际反应体积34在间歇反应器中在绝热条件下进行液相反应其反应速率方程为式中组分A及B的浓度CA及CB以kmolm3为单位温度T的单位为K该反应的热效应等于-4000kJkmol反应开始时溶液不含R组分A和B的浓度均等于004kmolm3反应混合物的平均热容按4102kJm3K计算反应开始时反应混合物的温度为50?1 试计算A的转化率达85时所需的反应时间及此时的反应温度2 如果要求全部反应物都转化为产物R是否可能为什么解 1由数值积分得出2 若A全部转化为R即XA 10则由上面的积分式知t??这显然是不可能的35在间歇反应器中进行液相反应A的初始浓度为01kmolm3CD的初始浓度为零B过量反应时间为t1时CA 0055kmolm3CC 0038 kmolm3而反应时间为t2时CA 001 kmolm3CC 0042kmolm3试求1 k2k12 产物C的最大浓度3 对应C的最大浓度时A的转化率解 1 因为B过量所以恒容时ABB式除以A式得解此微分方程得C将t1CACC及t2CACC数据代入C式化简得解之得2 先求出最大转化率3 产物C的最大收率产物C的最大浓度36 在等温间歇反应器中进行液相反应初始的反应物料中不含A2和A3A1的浓度为2moll在反应温度下k1 40min-1k2 36min-1k3 15min-1试求1 反应时间为10min时反应物系的组成2 反应时间无限延长时反应物系的组成3 将上述反应改为反应时间无限延长时反应物系的组成解根据题中给的两种反应情况可分别列出微分方程然后进行求解但仔细分析这两种情况其实质是下述反应的特例A 当时A式变为B 当时A式变为C 当时A式变为D 其中式D即为书讲的一级不可逆连串反应可见只要得到A式的解则可容易化简得到B C 及 D 式的解对于 A 式可列出如下微分方程组123由题意知初始条件为4 联立求解此微分方程组可得567 式中由如下式确定89 现在可用上述结果对本题进行计算1由5,9式得2当t??时由5,9式得3此时为的情况当t??时由得37拟设计一反应装置等温进行下列液相反应目的产物为RB的价格远较A贵且不易回收试问1 如何选择原料配比2 若采用多段全混流反应器串联何种加料方式最好3 若用半间歇反应器加料方式又如何解1由上式知欲使S增加需使CA低CB高但由于B的价格高且不易回收故应按主反应的计量比投料为好2保证CA低CB高故可用下图所示的多釜串联方式3用半间歇反应器若欲使CA低CB高可以将B一次先加入反应器然后滴加A 38在一个体积为300l的反应器中86?等温下将浓度为32kmolm3的过氧化氢异丙苯溶液分解生产苯酚和丙酮该反应为一级反应反应温度下反应速率常数等于008s-1最终转化率达989试计算苯酚的产量1 如果这个反应器是间歇操作反应器并设辅助操作时间为15min2 如果是全混流反应器3 试比较上二问的计算结果4 若过氧化氢异丙苯浓度增加一倍其他条件不变结果怎样解1苯酚浓度苯酚产量2全混流反应器苯酚产量3说明全混釜的产量小于间歇釜的产量这是由于全混釜中反应物浓度低反应速度慢的原因4由于该反应为一级反应由上述计算可知无论是间歇反应器或全混流反应器其原料处理量不变但由于CAB增加一倍故C苯酚也增加一倍故上述两个反应器中苯酚的产量均增加一倍39在间歇反应器中等温进行下列液相反应rD及rR分别为产物D及R的生成速率反应用的原料为A及B的混合液其中A 的浓度等于2kmolm31 计算A的转化率达95时所需的反应时间2 A的转化率为95时R的收率是多少3 若反应温度不变要求D的收率达70能否办到4 改用全混反应器操作反应温度与原料组成均不改变保持空时与1的反应时间相同A的转化率是否可达到955 在全混反应器中操作时A的转化率如仍要求达到95其它条件不变R的收率是多少6 若采用半间歇操作B先放入反应器内开始反应时A按1计算的时间均速加入反应器内假如B的量为1m3A为04m3试计算A加完时组分A所能达到的转化率及R 的收率解1第二章29题已求出t 0396h 2423min23 若转化率仍为095且温度为常数则D的瞬时选择性为D的收率这说明能使D的收率达到704对全混流反应器若使τ t 03958h则有解之得CA 04433所以这说明在这种情况下转化率达不到955 对全混流反应器若X 095则R的收率为6依题意知半间歇式反应器属于连续加料而间歇出料的情况为了求分组A的转化率及R的收率需要求出A及R 的浓度随时间的变化关系现列出如下的微分方程组对A 1对R23在反应时间t 04038h为方便起见取t ?04h内将04 m3的A均速加入反应器内故采用间歇釜操作时原料为A与B的混合物A的浓度为2kmol m3现采用半间歇釜操作且故可算出原料A的浓度为由于代入12式则得如下一阶非线性微分方程组45初始条件t 0CA 0CR 0可用龙格---库塔法进行数值求解取步长?t 002h直至求至t 04h即可用t 04h 时的CA和CR可以进行A的转化率和R的收率计算式中VA为所加入的A的体积且VA 04m3CA0为所加入的A的浓度且CA07kmolm3V为反应结束时物系的体积V 14m3同理可以计算出R的收率310在两个全混流反应器串联的系统中等温进行液相反应加料中组分A的浓度为02kmolm3流量为4m3h要求A的最终转化率为90试问1 总反应体积的最小值是多少2 此时目的产物B的收率是多少3 如优化目标函数改为B的收率最大最终转化率为多少此时总反应体积最小值是多少解1对上式求dVrdXA1 0可得将XA2 09代入上式则解之得XA1 0741所以总反应体积的最小值为2即解得CB1 0005992 kmolm3 同理解得CB2 000126 kmolm3B的收率3 目标函数改为B的收率这时的计算步骤如下对于第i个釜组分AB的衡算方程分别为对A对B当i 1时12当i 2时34由1式解出CA1代入2式可解出CB1 由1式解出CA1代入3式可解出CA2将CB1及CA2代入4式可解出CB2其为τ1τ2的函数即5式中CA0为常数由题意欲使CB2最大则需对上述二元函数求极值联立上述两个方程可以求出τ1及τ2题中已给出Q0故由可求出CB2最大时反应器系统的总体积将τ1τ2代入5式即可求出B的最高浓度从而可进一步求出YB将τ1τ2代入CA2则由XA2 CA0-CA2 CA0可求出最终转化率311在反应体积为490cm3的CSTR中进行氨与甲醛生成乌洛托品的反应式中A--NH3 B HCHO反应速率方程为式中氨水和甲醛水溶液的浓度分别为106moll和623moll各自以150cm3s的流量进入反应器反应温度可取为36?假设该系统密度恒定试求氨的转化率XA及反应器出口物料中氨和甲醛的浓度CA及CB解即得整理得解得XAf 0821反应器出口AB得浓度分别为312在一多釜串联系统22kgh的乙醇 com进行可逆反应各个反应器的体积均为001m3反应温度为100?酯化反应的速率常数为476×10-4lmolmin逆反应酯的水解的速率常数为163×10-4 lmolmin反应混合物的密度为864kgm3欲使醋酸的转化率达60求此串联系统釜的数目解等体积的多釜串联系统ABCD分别代表乙酸乙酸乙酯和水由计量关系得从已知条件计算出将上述数据代入A式化简后得到若i 1则B式变为解之得若i 2则B式变为解之得若i 3则B式变为解之得即三釜串联能满足要求313以硫酸为催化剂由醋酸和丁醇反应可制得醋酸丁酯仓库里闲置着两台反应釜一台的反应体积为3m3另一台则为1m3现拟将它们用来生产醋酸丁酯初步决定采用等温连续操作原料中comolm3丁酯则大量过剩该反应对醋酸为2级在反应温度下反应速率常数等于12m3hkmol要求醋酸的最终转化率不小于50这两台反应釜可视为全混反应器你认为采用怎样的串联方式醋酸丁酯。
化工反应工程答案第二章

化⼯反应⼯程答案第⼆章2 反应动⼒学基础2.1在⼀体积为4L的恒容反应器中进⾏A的⽔解反应,反应前 A的含量为12.23%(重量),混合物的密度为1g/mL,反应物A的分⼦量为88。
在等温常压下不断解:利⽤反应时间与组分A的浓度变化数据,作出C~t的关系曲线,⽤镜A⾯法求得t=3.5h时该点的切线,即为⽔解速率。
切线的斜率为0.760.125mol/l.h 6.1)式可知反应物的⽔解速率为由(2.6?dCA?0.125mol/lr?.h Adt2.2在⼀管式反应器中常压300℃等温下进⾏甲烷化反应:CO?3H?CH?HO242⽓体,改变进⼝原10ml催化剂体积为,原料⽓中CO的含量为3%,其余为N,H22料⽓流量Q进⾏实验,测得出⼝CO的转化率为:022.2 38.5 29.4 83.3 67.6 50.0 Q(ml/min) 07060 40 20 30 50 X(%)的转化速率。
50ml/min时CO试求当进⼝原料⽓体流量为解:是⼀个流动反应器,其反应速率式可⽤(2.7)式来表⽰?dF A?r A dV R F?F(1?X)?QC(1?X)AAAA000A dF??QCdX AA00A故反应速率可表⽰为:dXdX AA r?QC?C A00AA0dVd(V/Q)0RR)作图,过V⽤X~/QV/Q的点作切线,即得该条件下的=0.20mindX/d(V/Q0RA0RA0Rα。
值0.45 0.20 0.26 0.34 0.148 min V/Q0.12 0R70.020.0 % X30.0 60.0 40.0 50.0 A0.65?0.04??1.79?0.34 CO故的转化速率为P0.030.1013?4?0A??10lmol/C??6.380A RT?3??8.31410573dX?4?3A mol/l?1.14?10?6.38r?C?10.min1.79?0AA d(V/Q)0R催化剂上⽔煤⽓变换反应的正反应动⼒学⽅程为:Fe-Mg2.3已知在0.40.85?h?kmolr?kyy/kg COwCO2时反700Ky式中y和为⼀氧化碳及⼆氧化碳的瞬间摩尔分率,0.1MPa压⼒及CO2CO2堆密度为/g,0.0535kmol/kg.h。
化学反应工程1-2章习题答案

化学反应工程1-2章答案(华东理工大学张濂版课后习题)第一章1-1 乙苯循环量:46kg/h 补充的新鲜乙苯:100-46=54 kg/h单程转化率=(100-46)/100×100%=54%选择率=(48/105)/(54/107)×100%=90.6%单程摩尔收率=(48/105)/(100/107)×100%=48.9% 单程质量收率=48/100×100%=48% 总摩尔收率=(48/105)/(54/107)×100%=90.6% 总质量收率=48/54×100%=88.9%单耗(摩尔)=1/90.6%=1.104 单耗(质量)=1/88.9%=1.1241-2以100kg进口气体为基准,设甲醛转化量为xkg则:进口出口100kg 100kg甲醛:10kg 1.6kg丁炔二醇:0kg 7.65kg转化率=(10-1.6)/10×100%=84%选择率=(7.65/86)/((10-1.6)/30)×100%=31.76%单程质量收率=7.65/100×100%=7.65%总质量收率=7.65/(10-1.6)×100%=91.07%1-3得到的顺丁烯二酸酐:20.27×34.5%=6.99t质量收率:6.99/7.21×100%=96.9%摩尔收率:(6.99/98)/(7.21/78)×100%=72.7%第二章2-1 化学计量方程式不影响速率表达式,因此以反应物B和产物P表示的反应速率表达式为:(-r B)=k B C B2C p22-2k C=(-r A)/C A n k P=(-r A)/P A nn=0 (-r A)=k C=k P mol/m3﹒hn=1 k C =(-r A)/C A=( mol/m3﹒h)/(mol/L)=(103h)-1k P=(-r A)/P A=( mol/m3﹒h)/Mpa=mol/m3﹒h﹒Mpan=2 k C=(-r A)/C A2=( mol/m3﹒h)/ (mol/L)2=(106h﹒mol)-1k P=(-r A)/P A2=( mol/m3﹒h)/(Mpa)2= mol/m3﹒h﹒Mpa2 2-3 t1=8d=11520min T1=20℃=293Kt2=10min T2=120℃=393Kln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln(11520/10)=E/8.314(1/293-1/393)E=67751J/mol2-4 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)1)r2/r1=2 T1=473K E1=156.9kJ/molln2=156.9×103 /8.314(1/473-1/T2)T2=482.3K=209.3℃△T=9.3℃2)同1),ln2=104.6×103 /8.314(1/473-1/T2)T2=489K=216℃△T=16℃2-5 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln2=E1/8.314(1/300-1/310) E1=57616J/mol同理:ln2=E2/8.314(1/400-1/410) E2=94607J/mol ln2=E3/8.314(1/500-1/510) E3=144040J/molln2=E4/8.314(1/600-1/610) E4=208332J/mol。
化学反应工程课后习题答案

化学反应工程课后习题答案化学反应工程课后习题答案化学反应工程是化学工程学科中的重要分支之一,它研究的是化学反应在工业生产中的应用。
通过对反应过程的分析和优化,可以提高反应的产率、选择性和经济性。
在学习化学反应工程的过程中,我们经常会遇到一些习题,下面我将为大家提供一些常见习题的解答。
1. 习题一:对于一个一级反应A→B,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
求该反应的速率常数k。
解答:根据一级反应的速率方程,可以得到d[A]/dt = -k[A],其中d[A]/dt表示A的浓度随时间的变化率。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t。
将这两个式子相等,可以得到(Ct - C0)/t = -k[A]。
由于初始浓度为C0的A,所以[A] = C0。
将这个值代入上式,可以得到(Ct - C0)/t = -kC0。
整理一下,就可以得到k = (C0 - Ct)/C0t。
2. 习题二:对于一个二级反应A + B→C,初始浓度分别为C0的A和C1的B,经过一段时间t后,浓度分别为Ct的A和Ct+1的B。
求该反应的速率常数k。
解答:根据二级反应的速率方程,可以得到d[A]/dt = -k[A][B],d[B]/dt = -k[A][B]。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t,d[B]/dt = (Ct+1 - C1)/t。
将这两个式子相等,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -k[A][B]。
由于初始浓度分别为C0的A和C1的B,所以[A] = C0,[B] = C1。
将这两个值代入上式,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -kC0C1。
整理一下,就可以得到k = (C0- Ct)/(C0C1t) = (Ct+1 - C1)/(C0C1t)。
3. 习题三:对于一个零级反应,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
化工反应工程答案 第二章
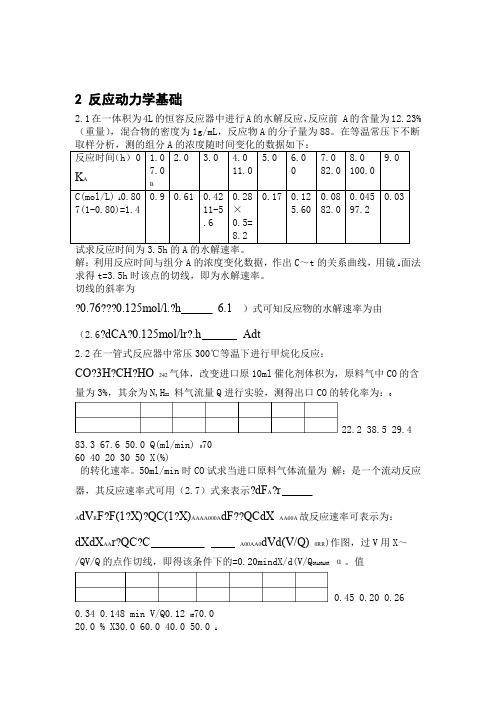
2 反应动力学基础2.1在一体积为4L的恒容反应器中进行A的水解反应,反应前 A的含量为12.23%(重量),混合物的密度为1g/mL,反应物A的分子量为88。
在等温常压下不断解:利用反应时间与组分A的浓度变化数据,作出C~t的关系曲线,用镜A面法求得t=3.5h时该点的切线,即为水解速率。
切线的斜率为?0.76???0.125mol/l.?h 6.1)式可知反应物的水解速率为由(2.6?dCA?0.125mol/lr?.h Adt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:CO?3H?CH?HO242气体,改变进口原10ml催化剂体积为,原料气中CO的含量为3%,其余为N,H22料气流量Q进行实验,测得出口CO的转化率为:022.2 38.5 29.4 83.3 67.6 50.0 Q(ml/min) 07060 40 20 30 50 X(%)的转化速率。
50ml/min时CO试求当进口原料气体流量为解:是一个流动反应器,其反应速率式可用(2.7)式来表示?dF A?rA dV R F?F(1?X)?QC(1?X)AAAA000A dF??QCdX AA00A故反应速率可表示为:dXdX AA r?QC?C A00AA0dVd(V/Q)0RR)作图,过V用X~/QV/Q的点作切线,即得该条件下的=0.20mindX/d(V/Q0RA0RA0Rα。
值0.45 0.20 0.26 0.34 0.148 min V/Q0.12 0R70.020.0 % X30.0 60.0 40.0 50.0 A0.65?0.04??1.79?0.34 CO故的转化速率为P0.030.1013?4?0A??10lmol/C??6.380A RT?3??8.31410573dX?4?3A mol/l?1.14?10?6.38r?C?10.min1.79?0AA d(V/Q)0R催化剂上水煤气变换反应的正反应动力学方程为:Fe-Mg2.3已知在0.40.85?h?kmolr?kyy/kg COwCO2时反700Ky式中y和为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa压力及CO2CO2堆密度为/g,0.0535kmol/kg.h。
反应工程第二章-gf

2.二级不可逆反应 若本征动力学方程为二级不可逆反应,则有:
rA
ks
f
(CA )
ksC
2 A
(rA )g =kGSe (CAg CAs )= ksSiCA2sζ
CAs
1 2ks Si
ζ
(kGSe )2
4kGSeksSiζCAg
kG
Se
总体速率方程
(rA
)g=kG Se
CAg-
1. 外扩散过程
C AS
扩散推动力:CAg -CAs
C AC
CA 是直线分布。 2.扩散-反应过程
C
A
CAC为内扩散过程和反应过程 的表观浓度,浓度分布是曲线。
RP 0
RP
2-2 内扩散有效因子与总体速率(p45) 1.内扩散有效因子ζ
在催化剂颗粒内部,反应物的内扩散过程和化学反
应过程同时进行,扩散-反应过程的表观结果是使A 的浓度下降。
第一节 气-固相催化反应的宏观过程
二、不可逆反应总体速率及其简化(略) 1.一级不可逆反应
rA ksSi f (CA ) ksSiCA
(rA )g =kGSe (CAg CAs )= ksSiCAs ζ
kGSe (CAg CAs )= ksSiCAs ζ
CAS
kG SeCAg
kGSe kS Si
第一节 气-固相催化反应的宏观过程
2)内扩散强烈影响 (1)判别条件
1 kG Se
1 且ζ 1,略去 1 项
ksSi ζ
kG Se
(rA )g =
CAg 1 1
kGSe ksSi ζ
化工基础课后习题答案-第二章

第二章 流体流动与输送1、一个工程大气压是 9.81⋅104Pa ,一个工程大气压相当于多少毫米汞柱?相当于多少 米水柱?相当于密度为 850kg ⊕ m 3的液体多少米液柱?解:已知:〉Hg = 13600 kg ⊕ m 3〉 3H 2O = 1000 kg ⊕ m〉料 = 850 kg ⊕ m 3求:h Hg 、 h H 2O 、h 料〉 = 9.81⋅104Pa 因;P = 〉Hg ⊕ g ⊕ h Hg = 〉 ⊕ g ⊕h H 2O = 〉料 ⊕ g ⊕ h 料PH 2O ⋅ 4 所以:h Hg =〉 ⊕g= 9.81 10 ⋅ = 0.735mHg = 735mmHg Hg13600 9.81⋅4 h = P = 9.81 10 = 10.0mH OH 2O 〉 ⊕ ⋅ 2 H 2Og 1000 9.81⋅ 4h 料 = P = 9.81 10 = 11.8m 液柱〉 ⊕g⋅ 料 850 9.812、一个物理大气压是 760 毫米汞柱,问其相当于多少 Pa ?相当于多少米水柱? 解:因P = 〉Hg ⊕ g ⊕ h Hg = 〉H 2O ⊕ g ⊕ 〉 ⊕h h H 2O⋅所以: h H 2O = -13Hg Hg 〉 = -1313600 0.760 = 10.33mH 2OH O-131000 2P = h Hg ⊕ 〉Hg ⊕ g = 13600 ⋅ 0.760 ⋅ 9.81 = 1.013 ⋅ 105Pa3、在附图所示的气柜内盛有密度为0.80kg ⊕ m 3的气体,气柜与开口U 形管压差计相连, 指示液水银面的读数R 为 0.4m ,开口支管水银面上灌有一段高度R 2为 0.01m 的清水。
左侧水 银面与侧压口中心 线垂 直距离,试求测压口中心截面 处的绝对压强。
(当地大气压m强为 3,水银密度解:设大气因1.01 Pm33PP mn武汉大学取水的密度〉H2O = 1000kg ⊕P A = Pa + R2 〉H2O g + R〉Hg g h〉气g (3)= 1.0133 ⋅ 105 + 0.01 ⋅ 1000 ⋅ 9.81 + 0.4 ⋅ 13600 ⋅ 9.81 0.76 ⋅ 0.8 ⋅ 9.81= 154788.5PaH 1.55 ⋅ 105Pa由于〉气 < 〉Hg 及〉气 < 〉H 2O ,且R 2值很小,故在工程计算中往往略去式(3)中R 2 〉H 2O g及h 〉气g 两项,即将式(3)简化为:P A = Pa + R 〉Hg g= 1.0133 ⋅ 105+ 0.4 ⋅ 13600 ⋅ 9.81= 154696.4 H 1.55 ⋅ 105Pa4、用 U 形管压力计测容器内的压力(如附图)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为0.125/.-==dC A r mol l hAdt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+CO H CH H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,改变进口原料气流量Q 0解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX故反应速率可表示为:0000(/)==A AA A A R R dX dXr Q C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R /Q 0)值α。
0.650.04 1.790.34α-==故CO 的转化速率为40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C mol l RT4300 6.3810 1.79 1.1410/.min(/)--==⨯⨯=⨯AA A R dX r C mol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为: 20.850.4/-=⋅w CO CO r k y y kmol kg h式中y CO 和y CO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。
如催化剂的比表面积为30m 2/g ,堆密度为1.13g/cm 3,试计算:(1) (1) 以反应体积为基准的速率常数k V 。
(2) (2) 以反应相界面积为基准的速率常数k g 。
(3) (3) 以分压表示反应物系组成时的速率常数k g 。
(4) (4) 以摩尔浓度表示反应物系组成时的速率常数k C 。
解:利用(2.10)式及(2.28)式可求得问题的解。
注意题中所给比表面的单位换算成m 2/m 3。
33230.450.45330.45(1) 1.13100.053560.46/.6(2) 1.7810/.301011(3)()()0.05350.15080.1013..()8.3110700(4)()(0.05350.333(0.1)ρρρρ-==⨯⨯=-===⨯⨯⨯==⨯=⨯⨯==⨯=v b w bbg w wvb n p w nc w k k kmol m h k k k kmol m h a kmol k k P kg h MPa m RT k k P km 0.45)().kmol ol kg h2.4在等温下进行液相反应A+B →C+D ,在该条件下的反应速率方程为: 1.50.50.8/min =⋅A A B r C C mol l若将A 和B 的初始浓度均为3mol/l 的原料混合进行反应,求反应4min 时A 的转化率。
解:由题中条件知是个等容反应过程,且A 和B 的初始浓度均相等,即为1.5mol/l ,故可把反应速率式简化,得1.50.522200.80.80.8(1)===-A A B A A A r C C C C X由(2.6)式可知00(1)⎡⎤⎢⎥⎣⎦--==-=A A A A A A d C X dC dX r C dt dt dt代入速率方程式2200.8(1)=-A A A A dX C C X dt化简整理得00.8(1)=-AA A dX C dtX积分得00.81=-AA A X C t X解得X A =82.76%。
2.5氨合成塔入口的气体组成为3.5%NH 3,20.8%N 2,62.6%H 2,7.08%Ar 及5.89CH 4。
该塔是在30MPa 压力下操作。
已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol ),试计算该处的反应速率。
在Fe 催化剂上氨合成反应速率式为:322321.531.512/=-⋅NH H N NH H pp r k p k kmol m h p p 逆反应的活化能417.5810/=⨯su E J mol 。
450℃时30.5322277()/=⋅k m MPa m h ,且212/=Pk k K ,490℃时,Kp 可按下式计算:472log 2047.8/ 2.4943log 1.25610 1.856410 3.206--=--⨯+⨯+p K T T T T 注:m 3为标准立方米。
解:题中给出450℃时的k 2值,而反应是在490℃下,故首先要求出490℃时的k 2值。
利用(2.27)试,求出频率因子A:44217.5810/8.314723162'1617.5810/8.314723430.532exp()exp()2277/ 1.14510exp() 1.14510 1.05510()/.-⨯⨯-⨯⨯-=-===⨯-==⨯=⨯sususuE k A RT E A k e RT E k A e m MPa m hRT490℃的Kp 值由题给公式计算出4722log 2047.8/763 2.4943log763 1.25610763 1.8564107633.206 1.25245.59210 ---=--⨯⨯+⨯⨯+=-=⨯p p K K 求k 1值:22'112'22243 1.531(5.59210) 1.0551033()/.--===⨯⨯⨯=p p k K k K k k k m MPa m h求各组分的分压值:2233122+↔N H NH5716.0.14160*(-2)*2087.01.14160*2087.0*3-626.0 1y 13y y 1904.0 .14160*(-2)*2087.01)1416.0-(12087.0 1y y y 1416.05.6914.45*(-2)*2087.01*2087.0*211035.010.01y y y 22123211 %87.20Py , 1y y y 1000H H 000A A 00R 0R R 0000000==-)+-(=,+=δ+-==+=δ+-===+--=δ+νν-=δ==δ+νν-=δ+νν-=AA A AA AA A AA A A AA AA A AA AA A i i AA A A A Aii i AA A A A Aii i X y X X y X X X X X X y X y p X y X X y X p p p P y i i p =反应速率为:322321.5 1.541.5121.5333317.15333.0 5.718 1.05510317.154.02310/.(179.6/.)=-=⨯⨯-⨯⨯=⨯NH H N NH H p p r k p k p p m m cat h kmol m cat h2.6下面是两个反应的T-X 图,图中AB 是平衡曲线,NP 是最佳温度曲线,AM 是等温线,HB 是等转化率线。
根据下面两图回答:(1) (1) 是可逆反应还是不可逆反应? (2) (2) 是放热反应还是吸热反应?(3) (3) 在等温线上,A,D,O,E,M 点中哪一点速率最大,哪一点速率最小? (4) (4) 在等转化率线上,H,C,R,O,F 及B 点中,哪一点速率最大,哪一点速率最小?(5) (5) 在C,R 两点中,谁的速率大?(6) (6) 根据图中所给的十点中,判断哪一点速率最大?解: 图2.1 图2.2 (1)可逆反应 可逆反应 (2)放热反应 吸热反应(3)M 点速率最大,A 点速率最小 M 点速率最大,A 点速率最小 (4)O 点速率最大,B 点速率最小 H 点速率最大,B 点速率最小 (5)R 点速率大于C 点速率 C 点速率大于R 点速率(6)M 点速率最大 根据等速线的走向来判断H,M 点的速率大小。
2.7在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为49.62910/⨯J mol ,如果不考虑逆反应,试问反应温度是550℃时的速率比反应温度是400℃时的速率大多少倍?解:从题中可知,反应条件除了温度不同外,其它条件都相同,而温度的影响表现在反应速率常数k 上,故可用反应速率常数之比来描述反应速率之比。
400550119629011()()5505505508.314673823400400400exp()23exp()(倍)---=====-E R T T E A r k RT e e r k E A RT2.8常压下,在钒催化剂上进行SO 2氧化反应,原料气组成为7%O 2及82%N 2。
试计算转化率为80%时的最佳温度。
二氧化硫在钒催化剂上氧化的正反应活化能为49.21110/⨯J mol ,化学计量数等于2,反应式为:22312+↔SO O SO其平衡常数与温度的关系为:log 4905.5/ 4.6455=-p e K T该反应的热效应49.62910/-=⨯r H J mol 。
解:(1)求出转化率为80%时各组分的分压:2222332233320.1013 1.4/97.2 1.4610()0.10138.2/97.28.5510()0.1013 5.6/97.2 5.8410()0.101382/97.28.5510()----==⨯=⨯==⨯=⨯==⨯=⨯==⨯=⨯SO SO O O SO SO N N p Py MPa p Py MPa p Py MPa p Py MPa(2)求与上述组成对应的平衡常数K P 值:32230.50.5335.841043.261.46108.5510---⎛⎫ ⎪⎝⎭⨯===⨯⨯SO P SO op K p p(3)求平衡温度Telog 4905.5/ 4.64554905.5780.96.282=-==p e e K T T K(4)利用(2.31)式求逆反应活化能值4459.629109.21110 1.40310/2ν-⨯∆=-=⨯-=⨯su u r rr H E E J mol(5)利用(2.31)式求最佳温度T OP4780.9739.0048.314780.914.031ln 1ln 9.211(14.039.211)10===⨯++-⨯-su su u r u r eOP e T T KRT E E E E2.9在一恒容反应器中进行下列液相反应:+→A B R 31.6/=⋅R Ar C kmol m h 2→A D 238.2/=⋅D Ar C kmol m h 式中r R ,r D 分别表示产物R 及D 的生成速率。
