食盐中碘元素含量的测定实验
实验11 食盐中碘含量的测定

实验11 食盐中碘含量的测定教学目的与要求:1.学习测定食盐中碘含量的原理和方法;2.了解碘量法测定食盐中碘含量的具体步骤;3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;4.进一步熟练掌握滴定操作;5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:重点:1.碘量法的原理和方法;2.培养学生的动手操作能力及创新意识。
难点:1.降低碘量法测定误差的条件控制;2.碘量法滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:食盐,又称餐桌盐,是对人类生存最重要的物质之一,也是烹饪中最常用的调味料。
盐的主要化学成份氯化钠(化学式NaCl)在食盐中含量为99%,部份地区所出品的食盐加入氯化钾以降低氯化钠的含量以降低高血压发生率。
同时世界大部分地区的食盐都通过添加碘来预防碘缺乏病,添加了碘的食盐叫做碘盐。
2011年3月11日,日本本州岛海域发生地震引发核电站爆炸,我国多地居民出现为防止核辐射而抢购食盐的现象,专家表示,吃食盐能防辐射一说不靠谱,市民请勿信谣言。
问题1:食盐中为什么加碘?碘是人体必需的微量元素之一,有智力元素之称。
世界卫生组织将碘缺乏危害简称IDD,为目前导致人类智力发育落后的最主要原因。
现已证实,人脑发育大部分是在胚胎期和婴幼儿期完成的。
在智力发育全过程中,如果碘摄入不足,就会在生长发育过程中产生一系列障碍,即使轻微缺碘,也会引起智力的轻度落后并持续终生。
而严重的缺碘会对儿童的体格发育造成障碍,即身材矮小,性发育迟缓、智商低下。
并可造成早产、死胎、先天畸形、聋、哑、痴呆等,更为常见的为地方性甲状腺肿(即粗脖子病)和地方性克汀病。
这些损害统称为碘缺乏病。
问题2:食盐中添加的碘以什么形式存在?如何检验?食盐中添加的碘以碘酸钾形式存在。
检验方法:①碘单质的检验:淀粉溶液+食盐。
结果:不变蓝,说明食盐中的碘不是碘单质。
②碘化物的检验:5mLH2O2+少量食盐+几滴硫酸+滴入淀粉溶液;对比实验:5mLH2O2+少量碘化钾+几滴硫酸+滴入淀粉溶液。
亚甲基蓝氧化褪色光度法测定食盐中的碘

0 2 0 O . 5 0gKI 。于小 烧 杯 中 , 适 量 的水 溶 解 后 转 人 加 2 0mL 5 容量瓶 , 用水 稀释 至刻度 , 摇匀 备用 。
碘酸钾 标 准 溶液 , 0g / 2 g mL( I作 液 ) 用 移 液管 : 准确 移 取 5 O . 0 mL 上 述 制 得 的 碘 酸 钾 贮 备 液 于 2 0mL 5 容量瓶 中, 水稀释 至刻 度 , 匀 。 用 摇
关 系, 尔吸光 系数 为 1 1 O L・ l1・ m_ 。用 于测定食盐 中微量 碘 的含 量 , 摩 . ×1 。 mo_ c 。 结果满 意 。
关键 词 : 甲基蓝 ; 亚 氧化褪 色 ; 光度 法 ; 碘
中 图分 类号 : S 7 T 3
文献标识 码 : B
文章编号 :O O 9 3 2 1 ) 1 1 4 2 1 0 一9 7 ( 0 1 0 一O 1 一O
检验加碘食盐中的碘元素的方法

检验加碘食盐中的碘元素的方法“哇塞,这盐里真有碘元素吗?”我看着厨房里的那袋加碘食盐,满心好奇。
旁边的小伙伴也凑过来,“啥是碘元素啊?这盐里真有那玩意儿?”我挠挠头说:“我也不太清楚呢,要不咱来研究研究?”
咱先说说咋检验这加碘食盐里的碘元素吧。
首先呢,得找点淀粉,就像做饭得有食材一样。
然后把淀粉加水调成糊糊,这就跟和泥巴似的,可好玩啦。
接着,把加碘食盐放到水里溶解,就像糖在水里化掉一样。
再把溶解了盐的水倒进淀粉糊糊里。
这时候要是有碘元素,淀粉糊糊就会变蓝。
嘿,这可神奇了吧?
那检验碘元素有啥用呢?这用处可大啦!咱都知道碘对身体好,要是能知道盐里有没有碘元素,咱不就能放心吃了吗?就好比咱买个玩具,得知道它好不好玩才买呀。
而且要是能自己检验,那多有成就感呀!
我记得有一次,我和小伙伴们一起做这个实验。
大家都可兴奋啦,眼睛死死地盯着那淀粉糊糊。
等水倒进去的时候,哇,真的变蓝了!大家都高兴得跳了起来。
“哈哈,真的有碘元素呢!”这就是检验碘元素的实际效果,超棒吧?
所以说啊,检验加碘食盐里的碘元素可好玩啦,还能让咱知道盐好不
好。
咱以后可以多试试这样的小实验,又有趣又能学到东西。
多好呀!。
加碘食盐中碘元素检验的探究66

加碘食盐中碘元素检验的探究加碘食盐中碘元素检验的探究实验目标:通过探究活动,了解食盐中碘元素的存在形式,掌握检验I2、I-、IO3-的原理和实验操作,提高实验设计能力。
准备材料:药品:加碘精盐、醋精、新制氯水、碘化钾溶液、淀粉溶液、蒸馏水。
仪器:九孔井穴板、多用滴管。
探究活动:提出问题:食盐是我们在日常生活中十分常见的一种调味品,它也是一种人体的必需品,参与了我们体内每时每刻都在进行着的新陈代谢的过程,这样一种与我们的生命息息相关的常见的物质,我们对它又了解多少呢?现在市场上所出售的食盐几乎每一包的包装上都标有“加碘”二字。
从这两个字我们可以看出在食盐中含有碘元素,但是碘元素有多种存在形式,常见较为稳定的存在形式有I2、I-和IO3-等几种,在我们的食盐中添加的碘到底是这其中的哪种形式或是多种形式的组合呢?我们怎样才能知道食盐中碘的存在形式?实验设计:学生根据要探究的问题,运用已有的知识设计实验方案、阐述实验原理和方法、步骤,并相互讨论和质疑,教师适当引导,修改方案、确定方案如下:(1)利用淀粉溶液遇碘单质变蓝色,检验是否以碘单质存在。
(2)利用新制氯水能把I-氧化成单质碘,检验是否以I-存在。
(3)利用IO3-的氧化性,在酸性介质中I-和IO3-能发生归中反应而得到单质碘,检验是否以碘酸根离子存在。
(4)检验是否为I-和IO3--两种组合状态存在,反应原理与(3)一致。
实验过程:(1)取少许食盐(约0.1克)于九孔井穴板的某一井穴中,用少量(约15滴)蒸馏水溶解,再滴加一滴淀粉溶液,搅拌,无蓝色出现,说明没有碘单质。
(2)取少许食盐(约0.1克)于九孔井穴板的某一井穴中,用少量(约15滴)蒸馏水溶解,滴入一滴双氧水,再滴加一滴淀粉溶液,搅拌,无蓝色出现,说明食盐中不存在I-。
(3)取少许食盐(约0.1克)于九孔井穴板的某一井穴中,用少量(约15滴)蒸馏水溶解,滴加一滴醋精,再滴加一滴淀粉溶液,搅拌,观察无蓝色出现。
加碘酸钾食盐中碘含量的紫外分光光度法测定

Ξ加碘酸钾食盐中碘含量的紫外分光光度法测定刘翠格, 默丽萍, 魏永巨(河北师范大学化学学院,河北石家庄 050016)摘 要:根据碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外吸收光谱,拟订了加碘酸钾食盐中碘含量的光度测定方法.在p H 2.4,KI 浓度为0.01mol/L 的HCl 介质中,1mol 碘酸钾可定量转变为3mol I 3-,通过测量I 3-在288nm 或350nm 处的吸光度,可计算食盐样品中碘的含量.方法的加入回收率在96.8%~102.6%之间.本文中,笔者分析了2种市售碘盐样品,结果令人满意.关键词:碘;食盐;紫外分光光度法中图分类号:O 657.32 文献标识码:A 文章编号:100025854(2003)0520497203碘是人体内合成甲状腺素所必需的微量元素.适量的甲状腺素有促进机体生长、调节能量转换、稳定神经系统等作用.缺碘会影响机体代谢,引起甲状腺肿,严重者可致发育停滞、痴呆.按国际推荐标准,成人每日需碘0.1~0.3mg [1].防止碘缺乏的一个重要措施是推广食用加碘食盐.食盐中加碘的方法有2种,一是加入碘化钾,二是加入碘酸钾.1994年,国家规定在食盐中加入碘酸钾[2,3].目前市售加碘酸钾食盐中碘含量一般为(35±15)mg/kg.食盐含碘量的测定方法有多种[2],如滴定分析法、吸光光度法[3~6]、荧光及化学发光法[7]、离子选择电极法、极谱法、色谱法和专用测碘仪法[8]等.笔者在研究碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外光谱时,观察到I 3-的紫外光谱与I 2和I -的紫外光谱有明显不同.根据这种光谱差异和碘的化学性质,拟订了加碘酸钾食盐中碘含量的测定方法,实验结果令人满意.1 原 理在酸性介质中,KIO 3与过量KI 反应生成I 2: IO 3-+5I -+6H +=3I 2+3H 2O.(1)I 2与I -结合生成I 3-: I 2+I -=I 3-.(2)反应完成后,溶液中含有I 3-和过量的I -.由于I 3-在260nm 以上有灵敏的光吸收,而I 2和I -在260nm 以上没有吸收(见图1),因而可以通过测定溶液的吸光度而得知I 3-的浓度,进而推算加碘酸钾食盐中碘的含量.2 实验部分2.1 仪器与试剂UV 2501PC 分光光度计(日本,岛津).I 2:分析纯,天津市天大化工实验厂出品,配制成0.500mmol/L 水溶液;KI :分析纯,中国医药公司进口分装,配制成0.050mol/L 水溶液,使用时适当稀释;KIO 3:化学纯,上海化学试剂总厂出品,配制成0.100mol/L 水溶液,使用时适当稀释;HCl :分析纯,配制成水溶液并标定其准确浓度;NaCl :分析纯,1.0mol/L 水溶液;实验用水为蒸馏水.2.2 实验方法在25mL 容量瓶中分别加入I 2,KI ,KIO 3,HCl ,NaCl 等溶液,用水稀释至刻度,摇匀,以水为参比,Ξ收稿日期:20030403;修回日期:20030531作者简介:刘翠格(1954),女,河北保定人,河北师范大学副教授,从事无机化学的教学与研究.第27卷第5期2003年 9月河北师范大学学报(自然科学版)Journal of Hebei Normal University (Natural Science Edition )Vol.27No.5Sep.20031cm 吸收池,扫描吸收光谱,或读取一定波长的吸光度.根据加入HCl 标准溶液的浓度和体积,计算显色溶液的p H 值,加入NaCl 溶液以控制离子强度.3 结果与讨论3.1 I 2,I -和I 3-的吸收光谱按实验方法测量I 2,I -和I 3-的吸收光谱,得图1.图1中I 2的吸收峰在202nm ,I -的吸收峰在193和226nm ,I 2和I -在260nm 以上没有吸收;I 3-的吸收峰在288和350nm ,摩尔吸光系数(ε)分别为3.52×104和2.33×104L/(mol ・cm ).根据反应式(1)和(2),1mol KIO 3可以定量转变为3mol I 3-,因此,KIO 3的反应是一个有倍增效应的高灵敏度显色反应.3.2 溶液酸度的影响溶液酸度对反应(1)有显著影响,实验表明在p H 1.4~3.4之间较为合适(见图2).在高酸度条件下(p H <1.4),I -可与溶解氧发生反应:4I -+4H ++O 2=2I 2+2H 2O ,产生正误差;而在低酸度条件下(p H >3.4),I 2发生歧化反应:3I 2+6OH -=5I -+IO 3-+3H 2O ,此时I 3-将不能生成.本实验控制p H为2.4.λ/nmI 2与I -的浓度均为0.060mmol/L ;I 3-为0.040mmol/L I 2+0.010mol/L KI图1 I 2,I -和I 3-的紫外吸收光谱p HKIO 3:5.0μmol/L ;KI :0.010mol/L ;0.2mol/L NaCl 介质图2 溶液酸度对显色反应的影响3.3 KI 用量的影响I 2:0.040mmol/L ;曲线1和2的测量波长分别为350,288nm图3 KI 用量对显色反应的影响由于I 3-的稳定常数较小(lg K =2.96)[9],为了保证反应(2)进行完全,必须加入过量的KI (见图3).本实验取KI 浓度为0.01mol/L.3.4 显色溶液的稳定性在过量KI 存在下,I 3-是相当稳定的.显色溶液在50min 内吸光度基本不变;时间再延长,溶液吸光度有所下降[5].3.5 共存物质的影响本方法基于氧化还原反应(1),只有氧化性离子如MnO 4,Cr 2O 72-,Cu 2+等才能产生干扰,但在食盐中,这些离子一般不存在,因此,本方法基本不存在干扰物质[4].3.6 工作曲线在p H 2.4,NaCl 浓度为0.2mol/L 的条件下,用KIO 3标准溶液制作工作曲线,回归方程分别如下:288nm :A =0.009+0.787c I ,r =0.99997;894河北师范大学学报(自然科学版)第27卷350nm :A =0.005+0.518c I ,r =0.99995.3.7 加入回收实验在碘盐样品溶液中定量加入KIO 3标准溶液,与样品溶液同时显色后,以样品显色溶液为参比,测量由于加入KIO 3所产生的吸光度增加值,再根据回归方程计算加入碘的浓度,进而计算回收率.以不同样品为基体,做了7次加入回收实验,分别在288和350nm 波长下测量,结果列于表1.表1中回收率在96.8%~102.6%之间,在光度分析允许误差范围内.表1 加入回收实验结果加入碘/(mg ・L -1)288nm吸光度增加值测得碘/(mg ・L -1)回收率/%350nm吸光度增加值测得碘/(mg ・L -1)回收率/%0.2540.20330.24797.20.13540.25299.20.2540.20230.24696.80.13490.25198.80.3810.30860.381100.00.20300.382100.30.3810.30410.37598.40.20000.37698.70.5080.41160.512100.80.27140.514101.20.3810.31430.388101.80.20760.391102.60.2540.20300.24797.20.13290.24797.23.8 样品分析称取市售加碘酸钾食盐10.00g ,溶解后转移至100mL 容量瓶中,以水定容.移取此溶液2.00~4.00mL 至25mL 容量瓶中,加入5.0mL 0.05mol/L KI ,1.0mL 0.1mol/L HCl ,用水稀释至刻度,摇匀,在288或350nm 测量吸光度,由工作曲线计算样品中碘的含量.笔者测定了2种市售加碘酸钾食盐样品,测量数据与计算结果列于表2.其中样品1为自然精制碘盐(执行标准QB 2446—99),样品2为碘盐洗粉(执行标准G B 5461—2000).这2种样品的含碘量标签值均为(35±15)mg/kg.由表2可见,样品2的含碘量平均值 x 与标签值一致,而样品1的含碘量平均值比标签值略低.表2 食盐样品碘含量的测定结果V /mL 样品1288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)样品2288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)2.000.136620.20.088320.00.243037.10.158837.03.000.189419.10.123219.00.344335.50.227035.74.000.248319.00.161818.90.461035.90.302635.9x ±s 19.4±0.719.3±0.636.2±0.836.2±0.8参考文献:[1] 周爱儒.生物化学[M ].第5版.北京:人民卫生出版社,2000.396.[2] 刘占广.碘盐含碘量分析综述[J ].海湖盐与化工,1999,28(6):33235.[3] 王彦,薛斌.分光光度法测定食盐中的碘含量[J ].辽宁化工,1996,(1):57258.[4] 胡章记.倍增反应紫外吸光光度法测定食盐中微量碘[J ].化学研究,2002,13(1):43244.[5] 马卫兴,薛婉立.紫外光度法测定食盐中的添加剂碘酸钾[J ].中国调味品,1997,(6):22224.[6] 王末肖,高磊红,刘春艳,等.吸光光度法测定碘酸钾的研究[J ].理化检验(化学分册),2002,38(5):2432244.[7] 张子红,杜凌云,王术皓,等.停流流动注射化学发光法测定碘盐中的碘酸根[J ].光谱实验室,2001,18(5):5842587.[8] 陈焕文,于爱民,韩松柏,等.手持式测碘仪现场测定食盐中的碘[J ].分析化学,2001,29(7):8552858.[9] 刘翠格,默丽萍.分光光度法测定I 3-的稳定常数[J ].化学通报,2003,66(3):2132214.(下转第530页)994第5期刘翠格等:加碘酸钾食盐中碘含量的紫外分光光度法测定035河北师范大学学报(自然科学版)第27卷界的物种多样性和遗传多样性的基因库.因此,在白洋淀建立湿地自然保护区,实施保护措施,防止湿地生态环境的破坏和生态功能的退化,无论是从保护湿地生态系统的特殊性、典型性和生物多样性的稀有性上,还是淡水湖泊资源本身所具有的社会经济价值上衡量,都具有十分重要的保护地位.但是,由于保护不力,白洋淀生态环境退化日益严重,已经给淀周边地区的经济和社会发展造成了巨大损失,并制约了淀区社会经济的发展,阻碍了人民生活水平的迅速提高,影响了社会的可持续发展战略的实施.因此,建议尽快建立白洋淀湿地自然保护区,以便使白洋淀能够迅速得到切实、有效的保护.白洋淀湿地自然保护区建立以后,应以生态学、生态经济学和可持续发展理论为指导,以保护湿地资源、生态环境和生物多样性为中心,以确保自然资源永续利用和生态系统的良性循环为目标,严格保护白洋淀湿地生态系统,大力改善和建设湿地生态环境,加大科技投入,积极开展科学研究,科学合理地利用自然资源,实现湿地生态系统的良性循环,促进区域社会经济的持续、稳定、健康发展,把白洋淀湿地自然保护区建设成为集自然保护、科研、宣传教育、生态旅游等多种功能于一体的综合效益显著的湿地类型自然保护区.参考文献:[1] 安新县地方志办公室.白洋淀志[M].北京:新华出版社,1996.[2] 安新县地方志编纂委员会.安新县志[M].北京:新华出版社,2000.On Establishing the N ature Preserve of B aiyangdian EvergladeWEN Zhi2guang(College of Resource and Environment Sciences,Hebei Normal University,Hebei Shijiazhuang 050016,China) Abstract:Illuminates the necessary of the nature preserve of Baiyangdian everglade through analyzing the worthiness of the ecological protect,economic and social benefits,and illuminates the urgent character of establishing the nature preserve of Baiyangdian everglade though analyzing the existent problems in the ecological protect,finally,advises establishing the nature preserve of Baiyangdian everglade as soon as possible and puts forward instructional thought and developmental direction of the constructing the nature preserve of Baiyangdian everglade.K ey w ords:Baiyangdian everglade;marsh;ecology;nature preserve(责任编辑 蔡丹英)(上接第499页)Determination of Iodine in Edible Salt AddedPotassium Iodate by U ltraviolet SpectrophotometryL IU Cui2ge, MO Li2ping, WEI Y ong2ju(College of Chemistry,Hebei Normal Universit y,Hebei Shijiazhuang 050016,China)Abstract:According to the ultraviolet absorption spectra of iodine,iodide ion and triiodide ion,a method for determination of iodine in edible salt added potassium iodate was proposed.In the medium of HCl with p H2.4,0.01mol/L KI,1mol potassium iodate may be quantitatively converted into3mol I3-. By measuring the absorbance of I3-at288or350nm,quantity of iodine in edible salt can be calculated.A recovery percent of this method was found to be96.8%~102.6%.Two samples of edible salt purchased from market were analyzed.The results were satisfactory.K ey w ords:iodine;edible salt;ultraviolet spectrophotometry(责任编辑 邱 丽)。
高效液相色谱法测定食盐中碘含量

高效液相色谱法测定食盐中碘含量长春市卫生防疫站任凯刘剑平左社清长春市中心医院孙轶峰碘被认为是体内不能合成的必需的微量元素U当机体摄入量不足时则可引起碘缺乏病V人体摄入的碘主要来自碘盐U而碘盐中的碘酸钾易被氧化为单质碘而逸失U使碘盐中的碘化物与碘的比例达不到%aC KK K K b%aS KK K K U降低了补碘的作用U因此对碘盐定期监测是对碘盐市场进行监督的手段U是消除碘缺乏病的重要措施之一V近年来碘的检测方法发展迅速U过去使用的氧化法W比色法等化学法及\N]*_<法均有操作繁锁W使用试剂较多等缺点U本文作者现将高效液相色谱法测定食盐中的碘含量介绍如下V%实验部分c仪器[高效液相色谱仪%%K K型7美国惠普公司;Vd试剂[K$%B@e碘酸钾标准液W%K=B@e碘酸钾标准应用液Vf仪器测定条件[色谱柱C K K==OJ==U</)+1(’+#g&<C$S h=V流动相S$C B@eL流速%=6@=1-U柱C i]g J@N j k E S a%S V温C J lU进样量%K h6V检测器m N&U电极[玻璃碳工作电极W计数电极W参考电极V工作电压为%n U操作方法是电流滴定分析V o标准曲线[准确移取%K=B@e碘化钾标准应用液K$K K W K$C K W K$J K W K$H K W K$E K和%$K=6于小烧杯中U加去离子水至%K=6U在上述色谱条件下进样C K h6U以蜂面积定量U工作曲线相关系数为+pK$T T S VC结果与讨论加标回收实验U在市售碘盐样品中加入碘标准液U用本法进行回收率实验V回收率在T H$J qb%K%$E q之间U 取含碘量为D E$H S h B@B的样品U在同一周内进行五次实验U变异系数在%$E%qbC$J E q之间V食盐中碘含量测定方法的改进是本着准确W简易W快速W经济的原则V高效液相色谱法测定食盐中碘含量U具有选择性强W方法简单W快速W准确W使用化学试剂少等优点U此方法也适用于其它样品中碘含量的测定U对防治碘缺乏病具有重要意义V万方数据r%S%r高效液相色谱法测定食盐中碘含量作者:任凯, 刘剑平, 左社清, 孙轶峰作者单位:任凯,刘剑平,左社清(长春市卫生防疫站), 孙轶峰(长春市中心医院)刊名:白求恩医科大学学报英文刊名:JOURNAL OF NORMAN BETHUNE UNIVERSITY OF MEDICAL SCIENCES年,卷(期):2001,27(2)本文链接:/Periodical_bqeykdxxb200102055.aspx。
碘测定实验报告

碘测定实验报告碘测定实验报告引言:碘是一种重要的化学元素,广泛应用于医药、食品、环境等领域。
为了准确测定样品中碘的含量,我们进行了一项碘测定实验。
本实验旨在通过一系列化学反应,将样品中的碘转化为可测定的化合物,并利用比色法确定其浓度。
实验材料:- 碘酸钾(KIO3)- 硫酸(H2SO4)- 甘油(C3H8O3)- 淀粉溶液- 未知含碘样品实验步骤:1. 首先,我们准备了一定浓度的碘酸钾溶液,并称取一定体积的样品溶液。
2. 将样品溶液加入锥形瓶中,并加入适量的硫酸和甘油。
这一步的目的是将样品中的碘转化为碘酸盐。
3. 在反应进行的过程中,我们观察到溶液的颜色由无色逐渐变为深紫色。
这是由于碘酸盐与甘油反应生成的碘离子的存在。
4. 为了测定溶液中碘的浓度,我们利用淀粉溶液进行指示剂滴定。
当溶液中的碘完全被滴定剂滴定时,溶液的颜色由深紫色变为无色。
5. 根据滴定过程中滴定剂的用量,我们可以计算出样品中碘的浓度。
实验结果与分析:通过实验测定,我们得到了样品中碘的浓度为X mg/L。
这个结果表明样品中的碘含量较高/低。
与其他已知样品相比,我们可以进一步分析样品的来源和可能的应用领域。
实验误差分析:在实验过程中,可能存在一些误差。
首先,样品的取样过程可能导致一定的误差。
其次,滴定过程中,滴定剂的滴加速度和滴定终点的判断可能会有一定的主观性。
为了减小误差,我们可以进行多次实验并取平均值,同时加强对滴定终点的观察。
实验应用:碘测定在医药、食品、环境等领域具有广泛的应用价值。
例如,碘在医药领域中被用作抗菌药物的原料,同时也可以用于甲状腺功能的检测。
在食品领域,碘是一种重要的营养元素,可以用于食盐、海产品等的添加。
此外,碘测定还可以用于环境监测,例如测定水体中的碘含量,以评估水质的安全性。
结论:通过碘测定实验,我们成功地确定了样品中碘的含量,并对其应用领域进行了初步的分析。
这项实验不仅加深了我们对碘的认识,还展示了化学实验的操作技巧和分析能力。
食盐中碘含量的测定实验报告

食盐中碘含量的测定实验报告食盐中碘含量的测定实验报告引言:食盐是我们日常生活中必不可少的调味品之一,而碘是人体必需的微量元素之一,对于人体的正常生长发育和代谢具有重要的作用。
因此,了解食盐中的碘含量对于人们的健康至关重要。
本实验旨在通过一系列的实验步骤,测定食盐中的碘含量,并对实验结果进行分析和讨论。
实验方法:1. 实验器材准备:分析天平、研钵、研杵、滴定管、锥形瓶、滴定管架等。
2. 食盐样品的制备:将一定量的食盐样品取出,放入研钵中,用研杵研磨成细粉末状。
3. 碘酸钠溶液的制备:称取一定量的碘酸钠固体,溶解于一定体积的去离子水中,搅拌均匀。
4. 滴定实验的进行:取一定量的食盐样品溶解于一定体积的去离子水中,加入淀粉溶液作为指示剂,滴定碘酸钠溶液至溶液呈现蓝色为止,记录滴定所需的碘酸钠溶液体积。
5. 实验数据处理:根据滴定所需的碘酸钠溶液体积和样品的质量,计算出食盐中的碘含量。
实验结果与分析:通过实验测定,我们得到了食盐中的碘含量为X mg/kg。
根据相关标准,食盐中的碘含量应在Y mg/kg范围内。
比较实验结果与标准要求,可以判断该批食盐的碘含量是否符合标准。
在实验过程中,我们使用了滴定法来测定食盐中的碘含量。
滴定法是一种常用的定量分析方法,通过溶液之间的反应来确定物质的含量。
在本实验中,我们使用了碘酸钠溶液作为滴定试剂,它与食盐样品中的碘反应生成碘酸盐,从而确定食盐中的碘含量。
实验中还添加了淀粉溶液作为指示剂。
淀粉溶液在碘溶液中呈现蓝色,而在滴定过程中,当食盐样品中的碘被滴定试剂完全反应消耗后,溶液中的碘浓度降低,淀粉溶液不再呈现蓝色,这时滴定过程结束。
实验中的数据处理非常重要。
通过计算滴定所需的碘酸钠溶液体积和样品的质量,我们可以得到食盐中的碘含量。
在实验中,我们还应注意实验条件的控制,如溶液的浓度、滴定剂的滴定速度等,以保证实验结果的准确性和可靠性。
结论:通过本实验的测定,我们得到了食盐中的碘含量为X mg/kg。
甲基紫显色光度法测定食盐中微量碘
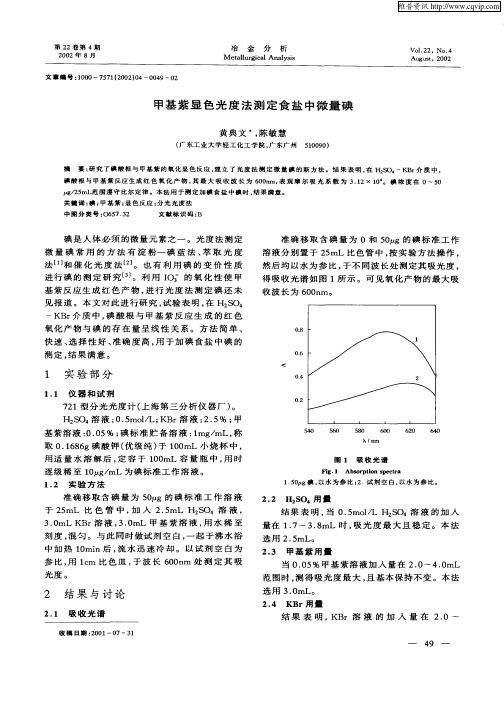
碘 酸根 与 甲基 紫反应 生成 红 色 氧 化 产 物 , 最 大 吸 收 波 长 为 6 0m, 观摩 尔 吸 光 系 数 为 3 1 其 0n 表 . 2× 1 碘 浓 度 在 0~ 5 0。 0 t /5  ̄ 2 mL范 围 遵 守 比 尔 定 律 。本 法 用 于 测 定 加 碘 食 盐 中 碘 时 , 果 满 意 。 g 结 关 键 词 : ; 基 紫 ; 色 反 应 ; 光 光 度 法 碘 甲 显 分
1.O 5 g碘 , 水 为 参 比 ; 试 剂 空 白 , 水 为 参 比 。 以 2. 以
准 确 移 取含 碘 量 为 5 0 g的 碘 标 准 工 作 溶 液 于 2 mL 比 色 管 中 , 入 2 5 S 4溶 液 , 5 加 . mL H2 O 3.mL KB 溶 液 , . mL 甲 基 紫 溶 液 , 水 稀 至 0 r 30 用 刻 度 , 匀 。与 此 同 时 做 试 剂 空 白 , 起 于 沸 水 浴 混 一 中 加 热 1 mi 0 n后 , 水 迅 速 冷 却 。 以 试 剂 空 白 为 流 参 比 , l m 比 色 皿 , 波 长 6 0 m 处 测 定 其 吸 用 c 于 0n
一
KB 介 质 中 , 酸 根 与 甲 基 紫 反 应 生 成 的 红 色 r 碘
氧化产 物与碘 的存 在量 呈线 性关 系 。方法 简单 、
快 速 、 择 性 好 、 确 度 高 , 于 加 碘 食 盐 中碘 的 选 准 用 测定 , 果 满意 。 结
1 实 验 部 分
1 1 仪 器 和 试 剂 .
范 围时 , 得 吸 光 度最 大 , 基 本 保 持 不 变 。本 法 测 且
选用 30 . mL。
2. KBr用 量 4
加碘食盐中碘含量的测定

加碘食盐中碘含量的测定一、实验目的1、学会查阅本实验的相关资料;2、设计出该实验的实验原理;3、拟定完成该实验所需试剂及仪器;4、拟定完成该实验的具体步骤;5、进一步熟悉滴定操作。
二、实验原理由于加碘食盐中碘元素绝大部分是以IO3-存在,少量的是以I-形式存在。
食盐溶于水后,在酸性条件下,加入饱和溴水,I-被氧化为IO3-,再用过量的甲酸钠除去过量的溴。
在酸性条件下,加入碘化钾,I-与IO3-反应析出I2,然后用标准的硫代硫酸钠滴定I2,从而确定碘元素的含量。
发生的反应如下:I-+3Br2+3H2O IO3-+6H++6Br-;Br2+2HCOO-+2H2O2CO32-+4H++2Br-;IO3-+5I-+6H+ 3I2 +3H2O I2 + 2S2O32-2I-+S4O62-故有KIO3~I ~ 3I2 ~ 6Na2S2O3 及I~KIO3~3I2~6Na2S2O3三、试剂及仪器酸式滴定管,锥形瓶(250mL),容量瓶(250mL),移液管(25mL),FA/JA1004型电子天平,称量瓶,滴定管夹, 托盘天平, 滤纸, 药匙, 铁架台, 小烧杯,量筒(5mL,10mL) ,恒温箱;食用加碘盐,蒸馏水,2mol/L盐酸,10%的KI 溶液,0.001mol/L的Na2S2O3溶液,1%的淀粉试液,碘酸钾,甲酸钠(10%),饱和溴水。
四、实验步骤1、配制碘酸钾标准溶液在分析天平上称取0.008~0.016g(于110±2°烘至恒重的)碘酸钾,加30mL蒸馏水,待完全溶解后冷至室温,然后配成250mL溶液。
2、标定硫代硫酸钠用移液管移取25.00mL标准碘酸钾溶液于250mL锥形瓶中,加50mL蒸馏水,2mL 2mol/L盐酸,摇匀后加3mL10%的KI溶液,摇匀后立即用Na2S2O3标准溶液滴至浅黄色,再加入2mL1%的淀粉溶液,继续滴至蓝色恰好消失为止,记录所用Na 2S 2O 3标准液的体积。
检验加碘食盐中的碘元素的方法

检验加碘食盐中的碘元素的方法嘿,小伙伴们,今天我们来聊一聊如何检验加碘食盐中的碘元素,这可是个大问题哟!
你得有个玻璃烧杯,然后把一些加碘食盐放进去,加点水,然后
搅一搅,让碘都溶解在水里。
哎呀,不要忘了,在搅拌之前,要加点醋,让加碘食盐中的碘元素更容易被溶解出来。
接着,咦,我们要用一根玻璃棒蘸一点碘酒,然后放进烧杯里,
轻轻搅一搅。
这时候,如果烧杯里的液体变成了蓝色,那就说明加碘
食盐中含有碘元素了嗨!
嗨呀,碘元素是很重要的哟,它可以预防甲状腺功能减退、克山病,还能帮助我们的大脑发育。
所以啊,检验加碘食盐中的碘元素,
对我们的健康可是非常重要的哟!
嘿,话说回来,如果我们想要确认加碘食盐中碘元素的含量,可以用一种叫做分光光度计的仪器来测量。
不过,这个仪器可得好好操作哟,否则测出来的数据可就不准确了。
唉,如果我们在家里没有这种高级仪器,就可以用一些简单的方法来判断加碘食盐中的碘含量。
比如说,我们可以用淀粉溶液来做判断,如果加碘食盐中含有碘元素,加入淀粉溶液后会变成深蓝色。
检验加碘食盐中的碘元素,有很多种方法可以选择哟。
不管是用简单的化学试剂,还是用高级的仪器,都需要我们认真对待,因为这关乎到我们的健康嘛!。
碘离子选择电极快速测定食盐中碘的含量

L c e g . Ya i g i Yu h n o Jn
( .X l g o awn l eh nc c o fXl h oe 0 6 0 1 in u l n t a ca i sh o , in a t 2 0 0; i e m i
食盐中碘含量的测定

实验报告食盐中碘含量的测定班级:应111-1一.【实验目的】1. 通过本实验了解碘对人体的作用,熟悉碘盐中碘的添加形式以及含量范围。
2. 准确,熟练掌握滴定的基本操作。
3. 熟练掌握碘量法测定碘含量的基本原理,方法。
4. 熟练掌握硫代硫酸钠的配置与标定,熟悉硫代硫酸钠与基准物重铬酸钾的反应条件。
二.【实验原理】在加碘盐的产品质量检验中,碘含量是一项重要的指标 按照GB5461-92的规定,加碘中碘酸钾的加入量应为20-50mg /kg .由于加碘食盐中碘元素绝大部分是以IO 3-存在,少量的是以I -形式存在。
本实验依据碘的性质对其进行定性和定量检测。
1.碘的测定:(1)I -的定性检测:通过NaNO 2在酸性环境下氧化I -生成I 2,遇淀粉呈蓝紫色而检验I -的存在。
(2)KIO 3的定性:在酸性条件下,IO 3-易被Na 2S 2O 3还原成I 2,遇淀粉呈现蓝紫色。
但Na 2S 2O 3浓度太高时,生成的I 2又和多余的Na 2S 2O 3反应,生成I -使蓝色消失。
因此实验中要使Na 2S 2O 3的酸度控制在一定范围。
测定范围是每克食盐含30ug 碘酸钾立即显浅蓝色,含50ug 显蓝色。
含碘越多颜色越深。
(3)定量测定:I -在酸性介质中能被饱和溴水还原成IO 3-,样品中原有及氧化生成的IO 3-于酸性条件下与I -成的I 2再用Na 2S 2O 3标准溶液滴定,以淀粉为指示剂,滴定至溶液的蓝色刚好消失为终点,从而求得加碘盐中的碘含量。
主要反应:I - +3Br 2+3H 2 IO 3-+6H ++6Br - IO 3-+ 5I -+6H 3I 2 +3H 2O I 2 + 2S 2O 32 2I -+ S 4O 62-故有 KIO 3~I ~ 3I 2 ~ 6Na 2S 2O 3 及 I ~KIO 3~ 3I 2 ~ 6Na 2S 2O 3 2.Na 2S 2O 3的标定:(1).结晶硫代硫酸钠含有杂质,不能采用直接法配制标准溶液,且Na 2S 2O 3溶液不稳定易分解。
加碘食盐中的碘元素实验结论

加碘食盐中的碘元素实验结论
在本次实验中,我们对市售的加碘食盐进行了实验,以确定其
中的碘元素含量。
实验结果显示,加碘食盐中的碘元素含量符合国
家标准要求。
经过仔细的实验操作和数据分析,我们得出以下结论:
1. 加碘食盐中的碘元素含量稳定。
在多次实验中,我们发现不
同批次的加碘食盐中的碘元素含量基本保持在稳定的水平,符合国
家标准规定的范围。
2. 实验结果与标称值相符。
我们对加碘食盐中的碘元素含量进
行了多次测定,结果显示,实验测得的碘含量与包装上标称的数值
基本一致,表明该食盐生产商在生产过程中对碘元素的添加进行了
精确控制。
3. 加碘食盐对碘元素的释放稳定可靠。
我们通过模拟食用加碘
食盐后,对其中的碘元素进行了释放实验,结果显示,加碘食盐中
的碘元素能够在人体消化道中稳定释放,确保了人体对碘元素的充
分吸收。
综上所述,通过本次实验,我们得出结论,市售的加碘食盐中
的碘元素含量稳定,符合国家标准要求,可以作为人们日常生活中的重要碘补充来源。
同时,我们也提醒消费者在购买食盐时,应选择正规渠道购买,并注意查看包装上的产品标识,确保所购买的加碘食盐符合国家标准要求。
如何鉴定食盐中的碘精品

【关键字】方案、方法、条件、地方、充分、良好、健康、发现、了解、研究、特点、需要、环境、途径、能力、作用、检验、分析、丰富、满足、教育、取决于、改进如何鉴定食盐中的碘如东县丰利中学陈伟杰一、碘对人体健康的影响:1.碘在人体内的分布和代谢碘吸收迅速而完全,进入胃肠道的膳食碘1h内的大部分吸收,3h内完全吸收。
进入循环后,碘离子就遍布于细胞外液,并且在一些组织中浓集,如肾脏,唾液腺、胃粘膜、泌乳的乳腺、脉络膜丛和甲状腺。
但在这些组织中只有甲状腺能利用碘以合成甲状腺激素。
人体内约含碘25~36mg,大部分(约15mg)集中在甲状腺内供合成甲状腺激素之用。
体内的碘由尿、粪、乳汁等途径排出,其中有近90%随尿排出,近10%随粪便排出,其余极少量则随汗液和呼出气等排出。
哺乳的妇女可从乳汁中排出一定量的碘(人乳中的含碘量约为7~14ug%)。
授乳妇女易于发生甲状腺肿可能与此有关。
2.碘缺乏成人缺碘可引甲状腺肿,胎儿期和新生儿期缺碘可引起呆小病。
由于这些病具有地区性特点(多流行于山区和半山区,亦有流行于个别平原地区),故称为地方性甲状腺肿和地方性呆小病等。
3.碘过量碘摄入过量通常发生于摄入含碘高的海产品过多,以含碘高的水(某些深井和缺碘地区的地面水和井水)作为饮食用水,以及在治疗甲状腺肿等疾病中使用过量的碘剂等。
摄入过多的碘可发生如下病症。
(1)碘性甲状腺肿:甲状腺轻度肿大,多呈弥漫型,硬度高于因缺碘引起的。
我国河北和日本北海道沿海渔民都有因摄入因摄入过多含碘量高的海产品而发生甲状腺肿的,而在减少海藻的摄食量后,甲状腺肿即渐消散。
我国也有因饮用含碘量高的深井水而引起高碘甲状腺肿者。
临床上过量使用碘剂,亦可引起碘性甲状腺肿。
(2)碘性甲状腺毒症:碘剂一经使用于地方性甲状腺肿的防治,就发现它还有另一种作用——诱发甲状腺机能亢进。
出现心率加速(常伴有早搏和房颤)、气短、急躁不安、失眠、腱反射亢进,手、舌、眼睑以到全身震颤,怕热多汗,代谢和食欲亢进等。
碘盐检验试验

创设情境
日常生活中我们每天都会摄入一 定量的加碘食盐,那同学们知道 为什么食盐中必须加碘吗?
Байду номын сангаас碘的危害:
缺碘引起的甲状腺肿即大脖子病
缺碘 引起 的克 汀病 即呆 小病
你知道吗?
国家规定市售的食盐都必须含一 定量的碘,但市售“碘盐”是不 是真的含有碘?如果含碘,那么, 碘的存在形式又是怎样的呢?
淀粉分子中蔗糖的长度(即聚合度)有关。淀 粉多蔗糖的长度与颜色有如下关系:
葡萄糖 >60 30-60 30-25 20-15 12-8 单体的
个数
显示颜 深蓝色 蓝色 蓝紫色 紫红色 红色 色
<6 无色
猜想1 加碘食盐中碘元素以碘 单质(即I2)的形式存在
如何检验?
淀粉溶液
设计实验方案: 用药匙取市售食盐配成溶液,加入淀粉溶液观察现象。
请同学们大胆猜想
碘的检验----淀粉与碘液的显 色作用
碘遇淀粉溶液即有蓝色或者深 蓝色出现,这是检测碘的灵敏而有 效的方法。这种原理一般认为是由 于淀粉分子具有螺旋状的卷曲结构, 能够使淀粉与碘形成淀粉-碘的复合 物,因而显示颜色。
碘的测定----淀粉与碘液的显 色作用
淀粉与碘的显色作用,呈现的颜色深浅与
在食盐中加碘有如下几个优点:
(1)生活化、长期性。由于外环境缺碘,人类需 要长期适量补碘。而人类无论种族、民族、年龄、 性别都必须每日吃适量的盐,所以食盐是补碘的最 好载体。通过吃碘盐,能保证补碘的生活化、适量 化及持久性。
(2)经济、易推广。食用碘盐很经济,用钱少, 只需花少量的钱即可解决防治疾病的大问题,即使 对一个十分贫穷的国家也是可以接受的。
设计实验方案: 用药匙取市售食盐配成溶液,加一定稀硫酸和碘化钾,再加入
利用氧化还原电势传感器测定加碘食盐中的碘含量

利用氧化还原电势传感器测定加碘食盐中的碘含量摘要:基于碘量法原理,采用硫代硫酸鈉标准溶液测定被测物中碘元素的含量。
借助氧化还原电势传感器和液滴数传感器获得滴定曲线图并确定滴定终点,从而测得加碘食盐中碘元素的含量。
与传统实验相比,运用数字化实验数据进行表征使氧化还原滴定过程可视化,帮助学生深入理解氧化还原滴定的原理,提升学生的化学思维品质。
1 问题提出碘是人体必需的微量元素之一,它是人体合成甲状腺素的主要原料,对维持人体新陈代谢起着极为重要的作用。
人体自身不能合成碘,需要从外界摄入,最常见的方法就是合理摄入加碘食盐。
苏教版高中化学必修一教材将加碘食盐中碘元素的定性检验安排为课后兴趣实验。
其原理是碘在加碘盐中以IO-3形式存在,在酸性条件下IO-3和I-发生反应,生成碘单质,利用淀粉溶液变蓝色将碘元素定性检验出来。
碘元素的定量测定有很重要的应用价值。
食用盐中加入一定量的碘酸钾,是为了满足人体对碘的需要。
但值得注意的是,人体摄入过多的碘也是有害的。
《食品安全国家标准食用盐碘含量》(GB 26878—2011)[1]中规定了加碘食盐中碘含量的平均水平(以碘元素计)为20~30mg/kg。
数字化实验是信息技术发展和科学教育研究相结合的产物。
与传统实验相比,数字化实验最大的特色就是借助传感器和信息处理终端进行实验数据的实时采集与分析,实现了人类感官的延伸[2]。
本文运用氧化还原电势传感器手持技术展开加碘盐中碘元素含量测定的研究,作为对教材实验的扩展和补充。
2 实验设计2.1 碘量法碘量法[3]是以I2的氧化性和I-的还原性为基础的一种氧化还原方法,可分为直接碘量法和间接碘量法。
2.1.1 直接碘量法(碘滴定法)当E<E(I2/I-),用I2标准溶液直接滴定还原剂(如Sn2+、As2O3、S2-、SO2-3)的滴定方法称为直接碘量法,又称为碘滴定法。
该反应原理为:I2+Red2I-+Ox该种方法滴定应在酸性或中性介质中进行,因为在碱性条件下I2易发生歧化反应:3I2+6OH-IO-3+5I-+3H2O。
简述碘量法的原理及应用

简述碘量法的原理及应用碘量法的原理碘量法是一种常用于测定物质中含有的碘含量的方法。
碘量法基于甲基橙指示剂在酸性条件下由无色变为深紫色的反应,通过测定反应前后的碘溶液的体积差来计算物质中的碘含量。
具体步骤如下: 1. 将待测物质溶解在酸性条件下,如硫酸溶液中,使其转化成不同等价的碘的离子。
2. 在适当pH条件下,加入甲基橙指示剂,使溶液变色。
3. 在溶液中滴加标准溴酸钠溶液,使甲基橙指示剂完全转化成甲基棕色指示剂时停止滴加。
4. 计算溴酸钠溶液的体积差,根据转换关系,可以计算出待测物质中含有的碘含量。
碘量法的应用碘量法在许多领域中得到广泛应用,下面分别介绍其在食品工业、医药领域和环境监测中的具体应用。
在食品工业中的应用1.测定食盐中的碘含量:食盐中的碘是人体必需的微量元素,通过碘量法可以测定食盐中含有的碘含量,确保食盐的营养价值。
2.测定蜂蜜中的糖精含量:碘量法可以用来检测蜂蜜中是否含有过量的糖精,保证蜂蜜的安全性。
在医药领域中的应用1.测定药物中的碘含量:碘化物在某些药物中作为药物活性成分存在,通过碘量法可以准确测定药物中含有的碘含量,确保药物质量。
2.碘量法也可以用于测定体内碘含量,以辅助判断机体的碘缺乏状况。
在环境监测中的应用1.测定水中的碘含量:碘作为水中的微量元素,通过碘量法可以测定水样中的碘含量,用于环境监测和水质检测。
2.监测土壤中的碘含量:碘量法可以用于测定土壤样品中的碘含量,以评估土壤质量和农作物生长的适宜性。
以上列举的仅是碘量法在食品工业、医药领域和环境监测中的一部分应用,该方法还在其他领域中得到广泛使用,如化学研究、地质探测等。
总而言之,碘量法是一种简单、快速、经济的方法,广泛应用于物质中碘含量的测定,具有重要的理论价值和实际应用价值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食盐中碘元素含量的测定实验
常听人说:“我的身体像钢铁一样。
”如果身体真是钢铁的话,那么食盐就是其中的碳,虽然需要的量不多,但所起的作用却非同一般。
成年人缺碘,会引起甲状腺肿大,儿童缺碘,则严重影响其智力发展导致智力低下,因此人们将碘称为智慧元素。
从建国初开始,我国的科学家就致力于加碘食盐的研究,取得了较大的进展,并在全国强制推广使用,有效地防止了碘缺乏病的流行,提高了儿童的智力。
那么食盐中的碘的含量到底多少为好,我们现在食用的加碘盐符合要求吗?我们该怎样识别食盐是否加碘呢?市场上购买的食盐含碘量是否达标呢?带着这些问题,我们在老师指导下,利用已学过化学元素化合物知识和化学分析知识,对加碘盐进行了定性定量分析。
食盐加碘不是在食盐中加单质碘,而是在食盐中加碘化物。
目前我国在食盐中主要加碘酸钾,而过去则是加碘化钾。
碘化钾的优点是含碘量高(76.4%),缺点是容易被氧化,稳定性差,使用时需加稳定剂。
碘酸钾稳定性高,不需要加稳定剂,但含碘量较低(59.3%)相比之下,使用碘酸钾优点是明显的,因此,90年开始我国规定民用食盐的碘的添加剂为碘酸钾。
食盐中碘酸钾的定性分析:
在试管中加少量碘化钾—淀粉溶液,滴入几滴稀硫酸酸化,不见什么变化,加入少量市售固体食盐,若含有碘酸钾则溶液立即显蓝色。
反应方程式为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
食盐中碘酸钾的定量分析:
实验仪器:25mL酸式滴定管铁架台滴定管夹烧杯锥形瓶25mL移液管
玻璃棒滴管容量瓶托盘天平
实验药品:硫代硫酸钠晶体(Na2S2O3·5H2O)碘化钾晶体稀硫酸淀粉溶液市售食盐
实验原理:先在食盐样品中加入略过量硫酸酸化的碘化钾溶液,把碘酸钾转化成碘分子,再用硫代硫酸钠溶液去测定生成的碘即可。
反应方程式为:
(1)KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)I2+2S2O42- =2I- +S4O62-
实验步骤:(1)用硫代硫酸钠晶体(Na2S2O3·5H2O)配制0.00073mol/L 的Na2S2O3 500mL溶液。
(2)用碘化钾晶体配制0.1mol/L的KI溶液500mL。
(3)洗净一支25mL酸式滴定管,用0.00073mol/L的Na2S2O3 500mL溶液润洗二至三次,装满25mL。
(4)称取3.8g市售食盐,转移到容量瓶中,用适量水溶解,加入2mLKI溶液,滴入5滴稀硫酸,溶液变黄色,再加入6滴淀粉溶液,溶液变蓝色。
最后用0.00073mol/L的Na2S2O3 溶液滴定,重复二至三次,实验结果记录如下:
(5)计算:
KIO3--------------6S2O32-
1mol 6mol
n(KIO3)
n(KIO3)=
食盐中含碘量=
即含碘量为每千克食盐含碘微克(国家标准含量:)
该加碘食盐是否达标?
体会:通过这次研究活动,我们把书本上学到的知识,真正地与实际需要结合起来,让我们像科学家一样,提出问题,对问题进行分析思考,设计实验方案,进行实验研究。
在研究过程中,我们懂得了一个人的力量和智慧是有限的,研究时要分工合作,为了做好这一课题,先到图书馆和电子阅览室去查阅资料,搞清食盐中为什么要加碘,加得是哪一种形态的碘;然后根据学过的知识和原理设计实验方案,确定操作步骤,列出仪器清单;每次实验后要研究设计是否合理,分析产生误差的原因,研究改进办法。
也正是在这种克服困难、解决问题的过程中,学到了知识,发展了技能,而且学会了思考,提高了素质。
研究性学习小组成员:
指导老师:。
