第19章-滴定分析法
滴定分析概述-滴定分析的计算-例题-计算过程步骤

C2O42-
2 物质的量与质量的关系及浓度的关系
n m M
n CV
3 滴定剂浓度与被测溶液浓度间的关系
CT ·VT
t a CA ·VA
4 滴定剂浓度与被测物质的质量关系
(4-3)
t nT = a nA
(4-4)
CT ·VT
t
m ·
A
a MA
CT ·VT
t a
m ·
A
MA
1000
(4-5a) (4-5b)
解:
mNaOH M NaOH
CNaOH ·VNaOH
mNaOH
0.1 600 1000
40.00
2.4g
2 溶液稀释或增浓时浓度的计算
当溶液稀释或增浓时,溶液中溶质的物质的量未
改变,只是浓度和体积发生了变化,
即
C1V1=C2V2
(4-6)
例3 浓H2SO4的浓度约为18 mol/L,若配制500mL 0.2mol/L 的H2SO4待标液,应取浓H2SO4多少毫升?
解: 2HCl + CaCO3 = CaCl2 + H2O + CO2
据
TT /
A
a t
CT M A 1000
THCl/CaCO3
1 2
0.1043 100.0 1000
5.125103 g/mL
应用二
滴定剂的量 浓度CT与滴 定度TT之间 的关系
TT是1mL滴定剂中 所含滴定剂溶质的 克数,故当VT=1mL 时,TT=mT 。
CaCO3 2HCl CaCl2 CO2 H2O
Ca 2
C
O2
24
CaC2O4
CaC2O4 H2 SO4 H2C2O4
分析化学滴定分析

分析化学滴定分析滴定分析是一种常用的分析化学方法,主要用于测定溶液中其中一种物质的含量或浓度。
它通过添加一种已知浓度的试剂(称为滴定试剂),使之与待测溶液中所需测定的物质发生化学反应,根据化学反应的滴定终点,即溶液发生可观察的变化,比如颜色变化、电位变化或沉淀的出现,确定滴定的终点,从而计算出被滴定物质的浓度。
滴定分析在实际应用中广泛用于酸碱中和反应、氧化还原反应、络合反应等。
其中最常见的滴定反应是酸碱滴定反应。
酸碱滴定分析的基本原理是根据酸、碱之间的中和反应来测定溶液中酸或碱的浓度。
其常用的滴定试剂有强酸和强碱,如盐酸、硫酸、氢氧化钠等。
在进行酸碱滴定分析时,首先需要准备两种溶液,一个是待测溶液,一个是滴定试剂。
待测溶液的浓度通常是未知的,而滴定试剂的浓度通常是已知的。
滴定试剂以滴定管逐滴加入待测溶液中,同时不断搅拌溶液,直到滴定终点出现。
滴定终点是指溶液中化学反应发生完全,可观察到的物理变化出现,如颜色突变或电位突变。
滴定过程中需要注意一些重要的实验技巧。
首先,滴定试剂的浓度要适当选择,以使其与被测物质充分反应。
其次,要进行试剂的标定,即确定滴定试剂的准确浓度。
这可以通过溶液的标定反应来实现,即反应滴定试剂与已知浓度的物质,根据反应的化学计量关系计算出滴定试剂的浓度。
再次,滴定过程中要注意控制滴定液的滴加速度,以免产生误差。
最后,在靠近滴定终点时,要慢慢地滴加试剂,以避免过量滴定,从而影响结果的准确性。
滴定分析具有准确度高、操作简便、结果可靠等优点,因此被广泛应用于实际分析中。
例如,酸碱滴定法可以用于测定水样中的酸度或碱度,从而评估水质的好坏。
氧化还原滴定法可以用来测定溶液中其中一种物质的氧化或还原能力,如测定食品中的抗氧化剂含量。
络合滴定法可以用来测定金属离子的浓度,如测定水中的钙离子含量。
总的来说,滴定分析是一种重要的分析化学方法,常用于测定溶液中其中一种物质的含量或浓度。
其原理简单,操作方便,准确度高,广泛应用于实际分析和实验室研究中。
分析化学滴定分析实验原理

物质的含量
量
滴定分析的关键术语与概念
01
滴定度
• 滴定度是指滴定剂与待测物质发生化学反应时,每消耗
一定体积的滴定剂,待测物质的浓度变化量
• 滴定度是滴定分析中的重要参数,可以通过实验测定
02
终点
• 终点是指滴定过程中,滴定剂与待测物质发生化学反应
达到平衡的状态
• 终点可以通过观察滴定过程中的颜色变化、电导变化等
信号来确定
03
滴定误差
• 滴定误差是指滴定分析过程中由于各种因素导致的待测
物质含量测量误差
• 滴定误差主要包括试剂纯度、滴定管精度、滴定操作等
因素引起的误差
02
滴定分析实验的仪器与试剂
滴定分析实验所需的仪器
滴定管
⌛️
• 滴定管是用于滴定分析
的实验仪器,用于准确测
量滴定剂的体积
• 滴定管分为酸式滴定管
分析化学滴定分析实验原理
SMART CREATE
01
滴定分析的基本概念与原理
滴定分析的定义与分类
滴定分析是一种定量分析方法
• 通过测量滴定过程中消耗的试剂体积来确定待测物质的含量
• 滴定分析是一种经典的化学分析方法,具有高精度和高准确度
滴定分析的分类
• 按滴定剂的类型分类:酸碱滴定、氧化还原滴定、沉淀滴定等
• 沉淀滴定分析的关键是选择合适的滴定剂和指示剂,以及准确判断滴定终点
实验步骤
• 准备沉淀滴定所需的试剂和仪器
• 进行空白实验,消除实验误差
• 将滴定剂滴加到待测物质中,同时记录滴定剂的体积和溶液的颜色变化
• 绘制滴定曲线,根据滴定曲线的形状和滴定度确定滴定终点
• 计算待测物质中沉淀成分的含量
滴定分析法ppt课件

2024/3/14
12
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
第一章 滴定分析法概论
2. 片剂(胶囊剂) 标示 %量 C1/W C0 标 VT示 W 量 10% 0
平行做2份,RAD≤0.5%。
第一章 滴定分析法概论
⑶ 所用基准物质应采用“基准试剂”,取用
时应先用玛瑙乳钵研细,并按规定条件干燥,
置干燥器中放冷至室温ห้องสมุดไป่ตู้,精密称取;有引湿
性的基准物质宜采用“减量法”进行称重。
如系以另一已标定的滴定液作为标准溶液, 通过“比较”进行标定,则该另一已标定的滴 定液的取用应为精确量取(精确至0.01ml), 用量除另有规定外,应等于或大于20ml,其浓 度亦应按药典规定准确标定。
酸碱滴定法及其应用
盐酸滴定液(1、0.5、0.2或0.1mol/L) (1)配制中,如按药典的规定量取,则F
值常为1.05~1.10。因此,宜先与已知 浓度的氢氧化钠滴定液作比较试验,求 得其粗略浓度,在加水适量稀释,使其 F值为0.95~1.05,而后再进行标定。
2024/3/14
17
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
第一章 滴定分析法概论
⑹标定中的空白试验,系指在不加供试品或以 等量溶剂替代供试液的情况下,按同法操作 和滴定的结果。
⑺初标者和复标者在相同条件各做平行 试验 3份,分别进行计算;3份平行试验结果的 RAD≤0.1%;初标平均值和复标平均值 RAD≤ 0.1%;标定结果按初、复标的平均 值计算,取4位有效数字。
10第十九章 滴定分析法

2、滴定分析的方法及特点
方法: 酸碱滴定,配位滴定, 氧化还原滴定,沉淀 滴定等 特点: 1.简便、快速,适于 常量分析(>1%) 2.准确度高(±0.2%) 3.应用范围较广
二、滴定分析法对化学反应的要求和滴定 方式 1、要求:
a.反应定量、完全 b.反应迅速 c.具有合适的确定终点的方法 d.必须有合适的消除干扰的方法
-
(四)缓冲溶液的pH计算-
[H ] [HA] - Ca [OH ] PBE:[H ] [OH ] [A ] - Cb
[A - ] Cb [H ] - [OH ]
[HA] Ca [H ] [OH ]
Ca [H ] [OH ] [HA] [H ] K a Ka [A ] Cb [H ] - [OH ]
2 H
2A
H 2 A
A2- + H+
1 HA
HA
c
2
c
0 A
2
A
c
H H K H K K K H H K H K K
2 2 a1 a1
a1 2
一、弱酸(碱)溶液中各物种的分布
平衡浓度:溶液体系达平衡后,某一物种的浓度 分析浓度:溶液体系达平衡后,各种物种的平衡 浓度之和(总浓度c) 分布分数: δ = [某物种的平衡浓度] / 分析浓度 决定于酸(碱)的性质和溶液中[H3O+], 与c无关 δ的大小能定量说明溶液中各物种的分布情 况 知道δ的大小,便可求得溶液中各物种的平 衡浓度
1.一元弱酸(碱)溶液中各种物种的分布
HA A- + H+
络合滴定法

Cu(NH3)32+ + NH3 === Cu(NH3)42+K4=102.11
正是因为这一性质限制了简单络合物在滴定分析中的应用,仅作为掩蔽剂、显色剂和指示剂,而作为滴定剂的只有以CN-为络合剂的氰量法和以Hg2+为中心离子的汞量法具有一些实际意义。
§6-2络合物的平衡常数
一、络合物的稳定常数
在络合反应中,络合物的形成和离解,同处于相对的平衡状态中。其平衡常数,常以形成常数或稳定常数来表示。
如;:逐级络合物在溶液中的平衡(为简化书写,将所有离子的电荷均略去)
M+L===ML
ML+L===ML2
… ┇
MLn-1+L===MLn
对具有相同配位体数目的络合物或配离子,K稳值越大,说明络合物越稳定。
“SO型”和“SN型”螯合剂能与许多种阳离子形成螯合物,通常形成较稳定的五原子环螯合物。
三、乙二胺四乙酸
很多金属离子易与螯合剂中的氧原子形成配位键,也有很多离子易与螯合剂中的氮原子形成配位键。如果在同一配体中,既有氧原子,又有氮原子,则必须具有很强的螯合能力,可形成NO型稳定螯合物。同时具有氨氮和羧基的氨羧化合物就是这一类螯合剂,其中在滴定分析中应用最广泛的是乙二胺四乙酸,简称EDTA,表示为H2Y。其性质如下:
主反应
副反应
由上图可知,反应物(M、Y)发生副反应时,使平衡向左移动,不利于主反应的进行,使主反应的完全程度降低;反应产物(MY)发生副反应时,形成酸式(MHY)络合物或碱式(MOHY)络合物,使平衡向右移动,有利于主反应的进行。M、Y及MY的各种副反应进行的程度,可由其相应的副反应系数表示出来。下面着重讨论滴定剂(Y)和金属离子(M)的副反应。
第19章-滴定分析法

第19章 滴定分析法[19-1]写出下列各酸碱水溶液的质子条件式:〔1〕NH 4Cl 〔2〕NH 4Ac 〔3〕HAc + H 3BO 3〔4〕H 2SO 4 + HCOOH 〔5〕NaH 2PO4 + Na 2HPO 4〔6〕NaNH 4HPO 4答:〔1〕NH 4Cl :c<NH 3> + c<OH -> = c<H +>〔2〕NH 4Ac :c<NH 3> + c<OH -> = c<H +> + c<HAc>〔3〕HAc + H 3BO 3:c<H +> = c<OH -> + c<Ac -> + c<H 4BO 4->〔4〕H 2SO 4 + HCOOH :c<H +> = c<OH -> + c<HCOO -> + c<HSO 4-> + 2c<SO 42->〔5〕NaH 2PO4 + Na 2HPO 4c 1 c 2以NaH 2PO 4为零水准:c<H +> + c<H 3PO 4> = c<OH -> + c<HPO 42-> + 2c<PO 42->–c 2以Na 2HPO 4为零水准:c<H +> + c<H 2PO 4-> +2c<H 3PO 4>–c 1= c<OH -> + c<PO 43->〔6〕NaNH 4HPO 4:c<H +> + c<H 2PO 4-> +2c<H 3PO 4> = c<OH -> + c<PO 43-> + c<NH 3>[19-2]计算下列溶液的pH :〔1〕50mL 0.10 mol·L -1 H 3PO 4〔2〕50mL 0.10 mol·L -1 H 3PO 4 + 25mL 0.10 mol·L -1 NaOH〔3〕50mL 0.10 mol·L -1 H 3PO 4 + 50mL 0.10 mol·L -1 NaOH〔4〕50mL 0.10 mol·L -1 H 3PO 4 + 75mL 0.10 mol·L -1 NaOH解:〔1〕已知H 3PO 4的K a 1 = 6.9×10-3,K a 2 = 6.2×10-8, K a 3 =4.8×10-13由于K a 1>> K a 2 >> K a 3,31109.61.0-⨯=a K c <500,故应用一元弱酸的近似公式: [H +] =c K K K a a a 121142++– = –1.0109.64)109.6(2109.63233⨯⨯+⨯+⨯--- = 2.3×10-2mol.L -1 pH = 1.64〔2〕H 3PO 4与NaOH 反应,生成NaH 2PO 4,浓度为:0333.025500.10)(25=+⨯mol·L –1根据溶液组成,按共轭酸碱对公式进行溶液pH 计算,先按最简式计算:3[]7.5210a a a b b c c H K c c +-==⨯⨯ ∵1a bc c =,∴3[]lg lg(7.5210) 2.12a a H K pH K +-=⇒=-=-⨯= 〔3〕H 3PO 4与NaOH 等摩尔反应,全部生成NaH 2PO 4,浓度为 0.10/2 = 0.050 mol.L –1由于202.7109.605.031<=⨯=-a K c ,故应用近似式:[H +] =12/1a a K c c K + 即 [H +] =58109.12.71050.0102.6--⨯=+⨯⨯pH = 4.71 (2)H 3PO 4 与 NaOH 反应后,溶液组成为NaH 2PO 4 + Na 2HPO 4,两者的浓度比为1:1,此时溶液为缓冲溶液.由H 3PO 4的K a2 = 6.2×10-8,可知H 3PO 4的第二个质子不易离解,故应用缓冲溶液的最简式: pH = 7.21[19-3]讨论下列物质能否用酸碱滴定法直接滴定?使用什么标准溶液和指示剂?〔1〕NH 4Cl 〔2〕NaF 〔3〕乙胺〔4〕H 3BO 3〔5〕硼砂〔6〕柠檬酸解:〔1〕1410w 4a 5b K 1.010NH K 5.610K 1.810-+--⨯===⨯⨯为一元质子酸 所以NH 4Cl 不能用于直接滴定,可用甲醛法间接滴定.〔2〕1411w b 4a K 1.010F K 2.810K 3.5310----⨯===⨯⨯为一元质子酸 所以NaF 不能用于直接滴定.〔3〕4322b b CH CH NH K 5.610PK 3.25-=⨯=,,乙胺∴CH 3CH 2NH 2可以用HCl 标准溶液滴定.计量点产物323CH CH NH +可选用百里酚蓝作指示剂,pK HIn =7.3〔黄6.0~7.6蓝〕.〔4〕不能,因K a = 5.8×10-10太小.但可用甘油等强化,使其生成络合酸,化学计量点的pH=9.0,可选用酚酞作指示剂.〔5〕2-24724723323Na B O 10H O B O 5H O 2H BO 2H BO -⋅+=+硼砂可以选用甲基红作指示剂.[19-4]某一含有Na2CO3,NaHCO3与杂质的试样0.6020g,加水溶解,用0.2120 mol·L-1HCl 溶液滴定至酚酞终点,用去20.50mL;继续滴定至甲基橙终点,又用去24.08mL.求Na2CO3和NaHCO3的质量分数.解:[19-5]已知某试样可能含有Na3PO4,Na2HPO4,NaH2PO4和惰性物质.称取该试样的1.0000 g,用水溶解.试样溶液以甲基橙作指示剂,用0.2500mol·L-1HCl 溶液滴定,用去12.00mL.含同样质量的试样溶液以百里酚酞作指示剂,需上述HCl溶液12.00mL.求试样组成和含量.解:[19-6]用克氏定氮法处理0.300 g某食物试样,生成的NH3收集在硼酸溶液中.滴定消耗0.100 mol·L-1HCl 溶液25.0 mL;计算试样中蛋白质的质量分数〔将氮的质量分数乘以6.25即得蛋白质的质量分数〕.解:30.10025.01014.0076.250.7300.300w-⨯⨯⨯=⨯=蛋白质[19-7]试设计下列混合液的分析方法:〔1〕HCl和NH4Cl〔2〕硼酸和硼砂〔3〕Na2CO3和NaHCO3〔4〕NaOH 和Na3PO4解:〔1〕K a <NH4+> = 10-9.25HCl用NaOH标准溶液,甲基橙指示剂.NH4Cl:加NaOH→NH3,用H3BO3吸收,然后用HCl 标准溶液,甲基红指示剂滴定.〔2〕根据溶液pH值用缓冲公式计算硼酸和硼砂比值;硼砂:用HCl标准溶液,甲基红指示剂滴至H3BO3 .〔3〕用HCl 标准溶液,双指示剂.〔4〕[19-8]在铜氨配合物的水溶液中,若Cu<NH3>42+的浓度是Cu<NH3>32+浓度的100倍,问水溶液中氨的平衡浓度.解:查表知:12.59[19-9]将20.00 mL 0.100 mol·L-1AgNO3溶液加到20.00 mL0.250 mol·L-1NaCN 溶液中,所得混合液pH 为11.0.计算溶液c<Ag+>,c<CN->和c{[Ag< CN>2]-}.解:[19-10]计算 lg MYK ' 〔1〕pH = 5.0lg n ZY K '〔2〕pH =10.0lg l A Y K ' 〔3〕pH = 9.0[NH 3]+[NH 4+]=0.20 mol·L -1 ,[CN -]=10-5 mol·L -1lg i N Y K ' 解:〔1〕lgK’ZnY = lgK ZnY - lgαZn <OH> - lgαY 〔H 〕= 16.5 - 0 - 6.6 = 9.9〔2〕lgK’AlY = lgK AlY - lgαAl<OH> - lgαY 〔H 〕+ lgαAlYlgαAlY = 4.1 〔数字较大,应考虑〕lgK’AlY = 16.1 - 17.3 - 0.5 + 4.1 = 2.4〔3〕Kb = 1.8×10-5 , Ka = 5.6×10-10 , 缓冲公式: pH = pK a + lg {c <NH 3> ∕[0.20 - c <NH 3>]} = 9.0lg {c <NH 3> ∕[0.20 - c <NH 3>]} = 9.0 –9.25 = -0.25c <NH 3> = 0.072 = 10-1.14 mol·L -13() Ni NH α= 1+10-1.14×102.80+10-2.28×105.04+10-3.42×106.77+10-4.56×107.96+10-5.70×108.71+10-6.84×108.74=103.81αNi = 103.81 + 1011.3 + 100.1 = 1011.3lgαY 〔H 〕=1.4lgK’NiY = lgK NiY - lgαNi - lgαY 〔H 〕=18.6-11.3-1.4=5.9[19-11]以0.02mol·L -1EDTA 溶液滴定同浓度的含Pb 2+试液,且含酒石酸分析浓度为0.2mol·L -1,溶液pH 值为10.0.问于化学计量点时的lg PbY K ',c<Pb 2+> 和酒石酸铅配合物的浓度〔酒石酸铅配合物的lg K =3.8〕.解:()Pb PbL Pb OH ααα=+ = 102.7 +<1+0.1×103.8> = 103.1 =18.0 – 3.1 – 0.5 = 14.4c <Pb’> = < 0.01∕1014.4 >½ = 10-8.2 mol·L -1设酒石酸铅的浓度为c <PbL> ,则K 稳 = c <PbL> ∕{ c <Pb>×c <L> }103.8 = c <PbL> ∕{<10-8.2∕103.1>×0.1}c <PbL> ≈10-8.5 mol·L -1[19-12]吸取含Bi 3+,Pb 2+,Cd 2+的试液25.00 mL,以二甲酚橙作指示剂,在pH = 1.0时用0.020 15 mol.L –1 EDTA 溶液滴定,用去20.28 mL.然后调pH 至5.5,继续用EDTA 溶液滴定,又用去30.16 mL.再加入邻二氮菲,用0.020 02 mol.L –1 Pb 2+标准溶液滴定,用去10.15 mL.计算溶液中Bi 3+,Pb 2+,Cd 2+的浓度.解:在pH = 1.0时,只有Bi 3+可与EDTA 络合,故:01635.000.2528.2002015.03Bi =⨯=+c mol.L –1 在pH = 5.5时,用EDTA 溶液滴定,测定的是Pb 2+和Cd 2+的总量:02431.000.2502015.016.30=⨯ mol.L –1 滴定Pb 2+和Cd 2+的总量之后,再加入邻二氮菲,可释放出与Cd 2+结合的EDTA,故Cd 2+的浓度为: 008128.000.2515.1002002.02Cd =⨯=+c mol.L –1 Pb 2+的浓度为: 0.02431 – 0.008128 = 0.01618 mol.L –1[19-13]请为下列测定拟定分析方案:〔1〕Ca 2+与EDTA 混合液中两者的测定〔2〕Mg 2+,Zn 2+ 混合液中两者的测定〔3〕Fe 3+,Al 3 +,Ca 2+,Mg 2+混合液中各组分的测定解:〔1〕调pH=4,用Zn 2+ 滴定EDTA ;pH=7.6,用EDTA 滴定Ca 2+.〔2〕调pH=4,用EDTA 滴定Zn 2+;pH=9.7,用EDTA 滴定Mg 2+;加过量NaOH 或NH 3.〔3〕依次调pH=1.5,4.5,8,10,分别滴定.[19-14]用一定体积〔mL 〕的KMnO 4 溶液恰能氧化一定质量的KHC 2O 4·H 2C 2O 4·2H 2O ;同样质量的KHC 2O 4·H 2C 2O 4·2H 2O 恰能被所需KMnO 4体积〔mL 〕一半的0.2000mol·L-1 NaOH 溶液所中和.计算KMnO 4溶液的浓度.解:4242242KMnO KHC O H C O 2H O ⋅⋅与的反应式为[19-15]称取含Pb 3O 4试样1.2340 g,用20.00 mL 0.2500 mol·L -1H 2C 2O 4溶液处理,Pb 〔Ⅳ〕还原为Pb 〔Ⅱ〕.调节溶液pH,使Pb 〔Ⅱ〕定量沉淀为PbC 2O 4.过滤,滤液酸化后,用0.040 00 mol·L -1 KMnO 4溶液滴定,用去10.00 mL ;沉淀用酸溶解后,用同浓度KMnO 4溶液滴定,用去30.00 mL.计算试样中PbO 与PbO 2的含量.解:M <PbO> = 223.2;M <PbO 2> = 239.0反应式为+++++=+2H 2CO Pb O C H Pb 224224(n Pb> = n <422O C H > = 25n )KMnO (4 用于还原的422O C H 的物质的量即为PbO 2的物质的量.[19-16]称取含有苯酚试样0.5000 g,溶解后加入0.1000mol·L -1KBrO 3 <其中含有过量KBr>25.00mL,加酸酸化,放置待反应完全后,加入过量KI.用0.1003mol·L -1 Na 2S 2O 3溶液滴定析出的I2,用去29.91mL.求苯酚含量.解:BrO 3- + 5Br - + 6H + = 3Br 2 + 3H 2OC 6H 5OH + 3Br 2→ C 6H 2Br 3OH + 3HBrBr 2 + 2 I - = 2Br - + I 2I 2 + 2S 2O 32- = S 4O 62- + 2I -苯酚~ 3Br 2 ~ BrO 3- ~ 3I 2 ~ 6S 2O 32-n <BrO 3-> = 0.1000 ×25.00 = 2.500 mmoln <Br 2>总= 2.500 ×3 = 7.500 mmoln <S 2O 32-> = 0.1003×29.91 = 3.000 mmol与I -反应的n <Br 2> = 3.000 ÷2 = 1.500 mmol 与苯酚反应的n <Br 2> = 7.500 – 1.500 = 6.000 mmoln <苯酚> = 6.000 ÷3 = 2.000 mmolω= < 94.11 ×2.000 ×10-3 > ∕0.5000 = 37.64 %[19-17]称取1.0000g 卤化物的混合物,溶解后配制在500mL 容量瓶中.吸取50. 00mL,加入过量溴水将I-氧化至IO3-,煮沸除去过量溴.冷却后加入过量KI,然后用了19.26 mL 0.05000 mol ·L-1 Na2S2O3溶液滴定.计算KI 的含量.解:5 Br 2 + 2I - + 6 H 2O = 2IO 3- + 10 Br - +12 H +IO 3- + 5 I - +6 H + = 3 I 2 + 3 H 2OI 2 + 2 S 2O 32- = S 4O 62- + 2 I -KI ~ IO 3- ~ 3I 2 ~ 6S 2O 32-n <S 2O 32-> = 0.0500×19.26 = 0.9630 mmoln <KI> = 0.9630 ÷6 = 0.1605 mmolω= < 166.0 ×0.1605 ×10-3 > ∕ < 1.0000×0.1> = 26.64 %[19-18]称取含Pb 3O 4试样1.2340 g,用20.00 mL 0.2500 mol·L -1H 2C 2O 4溶液处理,Pb 〔Ⅳ〕还原为Pb 〔Ⅱ〕.调节溶液pH,使Pb 〔Ⅱ〕定量沉淀为PbC 2O 4.过滤,滤液酸化后,用0.040 00 mol·L -1 KMnO 4溶液滴定,用去10.00 mL ;沉淀用酸溶解后,用同浓度KMnO 4溶液滴定,用去30.00 mL.计算试样中PbO 与PbO 2的含量.解:M <PbO> = 223.2;M <PbO 2> = 239.0反应式为+++++=+2H 2CO Pb O C H Pb 224224(n Pb> = n <422O C H > = 25n )KMnO (4 用于还原的422O C H 的物质的量即为PbO 2的物质的量.[19-19]含KI 的试液25.00 mL,用10.00 mL 0.05000 mol·L -1KIO 3溶液处理后,煮沸溶液除去I 2.冷却后加人过量KI 溶液使之与剩余的KIO 3反应,然后将溶液调至中性.最后用0.1008 mol·L -1 Na 2S 2O 3溶液滴定析出的I 2, 用去21.14 mL,求KI 试液的浓度.解:本题涉与的反应为:IO 3- + 5I - + 6H + = 3I 2 + 3H 2OI 2 + 2S 2O 32- = 2I - + S 4O 62-由反应可知: 1 IO 3-~5I -, S 2O 32-~21I 2~61IO 3- 因此 02897.000.25)14.211008.06100.1005000.0(5KI =⨯⨯-⨯⨯=c mol·L -1 [19-20]称取一定量的乙二醇溶液,用 50.00mL KIO 4溶液处理,待反应完全后,将溶液调至pH = 8.0,加入过量KI 释放出的I 2用去14.00 mL0.05000mol·L -1 Na 3AsO 3 溶液滴定.另取上述KIO4 溶液50.00mL,调至pH= 8.0,加过量KI ,用去40.00mL 同浓度 Na 3AsO 3 溶液滴定.求试液中乙二醇的含量<mg>.解:4 HOCH 2-CH 2OH + IO 4- + 4 H+8 HCHO + 4H 2OIO 4- + 7 I - + 8 H + = 4 I 2 + 4 H 2OI 2 + AsO 33- + 2 OH - = AsO 43- + 2 I -+ H 2O4 HOCH 2-CH 2OH ~ IO 4- ~ 4 I 2 ~ 4 AsO 33-第一次:n <AsO 33-> = 0.0500×14.00 = 0.7000 mmol 需: n <IO 4-> = 0.7000÷4 = 0.1750 mmol 第二次:n <AsO 33-> = 0.0500×40.00 = 2.000 mmol 需: n <IO 4-> = 2.000÷4 = 0.5000 mmol n <乙二醇> = < 0.5000 – 0.1750 > × 4 = 1.300 mmolm <乙二醇> = 1.300 ×62.07 = 80.69 mg[19-21]吸取 50.00 mL 含有用IO 3-和IO 4-的试液,用硼砂调溶液pH,并用过量KI 溶液处理,使IO 4-转变为 IO 3-,同时形成的I 2用去18.40 mL 0.1000 mol·L -1 Na 2S 2O 3溶液.另取10.00 mL 试液,用强酸酸化后,加入过量KI ,用同浓度Na 2S 2O 3溶液完全滴定,用去48.70 mL.计算试液中IO 3-和IO 4-浓度.解:IO 4- + 2 I - + H 2O = IO 3- + I 2 + 2 OH -IO 4- + 7 I - +8 H + = 4 I 2 + 4 H 2OIO 3- + 5 I - +8 H + = 3 I 2 + 3 H 2O由第一次滴定:IO4-~I2~2S2O32-n<IO4-> = n <S2O32->∕2= < 0.1000×18.40 > ∕2 = 0.9200 mmol第二次滴定:IO4-~4I2~8S2O32-IO3-~3I2~6S2O32-n<S2O32-> = 0.1000×48.70 = 4.870 mmol滴定IO4-需: n<S2O32-> = 0.9200×8∕5 = 1.472 mmoln<IO3-> = < 4.870–1.472 > ∕6 =0.5663 mmol∴c<IO4-> = 0.9200∕50.00 = 0.01840 mol·L-1c<IO3-> = 0.5663∕10.00 = 0.05663 mol·L-1[19-22]称取含有H2C2O4·2H2O,KHC2O4和K2SO4的混合物2.7612 g,溶于水后转移至100mL容量瓶. 吸取试液10.00 mL,以酚酞作指示剂,用去16.25 mL 0.1920 mol·L-1 NaOH溶液滴定;另取一份试液10.00 mL,以硫酸酸化后,加热,用0.03950 mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.95 mL.〔1〕求固体混合物中各组分的含量.〔2〕若在酸碱滴定中,用甲基橙指示剂代替酚酞,对测定结果有何影响?解:n<NaOH> = 0.1920×16.25 = 3.120 mmoln<KMnO4> = 0.03950 ×19.95 = 0.7880 mmoln<C2O42-> = 2.5 ×0.7880 =1.970 mmol设H2C2O4·2H2O为x mmol,KHC2O4为< 1.970 - x >mmol,则2 x +〔1.970 - x〕= 3.120解得x = 1.150 mmoln<KHC2O4> = 1.970 – 1.150 = 0.820 mmolω<H2C2O4·2H2O> = < 126.1×1.150×10-3×10>∕2.7612 = 52.52 %ω<KHC2O4> = < 128.12 × 0.820 ×10-3×10>∕2.7612 = 38.04 %ω<K2SO4> = 1.0000 – 0.5252 – 0.3804 = 9.44 %〔2〕若在酸碱滴定中,用甲基橙指示剂代替酚酞,则会使中和反应不完全,使H2C2O4·2H2O测定结果偏低,KHC2O4测定结果也偏低.[19-23]设计用氧化还原滴定法测定各组分含量的分析方案:〔1〕Fe3+和Cr3+的混合液〔2〕As2O3和As2O5的混合物解:〔1〕用KMnO4法滴定Cr3+,用碘量法滴定Fe3+.〔2〕调pH=8,I 2 + As 2O 3→酸化后, I - + As 2O 5→[19-24]称取一含银废液2.075g,加适量硝酸,以铁铵矾作指示剂,用0.04634 mol.L –1NH 4SCN 溶液滴定,用去25.50 mL.求废液中银的含量.解:[19-25]称取某含砷农药0.2000 g,溶于硝酸后转化为H 3AsO 4,调至中性,加AgNO 3 使其沉淀为Ag 3AsO 4.沉淀经过滤,洗涤后再溶解于稀HNO 3 中,以铁铵矾作指示剂,用0.1180 mol·L -1 NH 4SCN 溶液滴定,用去33.85mL.求农药中As 2O 3的含量. 解:根据题意,存在如下反应:当反应到达终点时,Ag +与SCN -反应完全,由题可知存在如下关系:[19-26]称取含有NaCl 和NaBr 的试样0.3760 g,溶解后,用去21.11 mL 0.1043 mol.L –1 AgNO 3溶液滴定;另取同样质量的试样,溶解后,加过量AgNO 3溶液,得到的沉淀经过滤、洗涤,干燥后称重为0.4020 g.计算试样中NaCl 和NaBr 的质量分数.解:M <NaCl> = 58.44, M <NaBr> = 102.9, M <AgCl> = 143.3, M <AgBr> = 187.8 解法一:设NaCl 质量为x <g>, NaBr 质量为y <g>, 则有:上两式联立,解之得: x = 0.01509 g y = 0.2000 g因此: 04013.03760.001509.0)NaCl (==w 5319.03760.02000.0NaBr)(==w 解法二:依题意, 代入数据得:解得:[19-27]某试样含有KBrO 3、KBr 和惰性物质.称取1.000 g 溶解后配制于100mL 容量瓶中.吸取25.00mL,于H 2SO 4介质中用Na 2SO 3将 BrO 3-还原至Br -,然后调至中性,用莫尔法测定Br -,用去0.1010mol·L -1AgNO 3 10.51mL.另吸取25.00mL 用H 2SO 4酸化后加热除去Br 2,再调至中性,用上述AgNO 3溶液滴定过剩Br -时用去3.25mL.计算试样中KBrO 3和KBr 的含量.解:BrO3- + 3SO32- = Br - + 3SO42-BrO3-~Br -~Ag+n<KBrO3 + KBr> = 0.1010 ×10.51 = 1.0615 mmolBrO3- + 5Br - + 6H+ = 3Br2 + 3 H2OBrO3-~5Br -~5Ag+n<Ag+>第2次= 0.1010 ×3.25 = 0.3283 mmol滴定前已反应掉:1份KBrO3,5份KBr,设KBrO3为x mmol,则KBr为< 5 x + 0.3283〕mmol, ∴x +〔5x + 0.3283〕= 1.0615n<KBrO3> = x =<1.0615 - 0.3283>∕6 = 0.1222 mmoln<KBr> = 1.0615 – 0.1222 = 0.9393 mmol<KBrO3> = < 167.0×0.1222×10-3×4 >∕1.000 = 8.16 %<KBr> = < 119.0×0.9393×10-3×4 >∕1.000 = 44.71 %[19-28]请设计测定下列试样中氯含量的分析方案:〔1〕NH4Cl,BaCl2和FeCl3;〔2〕NaCl和Na2SO4的混合物.解:〔1〕NH4Cl:加碱、加热→NH3↑,用酸吸收后滴定;BaCl2:用佛尔哈德法;FeCl3:用莫尔法.〔2〕加Ba2+除去2-,用重量法测Na2SO4;NaCl:用莫尔法.。
分析化学 滴定法概述

比较法:用一种已知浓度的标液来确定 另一种溶液的浓度方法。
4.标准溶液浓度的表示方法
4.1物质的量浓度(简称浓度) (1)定义 单位体积溶液所含溶质的物质的量(n), 如物质B的浓度用符号 表示。
(mol/L) 注意:单位和下角标!
(2 -1)
(2)物质的量n与质量m的关系
mB nB MB
(2 -2 )
第二章 滴定分析法概述
基本概念 标准溶液 滴定分析的计算
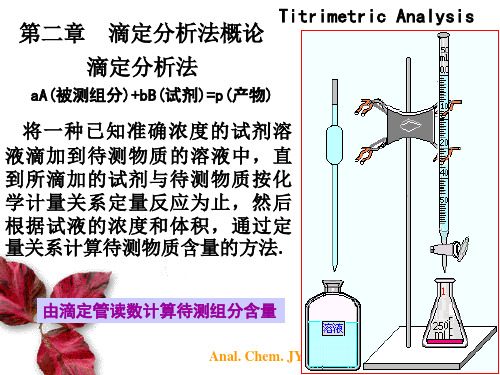
1. 基本概念
(1)滴定分析法: 将一种已知准确浓度的试剂溶液滴加到 待测物质的溶液中,直到所滴加的试剂 与待测物质按化学计量关系定量反应为 止,然后根据试液的浓度和体积,通过
定量关系计算待测物质含量的方法。
(2)滴定:滴加标准溶液的操作过程。
5.2 被测组分质量分数的计算
设试样质量为mS ,被测组分的质量为 mA ,则被测组分在试样中的质量分数为
m 100% (2-8) m a m C V M b
A A S
A
B
B
A
a C V M 100% b m
B B A A S
(2-9)
5.3 根据等物质的量反应规则计算 滴定剂和被测物质之间的计量关系
C2O42-
间接测定
3. 标准溶液
概念
标准溶液:浓度准确已知的溶液 基准物质:能用于直接配制或标定标准
溶液的物质
一般试剂等级及标志
级别 中文名称 英文名称 标签颜色 主要用途
一级 优级纯 GR 绿 精密分析实验 二级 分析纯 AR 红 一般分析实验 三级 化学纯 CP 蓝 一般化学实验 生物化 生化试剂 BR 咖啡色 生物化学及 学试剂 生物染色剂 (染色剂:玫红色) 医用化学实验
分析化学课后习题答案

第二章 误差和分析数据处理1、 指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减免方法。
答:①砝码受腐蚀:系统误差(仪器误差);更换砝码。
②天平的两臂不等长:系统误差(仪器误差);校正仪器。
③容量瓶与移液管未经校准: 系统误差(仪器误差);校正仪器。
④在重量分析中,试样的非被测组分被共沉淀: 系统误差(方法误差);修正方法,严格沉淀条件。
⑤试剂含被测组分:系统误差(试剂误差);做空白实验。
⑥试样在称量过程中吸潮:系统误差(操作误差);严格按操作规程操作。
⑦化学计量点不在指示剂的变色范围内: 系统误差(方法误差);另选指示剂。
⑧读取滴定管读数时,最后一位数字估计不准: 偶然误差;严格按操作规程操作,增加测定次数。
⑨在分光光度法测定中,波长指示器所示波长与实际波长不符: 系统误差(仪器误差);校正仪器。
10、进行下述运算,并给出适当位数的有效数字。
解:(1)34102.54106.1615.144.102.52-⨯=⨯⨯⨯(2)6102.900.00011205.1021.143.01⨯=⨯⨯(3)4.020.0020342.512104.0351.04=⨯⨯⨯- (4)53.01.050102.128.10.03242=⨯⨯⨯(5)3.193.5462107.501.89405.422.512.28563=⨯⨯-+⨯- (6)pH=2.10,求[H +]=?。
[H +]=10-2.10=7.9×10-3。
11、两人测定同一标准试样,各得一组数据的偏差如下:① 求两组数据的平均偏差和标准偏差;② 为什么两组数据计算出的平均偏差相等,而标准偏差不等; ③ 哪组数据的精密度高? 解:①nd d d d d 321n++++=0.241=d 0.242=d12i -∑=n d s 0.281=s 0.312=s ②标准偏差能突出大偏差。
滴定分析法基础

2020/5/12
3.1.1 滴定分析中的有关术语及基础知识
1. 有关术语与名词
(1)滴定分析法
(动画)
(2)标准溶液 :如0.1000 mol·L-1 HCl
(3)化学计量点(等当点)
(4)指示剂
(5)滴定终点
(6)终点误差
(7)基准物质
(8)滴定曲线
2020/5/12
BrO3- + 6 I- + 6H+ = 3 I2 + Br- + 3H2O
n(BrO3-) = 1/3 n(I2)
相当于: n(BrO3- )
3 n(I2 )
(2) 用Na2S2O3 溶液滴定析出的 I2
2 S2O32- + I2 = 2 I- + S4O62-
n(I2 ) = 1/2 n(S2O32-)
本章教学基本要求
1.熟悉滴定分析法的特点及有关名词术语。掌握滴定 分析对化学反应的要求;标准溶液的配制方法,浓度 的确定及表示方法。
2.掌握滴定分析基本原理,包括化学平衡的基本原理 及相关计算,滴定曲线的计算方法,滴定终点、突跃 范围的确定及影响因素;各种指示剂的变色原理、选 择方法;终点误差与直接滴定的条件等。
1. 标准溶液和基准物
标准溶液的浓度通过基准物来确定。 基准物应具备的条件: (1) 必须具有足够的纯度; (2) 组成与化学式完全相同; (3) 稳定; (4) 具有较大的摩尔质量。为什么? (可降低称量误差)。 常用的基准物有: K2Cr2O7;Na2C2O4; H2C2O4•2H2O; Na2B4O7•10H2O; CaCO3;NaCl;Na2CO3
《分析化学酸碱滴定法》

《分析化学酸碱滴定法》
分析化学酸碱滴定法是一种常用的定量分析方法,用于测定溶液中的酸碱物质的浓度。
酸碱滴定法是通过滴定试剂的体积和溶液中目标物质的反应来确定目标物质的浓度,是一种简便、快速、准确的分析方法。
酸碱滴定法的原理是根据酸碱中和反应来确定溶液中的酸碱物质的浓度。
在酸碱滴定中,一种称为指示剂的物质通常被添加到待测溶液中,以便在滴定过程中显示颜色变化。
当滴定试剂与溶液中的目标物质完全反应时,指示剂会发生颜色变化,从而表明滴定达到终点。
通过记录滴定试剂的用量和终点指示剂的颜色变化,可以计算出目标物质的浓度。
酸碱滴定法的步骤通常包括准备待测溶液、选择合适的指示剂、准备滴定试剂、进行滴定、记录终点和计算结果等。
首先,将待测溶液放入滴定烧杯中,然后加入适量的指示剂。
接着,逐滴加入滴定试剂并持续搅拌溶液,直到出现终点指示剂颜色变化。
记录滴定试剂的用量,根据滴定试剂的浓度和滴定时的体积,计算出目标物质的浓度。
酸碱滴定法广泛应用于实验室中的定量分析和质量控制。
它可以用于测定饮用水、食品、药品、石油产品等中的酸碱物质的含量,也可以用于测定工业废水、环境样品等中的酸碱物质。
酸碱滴定法具有简单、快速、准确和敏感等优点,特别适用于需要高精度和高效率的实验室分析。
总的来说,酸碱滴定法是一种重要的分析化学方法,广泛应用于各个领域的定量分析。
通过掌握酸碱滴定法的原理和操作步骤,可以更准确地测定溶液中酸碱物质的浓度,为科学研究和生产实践提供有力的支持。
第十九章 滴定分析法

0.1005 mol /L
例2 为标定HCl溶液,称取硼砂(Na2B4O7·10H2O)0.4710g,用 HCl溶液滴定至化学计量点消耗24.20mL。求HCl溶液的浓度。
解
Na2 B4O7 2HCl 5H 2O 4H3BO3 2NaCl
c Vn 2n V (HCl )
(HCl ) (HCl )
6 0.01500 33.45103 55.85 0.3359 0.5006
以Fe2O3形式表示质量分数: 由于每个Fe2O3分子中有2个Fe原子
n(Fe2O3 )
1 2
n( Fe)
则 wFe2O3
m(Fe2O3 ) m( s )
n M (Fe2O3 ) (Fe2O3 ) m( s )
解
Cr2O72 6I 14H 2Cr 3 3I2 7H2O
I2 2S2O32 2I S4O62
n 16 n (K2Cr2O7 )
( Na2S2O3 )
m 1 (K2Cr2O7 ) M 6 c V (K2Cr2O7 )
( Na2S2O3 ) ( Na2S2O3 )
c M 6m V (Na2S2O3 )
第十九章 滴定分析法
滴定分析
酸
配
碱
位
滴
滴
定
定
法
法
氧
沉
化 原
淀
还
滴
滴 定
定
法
法
学习要求
学习要求
1.了解滴定分析和基本知识; 2.掌握酸碱滴定、配位滴定、氧化还原滴定和沉淀滴定
法的基本原理; 3.掌握各种滴定分析的实际应用。
返回
第一节 滴定分析法概论
一、滴定分析过程和方法分类 滴定分析法----将标准溶液,滴加到被测物质的溶液中,或者是将被
滴定分析法总结范文

滴定分析法总结范文
酸碱滴定是滴定分析中最常用的方法之一、它是通过酸和碱之间的中
和反应来确定酸性或碱性物质的含量。
在滴定过程中,滴定试剂会与待测
溶液中的酸或碱发生反应,通过检测反应终点所要使用的指示剂颜色的变化,来判断滴定试剂的用量和酸碱溶液的浓度。
氧化还原滴定常用于测定含氧化还原物质的浓度。
在滴定过程中,氧
化剂与待测溶液中的还原剂发生氧化还原反应,通过观察溶液颜色的变化
或者使用指示剂来确定滴定反应的终点,进而计算出待测溶液中还原剂的
浓度。
络合滴定是测定金属离子和配体之间络合物的浓度的一种方法。
在滴
定过程中,滴定试剂(配体)与待测溶液中的金属离子形成络合物,通过
溶液颜色的变化或者通过其他检测手段来判断滴定反应的终点。
滴定分析法的实验条件严格,操作技巧要求高。
为了获得准确的滴定
结果,滴定试剂的浓度和用量、试剂的纯度、滴定过程中剧烈搅拌的程度、溶液的温度、反应时间等都需要严格控制。
同时,选择合适的指示剂对于
滴定分析也是至关重要的。
除了注意实验细节外,在实验过程中还需要注意实验室安全。
滴定试
剂和待测溶液中可能存在的有毒、易燃品质,以及气体的产生等都需要注
意控制,避免产生危险。
总之,滴定分析法是一种应用广泛、准确快速、操作简便的化学分析
方法。
它在医药、食品、环境等领域具有重要的应用价值。
在实验过程中
需要注意实验技巧的掌握、实验条件的控制以及实验室安全的保障,以便
获得准确可靠的滴定结果。
2-滴定分析法概论0
基本术语:
标准溶液: 已知准确浓度的溶液 滴定: 将标准溶液通过滴定管滴加到被测物质溶液中的操作 化学计量点(sp): A与B恰好按反应式完全反应 指示剂:滴定分析中能发生颜色改变而指示终点的试剂 滴定终点(ep):指示剂的颜色突变,停止滴定 滴定误差(终点误差(Et)) :epsp,由此造成的滴定误差
淡 红 色 [Fe (
SCN)]2+
Anal. Chem. JYPC
置换滴定法
将待测试样定量地转化为可直接滴定的物质后进行直接滴定的方式
例4: Na2S2O3+K2Cr2O7
K2Cr2O7 +过量KI
S4O62-+SO42无定量关系 定量生成 I2 淀粉指示剂
Na2S2O3标液
深蓝色消失
适用:无明确定量关系的反应(不满足条件1)
Anal. Chem. JYPC
m溶液 B ( V ' ) B m ( )B nB MB MB M cB V V V V
§2.3 基准物质与标准溶液
标准溶液:
具有准确浓度的溶液(通常保留四位有效数字)
基准物质:
能用于直接配制标准溶液或标定标准溶液的物质 基准试剂又分为C级基准(含量在99.98%以上)和 D级基准(含量在99.95%以上,也叫第一基准和工作 基准。一般滴定分析用工作基准试剂即可)
Anal. Chem. JYPC
如: THCl
/ NaOH
= 0.003001 g/mL
表示每消耗1mLNaOH标液可与0.003001g HCl完全反应 TFe/K2Cr2O7=0.005000 g/mL,如消耗K2Cr2O7标准溶液
21.50毫升,问被滴定溶液中铁的质量?
分析化学:19章(4)_沉淀滴定法.

(1)沉淀反应必须迅速,并按一定的化学计量关系进行。 (2)生成的沉淀应具有恒定的组成,而且溶解度必须很小。 (3)有确定化学计量点的简单方法。 (4)沉淀的吸附现象不影响滴定终点的确定。
目前应用最多的是生成难溶银盐的反应(银量法)。 Ag+ + Xˉ = AgX (Xˉ :Cl ˉ,Br ˉ,I ˉ,CN ˉ,SCN ˉ)
2 3 3 2 如SO3 、PO4 、AsO4 、S 2、C2 O4 等
优点:测Cl-、Br- 直接、简单、准确。) 缺点:干扰大(生成沉淀AgmAn 、Mm(CrO4 )n、 M (OH)n等); 不可测I-、SCN- ; 注意 先产生的AgCl沉淀容易吸附溶液中的C1-,使
溶液中的Cl-浓度降低,以致终点提前而引入误差。
入已知过量的AgNO3标准溶液,再用铁铵矾作指示剂,用
NH4SCN标准溶液回滴剩余的Ag+(HNO3介质)。 X-+ Ag+(过量)=AgX↓ Ag+(剩余)+SCN-=AgSCN↓ Fe3++SCN-=(FeSCN)2+
注意的几个问题:
(1)因为Ksp(AgSCN) < Ksp(AgCl)
AgCl SCN AgSCN Cl
[Ag ]AgCl
[Ag ]Ag 2CrO 4
Ksp(AgCl) 1.8 1010 9 1 1 . 8 10 mol L [Cl ] 0.10
K sp(Ag 2CrO 4 ) 1.110 12 5 -1 1 . 0 10 mol L [CrO 2 0.010 4 ]
(3)此方法的优点:在酸性溶液中滴定,许 多的弱酸根离子都不会干扰,选择性较高。 (4)干扰:强氧化剂、氮的低价氧化物、铜
分析化学-第二章-滴定分析法概述
(g / mL)
1000
(2)TB/T 指每毫升标准溶液相当于待测物 (B)的质量
aA bB cC dD
TB /T
m(B) V (T )
nB M B VT
b nA M B a VT
b nA M B b CAM B a VT 1000 a 1000 1000
3.3滴定剂的量浓度与滴定度的换算
➢ 应指明基本单元:原子、分子、离子、电子等。
注意B为一基本单元,B可以是原子、分子、离 子及其它基本粒子,如 C(1/6K2Cr2O7), C(1/6K2Cr2O7)=6 C(K2Cr2O7) 以H2SO4作基本单元,98.08g为1mol;以1/2 H2SO4为基本单元,则为2mol。 1mol所包含的基本单元数与0.012kg C12 的原子数目相等。
生化及医用化学
注意标准试剂、高纯试剂、专用试剂的区别
§1滴定分析法简介
使用滴定管将一种已知 准确浓度的试剂溶液(标 准溶液)滴加到待测物的 溶液中,直到待测组分恰 好完全反应为止,然后根 据标准溶液的浓度和所消 耗的体积,算出待测组分 的含量。
1.1滴定分析基本术语
滴定(Titration):滴加标准溶液的操作过程。 化学计量点(Stoichiometric point):滴加标
Na2S2O3+K2Cr2O7 K2Cr2O7 +过量KI
S4O6 2-+SO4 2无定量关系
定量生成 I2
Na2S2O3 标液 淀粉指示剂
深蓝色消失
§3 标准溶液
3.1 标准溶液配制
1.直接配制法 直接用容量瓶配制,定容。一般使用 基准试剂或优级纯。
2. 间接配制法(标定法)
标准溶液的浓度通过基准物来确 定或用一种已知浓度的标液来确定另
药用化学-19-1 滴定分析法检测题二 有答案

三、选择题
1、下列是滴定分析反应必须具备的条件是(B )
①反应必须按化学方程式定量完成,没有副反应;
②反应速率快;③反应必须生成气体;
④反应必须有沉淀生成;⑤有适当的方法确定化学计量点;
⑥反应必须有水生成;
A.①②③④⑤⑥;B.①②⑤;C.③④⑤⑥;D.①②⑤⑥;
2、用盐酸标准溶液测定氢氧化钠溶液的浓度属于(A )
A ①③④⑤⑥ B ②③④⑤⑥ C ①④⑥ D ①③⑤
16、下列物质是基准物质的有( D )
A 盐酸 B 氢氧化钠 C 高锰酸钾 D 邻苯二甲酸氢钾
17、用 NaOH 标准溶液滴定 HAc 的过程中,化学计量点偏碱性,应选用(
A.甲基橙;B.酚酞;C.溴酚蓝;D.甲基红;
18、下列哪个是酸碱指示剂指示剂( D):
A KMnO4
B EBT
C 萤光黄 D 酚酞
B )为指示剂。
问答题 1、什么是化学计量点(理论终点)?什么是滴定终点?
答:滴加的标准溶液与待测组分恰好反应完全的这一点称为化学计量点。 指示剂变色时停止滴定的这一点为滴定终点(end point, ed )。 2、什么滴定误差?(应为终点误差)? 答:滴定终点与化学计量点不一定恰好符合,由此而造成的分析误差称为终点误差。 3、滴定分析中化学计量点与滴定终点有何区别? 答:化学计量点是根据化学方程式计算的理论终点,滴定终点是实际滴定时用指示剂变色 或其它方法停止滴定的点。滴定终点与化学计量点不一定恰好符合,由此而造成的分析 误差称为终点误差。 4、什么是基准物质?什么是标准溶液? 答: 已知准确浓度的溶液叫标准溶液。 能用来直接配制标准溶液或标定标准溶液的物质叫基准物质。
教学目标检测题二 一、填空题
1、用每mL标准溶液相当于被测物质的质量表示溶液的浓度称为滴定度,其单位是 g/ml。 2、根据滴定时化学反应的类型不同,滴定分析可分为四类:酸碱滴定法、氧化还 原滴定法、配位滴定法和沉淀滴定法。 3、滴定分析法又称 容量分析 法,在滴定分析中已知准确浓度的试剂溶液称为 标 准溶液 。将标准溶液通过滴定管加入到被测物质中的过程称为 滴定 。标准溶液 与被测物质完全反应时称为化学计量点。 4、一般情况下,硼砂、K2Cr2O7标准溶液采用_直接_法配制,而KMnO4、NaOH标准 溶液采用_间接_法配制。 5、能用于直接配制或标定标准溶液的物质称为基准物质。基准物质必须具备 纯 度高 、 性质稳定 、 组成恒定、摩尔质量尽可能大等条件。 6、滴定分析法的滴定方式有直接滴定法、__返滴定法______、间接滴定法、__置 换滴定法______。 7、定量分析的一般过程 取样、制备试液、消除干扰、选择分析方法、测定、计 算。 二、判断题 V1、指示剂的用量不宜过多,因浓度大时,溶液颜色较深,变色不敏锐。 V2、用每 mL 标准溶液相当于被测物质的质量表示溶液的浓度称为滴定度。 V3、间接法配制的标准溶液,其准确浓度需要用基准物质或已知准确浓度的标准 溶液标定。 X4、滴定分析中,滴定至溶液中指示剂恰好发生颜色突变时即为计量点。 V5、不论采用何种滴定方法,都离不开标准溶液。 X6、标准溶液的浓度只能用物质的量浓度表示。 X7、滴定分析法测定结果准确度较高,相对误差不超过 0.2%,所以也适用于微量 组分的测定。 x8、用来直接配制标准溶液的物质称为基准物质,KMnO4 是基准物质。 V9、滴定终点与化学计量点不一定恰好符合,由此而造成的分析误差称为终点误 差。 V10、定量计算的基础是标准溶液与被测物质之间的反应要按一定的化学反应方程 式进行,而且反应要进行完全(要求达到 99.9%以上)。 V11、滴定分析法的滴定终点多数的是选用适当的指示剂来判断滴定终点的,有的 也可以用仪器测试。 X12、NaOH、KMnO4 、K2Cr2O7、HCl 都是非基准物质。 V13、草酸钠、硼砂和邻苯二甲酸氢钾都是非基准物质。 V14、硼砂和邻苯二甲酸氢钾都可以直接法配制标准溶液。 V15、滴定分析法又称容量分析法,间接配制法又称标定法。
滴定分析法概论

第一节 滴定分析方法和滴定方式
❖ 滴定分析法定义及几个基本术语 ❖ 滴定分析法的特点及主要方法 ❖ 滴定分析对化学反应的要求及主要方式
一、 基本概念
滴定分析法:
将一种已知准确浓度的试剂溶 液滴加到待测物质的溶液中, 直到所滴加的试剂与待测物质 按化学计量关系定量反应为止, 然后根据试液的浓度和体积, 通过定量关系计算待测物质含 量的方法
MLn-1 + L ⇌ MLn Kn
βn = K1K2 ···Kn
2、配合物在溶液中各型体的分布
设金属离子的总浓度为c(M),c(M) = [M] + [ML] + ···+ [MLn]
x0 = x1 =
xn =
[M] c(M) [ML] c(M)
[ML2] c(M)
1
= 1+1[L]+n[L]n
2.二元酸:
H2C2O4
HC2O4-+ H+
HC2O4-
C2O42- + H+
C H2C2O4 HC2O4 C2O42
H2C2O4
H 2C2O4 C
H 2 H 2 Ka1 H
Ka1 Ka2
1
HC 2O4
HC 2O4 C
Ka1 H H 2 Ka1 H Ka1 Ka2
nB
mB MB
(mol )或(mmol )
CB
nB V
mB M BV
(mol / L)或(mmol / L)
➢ 滴定度 :
TA 指每毫升标准溶液含有溶质的质量
TA
mA V
(
gபைடு நூலகம்
/
mL
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第19章 滴定分析法【19-1】写出下列各酸碱水溶液的质子条件式:(1)NH 4Cl(2)NH 4Ac(3)HAc + H 3BO 3 (4)H 2SO 4 + HCOOH(5)NaH 2PO4 + Na 2HPO 4(6)NaNH 4HPO 4答:(1)NH 4Cl :c(NH 3) + c(OH -) = c(H +) (2)NH 4Ac :c(NH 3) + c(OH -) = c(H +) + c(HAc) (3)HAc + H 3BO 3:c(H +) = c(OH -) + c(Ac -) + c(H 4BO 4-)(4)H 2SO 4 + HCOOH :c(H +) = c(OH -) + c(HCOO -) + c(HSO 4-) + 2c(SO 42-) (5)NaH 2PO4 + Na 2HPO 4c 1 c 2以NaH 2PO 4为零水准:c(H +) + c(H 3PO 4) = c(OH -) + c(HPO 42-) + 2c(PO 42-)–c 2 以Na 2HPO 4为零水准:c(H +) + c(H 2PO 4-) +2c(H 3PO 4)–c 1= c(OH -) + c(PO 43-)(6)NaNH 4HPO 4:c(H +) + c(H 2PO 4-) +2c(H 3PO 4) = c(OH -) + c(PO 43-) + c(NH 3) 【19-2】计算下列溶液的pH : (1)50mL 0.10 mol·L -1 H 3PO 4(2)50mL 0.10 mol·L -1 H 3PO 4 + 25mL 0.10 mol·L -1 NaOH (3)50mL 0.10 mol·L -1 H 3PO 4 + 50mL 0.10 mol·L -1 NaOH (4)50mL 0.10 mol·L -1 H 3PO 4 + 75mL 0.10 mol·L -1 NaOH解:(1)已知H 3PO 4的K a 1 = 6.9×10-3,K a 2 = 6.2×10-8, K a 3 = 4.8×10-13 由于K a 1>> K a 2 >> K a 3,31109.61.0-⨯=a K c <500,故应用一元弱酸的近似公式: [H +] = c K K K a a a 121142++–= –1.0109.64)109.6(2109.63233⨯⨯+⨯+⨯--- = 2.3×10-2 mol.L -1 pH = 1.64(2)H 3PO 4与NaOH 反应,生成NaH 2PO 4,浓度为:0333.025500.10)(25=+⨯mol·L –1根据溶液组成,按共轭酸碱对公式进行溶液pH 计算,先按最简式计算:3[]7.5210a a ab bc c HK cc +-==⨯⨯ ∵1abc c =,∴3[]lg lg(7.5210) 2.12a a H K pH K +-=⇒=-=-⨯= (3)H 3PO 4与NaOH 等摩尔反应,全部生成NaH 2PO 4,浓度为 0.10/2 = 0.050 mol.L –1 由于202.7109.605.031<=⨯=-a K c ,故应用近似式:[H +] =12/1a a K c c K + 即 [H +] =58109.12.71050.0102.6--⨯=+⨯⨯ pH = 4.71(2)H 3PO 4 与 NaOH 反应后,溶液组成为NaH 2PO 4 + Na 2HPO 4,两者的浓度比为1:1,此时溶液为缓冲溶液。
由H 3PO 4的K a2 = 6.2×10-8,可知H 3PO 4的第二个质子不易离解,故应用缓冲溶液的最简式: pH = 7.21【19-3】讨论下列物质能否用酸碱滴定法直接滴定?使用什么标准溶液和指示剂? (1)NH 4Cl (2)NaF (3)乙胺 (4)H 3BO 3(5)硼砂(6)柠檬酸解:(1)1410w 4a 5b K 1.010NH K 5.610K 1.810-+--⨯===⨯⨯为一元质子酸 41118a a NH C 0.1000mol L C K 5.610C K 1.010+---=⋅⋅=⨯<⋅=⨯Q 设所以NH 4Cl 不能用于直接滴定,可用甲醛法间接滴定。
(2)1411w b 4a K 1.010F K 2.810K 3.5310----⨯===⨯⨯为一元质子酸 1128b b F C 0.1000mol L C K 2.810C K 1.010----=⋅⋅=⨯<⋅=⨯Q 设所以NaF 不能用于直接滴定。
(3)4322b b CH CH NH K 5.610PK 3.25-=⨯=,,乙胺322-158CH CH NH b C 0.1000mol L C K 5.6101.010--=⋅⋅=⨯>⨯,设∴CH 3CH 2NH 2可以用HCl 标准溶液滴定。
322323HCl CH CH NH CH CH NH Cl +-+=+计量点产物323CH CH NH +7[H ]9.410+-===⨯ pH 6.03=可选用百里酚蓝作指示剂,pK HIn =7.3(黄6.0~7.6蓝)。
(4)不能,因K a = 5.8×10-10太小。
但可用甘油等强化,使其生成络合酸,化学计量点的pH=9.0,可选用酚酞作指示剂。
(5)2-24724723323Na B O 10H OB O 5H O 2H BO 2H BO -⋅+=+硼砂-523b H BO K 1.710-=⨯,具有较强的碱性133H BO 0.1000mol L -⋅,化学计量点时的浓度为61[H ]7.610mol L pH 5.1+--==⨯⋅=1124720.1000mol L HCl 0.05000mol L Na B O 10H O --∴⋅⋅⋅,可用直接滴定 可以选用甲基红作指示剂。
(6)4571a12a213a3Ka 7.410,PK 3.14;Ka 1.710,PK 4.76;Ka 4.010,PK 6.40;---=⨯==⨯==⨯=-158a1C 0.1000mol L C K 7.4101.010;--=⋅⋅=⨯>⨯,设 6888a2a3C K 1.7101.010;C K 4.0101.010;----⋅=⨯>⨯⋅=⨯>⨯44a1a2a2a3K K 1010H K K --+<<∴;且该三元酸中的三个都可以 pH 用强碱直接滴定,且可以一次滴定,产生一个突跃。
3332H A 3OH A 3H O A ---+=+;相当于三元质子酸51[OH ] 2.510mol L ---===⨯⋅ pH 9.40pOH 4.60==;可选酚酞作指示剂。
【19-4】某一含有Na2CO3,NaHCO3及杂质的试样0.6020g,加水溶解,用0.2120 mol·L-1HCl 溶液滴定至酚酞终点,用去20.50mL;继续滴定至甲基橙终点,又用去24.08mL。
求Na2CO3和NaHCO3的质量分数。
解:33-321HCl HClNaHCONaHCOV VC M(24.0820.50)100.212084.010.1059m(s)0.6020ω-⋅-⨯⨯⨯===()2323-3HCl HCl Na CONa CO11C2V M0.2120220.5010105.99220.7652m(s)0.6020ω⋅⋅⨯⨯⨯⨯⨯===【19-5】已知某试样可能含有Na3PO4,Na2HPO4,NaH2PO4和惰性物质。
称取该试样的1.0000 g,用水溶解。
试样溶液以甲基橙作指示剂,用0.2500mol·L-1HCl 溶液滴定,用去12.00mL。
含同样质量的试样溶液以百里酚酞作指示剂,需上述HCl溶液12.00mL。
求试样组成和含量。
解:【19-6】用克氏定氮法处理0.300 g某食物试样,生成的NH3收集在硼酸溶液中。
滴定消耗0.100 mol·L-1HCl 溶液25.0 mL;计算试样中蛋白质的质量分数(将氮的质量分数乘以6.25即得蛋白质的质量分数)。
解:30.10025.01014.0076.250.7300.300w-⨯⨯⨯=⨯=蛋白质【19-7】试设计下列混合液的分析方法:(1)HCl和NH4Cl (2)硼酸和硼砂(3)Na2CO3和NaHCO3 (4)NaOH 和Na3PO4解:(1)K a (NH4+) = 10-9.25HCl用NaOH标准溶液,甲基橙指示剂。
NH4Cl:加NaOH→NH3,用H3BO3吸收,然后用HCl 标准溶液,甲基红指示剂滴定。
(2)根据溶液pH值用缓冲公式计算硼酸和硼砂比值;硼砂:用HCl标准溶液,甲基红指示剂滴至H3BO3。
(3)用HCl 标准溶液,双指示剂。
(4)【19-8】在铜氨配合物的水溶液中,若Cu(NH3)42+的浓度是Cu(NH3)32+浓度的100倍,问水溶液中氨的平衡浓度。
解:查表知:12.59【19-9】将20.00 mL 0.100 mol·L-1AgNO3溶液加到20.00 mL0.250 mol·L-1NaCN 溶液中,所得混合液pH 为11.0。
计算溶液c(Ag+),c(CN-)和c{[Ag( CN)2]-}。
解:【19-10】计算 lg MYK ' (1)pH = 5.0 lg n ZY K ' (2)pH =10.0lg l AY K ' (3)pH = 9.0[NH 3]+[NH 4+]=0.20 mol·L -1 ,[CN -]=10-5 mol·L -1lg i NY K ' 解:(1)lgK’ZnY = lgK ZnY - lgαZn (OH) - lgαY (H ) = 16.5 - 0 - 6.6 = 9.9(2)lgK’AlY = lgK AlY - lgαAl(OH) - lgαY (H )+ lgαAlYAlY OH48.1AlOHY - 1 (OH )11010a c K -=+=+⨯lgαAlY = 4.1 (数字较大,应考虑) lgK’AlY = 16.1 - 17.3 - 0.5 + 4.1 = 2.4 (3)Kb = 1.8×10-5 , Ka = 5.6×10-10 , 缓冲公式: pH = pK a + lg {c (NH 3) ∕[0.20 - c (NH 3)]} = 9.0 lg {c (NH 3) ∕[0.20 - c (NH 3)]} = 9.0 –9.25 = -0.25 c (NH 3) = 0.072 = 10-1.14 mol·L -13()Ni NHα=1+10-1.14×102.80+10-2.28×105.04+10-3.42×106.77+10-4.56×107.96+10-5.70×108.71+10-6.84×108.74=103.81431.32011.3Ni(CN)41(CN )1101010c αβ--≈+=+⨯=0.1Ni(OH)10α=αNi = 103.81 + 1011.3 + 100.1 = 1011.3 lgαY (H )=1.4lgK’NiY = lgK NiY - lgαNi - lgαY (H )=18.6-11.3-1.4=5.9【19-11】以0.02mol·L -1EDTA 溶液滴定同浓度的含Pb 2+试液,且含酒石酸分析浓度为0.2mol·L -1,溶液pH 值为10.0。
