相律相图答案..
相律及二元相图

• 但上述三个平衡中只有两个是独立的,可由其中任意两个 通过相加减得到第三个.因此R=23.
一、基本概念
2. 物种数和组分数
如有特殊限制条件,情况又将不同 如PCl5,PCl3,Cl2三种物质组成系统中,若指定 mol(PCl3)/mol(Cl2)=1,或开始时只有PCl5,则平衡时 mol(PCl3)/mol(Cl2)=1,这时就存在一浓度限制条件,因此K= 1 23.
一、基本概念
2. 物种数和组分数
物种数S随着考虑问题的角度不同而不同,但是K值总是一样的. 如:NaCl,H2O构成系统,只考虑相平衡,S=K=2. Sol(NaCl+H2O),考虑NaCl电离平衡,S=3,有H2O,Na+,Cl-, 因为溶解是电中性的, mol(Na+)=mol(Cl-),R`=1,K=3-1=1. 再考虑H2O的电离平衡,S=6, NaCl,H2O, Na+,Cl-, H+, OH-.此时,R=2,R`=2 NaCl=Na++ClK=S-R-R`=6-2-2=2 H2O=H++OHmol(Na+)=mol(Cl-), mol(H+)=mol(OH-),
K=S-R-R` R`:浓度限制条件.
注意:浓度限制条件只在同一相中方才能成立,在不同相之 间,浓度限制条件不成立. CaCO3的分解,mol(CaO)/mol(CO2)=1, 但是由于一个是固相一个是气相浓度限制条件不成立,K=2 1.
一、基本概念
2. 物种数和组分数
尽管一开始只有CaCO3 ,平衡时:
定温下,气液平衡时气相组成为:
pA* p pB*
pA p A* x A yA * p p A ( pB* p A* ) x B
物理化学相图试卷及答案

物理化学相图试卷及答案相平衡一、选择题41、(本题2分)用比较准确的语言表达,相图说明的是()系统。
A.封闭系统B.已达平衡的多相开放系统C.非平衡开放系统D.开放系统B2、(本题2分)在标准压强下,根据吉布斯相律,双组分平衡系统的最大条件自由度数为()。
4A.1B.2C.3D.4B3、(本题2分)NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时有()。
6A.C=2,Φ(P)=2,?=2;B.C=1,Φ(P)=2,?=1;C.C=1,Φ(P)=3,?=2;D.C=1,Φ(P)=2,?=3。
A4、(本题2分)二组分合金处于两相平衡时系统的条件自由度数?(F)为()。
6A.0;B.1;C.2;D.3。
B5、(本题2分)I2在液态水和CCl4中达到分配平衡(无固态碘存在)则该系统的条件自由度数为()。
6A.?’=1;B.?’=2;C.?’=0;D.?’=3。
D6、(本题2分)对恒沸混合物的描写,下列各种叙述中哪一种是不正确的()5A.与化合物一样,具有确定的组成;B.恒沸混合物的组成随压力的改变而改变;C.平衡时,气相和液相的组成相同;D.其沸点随外压的改变而改变。
B7、(本题2分)硫酸与水可形成H2SO4?H2O(s),H2SO4?2H2O(s),H2SO4?4H2O(s)三种水合物,问在101325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种()6A.3种;B.2种;C.1种;D.不可能有硫酸水合物与之平衡共存。
C8、(本题2分)某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H2O(g)+C(s)H2(g) +CO(g);CO2(g)+H2(g)H2O+CO(g);CO2(g)+C(s)2CO(g)。
则该系统的组分数C为()。
6A.3;B.2;C.1;D.4。
A9、(本题2分)当水、冰、水蒸气三相平衡共存时,系统的自由度数为()。
第四章 二元合金相图与合金凝固参考答案

第四章二元合金相图与合金凝固一、本章主要内容:相图基本原理:相,相平衡,相律,相图的表示与测定方法,杠杆定律;二元匀晶相图:相图分析,固溶体平衡凝固过程及组织,固溶体的非平衡凝固与微观偏析固溶体的正常凝固过程与宏观偏析:成分过冷,溶质原子再分配,成分过冷的形成及对组织的影响,区域熔炼;二元共晶相图:相图分析,共晶系合金的平衡凝固和组织,共晶组织及形成机理:粗糙—粗糙界面,粗糙—光滑界面,光滑—光滑界面;共晶系非平衡凝固与组织:伪共晶,离异共晶,非平衡共晶;二元包晶相图:相图分析,包晶合金的平衡凝固与组织,包晶反应的应用铸锭:铸锭的三层典型组织,铸锭组织控制,铸锭中的偏析其它二元相图:形成化合物的二元相图,有三相平衡恒温转变的其它二元相图:共析,偏晶,熔晶,包析,合晶,有序、无序转变,磁性转变,同素异晶转变二元相图总结及分析方法二元相图实例:Fe-Fe3C亚稳平衡相图,相图与合金性能的关系相图热力学基础:自由能—成分曲线,异相平衡条件,公切线法则,由成分—自由能曲线绘制二元相图二、1.填空1 相律表达式为___f=C-P+2 ___。
2. 固溶体合金凝固时,除了需要结构起伏和能量起伏外,还要有___成分_______起伏。
3. 按液固界面微观结构,界面可分为____光滑界面_____和_______粗糙界面___。
4. 液态金属凝固时,粗糙界面晶体的长大机制是______垂直长大机制_____,光滑界面晶体的长大机制是____二维平面长大____和_____依靠晶体缺陷长大___。
5 在一般铸造条件下固溶体合金容易产生__枝晶____偏析,用____均匀化退火___热处理方法可以消除。
6 液态金属凝固时,若温度梯度dT/dX>0(正温度梯度下),其固、液界面呈___平直状___状,dT/dX<0时(负温度梯度下),则固、液界面为______树枝___状。
7. 靠近共晶点的亚共晶或过共晶合金,快冷时可能得到全部共晶组织,这称为____伪共晶__。
相律相图答案

第5章 相律与相图复习思考题1.什么是独立组分数独立组分数与物种数有何区别和联系2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在下列物质共存的平衡系统中,有几个独立反应请写出反应式。
(a )C (s )、CO (g )、CO 2(g )、H 2(g )、H 2O (l )、O 2(g )。
(b )C (s )、CO (g )、CO 2(g )、Fe (s )、FeO (s )、Fe 3O 4(s )、Fe 2O 3(s )4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确为什么5.水和水蒸气在363 K 平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变 6.什么是自由度自由度是否等于系统状态的强度变量数如何理解自由度为零的状态7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量若CaCO 3量过少可能会发生什么现象8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少9.二液体组分若形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出下列平衡系统的物种数、组分数、相数和自由度: (1)Ca (OH )2(s )与CaO (s )、H 2O (g )呈平衡。
(2)CaSO 4与其饱和水溶液达平衡。
(3)在标准压力下,水与水蒸气平衡。
(4)由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; (5)由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:(1)3,1,0,=3,=1SR b f ===Φ(2)2,0,0,=2,=2S R b f ===Φ (3)1,0,0,=2,=0SR b f ===Φ (4)5,2,0,=4,=1SR b f ===Φ(5)5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统达到平衡: (1))求该系统组分数和自由度;(2)若将NH 4HS 放在一抽空容器内分解,平衡时,其组分数和自由度又为多少 解:(1)3,1,0,=2,=2SR b f ===Φ(2)3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: (1)在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种 (2)在 K 时,与水蒸气平衡共存的含水盐最多可有几种解:(1)设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。
物理化学第5章相律与相图

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。
大学物理化学5-相图课后习题及答案

相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”。
1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)及H2 S(g)达平衡时有:( )。
(A)C=2,φ=2,f =2;(B) C=1,φ=2,f =1;(C) C=1,φ=3,f =2;(D) C=1,φ=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种;(B) 2种;(C) 1种;(D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H2O(g)+C(s) H2(g) + CO(g)CO2(g)+H2(g) H2O + CO(g)CO2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1;(D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80︒C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。
工科大学化学(物理化学)相律与相图部分习题及解答

第12章相律与相图1.试计算下列平衡体系的自由度数:(1) 298.15 K、101 325Pa下固体NaCl与其水溶液平衡;(2) I2(s) ? I2(g);(3) NaCl(s)与含有HCl的NaCl饱和溶液。
(答案:①0,②1,③3)解:(1) K = 2, R = 0, b = 0, φ= 2∴C = K-R-b = 2, 又T, p已指定∴f = C -φ + n = 2- 2 + 0 = 0(2) K=1, R = 0, b = 0, φ=2∴C = K-R-b =1- 0- 0 =1则f = C -φ + n = 1- 2 + 2 = 1(3) K=3, R = 0, b = 0, φ=2则C = K-R-b =3–0–0 = 3∴f = C -φ + n =3- 2 + 2 = 32.固体NH4HS和任意量的H2S及NH3气体混合物组成的体系按下列反应达到平衡:NH4HS(s) ? NH3(g)+H2S(g)(1) 求该体系组元数和自由度数;(2) 若将NH4HS放在一抽空容器内分解,平衡时,其组元数和自由度数又为多少?(答案:①2,2,②1,1)解:(1) K=3, R = 1, b = 0, φ=2∴C = K-R-b =st1:chsdate Year="2000" Month="3" Day="1" IsLunarDate="False" IsROCDate="False">3 -1- 0 = 2 即体系组元数为2而体系的自由度数f = C -φ + n = 2 – 2 + 2 = 2(2) K=3, R = 1, b = 1, φ=2∴该体系平衡时的组元数C = K-R-b =3 – 1 – 1 = 1而体系的自由度数 f = C -φ + n = 1- 2 + 2 = 13.求下列体系的组元数和自由度数:(1) 由Fe(s)、FeO(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(2) 由Fe(s)、FeO(s)、Fe3O4(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(3) Na2SO4水溶液,其中有Na2SO4(s)、H2O、H + 和OH -;(4) 已知Na2SO4水溶液中有+、、(l)、(s)、H + 和OH -。
第五章 相平衡(10个)

第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯—克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图.6.掌握杠杆规则在相图中的应用.7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯—克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数,定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5—1中三条曲线将平面划分成固、液及气相三个区.单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1.虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。
第5章相律与相平衡(修改)

(2)物种数和组分(元)数 (2)物种数和组分( 物种数和组分
系统中所含的化学物质数称为系统的“ 系统中所含的化学物质数称为系统的“物种 化学物质数称为系统的 表示。 数”,用符号 S 表示。 足以表示系统中各相组成所需要的最少独立物 足以表示系统中各相组成所需要的最少独立物 种数称为系统的 组分数” 称为系统的“ 表示。 种数称为系统的“组分数”,用符号 K 表示。 无化学反应体系: 无化学反应体系:组分数 K = 物种数 S 若有化学反应存在, 若有化学反应存在,组元数 ≠ 物种数 组分数K 独立化学反应数 组分数K = 物种数 S - 独立化学反应数 R 则 例如, (g)= 例如,PCl5 (g)=PCl3 (g) + Cl2 (g) 物种数为3 但组分数却为2 物种数为3,但组分数却为2。 K=S- 若有其它限制条件R ’,则 K=S-R-R ′ ,
在某温度压力下, 例2 在某温度压力下,ZnO(s)被还原而成为平衡 被还原而成为平衡 系统,其中存在纯固态ZnO,液态 ,纯碳以及 系统,其中存在纯固态 ,液态Zn,纯碳以及CO 气体, 与CO2气体,试写出该系统中的独立化学反应的方程 该系统有几个强度变量,几个自由度? 式,该系统有几个强度变量,几个自由度? 解:根据题意,系统中的独立化学反应为: 根据题意,系统中的独立化学反应为: ZnO(s)+C(s) = Zn(l)+CO(g) 2CO(g) = C(s)+CO2(g) 故系统中共有5种化学物种 种化学物种, 个独立反应 个独立反应, 故系统中共有 种化学物种,2个独立反应, 则 K=5–2=3。设固体不互溶,即共 相,故f=3–4+2=1。 。设固体不互溶,即共4相 。 系统强度变量为T, 系统强度变量为 p, p(CO), p(CO2), p(Zn),5个强度 , 个强度 变量中只有1个是独立的 个是独立的由度。 例1: 下列两种系统各有几种组分和几个自由度。 a. NaH2PO4溶于水成为与水气平衡的不饱和溶液 (可不考虑 可不考虑NaH2PO4的水解 。 的水解)。 可不考虑 溶于水中水解而沉淀出Al(OH)3固体。 固体。 b. AlCl3溶于水中水解而沉淀出 解题思路: 因不考虑电离,溶液中只有NaH2PO4与 解题思路:a. 因不考虑电离,溶液中只有 H2O两种物质,存在水与气两相,故K=2,Φ =2。 两种物质, 两种物质 存在水与气两相, , 。 b. 由于 由于AlCl3在水中发生水解 AlCl3+H2O=Al(OH)3↓+HCl 故系统中存在AlCl3,H2O,Al(OH)3与HCl四种化合 故系统中存在 , 四种化合 物质,但其间存在上述反应。 物质,但其间存在上述反应。系统存在溶液与固态 Al(OH)3二种相。故K=4–1=3, Φ=2。 二种相。
第四章 二元合金相图与合金凝固答案

第四章二元合金相图与合金凝固一、本章主要内容:相图基本原理:相,相平衡,相律,相图的表示与测定方法,杠杆定律;二元匀晶相图:相图分析,固溶体平衡凝固过程及组织,固溶体的非平衡凝固与微观偏析固溶体的正常凝固过程与宏观偏析:成分过冷,溶质原子再分配,成分过冷的形成及对组织的影响,区域熔炼;二元共晶相图:相图分析,共晶系合金的平衡凝固和组织,共晶组织及形成机理:粗糙—粗糙界面,粗糙—光滑界面,光滑—光滑界面;共晶系非平衡凝固与组织:伪共晶,离异共晶,非平衡共晶;二元包晶相图:相图分析,包晶合金的平衡凝固与组织,包晶反应的应用铸锭:铸锭的三层典型组织,铸锭组织控制,铸锭中的偏析其它二元相图:形成化合物的二元相图,有三相平衡恒温转变的其它二元相图:共析,偏晶,熔晶,包析,合晶,有序、无序转变,磁性转变,同素异晶转变二元相图总结及分析方法二元相图实例:Fe-Fe3C亚稳平衡相图,相图与合金性能的关系相图热力学基础:自由能—成分曲线,异相平衡条件,公切线法则,由成分—自由能曲线绘制二元相图二、1.填空1 相律表达式为___f=C-P+2 ___。
2. 固溶体合金凝固时,除了需要结构起伏和能量起伏外,还要有___成分_______起伏。
3. 按液固界面微观结构,界面可分为____光滑界面_____和_______粗糙界面___。
4. 液态金属凝固时,粗糙界面晶体的长大机制是______垂直长大机制_____,光滑界面晶体的长大机制是____二维平面长大____和_____依靠晶体缺陷长大___。
5 在一般铸造条件下固溶体合金容易产生__枝晶____偏析,用____均匀化退火___热处理方法可以消除。
6 液态金属凝固时,若温度梯度dT/dX>0(正温度梯度下),其固、液界面呈___平直状___状,dT/dX<0时(负温度梯度下),则固、液界面为______树枝___状。
7. 靠近共晶点的亚共晶或过共晶合金,快冷时可能得到全部共晶组织,这称为____伪共晶。
相律分析及相图表示

6) 具有液相分层的二元相图 溶解度随温度的变化
t/oC
20 40 60 80 100 120 132.8
水相wB% 8.5 7.0 6.4 7.2 9.3 14.0 37 醇相wB% 83.6 81.6 79.0 75.2 70.2 61.5 37
a,b (L’,L”): 共轭溶液 (conjugate
CaO-C2S体系:具有一个低共熔点。 含有一个异分熔化化合物C3S,存在温 度为1250-1900℃。低于1250℃时C3S 分解为CaO和C2S。
C2S-CS体系: 含有一个异分熔化 化合物C3S2和一个包晶点。在 1475℃发生包晶反应:
L+C2S=C3S2
CS-SiO2体系:具有一个共晶点; 存在一个两液相分层区(L1+L2), 两个液相在1700℃以上平衡共存。 1700℃时的相平衡关系为:
1) 具有一个稳定化合物的二元相图
2) 具有一个不稳定化合物的二元相图
T=Tp时,发生包晶反应:
Lp + A
C (AmBn)
析晶路线
T
a
L
L+A E A+C
1
b
K
P GD
L+C OH
M L+B
F
C+B
L C
B
A
C
B
L B
熔体1 L
K [M , (B)]
p=1 f=2
p=2 f=1
P[F, 开始转溶B+(C)]LP +BC p=3 f=0
炉渣中有Fe2O3出现时,有利于CaO的溶解,在烧
结过程中有利于铁酸钙粘结相的形成。
3. 三元体系相图
3.1 三元系的组成表示法
材料科学基础相图习题
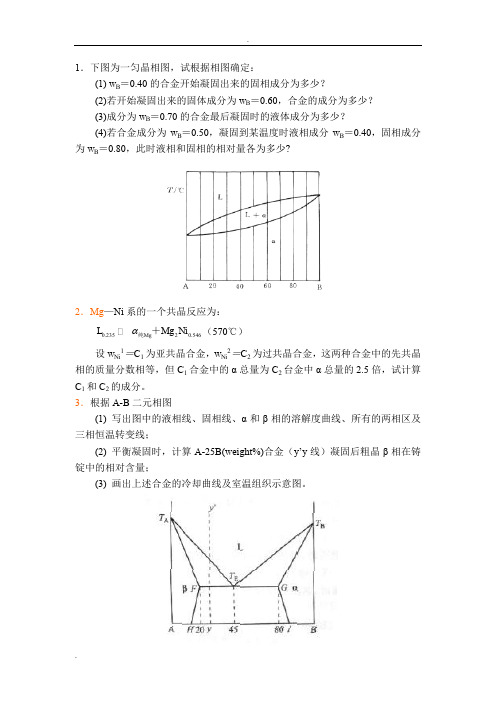
1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。
3.根据A-B 二元相图(1) 写出图中的液相线、固相线、α和β相的溶解度曲线、所有的两相区及三相恒温转变线;(2) 平衡凝固时,计算A-25B(weight%)合金(y ’y 线)凝固后粗晶β相在铸锭中的相对含量;(3) 画出上述合金的冷却曲线及室温组织示意图。
4.根据如图所示的二元共晶相图(1)分析合金I,II的结晶过程,并画出冷却曲线;(2)说明室温下合金I,II的相和组织是什么,并计算出相和组织组成物的相对含量?(3)如果希望得到共晶组织加上5%的 初的合金,求该合金的成分。
(4)合金I,II在快冷不平衡状态下结晶,组织有何不同?5.指出下列相图中的错误:6.试述二组元固溶体相的吉布斯(Gibbs)自由能-成分曲线的特点?(a) (b)(c) (d)1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分约为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分约为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?第1题答案2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。
相图小知识

相图小知识1.相律的有关概念与相律表达式(1)独立组份数C=S-R-R′。
S为物种数,R为独立化学反应计量式数目。
R′ 为同一相中独立的浓度限制条件数(包括不同物种依反应计量式比例关系及离子物种电中性条件)(2)自由度数f,系指相平衡体系中相数保持不变时,所具有独立可变的强度变量数。
(3)相律内容及其数学表达式。
相律就是揭示pVT平衡系统中自由度数、独立组份数和相数三者之间的制约关系。
表达式为:f=C-Φ+2;式中(式中 2 指T、p两强度变量)当T、p中有任一固定,则表达式为:条件自由度数f*=C-Φ+1当考虑除T、p、X B以外的其他变量或相间有某种限制时,则表达式为f=C-Φ+n;(式中n≥2)(4)相律的局限性与应用的关键性。
相律是一个定性规律,它指明特定条件下该平衡系统至多存在的相数及其相应的独立变量数,但不能指明是哪些相共存?哪些性质可作为独立变量及其它们之间的定量关系?相律对单相与复相都适用,但应用相律时,首先要考察系统是否满足相律成立的条件,并确定系统的组份数。
2.单组份系统的相图与特征(1)单组份系统相律与相图:因C=1 ,故相律表达式为f=3-Φ。
显然f最小为零,Φ最多应为 3 ,因相数最少为 1 ,故自由度数最多为 2 。
相图是用几何图形来描述多相平衡系统宏观状态与T、p、X B(组成)的关系。
在单组份相图中有单相的面、两相平衡线和三相平衡的点,自由度分别为f=2、f=1、f=0。
(2)单组份相变的特征与类型。
相变是一个连续的质的飞跃。
相平衡时物质在各相中的化学势相等,相变时某些物理性质有突变。
根据物性的不同变化有一级相变和连续相变(包括二级相变等高阶相变)之分;前者广为存在如气、液、固之间转变,其特点是物质在两相中的化学势一级导数不相等,且发生有限的突变〔即〕,此类相变平衡曲线斜率符合克拉贝龙方程。
后者如氦He(Ⅰ)与He(Ⅱ)的转变。
正常状态与超导状态的转变,其特点是化学势的一级导数在相变点连续〔即V1=V2,S1=S2〕,但化学势二级导数在相变点附近则迅速变化,出现一个极大峰如;或。
相律

上一内容 下一内容 回主目录
返回
2020/7/7
例 1:今有密闭抽空容器中有过量固体 NH4Cl,
有下列分解反应:
NH4Cl(s)=NH3(g) + HCl(g)
C = S – R– R’
S=3 R =1 Kp= P(NH3) × P(HCl) R´=1 P(NH3)=P(HCl)
C=1
上一内容 下一内容 回主目录
(1) C(s)+H2O(g) CO(g)+H2(g) (2) C(s)+CO2(g) 2CO(g) (3) CO(g)+H2O(g) CO2(g)+H2(g)
其中S=5, 独立化学平衡数 R3=2, C=5– 2=3 注意:系统确定后,其组分数是确定的,物种数有一定 随意性。
上一内容 下一内容 回主目录
推导:
每一相中有(C–1)个浓度,共有Φ个相,必须 指定Φ(C–1)个浓度.
f = Φ ( C–1) + 2
根据相平衡条件,每个组分在各相中的化学
势相等: i() = i() = … i(Φ)
共有(Φ–1)个等式,C个组分则共有C(Φ–1)个等式
f = Φ(C–1) + 2 – C(Φ–1) = C – Φ + 2
如:铁粉 + 铜粉(二相)
上一内容 下一内容 回主目录
返回
2020/7/7
同质多晶
上一内容 下一内容 回主目录
返回
2020/7/7
常见的水有几相?
上一内容
下一内容
水的P-T相图
回主目录
返回
2020/7/7
2. 物种数S和组分数C
物种数S:系统中能独立存在的化学物质的种类数 如:水和水蒸气, S=2
第4章 习题答案(科学出版社)

第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在105Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K 。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第5章 相律与相图复习思考题1.什么是独立组分数?独立组分数与物种数有何区别和联系?2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在下列物质共存的平衡系统中,有几个独立反应?请写出反应式。
(a )C (s )、CO (g )、CO 2(g )、H 2(g )、H 2O (l )、O 2(g )。
(b )C (s )、CO (g )、CO 2(g )、Fe (s )、FeO (s )、Fe 3O 4(s )、Fe 2O 3(s )4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确?为什么?5.水和水蒸气在363 K 平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变? 6.什么是自由度?自由度是否等于系统状态的强度变量数?如何理解自由度为零的状态?7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量?若CaCO 3量过少可能会发生什么现象?8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少?9.二液体组分若形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出下列平衡系统的物种数、组分数、相数和自由度: (1)Ca (OH )2(s )与CaO (s )、H 2O (g )呈平衡。
(2)CaSO 4与其饱和水溶液达平衡。
(3)在标准压力下,水与水蒸气平衡。
(4)由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; (5)由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:(1)3,1,0,=3,=1SR b f ===Φ(2)2,0,0,=2,=2S R b f ===Φ (3)1,0,0,=2,=0SR b f ===Φ (4)5,2,0,=4,=1SR b f ===Φ(5)5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统达到平衡: (1))求该系统组分数和自由度;(2)若将NH 4HS 放在一抽空容器内分解,平衡时,其组分数和自由度又为多少? 解:(1)3,1,0,=2,=2SR b f ===Φ(2)3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: (1)在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种? (2)在293.15 K 时,与水蒸气平衡共存的含水盐最多可有几种?解:(1)设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。
即最多有一种含水盐与之共存。
(2)分析同(1)可得,2(1)120f x x =-++=-≥,所以,2x ≤即最多有两种含水盐与之共存。
4.固态氨的饱和蒸气压与温度的关系可表示为ln (p/p º)= 4.707–767.3/T ,液体氨的饱和蒸气压与温度的关系可表示为ln (p/p º)=3.983–767.3/T 。
试求:(1)三相点的温度及压强;(2)三相点时的蒸发热、升华热和熔化热。
解:(1)在三相点处液氨对应的饱和蒸气压应与固氨对应的饱和蒸气压相等,故有:4.707767.3/ 3.983626.0/T T-=-解得:195.17K 77.90T==℃将所求温度数据代入任意一个饱和蒸气压与温度的关系式可解得:p 2.17 p Pa Θ=(2) 由克-克公式:ln /trs P R C Hm T ∆=-+与题目所给关系式相比较可得:-1626.05204.56 J mol vap m H R ⋅∆== -1767.36379.33 J mol sub m H R ⋅∆==-11174.77 J mo l ==fus m sub m vap m H H H ⋅∆∆-∆5. 溜冰鞋下面的冰刀与冰接触的地方,长度为7.62×10―2m ,宽度为2.45×10―5m ,(1)若某人的体重为60kg ,试问施加于冰的压力为若干?(2)在该压力下冰的熔点为若干?已知冰的熔化热为6010 J/mol ,冰和水的密度分别是920kg / m 3和1000 kg / m 3。
解:(1)Pa S F p 852105748.11045.21062.728.960⨯=⨯⨯⨯⨯⨯==-- (2)Clapeyron 方程用于固液系统fus mfus mH dp dT T V ∆=∆ 代入数据积分得,T =262.2K6. 试根据下列数据,画出HAc 的相图(示意图)。
(1)固体HAc 的熔点为16.6℃,此时的饱和蒸气压为120Pa 。
(2)固体HAc 有α、β两种晶型,这两种晶型的密度都比液体大,α晶型在低压下是稳定的。
(3)α晶型和β晶型与液体成平衡的温度为55.2℃,压力为2×108Pa 。
(4)α晶型和β晶型的转化温度(即α和β的平衡温度)随压力的降低而降低。
(5)HAc 的正常沸点为118℃。
7. 在标准压力和不同温度下,丙酮和氯仿系统的溶液组成及平衡蒸气压有如下数据: t/℃ 56.0 59.0 62.5 65.0 63.5 61.0 x (丙酮,l ) 0.00 0.20 0.40 0.65 0.80 1.00 y (丙酮,g ) 0.00 0.11 0.31 0.65 0.88 1.00 (1)画出此系统的T-x 相图。
(2)将4mol 氯仿与1mol 丙酮的混合物蒸馏,当溶液沸点上升到60℃时,整个馏出物的组成约为若干?(3)将(2)中所给溶液进行精馏,能得何物?若将4mol 丙酮与1mol 氯仿的混合物进行精馏,又能得何物?氯仿与丙酮的混合物能否用精馏法同时得到纯氯仿和纯丙酮?解:(1)根据数据,origin 作图得T-x 相图0.00.20.40.60.81.0565860626466T (℃)x 丙酮A OB(2)如图所示,根据杠杆原理可知气态混合物约为3.33mol ,其中丙酮约为 0.53 mol ,氯仿约为2.80 mol. (3)将(2)中所给溶液进行精馏,将得到纯丙酮以及丙酮与氯仿的共沸混合物。
若将4mol 丙酮与1mol 氯仿的混合物进行精馏,将得到纯氯仿以及丙酮与氯仿的共沸混合物。
无法用精馏法同时得到纯氯仿和纯丙酮。
8.图5-29是标准压力下正丁醇-水的溶解度图,在20℃时往100克水中慢慢滴加正丁醇,试根据相图求: (1)系统开始变浑浊时,加入的正丁醇质量;(2)正丁醇的加入量为25克时,两共轭液层的组成和数量; (3)至少应加入多少正丁醇才能使水层消失?(4)若加入正丁醇25.0克,并将此溶液加热至80℃,两共轭液层的质量比;(5)若将(4)中的混合液在常压下一边搅拌一边加热,将在什么温度下系统由浑浊变清澈?图5-29 正丁醇-水溶解度图解:(1)约为8.8g ;(2)约1.6g 正丁醇和18.4g 水共20g ,以及约86.1g 正丁醇和18.9g 水共105g 的共轭液层; (3)约456g ;(4)类似(3)可计算;(5)393K 。
9.NaCl-H 2O 所成的二组分系统,在252K 时有一个低共熔点,此时冰、NaCl •2H 2O (s )与浓度为22.3%(质量百分数,下同)的NaCl 水溶液共存。
在264K 时不稳定化合物NaCl •2H 2O 分解,生成无水NaCl 和27%的NaCl 水溶液。
已知无水NaCl 在水中的溶解度受温度的影响不大(当温度升高时,溶解度略有增加)。
(1)绘制相图,并指出各相区的状态。
(2)若有1.00kg28%的NaCl 溶液由433K 冷却到263K ,问在此过程中最多能析出多少纯NaCl ?解:(1)(2)按杠杆规则有W b 〃ba = W c 〃ac 而ba =28-27=1ac =100-28=72 又 W b + W c =1∴ 解得:W c =0.0137Kg 即可得纯NaCl 约13.7g10.由Sb-Cd 系统的一系列不同组成的熔点步冷曲线得到下列数据:W (Cd )(质量分数) 0 0.20 0.375 0.475 0.50 0.583 0.70 0.90 1.00240260 280300 320 340 360 380 400 10H 2O 2030405060708090NaCl(Ⅰ)NaCl (%Wt)T/K252420 440 LL+NaCl(s)(Ⅴ)M(22%NaCl,433K)NaCl ·2H 2O+NaCl(Ⅲ) (Ⅳ)(Ⅱ)NaCl ·2H 2O+冰 L+ NaCl ·2H 2O 冰+L (Ⅵ) 264Kt (开始凝固的温度)/℃ — 550 460 — 419 — 400 — — t (全部凝固的温度)/℃ 630 410 410 410 410 439 295 295 321(1)试根据上述数据画出Sb-Cd 系统的相图,并标出各区域存在的相和自由度。
(2)将1kg 含Cd0.80(质量分数)的熔液由高温冷却,刚到295℃时,系统中有哪两个相存在,其两相的质量各有若干?解:(1) 由数据表可知: ①纯组分锑、镉的熔点分别为630℃和321℃; ② 含Cd 58.3%物系在冷却过程中出现一停顿温度,且为最高,又无转折温度,说明 生成了稳定化合物Sb m Cd n ; ③ 含Cd 58.3%的稳定化合物左边有一共同停顿温度(410℃),此即为Sb 与Sb m Cd n 的低共熔温度,其最低共熔点组成为含Cd 47.5%。
④ 含Cd 58.3%稳定化合物右边有一共同停顿温度(295℃),此即为Sb m Cd n 和Cd 之 低共熔点,其低共熔点组成为Cd 93%。
由以上分析可知,Sb-Cd 相图为两个简单低共熔点相图合并而成,如图所示。
T (℃)x Cd(2)由杠杆原理可计算。
11. 金属A 和B 的熔点分别是623K 和553K ,热分析指出,在473K 时有三相共存,其中一相是含30%B 的熔化物,其余两相分别是含20%B 和25%B 的固溶体。
冷却到423K 时又呈现三相共存,分别是含55%B 的熔化物、含35%B 和80%B 的两个固溶体。
