引物纯化方法介绍
引物纯化方式HAP、PAGE、DHLPC的区别

引物纯化方式HAP、PAGE、DHLPC等的区别纯化方式:一OPC纯化OPC纯化是使用一种叫Cartridge的反向层析柱(美国Waters 公司生产),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
1. DNA 合成是用全自动DNA 合成仪从3‘ →5‘ 进行人工合成的。
在刚合成完的DNA 的5‘ 端的碱基上带有一个大型的疏水性保护基团DMTr 基,而中间产物的短链杂质DNA 中不具有DMTr 基。
利用这一性质进行目的DNA 的纯化。
2. 把粗样DNA 加入Sep-Pak Cartridge 柱上(简易反相柱) 。
此时,所有的合成产物全吸附于反相柱上。
3. 用甲醇清洗反相柱。
此时,吸附能力强的带有DMTr 保护基的目的DNA 仍吸附于反相柱上,而短链杂质DNA 片段全部被冲走。
4. 向反相柱上加入强酸TFA (Trifluoroacetic acid) , 切断DMTr 保护基和目的DNA 之间的连接。
5. 再用乙腈洗脱目的DNA 。
此时回收出来的目的DNA 的纯度能达到95% 以上。
可用于DNA 测序等。
二 PAGE纯化PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于95%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三 HPLC纯化采用高效液相色谱纯化,产物纯度极高,可达99%。
适用于各种基因工程试验,特别是:荧光标记DNA、长链DNA、PCR克隆,定点突变,人工合成基因等。
HPLC 纯化HPLC 纯化是使用高效液相色谱仪,对目的DNA 片段进行纯化的方法。
HPLC 纯化的设备投资大,生产成本高,但使用本法纯化的 DNA 片段纯度极高,大于99% 。
引物纯化方式选择指南

引物纯化方式选择指南引物纯化是分子生物学实验中常用的一项技术操作,目的是去除引物中的杂质或副产物,以提高引物的纯度和特异性。
选择正确的引物纯化方式对实验结果的准确性至关重要。
本文将从引物纯化的原理、常用的纯化方式以及选择参考因素三个方面为大家介绍引物纯化方式的选择指南。
一、引物纯化的原理引物纯化的原理是通过选择性地去除引物中的杂质或副产物。
引物纯化的方法主要包括有机溶剂沉淀、凝胶纯化、离心滤膜纯化和磁珠纯化等。
这些方法的基本原理是通过杂质和目标分子之间的物理性质差异来实现分离纯化。
1.有机溶剂沉淀:利用酒精或醋酸钠等有机溶剂与引物中的杂质形成不可溶或部分溶解的复合物,然后通过高速离心将引物与复合物分离。
2.凝胶纯化:将引物与杂质分子一起加载在凝胶电泳槽中,用电场将其迁移,根据引物与杂质分子在凝胶中的迁移速度差异进行分离纯化。
3.离心滤膜纯化:将引物混合物通过滤膜孔隙的方法分离纯化,通过准确调节离心速度和离心时间,实现引物与杂质的分离。
4.磁珠纯化:利用带有特定功能的磁珠与引物及其杂质结合,然后通过磁力将引物与磁珠分离。
二、常用的纯化方式根据引物的具体情况和实验需求,可以选择不同的纯化方式。
下面介绍几种常用的引物纯化方式。
1.有机溶剂沉淀:适用于纯化大分子引物,往往需要经过酚/氯仿提取等前处理步骤。
此方法简单易行,但纯化效果可能不如其他方法理想。
2.凝胶纯化:适用于纯化较长的引物,可以有效去除其中的副产物和杂质。
参考因素包括所用凝胶的浓度、运行电场和运行时间等。
3.离心滤膜纯化:适用于小分子引物的纯化。
参考因素包括滤膜孔隙大小、离心速度和时间等。
此方法操作简单,无需特殊设备。
4.磁珠纯化:适用于高效、快速纯化,通常利用磁性珠子和特异性亲和剂结合,可以选择性地富集引物。
此方法通常需要特殊的磁性珠子和离心仪设备。
三、选择参考因素选择适合的引物纯化方法需要考虑以下因素:1.引物的性质:包括分子大小、长度、配对性,选择合适的纯化方法对于不同性质的引物十分重要。
引物纯化方式dsl及应用

引物纯化方式dsl及应用引物纯化是分子生物学和基因工程实验中常用的技术之一,用于从引物混合物中纯化目标引物,以确保实验的准确性和可靠性。
引物纯化的方式有很多种,其中最常用的方式是使用聚丙烯酰胺凝胶电泳、高效液相色谱(HPLC)和磁珠纯化。
聚丙烯酰胺凝胶电泳是常用的引物纯化方式之一。
它基于分子大小的差异,将引物从其他杂质分离出来。
首先,将引物混合物加载到聚丙烯酰胺凝胶上,并在电场作用下进行电泳。
分子大小不同的引物会在凝胶上移动的速度有所不同,从而分离出目标引物。
随后,通过切下凝胶中目标区域进行DNA的析取。
高效液相色谱(High Performance Liquid Chromatography,HPLC)也被广泛应用于引物纯化。
该方法基于引物分离和纯化纯度分析的高分辨率技术。
首先,引物混合物经过柱塞式层析柱,不同化合物在柱塞中有不同的保留时间,从而可以将目标引物与杂质分离。
随后,使用梯度洗脱的方法,通过改变洗脱溶液的浓度梯度和组成来纯化目标引物。
此外,HPLC还可用于监测和评估纯化过程中目标引物的纯度和含量。
磁珠纯化是一种新兴的引物纯化技术,它在材料科学和生物分离领域具有广泛的应用潜力。
该方法利用磁珠表面的功能化修饰剂与目标引物之间的特异性相互作用,如亲和吸附、离子交换、亲水性相互作用等。
首先,将目标引物与磁珠上的功能化修饰剂进行特异性结合,然后通过磁力来实现引物纯化。
磁珠纯化具有高纯化效率、操作方便、快速响应和重复利用等优点,已在DNA测序、基因检测和蛋白质研究等领域得到广泛应用。
引物纯化在基因克隆、PCR扩增、测序等分子生物学实验中应用广泛。
在基因克隆中,准确纯化引物可以确保目标DNA片段的正确扩增和插入,提高克隆的成功率。
在PCR扩增中,引物纯化可以提高PCR反应的特异性和准确性,减少杂交和非特异性扩增。
在测序中,引物纯化可以去除非特异性引物和杂质,提高测序的准确性和可靠性。
总而言之,引物纯化是基因工程和分子生物学实验中的重要步骤之一。
引物纯化方法与应用指南
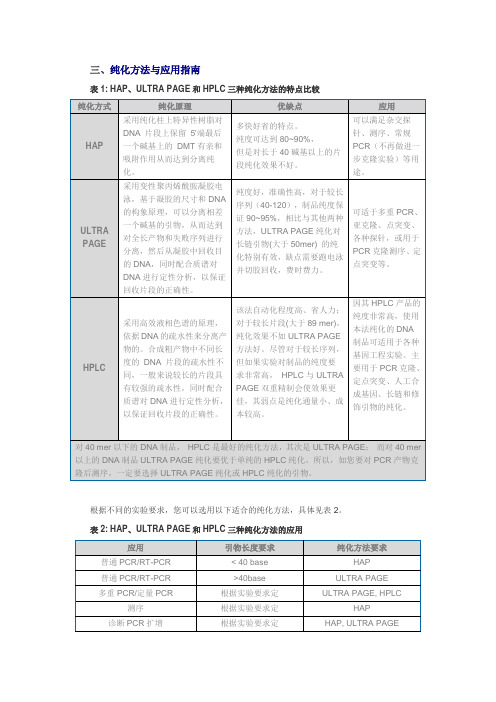
根据不同的实验要求,您可以选用以下适合的纯化方法,具体见表2。
纯度好,准确性高,对于较长序列(40-120),制品纯度保证90~95%,相比与其他两种方法,ULTRA PAGE纯化对长链引物(大于50mer)的纯化特别有效,缺点需要跑电泳并切胶回收,费时费力。
可适于多重PCR、亚克隆、点突变、各种探针,或用于PCR克隆测序、定点突变等。
HPLC
采用高效液相色谱的原理,依据DNA的疏水性来分离产物的。合成粗产物中不同长度的DNA片段的疏水性不同,一般来说较长的片段具有较强的疏水性,同时配合质谱对DNA进行定性分析,以保证回收片段的正确性。
根据实验要求定
HAP, ULTRA PAGE
亚克隆,点突变
根据实验要求定
ULTRA PAGE, HPLC
基因构建
根据实验要求定
ULTRA PAGE, HPLC
全基因合成
根据实验要求定
HAP
反义核酸
根据实验要求定
HPLC
修饰/标记引物
根据实验要求定
HPLC
PCR产物用于克隆表达研究或基因重组等
根据实验要求定
ULTRA PAGE, HPLC
该法自动化程度高、省人力;对于较长片段(大于89 mer),纯化效果不如ULTRA PAGE方法好。尽管对于较长序列,但如果实验对制品的纯度要求非常高,HPLC与ULTRA PAGE双重精制会使效果更佳,其弱点是纯化通量小、成本较高。
引物纯化方式HAP PAGE DHLPC的区别

引物纯化方式HAP、PAGE、DHLPC等的区别纯化方式:一OPC纯化OPC纯化是使用一种叫Cartridge的反向层析柱(美国Waters 公司生产),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
1. DNA 合成是用全自动DNA 合成仪从3‘ →5‘ 进行人工合成的。
在刚合成完的DNA 的5‘ 端的碱基上带有一个大型的疏水性保护基团DMTr 基,而中间产物的短链杂质DNA 中不具有DMTr 基。
利用这一性质进行目的DNA 的纯化。
2. 把粗样DNA 加入Sep-Pak Cartridge 柱上(简易反相柱) 。
此时,所有的合成产物全吸附于反相柱上。
3. 用甲醇清洗反相柱。
此时,吸附能力强的带有DMTr 保护基的目的DNA 仍吸附于反相柱上,而短链杂质DNA 片段全部被冲走。
4. 向反相柱上加入强酸TFA (Trifluoroacetic acid) , 切断DMTr 保护基和目的DNA 之间的连接。
5. 再用乙腈洗脱目的DNA 。
此时回收出来的目的DNA 的纯度能达到95% 以上。
可用于DNA 测序等。
二 PAGE纯化PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于95%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三 HPLC纯化采用高效液相色谱纯化,产物纯度极高,可达99%。
适用于各种基因工程试验,特别是:荧光标记DNA、长链DNA、PCR克隆,定点突变,人工合成基因等。
HPLC 纯化HPLC 纯化是使用高效液相色谱仪,对目的DNA 片段进行纯化的方法。
HPLC 纯化的设备投资大,生产成本高,但使用本法纯化的 DNA 片段纯度极高,大于99% 。
引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE 公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基 (Deblocking)用三氯乙酸 (Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化 (Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接 (Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭 (Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
pcr产物纯化原理

pcr产物纯化原理PCR产物纯化原理。
PCR(Polymerase Chain Reaction)是一种用于扩增DNA片段的技术,它可以在短时间内从少量DNA样本中扩增出大量的特定DNA序列。
在PCR反应结束后,我们通常需要对PCR产物进行纯化,以去除杂质和残余的试剂,从而得到纯净的DNA产物。
本文将介绍PCR产物纯化的原理及相关方法。
首先,我们需要了解PCR产物中可能存在的杂质。
在PCR反应中,除了目标DNA片段外,还会存在引物、缺失片段、外源DNA和反应试剂等杂质。
这些杂质会影响后续的实验结果,因此需要进行纯化处理。
PCR产物的纯化原理主要包括离心沉淀、凝胶电泳分离、离子交换层析和硅胶柱纯化等方法。
离心沉淀是一种简单快速的纯化方法,通过高速离心将DNA沉淀到底部,然后去除上清液中的杂质。
凝胶电泳分离是一种常用的纯化方法,通过电泳将DNA片段从凝胶中分离出来。
离子交换层析则是利用DNA与离子交换树脂之间的亲和性差异进行分离。
硅胶柱纯化则是利用硅胶柱吸附DNA,再通过洗脱的方式得到纯净的DNA产物。
在选择纯化方法时,需要考虑产物的大小、纯度和后续实验的要求。
对于较大的DNA片段,离心沉淀和凝胶电泳分离可能更适合;而对于小片段的DNA,离子交换层析和硅胶柱纯化可能更有效。
在进行纯化操作时,需要注意避免DNA的降解和损伤。
因此,在操作过程中需要使用无核酸酶的试剂和工具,避免过多的离心和振荡,以及避免暴露在紫外线下。
总之,PCR产物的纯化是PCR实验中至关重要的一步,它直接影响到后续实验结果的准确性和可靠性。
选择合适的纯化方法,并严格按照操作规程进行操作,可以有效地得到纯净的DNA产物,为后续实验提供可靠的基础。
希望本文对PCR产物纯化原理有所帮助,谢谢阅读!。
赛默飞引物纯化方式

赛默飞引物纯化方式引物纯化是分子生物学研究中的重要环节,其中赛默飞引物纯化方式是目前使用广泛的一种方法。
本文将详细介绍赛默飞引物纯化的步骤和关键注意事项,希望对读者有所帮助。
赛默飞引物纯化是一种利用离心管柱纯化的技术,通过特殊的膜和离子交换树脂,能够快速高效地纯化引物。
下面我们将介绍具体步骤:1. 准备工作:首先,需要准备好需要纯化的引物溶液、赛默飞离心管柱和离心机。
为了确保实验的准确性,还需准备一些辅助试剂,如缓冲液和洗涤缓冲液。
2. 样品加载:将需要纯化的引物溶液加入离心管柱中,注意避免得到太多的杂质。
一般来说,用量应根据实验需要而定,不宜过多,以便提高纯化效果。
3. 离心纯化:将装有样品的离心管柱放入离心机中,以约12000×g的速度离心纯化,时间一般为1-2分钟。
此步骤的目的是将引物分离并纯化出来,赛默飞离心管柱能够高效地去除杂质和缓冲液中的盐离子。
4. 杂质洗脱:将离心管柱放入一个干净的收集管中,加入提前配制好的洗涤缓冲液。
利用离心机以同样的速度离心洗脱,洗掉残留的杂质和缓冲液中的盐离子。
5. 引物洗脱:将装有已经纯化的引物的离心管柱放入新的收集管中,用适量的纯水洗脱引物。
一般来说,洗脱液体的体积可以比样品原来的体积小,这有利于浓缩引物,但也不能过小,以防引物损失。
6. 引物质量检测:将洗脱得到的引物进行质量检测,可以通过比色法、凝胶电泳等方法来确定引物的浓度和纯度。
若需要进一步的研究,还可以进行测序验证。
需要注意的是,在进行赛默飞引物纯化过程中,要严格遵守实验室的操作规范,保持操作环境的干净整洁。
同时,要避免引物接触到氧气和紫外线等有害因素,以避免引物降解和质量下降。
此外,保存已纯化的引物时,应该冷冻保存,并避免多次冻融循环,以保证引物的稳定性和活性。
综上所述,赛默飞引物纯化方式是一种高效、快速的纯化技术,能够在分子生物学研究中发挥重要作用。
在操作过程中,需要注意实验规范和引物的保护,以获得高质量的引物。
引物的制备

引物的制备
引物的制备是一项关键的实验步骤,它涉及到多个技术细节和严格的实验操作。
一般来说,引物的制备包括三个主要步骤:合成、纯化和定量分析。
合成引物的方法有很多种,其中最常用的是化学合成和PCR扩增法。
化学合成法是通过合成机进行合成,采用的是磷酸二酯化学合成技术,可以合成单链DNA、RNA和寡核苷酸等。
而PCR扩增法则是通过利用引物的互补性和DNA聚合酶的催化作用,在体外进行DNA复制,从而扩增所需的引物序列。
在合成完成后,需要对引物进行纯化以去除杂质。
一般来说,纯化方法有凝胶电泳、高效液相色谱等多种选择,其中凝胶电泳是最常用的方法之一。
凝胶电泳可以将引物按大小分离,去除杂质,并且可以使用紫外线照射对DNA进行可视化。
最后,需要对引物进行定量分析,以确定引物的浓度和纯度。
常用的定量方法有紫外分光光度法、荧光定量法等。
其中,紫外分光光度法是最常用的方法之一,它可以通过测量DNA的吸收值来计算DNA 的浓度,同时也可以评估DNA的纯度。
总之,引物的制备是一项非常重要的实验步骤,需要仔细操作和科学规划。
只有通过正确的制备方法,才能获得高质量的引物,并为后续实验奠定坚实的基础。
- 1 -。
引物纯化方式

引物纯化方式
引物是生物学中一种重要的试剂,它可以用于分子生物学的研究,如PCR、克隆等。
因此,引物的质量对于实验的成功至关重要。
然而,在市场上购买的引物往往含有污染成分,如核酸、蛋白质和其他杂质,这些杂质会影响实验效果。
因此,有必要对其进行纯化处理以提高实验效果。
目前常用的引物纯化方法有凝胶电泳、变性层析、气相色谱、水相层析和核酸分子印迹法。
凝胶电泳是一种常用的分子量分离方法,可以将不同大小的核酸分子隔离出来。
变性层析是一种常用的核酸分子选择性纯化方法,依靠核酸分子与不各不同pH值所形成的变性差异而进行选择性地对核酸分子进行对选择性地进行分选。
气相色谱是一个多功能的工具,可以将多个样品中的不各不各成分快速、有效地隔离出来。
水相层析是一个广泛使用的生物大分子纯化工具,可以将大量复杂样品中所含有的生物大分子快速有效地隔离出来。
考样印迹法是一个新兴但十分有效的方法,它可以将低浓度考样中所含有的少量引物快速、有效地隔离出来。
无论使用何种方法对引物进行纯化时都应该遵循正确的实验流程并注意详尽地保存实验数据。
此外,如果想要得到优质引物产品也应该使用优质原料并注意原料储存条件。
引物纯化的方法有哪些

【蛋白研究系列专题】-17丨分分钟get引物各纯化方式如今,引物纯化方式多种多样。
各位科研君,每天忙碌奔波于核酸提取、载体构建、蛋白表达等环节,没有深入了解过各种引物纯化方式吧!今天,小编带各位对各种引物纯化方式作下对比。
各位科研君在以后的研究中,记得对号入座哦!一般纯化方式目前,采用的主打的引物纯化方式是脱盐纯化。
其只能纯化掉引物中的盐分,并不能去除含的小片段,价格较为便宜,能满足一般常规的应用。
1. C18柱:又称为简易反相柱,对DNA有特异性吸附,可被有机溶液洗脱,但不会被水洗脱。
因此能有效地去除盐分,但不能有效去除比目的片段短的小片段。
该方法一般不会对普通PCR反应产生影响。
对于需要用于测序、克隆的引物不能使用这个级别。
2. OPC纯化:采用寡核苷酸纯化柱 (Oligonucleotide Purification Cartridge,OPC)纯化,制品纯度保证80 ~ 90%。
此级别制品可用作PCR引物、DNA测序引物、各种探针等。
该级别只提供长度在35 mer以下的合成DNA制品。
序列更长时,制品的纯度得不到保证。
3. HAP纯化方法HAP(High Affinity Purification)其原理是利用合成引物5'-端DMT基团对HAP树脂专一性吸附,而不含DMT的短链DNA不被吸附,从而达到分离纯化的目的。
制品纯度可达到80~90%,可以满足杂交探针、测序、常规PCR(不再做进一步克隆实验)等用途了。
但是因为其专一性吸附 DMT 能力有限,不免仍然有短片段带入的可能,而且负载量小。
特别是对长于39 碱基以上的片段纯化效果不好。
此级别只提供长度在10-39mer以下的合成oligo DNA制品。
序列更长时,制品的纯度得不到保证。
4. RPC纯化RPC纯化是通过反相净化滤芯 (Reverse Phase Cartridge) 对引物进行纯化,纯化原理与反相HPLC纯化一样。
(完整word版)引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14内容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE 公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基(Deblocking)用三氯乙酸(Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化(Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接(Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭(Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14内容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基(Deblocking)用三氯乙酸(Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化(Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接(Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭(Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
pcr纯化回收原理 -回复

pcr纯化回收原理-回复PCR(聚合酶链反应)纯化回收是一项关键的实验步骤,用于从PCR反应体系中分离和纯化所需的目标DNA片段。
这是由于PCR反应体系中含有许多杂质物质,如剩余的引物、PCR酶、缓冲液等,这些杂质会干扰下游实验的结果。
因此,纯化回收PCR产物不仅能提高下游实验的效果,还能减少后续实验的干扰。
一般而言,PCR产物纯化回收的步骤主要包括抽提、纯化和浓缩三个过程。
下面将详细介绍这些步骤的原理和操作方法。
首先,抽提是将PCR反应液中的DNA目标片段分离出来,而且常用的抽提方法有有机溶剂法、盐析法和固相离心法等。
其中,有机溶剂法是较为常用的抽提方法。
具体而言,该方法通过将PCR反应液与有机溶剂(如丙酮、异丙醇等)进行共沉淀来分离DNA目标片段。
其原理是DNA与有机溶剂存在亲疏水性差异,通过调节反应液的pH值和添加足够的盐可以控制DNA目标片段与有机溶剂之间的分离,从而实现DNA的分离纯化。
其次,纯化是将DNA目标片段从抽提液中进一步纯化,使其获得更高纯度和更好的品质。
纯化方法根据实验需求和条件的不同,可以选择凝胶纯化、固相萃取、凝胶柱纯化等不同方法。
其中凝胶纯化是最常用的纯化方法之一。
其原理是将抽提液进行琼脂糖凝胶电泳,然后通过紫外线照射可见DNA带,最后使用DNA提取缓冲盐溶解目标DNA片段,使其从琼脂糖凝胶中溶解、纯化出来。
最后,浓缩是将纯化后的DNA目标片段从缓冲液中浓缩得到较高浓度的DNA溶液。
浓缩的方法主要有乙醇沉淀法、杂交膜浓缩法和速浓器法等。
其中,乙醇沉淀法是最常用的浓缩方法之一。
其原理是通过加入适量的乙醇使DNA溶解度降低,从而使DNA沉淀出来。
然后通过离心来分离DNA 沉淀,并去除乙醇溶液。
最后,使用适量的缓冲溶液溶解DNA沉淀,以获得目标DNA的高浓度溶液。
综上所述,PCR纯化回收的原理包括抽提、纯化和浓缩三个主要步骤。
其中,抽提通过有机溶剂法将DNA目标片段从PCR反应体系中分离出来;纯化通过凝胶纯化等方法进一步提高DNA纯度和品质;浓缩通过乙醇沉淀法等方法使纯化后的DNA目标片段从缓冲液中得到较高浓度的DNA 溶液。
不同纯化方法处理DNA合成引物对PCR扩增效率的影响

不同纯化方法处理 D N A 合成引物对 PCR 扩增效率的影响赵庆萱 石乐琴 王春晖(卫生部兰州生物制品研究所 兰州 730046)摘 要 对 D N A 合成的幽门螺杆菌尿素酶引物 H P 1、H P 2、H P 3、H P 4 进行了几种不同的纯化试验, 分别采用无水乙醇沉淀法、N T 柱及聚丙烯酰胺凝胶电泳方法, 对其相应的纯化收率, PCR 扩增效率作 了比较及分析。
琼脂糖凝胶电泳结果证实, 以无水乙醇沉淀纯化方法的 PCR 扩增效果较为理想。
该方法 操作简便、稳定高效、省时省力、成本低。
为此建议用该法处理 DN A 合成引物。
关键词 分类号 DN A 合成引物 纯化 收率 PCR 凝胶电泳Q 523T he I n f l uen c e of the Sy n the s i zed D NA Pr i m er s Pur i f ied w i t h D if f e ren t M e t hods on PCR Am p l i f ica t i on Ef f ic i en c y Z h a o Q ing x u a n , e t a l L an z h o u I n s t i tu te of B io log ica l P rod u c t s , L an z h o u , 730046A bstra c t T h e syn th e sized DN A p r i m e r s H P 1 H P 2 H P 3 an d H P 4 w e re p u r if ied w ith d iffe r en t m e t h 2 o d s : e th ano l p rec i p ita t i o n , N T co lu m n an d po lyac ry l am ide ge l e lec t rop ho re sis. T h e reco ve ry ra t e o f p u 2 r if ica t i o n an d th e eff ic ien cy o f PCR o f th e se p r i m e r s w e re an a lyzed re sp e c t ive ly . T h e re su lt o f aga r o s e g e l e lec t rop ho re sis show ed th a t th e m e tho d o f e t h ano l p rec i p ita t i o n is be t t e r th an o t h e r s. T h is m e t ho d h a s th e advan tage o f si m p lica t i o n , eff i c i en cy , stab ility , t i m e 2saved an d low 2co st . W e com m en d th is m e t ho d o n p u r i f i n g syn th e s ized DN A p r i m e r s so a s to a t t a i n sa t i sfac t o ry re s u lt .Key words Syn th e s ized DN A p r i m e r s p u r i f i ca t i o n reco v e r y ra t e PCRge l e l ec t r op h o re s isPCR 扩增试验前的引物合成、合成后的纯 化试验, 对其以后的 PCR 扩增结果有一定的影 响。
引物合成的详解

引物合成的详解.txt这是一个禁忌相继崩溃的时代,没人拦得着你,只有你自己拦着自己,你的禁忌越多成就就越少。
自卑有多种档次,最高档次的自卑表现为吹嘘自己干什么都是天才。
11月13日引物合成的详解1.引物是如何合成的?目前引物合成基本采用固相亚磷酰胺三酯法。
DNA合成仪有很多种, 主要都是由ABI/PE 公司生产,无论采用什么机器合成,合成的原理都相同,主要差别在于合成产率的高低,试剂消耗量的不同和单个循环用时的多少。
亚磷酰胺三酯法合成DNA片段,具有高效、快速的偶联以及起始反应物比较稳定的特点。
亚磷酰胺三酯法是将DNA固定在固相载体上完成DNA链的合成的,合成的方向是由待合成引物的3′端向5′端合成的,相邻的核苷酸通过3′→5′磷酸二酯键连接。
第一步是将预先连接在固相载体CPG上的活性基团被保护的核苷酸与三氯乙酸反应,脱去其5′-羟基的保护基团DMT,获得游离的5′-羟基。
第二步,合成DNA的原料,亚磷酰胺保护核苷酸单体,与活化剂四氮唑混合,得到核苷亚磷酸活化中间体,它的3′端被活化,5′-羟基仍然被DMT保护,与溶液中游离的5′-羟基发生缩合反应。
第三步,带帽(capping)反应,缩合反应中可能有极少数5′-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应,这种短片段可以在纯化时分离掉。
第四步,在氧化剂碘的作用下,亚磷酰形式转变为更稳定的磷酸三酯。
经过以上四个步骤,一个脱氧核苷酸被连接到固相载体的核苷酸上。
再以三氯乙酸脱去它的5′-羟基上的保护基团DMT,重复以上步骤,直到所有要求合成的碱基被接上去。
合成过程中可以观察TCA处理阶段的颜色判定合成效率。
通过氨水高温处理,连接在CPG上的引物被切下来,通过OPC, PAGE等手段纯化引物,成品引物用C18浓缩,脱盐,沉淀。
沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
2.引物纯化方式有哪些,如何选择?◆C18柱脱盐:有人称其为简易反相柱,它对DNA有特异性的吸附,可以被有机溶解洗脱,但不会被水洗脱,所以能有效地去除盐分。
PCR产物纯化

1.PCR产物纯化方法酒精/NaAc法1 每管加入1/10体积的3 M NaAc,到管底2 每管加入2.5倍体积的100% 酒精,混匀;3 2000-3000 xg离心30 min,倒置96孔板离心至185 xg停止离心,去除酒精;4 每管加入100 µL 70% 酒精,1650 xg 4°C离心15 min,倒置96孔板离心至185 xg停止离心,去除酒精;5 重复70% 酒精洗涤1次;6 让残余的酒精挥发干,加入原体积一半的去离子水溶解DNA。
该方法是最经典经济的PCR产物纯化再测序方法,使用该方法纯化后可以直接交给公司做测序反应,而且效果不比割胶纯化差!!!附试剂配置:3M NaAc注意:不同测序MIX采用不同PH值,如MIX1.0、2.0和3.0: pH4.6; 1.1 和3.1: pH5.2(MIX为ABI公司,当前国内测序仪一般为ABI公司生产),102.06 g NaAc•3H2O溶于200mLdH2O中,冰醋酸调至pH5.2,定容至250 mL,分装,高压消毒。
125 mMEDTA按照《分子克隆》配制。
2.具我的经验pcr产物纯化并不一定要用试剂盒,我用自己的方法纯化的效果反而更好,而且节约!!步骤如下:1.紫外灯下切胶,(目的片段)2.TE 溶.3.取溶液,用氯仿, Tris- 饱和酚抽提数次,3-44,无水酒精沉淀,5.70%酒精洗2次6.-20 保存即可3.P CR产物不一定用试剂盒纯化,我一般用低熔点琼脂糖纯化,效果很好:1。
PCR产物低熔点琼脂糖凝胶电泳,80V,30min。
2。
紫外灯下尽可能的把多余的胶切掉。
将胶放入1.5ml的EP管里。
3。
70度加热10分钟,让胶充分熔化,加入两倍体积的TE。
混匀4。
加入等体积的苯酚、氯仿抽提,4000RPM离心10分钟,吸取上清于另一离心管内,注意不要把白色物质(低熔点琼脂糖)吸上来。
5。
1/10醋酸钠、2倍体积的无水乙醇沉淀DNA,-20度1-2小时6。
page引物合成纯化

page引物合成纯化英文回答:I. Introduction.Page primers are short, single-stranded DNA fragments used for PCR amplification. They are designed to bind to specific regions of the target DNA sequence and provide a starting point for DNA synthesis by DNA polymerase. Page primers are typically 18-30 bases long and are synthesized using an automated DNA synthesizer. The synthesis process involves the sequential addition of nucleotides to a growing DNA chain. Once the desired sequence has been synthesized, the primer is purified to remove any impurities.II. Methods for Page Primer Purification.There are a variety of methods available for purifying page primers. The most common methods include:Ethanol precipitation: This method involves adding ethanol to the primer solution to precipitate the DNA. The precipitated DNA is then collected by centrifugation and washed with ethanol to remove any remaining impurities.Solid-phase extraction: This method involves passing the primer solution through a solid-phase matrix that binds the DNA. The impurities are then washed away, and the purified DNA is eluted from the matrix.HPLC purification: This method involves separating the primer from the impurities using high-performance liquid chromatography (HPLC). The primer is injected into an HPLC column, and the different components of the solution are separated based on their size and charge. The purified primer is then collected from the column.III. Considerations for Page Primer Purification.The choice of purification method depends on a number of factors, including the desired purity of the primer, thevolume of the primer solution, and the cost of the purification method. For most applications, ethanol precipitation is a simple and inexpensive method that provides adequate purity. However, for applications where high purity is required, solid-phase extraction or HPLC purification may be necessary.IV. Advantages of Page Primer Purification.Purifying page primers offers a number of advantages, including:Increased specificity: Purified primers are free of impurities that can interfere with PCR amplification. This results in increased specificity and reduced background noise.Improved sensitivity: Purified primers are more sensitive than unpurified primers. This means that they can be used to amplify smaller amounts of target DNA.Reduced cost: Purified primers can be used multipletimes, which reduces the cost of PCR amplification.V. Conclusion.Page primer purification is an important step in PCR amplification. By removing impurities from the primer solution, purification increases the specificity, sensitivity, and cost-effectiveness of PCR.中文回答:I. 引言。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武汉安基生物科技有限公司
引物纯化方法介绍
1) RPC 纯化,它对DNA 有特异性的吸附,可以被有机溶液洗脱,但不会被水洗脱,所以能有效地去除盐分,但是它不能有效去除比目的片段短的小片段。
这种方法处理的产物中虽然含有比目的片段少5'端一个或两个或多个碱基的产物,却一般不会对普通PCR 反应产生影响。
但是对于需要用于测序、用于克隆的引物不能使用这个级别。
2) OPC 柱纯化,OPC 柱中装有对DMT 具有亲和力的树脂,合成DNA 片段时保留5'端最后一个碱基上的DMT,所有合成产物吸附在O PC 柱上以后,用稀的有机溶剂洗柱,带有DMT 的片段吸附能力强,不易被洗脱,不带有DMT 的片段吸附能力弱,被洗脱。
然后用三氟乙酸TFA 或三氯乙酸TCA 脱去DMT 基团,再用浓一点的有机溶剂洗脱DNA。
这种方法的优点是快速,简易。
但是其专一性吸附DMT 能力有限,不免仍然有短片段带入的可能,而且负载量小。
特别是对长于25碱基以上的片段纯化效果不好。
3) HPLC 纯化,这是国外厂家常常使用的办法。
它是依据不同大小的片段带有的净荷多少来分离产物的。
合成粗产物中不同长度的DNA 片段决定了它带有不同的净电荷,较长的片段带有高电荷比带电荷低的短片段在离子交换柱中流动得慢。
先将粗产物检测主峰位置,再增加加样量,回收主峰位置的部分。
它的优点是自动化程度高、省人力;缺点是纯化量小、不能纯化长片段(对于长于40碱基的片段,无法纯化)。
4) PAGE 纯化,几乎所有专业书籍上介绍的最佳纯化方法。
它是依据DNA 片段在变性聚丙烯酰胺凝胶中电泳时的迁移率不同来分离大小片段的。
由于各分子所带电荷和大小不同,综合影响其在凝胶中的迁移速度,大片段迁移得慢,经过一定时间的电泳,大小片段会分开,然后停止电泳,剥离凝胶,置于荧光TLC 板上在紫外灯下切割目的条带,浸泡碎胶,并从泡胶的盐溶液中回收目的DNA。
优点是纯化效果很好、尤其是纯化长链效果更好、而且是可以直观看见DNA 片段合成情况的质控环节。
通常认为的缺点是实验室水平的PAGE 纯化实验步骤多费人工、电泳及后处理过程样品损失量大、电泳装置局限或电泳时间如果不够会影响纯化效果。
但这些缺点完全可以克服。
我们通过扩大规模流水作业使实验过程便于掌握和节
武汉安基生物科技有限公司
省人力;在粗样品中加入尿素饱和液增加样品比重减少电泳上样的损失;改用C18柱回收产物,使得回收效率大大提高;通过特制电泳装置,增加凝胶厚度和长度来增加负载量和分离效果等等。
所以我们一直使用PAGE 纯化方式保证合成产物的纯度。
为了保障后续实验,最好选用PAGE 纯化产品。
