引物纯化方式HAP、PAGE、DHLPC的区别
引物纯化方法介绍

武汉安基生物科技有限公司引物纯化方法介绍1) RPC 纯化,它对DNA 有特异性的吸附,可以被有机溶液洗脱,但不会被水洗脱,所以能有效地去除盐分,但是它不能有效去除比目的片段短的小片段。
这种方法处理的产物中虽然含有比目的片段少5'端一个或两个或多个碱基的产物,却一般不会对普通PCR 反应产生影响。
但是对于需要用于测序、用于克隆的引物不能使用这个级别。
2) OPC 柱纯化,OPC 柱中装有对DMT 具有亲和力的树脂,合成DNA 片段时保留5'端最后一个碱基上的DMT,所有合成产物吸附在O PC 柱上以后,用稀的有机溶剂洗柱,带有DMT 的片段吸附能力强,不易被洗脱,不带有DMT 的片段吸附能力弱,被洗脱。
然后用三氟乙酸TFA 或三氯乙酸TCA 脱去DMT 基团,再用浓一点的有机溶剂洗脱DNA。
这种方法的优点是快速,简易。
但是其专一性吸附DMT 能力有限,不免仍然有短片段带入的可能,而且负载量小。
特别是对长于25碱基以上的片段纯化效果不好。
3) HPLC 纯化,这是国外厂家常常使用的办法。
它是依据不同大小的片段带有的净荷多少来分离产物的。
合成粗产物中不同长度的DNA 片段决定了它带有不同的净电荷,较长的片段带有高电荷比带电荷低的短片段在离子交换柱中流动得慢。
先将粗产物检测主峰位置,再增加加样量,回收主峰位置的部分。
它的优点是自动化程度高、省人力;缺点是纯化量小、不能纯化长片段(对于长于40碱基的片段,无法纯化)。
4) PAGE 纯化,几乎所有专业书籍上介绍的最佳纯化方法。
它是依据DNA 片段在变性聚丙烯酰胺凝胶中电泳时的迁移率不同来分离大小片段的。
由于各分子所带电荷和大小不同,综合影响其在凝胶中的迁移速度,大片段迁移得慢,经过一定时间的电泳,大小片段会分开,然后停止电泳,剥离凝胶,置于荧光TLC 板上在紫外灯下切割目的条带,浸泡碎胶,并从泡胶的盐溶液中回收目的DNA。
优点是纯化效果很好、尤其是纯化长链效果更好、而且是可以直观看见DNA 片段合成情况的质控环节。
引物纯化方式选择指南

引物纯化方式选择指南引物纯化是分子生物学实验中常用的一项技术操作,目的是去除引物中的杂质或副产物,以提高引物的纯度和特异性。
选择正确的引物纯化方式对实验结果的准确性至关重要。
本文将从引物纯化的原理、常用的纯化方式以及选择参考因素三个方面为大家介绍引物纯化方式的选择指南。
一、引物纯化的原理引物纯化的原理是通过选择性地去除引物中的杂质或副产物。
引物纯化的方法主要包括有机溶剂沉淀、凝胶纯化、离心滤膜纯化和磁珠纯化等。
这些方法的基本原理是通过杂质和目标分子之间的物理性质差异来实现分离纯化。
1.有机溶剂沉淀:利用酒精或醋酸钠等有机溶剂与引物中的杂质形成不可溶或部分溶解的复合物,然后通过高速离心将引物与复合物分离。
2.凝胶纯化:将引物与杂质分子一起加载在凝胶电泳槽中,用电场将其迁移,根据引物与杂质分子在凝胶中的迁移速度差异进行分离纯化。
3.离心滤膜纯化:将引物混合物通过滤膜孔隙的方法分离纯化,通过准确调节离心速度和离心时间,实现引物与杂质的分离。
4.磁珠纯化:利用带有特定功能的磁珠与引物及其杂质结合,然后通过磁力将引物与磁珠分离。
二、常用的纯化方式根据引物的具体情况和实验需求,可以选择不同的纯化方式。
下面介绍几种常用的引物纯化方式。
1.有机溶剂沉淀:适用于纯化大分子引物,往往需要经过酚/氯仿提取等前处理步骤。
此方法简单易行,但纯化效果可能不如其他方法理想。
2.凝胶纯化:适用于纯化较长的引物,可以有效去除其中的副产物和杂质。
参考因素包括所用凝胶的浓度、运行电场和运行时间等。
3.离心滤膜纯化:适用于小分子引物的纯化。
参考因素包括滤膜孔隙大小、离心速度和时间等。
此方法操作简单,无需特殊设备。
4.磁珠纯化:适用于高效、快速纯化,通常利用磁性珠子和特异性亲和剂结合,可以选择性地富集引物。
此方法通常需要特殊的磁性珠子和离心仪设备。
三、选择参考因素选择适合的引物纯化方法需要考虑以下因素:1.引物的性质:包括分子大小、长度、配对性,选择合适的纯化方法对于不同性质的引物十分重要。
引物纯化方式HAPAGEDHLPC的区别修订稿

引物纯化方式H A P A G E D H L P C的区别Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】引物纯化方式HAP、PAGE、DHLPC等的区别纯化方式:一 OPC纯化OPC纯化是使用一种叫Cartridge的反向层析柱(美国 Waters 公司生产 ),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
1. DNA 合成是用全自动 DNA 合成仪从3‘ → 5‘ 进行人工合成的。
在刚合成完的 DNA 的5‘ 端的碱基上带有一个大型的疏水性保护基团 DMTr 基,而中间产物的短链杂质 DNA 中不具有 DMTr 基。
利用这一性质进行目的 DNA 的纯化。
2. 把粗样 DNA 加入 Sep-Pak Cartridge 柱上(简易反相柱 ) 。
此时,所有的合成产物全吸附于反相柱上。
3. 用甲醇清洗反相柱。
此时,吸附能力强的带有 DMTr 保护基的目的 DNA 仍吸附于反相柱上,而短链杂质 DNA 片段全部被冲走。
4. 向反相柱上加入强酸 TFA (Trifluoroacetic acid) , 切断 DMTr 保护基和目的 DNA 之间的连接。
5. 再用乙腈洗脱目的 DNA 。
此时回收出来的目的 DNA 的纯度能达到 95% 以上。
可用于 DNA 测序等。
二PAGE纯化PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于9 5%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三HPLC纯化采用高效液相色谱纯化,产物纯度极高,可达99%。
各种PCR简介
原位PCR:PCR在组织或细胞样本片上直接进行,用原位杂交找到目的基因的表达位置。
递减PCR:每个循环降低1度退火温度,无需确定最佳退火温度即可反应。
菌落PCR:不用提取基因组DNA,不用酶切鉴定,直接对把菌体热解后暴露的DNA跑PCR简并PCR:用氨基酸序列设计带有简并性的引物库,可以发现新基因或基因家族、多重PCR:也就是把许多种引物放进去,一次增殖多种DNA(省资源)。
不对称PCR:两种引物含量不同(50或100:1),用于制作单链DNA(在前几轮循环中已把低浓度引物用完并搞出足够的模板链,之后便可以快速合成目标链)有色互补PCR(CCA-PCR):用不同荧光染料标记引物5'端,如果是靶基因那会出现两头荧光(正反链都符合各自引物故出现两种荧光,只有一头荧光不是靶序列)。
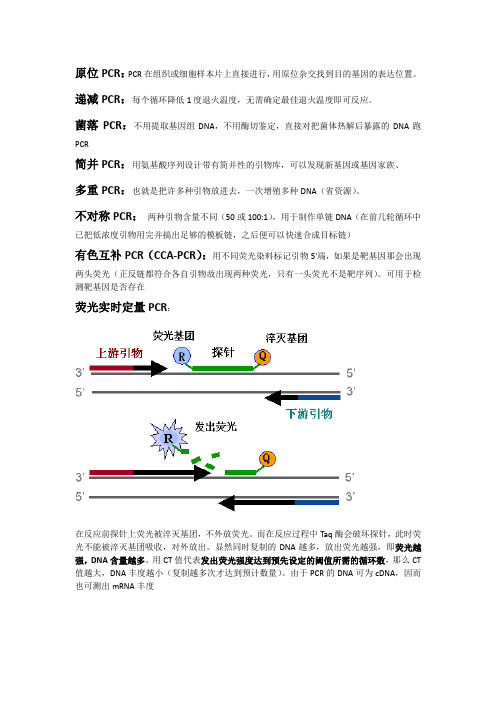
可用于检测靶基因是否存在荧光实时定量PCR:在反应前探针上荧光被淬灭基团,不外放荧光。
而在反应过程中Taq酶会破坏探针,此时荧光不能被淬灭基团吸收,对外放出。
显然同时复制的DNA越多,放出荧光越强,即荧光越强,DNA含量越多。
用CT值代表发出荧光强度达到预先设定的阈值所需的循环数,那么CT值越大,DNA丰度越小(复制越多次才达到预计数量)。
由于PCR的DNA可为cDNA,因而也可测出mRNA丰度热不对称交错PCR:为了用已知序列找未知序列。
基本原理为:1.用简并性引物在未知序列上创造位点。
2.用巢式PCR提高扩增产物特异性3.用2轮高温(特异性引物反应),1轮低温交替(非特异性引物反应)的超级PCR循环提高特异产物比例。
(即不对称PCR的部分)4.通过稀释来降低非特异性产物比例。
引物纯化方式

引物纯化方式
引物是生物学中一种重要的试剂,它可以用于分子生物学的研究,如PCR、克隆等。
因此,引物的质量对于实验的成功至关重要。
然而,在市场上购买的引物往往含有污染成分,如核酸、蛋白质和其他杂质,这些杂质会影响实验效果。
因此,有必要对其进行纯化处理以提高实验效果。
目前常用的引物纯化方法有凝胶电泳、变性层析、气相色谱、水相层析和核酸分子印迹法。
凝胶电泳是一种常用的分子量分离方法,可以将不同大小的核酸分子隔离出来。
变性层析是一种常用的核酸分子选择性纯化方法,依靠核酸分子与不各不同pH值所形成的变性差异而进行选择性地对核酸分子进行对选择性地进行分选。
气相色谱是一个多功能的工具,可以将多个样品中的不各不各成分快速、有效地隔离出来。
水相层析是一个广泛使用的生物大分子纯化工具,可以将大量复杂样品中所含有的生物大分子快速有效地隔离出来。
考样印迹法是一个新兴但十分有效的方法,它可以将低浓度考样中所含有的少量引物快速、有效地隔离出来。
无论使用何种方法对引物进行纯化时都应该遵循正确的实验流程并注意详尽地保存实验数据。
此外,如果想要得到优质引物产品也应该使用优质原料并注意原料储存条件。
引物纯化的方法有哪些

【蛋白研究系列专题】-17丨分分钟get引物各纯化方式如今,引物纯化方式多种多样。
各位科研君,每天忙碌奔波于核酸提取、载体构建、蛋白表达等环节,没有深入了解过各种引物纯化方式吧!今天,小编带各位对各种引物纯化方式作下对比。
各位科研君在以后的研究中,记得对号入座哦!一般纯化方式目前,采用的主打的引物纯化方式是脱盐纯化。
其只能纯化掉引物中的盐分,并不能去除含的小片段,价格较为便宜,能满足一般常规的应用。
1. C18柱:又称为简易反相柱,对DNA有特异性吸附,可被有机溶液洗脱,但不会被水洗脱。
因此能有效地去除盐分,但不能有效去除比目的片段短的小片段。
该方法一般不会对普通PCR反应产生影响。
对于需要用于测序、克隆的引物不能使用这个级别。
2. OPC纯化:采用寡核苷酸纯化柱 (Oligonucleotide Purification Cartridge,OPC)纯化,制品纯度保证80 ~ 90%。
此级别制品可用作PCR引物、DNA测序引物、各种探针等。
该级别只提供长度在35 mer以下的合成DNA制品。
序列更长时,制品的纯度得不到保证。
3. HAP纯化方法HAP(High Affinity Purification)其原理是利用合成引物5'-端DMT基团对HAP树脂专一性吸附,而不含DMT的短链DNA不被吸附,从而达到分离纯化的目的。
制品纯度可达到80~90%,可以满足杂交探针、测序、常规PCR(不再做进一步克隆实验)等用途了。
但是因为其专一性吸附 DMT 能力有限,不免仍然有短片段带入的可能,而且负载量小。
特别是对长于39 碱基以上的片段纯化效果不好。
此级别只提供长度在10-39mer以下的合成oligo DNA制品。
序列更长时,制品的纯度得不到保证。
4. RPC纯化RPC纯化是通过反相净化滤芯 (Reverse Phase Cartridge) 对引物进行纯化,纯化原理与反相HPLC纯化一样。
引物纯化、稀释、保存

三、引物溶解稀释
1.干粉引物溶解稀释方法:
收到引物后,在开启离心管盖前在3000-4000转/分钟的转速下离心1分钟,以防开盖时引物干粉散失。
引物保存在高浓度的状况下比较稳定。
如果对实验的重复性要求较高,合成的OD数较大,建议分装,避免反复冻融。
引物一般配制成10-100pmol/ul(umol/l)。
三博远志的引物在出厂时都标有1OD 相当于多少umol 的计算结果,进行稀释时的引物加水量可以按以下公式计算:
稀释成100pmol/ul 1OD 需加水量(ul)=1OD相当于umol 数×10000
例如,您拿到的引物DNA合成报告单上标有1OD≈0.0035umol ,包装量是1OD/管,如果您希望将引物浓度定为
100umol/L,那么只需用35ul无核酸酶的双蒸水将1OD的引物干粉溶解即可。
2.液体引物再稀释可用下列公式:
稀释引物要达到的浓度(pmol/ul)=母液浓度(pmol/ul)×汲取母液的体积(ul)÷(汲取母液的体积(ul)+加水量(ul))四、引物保存
◆干燥制品很稳定,常温下数个月无问题。
但为保证万无一失,最好放置于- 20 ℃保存;
◆溶解后的溶液DNA短期内(1~2 周)使用可放置在4 ℃下,长期保存请放置于- 20 ℃;溶解DNA时,请注意使用无菌、无核酸酶的水或TE Buffer;
◆如果对实验的重复性要求较高,合成的OD数较大,建议分装,避免反复冻融;
◆荧光标记引物请避光保存。
PCR类型

PCR类型1、共享引物PCR(Shared primer PCR):用3条引物来扩增两种不同的DNA 序列,其中一条引物与两种DNA序列都互补,这条引物与另外两条引物分别组成两对PCR引物。
又称引物竞争法PCR。
2、多重PCR:在一个反应体系中使用一对以上引物的PCR称为多重PCR。
其结果是产生多个PCR产物,用于检测特定基因序列的存在或缺失。
3、不对称PCR(Asymmetric PCR)在PCR中加入的上、下游引物量不同,一般为100:1,在前10~15个循环中产物为双链,当低浓度引物消耗尽后,高浓度引物介导的PCR就会产生大量单链DNA。
用于产生大量单链DNA可用于测序。
4、锚定PCR(Anchored PCR):以mRNA为模板,用oligo(dT)或与mRNA互补的寡核苷酸作引物,在cDNA3`端加上polydG作锚位,用poly(dc)作锚引物,进行PCR扩增。
可用于仅知一端顺序,另一端未知,或多变的DNA扩增。
5、反向PCR:是用反向的互补引物来扩增两引物以外的DNA片段,对某个已知DNA片段两侧的未知序列进行扩增。
可对未知序列扩增后进行分析,如探索邻接已知DNA片段的序列;用于仅知部分序列的全长cDNA的克隆,扩增基因文库的插入DNA;建立基因组步移文库。
6、彩色PCR(color PCR ):用不同的荧光物质标记PCR引物的5’端,扩增产物可发出不同的荧光。
7、原位PCR:原位聚合酶链式反应(In Still PCR,Is-PCR)是由Haase等于1990年首创。
它是利用完整的细胞作为一个微小的反应体系来扩增细胞内的目的片段,在不破坏细胞的前提下,利用一些特定的检测手段来检测细胞内的扩增产物。
8、定量PCR(quantitative PCR):以外参或内参为标准,通过对PCR终产物的分析或PCR过程的监测,对PCR起始模板量的定量。
基本原理:将目的基因和一个单拷贝的参照基因置同一试管→PCR →电泳得两条区带→比较两区带的丰度或引物标上标记物→检测放射性或荧光强度。
(完整word版)引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14内容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE 公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基(Deblocking)用三氯乙酸(Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化(Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接(Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭(Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
HAP法纯化引物

HAP法纯化引物I.处理柱子1.加500ul乙腈,1200r/min 离心1min2.加500ul盐水,1500 r/min 离心1min重复步骤2II.氨解3.将CPG移至96孔尖孔板,用排枪向每孔加入180ul甲胺并盖膜静置10min,2200r/min 离心1min4.取出再次盖膜静置10min,3300r/min 离心1min5.夹板65度水域加热35min6.取出夹板于冷水中浸15minIII.转移7.用排枪向每孔中加入140ulddH2O,转移上柱,梯度离心4min(850、950、1200、1600各一分钟)8.离心后的溶液再次转移上柱,梯度离心4min(850、950、1200、1600各一分钟)IV.做板(纯化)9.加500ul氨水,1500r/min 离心1min重复此操作10.加500ul ddH2O,1500r/min 离心1min重复此操作11.加500ul三氟乙酸,梯度离心5分钟(750 1min、850 1min、960 2min、1600 1min)12.加500ul TEAA,1500r/min 离心1min重复此操作13.加500ul ddH2O,1500r/min 离心1min重复此操作(离心转速改为2600)V.打乙腈14.换用干净的96深孔板,加入400ul乙腈,梯度离心5min(700、850、960、1200、2500各一分钟)VI.做酒沉15.加50ul NaAC,再加960ul冰酒精,注意观察溶液的浑浊现象16.浊夜转移至新的HAP柱,22 00r/min 离心1min重复此操作(离心速度改为3500 r/min)17.脱洗加500ul酒精2600 r/min 离心1minVII.打下来18.换用新的深孔板,加500ul ddH2O静置20min,2600 r/min 离心1min19.盖皮摇匀转至2000停止,测吸光度,取样送交质谱检测。
引物纯化方式HAP AGE DHLPC的区别

引物纯化方式HAP、PAGE、DHLPC等的区别纯化方式:一OPC纯化? ? OPC纯化是使用一种叫Cartridge的反向层析柱(美国Waters 公司生产),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
?1. DNA 合成是用全自动DNA 合成仪从3‘ →5‘ 进行人工合成的。
在刚合成完的DNA 的5‘端的碱基上带有一个大型的疏水性保护基团DMTr 基,而中间产物的短链杂质DNA 中不具有DMTr 基。
利用这一性质进行目的DNA 的纯化。
?2. 把粗样DNA 加入Sep-Pak Cartridge 柱上(简易反相柱) 。
此时,所有的合成产物全吸附于反相柱上。
?3. 用甲醇清洗反相柱。
此时,吸附能力强的带有DMTr 保护基的目的DNA 仍吸附于反相柱上,而短链杂质DNA 片段全部被冲走。
?4. 向反相柱上加入强酸TFA (Trifluoroacetic acid) , 切断DMTr 保护基和目的DNA 之间的连接。
?5. 再用乙腈洗脱目的DNA 。
此时回收出来的目的DNA 的纯度能达到95% 以上。
可用于DNA 测序等。
?二??PAGE纯化? ? PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于95%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三??HPLC纯化? ? 采用高效液相色谱纯化,产物纯度极高,可达99%。
适用于各种基因工程试验,特别是:荧光标记DNA、长链DNA、PCR克隆,定点突变,人工合成基因等。
HPLC 纯化?HPLC 纯化是使用高效液相色谱仪,对目的DNA 片段进行纯化的方法。
引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14内容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基(Deblocking)用三氯乙酸(Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化(Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接(Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭(Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
引物纯化方式HAP、PAGE、DHLPC的区别

引物纯化方式HAP、PAGE、DHLPC等的区别纯化方式:一OPC纯化OPC纯化是使用一种叫Cartridge的反向层析柱(美国 Waters 公司生产 ),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
1. DNA 合成是用全自动 DNA 合成仪从3‘ → 5‘ 进行人工合成的。
在刚合成完的 DNA 的5‘ 端的碱基上带有一个大型的疏水性保护基团 DMTr 基,而中间产物的短链杂质 DNA 中不具有 DMTr 基。
利用这一性质进行目的 DNA 的纯化。
2. 把粗样 DNA 加入 Sep-Pak Cartridge 柱上(简易反相柱) 。
此时,所有的合成产物全吸附于反相柱上。
3. 用甲醇清洗反相柱。
此时,吸附能力强的带有 DMTr 保护基的目的 DNA 仍吸附于反相柱上,而短链杂质 DNA 片段全部被冲走。
4. 向反相柱上加入强酸 TFA (Trifluoroacetic acid) , 切断 DMTr 保护基和目的 DNA 之间的连接。
5. 再用乙腈洗脱目的 DNA 。
此时回收出来的目的 DNA 的纯度能达到 95% 以上。
可用于 DNA 测序等。
二 PAGE纯化PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于95%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三 HPLC纯化采用高效液相色谱纯化,产物纯度极高,可达99%。
适用于各种基因工程试验,特别是:荧光标记DNA、长链DNA、PCR克隆,定点突变,人工合成基因等。
HPLC 纯化HPLC 纯化是使用高效液相色谱仪,对目的 DNA 片段进行纯化的方法。
PCR反应中基本成分(引物、dNTP、模板等)的作用

PCR反应中基本成分(引物、dNTP、模板等)的作用PCR 反应中基本成分(引物、dNTP 、模板等)的作用PCR聚合酶链式反应)反应包括三个基本步骤,即:模板DNA的变性、模板DNA 与引物的退火复性、弓I物的延伸。
PCR反应体系包括5种基本成分,依次为:引物、DNA聚合酶、dNTP 模板DNA Mg2+PCR聚合酶链式反应)反应包括三个基本步骤,即:模板DNA的变性、模板DNA 与引物的退火复性、弓I物的延伸。
PCF反应体系包括5种基本成分,依次为:引物、DNA聚合酶、dNTP 模板DNA Mg2+1、引物引物是PCR特异性反应的关键,PCR产物的特异性取决于引物与模板DNA互补的程度。
理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板DNA在体外大量扩增。
设计引物应遵循以下原则:①引物长15-30bp,常用为20bp左右。
②引物扩增跨度:以200-500bp为宜,特定条件下可扩增长至10kb的片段。
③引物碱基:G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。
ATGC ft好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列。
④避免引物内部出现二级结构,避免两条引物间互补,特别是3'端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
⑤引物3'端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致PCR失败。
⑥引物中有或能加上合适的酶切位点,被扩增的靶序列最好有适宜的酶切位点, 这对酶切分析或分子克隆很有好处。
⑦引物的特异性:引物应与核酸序列数据库的其它序列无明显同源性。
引物量:每条引物的浓度0.1?1umol或10?100pmol,以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。
2、酶目前有两种Taq DNA聚合酶供应,一种是从栖热水生杆菌中提纯的天然酶,另一种为大肠菌合成的基因工程酶。
PCR反应中基本成分(引物、dNTP、模板等)的作用

P C R反应中基本成分(引物、d N T P、模板等)的作用------------------------------------------作者xxxx------------------------------------------日期xxxxPCR反应中基本成分(引物、dNTP、模板等)的作用PCR(聚合酶链式反应)反应包括三个基本步骤,即:模板DNA的变性、模板DNA 与引物的退火复性、引物的延伸。
PCR反应体系包括5种基本成分,依次为:引物、DNA聚合酶、dNTP、模板DNA、Mg2+。
PCR(聚合酶链式反应)反应包括三个基本步骤,即:模板DNA的变性、模板DNA 与引物的退火复性、引物的延伸。
PCR反应体系包括5种基本成分,依次为:引物、DNA聚合酶、dNTP、模板DNA、Mg2+。
1、引物引物是PCR特异性反应的关键,PCR 产物的特异性取决于引物与模板DNA互补的程度。
理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板 DNA在体外大量扩增。
设计引物应遵循以下原则:①引物长度: 15-30bp,常用为20bp左右。
②引物扩增跨度:以200-500bp为宜,特定条件下可扩增长至10kb的片段。
③引物碱基:G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。
ATGC最好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列。
④避免引物内部出现二级结构,避免两条引物间互补,特别是3’端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
⑤引物3’端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致PCR失败。
⑥引物中有或能加上合适的酶切位点,被扩增的靶序列最好有适宜的酶切位点,这对酶切分析或分子克隆很有好处。
⑦引物的特异性:引物应与核酸序列数据库的其它序列无明显同源性。
引物量:每条引物的浓度0.1~1umol或10~100pmol,以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。
引物纯化方式选择指南

引物纯化方式选择指南2012-2-16 10:24:14容导读一、DNA合成的方法和原理二、引物纯化的方法原理及其效果三、纯化方法与应用指南四、常见问题的原因分析及相应的对策一、DNA合成的方法和原理目前引物合成主要采用固相亚磷酰胺三酯法进行。
基于该方法的DNA合成仪有多种,由ABI/PE 公司生产的高通量DNA自动合成仪得到了广泛的应用。
各合成仪进行引物合成的原理基本相同,主要区别在于合成产率的高低、试剂消耗量和单个循环用时等。
生工公司采用的合成仪主要机型为全新的ABI3900高通量合成仪。
固相亚磷酰胺三酯法合成DNA片段,具有高效、快速偶联以及起始反应物比较稳定的特点。
该方法是在固相载体上完成DNA链的合成的,DNA化学合成不同于酶促的DNA合成过程从5’ →3’方向延伸,而是由3’端开始,相邻的核苷酸通过3’→ 5’磷酸二酯键连接。
具体的反应步骤如图一。
1、脱保护基 (Deblocking)用三氯乙酸 (Trichloroacetic Acid,TCA) 脱去连结在CPG (Controlled Pore Glass) 上的核苷酸的保护基团DMT (二甲氧基三苯甲基),获得游离的5'-羟基端,以供下一步缩合反应。
2、活化 (Activation)将亚磷酰胺保护的核苷酸单体与四氮唑活化剂混合并进入合成柱,形成亚磷酰胺四唑活性中间体(其3'-端已被活化,但5'-端仍受DMT保护),此中间体将与GPG上的已脱保护基的核苷酸发生缩合反应。
3、连接 (Coupling)亚磷酰胺四唑活性中间体遇到CPG上已脱保护基的核苷酸时,将与其5'-羟基发生亲合反应,缩合并脱去四唑,此时合成的寡核苷酸链向前延长一个碱基。
4、封闭 (Capping)缩合反应后,为了防止连在CPG上的未参与反应的5'-羟基在随后的循环反应中被延伸,常通过乙酰化来封闭此端羟基,一般乙酰化试剂是用乙酸酐和N-甲基咪唑等混合形成的。
3种PCR产物纯化方法的比较
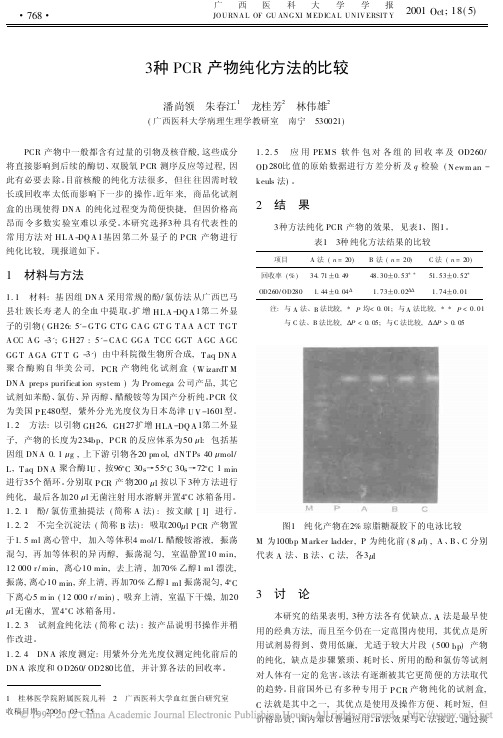
收稿日期: 2001- 02- 10
1. 3 结 果: 以 A DL ( 日常生活能力) 分级法, Ⅰ级为良好 4例, Ⅱ~Ⅲ级为轻残12例, Ⅳ~Ⅴ级为重残4例, 死亡5例。
2 护 理
2. 1 术前护理 除做好常规术前准备外, 还要做好清醒病人及家属的心 理护理, 密切观察 生命体征的变化, 正确进行 GCS 评分, 对 血压过高并伴有颅内压增高的表现 或脑疝先兆时, 立即给予 脱水剂, 并按医嘱给予安全、有效、适度的降压, 但要防止 血压下 降过低、过快[1] 。有研究指明将血 压降至出血 前水平 或维持在20~21. 2/ 12~13. 3 kPa, 可预防进一步出血, 同时 不会导致过度降压所引起的脑灌注 不足, 以保证手术顺利进 行。 2. 2 术后护理 2. 2. 1 引流管置管期 的观察及护理: 能否有效 地发挥引流 的作用, 取决于手术后引流的护理。既 要仔细的观察, 又要得 当地护理, 每一 个环节对手术成功 都至关重要。脑出血破入 脑室, 由于血肿对脑干及丘脑下部的刺激或脑脊液循环通路 受阻, 皆可导致病人症状加重及出现继发性损害致诸多致命 并发 症。脑 室内出 血最重 要的手 术方法是 脑室外 引流。我们 采用双侧脑室外引流, 对于出血破入一侧脑室者, 先行对侧 脑室引流, 迅速降低颅内压, 阻断脑缺血、缺氧、脑水肿的 恶性循环, 争取 了抢救时间。并且尿激酶持续 灌滴环流冲洗 脑室 出血, 使清 除脑室 内血肿 和疏通 脑脊液 循环的 时间缩 短, 以减少留管 于脑室带来的可能 的感染。严 格无菌操作及 密闭式引流仍是预防感染的重要环 节, 并准确记录引流液的 量、颜色和性质, 待冲洗排出液颜色清亮, 复查 CT 证实血 肿清除, 病人一般情况好转, 可根据医嘱作好拔管准 备。 2. 2. 2 意识 状态及 瞳孔的 观察。意识状 态是判 断病情 及预 后的重 要指标[2] 。当患者由清醒转 为嗜睡或烦躁 不安, 或有
引物的合成和纯化

FAQ:引物的合成和纯化1. 引物是如何合成的?目前引物合成基本采用固相亚磷酰胺y三酯法。
该方法具有高效、快速的偶联以及起始反应物比较稳定的特点。
主要是将DNA固定在固相载体上完成DNA链的合成的,合成的方向是由待合成引物的3'端向5'端合成的,相邻的核苷酸通过3'→5'磷酸二酯键连接。
固相亚磷酰胺三酯法合成引物的具体步骤如下:1) 将预先连接在固相载体CPG上的活性基团被保护的核苷酸与三氯乙酸反应,脱去其5'-羟基的保护基团DMT,获得游离的5'-羟基。
2) 合成DNA的原料,亚磷酰胺保护核苷酸单体,与活化剂四氮唑混合,得到核苷亚磷酸活化中间体,它的3'端被活化,5'-羟基仍然被DMT保护,与溶液中游离的5'-羟基发生缩合反应。
3) 带帽(capping)反应,缩合反应中可能有极少数5'-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应,这种短片段可以在纯化时分离掉。
4) 在氧化剂碘的作用下,亚磷酰形式转变为更稳定的磷酸三酯。
经过以上四个步骤,一个脱氧核苷酸被连接到固相载体的核苷酸上。
再以三氯乙酸脱去它的5'-羟基上的保护基团DMT,重复以上步骤,直到所有要求合成的碱基被接上去。
合成过程中可以观察TCA处理阶段的颜色判定合成效率。
通过氨水高温处理,连接在CPG上的引物被切下来,通过RPC、PAGE等手段纯化引物,成品引物用C18浓缩,脱盐,沉淀。
沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
2. DNA合成粗产物中含有什么杂质?主要是合成反应过程中产生的失败片段以及脱保护基团时产生的铵盐。
3. 引物纯化方式有哪些?引物常用的纯化方式C18脱盐、RPC纯化、PAGE纯化、HPLC纯化。
4. 引物纯化方式如何选择?引物纯化主要方法的适用范围及建议您可以根据您的实验需求,选择合适的金斯瑞引物纯化方式,更加经济方便。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
引物纯化方式HAP、PAGE、DHLPC等的区别
纯化方式:
一OPC纯化
OPC纯化是使用一种叫Cartridge的反向层析柱(美国Waters 公司生产),根据DNA保护基(DMTr基)和层析柱中树脂间的亲和力作用的原理进行纯化目的DNA片段。
OPC法纯化的DNA纯度大于90%,适用于PCR用引物,DNA测序用引物,各种探针等。
此级别对短链较为有效。
具体操作方法如下。
1. DNA 合成是用全自动DNA 合成仪从3‘ →5‘ 进行人工合成的。
在刚合成完的DNA 的5‘ 端的碱基上带有一个大型的疏水性保护基团DMTr 基,而中间产物的短链杂质DNA 中不具有DMTr 基。
利用这一性质进行目的DNA 的纯化。
2. 把粗样DNA 加入Sep-Pak Cartridge 柱上(简易反相柱) 。
此时,所有的合成产物全吸附于反相柱上。
3. 用甲醇清洗反相柱。
此时,吸附能力强的带有DMTr 保护基的目的DNA 仍吸附于反相柱上,而短链杂质DNA 片段全部被冲走。
4. 向反相柱上加入强酸TFA (Trifluoroacetic acid) , 切断DMTr 保护基和目的DNA 之间的连接。
5. 再用乙腈洗脱目的DNA 。
此时回收出来的目的DNA 的纯度能达到95% 以上。
可用于DNA 测序等。
二 PAGE纯化
PAGE纯化法是使用变性聚丙烯酰胺凝胶电泳,对DNA片段进行分离,然后从凝胶中回收目的DNA的方法。
PAGE纯化法也是一种非常有效的DNA纯化方法,纯化后的纯度大于95%,对长链Oligo DNA的纯化特别有效。
适用于PCR用引物,DNA测需用引物,各种探针等。
三 HPLC纯化
采用高效液相色谱纯化,产物纯度极高,可达99%。
适用于各种基因工程试验,特别是:荧光标记DNA、长链DNA、PCR克隆,定点突变,人工合成基因等。
HPLC 纯化
HPLC 纯化是使用高效液相色谱仪,对目的DNA 片段进行纯化的方法。
HPLC 纯化的设备投资大,生产成本高,但使用本法纯化的 DNA 片段纯度极高,大于99% 。
HPLC 纯化的操作方法如下。
1. 合成高纯度级DNA 制品时,在全自动DNA 合成仪上,需自动脱去DMTr 保护基。
2. 将粗样DNA 注入分离性能极强的离子交换高效液相色谱系统,进行粗检测,确认主峰位置、目的DNA 含量等。
3. 增加注样量,回收主峰平头部分。
此时可达到去除杂质短链DNA ,纯化目的DNA 的目的。
为了确保DNA 的纯度,一般一次的纯化量为 1 OD 左右。
4. 将回收后的DNA 进行纯度检测,确认纯度的可靠性。
四HAP
什么是HAP?
HAP是英文HIGE AFFINITY PURIFICATIION的缩写。
HAP方法是生工自主开发的新型oli go DNA纯化方法。
用HAP纯化的引物纯度可达98%以上,完全可与PAGE、HPLC方法媲美。
其原理是利用合成引物5’-端DMT基团对HAP树脂专一性吸附、而不含DMT的短链DNA 不被吸附,从而达到分离纯化的目的。
HAP方法的三大优势:
纯度高。
用其纯化所得引物的纯度高达98%以上(见图1)。
可用于绝大多数分子生物学实验。
快速。
用HAP方法纯化的引物一轮只需2小时,因而可比PAGE方法提前一天交货,节约您更多宝贵时间。
价格上更有竞争优势。
由于HAP方法与PAGE、HPLC方法相比速度快、成本低,从而节约科研经费。
HAP引物的用途
用HAP方法纯化的引物可用于绝大多数分子生物学实验,包括DNA测序、基因合成、PCR 反应、点突变、分子杂交和基因芯片技术等。
其纯度对于一般的PCR实验而言更是绰绰有余。
从2000年起,生工测序部和基因合成部所用引物均来自HAP方法。
目前基因合成部更是每周需要HAP纯化的引物至少2000条。
事实证明,HAP方法纯化的引物完全可以用于测序反应和基因合成等对引物纯度要求较高的实验。
五RPC纯化
RPC纯化是通过反相净化滤芯(Reverse Phase Cartridge) 对引物进行纯化,纯化原理与反相HPLC纯化一样。
与反相HPLC比较,RPC是一种有效且更加经济的纯化方式。
反相净化滤芯通常包含一种疏水基质如C18的硅胶,能够很好的吸附DNA,并且可以用水轻松地将切割下来的保护基团和短的引物片段从反相柱上洗掉。
RPC纯化的引物可以应用于DNA测序、PCR及基因合成等。
根据纯化方式的不同,DNA 制品可分为三个级别:OPC 级、PAGE 级、高纯度级。
OPC 级制品:进行OPC 纯化,纯度大于95% 。
适用于PCR 用引物、DNA 测序用引物、各种探针等。
此级别只接受30mer 以下的制品。
PAGE 级制品:用PAGE 胶纯化,纯度大于95% 。
适用于PCR 用引物、DNA 测序用引物、各种探针等。
纯化 30mer 以上的合成DNA 制品时,纯度高于OPC 纯化法。
高纯度级制品:采用高效液相色谱(HPLC )法进行纯化,纯度大于99% 。
由于纯度极高,使用本法纯化的DNA 制品可适合于各种基因工程实验。
特别是:PCR 克隆、定点突变、人工合成基因等。
