人教版化学九年级上册第三单元《原子的结构》ppt课件 ( 共45张PPT)
合集下载
新人教版化学九年级上册课件:3.2《 原子的结构》(共47张PPT)

2、原子中:质子的质量≈中子的质量 3、原子的质量主要集中在原子核上。
练习
1.一个碳原子的质量是1.993×10-26 Kg,碳的相 对原子质量为( C ) A. 12 g B. 1/12 C.12 D.1.993×10-26 Kg/12
2.碳和镁的相对原子质量分别是12和24,则 碳和镁的原子质量最之比为 ( D ) A.12:1 B.2:12 C.2:1 D.1:2
+16 2 8 8
S
S2-
1、在原子中,质子数和电子数有何关系 ?
2、在离子中,质子数和电子数又有何关系? 不相等
原 子 中: 质子数=电子数 阳离子中: 质子数>电子数; 阴离子中: 质子数<电子数;
•原子和离子的区别 •原子不带电(质子数=电子数) •离子带电(质子数≠电子数)
2、离子的形成
学习目标:
1.掌握原子的构成,以及构成粒子之间的关系; 2.掌握原子结构示意图; 3.了解原子核外的电子分层排布,以及典型元素原子核外电子的排布特点; 4.了解离子形成过程,掌握离子符号的书写。
氧 化 汞 分 子 的 分 解
分子是保持物质化学性质的最小粒子; 原子是化学变化中的最小粒子;
在化学变化中,分子可以再分,而原子不能再分。
②单位为“ 1 ”(省略不写)。
其它原子的质量 相对原子质量= 碳原子质量 1/12
计算:氢碳氧的 相对原子 质量
已知:
一个氢原子的质量为1.67×10-27kg
一个碳原子的质量为1.993×10-26kg 一个氧原子的质量为2.657×10-26kg, 计算它们的相对原子质量
氢原子的实际质量 氢的相对原子质量=
3X
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
练习
1.一个碳原子的质量是1.993×10-26 Kg,碳的相 对原子质量为( C ) A. 12 g B. 1/12 C.12 D.1.993×10-26 Kg/12
2.碳和镁的相对原子质量分别是12和24,则 碳和镁的原子质量最之比为 ( D ) A.12:1 B.2:12 C.2:1 D.1:2
+16 2 8 8
S
S2-
1、在原子中,质子数和电子数有何关系 ?
2、在离子中,质子数和电子数又有何关系? 不相等
原 子 中: 质子数=电子数 阳离子中: 质子数>电子数; 阴离子中: 质子数<电子数;
•原子和离子的区别 •原子不带电(质子数=电子数) •离子带电(质子数≠电子数)
2、离子的形成
学习目标:
1.掌握原子的构成,以及构成粒子之间的关系; 2.掌握原子结构示意图; 3.了解原子核外的电子分层排布,以及典型元素原子核外电子的排布特点; 4.了解离子形成过程,掌握离子符号的书写。
氧 化 汞 分 子 的 分 解
分子是保持物质化学性质的最小粒子; 原子是化学变化中的最小粒子;
在化学变化中,分子可以再分,而原子不能再分。
②单位为“ 1 ”(省略不写)。
其它原子的质量 相对原子质量= 碳原子质量 1/12
计算:氢碳氧的 相对原子 质量
已知:
一个氢原子的质量为1.67×10-27kg
一个碳原子的质量为1.993×10-26kg 一个氧原子的质量为2.657×10-26kg, 计算它们的相对原子质量
氢原子的实际质量 氢的相对原子质量=
3X
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
人教版初中化学《原子的结构》_优质课件

氢 和电子所1 带的电量相0 等,但电 1
氦 性相反,2 所以原子不2 显电性。 2
碳
6
6
6
钠
11
12
11
氯
17
18
17
铁
26
30
26
探索新知 一、原子内部结构有何奥秘
观察下表 ,你又能获得哪些信息?
原子种类 核电荷数 质子数 中子数 核外电子数
氢
1
1
0
1
氦
2
2
2
2
钠
11
11
12
11
氯
17
17
18
1909年至1911年, 英国物理学家卢瑟福和 他的合作者通过α粒子的 散射实验,提出了原子 结构的核式结构学说。
a粒子轰击金箔视频
探索新知 一、原子内部结构有何奥秘
原子的发现历程 3.原子结构的核式结构学说?
即:在原子的中心有一 个带正电荷的核,它的质量 几乎等于原子的全部质量, 电子在它的周围沿着不同的 轨道运转,就像行星环绕太 阳运转一样。
原子的质量主要集中在 原子上核。
探索新知 一、原子内部结构有何奥秘
原子的结构
原子
质子
每个质子带一 个单位正电荷
原子核 (带正电)
所带正电荷数称 为核电荷数
(带正电) 中 子
(不带电)
电 子 每个电子带一个 (带负电)单位负电荷
探索新知 一、原子内部结构有何奥秘
思考2:原子是由带电的粒子构成的, 那么原子显电性吗?为什么?
人教版九年级化学上册 第三单元课题2 《原子的结构》 第1课时
原子的结构
知识回顾
1.物质是由分子、原子等粒子构成的。 2.分子是保持物质化学性质的最小粒子。 3.原子是化学变化中的最小粒子。 4.在化学变化中,分子是可分的,原子是不可分的。 5.化学变化的实质——在化学反应中,分子分成原子,原
人教版九年级化学上册第3单元1分子和原子(共45张PPT)
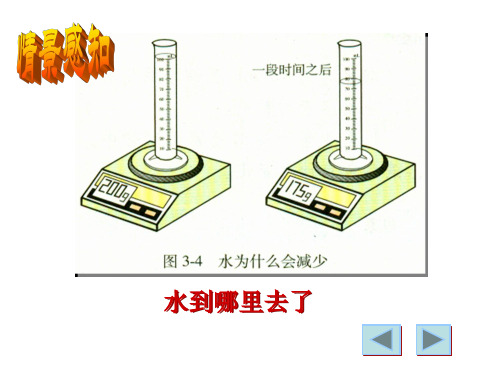
在化学变化前后,原子的种类、 大小、性质都不变。
联 系
分子由原子构成
原子是构成分子的粒子,也是 直接构成物质的一种粒子。
分子可以构成物质,原子也可以直接构成物质。
注
意
分子与构成这种分子的原子相比,分子要大些。但不能笼统认为 分子比原子大。
下列的说法是否正确:
1、分子大,原子小。 2、分子可直接构成物质,而原子则先 构成分子后再构成物质
是否分子变了,化学性质也 变了?分子是怎样变的呢?
讨论:
1、从分子的角度看,水的蒸发和水 的电解有什么不同?
加热
水
水蒸气
通电
水
氢气
氧气
4、在发生物理变化时,分子的本身没有 变化。(同种分子,性质相同)
形状变
状态变
4、在发生物理变化时,分子的本身没有 变化。(同种分子,性质相同)
形状变
状态变
4、在发生物理变化时,分子的本身没有 变化。(同种分子,性质相同)
元素
(组成) 化合物
(不同种原子按一定比例)
(同种原子) 原子
(由同种原子构成的分子)
分子 (由不同种原子按一定 比例构成的分子)
四、用分子、原子观点解释物理变化、化学变化
1、物质发生物理变化时,分子不变,当 物质发生化学时分子变了,原子不变。 2、混合物和纯净物
由分子构成的物质中,纯净物中由同 种分子构成的,有固定的组成;混合 物是由为同种分子构成的,无固定的 组成。
混合物
物质
纯净物
单质 化合物
氧化物
酸 碱 盐
单质
(组成)
根据下列的图形给物质分类(混合物、 纯净物、单质、化合物):
纯净物、化合物
九年级化学人教版上册第三单元课题2《原子的结构》课件

2、离子的表示方法: 离子结构示意图 +11 2 8
+17 2 8 8
离子符号
Na+
Cl-
在元素符号的右上角标出所带的电荷数,数值前符号在后, 1可以省略不写。 如:Na+ Mg2+ Cl- O2-
原子中: 核电荷数 = 质子数 = 核外电子数
阳离子: 核电荷数 = 质子数 > 核外电子数 阴离子: 核电荷数 = 质子数 < 核外电子数
3S2- 表示3个硫离子
4、离子和原子的区别与联系:
原子
离子
阳离子
阴离子
结构
质子数== 核外电子数 质子数>核外 质子数<核外
电子数
电子数
电性
不带电
表示法
阳离子
联系
Na
失去电子
得到电子
原子
带正电
Na+
得到电子 失去电子
带负电
Cl-
阴离子
5.常见的原子团离子
名称 硫酸根离子
碳酸根离子
硝酸根离子
氢氧根离子
学生练习
3、从“分子、原子、质子、中子、电子、原子核、”中, 选出适当的微粒名称填写下列空白。 (1)在化学变化中,一定发生变化的微粒是 分子 。 (2)在原子结构中不显电性的是 中子,带正电荷的 是 质子 ,带负电荷的是 电子 。 (3)一般来说,同一种原子里,数目一定相等的 是 质子数和电子数 。 (4)构成原子的微粒有 质子、中子、电子。 (5)构成物质的微粒有分子、原子 。
因此原子核带正电,数目跟质子相等。
分析表格
观察表格,思考下列问题
原子种类
质子数
中子数
核外电子数
氢
1
0
人教版化学九年级上册第三单元3.2《原子的结构》ppt课件 ( 共45张PPT)

原子的体积很小
原子核比原子小得多
原子
• 不同原子的质量各不相同,可以用现代 科学仪器精确地测量出来。如:
• 一个氢原子的质量是:1.67×10-27㎏, • 一个氧原子的质量是:2.657×10-26㎏, • 一个铁原子的质量是:9.288×10-26㎏。
这样小的数字,书写、记忆和使用起来都 很不方便,就像用吨做单位来表示一粒稻谷或 小麦的质量一样,能不能用一种好写、好记、 好用的方法来表示原子的质量呢?
带一个单位负电荷
Cl
-
静电作用形成化合物
-
-
--
-
--
-
--
--
-
+11
-
+17
--
-
-
---
--
--
-
-
NaCl
四、离子的形成
1、离子 带电的原子或原子团
2、离子分类
阴离子 (电子数>质子数) 阳离子 (电子数<质子数)
3、离子的表示——离子符号
n±
X
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
3.俄罗斯科学家最近合成了核电荷数为114的元
素的原子,经测定该原子的近似相对质量为
289,则其中子数是_____1_7_5_____。
4.化学变化中的最小粒子是( A )
A.原子 B.分子
C.质子
D.中子
5.已知1个C-12原子的质量为akg,则实际质量
为b kg的另一种原子的相对原子质量为( B)
1.决定元素化学性质的是( B)
A质子数 B最外层电子数 C中子数 D原子量 2.同种元素的原子和离子一定具有相同的( A) A核电荷数 B电子层数 C最外层电子数 D带电量 3.某元素原子核外有3个电子层,最外层上有1个电 子,该元素的核电荷数 为( B) A 5 B 11 C 1 D 18 4.根据4种粒子结构示意图,下列说法正确的是( C)
人教版九年级上册化学课件原子的结构课件

2. 某元素原子结构示意图为,则X的值为(11 )。
根据元素原子结构示意图,
+X 2 8 1
不能直接获得的信息是( B )
A.核电荷数
B.相对原子质量
C.电子层数
D.最外层电子数
3、某元素原子最外层电子数是次外层电子数的3倍, 该原子的质子数是 。
解析:
①假设该原子只有两个电子层,次外层就是第一层, 第一层电子最多只有两个,那么最外层电子数就是 2X3=6个电子,质子数=电子数=2+6=8个
课题2 原子的结构
学习目标
1.知道原子是由原子核和核外电子构成的, 并知道整个原子呈电中性的原因。
2.记住核电荷数、质子数和核外电子数之 间的关系。
3.知道原子核外电子的排布规律
先学
阅读课本53页,3分钟后请同学回答
下列问题
1、原子是 空心 (空心/实心)的球体。 2、原子是由 原子核和 核外电子构成的。原子核是由 和 质子 构成中的子。 3、一个质子带1个正电荷 ,一个电子带 1个负电荷 ,
4.一种元素与另一种元素的本质区别是( A)
A.质子数不同 B.中子数不同
C.相对原子质量不 同 D.电5分钟后请同学回答下列问题
1、在多电子原子中,核外电子具有 不同的 运动状态, 离核越近,能量 越低,离核越远,能量越高 。
2、离原子核最近的电子层成为第一层 ,次之为第二层, 以此类推,离核最远的称为 最外层 。核外电子的这种 分层运动又叫分层排布 。
3、得电子失电子都会使原子带电,这种带电原子叫 做 离子 ,带正电的叫 阳离子 ,带负电的叫阴离子 。
像稀有气体元素原子这样的结构 叫8电子稳定结构。 若只有一个电子层,则2电子 也是稳定结构(如:He)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大 部 分 体 积, 原 子 核 集 中原 子 的 主 要 质 量 。
课题2 原子的结构第二教时
原子核外电子运动的特征:核外电子的运 动有自己的特点,没有固定的轨道,但却 有经常出现的区域。
原 核外子电核子外的电运动子有运自动己的的特特点征,没有
固定的轨道,但却有经常出现的区域
电子在原子核外一定区域内出现,这些区域 叫做“电子层”,核外电子是在不同的电子层内 运动的,此现象叫做核外电子的分层排布。
(也叫最外层)
+2 2
+10 2 8
+18 2
8
8
+11
2
8 1
+12 2 8 2
氦(He) 氖(Ne) 氩(Ar) 钠(Na) 镁(Mg)
+6 2 4 +7 2 5
+8 2 6
+9 2 7
n2
碳(C) 氮(N) 氧(O) 氟(F)
+13 2 8 3
铝(Al)
3、核外电子排布的规律(2n2)
A.12b/a kg B.12b/a C.12a/b D.12a/b kg
6.氡原子的质子数为86,中子数为136,这种氡
原子核外电子数为( B )
A.50 B.86
C.136
D.222
7.在 原 子 的 组 成 中,
质 子 带 正 电,
电 子 带 负 电, 中 子 不 带 电, Байду номын сангаас 子 绕
着原 子 核 做 高 速 运 动。 电 子 占 据 原 子 的 绝
二:相对原子质量(P56)
原子的质量
一个碳原子的质量是:1.993×10-26千克 一个氧原子的质量是:2.657×10-26千克 一个氢原子的质量是:1.67×10-27千克
1. 定义:以一种C—12原子质量的1/12为标准 (实际上就是一个质子或一个中子质量)其他原 子的质量跟它相比较所得的值,作为这种原 子的相对原子质量。(符号为Ar)
80
35
45
35
复习提问
1.原子的结构? 2.相对原子量的定义? 3. 相对原子量在数值上等于什么?
课堂练习
1 铁原子的相对原子质量是( B )
A 56克
B 56
C 9.288 × 10-26 Kg D 1/56
2 组成一切原子必不可少的粒子是( B )
A 质子
B 质子 电子
C 质子 中子 电子 D 质子 中子
氧原子质量
氧的相对原子质量=
2.657×10-26Kg 1.66×10-27Kg 标准
≈ 16
注意: 单位为1(一般不写)
• 尝试查阅一下如下几种元素的相对原 子质量:磷、铝、氮、钠、硫、镁
•
看谁查得又快又准!
磷——31 铝——27
氮——14 钠——23
硫——32 镁——24
相对原子质量和质子数 、 中子数之间的关系
3.俄罗斯科学家最近合成了核电荷数为114的元
素的原子,经测定该原子的近似相对质量为
289,则其中子数是_____1_7_5_____。
4.化学变化中的最小粒子是( A )
A.原子 B.分子
C.质子
D.中子
5.已知1个C-12原子的质量为akg,则实际质量
为b kg的另一种原子的相对原子质量为( B)
原子种类
氢 碳 氧 钠 磷 硫 铁
相对原子质量
1 12 16 23 31 32 56
质子数
1 6 8 11 15 16 26
相对原子质量 ≈质子数 + 中子数
中子数
0 6 8 12 16 16 30
填表
微粒 H
相对原 子质量
1
质子数 中子数
1
0
电子数 1
Na
23
11
12
11
S
32
16
16
16
3850Br
人教版化学九年级上册 第三单元《原子的结构
》ppt课件 ( 共45张 PPT)
2020/8/26
复习提问
1.分子和原子的定义? 2.分子和原子的特征? 3.化学反应的实质?
• 在化学反应 里分子可以分为 原子,原子不能 再分,那么用其 它方法能不能将 原子再分呢?
1897年,英国科学家汤姆生发现了电子(来自原子 内部),证明原子可分的;卢瑟福提出原子结构的“核式
2.定义式: 某原子的相对原子质量Ar
一个该原子的实际质量(kg) = ─────────────
一个碳原子的实际质量 (kg) × 1/12
注意:a.相对原子质量是一个比值不是实际质量.
b.国际单位制为1.
已知:氧原子的质量=2.657×10-26Kg
标准=
1 12
×一个碳12原子的质量
≈ 1.66×10-27Kg
原子的体积很小
原子核比原子小得多
原子
• 不同原子的质量各不相同,可以用现代 科学仪器精确地测量出来。如:
• 一个氢原子的质量是:1.67×10-27㎏, • 一个氧原子的质量是:2.657×10-26㎏, • 一个铁原子的质量是:9.288×10-26㎏。
这样小的数字,书写、记忆和使用起来都 很不方便,就像用吨做单位来表示一粒稻谷或 小麦的质量一样,能不能用一种好写、好记、 好用的方法来表示原子的质量呢?
原子核外电子的运动与排布
原子核外电子的运动与排布
三、原子核外电子的排布
1、原子核外电子是分层排布的
人们发现原子核外电子最少的有1层, 最多的有7层. (K L M N O P Q 或1 2 3 4 5 6 7 )
2、原子结构示意图
原子核
原子核带正电
质子数
+15 2 8 5
第1层 第2层 第3层
构成原子的粒 子种类
各粒子的电性
各粒子的质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷 质子质量的1/1836
4、原子的质量主要集中在原子核上;核外电子占 据
原 子 的 绝 大 部 分 体积。
原子不显电性的原因:
由于原子核所带电量和核外电子 的电量相等,但电性相反,所以整个 原子不显电性。
模型”又叫“行星模型”
一、原子的构成
质子
原子核
原子
中子
核外电子
2020/8/26
原子核带正电
1 电性和电量
1个质子带一个单位正电荷;
中子不带电;
1个电子带一个单位负电荷。
原子核所带的正电荷数目叫做 核电荷数
原子 种类
氢 碳 氧 钠 铁
原子核
核外
核电 荷数
质子数 中子数
电子 数
1
1
0
1
6
6
6
6
8
8
8
8
11
11
12
11
26
26
30
26
2从表中可以得出:
(1)、质 子 数 不 一 定 等 于 中 子 数,原 子 中 不 一 定 含 有 中 子;
(2)、构成原子的必要粒子是质子和电 子,决定原子种类的是核内质子数,它必 不可少。
(3)、核电荷数=质子数=核外电子数
分析表格
阅读下表3-2,你能得出什么结论呢?
