2020届高中化学竞赛辅导(一)原子结构元素周期律
化学竞赛常用知识点总结

化学竞赛常用知识点总结一、元素周期表1. 元素周期表的结构和元素的排列规律元素周期表是按照元素的原子序数从小到大排列的一张表,原子序数是指元素原子核中质子的数量。
元素周期表的横向周期数称为周期,竖向的行称为族。
元素周期表中元素的排列是按照其原子序数递增的顺序排列的,按照周期数分为七个周期,按照族分为18个族。
2. 元素的周期性特征元素周期表中,同一周期的元素,其外层电子的能级相同;同一族元素,其外层电子数相同。
根据这一规律,可以总结出元素周期表中元素的周期性特征,如原子半径的变化规律、电负性的变化规律、电离能的变化规律等。
3. 元素周期表中主要族的特征主族元素的特征包括原子半径、电负性、电离能、化合价等方面的周期性规律。
其中,碱金属元素的化合价为+1,从上到下原子半径逐渐增加,电离能逐渐减小;碱土金属元素的化合价为+2,从上到下原子半径逐渐增加,电离能逐渐减小。
4. 元素周期表中的过渡金属过渡金属是指元素周期表中位于主族元素与稀土元素之间的一组元素。
过渡金属具有几种原子价态,同时具有两种或更多的氧化态,容易形成多种阳离子。
过渡金属具有一定的金属性质,同时也具有一定的非金属性质。
5. 元素周期表中的稀土元素稀土元素是指元素周期表中镧系和钪系元素的元素。
这些元素在化学性质上表现出相似的特点,具有较强的金属性质和一定的发光性能。
稀土元素广泛应用于核工业、航天航空、电子技术和光学材料等领域。
二、化学键1. 化学键的种类和性质化学键包括共价键、离子键、金属键等。
共价键是指共用电子对形成的化学键,具有方向性和极性。
离子键是指离子之间的静电作用形成的化学键,通常由金属和非金属元素形成。
金属键是指金属原子之间的电子云形成的化学键,具有自由移动性。
2. 共价键的特点和性质共价键是由原子间共用电子对形成的化学键。
共价键具有极性和方向性,共价键中的原子存在特定的电负性差异。
根据原子间电负性的不同,可以区分出非极性共价键、极性共价键和离子键。
2020年高中化学必修一元素周期律

专题元素周期律学习目标1.掌握元素周期律;2.了解金属、非金属在周期表中的位置及其性质的递变规律;3.由元素周期律和元素周期表的关系,了解元素周期表的应用。
新授课一、元素周期律1、元素原子结构及化合价的变化(以第三周期元素为例)规律:同一周期元素,随着原子序数的递增,原子的最外层电子数呈现由的周期性变化(第一周期除外),主族元素原子的最高正价呈现由到的周期性变化,最低负价呈现由的周期性变化(第一周期除外)。
【注意】F无正价,O无最高正价2.元素原子半径的周期性变化规律:同一周期元素,随着原子序数的递增,原子半径呈现由的周期性变化(稀有气体除外)(同主族,随着原子序数的递增,原子半径由)。
注:微粒半径大小的比较方法:一看电子层数:当电子层数不同时,电子层数越多,半径越大。
二看核电荷数:当电子层数相同时,核电荷数越大,半径越小。
三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
微粒半径由电子层数和核电荷数决定。
电子层数越多,则半径越__ __,核电荷数越多,对核外电子吸引力越_ _,微粒半径越,比较时应把二者综合考虑.(1)原子半径的比较①同一周期电子层数相同,随着原子序数递增,主族元素原子半径____________例如:r(Na) r(Mg) r(Al) r(Si) r(P) r(S) r(Cl)②同一主族,随着______递增,原子半径__________例如:r(Li) r(Na) r(K) r(Rb) r(Cs)(2)离子半径的比较①同种元素,电子数越多,半径例如:r(Cl-) r(Cl),r(Fe) r(Fe2+) r(Fe3+)②电子层结构相同的离子,核电荷数越大,半径_________即。
例如:r(O2-) r(F-) r(Na+) r(Mg2+) r(Al3+)例如:第三周期离子半径大小比较:3、第三周期元素的金属性、非金属性的变化规律实验2: 实验完成后,用2 mL 1 mol·L-1的MgCl2溶液代替AlCl3溶液进行上述实验①钠、镁、铝置换出水(或酸)中的2时,由易到难的顺序为②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为结论:钠、镁、铝的金属性由强到弱的顺序为(2)Si、P、S、Cl非金属性强弱比较①硅、磷、硫、氯单质与氢气化合条件由易到难②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱结论:硅、磷、硫、氯元素非金属性由强到弱4.元素周期律:元素的随着的递增而呈变化的规律。
化学竞赛辅导课件-原子结构与元素周期系-1

OP 在 xoy 平面内的投影 OP′
与 x 轴的夹角 ( 0 — 2 )
P r o
根据 r,, 的定义,有 x = r sin cos y = r sin sin y
z = r cos
r2 = x2 + y2 + z2
x
P′
中学化学资料网:[]
eV
代入n值,得不同能级的能量,呈量子化递增。n为量子数
玻尔理论对氢光谱的解释
2k22mZ2e4 1 ( 2 1 2) ν= n1 n2 h3 1 ) s-1 1 ν = 3.2891015( 2 n1 n22
n2 = 3,4,5,…. 跃迁 n2 = 2,3,4,…. 跃迁 n1 = 2 n1 = 1 巴耳麦线系 赖曼线系
原子结构与元素周期系-1
1.1 核外电子的运动状态 1.2 核外电子的排布和元素周期律 1.3 元素基本性质的周期性
重点要求掌握四个量子数对核外电子运动状态的描
述熟悉s,p,d原子轨道和电子云的形状和伸展方向;掌握
周期系内各元素原子的核外电子层结构的特征,电子排 布规律
中学化学资料网:[]
1.1 核外电子的运动状态
1.1.1 氢原子光谱和玻尔理论 1.1.2 微观粒子的玻粒二象性
1.1.3 玻函数和原子轨道
1.1.4 几率分布和电子云 1.1.5 玻函数的空间图象 1.1.6 四个量子数
中学化学资料网:[]
1.1.1 氢原子光谱和玻尔理论
连续光谱 (自然界)
质波称为 de Broglie 波。
研究微观粒子的运动时,不能忽略其波动性 。 微观粒子具有波粒二象性。
中学化学资料网:[]
电子衍射实验示意图
用电子枪发射高速电子通过薄晶体片射击感光荧屏,得到明暗相间的环 纹,类似于光波的衍射环纹。
高一化学竞赛辅导 元素周期律

高一化学竞赛辅导元素周期律质子:带正电荷,决定元素种类,核电荷数,原子序数,相对原子质量。
中子:不带电,决定核素、同位素及相对原子质量。
电子:带负电荷,外围决定化学性质。
同位素说明:a.同一元素的各种同位素虽然质量数不同,但它们的化学性质几乎完全相同。
b. 同位素的不同原子(即核素)构成的单质(或化合物)是化学性质几乎相同而物理性质不同的不同种单质(或化合物)。
c. 天然存在的某种元素里,各种同位素所占的原子个数百分比一般是不变的。
d. 使用同一元素符号。
同位素是同种元素的不同种原子;同素异形体是同种元素构成的不同种单质。
e. 在周期表中处于同一位置。
同位素原子间质子数相同,中子数、质量数不同。
原子序数=核电荷数=质子数=核外电子数①原子半径主要是由核外电子层数和原子核对核外电子的作用等因素决定的。
②惰性气体原子半径的测量方法与其它原子半径的测定方法不同,所以惰性气体的原子半径与其他原子的原子半径没有可比性。
一般不比较惰性气体与其它原子半径的大小。
③粒子半径大小比较的一般规律:电子层数越多,半径越大,电子层数越少,半径越小;当电子层结构相同时,核电荷数多的半径小,核电荷数少的半径大;对于同种元素的各种粒子半径,核外电子数越多,半径越大;核外电子数越少,半径越小。
例如,半径H->H>H+;Fe3+<Fe2+。
①氧元素无最高正价,氟元素无正价,金属元素无负价,单质及稀有气体元素一般为零价。
②元素的最高正价=最外层电子数③只有非金属才有负价,且∣负价数值∣+∣正价数值∣=8。
1.金属性强弱判断:(1)与H2O(或酸)反应置换出氢的难易程度:金属越容易把水或酸中的H+置换成H2,则金属性越强;(2)金属最高价氧化物对应水化物的碱性强弱:金属的最高价氧化物的水化物碱性越强,则金属性越强。
2.非金属性强弱判断:(1)与H2生成气态氢化物的难易程度及氢化物的稳定性:非金属越容易与H2化合或与H2生成的气态氢化物越稳定,则非金属性越强。
2020高中化学竞赛辅导专题:原子结构与元素周期律讲义pdf

1887-1961 获1933年Nobel 物理奖
二阶偏微分方程
2Y
x 2
2Y
+ y 2
2Y+ z 2源自+8p 2m
h2
(E-V
)Y
=
0
式中:Y - 波函数(是 x,y,z 的函数); E - 电子的总能量; V - 电子的势能; m- 电子的质量。
2Y
x 2
因为
x •
h 2πm
h m
的数量级约为 10-4 m2•s-1,
这在微观世界是很大的数字。
对于质量较大的宏观物体, 不确定原理没有实际意义。
例如 子弹, m = 10 g,
h m
约为 10-32 m2•s-1
考察其 x 和 的大小
x / m
10-6 10-9 10-12
/ m•s-1 10-26 10-23 10-20
遵循不确定原理, 不能用牛顿力学去研 究,而应该去研究微观粒子(如电子) 运动的统计性规律。
要研究电子出现的空间区域,则要 去寻找一个函数,用该函数的图象与这 个空间区域建立联系。
── 微观粒子运动的波函数 ( )。
5.2 核外电子运动状态的描述
5.2.1 薛定谔方程
1926年,奥地利科学家 薛定谔建立了描述微观粒子 运动的波动方程。
将光子的能量 公式
E=h
与爱因斯坦的质能方程联立
E=mc2
得
c
mc2 =h = h
c
mc2 =h = h
若用 p 表示动量 mc ,则 p= h
左侧 p 表示粒子性,右侧 表示
波动性,二者通过公式联系起来 。
2020高考化学复习专题之物质结构和元素周期律

物质结构、元素周期律(一)原子结构1.原子(A Z X)中有质子(带正电):Z个,中子(不显电性):(A—Z)个,电子(带负电):Z个。
2.原子中各微粒间的关系:①A=N+Z(A:质量数,N:中子数,Z:质量数)②Z=核电荷数=核外电子数=原子序数③M Z ≈ M N≈1836 M eˉ(质量关系)3.原子中各微粒的作用(1)原子核几乎集中源自的全部质量,但其体积却占整个体积的千亿分之一。
其中质子、中子通过强烈的相互作用集合在一起,使原子核十分“坚固”,在化学反应时不会发生变化。
另外原子核中蕴含着巨大的能量——原子能(即核能)。
(2)质子带一个单位正电荷。
质量为1.6726×10-27kg,相对质量1.007。
质子数决定元素的种类。
(3)中子不带电荷。
质量为1.6748×10-27kg,相对质量1.008。
中子数决定同位素的种类。
(4)电子带1个单位负电荷。
质量很小,约为11836×1.6726×10-27kg。
与原子的化学性质密切相关,特别是最外层电数数及排布决定了原子的化学性质。
4.原子核外电子排布规律(1)能量最低原理:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即依次:K→L→M→N→O→P→Q顺序排列。
(2)各电子层最多容纳电子数为2n2个,即K层2个,L层8个,M层18个,N层32个等。
(3)最外层电子数不超过8个,次外层不超过18个,倒数第三层不超过32个【注意】以上三条规律是相互联系的,不能孤立理解其中某条。
如M层不是最外层时,其电子数最多为18个,当其是最外层时,其中的电子数最多为8个。
(二)元素周期律、元素周期表1.原子序数:人们按电荷数由小到大给元素编号,这种编号叫原子序数。
(原子序数=质子数=核电荷数)2.元素周期律:元素的性质随着原子序数的递增而呈周期性变化,这一规律叫做元素周期律。
具体内容如下:随着原子序数的递增,①原子核外电子层排布的周期性变化:最外层电子数从1→8个的周期性变化。
高中化学竞赛-元素周期表与元素周期律
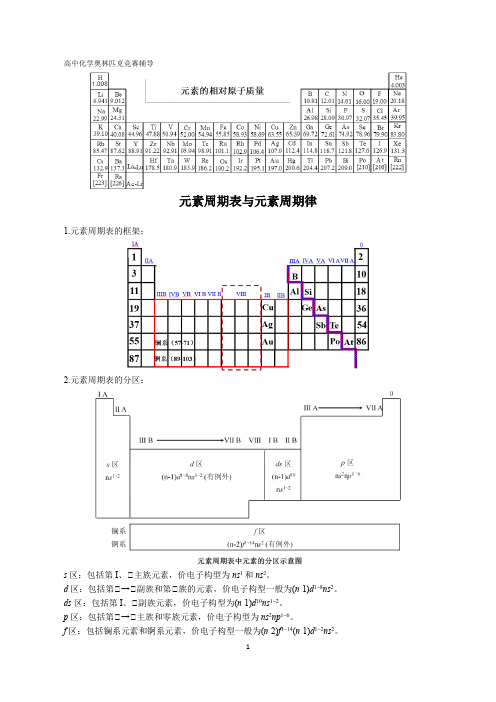
高中化学奥林匹克竞赛辅导元素周期表与元素周期律1.元素周期表的框架:2.元素周期表的分区:s区:包括第I、Ⅱ主族元素,价电子构型为ns1和ns2。
d区:包括第Ⅱ→Ⅱ副族和第Ⅱ族的元素,价电子构型一般为(n-1)d1~8ns2。
ds区:包括第I、Ⅱ副族元素,价电子构型为(n-1)d10ns1~2。
p区:包括第Ⅱ→Ⅱ主族和零族元素,价电子构型为ns2np1~6。
f区:包括镧系元素和锕系元素,价电子构型一般为(n-2)f1~14(n-1)d1~2ns2。
说明:(1)周期序数=原子的电子层数n。
第n周期含有元素的数目有以下规律:当n为偶数时,第n 周期含有元素的数目为(n+2)2/2;当n为奇数时,第n周期含有元素的数目为(n+1)2/2。
(2)主族元素的族序数=原子最外层电子数。
(3)对于d区元素,族序数=元素最高能级中的电子总数,如21Sc:[Ar]3d14s2是第Ⅱ B族,Mo:[Ar]3d64s2是第Ⅱ族。
26注意:如果元素最高能级组中的电子总数大于8,也属于第Ⅱ族,如Co、Ni等。
(4)对于ds区元素:族序数=原子最外层电子数,如29Cu:[Ar]3d104s1是第Ⅱ B族(5)d区和ds区元素均为副族元素,统称为过渡元素。
f区元素统称为内过渡元素。
3.元素周期律:原子半径、金属性、非金属性、电离能、电子亲合能、电负性。
4.原子半径:原子核的周围是电子云,它们是没有确定的边界的。
我们通常所说的原子半径是人为地规定的一种物理量。
原子半径可分为金属半径、共价半径、范德华半径三种。
共价半径是元素的两个原子以共价单键相连时,核间距离的一半。
稀有气体元素一般不能形成共价单键,所以用稀有气体分子晶体中两个原子距离的一半作为其半径,称为范德华半径。
范德华力不能像共价键一样将两个原子紧密结合,所以范德华半径大于共价半径,因此由于标准的不同,稀有气体的原子半径在同一周期的元素中半径是最大的。
金属单质的晶体中,相邻两金属原子核间距离的一半,称为该金属原子的金属半径。
高中化学竞赛 第一章 原子结构与元素周期系

1.2.1 电子运动的特性
德国科学家海森堡
2、测不准原理
1927年,德国科学家 海森堡提出测不准原理, 即对具有波粒二象性的微 粒,不可能同时准确测定 它们在某瞬间的位置和速 度(或动量)。
1.2 原子结构的量子力学模 型
二、电子的运动状态
1、薛定锷方程
薛定锷
2
x2
2
y 2
2
z 2
8 2m
1、波粒二象性
1905年,爱因斯坦用 光子理论成功地解释了光 电效应,提出光既有粒子 性,又有波动性,即光具 有波粒二象性。
大科学家爱因斯坦
1.2.1 电子运动的特性
1、波粒二象性
法国物理学家德布罗依
1924年,法国物理学 家德布罗依受到光具有波 粒二象性的启发,提出了 电子等实物粒子也具有波 粒二象性的假设。该假设 在1927年被电子衍射实验 所证实。
第一章 原子结构与元素周期 系
1.1 原子结构理论的发展概 况 1.2 原子结构的量子力学模 型 1.3 原子的电子层结构与元素周期 系 1.4 原子结构与元素性质的关系
1.1 原子结构理论的发展概
况
一、英国物理学家
汤姆森 (J.J.Thomson)
1884年担任著名的卡文 迪许实验室主任
1897年通过阴极射线实 验发现了电子
c. 代表层次:
n值 n 值代号
1 2 3 4 5… K L M N O…
d. 决定电子能量的高低:
n值越大,电子能量越高。
1.2.2 电子的运动状态
4、四个量子数
(2)角量子数(l)
a. 描述原子轨道的不同形状,表示电子层中各个不 同的电子亚层。
b. 取值范围:l 可取 0 ~ n-1之间的整数
高中化学竞赛辅导资料

高中化学竞赛辅导资料化学竞赛辅导资料(全初)赛专辑)国第一节原子结构与化学键一、原子核外电子的排列现代原子结构理论认为,电子在原子核外高速运动,而且没有一定的轨道,所以,电子在核外运动时就像一团带负电荷的云雾笼罩着带正电荷的原子核,因此,通常把核外电子的运动比喻为电子云。
原子结构理论进一步指出,核外电子是在不同层上运动,这些层叫做电子层;电子层又分为若干亚层;亚层还有不同的轨道;而在每个轨道中运动的电子还有两种不同的自旋。
电子层、亚层、轨道、自旋四个方面决定了一个核外电子的运动状态。
不同元素的原子核外有不同数量的电子。
这些电子是如何在原子核外的不同电子层、子层和轨道中排列的?原子结构理论指出,电子在原子核外的排列遵循三个定律,即泡利不相容原理、最小能量原理和亨特定律,可以写出不同元素的电子排列公式。
以上是对核外电子运动和排布的概括叙述。
这一部分内容还应着重了解以下几点:1.关于电子云的含义电子云是一个生动的隐喻,它用宏观现象来想象微观世界的场景。
电风扇通常只有三片叶片,但当它高速旋转时,它会看到一片云,就像树叶变成云一样;电子在原子核外运动的速度非常快,而且没有确定的轨道。
因此,可以想象,电子的运动“变成”一团云,一团带负电荷的云。
因此,电子云不是一个实体云,不能被理解为由无数电子组成的云。
需要指出的是,氢原子核外只有一个电子,这仍然可以用电子云来描述。
电子云常用由许多小黑点组成的图形表示。
小黑点密集的地方表示在该处的单位体积内,电子出现机会较多(或称为几率密度较大)。
电子云图中单独一个小黑点没有任何意义。
2.关于电子层、亚层、轨道的意义① 电子层——它有两种含义:一方面,它意味着电子和原子核之间的平均距离不同,另一方面,它意味着电子能量不同。
k、 l、m、n、o、p??电子到原子核的平均距离依次增加,电子的能量依次增加。
② 子层还意味着两种含义:一方面,它意味着电子云的形状不同。
S电子云是以原子核为中心的球形电子云,P电子云是以原子核为中心的固定哑铃形电子云,D和f电子云的形状更复杂;另一方面,这意味着S、P、D和F的电子能量依次增加。
2020届高考化学必背知识 物质结构 元素周期律

模块三 物质结构 元素周期律一、原子结构1.原子结构模型的演变2.原子的构成 (1)原子的构成原子(A Z X)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(Z )一个质子带一个单位正电荷中子(N )不带电核外电子一个电子带一个单位负电荷(2)原子中两个数量关系①核电荷数=质子数(Z )=核外电子数=原子序数 ②质量数(A )=质子数(Z )+中子数(N ) (3)构成原子的粒子及粒子间的关系二、元素、同位素、核素的比较三、四种“量”的比较四、原子核外电子的排布1.电子层的表示方法及能量变化2.原子核外电子排布规律3.原子核外电子排布的表示方法——原子或离子结构示意图(1~18号元素原子结构)如(1)Na的原子结构示意图:(2)Na+的离子结构示意图:五、元素金属性、非金属性强弱比较【温馨提醒】⑴比较物质非金属性强弱时,应是最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。
⑵所含元素种类最多的族是ⅢB族,形成化合物种类最多的元素在第ⅣA族。
⑶化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。
⑷并非所有非金属元素的氢化物分子间都存在氢键,常见的只有非金属性较强的元素如N、O、F的氢化物分子间可形成氢键。
⑸金属性是指金属气态原子失电子能力的性质,金属活动性是指在水溶液中,金属原子失去电子能力的性质,二者顺序基本一致,仅极少数例外。
如金属性Pb>Sn,而金属活动性Sn>Pb。
⑹利用原电池原理比较元素金属性时,不要忽视介质对电极反应的影响。
如Al—Mg—NaOH溶液构成原电池时,Al为负极,Mg为正极;Fe—Cu—HNO3(浓)构成原电池时,Cu为负极,Fe为正极。
六、元素周期表1.元素周期表的结构(1)周期(2)族①主族:由短周期元素和长周期元素共同组成的族(第18列除外)②副族:仅由长周期元素组成的族(第8、9、10列除外)③Ⅷ族:包括8、9、10三个纵列。
高中化学竞赛《原子结构和元素周期律》

量子 数
物理意义
取值范围
主量子数n
角量子数l
磁量子数m
自旋量子数 ms
描述电子离核远近及 能量高低
描述原子轨道的形状 及能量的高低
描述原子轨道在空间 的伸展方向
描述电子的自旋方向
n=1,2,3, …正整数
l=0,1,2,… 小 于 n 的 正 整数 m=0,+1,-1, +2, -2
, …±l ms =+1/2,-1/2
4
0,+1,-1,+2,-2,+3,-3,+4, -4
轨道符号
1s 2s 2p 3s 3p 3d 4s
4p
4d
轨道数 1 1 3 1 3 5 1
3
5
4f
7
5s
1
5p
3
5d
5
5f
7
5g
9
多电子原子近似能级图的特点:
• 近似能级图是按原子轨道的能量高低而不是按原子轨道 离核的远近顺序排列起来。把能量相近的能级划为一组, 称为能级
能量最低原理
多电子原子在基态时,核外电子总 是尽可能分布到能量最低的轨道,这称 为能量最低原理。
堡里不相容原理
一个电子的四个量子数为(3、2、0、-1/2) 另一个电子的四个量子数为(3、2、0、+1/2)
从保里原理可获得以下几个重要结论: a)每一种运动状态的电子只能有一个。 b)由于每一个原子轨道包括两种运动状态,所以每一个
二、 测不准原理和几率概念
• 测不准原理:
一个粒子的位置和动量不能同时地、准确地 测定。 注意:这里所讨论的不确定性并不涉及所用的测 量 仪器的不完整性,它们是内在固有的不可 测定性。
高中化学竞赛《物质结构》讲义

物质结构---第一部分原子结构元素周期系1.原子结构核外电子的运动状态: 用s、p、d等表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能、电子亲合能、电负性。
2.元素周期律与元素周期系周期。
1~18族。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。
原子半径和离子半径。
s、p、d、ds、f区元素的基本化学性质和一原子的电子构型。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高氧化态与族序数的关系。
对角线规则。
金属与非金属在周期表中的位置。
半金属(类金属)。
主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及其主要形体。
铂系元素的概念。
第一节核外电子的运动一、原子核外电子的运动状态(一)核外电子的运动特点:;;。
(二)核外电子的运动表示电子云是描述电子在核外空间运动的一种图象,它从统计的概念出发对核外电子出现的几率密度作形象化的图示。
二、原于核外电子的排布(一)多电子原子的电子排布---1.依据:、。
2.图示(二)核外电子排布的原理1.能量最低原理:2.保里不相容原理:3.洪特(Hund)规则:电子将尽可能多分占不同的简并轨道,且自旋平行。
及Hund特例:简并轨道全充满,半充满,全空,能量相对较低,较稳定。
[例外] Nb、Ru、Rh、W、Pt(三)能级顺序——近似能级图1. 能级交错现象;2. 能级组:能量相近的能级划分为一组;3. 徐光宪先生 n+0.7规则:4. 近似能级图——电子填充顺序(四)核外电子排布的表示方法:有关概念:基态、激发态;原子、离子;“原子实”——希有气体结构;“价电子构型”1.轨道表示式:2.电子排布式:4.原子结构和元素在周期表中位置的关系。
①元素的周期数原子最外层的n数值即为该元素的所在周期数。
一个能级组相当于一个周期,周期有长短之分。
短周期(能级组内仅含有s、p能级)。
2020高中化学竞赛知识点总结

2020高中化学竞赛知识点总结一、原子结构与元素周期律1. 原子的组成:质子、中子、电子。
2. 原子核外电子排布:遵循奥布谬原理,电子云的分层和电子排布的规律。
3. 元素周期表:周期、族(主族和过渡族)、区块(s、p、d、f区)。
4. 元素周期律:原子半径、电负性、电离能、亲氧性等性质的周期性变化。
5. 同位素、同素异形体。
二、化学键与分子结构1. 化学键的类型:离子键、共价键(单键、双键、三键)、金属键。
2. 键参数:键长、键角、键能。
3. 分子的几何形状:VSEPR理论,分子的极性和非极性。
4. 分子轨道理论基础:分子轨道的形成、键合与反键合分子轨道。
5. 氢键及其他分子间作用力。
三、化学反应原理1. 化学反应的类型:合成反应、分解反应、置换反应、还原-氧化反应等。
2. 化学反应速率:速率方程、反应级数、催化剂。
3. 化学平衡:平衡常数、Le Chatelier原理、多重平衡系统。
4. 酸碱理论:Arrhenius理论、Bronsted-Lowry理论、pH计算。
5. 沉淀-溶解平衡:溶度积(Ksp)和溶解度的关系。
四、溶液与电解质1. 溶液的分类:饱和溶液、不饱和溶液、过饱和溶液。
2. 溶度积与溶解度的关系。
3. 电解质的分类:强电解质、弱电解质、非电解质。
4. 电导率:电解质溶液的导电性、电导率的测定。
5. 胶体与界面现象:胶体的性质、乳化作用、吸附。
五、氧化还原反应1. 氧化还原反应的特征:氧化数的变化、电子的转移。
2. 氧化剂与还原剂的识别。
3. 氧化还原反应的平衡:电势(Eh)、标准电极电势。
4. 电化学电池:伏打电堆、电解质电池、燃料电池。
5. 电化学系列:金属的活性顺序、电化学腐蚀。
六、热化学与能量变化1. 热化学方程式:焓变、反应热。
2. 热化学定律:能量守恒、熵变、Gibbs自由能。
3. 反应热的测量:量热法。
4. 化学能与物理能的转换:燃烧热、能量的储存与释放。
5. 相变热:熔化热、蒸发热、离子化能。
高一化学竞赛辅导【物质结构 元素周期律】课件

例 X、Y、Z和R分别代表四种元素,如果
aXm+、bYn+、cZn-、dRm-四种离子的电子层结 构相同,则下列关系正确的是
A.a-c=m-n
D B.a-b=n-m
C.c-d=m+n
D.b-d=n+m
2。元素、核素、同位素
(1)元素:具有相同核电荷数(质子数)的同一类原子叫做元素。 (2)核素与同位素:
原子结构示意图
原子核
第3层 第2层 第1层
原子核带正电
质子数
+ 15 2 8 5
K层 L层 M层
判断下列示意图是否正确?为什么?
A、+19 2 8 9
B、 +12 2 10
C、 +3 1 2
D、 +54 2 8 18 20 6
课堂练习
1.年新发现114号元素的同位素,其中子数为184,该同位素的质量
①核素:具有一定数目的质子和一定数目的中子的一种原 子叫核素。
②同位素:同一元素的不同核素之间互称为同位素。
元素、核素、同位素的比较
(1)两同:同质子、同元素;两不同:不同中子、不同原子。
(2)同种元素,可以有若干种不同的核素。
(3)核电荷数相同的不同核素,虽然它 们的中子数不同,但是属于同一种元素。
电子层(n)1、 2、 3、 4、 5、 6、 7、
代号是 K L M N O P Q
电子能量
由 低 到高
离核距离
由 近 到远
例题: 2004年高考全国A卷 6分
7. 下列离子中,所带电荷数和核外电子层数相等的是 A . Al3+ B . Mg 2+ C . Be2+ D . H+
高一化学竞赛辅导 元素周期律

高一化学竞赛辅导元素周期律质子:带正电荷,决定元素种类,核电荷数,原子序数,相对原子质量。
中子:不带电,决定核素、同位素及相对原子质量。
电子:带负电荷,外围决定化学性质。
同位素说明:a.同一元素的各种同位素虽然质量数不同,但它们的化学性质几乎完全相同。
b. 同位素的不同原子(即核素)构成的单质(或化合物)是化学性质几乎相同而物理性质不同的不同种单质(或化合物)。
c. 天然存在的某种元素里,各种同位素所占的原子个数百分比一般是不变的。
d. 使用同一元素符号。
同位素是同种元素的不同种原子;同素异形体是同种元素构成的不同种单质。
e. 在周期表中处于同一位置。
同位素原子间质子数相同,中子数、质量数不同。
原子序数=核电荷数=质子数=核外电子数①原子半径主要是由核外电子层数和原子核对核外电子的作用等因素决定的。
②惰性气体原子半径的测量方法与其它原子半径的测定方法不同,所以惰性气体的原子半径与其他原子的原子半径没有可比性。
一般不比较惰性气体与其它原子半径的大小。
③粒子半径大小比较的一般规律:电子层数越多,半径越大,电子层数越少,半径越小;当电子层结构相同时,核电荷数多的半径小,核电荷数少的半径大;对于同种元素的各种粒子半径,核外电子数越多,半径越大;核外电子数越少,半径越小。
例如,半径H->H>H+;Fe3+<Fe2+。
①氧元素无最高正价,氟元素无正价,金属元素无负价,单质及稀有气体元素一般为零价。
②元素的最高正价=最外层电子数③只有非金属才有负价,且∣负价数值∣+∣正价数值∣=8。
1.金属性强弱判断:(1)与H2O(或酸)反应置换出氢的难易程度:金属越容易把水或酸中的H+置换成H2,则金属性越强;(2)金属最高价氧化物对应水化物的碱性强弱:金属的最高价氧化物的水化物碱性越强,则金属性越强。
2.非金属性强弱判断:(1)与H2生成气态氢化物的难易程度及氢化物的稳定性:非金属越容易与H2化合或与H2生成的气态氢化物越稳定,则非金属性越强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高中化学竞赛辅导(一)原子结构元素周期律原子结构元素周期系一.〔4分〕某元素的离子R2+有5个电子层,最外层有2个电子,R(NO3)2是它的一种常见盐。
R的元素符号是,R元素在周期表中的位置是,配制澄清R(NO3)2溶液的方法是。
二.〔2分〕23592U原子吸取一个慢中子后,分裂成13654Xe和9038Sr,写出核反应方程式。
三.〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。
例如:S、Cr规定为ⅥA族;Se规定为ⅥB族。
1.写出S、Cr、Se最高价阳离子的电子构型;2.周期数和每周期元素个数是否发生变化;3.新旧周期表中哪些族的元素是统一的〔即完全相同〕4.不同的新的主、副族元素在原周期表的基础上做如何样的变动?四.美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。
他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙-48离子加速,用来轰击人造元素锎〔Cf〕-249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。
118号元素原子存在时刻仅为0.9毫秒。
研究人员观看到了118号元素原子的〝衰变链〞过程,证实了新元素的存在。
其衰变过程中依次开释出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。
1.指出118号元素在周期表中的位置;2.写出合成118号元素的核反应方程式;3.指出衰变过程中112号元素模样的质量数。
五.〔4分〕2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X和Y。
X是用高能48Ca撞击24393Am靶得到的。
通过100微秒,X发生α-衰变,得到Y。
然后Y连续发生4次α-衰变,转变为质量数为268的第105号元素Db的同位素。
以X和Y的原子序数为新元素的代号〔左上角标注该核素的质量数〕,写出上述合成新元素X和Y的核反应方程式。
六.〔5分〕X的单质是一种软的、白色的、较爽朗的金属;该元素的克拉克值低、分布分散、绝大部分伴生在有色金属、煤和铁矿中;X元素的世界储量不大,而我国的资源储量居世界前茅。
其化合物XP、XAs y P1-y是人们熟悉的半导体材料。
X在高价化合物中比在其低价化合物中稳固。
目前,具有层状结构的专门性能物质〔该金属的非整比化合物〕Cd0.5Ga2XS5和Hg0.8Ga1.6X1.2S5正在深入研究。
1.写出X的元素符号和名称;2.指出X的价电子构型和周期表中的位置;3.X还可用于制造哪一类型的合金。
七.〔10分〕光合作用是绿色植物和其他自养型生物利用光能由简单化合物合成高能复杂分子的过程。
光合作用中叶绿素分子与专门的酶分子受体〔MS〕相结合,发生一系列氧化还原反应。
科学家们发觉光合作用还存在许多变化形式,如有些细菌可用H2S代替H2O进行光合作用生成结构与性质完全相似的产物。
我国科学家早在1946年就发觉铀吸取中子后可发生核裂变分裂成较小的碎片。
如以一个漫中子轰击23592U发生核裂变时,能产生两种核素72X、16062Sm和假设干快中子。
快中子再与核素72X反应可生成6928Ni,继而生成以上MS中金属M的一种核素。
M是应用最广泛的金属之一,在高温高压下与CO作用生成淡黄色液体A〔A在高温下可分解为M和CO〕。
含有M的一种深红色化合物晶体B具有顺磁性,在碱性溶液中已能把Cr〔Ⅲ〕氧化为CrO42-,而本身被还原成黄色的C晶体。
溶液中C可被氯气氧化成B。
A连续与CO作用可形成满足18电子规那么的金属有机化合物D。
1.写出M的元素符号;2.写出上述所有核化学反应方程式;3.写出B与C互相转化的离子方程式;4.写出H2S代替H2O进行光合作用的要紧产物。
5.画出D的一种合理结构式,并指出有几种不同的成键方式。
八.〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。
例如:S、Cr规定为ⅥA族;Se规定为ⅥB族。
1.写出S、Cr、Se最高价阳离子的电子构型;2.周期数和每周期元素个数是否发生变化;3.新旧周期表中哪些族的元素是统一的〔即完全相同〕4.不同的新的主、副族元素在原周期表的基础上做如何样的变动?2018届高中化学竞赛专题辅导〔一〕原子结构元素周期系答案一〔4分〕某元素的离子R2+有5个电子层,最外层有2个电子,R(NO3)2是它的一种常见盐。
R 的元素符号是,R元素在周期表中的位置是,配制澄清R(NO3)2溶液的方法是。
答案:〔4分〕Sn〔1分〕第五周期ⅣA族〔1分〕将Sn(NO3)2溶于少量稀HNO3,并加入Sn粒防氧化〔2分〕二〔2分〕235 92U原子吸取一个慢中子后,分裂成13654Xe和9038Sr,写出核反应方程式。
三〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。
例如:S、Cr 规定为ⅥA族;Se规定为ⅥB族。
1.写出S、Cr、Se最高价阳离子的电子构型;2.周期数和每周期元素个数是否发生变化;3.新旧周期表中哪些族的元素是统一的〔即完全相同〕4.不同的新的主、副族元素在原周期表的基础上做如何样的变动?答案:1.S6+:1s22s22p6;Cr6+:[Ne]3s23p6;Se6+:[Ne]3s23p63d10。
〔0.5分〕2.不变〔1分〕3.ⅠA,ⅡA,ⅠB,ⅡB族是统一的,即ⅢA~ⅦA族为不完全相同的族,ⅢB~VIIIB 族为完全不同的族。
〔2分〕4.其变化情形如下:原周期表中第四、五、六周期的ⅢA~VIIIA族元素,依次为新周期表中ⅢB~ⅦB族元素,原周期表中第一、二、三周期的ⅢA~ⅦA族元素,依次和ⅢB~ⅦB族元素合并成为新周期表中的ⅢA~ⅦA族元素。
〔2.5分〕四〔4分〕美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。
他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙-48离子加速,用来轰击人造元素锎〔Cf〕-249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。
118号元素原子存在时刻仅为0.9毫秒。
研究人员观看到了118号元素原子的〝衰变链〞过程,证实了新元素的存在。
其衰变过程中依次开释出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。
1.指出118号元素在周期表中的位置;2.写出合成118号元素的核反应方程式;3.指出衰变过程中112号元素模样的质量数。
答案:1.第七周期0族稀有气体元素〔1分〕2.48Ca+249Cf→297118〔1.5分〕3.285〔1.5分〕五〔4分〕2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。
X 是用高能48Ca 撞击24393Am 靶得到的。
通过100微秒,X 发生α-衰变,得到Y 。
然后Y 连续发生4次α-衰变,转变为质量数为268的第105号元素Db 的同位素。
以X 和Y 的原子序数为新元素的代号〔左上角标注该核素的质量数〕,写出上述合成新元素X 和Y 的核反应方程式。
答案:Am 24395+4820Ca =288115+3n 〔2分,不写3n 不得分。
答291115不得分。
〕288115=284113+4He 〔2分,质量数错误不得分。
4He 也可用符号α。
〔答下式不计分:284113-44He =268105或268105Db 〕六〔5分〕X 的单质是一种软的、白色的、较爽朗的金属;该元素的克拉克值低、分布分散、绝大部分伴生在有色金属、煤和铁矿中;X 元素的世界储量不大,而我国的资源储量居世界前茅。
其化合物XP 、XAs y P 1-y 是人们熟悉的半导体材料。
X 在高价化合物中比在其低价化合物中稳固。
目前,具有层状结构的专门性能物质〔该金属的非整比化合物〕Cd 0.5Ga 2XS 5和Hg 0.8Ga 1.6X 1.2S 5正在深入研究。
1.写出X 的元素符号和名称;2.指出X 的价电子构型和周期表中的位置;3.X 还可用于制造哪一类型的合金。
答案:〔5分〕1.In 铟〔各1分〕2.5s 25p 1 第五周期ⅢA 族〔各1分〕3.低熔合金〔1分〕七〔10分〕光合作用是绿色植物和其他自养型生物利用光能由简单化合物合成高能复杂分子的过程。
光合作用中叶绿素分子与专门的酶分子受体〔MS 〕相结合,发生一系列氧化还原反应。
科学家们发觉光合作用还存在许多变化形式,如有些细菌可用H 2S 代替H 2O 进行光合作用生成结构与性质完全相似的产物。
我国科学家早在1946年就发觉铀吸取中子后可发生核裂变分裂成较小的碎片。
如以一个漫中子轰击23592U 发生核裂变时,能产生两种核素72X 、16062Sm 和假设干快中子。
快中子再与核素72X 反应可生成6928Ni ,继而生成以上MS 中金属M 的一种核素。
M 是应用最广泛的金属之一,在高温高压下与CO 作用生成淡黄色液体A 〔A 在高温下可分解为M 和CO 〕。
含有M 的一种深红色化合物晶体B 具有顺磁性,在碱性溶液中已能把Cr 〔Ⅲ〕氧化为CrO 42-,而本身被还原成黄色的C 晶体。
溶液中C 可被氯气氧化成B 。
A 连续与CO 作用可形成满足18电子规那么的金属有机化合物D 。
1.写出M 的元素符号;2.写出上述所有核化学反应方程式;3.写出B 与C 互相转化的离子方程式;4.写出H 2S 代替H 2O 进行光合作用的要紧产物。
5.画出D 的一种合理结构式,并指出有几种不同的成键方式。
答案:〔10分〕1.Fe 〔1分〕2.23592U +10n →7230Zn +16062Sm +410n 7230Zn +10n →6928Ni +42He 6928Ni +10n →6626Ni +42He 3.3Fe(CN)63-+Cr(OH)3+5OH -=3Fe(CN)64-+CrO 42-+4H 2O 〔各1分〕2Fe(CN)64-+Cl 2=2Fe(CN)63-+2Cl -〔各1分〕4.碳水化合物〔或葡萄糖〕、硫〔1.5分〕5.〔2分〕4种〔0.5分〕八〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。
例如:S、Cr 规定为ⅥA族;Se规定为ⅥB族。
1.写出S、Cr、Se最高价阳离子的电子构型;2.周期数和每周期元素个数是否发生变化;3.新旧周期表中哪些族的元素是统一的〔即完全相同〕4.不同的新的主、副族元素在原周期表的基础上做如何样的变动?。
