麦克斯韦速率分布律
高二物理竞赛麦克斯韦速率分布律课件9

利用麦克斯韦速率分布函数 f (v),可以导出反映分子热运动状态具有代表性的三种速率的统计平均值。
v ( v ) N v dN N v f (v)dv 比的值氮K气越。小表明引力势能越小,分子较容易逃脱2地球引力N场空间2,扩散到太空中去,2于是经过几十亿年演变,2地球大气层就保留了含有大气质量约 23%的氧气和约占大气质量 76%
T = 273K
vpTh < vpAg < vpCu < vpAl
vp 称为最概然速率 。
解:已知氧气和氢气的摩尔质量分别为:
他在概率论基础上导出了分子速度的按分布以规律上。数据可分别计算出氧气和氢气的方均根速率为:
由于曲线下的面积恒等于1,所以温度升高时曲线变得平坦些,并向高速区扩展。
v rms,O2
3RT M O2
38.31 273 32.0 103
0.461103 m/s
v rms,H2
3RT
M H2
38.31 273 2.0 103
1.845103 m/s
说明:计算表明,在 0°C 时,O2 和 H2 分子的方均根 速率比同温度下空气中声音传播速度(332m/s)还要大。 应该注意,不论对哪一种气体来说,并不是全部分子都 是以它的方均根速率在运动,实际上,气体分子各以不 同的速率在运动,有的比方均根速率大,有的比它小, 而方均根速率只不过是速率的某一统计平均值而已。对 平均速率和最概然速率也应作相仿的理解。
M 2.0 10 kg/mol 但就大量分子整体来看而言,分子热运动速度和速率是否具有一定规律呢?1859年,麦克斯韦给出了肯定的答案,他指出对大量气体3分子整体,在一定温度的平衡态下,它们的速
麦克斯韦速度分布律

1 2
m(v
2 x
v
2 y
vz2 )
动能,分子速度的函数。
k
dN (vx ,vy ,vz ) e kT dvxdvydvz
速度分布函数:F (v x
,vy
,vz
)
dN (vx ,vy ,vz ) Ndvxdv ydvz
C
k
e kT
常数 C 由归一化条件确定:
v3e
mv2 2kT
dv
0
4π
m 2π kT
3
2
2(m
1 2kT )2
8kT πm
8RT
π
速度平方的平均值 :
v2
0
v2
fM (v)dv
4π
m 2π kT
3
2
v
4e
mv 2 2kT
dv
0
4π
m 2π kT
3
积内的概率 分子在速度空间分布的概率密度
归一化条件 :
F (vx ,vy ,vz )dvxdvydvz 1
分子速度 vx、vy、vz 一定出现在 之间
证明:
F(vx ,vy ,vz )dvxdvydvz
dN (vx ,vy ,vz ) N 1
,vy
,vz
)
平衡态系统中分子的速率分布函数:
fM
(v)
4π
m 2π kT
3
2
v2e
mv2 2kT
大学物理麦克斯韦分子速率分布定律资料

11
例: 设有N个气体分子,其速率分布函数为
f
(
)
A
(0 0
)
0 0 0
求: (1)常数A;(2)最概然速率,平均速率和方均根;
(3)速率介于0~0/3之间的分子数;(4)速率介于0~ 0/3
之间的气体分子的平均速率。
f()
解: (1)气体分子的分布曲线如图
2 1300
N
dN
0
3 Nf ( )d
0
0 3
0
N
6
3 0
(0
)d
7N 27
13
(4)速率介于0~0/3之间的气体分子平均速率为
0~0 3
0
3 dN
0 0
0 3
0
N
6 v03
2
(
0
)d
30
7N 27
14
3 dN 0
注意:速率介于 1~ 2之间的气体分子的平均速率
的计算是
2f ( )d
1~2
1
2 f ( )d
1
而非
1 ~2
2f ( )d
1
14
作业题
设. 有N个粒子,其速率分布函数 f v 为
f
v
Av 30 v
0
v 30 v 30
求: (1)归一化常数A的值;(2)最概然速率
(3)N个粒子的平均速率 v
15
§3.4 麦克斯韦分子速率分布定律
任何一个分子,速度大小和方向都是偶然的, 不可预知。但在平衡态下,大量气体分子的速度分布 将具有稳定的规律 — 麦克斯韦速度分布律。
只考虑速度大小的分布—麦克斯韦速率分布律。
麦克斯韦速率分布律的物理意义

麦克斯韦速率分布律的物理意义
麦克斯韦速率分布律是概率论中的一个重要定律,它描述了随机变量的分布。
对于任意一个随机变量 X,它的分布律可以用麦克斯韦速率分布律来描述。
麦克斯韦速率分布律的物理意义可以从以下几个方面来理解:
1. 描述随机变量的分布:麦克斯韦速率分布律描述了随机变量 X 的取值在一个区间内出现的概率密度。
例如,如果随机变量 X 的取值为 [a, b],那么它在 [a, b] 区间内出现的概率密度就是 f(x) = dx/(b-a),其中 dx 是 X 取值[a, b] 区间内的微小区间。
2. 解释随机现象:麦克斯韦速率分布律可以用来解释随机现象。
例如,如果我们掷一枚硬币,硬币正面朝上的概率是 0.5,那么硬币正面朝上的概率密度就是 f(x) = 0.5 * dx/(1-0.5)。
我们可以用 f(x) 来描述硬币正面朝上的取值范围,从而解释掷硬币正面朝上的概率分布。
3. 计算随机变量的概率:麦克斯韦速率分布律可以用来计算随机变量的概率。
例如,如果我们想要计算随机变量 X 的取值 [a, b] 区间内的概率,我们可以用 f(x) = dx/(b-a) 来计算 X 在 [a, b] 区间内出现的概率。
麦克斯韦速率分布律是概率论中的一个重要定律,它可以用来描述随机变量的分布,解释随机现象,计算随机变量的概率。
它对于理解随机过程、随机变量的分布等方面都有重要的作用。
大学物理05_5麦克斯韦速率分布律
气体分子速率可以取从0到∞之间
的一切数值。速率很大和速率很
小的分子数所占的比率都很小,
f(0)=f(∞)=0 , 而 具 有 中 等 速 率 的
分子数所占的比率却很大。
上页 下页 返回 退出
例题5-5 从速率分布函数推算分子的三个统计速率
(1)算术平均速率
v
vf (v)dv
v4π(
m
)
3
2
O
v exp
mv2 2kT
共同作用的结果。
上页 下页 返回 退出
麦克斯韦(James Clerk Maxwell 1831—1879)
•他提出了有旋电场和位移电流概念,建 立了经典电磁理论(麦克斯韦方程组), 预言了以光速传播的电磁波的存在。
•1873年,他的《电磁学通论》问世,这 是一本划时代巨著,它与牛顿的《自然哲 学的数学原理》并驾齐驱,它是人类探索 19世纪伟大的英国 电磁规律的一个里程碑。 物理学家、数学家。 经典电磁理论的奠 •在气体动理论方面,他还提出气体分子 基人,气体动理论 按速率(速度)分布的统计规律。 的创始人之一。
当 v 0时,v dv ;N dN; 2. 速率分布函数 f(v) 的定义 f(v)
f (v) lim N dN v0 vN Ndv
注意:
在平衡态下,f(v)仅是v的函数。 O
v v+Δv
v
上页 下页 返回 退出
3. 速率分布函数 f(v) 的意义:概率密度函数
※分布在速率 v 附近单位速率间隔内的分子数占总 分子数的百分比(比率);
m不变,T vp
2kT m
曲线的峰值右移,由于曲线下 面积为1不变,所以峰值降低。O
T2 T1
推导麦克斯韦速度分布律、速率分布律的简单方法

推导麦克斯韦速度分布律、速率分布律的简单方法麦克斯韦速度分布律是量子力学中重要的一部分。
1860年,麦克斯韦发现在粒子系统中,粒子运动的速度都遵循一定的分布关系,即概率密度函数与速度成反比,这就是麦克斯韦速度分布律。
那么,如何推导出麦克斯韦速度分布律和速率分布律?
首先,考虑一个温度为T的系统,采用能量有限的情况下可以把粒子的运动视为马尔可夫链的形式。
由于能量有限,可以认为处在同一状态的粒子的总体数量就构成了该状态的热平衡状态。
由此可推出粒子的速度分布概率:
P(v) = e^(-mv^2/2kT)
其中,m为粒子的质量,T为温度,k为Boltzmann常数。
将此式作为粒子的速度分布函数,即可推出其速率分布函数。
即:
f(v) = e^(-mv^2/2kT) * Usqrt(m/2πkT)
此式也叫麦克斯韦分布,概率密度与粒子速率成反比,即概率密度随着粒子速率的增加而减少。
通过此式,可以推导出麦克斯韦速度分布律和速率分布律。
以上便是推导麦克斯韦速度分布律以及速率分布律的简单方法。
虽然在实际应用中,还有许多根据环境情况改变相关参数的变体,但基础思想是一致的:概率密度随着粒子运动速度的增加而减少。
麦克斯韦速率分布定律

(4) 平均速率和方均根速率.
f ( )
解:(1)求 C :
C (0 ) (0 0 ) 0 ( 0 )
0
f ( )d 1 C
6
3 0
(2) N 0 ~ 0 / 4 N
0 / 4
0
5 f ( ) d N 32
0 df ( ) (3)最可几速率 0 p d p 2
6.5 麦克斯韦速率分布定律
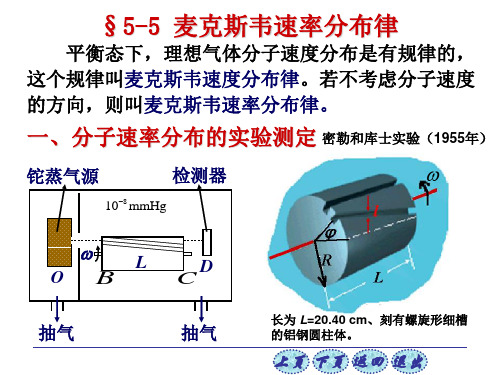
气体中个别分子的速度大小和方向完全是偶然的 , 但 平衡态下,气体分子的速度分布遵从一定的统计规律 — — 麦克斯韦速度分布定律. 若不考虑分子速度的方向, 这个规律就成为麦克斯韦速率分布定律.
1859年, 麦克斯韦用概率论导出了气体分子速率分布 定律,后由玻尔兹曼使用经典统计力学理论导出. 1920年史特恩用分子束实验, 获得分子有着确定的速 度分布的信息, 但未能给出定量的结果. 1934年我国留学 生葛正权在伯克利首次获得此定律的精确实验验证. 此 成功经报界报道, 当时闻名欧美, 在很大程度上改变了外 国人眼中“中国留学生只会读书不能动手, 我们不欢迎” 的形象, 对当时欧美中国留学生有极大的影响和鼓舞.
f (v )
av , (0 v v 0 ) 0 , (v v 0 )
2
f (v )
v0 v 求: (1)常量 a 和υ0 的关系 0 (2)平均速率 v v0 (3)速率在 0 之间分子的平均速率 v 2
解: (1)由归一化条件
0
2 0
0
f ( )d 1
3 得 a 3 v0
f ( v)
T1 300K T2 1200K
f ( v)
麦克斯韦速度分布律公式

麦克斯韦速度分布律公式麦克斯韦速度分布律麦克斯韦速度分布律是统计物理学中描述理想气体速度分布的重要定律之一。
它描述了在给定温度下,气体分子速度的分布情况。
以下是与麦克斯韦速度分布律相关的公式和解释说明:麦克斯韦速度分布律公式1.麦克斯韦速度分布函数:f(v) = (m / (2 * π * k * T) )^(3/2) * 4 * π * v^2 * exp(-m*v^2 / (2 * k * T))其中,f(v)是速度的概率密度函数,m是分子的质量,k是玻尔兹曼常数,T是气体的温度,v是速度。
2.平均速度:<v> = ∫(v * f(v)) dv计算麦克斯韦速度分布函数与速度的乘积的积分,求得平均速度。
3.均方根速度:vrms = √(3 * k * T / m)均方根速度描述了气体中分子速度的大小,它是所有分子速度平方的平均值的平方根。
麦克斯韦速度分布律解释以下是对麦克斯韦速度分布律公式的解释说明和例子:1.麦克斯韦速度分布函数公式解释:麦克斯韦速度分布函数表示了在给定温度下,速度在不同取值上的概率密度。
函数中的指数项含有一个负号,指数的绝对值大小与速度的平方成正比,即速度越大,对应的指数项越小,概率越小。
这符合物质中分子速度的分布趋势,常见的速度大都集中在某个范围内。
2.平均速度解释:平均速度表示在给定温度下,所有可能速度的加权平均值。
将速度与麦克斯韦速度分布函数相乘后积分,可以得到平均速度。
这意味着在一个气体体系中,速度的概率分布决定了平均速度的大小。
3.均方根速度解释:均方根速度是速度分布的一种描述方式,它描述了速度的大小和分散程度。
均方根速度是气体中所有分子速度平方的平均值的平方根。
根据麦克斯韦速度分布律,均方根速度与温度呈正比,与分子质量的平方根成反比。
总结麦克斯韦速度分布律是描述气体速度分布的重要定律,通过麦克斯韦速度分布函数、平均速度和均方根速度等公式,我们可以计算在给定温度下,气体分子速度的分布情况。
麦克斯韦速率分布律.pptx

麦克斯韦速率分布律
f (v)为速率分布函数,n为分子数密度,
说明下式的物理意义:
(1)nf (v)dv
f (v) dN , n N
Ndv
V
nf (v)dv
dN V
表示单位体积内分布在速率区间 v 内v的 dv
分子数。
第4页/共20页
麦克斯韦速率分布律
f (v)为速率分布函数,n为分子数密度, 说明下式的物理意义:
(2)Nf (v)dv
f (v) dN Ndv
Nf (v)dv dN
表示分布在速率区间 v v 内的dv分子数。
第5页/共20页
麦克斯韦速率分布律
f (v)为速率分布函数,n为分子数密度,
说明下式的物理意义:
(3)n v2 f (v)dv
v1
f (v)
dN
,n
N
Ndv
V
n v2 f (v)dv N N N
把这些量值代入,即得
W v= 1 v p 50
N=
N
4
99 100
2
e
99 100
2
1 50
1.66%
第19页/共20页
f (v ) p3
T1
T2
T1 T2 T3
温度越高,速率 大的分子数越多
T3
v v v O
p1 p 2 p3
v
第15页/共20页
气体的三种统计速率
同一温度下不同种气体速率分布比较
f (v)
m1
m1 m2 m3
m2
分子质量越小,速
率大的分子数越多
。
m3
O
v
第16页/共20页
麦克斯韦速率分布律

理气
d(m )F (器 dt壁)
真实气体 d (m ) (F 器 壁 f 内 部 )d t 分 子
pi
β
a
修正为
RT
Pb Pi
由于分子之间存在引力 而造成对器壁压强减少 内压强 P i
基本完成了第二 步的修正
内压强 1) 与碰壁的分子数成正比 2) 与对碰壁分子有吸引力作用的分子数成正比
解: 已知 T27 K,3 p1.0at m 1.01 1350 P,a d3.51 0 1m 0
kT 2d 2 p
1 .4 1 3 .1 1 . 3 4 (3 .5 8 1 1 2 0 3 1 0 2 )0 1 7 .0 3 150 6 .9 1 8 0 m
空气摩尔质量为2910-3kg/mol
讨论
麦克斯韦速率分布中最概然速率 v p 的概念
下面哪种表述正确?
v (A) p 是气体分子中大部分分子所具有的速率. v (B) p 是速率最大的速度值. v (C) p 是麦克斯韦速率分布函数的最大值.
(D) 速率大小与最概然速率相近的气体分子的比
率最大.
例 计算在 27C时,氢气和氧气分子的方均
§7-5 麦克斯韦分子速率分布定律
平衡态下,理想气体分子速度分布是有规律的, 这个规律叫麦克斯韦速度分布律。若不考虑分子速 度的方向,则叫麦克斯韦速率分布律。
麦克斯韦速率分布律: 1、速率分布率的实验测量 2、 分布函数及其意义 3、 麦克斯韦速率分布函数 4、 速率分布函数的应用
1.测定气体分子速率分布的实验
m ( H 2 ) m ( O 2 )
o
2000 v/ms1 vp(H 2)vp(O 2)
vp(H2) vp(O2)
14.6 麦克斯韦速率分布律

o
v1 v2
v
dN = Nf ( v )dv
v v1 → v2 区间的分子数 ∆N = ∫v 2 N f ( v )dv 速率位于 1
区间的分子数占总数的百分比: 速率位于 v1 → v2 区间的分子数占总数的百分比:
∆ N ( v1 → v 2 ) v2 ∆S = = ∫v f ( v )d v 1 N
气体在一定温度下分布在最概然 速率 v p 附近单位速率间隔内的相对 分子数最多 .
2)平均速率 )
v (mean speed)
∞ 0
∫ v=
N
0
vdN N
∫ =
vNf (v)dv N
8kT πm
f (v)
v = ∫ v f ( v )dv =
0
∞
=
8 RT πM mol
o
v
v ≈ 1 .6 0
kT = 1 .6 0 m
df (v) = 0 决定 (2)最概然速率由 最概然速率 dv v p
df (v) = A(v0 − 2v) v = 0 p dv vp
v0 vp = 2
v0
v0 6 2 平均速率: 平均速率: v = vf (v)dv = ∫ v (v0 − v)dv = 3 0 0 2 v0 ∞ v 6 3 2 3 2 2 v = v f (v)dv = ∫0 3 v (v0 − v)dv = v0 而 0 v0 10
三种统计速率 1)最概然速率 )
vp
(most probable speed)
f max
f v)
df ( v) =0 dv v=vp
根据分布函数求得
v ∵Mmol = mNA , R = NA k
普通物理PPT课件4.3 麦克斯韦速率分布律

v2 区间的分子数N 占分子总数
v2 N = f (v )dv v1 N
它对应于曲线下阴影部分的面积
0
f (v )dv=1
——速率分布函数的归一化
*由麦克斯韦速率分布函数表示一些平均值
v
v
2
vdN N
2
0
0
dN v N
vf (v )dv
0
在v = vp 附近单位速率区间(v =1m· s-1)内 的分子数总数为
6.02 1023 105 0.2 0 0 1.2 1026 个
在v = 10vp 附近单位速率区间(v =1m· s-1) 内的分子数总数为
6.02 1023 105 2.0 1042 0 0 1.2 10
速率在区间的分子数占分子总数的百分比为它对应于曲线下阴影部分的面积速率分布函数的归一化432最概然速率平均速率和方均根速率最概然速率定义速率分布曲线上速率分布函数f最大值对应的速率叫做最概然速率
4.3 麦克斯韦速率分布律
4.3.1 麦克斯韦速率分布律 4.3.2 最概然速率 平均速率和方均根速率 4.3.4 例题分析
v2
k 玻耳兹曼常数 m 分子的质量 T-热力学温度
以v为横坐标,f (v)为纵坐标画出的曲线叫 做气体分子的速率分布曲线.
f (v )
dN f ( v )dv N
o
vp
v v dv
v
麦克斯韦速率分布曲线
3.麦克斯韦速率分布曲线
面积:
f(v)
意义:分布在区间v~ v+v 内的分子数的百分率 面积:
麦克斯韦速率分布律

dN m 3 / 2 mv 2 / 2 kT 2 f ( v) 4 ( ) e v Ndv 2 π kT
23 ´ 当m 2 10 g , T 273k , V 800m / s
f (800) 10 什么含义
6
在800-800+dv速率区间,单位速 率区间分子数占总分子数之比
f (v ) d v
0 v0 2 av d v 0
0
1 3 av 0 3
3 a 3 v0
(2)设总分子数为N, 则
v
v 0
Nf (v ) d v N
2
v 0
f (v ) d v
v0 v 0
a 4 1 3 4 3 av d v v 0 ( 3 )v 0 v 0 4 v0 4 4
m 1.45 1.50 1.55 1.60 1.65 1.70 1.75 1.80 1.85 1.90 1.95
总人数1380 1.50-1.55m的人数130
30 25 20 15 10 5 0 25 26 26 26 27
1.51
1.52
1.53
1.54
1.55
1.56
50 40 30 20 10 0
N v d N v 0 N d Nv 0
i
N v 0
d Nv N
v 0
f (v ) d v
8kT 8RT 对麦氏速率分布经计算得: v πm π
v (v ) f (v ) d v
0
规律:任意v 的函数(v)对 全体分子的平均值都可以用 速率分布函数由上式求得:
课件:麦克斯韦速率分布律

Nf (v) a
o
解:(1)由图可写出分子速率分布函数:
v0
2v0 v
a
Nv0
v
f
(v)
a N
0
(0 v v0 )
(v0 v 2v0 ) (v v0 )
由归一化条件,得
f (v)dv 1
,即
0
v0 a vdv 2v0 a dv 1
0 Nv0
N v0
2N a
3v0
(2)速率在区间[1.5v0,2.0v0]内的分子数:
区间的分子数占总分子数的 百分比 .
归一化条件
N dN f ( v )dv 1
0N
0
f (v)
dN f (v)dv dS
N
S
速率位于v v dv 内分子数
o
v1 v2 v
dN Nf (v)dv
速率位于
v1
v2
区间的分子数 N
v2
v1
N
f
(v)dv
速率位于 v1 v2 区间的分子数占总数的百分比
v
v f (v)dv
v0 v f (v)dv
v v0 1 dv v0
0
0
0 v0
2
2、导体中自由电子的运动,可看作类似气体分子 的运动(称为电子气)。设导体中共有N个自由电
子,其中电子的最大速率为vF(称为费米速率)。
电子速率分布函数为
f
(v
)
4 A
N
v
2
0
0 v vF v vF
v v1dN1 v2dN2 vidNi vndNn N
N
vdN vNf (v)dv
v 0
0
麦克斯韦速率分布定律

υ 附近单位速率区
间的分子数
(5) nf ()d N dN dN
VN V
单位体积中速率在υ ~ υ+dυ区间的分子数
(6) 2 f ()d 1
dN N
N1 2 N
速率在υ1 ~ υ2区间的分
子数占总分子数的百分比
(7) 2 Nf ()d 1
1920年史特恩用分子束实验, 获得分子有着确定的速 度分布的信息, 但未能给出定量的结果. 1934年我国留学 生葛正权在伯克利首次获得此定律的精确实验验证. 此 成功经报界报道, 当时闻名欧美, 在很大程度上改变了外 国人眼中“中国留学生只会读书不能动手, 我们不欢迎” 的形象, 对当时欧美中国留学生有极大的影响和鼓舞.
p (O2 ) 500 m/s
例4. 设某气体的速率分布函数为
f (v )
av 2,(0 v v0 )
0 , (v v 0 )
f (v )
求:(1)常量 a 和υ0 的关系 0 v0
v
(2)平均速率 v
(3)速率在 0 v 0 之间分子的平均速率v
2
解:(1)由归一化条件
(1) f () dN Nd
(2) f ( )d dN
N
υ附近单位速率区间的分子
数占总分子数的百分比
速率在υ ~ υ+dυ区间的分
子数占总分子数的百分比
(3) N f ()d N dN dN
N
速率在υ ~ υ+dυ
区间的分子数
(4) N f () N dN dN Nd d
f ()
T1
T2 T1
T2
p
2kT m
麦克斯韦速率分布定律

1920年史特恩用分子束实验, 获得分子有着确定的速 度分布的信息, 但未能给出定量的结果. 1934年我国留学 生葛正权在伯克利首次获得此定律的精确实验验证. 此 成功经报界报道, 当时闻名欧美, 在很大程度上改变了外 国人眼中“中国留学生只会读书不能动手, 我们不欢迎” 的形象, 对当时欧美中国留学生有极大的影响和鼓舞.
氧气分子在 0ºC 时的分子速率分布
(m / s)
100以下
N / N (%)
1.4
100-200
8.1
200-300
16.5
300-400
21.4
400-500
20.6
500-600
15.1
600-700
9.2
700-800
4.8
800-900
2.0
二.气体分子速率分布 N /(Nv)
p (O2 ) 500 m/s
例4. 设某气体的速率分布函数为
f (v )
av 2,(0 v v0 )
0 , (v v 0 )
f (v )
求:(1)常量 a 和υ0 的关系 0 v0
v
(2)平均速率 v
(3)速率在 0 v 0 之间分子的平均速率v
2
解:(1)由归一化条件
N
0 / 4 0
f ()d
5N 32
(3)最可几速率
df () d p
0p
0
2
(4)
f
( )d
0
0
2
rms
2
[
麦克斯韦气体分子速率分布律

速率区间 (m/s)
100以下 100~200 200~300 300~400 400~500 500~600 600~700 700~800 800~900
900以上
分子数出现的概率 ΔN/N
0.014 0.081 0.165 0.214 0.206 0.151 0.092 0.048 0.020 0.009
25
7-6 麦克斯韦气体分子速率分布律
第七章 气体动理论
1865年春辞去教职回到家乡系统地总结他的关于 电磁学的研究成果,完成了电磁场理论的经典巨著 《论电和磁》,并于1873年出版。1871年受聘为剑桥 大学新设立的卡文迪什实验物理学教授,负责筹建著 名的卡文迪什实验室,1874年建成后担任这个实验室 的第一任主任,直到1879年11月5日在剑桥逝世。
(v)dv
N
v1
N
表示在速率v1~v2速率区间内, 分子出现的概率。
(4)
v2
Nf (v)dv N
表示在速率v1 ~ v2速率区间内, 分子出现的个数。
v1
20
7-6 麦克斯韦气体分子速率分布律
麦克斯韦速率分布律的实验 验证
麦克斯韦在 1860 年 从理论上预言了理想气 体的速率分布律。60 年 后,也就是 1920 年斯特 恩通过实验验证了这一 规律,后来密勒和库将 实验进一步完善。
ΔN→0
v
N vdN
vf (v)dv
0N
0
14
7-6 麦克斯韦气体分子速率分布律
第七章 气体动理论
2.平均速率 v
v 0 vf (v)dv
代入麦克斯韦理想气体的速率分布函数:
v 4
m
3
/
2
麦克斯韦速率分布定律ΔN

f(v) T1
T2(> T1)
f(v) μ2(> μ1) μ1
O
v p1 v p2
vO
v p2 v p1
v
例 氦气的速率分布曲线如图所示。
求 (1) 试在图上画出同温度下氢气的速率分布曲线的大致情况; (2) 氢气在该温度时的最概然速率和方均根速率。
解 (2) v p
2RT M
RT 2 103
1、速率分布函数 f(v)
设某系统处于平衡态下, 总分子数为 N ,则在v~v+ dv 区
间内分子数的比率为
dN N
f
(v ) dv
f (v) dN Ndv
f(v)
称为速率分布函数
分布在速率v 附近单位速率间隔内的分子数与总分子数比率
讨论 分子束中的速率分布和容器中的是否相同?
2、 麦克斯韦速率分布定律 理想气体在平衡态下,分子速率分布函数
df (v ) 0 dv vvp
vp
2kT μ
2RT 1.41 RT
M
M
2. 平均速率
v
v
dN N
1 N
0 v Nf (v
)dv
v
v f (v )dv
8kT 1.60
RT
0
π
M
3. 方均根速率
v 2
v
2
f
(v
)dv
3kT
0
μ
说明
v 2 3kT 1.73 RT
分子数与总分子数的比率
v2 f (v)dv N
v1
N
(7)曲线下面的总面积, 等
麦克斯韦速率分布律

麦克斯韦速率分布律介绍麦克斯韦速率分布律是描述理想气体粒子速度分布的统计物理学定律。
它是由19世纪物理学家詹姆斯·麦克斯韦提出的,通过分析气体分子的碰撞和运动,揭示了粒子速度的分布规律。
麦克斯韦速率分布律在理解和研究气体的性质和行为方面起着重要作用。
物理背景在理想气体状态下,气体分子间无相互作用力,分子之间碰撞时可以视为弹性碰撞,满足动量守恒和能量守恒。
根据统计物理学的理论,在给定温度下,气体粒子的速度具有一定范围的分布。
麦克斯韦速率分布函数麦克斯韦速率分布函数是描述理想气体速度分布的函数,可以用来计算在给定温度下不同速度范围内气体分子的数量。
麦克斯韦速率分布函数的形式为:[f(v)=4()^{3/2} v^2 e^{-}]其中,[f(v)]为速度为[v]的气体分子的数量,[m]为分子的质量,[k]为玻尔兹曼常数,[T]为气体的温度。
速度分布特点根据麦克斯韦速率分布律,气体分子的速度分布具有以下特点:1. 最概然速度最概然速度是指在给定温度下,气体粒子速度分布函数的峰值对应的速度值[v_p]。
最概然速度与温度无关,只取决于粒子的质量。
最概然速度可以通过对速度分布函数求导并令导数等于零来求得。
2. 平均速度平均速度是指在给定温度下,所有速度可能取值的加权平均值。
根据麦克斯韦速率分布律,平均速度与温度成正比,与粒子质量无关。
3. 方均根速度方均根速度是指在给定温度下,速度平方的平均值的开平方。
方均根速度与温度成正比,与粒子质量无关。
麦克斯韦速率分布律的应用麦克斯韦速率分布律在研究气体性质和行为时具有广泛的应用。
以下是一些麦克斯韦速率分布律的应用:1. 气体的热容根据麦克斯韦速率分布律可以计算出给定温度下气体分子的平均动能和热容。
热容是指单位物质在温度变化下吸收或释放的热量。
通过麦克斯韦速率分布律,我们可以计算气体的平均动能,并根据统计物理学的理论将其与热容联系起来。
2. 气体的扩散速率扩散是指气体中各个分子在温度梯度下的运动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§4-2 麦克斯韦速率分布律
f x
f ( x)
x x
N i f ( x ) x N
0
x
x
x x
f (v )
f ( x)
0 5 0
30 40 50 60 70 80 90 100
6
7
8
9
10
v
x
百米时间 20s 16.6s 14s 12.5s 11s 10s
f ( x)
f ( x)
理想气体状态方程
速率分布函数
pV RT
或
p nkT
麦克斯韦速率分布率
vp
三个速率
2 kT m
2 RT M mol
f (v )
v
v2
8 kT m
8 RT M mol
3 RT M mol
f (v )
3kT m
O
v vp
v
讨论:1、同一气体不同温度下速率分布比较
f (v)
中的极大值对应的分子速率
f (v )
O
vp
v
求解得
2kN AT m NA
平衡态下的理想气体,在一定温度下分布在最概然速 率 v p 附近单位速率间隔内的相对分子数最多。
(2)平均速率:
气体分子速率的算术平均值。
f (v )
(3)方均根速率: 气体分子速率平方的平均值的平方根。
O
vp
v
3kT 3kN AT v m m NA
p nkT
气体中分子是怎么样运动的?
热运动
§4-2 麦克斯韦速率分布律
个
cm3
(1000万倍于我国人口数量级)
500 m/s 碰 1010 次 / s 个
热运动
热力学系统中大量分子、不停地作无规则的热运动。分 子速度的大小、方向千变万化。但是分子的速率分布有无规 律?—速率分布函数
单个分子的速率无规则,但从大量 分子的整体来看,在平衡状态下,分子 的速率分布遵循一定的统计规律。
v2 p
(1式)
4 1 1 f (v p ) e (2式) vp
3kT 3 2kT 3 2 v vp m 2 m 2
2
取
v v
2
,并注意到
2 3 2 v 即 2 vp
代入(1式)
3
4 3 1 2 2 f( v ) e 2 vp
(3式)
1 2
概率之比即为(2式)比(3式)
速率分布函数 f(v)可写为
m 32 f (v) 4 ( ) v e 2 kT 2 2 1 v v v 4 v v 4 3 2 3 e e 3 vp vp
2 2 p
mv 2 2 2 kT
2
v2 p
4 v 2 v 2 f (v ) e 3 vp
在上式中取v=vp ,得
L v
狭 缝
L υt
粒子速率分布实验曲线如下所示 相 对 粒 子 数
O
粒子速率分布实验曲线
v
结论:气体分子速率分布符合麦克斯韦分布率
完
x
是位置的函数
f ( x)
称为概率分布函数
概率分布函数表示随机变量 x 处 单位区间内的概率,所以概率分布函 数又称为概率密度。
0
x
x x
x
N N
dN N
速率分布函数表达式 f ( x) 的意义
把速率分成很多相等的间隔
o
统计出每个间隔内的分子数N 间隔内分子数与分子总数N之比
v
地球形成之初,大气中应有大量的氢、氦, 但很多 H2分子和He原子的方均根速率超过了地球表面的逃逸速 率(11.2km/s),故现今地球大气中已没有氢和氦了。
N2和O2分子的方均根速率只有逃逸速率的1/25,故地 球大气中有大量的氮气 (占大气质量的76%)和氧气(占大 气质量的23%)。
上节基本概念回顾
L υt
实验说明:速度选择器两盘 都有一个小凹槽,它们的夹 角为θ,约20,都以角速度ω 金属 旋转,分子束通过两盘,它 蒸汽 的速率须满足:
接抽气泵
显 示 屏
因凹槽有一定的宽度,故所选择的是某一速率 范围内的分子数。 调节ω,不同速率的分子会沉积在显示屏上。 沉积的厚度不同,对应不同速率区间内的分子数.
3)
的意义
f ( v)
面积
面积
是速率分布曲线下 的一个有限面积,表示 速率在v1v2范围内分子 数与总分子数之比。
f ( v)
O
dv
v1
v2
v
4)
的意义
0
f ( v)dv 1
1)速率分布曲线下面积为1; 2)所有分子在所有速率范围内出现的概率为100%;
例1
n分子数密度, 说明下式的物理意义: 为速率分布函数,
2
N
v1
(3)速率在0到∞所有分子出现的概率为100%
0
f (v )dv 1
三、麦克斯韦速率分布律
麦克斯韦 1859年用概率论证明。在平衡态下,气体 分子速率分布函数为 f (v )
f (v )
也称麦克斯韦速率分布律
O
v vp
v
说明: (1) m 气体分子(原子)的质量;
(2)
v 气体分子(原子)的速率;
2 e 1ຫໍສະໝຸດ 10 f ( v 2 ) dv f ( v 2 ) 3
f ( v p ) dv
f (v p )
四、分子速率的实验测定
1920年,史特恩从实验上证实了麦克斯韦分子按速率分布的统 计规律. 1934年,中国科学家葛正权对实验装置进行了改进。 接抽气泵
金属 蒸汽
狭 缝
显 示 屏
(3) T 为气体的热力学温度; (4) k 为波尔兹曼常数。
麦克斯韦速率分布律讨论:
1)f (v ) 的意义
f ( v)
表示分子速率在v附近, 单位速率间隔内的分子数占 总分子数的百分比。 2)f (v ) dv的意义
f ( v)
面积
O
dv
v
表示分子速率在v—v+dv间隔内的分子数占总分子数的百分比。 f (v ) dv为速率分布图上的一个窄条面积
f x 例 伽尔顿板实验中, 设粒子总数为N, i为小槽的序号,Ni为落入第i个小槽 的粒子数
每个槽内的钢球数与总数之比:
N i 为确定值 N
N i N 1 N 2 , N N N
1)与狭槽的宽度有关 2)与狭槽的位置有关
N i f ( x ) x N
f ( x)
f ( x)
f (v p 1 )
f (v p 2 )
f (v p 3 )
比较 T1
T2
T3 的高低
T1
T2
T1 T2 T3
T3
温度越高,速率 大的分子数越多
O
v p1 v p 2 v p 3
v
讨论:2、同一温度下不同种气体速率分布比较
比较
m1 m2
m3 的大小
f (v)
m1
m2
m1 m2 m3
f ( v)
O2
H2
o v
po
vp
H
v
例4
试求分子在最概然速率vp 附近与在方均根速
率 v 2 附近出现的概率之比。 解:分子速率在最概然速率 vp附近dv 速率区间的 概率为f(vp)dv ,在方均根速率 v 2 附近 dv速率区 间的概率为 f ( v 2 )dv 。利用v2p =2kT/m,麦克斯韦
第四章
f (v)
m1
气体动理论
§4-2 麦克斯韦速率分布律
m2
m3
O
vp vp
1
2
vp 3
v
内燃机式普列车
回顾上一节平衡态与理想气体状态方程
一 热力学系统的平衡
平衡条件:系统内部压强、温度、化学组分处处相同。
二 态参量和态函数
三、状态方程 pV
体积V
温度T
压强p
1pa=1N· m-2
M RT M m ol
解:
表示单位体积内分布在速率区间 内的分子数。
表示分布在速率区间
内的分子数。
表示分布在单位体积内,速率区间
内的分子数。
四、气体的三种统计速率
(1)最概然速率: 速率分布函数 极值条件
mv 2 3 df (v) d m 2 e 2 kT v 2 0 4 2 kT dv dv
1 atm = 1.013105pa = 760mmHg
或
pV RT
R 8.31J mol k (摩尔气体常数 )
M Nm M mol N Am
N 令: n V
理想气体状态方程
R k 1.38 10 23 J/K NA
N R p T V NA
k : 波尔兹曼常数
m3
分子质量越小,速率 大的分子数越多。
O
v p v p vp 3
1 2
v
例2 N2 分子在不同温度下的速率分布曲线 如图所示,已知 T1 300K T 1200K
2
在曲线上标出温度
f ( v)
T1 300K
T2 1200K
o
vp
1
vp
2
v
例3 同一温度下两种气体 O 2 和 H 2 的速率 分布曲线如图所示,在曲线上标明气体。
N 1 某 处单位速率间隔内分子数与总数之比 N v
N N
+
