大鼠灌注固定取脑 ppt课件
大鼠脑的立体定位技术(共10张PPT)

确定注射位置 某些颅外标记与颅内结构具有相对固定的位置关系
前囟(bregma):位于冠状缝和矢状缝的交接处
3个标准检测是否固定成功(鼻对正中,头部不动,提尾不掉) 6 ml/100g, i.
取下动物,腹腔注射过量的20%氨基甲酸乙 立 小体心定安位 放仪 微为 量精 注密 射仪 器器 ,针,实尖验斜时面应中小点心进操入作孔,以内免时损,记坏高度。 酯使动物死亡 核团定位,做标志, 钻孔
脑图谱
第四页,共10页。
应用
核团微量注射 电位引导 核团的刺激或损毁
第五页,共10页。
材料
大鼠,立体定位仪,哺乳类手术器械, 牙科钻,20%氨基甲酸乙酯,生理盐水 ,2%滂胺天蓝溶液
第六页,共10页。
方法和步骤
麻醉
20%氨基甲酸乙酯 0.6 ml/100g, i.p.
固定
将大鼠头部固定于脑立体定位仪上,门齿杆 -3.3 mm
将大鼠头部固定于脑立体定位仪上,门齿杆 -3. 切头皮,剥开皮下组织, 将骨缝暴露清晰,用铅笔在前囟和后囟各做一标志
以咬骨钳咬开颅骨,小心取出大脑,顺着注 缓慢进针至LV ,注入10 l 2%滂胺天蓝溶液(2 l/min),留针10 min后缓慢拔针
缓慢进针至LV ,注入10 l 2%滂胺天蓝溶液(2 l/min),留针10 min后缓慢拔针
第九页,共10页。
注意事项
立体定位仪为精密仪器,实验时应小心操 作,以免损坏
微量注射器取出后应立即清洗,以防堵塞
第十页,共10页。
大鼠脑的立体定位技术
第一页,共10页。
目的
了解脑立体定位技术的原理,初步掌握 确定某一中枢核团的方法
第二页,共10页。
灌流取脑

大鼠灌注固定取脑准备物品:37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。
时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止6)旋转三通使之对准灌注液,开始灌注固定液。
固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。
7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
取出的脑在同样固定液中4℃再固定4-6小时。
8)保存或切片注意事项: 1、将灌注针插入主动脉内是灌注固定的关键,也是难点。
首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
大鼠灌注固定的方法
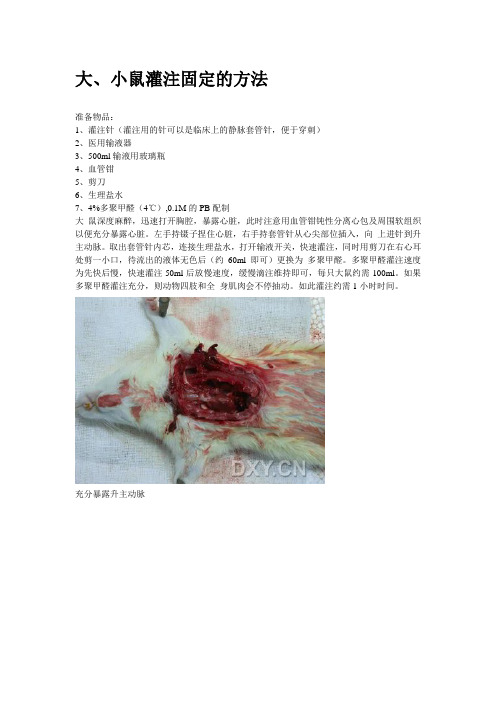
大、小鼠灌注固定的方法准备物品:1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺)2、医用输液器3、500ml输液用玻璃瓶4、血管钳5、剪刀6、生理盐水7、4%多聚甲醛(4℃),0.1M的PB配制大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。
左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。
取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。
多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。
如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。
如此灌注约需1小时时间。
充分暴露升主动脉套管针从心尖部位插入,向上进针到升主动脉1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。
2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。
相对来说,剪开右心耳更为方便。
我们就是这样做的。
3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。
另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。
有条件的话可加点肝素。
5、先主动脉插管,再右心耳放血,这样插管容易些。
先剪右心耳的话,心脏会瘪下去的。
小鼠灌注固定方法:采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20 mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20 mL 生理盐水。
推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。
大鼠灌注固定取脑

优点:可用单人用注射器直接完成,不用输液管架,而且平均每只仅需5~10ml固定液,时间也仅为5~10min。
注意事项:1)开胸时不要伤到心脏 2)心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯.插针部位是心尖部,方向向中线.3)生理盐水冲血管,到右心耳流出无色液体.4)多基甲醛固定成功的表现是SD鼠四肢抽搐.5)先断头再一步一步取脑6)根据你实验设计,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道.7)去颅骨后脑表面有一层硬脑膜,要去掉.
5 灌流:缓慢灌注PBS 10ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛,多聚甲醛的灌流也同PBS。
6 灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。
7 取脑:分离除去后颈部肌肉 ,用弯镊小心取出脑组织。
8 后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
3.制作灌注装置,用两瓶塑料包装的生理盐水,一瓶底部开口,倒出盐水,倒置灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端
2. 经心脏行灌注固定:麻醉,剪开胸廓,见到搏动的心脏,心尖插入灌注针头,止血钳固定,剪开右心耳,开放静脉血,首先快速滴入生理盐水100-200ml,再注入4%多聚甲醛300-350ml固定液
大鼠灌注固定取脑科研实验
具体方法:
1. 配好4%多聚甲醛PBS缓冲液,配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH直至7.0,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
灌注取脑

大鼠灌注取脑流程一、麻醉10%水合氯醛(0.4ml/100g)腹腔注射二、开胸1、沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉。
2、用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏。
三、穿刺将灌注针插入主动脉内是灌注固定的关键,也是难点。
1、首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起(剪开心包壁层的前壁,暴露升主动脉和肺动脉干的根部)。
2、穿刺之前要用适当大小的血管钳夹住心室以固定心脏,但不要夹得过紧,要让心腔内留有一定的间隙。
用小剪刀在心尖处先剪开一个小口,再插入穿刺针。
3、插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最好为3~5毫米,然后用丝线扎紧。
4、灌注针插入成功后,用小剪刀剪开右心耳。
四、灌注1、用量(夹闭腹主动脉)4℃生理盐水(50-100ml/只),4℃的4%多聚甲醛(50-100ml/只)2、速度先快后慢,共用30分钟左右3、成功标志生理盐水:右心耳流出液体血色较浅基本澄清,肺脏、眼珠、爪子迅速变白是排出血液的有效观察指标。
多聚甲醛:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明腹主动脉夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
五、取脑1、枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨。
2、用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉。
3、用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
六、保存取出的整个脑组织块再置于4%多聚甲醛4℃保存。
大鼠MCAO模型的制作 ppt课件

2
PPT课件
3
PPT课件
实验前准备工作(1)
手术器械+取脑器械:清洗干净,简单消毒
其他:干棉球,酒精棉球,大鼠板,固定线, 自制拉钩,培养皿
麻醉药:NS配制的10%水合氯醛,用法为 0.35ml/100gIP,手术过程中可用1/4~1/3倍 液追麻
TTC染液:NS配制的1%红四氮唑溶液,现配 现用,2℃~4℃避光保存
5
PPT课件
实验方法(1)
动物麻醉后仰卧位固 定在鼠板上,剪毛后 用75%乙醇简单消毒, 颈正中线开口
6
PPT课件
实验方法(2)
沿正中钝性分离两侧鼓泡腺体,暴露颈前肌群 沿胸锁乳突肌内缘分离肌肉和筋膜,暴露颈总动
脉及分支 这两步均用弯头止血钳进行钝性分离
7
PPT课件
实验方法(3)
9
PPT课件
实验方法(5)
用眼科镊向为内上方轻推栓线,从血管分叉处开始算距离,当插 入深度到达鱼线的标记处时,扎紧固定线
若鱼线堵在在1cm处,是误进翼颚动脉,若在1.6cm堵住,则是 卡在了入颅处。此时都应回抽鱼线调整方向再进线,反复试几次 还不行最好换根栓线,很可能前端已经变形
如果是再灌注模型,则在缺血一定时间后拔出鱼线,结扎死颈外 动脉残端就能恢复颈总到颈内的动脉血供
操作者手术熟练度 要求较高
15
PPT课件
注意保温 动作轻柔熟练 麻醉药用量宁少勿多 控制进线深度 线拴法有一定的死亡率,淘汰率也比较高,做
好预试 模型不成功的大鼠要记录和总结
16
PPT课件
谢谢!
17
PPT课件
重
11
PPT课件
大鼠灌注取脑

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH 值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
大鼠灌注取脑

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH 值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
[医学]大鼠灌注固定取脑,解剖取材
![[医学]大鼠灌注固定取脑,解剖取材](https://img.taocdn.com/s3/m/3cb4fdc019e8b8f67c1cb958.png)
• 2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。同时配好输液器备用。
• 3.10%水合氯醛按4mL/100g的剂量腹腔注射麻醉动物。
• 4.沿两侧肋弓剪开皮肤,打开腹腔,用止血管钳夹持剑突并向上提拉,用弯 • 剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断 • 膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏, • 直视下穿刺针左心室心尖处,用血管钳固定。
• 5.关于生理盐水的温度的选择,有人认为因 为是快速冲刷血管里的血液,低温造成血 管收缩,灌注的效果反而没有室温的好。 但是用低温的认为,低温有利于组织完整。
• 6.灌注成功的标志:刚开始灌注时老鼠剧烈 抽动;成功后老鼠后肢绷直,尾部竖起成 一直线;所灌注的脑组织白而硬。
• 7.去颅骨后脑表面有一层硬脑膜,要去掉。
省时省剂的方法
夹闭腹主动脉:只灌注上肢及头脑,固定 的好又快,又省试剂。先灌注生理盐水 约100ml,见到老鼠两前肢及两肺变白即可 改灌注多聚甲醛。多聚甲醛用100ml以下即 可。
灌注成功的标志:刚开始灌注时老鼠前肢剧 烈抽动(下肢不抽动证明腹主动脉夹闭完 全);前肢及颈部僵硬;所灌注的脑组 织白而硬
从小脑处将脑组织向上推起,用小 剪刀剪断脑神经
注意事项 • 1.多聚甲醛气味刺激,配置时做好自我保护。 • 2.暴露心脏这一步骤,容易损伤肺、心脏或者肝脏,“夹持剑
突并向上提拉,用弯剪在膈肌与胸骨柄相连处剪一小口,造成 人工气胸”,人工气胸后,肺萎缩,胸腔里的空间增大,提拉 剑突后,不容易损伤肺、心及肝脏,出血少。
生理盐水冲洗
4%多基甲醛固定
取脑
保存或切片.
具体过程
大鼠经深度麻醉后胸暴露并游离出心脏,经 左心室插入灌流针并固定, 切开右心耳,先灌 注冰冻无菌生理盐水(4℃)XmL,直到肝和肺 脏颜色转白及右心房流出液澄清,后再灌注 冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲 醛浸泡固定24小时。
大鼠灌注取脑培训资料

大鼠灌注取脑大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
大鼠灌注固定取脑

大鼠灌注固定取脑大鼠灌注固定取脑准备物品:37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。
时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止6)旋转三通使之对准灌注液,开始灌注固定液。
固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。
7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
取出的脑在同样固定液中4℃再固定4-6小时。
8)保存或切片注意事项:1、将灌注针插入主动脉内是灌注固定的关键,也是难点。
首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
大鼠灌注取脑培训资料

大鼠灌注取脑1.用于常规HE 染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot 和PCR 。
4.如果观察脑组织的缺血、损伤或者其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
1.脑组织较软,且细胞成份不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE 染色后,可去除红细胞背景影响。
1) 麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或者切片.大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4% 多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24 小时。
1.多聚甲醛的配置:普通方法为:4%多聚甲醛PBS 缓冲液配法:称取40g PFA 溶于装有500mlDEPC 水的玻璃容器(烧杯或者烧瓶)中,持续加热磁力搅拌至60 ~ 65℃,使成乳白色悬液。
用1.0mol/L 的NaOH 值至7.4,使呈清澈状(滴加),再加入约500ml PBS,充分混匀(在冰浴或者冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或者4℃保存备用。
简便方法:先配好PBS ,称好相应的多聚甲醛,37℃水浴或者温箱密封放置2 天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠灌注取脑之欧阳道创编

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA 溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠灌注取脑之欧阳音创编

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠灌注取脑

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2。
冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR.4。
如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果.原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法.多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤.3.脑内血液都在,HE染色后,可去除红细胞背景影响.大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片。
具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1。
多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1。
0mol/L的NaOH 值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
大鼠灌注取脑培训资料

大鼠灌注取脑大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉 2)开胸 3)心脏左心室穿针,剪开右心耳 4)生理盐水冲水 5)4%多基甲醛固定 6)取脑 7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ppt课件
1
用途
1.用于常规HE染色,免疫组化分析。 2.冰冻切片可以不做脑组织固定。 3.不可用于western blot和PCR。 4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注
固定,而是在取出脑组织后作固定,将大大影响效果。
ppt课件
2
精品资料
• 你怎么称呼老பைடு நூலகம்?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
原理
心脏灌流术能够快速冲净血液并在动物 死 亡前进行组织的前固定,避免了组织的自 溶 现象,是脑组织切片观察的常用方法。多 聚 甲醛使组织蛋白发生交联,以保持蛋白 的 原位和表面结构不变,从而能使其对应
ppt课件
8
• 1.多聚甲醛的配置: • 一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装 • 有500mlDEPC水的玻璃容器烧杯或烧瓶)中,持续加热磁力搅 • 拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH值至7.4, • 使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴 • 或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温 • 或4℃保存备用。
• 3.经心脏灌注,有时穿刺针会误进右心室,那样灌注主要在 肺循环起作用,体循环的血液影响不大。所以观察将穿刺针 插入到主动脉内可以确保起到体循环灌注冲洗血液的效果, 脑组织的血液冲干净后,才不会影响免疫组化的效果,不然 到处都是红细胞造成的背景染色。
• 4.灌注时注意排空输液管中的气泡,不然容易气栓,影响灌 注效果。一定要看到大鼠较剧烈抽搐,不然证明灌注不好。
ppt课件
10
省时省剂的方法
夹闭腹主动脉:只灌注上肢及头脑,固定
的好又快,又省试剂。先灌注生理盐水 约100ml,见到老鼠两前肢及两肺变白即可 改灌注多聚甲醛。多聚甲醛用100ml以下即 可。
灌注成功的标志:刚开始灌注时老鼠前肢剧 烈抽动(下肢不抽动证明腹主动脉夹闭完 全);前肢及颈部僵硬;所灌注的脑组
开胸
心尖向左心室穿针
剪开右心耳
生理盐水冲洗
4%多基甲醛固定
取脑
保存或切片.
ppt课件
7
具体过程
大鼠经深度麻醉后,固定于自制的手术木
板置于解剖盘中,开胸暴露并游离出心脏,经 左心室插入灌流针并固定, 切开右心耳,先灌 注冰冻无菌生理盐水(4℃)XmL,直到肝和肺 脏颜色转白及右心房流出液澄清,后再灌注 冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲 醛浸泡固定24小时。
ppt课件
20
常见问题
ppt课件
21
1.灌注取脑不可用于Western blot及PCR的原因
• 多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和 表面结构不变,从而能使其对应的抗体,准确检测其 表达的位置和量。
• 简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱 • 密封放置2天,就能全溶。若是很急,55℃水浴一天,期间不时 • 震荡。注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的
杂质,避免心脏灌流时造成栓塞影响灌流效果。
• 也可用10%福尔马林溶液,甲醛1:10稀释 甲醛100ml 磷酸二氢钠4g 磷酸氢二钠6.5g 蒸馏水900ml 或甲醛100ml加900mlPBS缓冲液。
• 5.快速滴注生理盐水(室温),同时剪开右心耳。约注入100~150mL,至流出液 • 体血色较浅基本澄清,停止灌注。肝脏、眼珠、爪子迅速变白是排出血液的 • 有效观察指标。
• 6.继续用4%多聚甲醛灌流250ml固定。
• 7.后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h, • 过夜最好
的抗体,准确检测其表达的位置和量。
ppt课件
5
必要性
1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供 也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。 3.脑内血液都在,HE染色后,可去除红细胞背景影响
ppt课件
6
麻醉
流程
ppt课件
9
• 2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。同时配好输液器备用。
• 3.10%水合氯醛按4mL/100g的剂量腹腔注射麻醉动物。
• 4.沿两侧肋弓剪开皮肤,打开腹腔,用止血管钳夹持剑突并向上提拉,用弯 • 剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断 • 膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏, • 直视下穿刺针左心室心尖处,用血管钳固定。
ppt课件
19
• 5.关于生理盐水的温度的选择,有人认为因 为是快速冲刷血管里的血液,低温造成血 管收缩,灌注的效果反而没有室温的好。 但是用低温的认为,低温有利于组织完整。
• 6.灌注成功的标志:刚开始灌注时老鼠剧烈 抽动;成功后老鼠后肢绷直,尾部竖起成 一直线;所灌注的脑组织白而硬。
• 7.去颅骨后脑表面有一层硬脑膜,要去掉。
织白而硬
ppt课件
11
大鼠脑组织取材步骤
1.剪开皮肤
ppt课件
12
• 2.用钩镊再眼眶处固定大鼠颅骨,用组织剪 再颅骨和颈椎连接处剪断
ppt课件
13
• 3.组织剪头部伸入枕骨大孔,尽量贴着骨头(不能插太深伤到脑组织)。
ppt课件
14
• 4.组织剪从枕骨大孔处伸入,朝向同侧眼眶 方向,贴着骨头剪,剪到眼眶
ppt课件
15
5.从大鼠眼眶之间剪断
ppt课件
16
6.左手持钩镊插入大鼠的眼眶固定颅 骨,用弯钳直接夹住枕骨大孔处的骨 头直接就掀起来了
ppt课件
17
从小脑处将脑组织向上推起,用小 剪刀剪断脑神经
ppt课件
18
注意事项 • 1.多聚甲醛气味刺激,配置时做好自我保护。
• 2.暴露心脏这一步骤,容易损伤肺、心脏或者肝脏,“夹持 剑突并向上提拉,用弯剪在膈肌与胸骨柄相连处剪一小口, 造成人工气胸”,人工气胸后,肺萎缩,胸腔里的空间增大, 提拉剑突后,不容易损伤肺、心及肝脏,出血少。
