配位化学习题答案
配位化学习题及答案(1)

配位化学习题及答案(1)配位化学练习题一.是非题1.配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
2+2+ 2+2.[Cu(NH)] 的积累稳定常数β是反应[Cu(NH)]+NH,[Cu(NH)]的平33332333衡常数。
3. 配位数是中心离子(或原子)接受配位体的数目。
4.配离子的电荷数等于中心离子的电荷数。
5.配合物中由于存在配位键,所以配合物都是弱电解质。
θ6.根据稳定常数的大小,即可比较不同配合物的稳定性,即K愈大,该配合物f愈稳定。
7. 对同一中心离子,形成外轨型配离子时磁矩大,形成内轨型配合物时磁矩小。
3+8.Fe(?)形成配位数为6的外轨型配合物中,Fe离子接受孤对电子的空轨道32是spd。
9.中心离子的未成对电子数越多,配合物的磁矩越大。
10. 配离子的配位键越稳定,其稳定常数越大。
二.选择题1. 下列叙述正确的是()A. 配合物由正负离子组成B. 配合物由中心离子(或原子)与配位体以配位键结合而成C. 配合物由内界与外界组成D. 配合物中的配位体是含有未成键的离子2.下面关于螯合物的叙述正确的是( )A、有两个以上配位原子的配体均生成螯合物B、螯合物和具有相同配位原子的非螯合物稳定性相差不大C、螯合物的稳定性与环的大小有关,与环的多少无关D、起螯合作用的配体为多齿配体,称为螯合剂,,,,,,,,,,,,3.已知lgAgNH=7.05, ,21.7, =7.57,lgAgCNlgAgSCN,,,,,,,,,,,232222,,,,2,,,,,,3,,,,=13.46;当配位剂的浓度相同时,AgCl在哪种溶液中的溶解度lgAgSO,,,,,2232,,1最大( )A. NH?HOB. KCNC. NaSOD. NaSCN 322234.为了保护环境,生产中的含氰废液的处理通常采用FeSO法产生毒性很小的配 4合物是( )3, A、Fe(SCN) B、Fe(OH) 363, C、Fe(CN) D、Fe [(Fe(CN)] 2 665. 下列说法中错误的是()A. 在某些金属难溶化合物中,加入配位剂,可使其溶解度增大3+3+B.FeNaFFe 在溶液中加入后,的氧化性降低3-C.[FeF] 在溶液中加入强酸,也不影响其稳定性63+D.[FeF] 在溶液中加入强碱,会使其稳定性下降66.对于一些难溶于水的金属化合物,加入配位剂后,使其溶解度增加,其原因是()A. 产生盐效应B. 配位剂与阳离子生成配合物,溶液中金属离子浓度增加C. 使其分解D. 阳离子被配位生成配离子,其盐溶解度增加7.下列分子或离子能做螯合剂的是( )-A. HN-NH B. CHCOO C. HO-OH D.HNCHCHNH 22 322228. 配位数是()A.() 中心离子或原子接受配位体的数目B.() 中心离子或原子与配位离子所带电荷的代数和C.中心离子(或原子)接受配位原子的数目D.中心离子(或原子)与配位体所形成的配位键数目 9.关于配合物,下列说法错误的是( )A.配体是一种可以给出孤对电子或π键电子的离子或分子B.配位数是指直接同中心离子相连的配体总数 C.广义地讲,所有金属离子都可能生成配合物 D.配离子既可以存在于晶体中,也可以存在于溶液中210.分子中既存在离子键、共价键还存在配位键的有( )3+AlCl A. B. C.[Co(NH)]Cl D. NaSOKCN3633243+11.下列离子中,能较好地掩蔽水溶液中Fe离子的是( )- ---A.F B.Cl C. Br D. I12. 下列说法中错误的是()A. B. 配合物的形成体通常是过渡金属元素配位键是稳定的化学键C. D. 配位体的配位原子必须具有孤电子对配位键的强度可以与氢键相比较13. 下列命名正确的是()A. [Co(ONO)(NH)Cl]Cl ?III 亚硝酸根二氯五氨合钴()352B. [Co(NO)(NH)] ?III 三亚硝基三氨合钴()2333C. [CoCl(NH)]Cl ?III 氯化二氯三氨合钴()233D. [CoCl(NH)]Cl ?III 氯化四氨氯气合钴()23414. 影响中心离子(或原子)配位数的主要因素有()A. 中心离子(或原子)能提供的价层空轨道数B.空间效应,即中心离子(或原子)的半径与配位体半径之比越大,配位数越大C. 配位数随中心离子(或原子)电荷数增加而增大D. 以上三条都是15. 下列说法中正确的是()A. 配位原子的孤电子对越多,其配位能力就越强B. 电负性大的元素充当配位原子,其配位能力就强C. 能够供两个或两个以上配位原子的多齿配体只能是有机物分子D. 内界中有配位键,也可能存在共价键16.CoCl?5NH?HO已知某化合物的组成为,其水溶液显弱酸性,加入强碱并加332AgNO热至沸,有氨放出,同时产生三氧化二钴的沉淀;加于另一份该化3 AgClAgNO合物的溶液中,有沉淀生成,过滤后,再加入而无变化,但加3 AgCl热至沸又产生沉淀,其重量为第一次沉淀量的二分之一,故该化合物的化学式为()A.[CoCl(NH)]Cl?HOB.[Co(NH)HO]Cl235235233C.[CoCl(NH)]Cl?HOD.[CoCl(NH)]Cl?NH?HO 3522234323+17.Fe 离子能与下列哪种配位体形成具有五元环的螯合离子()--2- A. CO B.CHCOCHCOCH C. HNCHCHNHD.OOCCHCOO 24323222222-18.下列各配合物具有平面正方形或八面体的几何构型,其中CO离子作为螯合 3剂的是( )+ + A.[Co(NH)CO]B.[Co(NH)CO]353333C.[Pt(en)CO]D.[Pt(en)( NH)CO] 33319.下列配离子能在强酸性介质中稳定存在的是( )3,2,3,2,,,,,,,AgSONiNHFeCOHgCl232433244A. B. C.; D.。
配位化学复习题及答案

配位化学复习题及答案配位化学是无机化学的一个重要分支,它研究金属离子与配体形成配位化合物的过程和性质。
以下是一些配位化学的复习题及答案,供参考:一、选择题1. 什么是配位化合物?A. 含有金属离子的化合物B. 含有配体的化合物C. 金属离子与配体通过配位键结合形成的化合物D. 只含有金属元素的化合物答案:C2. 配位化合物中的配位键是由什么构成的?A. 金属离子和非金属离子之间的离子键B. 金属离子和配体之间的共价键C. 金属离子提供的空轨道和配体提供的孤对电子D. 配体之间的共价键答案:C3. 下列哪个不是常见的配体?A. 水分子B. 氨分子C. 二氧化碳分子D. 硫氰酸根离子答案:C4. 配位数是指什么?A. 配体的数量B. 配位化合物中的金属离子数量C. 与中心金属离子直接相连的配体数量D. 配位化合物中的总原子数量答案:C5. 什么是内界和外界?A. 内界是配体,外界是金属离子B. 内界是金属离子,外界是配体C. 内界是配位化合物的中心,外界是配位化合物的外围D. 内界和外界都是配体答案:B二、填空题6. 配位化合物的化学式通常表示为[M(L)_n]^z+,其中M代表______,L代表______,n代表______,z代表______。
答案:中心金属离子;配体;配位数;电荷数7. 配位化合物的几何构型取决于配位数,例如,四面体、平面正方形、八面体等。
当配位数为4时,常见的几何构型是______。
答案:四面体8. 配位化合物的稳定性可以通过______来衡量,它与配体的电子供体能力有关。
答案:配位常数9. 配位化合物的光学活性是由于分子的______性造成的。
答案:手性10. 在配位化学中,硬酸和硬碱倾向于形成______,而软酸和软碱倾向于形成______。
答案:硬配位键;软配位键三、简答题11. 简述什么是配位化学中的“软硬酸碱理论”?答案:软硬酸碱理论是由R. P. Pearson提出的,它根据中心金属离子和配体的相对电负性差异,将它们分为硬酸、软酸、硬碱和软碱。
无机化学第九章 配位化合物习题答案

第九章配位化合物习题答案1.命名下列配合物,并指出中心离子的配位数和配体的配位原子。
(1) [Co(NH3)6]C12(2) [Co Cl (NH3)5]C12(3) [Pd (SCN)2(PPh3)2] (4) [Pd (NCS)2(PPh3)2](5) Na3[Ag(S2O3)2] (6) [Ni(C2O4) (NH3)2]答:配合物名称(1)二氯化六氨合钴(II)(2)二氯化一氯·五氨合钴(III)(3)二硫氰酸根·二* (三苯基磷)合钯(II)(4)二异硫氰酸根·二(三苯基磷)合钯(II)(5)二(硫代硫酸根)合银(I)配离子(6)二氯化四氨·二水合镍(II)* 为区别配体数目与配体名称,有时用““二(相当于di-)”字,说成“二硫氰酸根·双(三苯基磷)合钯(II)”。
2.写出下列配合物的化学式:(1) 三硝基·三氨合钴(III)(2) 氯化二氯·三氨·一水合钴(III)(3) 二氯·二羟基·二氨合铂(IV)(4) 六氯合铂(IV)酸钾答:配合物化学式(1)[Co(NO2)3 (NH3)3](2)[Co Cl2 (NH3)3(H2O)]C1(3)[Pt Cl2 (OH)2 (NH3)2](4)K2[PtCl6]9.在[Zn (N H3)4]SO4溶液中,存在下列平衡:[Zn (N H3)4]2+⇌ Zn 2+ + 4NH3分别向溶液中加入少量下列物质,请判断上述平衡移动的方向。
(1)稀H2SO4溶液;(2)NH3· H2O;(3)Na2S溶液;(4)KCN溶液;(5)CuSO 4溶液答:(1)右;(2)左;(3)右;(4)右;(5)右10.在含有2.5⨯10-3 mol·L -1 AgNO 3和0.41 mol·L -1 NaCI 溶液里,如果不使AgCl沉淀生成,溶液中最少应加入CN - 浓度为多少? 已知[Ag(CN)2]- K s (β2) = 1.26 ⨯1021 ,AgCl K sp = 1.56 ⨯10-10解:首先考虑沉淀溶解平衡 Ag + + Cl - = AgCl(s) 根据溶度积规则,有 [Ag +] [ Cl -]= K sp如果不使AgCl 沉淀生成,应满足[Ag +]< K sp / [ Cl -]=1.56 ⨯10-10/0.41=3.80⨯10-10 (mol/L) 然后考虑配位平衡Ag + + 2CN - = Ag(CN)2-初始浓度 2.5⨯10-3 a 0平衡浓度 3.80⨯10-10 a – 2⨯(2.5⨯10-3–3.80⨯10-10) 2.5⨯10-3–3.80⨯10-10 ≈ a –5.0⨯10-3 ≈ 2.5⨯10-3根据配位平衡原理,有 s22K ]CN ][Ag [])CN (Ag [=-+-为使[Ag +]< 3.80⨯10-10 mol/L ,应满足s 2K ]Ag [])CN (Ag []CN [+--> 将平衡浓度代入,得321103100.51026.11080.3105.2a ---⨯+⨯⨯⨯⨯>=7.2⨯10-7+5.0⨯10-3 ≈ 5.0⨯10-3 (mol·L -1)答:溶液中最少应加入CN - 浓度为5.0⨯10-3 mol·L -1。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 配位化学中,配体与中心原子通过什么键结合?A. 离子键B. 共价键C. 配位键D. 氢键答案:C2. 以下哪个不是配位化合物的特点?A. 含有配位键B. 含有金属离子C. 含有非金属离子D. 含有配体答案:C3. 配位化学中,配位数指的是什么?A. 配体的数量B. 中心原子的电荷数C. 配体的电荷数D. 配体的价电子数答案:A4. 以下哪种配位化合物的几何构型是八面体?A. [Co(NH3)6]3+B. [Fe(CN)6]4-C. [Ni(CO)4]D. [PtCl6]2-答案:B5. 配位化学中,内球络合物与外球络合物的区别是什么?A. 配体的种类不同B. 配位键的数目不同C. 配位键的强度不同D. 配位键的类型不同答案:C二、填空题(每题2分,共10分)1. 在配位化学中,中心原子与配体之间的键被称为________。
答案:配位键2. 配位化合物的化学式中,通常用方括号表示________。
答案:配位离子3. 配位化学中,配体与中心原子之间的键角通常小于________。
答案:180度4. 配位化合物的命名中,配体的名称通常放在中心原子的名称________。
答案:之前5. 配位化学中,配体的配位能力与其________有关。
答案:电子密度三、简答题(每题5分,共10分)1. 简述配位化学中的配位键形成机制。
答案:配位键的形成机制是指配体向中心原子提供孤对电子,而中心原子提供空轨道,两者通过共享电子对形成配位键。
2. 描述一下配位化学中的几何异构现象。
答案:在配位化学中,几何异构是指具有相同化学式但不同空间排列的配位化合物。
例如,[Co(NH3)4Cl2]Cl·H2O可以存在两种不同的几何异构体:顺式和反式。
四、计算题(每题10分,共20分)1. 已知一个配位化合物的化学式为[Cu(NH3)4]SO4,计算其中心原子Cu的氧化态。
配位化合物习题答案

第十九章配位化合物1、[Pt(NH3)2Cl4]1、配合物:K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O螯合物:Ni(en)2Cl2, Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O简单盐:Cu(OOCH3)23、(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4、(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体H3N NO2H3N NO2Pt PtH3N Cl H3N Cl (2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体Cl Py Cl NH3Pt PtBr NH3 Br PyCl 3PtPy Br(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体3NH3NH3 NH333OH Cl(4)[Co(NH3)2(NO2)4]-八面体2种异构体23O22O2NH3NO2(5)[Co(NH3)3(OH)3] 八面体2种异构体H3H3NH3 OH(6)[Ni(NH3)2Cl2] 四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体enSCN en(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3] 八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5、该中心金属离子可能是Fe2+)2nn= 4.90 n = 4(即在八面体场中有四个成单电子八面体强场中磁矩为零,即无成单电子故Fe2+符合题意6、高自旋的有:(1),(2),(5),(7)低自旋的有:(3),(4),(6),(8)内轨型的有:(3),(4),(6),(8)外轨型的有:(1),(2),(5),(7)7、dsp28、由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”9、(1)Al3+与F-的配合物更加稳定,Al3+为硬酸;而碱F-的硬度比Cl-大(2)Pd2+与RSH配合后更加稳定,Pd2+为软酸,而RSH为软碱,ROH为硬碱。
配位化学 课后习题答案

配位化学课后习题答案配位化学是化学中的一个重要分支,研究的是金属离子与配体之间的相互作用及其形成的配合物的性质。
在配位化学中,学生常常需要通过课后习题来巩固所学的知识。
本文将为大家提供一些配位化学课后习题的答案,希望能够帮助大家更好地理解和掌握这门学科。
1. 以下哪种配体不是双电子供体?答案:氨(NH3)。
氨分子中的氮原子只能提供一个孤对电子,因此它是单电子供体。
2. 以下哪种配体不是双电子受体?答案:氯(Cl-)。
氯离子中的氯原子已经满足了八个电子,不具有受体性质。
3. 对于配合物[M(H2O)6]2+,其中M代表金属离子,该配合物的配位数是多少?答案:6。
配位数是指一个金属离子周围配位体的数量,根据该配合物的化学式可知,M周围有6个水分子配位,因此配位数为6。
4. 对于配合物[Co(NH3)5Cl]Cl2,其中Co的氧化态是多少?答案:+3。
根据化学式可知,配合物中的氯离子带有-1的电荷,而Cl2带有-2的电荷,因此配合物中的Co离子需带有+3的电荷,即Co的氧化态为+3。
5. 以下哪个配体是取代型配体?答案:CN-。
取代型配体指的是能够替代配位体与金属离子形成配合物的配体,而CN-正是一种常见的取代型配体。
6. 以下哪种配合物是八面体构型?答案:[Fe(CN)6]4-。
八面体构型是指配合物中金属离子周围八个配位体呈八面体排列的结构,而[Fe(CN)6]4-正是一个典型的八面体配合物。
7. 对于配合物[PtCl4]2-,该配合物的配位键是哪种类型?答案:配位键是配体与金属离子之间的化学键,对于[PtCl4]2-,其中的Pt与Cl之间的配位键是配位键。
8. 以下哪个配合物是高自旋配合物?答案:[Fe(H2O)6]2+。
高自旋配合物是指配合物中金属离子的自旋多重度较高的配合物,而[Fe(H2O)6]2+中的Fe离子具有高自旋状态。
9. 对于配合物[Cu(NH3)4(H2O)2]2+,其中的配体是哪个?答案:配体是指与金属离子形成配合物的非金属离子或分子,对于该配合物,配体是NH3和H2O。
配位化学考研试题及答案

配位化学考研试题及答案一、选择题(每题2分,共20分)1. 下列哪项是配位化学中配体的特征?A. 能够提供孤对电子B. 能够接受孤对电子C. 能够提供空轨道D. 能够接受空轨道答案:A2. 在配位化合物中,中心离子或原子的电荷数与配位数的乘积称为?A. 配位数B. 配位数C. 配位能力D. 配位价答案:D3. 配位化合物的几何构型通常由什么决定?A. 中心离子的大小B. 配体的类型C. 配位数D. 以上都是答案:D4. 配位化合物的稳定性主要取决于什么?A. 配体的类型B. 中心离子的电荷C. 配位数D. 配位化合物的几何构型答案:A5. 配位化合物中,配体与中心离子之间的键被称为?A. 离子键B. 共价键C. 配位键D. 金属键答案:C6. 下列哪种类型的配体是硬酸?A. 氨B. 硫氰酸根C. 碘离子D. 溴离子答案:A7. 硬碱和硬酸之间的相互作用被称为?A. 软相互作用B. 硬相互作用C. 软硬相互作用D. 非相互作用答案:B8. 配位化学中,哪种类型的配体可以提供多个孤对电子?A. 单齿配体B. 双齿配体C. 多齿配体D. 桥联配体答案:C9. 配位化合物中,中心离子的氧化态通常由什么决定?A. 配体的类型B. 中心离子的电子构型C. 配位数D. 配位化合物的几何构型答案:B10. 配位化学中,哪种类型的配体可以作为桥联配体?A. 单齿配体B. 双齿配体C. 多齿配体D. 所有类型的配体答案:C二、填空题(每题2分,共20分)1. 配位化合物中,中心离子或原子的电荷数与配位数的乘积称为配位价。
2. 配位化合物的稳定性主要取决于配体的类型。
3. 硬碱和硬酸之间的相互作用被称为硬相互作用。
4. 配位化合物中,中心离子的氧化态通常由中心离子的电子构型决定。
5. 配位化合物的几何构型通常由配位数决定。
6. 配位化学中,多齿配体可以作为桥联配体。
7. 配位化合物中,配体与中心离子之间的键被称为配位键。
智慧树知到《配位化学本科生版》章节测试答案

智慧树知到《配位化学本科生版》章节测试答案第一章1、配位化学发展史上最早见于记录的配合物是()A:普鲁士蓝KCN.Fe(CN)2.Fe(CN)3B:二茂铁C:蔡氏盐D:大环配合物答案: 普鲁士蓝KCN.Fe(CN)2.Fe(CN)32、配位化学发展史上标志着配位化学研究的开始的配合物是()A:CoCl3.6NH3B:二茂铁C:蔡氏盐D:大环配合物答案: CoCl3.6NH33、提出超分子化学概念的是()A:维尔纳B:鲍林C:道尔顿D:莱恩答案: 莱恩4、配位化学是无机化学的一个重要分支学科。
它研究的对象是配合物。
A:对答案: 对5、分子间弱相互作用与分子组装的化学称为超分子化学,它的基础是分子识别。
A:对B:错答案: 对第二章1、C6H6是σ配体、π配体、还是π酸配体?A:σ配体B:π配体C:π酸配体D:都不是答案: π配体2、根据配体的成键方式,判断下列配合物中有几类配体?章测试2-2.pngA:1B:2C:3D:4答案: 33、[Pt(NH3)2BrCl]有几种几何异构体?A:1C:3D:4答案: 24、氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH3)2]+,使铜溶解。
A:对B:错答案: 对5、外轨型配离子磁矩大,内轨型配合物磁矩小。
A:对B:错答案: 对第三章1、以下不属于配位键类型的是 ( )A:σ配位键B:π配键C:反馈π键D:金属键答案:D2、在晶体场理论中,弱场是指()A:晶体场分裂能小于电子成对能(Δ<P)B:晶体场分裂能大于电子成对能(Δ> P)C:晶体场分裂能等于电子成对能(Δ= P)D:均不正确答案:A3、Cl-离子与下列金属离子配位能力大小为()A:Cr3+>Mo3+B:Mo3+ > Cr3+C:Cr3+和Mo3+相近D:无法比较答案:B4、(M→L)π反馈键形成后,配体分子中的化学键通常()A:减弱B:增强C:不变D:无法确定答案:B5、配合物的磁矩主要决定于配位后中心离子的()A:电荷数B:成对电子数C:成单电子数D:原子序数答案:C6、下列配体中,与过渡金属离子只能形成高自旋八面体配合物的是()A:NH3B:CN-C:F-D:CO答案:C7、价键理论认为,决定配合物空间构型的主要因素是()A:中心离子对配体的影响B:配体对中心离子的影响C:配体中配位原子对中心原子的作用D:中心离子的原子轨道杂化答案:D8、配合物呈现的颜色是()A:吸收可见光的互补色B:吸收可见光的颜色C:入射光的颜色D:均不正确答案:A第四章1、原位合成时所加入的配体发生变化生成了新的配体。
配位化学习题(答案参考)

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
化学_朱文祥_第3章配位化学-习题答案
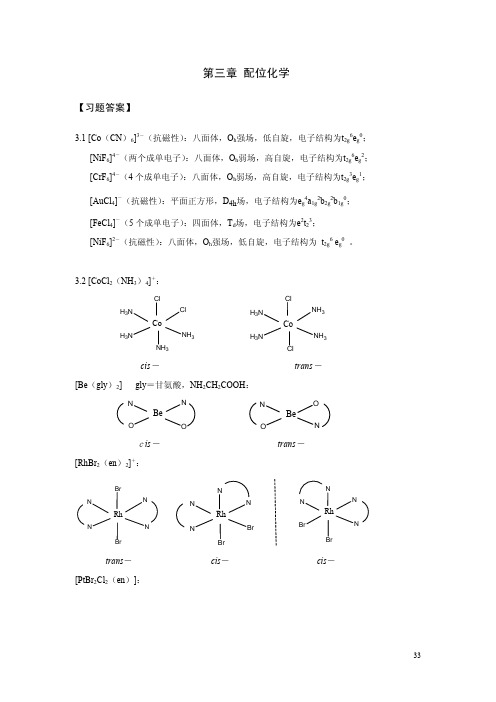
CoCl42-为正四面体构型。由于正四面体场的分裂能较小,所以(e)CoCl42-为高自旋。
3.6 配离子中的配体均为弱场配体,一般为高自旋构型。但是Co3+为d6组态,其与水分子配 位时产生的分裂能略大于电子成对能,因此(c)Co(H2O)63+为低自旋构型。
3.7 (c)的论述正确。F-为弱场配体,晶体场分裂能Δ小,CoF63-因采取高自旋构型而呈顺 磁性。
3.8 (b)Fe(H2O)62+产生Jahn-Teller效应。
3.9
H3N H3N
NO2 NH3
Co
NO2
NO2
mer-
H3N O2N
NO2
Co
NH3
NH3 NO2
fac-
3.10 具有平面四边形结构的配合物为(c)PtCl42—。
3.11 (a)4CoCl2· 6H2O + 4NH4Cl + 20NH3 + O2 → 4[Co(NH3)6]Cl3 + 26H2O (b)K2Cr2O7 + 7 H2C2O4 → 2K[Cr(C2O4)2(H2O)2]+ 6CO2 + 3H2O
3.17 粉红色固体用AgNO3溶液滴定时迅速生成 3 mol AgCl沉淀,说明 3 个Cl-在外界,粉红 色固体的化学式为 [Co(NH3)5(H2O)]Cl3,即三氯化五氨•一水合钴(Ⅲ)。受热外界的 1 个Cl-进入内界占据所失水分子的配位位点,因此紫色固体的化学式为 [CoC(l NH3)5]Cl2, 即二氯化一氯·五氨合钴(III)。
无机化学第12章配位化学基础习题及全解答

第12章 配位化学基础1 M 为中心原子,a, b, d 为单齿配体。
下列各配合物中有顺反异构体的是 (A )(A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形)2 在下列配合物中,其中分裂能最大的是 (A )(A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为(B ) (A ) 9 , (B ) 6 , (C )5 , (D )34 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯•四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰•氨•二乙二胺合铬(III )。
5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH4[Cr(SCN)4(NH3)2] ;二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl2(C2O4)en]-4。
6. 下列物质的有什么几何异构体,画出几何图形(1)[Co(NH3)4Cl2]+(2)[Co(NO2)3(NH3)3]答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。
7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。
(1)[Cd (NH3)4]2+ μm=0 ;(2)[Ni(CN)4]2-μm=0 ;(3)[Co(NH3)6]3+μm=0 ;(4)[FeF6]3-μm=μB;答:8判断下列配离子属何类配离子9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为 -3 —,配离子的空间构型为八面体,配位原子为 C(碳),中心离子的配位数为 6 ,d 电子在t2g 和e g轨道上的排布方式为 t2g6 e g0—,中心离子所采取的杂化轨道方式为 d2sp3,该配合物属反磁性分子。
普通化学:第十章配位化合物课后答案

第十章配位化合物习题答案1.指出下列配离子的形成体、配体、配位原子及中心离子的配位数。
[Cr(NH3)6]3+Cr3+NH3N 6[Co(H2O)6]2+Co2+H2O O 6[Al(OH)4]-Al3+OH- O 4[Fe(OH)2(H2O)4]+Fe3+OH-H2O O 6[PtCl5(NH3)]-Pt4+Cl-NH3O, Cl 62.写出下列配合物的化学式:(1) 三氯·一氨合铂(II)酸钾K[PtCl3(NH3)](2) 高氯酸六氨合钴(II) [Co(NH3)6](ClO4)2(3) 二氯化六氨合镍(II) [Ni(NH3)6]Cl2(4) 四异硫氰酸根·二氨合铬(III)酸铵(NH4) [Cr(NCS)4(NH3)2](5) 一羟基·一草酸根·一水·一乙二胺合铬(III) [Cr(OH)(C2O4)(H2O)(en)](6) 五氰·一羰基合铁(II)酸钠Na3 [Fe(CN)5(CO)]3.命名下列配合物,并指出配离子的电荷数和形成体的氧化数。
配合物名称配离子电荷形成体的氧化数[Cu(NH3)4][PtCl4] 四氯合铂(II)酸四氨合铜(II) +2,-2 +2,+2 Cu[SiF6] 六氟合硅(IV)酸铜-2 +4K3[Cr(CN)6] 六氰合铬(III)酸钾-3 +3 [Zn(OH)(H2O)3]NO3硝酸一羟基·三水合锌(II) +1 +2 [CoCl2(NH3)3H2O)]Cl 一氯化二氯·三氨·一水合钴(III) +1 +34.有下列三种铂的配合物,用实验方法确定它们的结构,其结果如下:物质I II III化学组成PtCl4·6NH3PtCl4·4NH3PtCl4·2NH3溶液的导电性导电导电不导电可被AgNO3沉淀的Cl-数 4 2 不发生根据上述结果,写出上列三种配合物的化学式。
(完整版)配位化合物习题及解析

《配位化合物》作业参考解析1. 下列说法正确的是A. 配合物的内界和外界之间主要以共价键相结合B. 中心原子与配体之间形成配位键C. 配合物的中心原子都是阳离子D. 螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ)B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾D. H2[PtCl6] 六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C. [Pt(en)(NH3)(CO3)]D. [Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。
配位化合物(习题参考答案)
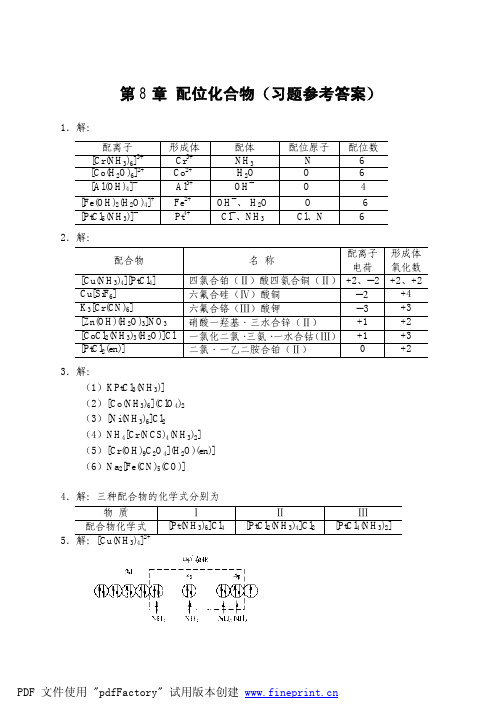
K fψ ([FeF6 ] 3− ) K fψ ([Fe (NCS) 2 ] )
= 8.91×10 10
K ψ 很大,故该反应向右进行。
*13.解: (1)[Ni(CN)4]2− + 2e− 对于电极反应:Ni2+ + 2e−
2+ ψ 2+ 2+ − ψ 2−
Ni + 4CN− Ni
E (Ni /Ni) = E (Ni /Ni) + (0.0592 V / 2) lg c( Ni 2 + ) / c ψ
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
3 4 2+
x
4
=
0.050 − x = 2.09×1013 4 x( 2.8 + 4 x )
0.050 =2.1×1013, x =3.9×10−17 4 x (2.8)
c([Cu(NH3)4]2+) ≈0.050 mol·L−1,c(NH3·H2O) ≈2.8 mol·L−1 若在此溶液中加入 0.010 mol NaOH(s),即:c(OH− ) = 0.50 mol·L−1
ψ J = 3.9×10−17 × (0.50)2 = 9.8×10−18 > K sp (Cu (OH)2)
故有 Cu (OH)2 沉淀生成。 9.解: 设 1.0 L 6.0 mol·L−1NH3·H2O 溶解 x mol AgI, 则 c([Ag(NH3)2]+) = x mol·L−1 (实 际上应略小于 x mol·L−1)c(I− ) = x mol·L−1 AgI(s) + 2NH3·H2O −1 平衡浓度/(mol·L ) 6.0 − 2 x [Ag(NH3)2]+ + I− + 2H2O x x
配位化学习题答案

配位化学习题答案
配位化学学习题答案
在配位化学中,配位化合物是由中心金属离子和周围的配体组成的。
学习配位
化学需要掌握一定的理论知识和解题技巧。
下面是一些配位化学学习题的答案,希望能帮助大家更好地理解和掌握这一知识点。
1. 问题:写出以下配位化合物的配体名称和化学式:
(a) [Co(NH3)6]Cl3
(b) K4[Fe(CN)6]
(c) [Cu(H2O)4]SO4
答案:
(a) 配体名称:氨
化学式:[Co(NH3)6]Cl3
(b) 配体名称:氰化物
化学式:K4[Fe(CN)6]
(c) 配体名称:水
化学式:[Cu(H2O)4]SO4
2. 问题:计算以下配位化合物的配位数和配体的数量:
(a) [Pt(NH3)4]Cl2
(b) [Co(en)3]Cl3
(c) [Ni(CN)4]2-
答案:
(a) 配位数:4
配体数量:4
(b) 配位数:6
配体数量:3
(c) 配位数:4
配体数量:4
3. 问题:根据配位化合物的性质,判断以下说法的正误:
(a) 配位化合物的颜色与中心金属离子的电子构型有关。
(b) 配位化合物的稳定性与配体的配位能有关。
(c) 配位化合物的磁性与中心金属离子的自旋态有关。
答案:
(a) 正确
(b) 正确
(c) 正确
通过以上学习题的答案,我们可以看到配位化学涉及到配体的命名、配位数的计算以及配位化合物的性质等多个方面。
希望大家在学习配位化学的过程中能够多加练习,加深对这一知识点的理解和掌握。
配位化学习题及答案

配位化学习题及答案
配位化学学习题及答案
配位化学是化学中一个重要的分支,涉及到配合物的结构、性质和反应等方面。
以下是一些配位化学的学习题及答案,希望能帮助大家更好地理解这一领域的
知识。
1. 什么是配合物?
答案:配合物是由中心金属离子和周围的配体组成的化合物。
配体通常是能够
提供一个或多个孤对电子给中心金属离子的分子或离子。
2. 什么是配位数?
答案:配位数是指一个中心金属离子周围配体的数量。
例如,对于[Fe(CN)6]4-
这个配合物来说,铁离子的配位数为6。
3. 什么是配位键?
答案:配位键是指中心金属离子和配体之间的化学键。
这种键通常是由配体中
的孤对电子和中心金属离子形成的。
4. 什么是配位化合物的立体化学?
答案:配位化合物的立体化学涉及到配体和中心金属离子之间的空间排布。
这
种排布对于配合物的性质和反应有很大的影响。
5. 什么是配合物的分子结构?
答案:配合物的分子结构是指配体和中心金属离子之间的空间排布。
这种排布
可以通过X射线衍射等方法来确定。
通过以上学习题及答案,我们可以更好地理解配位化学这一领域的知识。
希木
大家能够通过学习不断提高自己的化学水平,为将来的科研和工作打下坚实的
基础。
(四)配位化学答案

(四)配位化学答案一.(12分)配位化合物A 是单核配合物分子,由11个原子组成;微热后失重11.35%得到B ;B 进一步加热又失重26.66%(相对B )得到金属C ;B 极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
A 有2种异构体A1、A2,其中A2能与草酸盐反应得到一种式量比A 略大的配合物分子D (A1无相似反应)1.写出A 、B 、C 的化学式;2.写出B 溶于盐酸后产物的名称;3.试画出A1、A2、D 的结构,并比较A1、A2在水中溶解性的大小。
4.A 还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与AgNO3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
答案:1.A :Pt(NH3)2Cl2(1.5分) B :PtCl2(1分) C :Pt (1分)2.四氯合铂(Ⅱ)酸(1分)3.A1:Pt NH 3H 3NCl (1分) B :Pt Cl H 3N H 3N Cl(1分) D :Pt O H 3N H 3N O O O (1.5分)在水中溶解度较大的是A2(1分)4.(1)4种([Pt(NH3)4]重+、[Pt(NH3)3Cl]+与[Pt(NH3)Cl3]-、[PtCl4]2-组合)(1分)(2)[Pt(NH3)4][PtCl4]+2AgNO3=Ag2[PtCl4]+[Pt(NH3)4](NO3)2(2分二.(7分)某Ⅷ族不活泼金属A 溶于足量的王水生成B 的溶液(A 的含量为47.60%);将SO2通入B 的溶液中,得到C 的溶液(A 的含量为57.56%)。
已知B 、C 的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A 的元素符号;2.写出所涉及反应的化学方程式。
3.画出B 、C 阴离子的空间构型。
配位化学习题(答案参考)

配位化学习题(答案参考)配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )/doc/5016026078.html,->NH3>NCS->H2O>X-/doc/5016026078.html,->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
配位化学答案

(四)配位化学答案一.(12分)配位化合物A 是单核配合物分子,由11个原子组成;微热后失重11.35%得到B ;B 进一步加热又失重26.66%(相对B )得到金属C ;B 极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
A 有2种异构体A 1、A 2,其中A 2能与草酸盐反应得到一种式量比A 略大的配合物分子D (A 1无相似反应)1.写出A 、B 、C 的化学式;2.写出B 溶于盐酸后产物的名称;3.试画出A 1、A 2、D 的结构,并比较A 1、A 2在水中溶解性的大小。
4.A 还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与AgNO 3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
答案:1.A :Pt(NH 3)2Cl 2(1.5分) B :PtCl 2(1分) C :Pt (1分)2.四氯合铂(Ⅱ)酸(1分)3.A 1:PtNH 3H 3N Cl(1分) B :Pt Cl H 3N H 3N(1分) D :Pt O H 3N H 3N O O O (1.5分) 在水中溶解度较大的是A 2(1分)4.(1)4种([Pt(NH 3)4]重+、[Pt(NH 3)3Cl]+与[Pt(NH 3)Cl 3]-、[PtCl 4]2-组合)(1分)(2)[Pt(NH 3)4][PtCl 4]+2AgNO 3=Ag 2[PtCl 4]+[Pt(NH 3)4](NO 3)2(2分二.(7分)某Ⅷ族不活泼金属A 溶于足量的王水生成B 的溶液(A 的含量为47.60%);将SO 2通入B 的溶液中,得到C 的溶液(A 的含量为57.56%)。
已知B 、C 的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A 的元素符号;2.写出所涉及反应的化学方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位化学习题答案【篇一:配位化学及答案】ss=txt>配位化学一.(12分)配位化合物a是单核配合物分子,由11个原子组成;微热后失重11.35%得到b;b进一步加热又失重26.66%(相对b)得到金属c;b极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
a有2种异构体a1、a2,其中a2能与草酸盐反应得到一种式量比a略大的配合物分子d(a1无相似反应)1.写出a、b、c的化学式;2.写出b溶于盐酸后产物的名称;3.试画出a1、a2、d的结构,并比较a1、a2在水中溶解性的大小。
4.a还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与agno3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
二.(7分)某Ⅷ族不活泼金属a溶于足量的王水生成b的溶液(a的含量为47.60%);将so2通入b的溶液中,得到c的溶液(a的含量为57.56%)。
已知b、c的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定a的元素符号;2.写出所涉及反应的化学方程式。
3.画出b、c阴离子的空间构型。
三.(11分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)+子、h为空穴。
瑞士科学家最近发明了一种基于上图所示原理的廉价光电化学电池装置,其半导体电极由2个光系统串联而成。
系统一由吸收蓝色光的wo3纳米晶薄膜构成;系统二吸收绿色和红色光,由染料敏化的tio2纳米晶薄膜构成。
在光照-下,系统一的电子(e)由价带跃迁到导带后,转移到系统二的价带,再跃迁到系统二的导带,然后流向对电极。
所采用的光敏染料为配合物rul2(scn)2,其中中性配体l为4,4’-二羧基-2,2’-联吡啶。
1.指出配合物rul2(scn)2中配体l的配位原子和中心金属原子的配位数。
2.画出配合物rul2(scn)2的全部可能结构(键合异构体),有旋光活性的请说明。
3.分别写出半导体电极表面和对电极表面发生的电极反应式,以及总反应式。
四.(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
五.(7分)卟啉化合物是一类含氮杂环的共轭化合物,其中环上各原子处于一个平面内(结构如图1、图2)。
卟啉环中含有4个吡咯环,每2个吡咯环在2位和5位之间由一个次甲基桥连,在5,10,15,20位上也可键合4个取代苯基,形成四取代苯基卟啉。
图1 卟吩的结构图2 取代四苯基卟啉1.如果卟吩与xcl3形成配合物,写出该配合物的化学式;2.预测卟啉环(卟吩)是否有芳香性,为什么?3.卟啉环能与哪些金属离子配位,列举三种金属离子。
六.(8分)铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出它的立体结构,指出中心原子的氧化态和杂化类型。
要给出推理过程。
七.(10分)1.若a是双齿配体,易配位形成七元环,写出a的结构式。
2.确定b的化学式,并计算该化合物的磁矩。
3.写出b中的配离子所有可能的结构式。
八.(8分)研究发现,氯化钴与6-甲基吡啶-2-甲醇反应形成电中性分子的单核配合物分子,实验测得其钴的质量分数为17.4%。
1.确定该配合物的化学式;2.画出它的立体结构,指出构型。
3.实际测得该配合物分子以二聚体形式存在,且呈现双螺旋结构。
(1)二聚体分子间的作用力是什么?(2)画出该配合物的双螺旋结构。
九.(16分)ni(Ⅱ)的配合物可以形成四配位的四面体形或平面正方形,亦可形成六配位的八面体形;而ni(0)的配合物往往以四面体形的四配位形式存在。
-1.以cn和h2o为配体,写出符合下列条件的配合物化学式。
(1)一种非电解质的八面体配合物(2)两个平面正方形配合物a和b,它们均是1︰1电离类型,a 是,b是。
2.10℃下将h3bo3和nicl2在一定条件下反应,用naoh溶液中和后得钠盐c。
c是单核配合物(不带结晶水),配离子中有环状结构。
经元素分析x中w(ni)=18.82%。
画出c的结构示意图,并写出反应生成c的离子反应方程式。
3.金属ni与环稀烃d一定条件下以物质的量1︰2反应生成配合物分子e;e分子有很好的对称性,核磁共振显示e分子中只有2种类型的h原子;取一定量的e,在足量纯氧中燃烧,所得固体质量为原质量的27.15%。
画出e的结构简式。
4.金属镍一般由其氧化物的热还原法进行制备,但纯度不高。
如何由粗镍制备高纯度的镍。
2010届高中化学竞赛专题辅导(四)配位化学答案一.(12分)配位化合物a是单核配合物分子,由11个原子组成;微热后失重11.35%得到b;b进一步加热又失重26.66%(相对b)得到金属c;b极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。
a有2种异构体a1、a2,其中a2能与草酸盐反应得到一种式量比a略大的配合物分子d(a1无相似反应)1.写出a、b、c的化学式;2.写出b溶于盐酸后产物的名称;3.试画出a1、a2、d的结构,并比较a1、a2在水中溶解性的大小。
4.a还有若干种实验式相同的离子化合物。
它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。
(1)符合上述条件的离子化合物的精确的分子式有多少种。
(2)其中1种与agno3反应(摩尔比1︰2)得到两种组成不同的配合物,写出反应的化学方程式。
答案:1.a:pt(nh3)2cl2(1.5分) b:ptcl2(1分) c:pt(1分) 2.四氯合铂(Ⅱ)酸(1分)h3nclptclnh3h3nclptclh3noptoo3.a1:(1分) b:h3n(1分) d:h3n (1.5分)o在水中溶解度较大的是a2(1分)4.(1)4种([pt(nh3)4]重+、[pt(nh3)3cl]+与[pt(nh3)cl3]-、[ptcl4]2-组合)(1分)(2)[pt(nh3)4][ptcl4]+2agno3=ag2[ptcl4]+[pt(nh3)4](no3)2(2分二.(7分)某Ⅷ族不活泼金属a溶于足量的王水生成b的溶液(a的含量为47.60%);将so2通入b的溶液中,得到c的溶液(a的含量为57.56%)。
已知b、c的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定a的元素符号;2.写出所涉及反应的化学方程式。
3.画出b、c阴离子的空间构型。
答案:1.ma/0.4760-ma/0.5756=35.45n(1分) ma=97.51n (0.5分)n=2时ma=195.03n(0.5分)存在合理Ⅷ族pt(1分)2.3pt+4hno3+18hcl=3h2ptcl6+4no↑+8h2o(1.5分)h2ptcl6+so2+2h2o=h2ptcl4+h2so4+2hcl(1.5分)2.c:(八面体) d:(平面四边形)(各0.5分)三.(11分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)+子、h为空穴。
瑞士科学家最近发明了一种基于上图所示原理的廉价光电化学电池装置,其半导体电极由2个光系统串联而成。
系统一由吸收蓝色光的wo3纳米晶薄膜构成;系统二吸收绿色和红色光,由染料敏化的tio2纳米晶薄膜构成。
在光照下,系统一-的电子(e)由价带跃迁到导带后,转移到系统二的价带,再跃迁到系统二的导带,然后流向对电极。
所采用的光敏染料为配合物rul2(scn)2,其中中性配体l为4,4’-二羧基-2,2’-联吡啶。
1.指出配合物rul2(scn)2中配体l的配位原子和中心金属原子的配位数。
2.画出配合物rul2(scn)2的全部可能结构(键合异构体),有旋光活性的请说明。
3.分别写出半导体电极表面和对电极表面发生的电极反应式,以及总反应式。
答案:1.配体l的配位原子是2个吡啶环上的n,中心金属原子的配位数是6(各1分) 2.(没有旋光活性,2分)(有旋光活性,4分)3.半导体电极表面发生的电极反应式为:4h++h2o→o2+4h++-对电极表面发生的电极反应式为:4h+4e→2h2hvo2+2h2↑(各1分)总反应式为:2h2o???四.(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
答案:吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为vo(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
(3分)结论:该配合物的结构如下:(其他合理推论也可)和/或+(得分相同,2分)钒的氧化态为+Ⅳ(或答+4或v4)(1分)钒与吡啶甲酸根形成的五元环呈平面结构,因此,该配合物的配位结构为四角锥体(或四方锥体),氧原子位于锥顶。
(1分)(共7分)五.(7分)卟啉化合物是一类含氮杂环的共轭化合物,其中环上各原子处于一个平面内(结构如图1、图2)。
卟啉环中含有4个吡咯环,每2个吡咯环在2位和5位之间由一个次甲基桥连,在5,10,15,20位上也可键合4个取代苯基,形成四取代苯基卟啉。
图1 卟吩的结构图2 取代四苯基卟啉1.如果卟吩与xcl3形成配合物,写出该配合物的化学式;2.预测卟啉环(卟吩)是否有芳香性,为什么?3.卟啉环能与哪些金属离子配位,列举三种金属离子。
答案:1.c20h12n4xcl(2分)六.(8分)铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出它的立体结构,指出中心原子的氧化态和杂化类型。
