高等有机化学第十一章 卡宾
高三化学课件第十一章 有机化学基础(选修5)11-36

【解析】 芥子醇分子中含有三种含氧官能团,分别为醚 键、酚羟基和醇羟基,A错误;苯和乙烯都是平面结构,通 过单键的旋转,可以使所有碳原子处于同一平面上,B错误 ;由于酚类与溴水的取代反应通常发生在酚羟基的邻、对位 上,但芥子醇分子中这些位置均被其他基团占据,故只有碳 碳双键能与溴水发生反应,C错误;芥子醇分子结构中含有 碳碳双键、醇羟基、酚羟基,故能发生加成、取代和氧化反 应,D正确。
【答案】 B
2.(2018·广西南宁一模)香叶醛(
)是一种
重要的香料,在硫酸的作用下能生成对异丙基甲苯
(
)。
下列有关香叶醛与对异丙基甲苯的叙述正确的是( ) A.两者互为同分异构体 B.两者均能与溴发生加成反应 C.香叶醛的一种同分异构体可能是芳香醇 D.对异丙基甲苯的分子式为C10H14
【解析】 香叶醛含有O元素,二者分子式不同,不是同分
一、醇类的结构与性质 1.概念 羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇, 饱和一元醇的组成通式为___C_n_H__2n_+_1_O__H_或__C__nH__2_n+__2O____。
2.分类
3.物理性质的变化规律
4.由断键方式理解醇的化学性质 如果将醇分子中的化学键进行标号如图所示,那么醇发生 化学反应时化学键的断裂情况如下表所示。
【解析】 苯酚的酸性太弱,不能使酸碱指示剂变色,故A 错误;溴、三溴苯酚均易溶于苯,不能除杂,故B错误;苯 酚钠不溶于苯,易溶于水,可加入NaOH溶液,通过分液的 方法除去苯中少量苯酚,故C正确;浓溴水与苯酚反应生成 白色沉淀,可用于苯酚检验,而不能用稀溴水检验溶液中的 苯酚,故D错误。
【答案】 C
【答案】 D
7.(2018·武昌模拟)膳食纤维具有突出的保健功能,是人 体的“第七营养素”。木质素是一种非糖类膳食纤维。其单 体之一芥子醇的结构简式如图所示,下列有关芥子醇的说法 正确的是( )
最新有机化学第二版 高占先著 第十一章课后答案资料
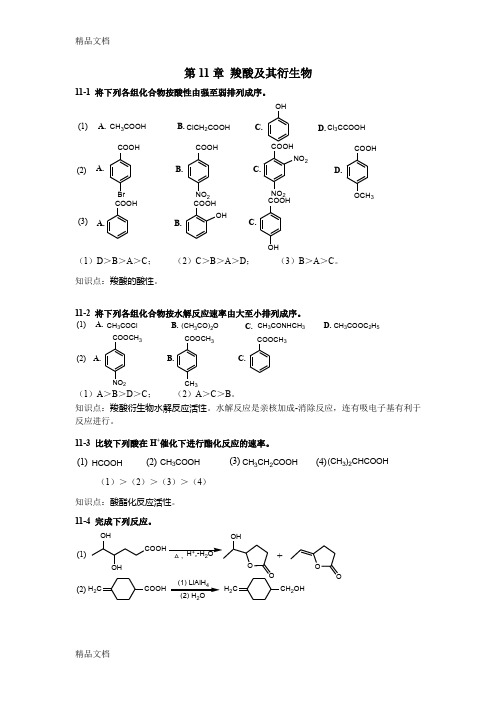
第11章 羧酸及其衍生物11-1 将下列各组化合物按酸性由强至弱排列成序。
CH 3COOHClCH 2COOHCl 3CCOOHOHA. B. C.D.A.B.C.D.COOHBr COOHNO 2COOHOCH 3COOHNO 2NO 2COOHOHCOOHCOOHOHA. B.C.(1)(2)(3)(1)D >B >A >C ; (2)C >B >A >D ; (3)B >A >C 。
知识点:羧酸的酸性。
11-2 将下列各组化合物按水解反应速率由大至小排列成序。
CH 3COCl(CH 3CO)2OCH 3CONHCH 3A. B. C. D.COOCH 3NO 2COOCH 3CH 3COOCH 3A.B.C.(1)(2)CH 3COOC 2H 5(1)A >B >D >C ; (2)A >C >B 。
知识点:羧酸衍生物水解反应活性。
水解反应是亲核加成-消除反应,连有吸电子基有利于反应进行。
11-3 比较下列酸在H +催化下进行酯化反应的速率。
HCOOH CH 3COOH CH 3CH 2COOH(1)(2)(3)(CH 3)2CHCOOH (4)(1)>(2)>(3)>(4) 知识点:酸酯化反应活性。
11-4 完成下列反应。
(1)COOHOHOHOOO+(1) LiAlH 4(2)H 2CCOOH2H 2CCH 2OHSOCl 2(3)H 3C CH 2CH 23C CH 2CH 2COClH 3COAlCl 3(分子内酰基化)(1) Zn, CH 3CH(Cl)COOEt(Reformasky 反应)(4)(2) H 2OOOHCHCOOC 2H 5CH 3(5)Br 2/红磷CH 2COOHCHCOOHBr(酰胺还原)(6)N HO(Hofmann 降解)(7)22C 6H 5H 32C 6H 5H 3(8)△H 3O(Claisen 酯缩合反应, Wittig 反应, Mannich 反应)32(9)△O(10)3(酯与格氏试剂反应,羟醛缩合反应)HCOOC 2H 5NaOC 2H5(11)+C H OHCHO(12)O O333CH 3COOC 2H 5AlPO 4(13)CH 3COOH2CH 3CH 2OHH 2CC O知识点:羧酸及其衍生物的化学性质。
引言

Part B. Reaction and Synthesis
中译本: 高等有机化学, A卷: 结构与机理; B卷: 反应与合成 夏炽中译 2. M. B. Smith, J. March March’s Advanced Organic Chemistry
Reactions, Mechanisms and Structure
高等有机化学是由物理化学和有机化学相 结合而发展起来的一门论述有机化合物的 结构、反应、机理及它们之间相互关系的 科学。
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
分子结构的 基本概念 含碳化合物的 反应性 化合物 中间体 结构
高等 有机化学
反应过程中的结构变化 反应机理
★ 自由基化学和金属有机化学等的发展,促进了高分 子材料,特 别是新的功能材料的出现。
Fullerene 化学(C60, H. Kroto, R. Smalley, R. Curl, 1996年 Nobel化学奖):有机化学中一个新的研究领域,对有机化学理论 和材料科学等产生巨大的影响。
★ 有机化学在蛋白质和核酸的组成与结构的研究,序 列测定方法的建立,合成方法的创建等方面的成就为分 子生物学的建立和发展奠定了基础。
•核酸:信息分子,担负遗传信息贮存,传递及表达功能。国际 上非常重视含硫、含氮的反义寡苷酸合成方法的研究。 多肽:特别是生物活性多肽在生物体内起着信息传递和调控的作 用。寻找高效专一性强的激动剂、拮抗剂,按化学、生物、催化 等性质合成全新蛋白质。 多糖:侧重于分离、纯化、化学组成及生物活性。 模拟酶:主客体分子,出现了催化性抗体的新策略。生物膜化学 和信息传递的分子基础是生物有机的另一重要研究领域,对医学、 卫生、农业生产均会产生深远影响。
化学知识补充概括

分子结构 struture(constitution) 分子中原子的连接次序和方式以及在空间的排布。
分子结构至少应包括分子的构造、构型和构象,结构是一个广义的概念,有时还与“构造”一词混同泛用。
构造 constitution 分子中原子的连接次序和方式,即指具有一定分子式的物质,其分子中各原子成键的顺序和键性。
构型 configuration 具有一定构造的分子中各原子在空间的排列状况。
构象conformation 在一定的条件下,由于单键的旋转而产生的分子中各原子(或原子团)在空间的不同排布形象。
构型和构象虽然都是表述分子的立体模样或空间形象的概念,但两者不能并列,构象比构型更为精细。
在室温下,分子的一种构象可以通过单键的“自由”旋转,变成另一种构象。
一般地讲,分子的构型是不能通过单键的旋转而改变的,必须通过化学键的断裂和形成才能改变分子的构型。
手性 Chirality 也称手征性,物质的分子和它的镜象不能重合的性质。
手性是物质具有旋光性和产生对映异构现象的充分必要条件。
手性分子 Chiral molecule 具有手性的分子称为手性分子。
手性分子一定具有旋光性,并存在一对对映体。
对映体 Enantiomer对映异构体的简称,两个互为镜象的立体异构体。
在非手性条件下,对映体具有相同的物理和化学性质。
非对映体Diaseromer 非对映异构体的简称,两个不呈镜象关系的立体异构体。
非对映体的物理性质不同。
由于具有相同的官能团,同属一类化合物,因而化学性质相似,即可发生相同类型的化学反应,但活性不同。
次序规则sequence rule 各种原子或取代基按其原子序数的大小排列成序的规则,顺、反异构体的Z、E标记法和手性中心的构型R、S标记法,都是按次序规则来进行标记的。
立体选择反应Stereoselective reaction 一个反应不管反应物的立体化学如何,如果生成的产物只有或主要是某一种立体异构体(或一对映体),这样的反应叫做立体选择性反应立体专一反应 Stereospecific reaction从立体化学上有差别的反应物分别给出立体化学上有差别的产物的反应对映体过量百分数(%e,.e.) enantiomeric excess percent 评价手性合成优劣的一种指标。
官能团的去除

CH3 OAc
2)磺原酸酯的的热消除——楚加耶夫反应
此反应与羧酸酯的热解相似,也为顺式消除,通常首先 制备黄原酸酯,然后将其直接或在惰性溶剂中加热。
优点:热解温度较低(100-200 oC),无异构化和重排产物生成; 缺点:多步合成黄原酸酯,热解时掺杂含硫杂质。
4.β-羟基酸可与多种试剂作用脱羧兼脱水生成烯烃。例如:
卡宾反应:又称碳宾、碳烯,通常由含有容易离去基团的分子 消去一个中性分子而形成。一般以R2C:表示,指碳原子上只有两个 价键含有基团,还剩两个未成键电子的高活性中间体。其寿命远 低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和 观察
卤代烷的α-消除反应 多卤代烷在碱作用下,消除α-H,得卤代 烷基负离子,但不稳定,再消除一个卤离子,得卡宾。 例如:
β-氯代醚的消除 的产率。
β-氯代醚用强碱处理可生成炔醇,且具有良好
炔烃在用碱处理时,会发生碳碳三键的位置异构。
α-二酮的脱氧 在氮气存在下与亚磷酸三乙酯一起共热可脱 氧生成炔烃。 例如:
O C6H5 C O C C6H5 (C2H5O)3P/N2 C6H5 C C C6H5
二、羟基的去除
常用的脱水剂有酸(硫酸,磷酸,草酸等)、酸性氧化物
高等有机化学 ——官能团的除去
讲解内容
卤代烃脱卤化氢
醇脱水
季铵盐及其碱的热解
羧酸酯、黄原酸酯、氧化叔胺的热 解
引入碳碳双 键或三键
其他消除反应
一、卤代烃的消去反应
卤代烷的α-消去反应 烯) 同一原子上失去两个基团 ,生成卡宾(碳
邢大本的错误纠正

邢大本的错误纠正作者:exoto上册P278~P279E1Cb邢大本描述,“这表明邻二卤代烷的消除肯定是反式消除,因而也是立体选择的”。
虽然说得是I-采取的反应,但是这句话本身是肯定不对的。
现有研究已经指出,该反应机理往往比较复杂,并与试剂和反应条件有关,以邢大本提出的Zn为例,发现有时候反应是反是立体专一的,有时候则不是。
何况,正常来说,顺势消除也并非不能发生(只是非常非常的慢,但如果是唯一途径,比如两个离去集团的二面角在过渡态时无法达到180度,顺势消除也是会发生的),这和底物结构也是有关的。
P337卡宾,单线态和三线态的卡宾杂化状态并非sp2和sp,或者不是纯粹的,这点键角角度能看出来。
P379习题9-11(i)以及炔烃的硼氢化氧化这个问题显著的与高等有机的介绍存在冲突,邢大本认为,烯基硼烷可以通过简单的B2H6与末端炔反应产生醛基,而事实上,这是错误的。
这个反应真实的情况是会产生双次的硼氢化,而很难停在一员取代上,如果希望得到最终产物醛,则需要大位组的硼烷比如邻苯二酚基硼烷或者与BHBr2-SMe2反应。
P494环戊二烯负离子,这页中间的大图里,环戊二烯负离子和EtBr发生SN2,产物却是苯基环戊二烯,这显然是印刷错误。
P325烯烃过氧化机理邢大本认为这个机理是过酸与烯烃产生了5元环的中间体,然后再通过消去羧酸得到的环氧化物。
这个机理是错误的,现有的量化计算已经详细得分析了过酸氧化烯烃的机理,以及过渡态的构型,给出LUMO的是过酸的O原子,而不是那个1,3偶极体。
这个过渡态的构型更像是五元环的过酸与烯烃交与O原子上,P554,wacker氧化反应这个反应的机理也是不准确的,正确的机理如wiki所说【其他网友】这个图总体上来说没有大问题,但是有几个地方不加以文字解释的话会产生很大的误解。
维基啥的,谨慎。
首先一个小小的不准确,在乙烯可逆的取代了一个氯离子后,水也很快的取代了乙烯对位的那个氯离子(当然这个反应也是可逆的),所有对Wacker反应机理的动力学研究都是从cis-[(C2H4)(H2O)PdCl2]起始的。
有机化学 第十一章

Section 3 chemical properties
3.1 acidity and saltforming reaction
3.1.1 acidity
CH3COOH + H2O CH3COO- + H3O+
羧酸的酸性强于酚、醇、及其他含氢化合物
O
O H C O
O
123pm
136pm
H C O
Section 3 chemical properties
在共轭体系中情况较为复杂
COOH COOH COOH COOH COOH
OH
CH3
Cl
NO2
4.57 4.38 4.19 -I & +C +I & +sHC 供电子性:-OH > -CH3
3.97 –I & +C
3.42 –I & –C
吸电子性:-NO2 > -Cl
③pKa1<pKa2
pKa1 1.23 2.83 4.16 4.34 ① pKa2 4.19 5.69 5.61 5.41 ②
④
① –COOH的吸电作用,随碳链增长而减弱 ② –COO- 的供电作用,随碳链增长而减弱 COO③从H–OOC(CH2)nCOO- ④CH 场效应 2 + 负离子中,不易再解离H COOH
X O R C OH OCOR' OR' NH2 O R C X O O R C O C R' O R C OR' O R C NH2
酰卤 酸酐 酯 酰胺
羧酸衍生物——羧酸中的羟基被其它基团取代的化 合物。 通式:
O R C L O R C
acyl group
高等有机化学 课件-中国药科大学 练习题答案

练习题一、名词解释1、三线态卡宾(Triplet carbene)卡宾是H2C: 及其取代衍生物的通称,也叫碳烯,含有一个电中性的二价碳原子,该碳原子上有两个未成键的电子,属于中性活泼中间体,通常由含有容易离去基团的分子消去一个中性分子而形成。
三线态卡宾的碳原子为sp杂化,生成的两个杂化轨道分别与其他原子形成σ键,而未参与杂化的两个p轨道中各有一个未成键电子,自旋平行。
2、前线分子轨道(Frontier Molecular Orbital)原子轨道线性组合形成分子轨道,在填充有电子的分子轨道中,能量最高的轨道叫最高占有分子轨道(HOMO);在未填充电子的分子轨道中,能量最低的分子轨道叫最低未占分子轨道(LUMO)。
HOMO与LUMO能量接近,HOMO上的电子被束缚得最松弛,最容易激发到能量最低的LUMO中去,组成新轨道,HOMO和LUMO是决定一个体系发生化学反应的关键,被称为前线分子轨道。
3、协同反应(Concerted reaction)是指反应过程中旧键的断裂和新键的形成同步进行,反应的过程中不产生离子或自由基等活性中间体,只有过渡态的动力学基元反应。
如周环反应、协同亲核取代反应(S N2)、协同消除反应(E2)等。
4、逆合成分析(Retrosynthesis)有机合成路线设计的基本方法,其实质是将目标化合物(Target Molecule)合理地分割成简单的合成子(Synthon),反推出合成所需的基本化学原料。
基本要求是反应步骤少,反应产率高,起始原料简便易得,有合适且合理的反应方法和反应机理作保证。
5、合成砌块(Synthetic block)带有较复杂官能团的合成原料称合成砌块。
6、不对称合成(Asymmetric synthesis)不对称合成即手性合成,将一种含前手性中心、前手性轴或前手性面的非手性化合物,与光学纯的化合物(手性试剂)反应形成新的光活性化合物,是对映选择合成的一种有效方法,文献上常叫“不对称合成”,属于立体选择反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十一章卡宾
11.1 卡宾的定义
C:表示,卡宾(carbene),又称碳烯,一般以R
2
指碳原子上只有两个价键连有基团,还剩两个未成键电子的高活性中间体。
卡宾的寿命远低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和观察。
它的存在已被大量实验所证明。
卡宾的两个未成键电子既能自旋方向相反,处于单线态,也可自旋方向平行,处于三线态。
取哪种状
C:的两种态应视取代基和制备方法而异。
下式为H
2
状态:
单线态和三线态卡宾
11.2 卡宾的轨道
1CH2H f=110.856KCAL/MOL3CH2H f=80.809KCAL/MOL
11.3 卡宾的立体结构
烷基卡宾
三线态卡宾的结构,最简单是用中心碳原子sp杂化来描述。
两个sp杂化轨道和两个氢原子成键,两个没有杂化的p轨道,每一个容纳一个电子。
这是形成两个σ键和最大程度降低所有六个电子的电子与电子之间相互排拒的最有效的形式。
三线态卡宾的分子构型是线性的。
由于每一个p轨道只容纳了一个电子,因而可以把三线态卡宾看作是一个双游离基。
事实上,它们在许多方面的表现也确是如此。
单线态卡宾最简单是用中心碳原子sp2杂化来描述。
在这三个sp2杂化轨道中,有两个和氢原子成键,第三个容纳孤电子对。
没有杂化的p轨道保持是空的。
这是对三个电子对的最大程度减少电子与电子之间排拒作用的最有效的形式。
单线态的几何构型是弯的,由于孤电子对对C-H 键的排拒作用,键角小于120°。
单线态卡宾同时显示了碳负离子的独电子对和碳正离子的空p轨道。
实际上,这样考虑的单线态和三线态的结构是过于简单化的。
最近的计算和测定的结果:单线态卡宾的键角约为103°,三线态键角约为136°。
单线态和三线态之间的能量差别也曾经见诸报导,三线态比单线态稳定,能量差约为8∼9千卡/摩尔。
芳基卡宾
电子自旋共振谱表明芳基卡宾的基态是三线态。
反应物光解首先形成单线态卡宾,然后自旋反转,形成三线态卡宾。
三线态的esr信号的寿命比较长,在77K长达几小时。
芳基卡宾的esr谱表明芳基卡宾有一个未成对电子和芳香π体系共轭,一个未成对电子和它垂直。
基态三线态芳基卡宾是弯的,这里,一个p轨道和芳香体系重叠,从而在77K阻碍了旋转。
11.4 卡宾的生成
(1)活泼的乙烯酮或重氮化合物分解
(2) α-消去反应
二卤卡宾的稳定性和卤素的电负性是密切关联的。
卤素的电负性越大,二卤卡宾的稳定性越高。
(3) 三卤乙酸的碱脱羧反应
(4)碳正离子中间体的α-消去反应
(5)光消去反应
(6)三卤甲基汞衍生物分解反应
(7) 强碱与烷基锂的作用
11.5 卡宾的反应卡宾是典型的缺电子的化合物,它们以亲电子反应为特征。
1.和负离子反应二氯卡宾很容易和卤离子结合,形成CX 3 -,然后接受质子,形成卤仿。
与中性分子(如水)作用,形成溶剂化产品,也是常见的。
2. 对多重键反应(合成环状结构)
b.卡宾和C=N ,C=P ,N=N 等双键也能发生加成反应。
例如,二氯卡宾加成到重氮化合物(A)形成烯烃
(B)。
a.烯烃
对N=N双键加成,并不形成二氮杂环丙烷;用偶氮二甲酸酯捕集卡宾,形成重排产品。
c.苯
卡宾和叁键也能发生加成反应。
3. 对单键反应
4. 重排反应
饶有兴趣的是:使用光学活性环丙烷作用物,给予光学活性丙二烯,反应具有高度的立体选择性。
这种重排,考虑是顺旋开环。
但是,这里可能有两种顺旋开环,导致两种不同的对映体。
可以预计开环按非键张力最小的途径进行。
芳基卡宾在溶液中虽然不倾向于重排,但是在气相加热则发生重排。
5. 二聚反应
在溶液中进行反应,卡宾几乎不发生二聚;这里,卡宾的浓度很小,两个分子相遇以前,已然和作用物发生反应,或者分子内部发生反应,形成了新的产品。
但是,在闪光分解、或者温热的惰性模床的条件下,则二聚产品是常见的。
11.6 单线态和三线态卡宾反应的特点
1. 对单键反应
单线态卡宾(协同机理)
反应产物具有立体选择性
三线态卡宾(自由基机理)
反应产物无立体选择性
2. 对π键反应
单线态卡宾(协同机理)
反应产物具有立体选择性
三线态卡宾(自由基机理)
反应产物无立体选择性
单线态卡宾选择性比较小。
在C-H插入反应中只有很小的选择性。
和异戊烷反应,选择性依次3°>2°>1°,比例为1.5:1.2:1。
在烯烃环加成中,由于取代基的不同,在速度上只有很小的改变。
这些选择性数据表明单线态卡宾反应对自由基稳定性不敏感。
三线态卡宾与不同类的C-H键反应的选择性比较大,选择性依次3°>2°>1°,比例约为7:2:1。
对烯烃的活泼性表现的范围也比较大,例如,在气相,三线态卡宾与丁二烯-1,3的反应比与乙烯的快19倍。
这些情况很容易在形成最稳定的双自由基或自由基对的基础上来解释。
