药品不良反应分析报告实例
药物分析药物不良反应案例分析-”欣弗“事件

P果
国家食品药品监督管理局和安徽省有 关部门根据药品管理法和有关法规,对造成 “欣弗”不良事件的安徽华源生物药业有限 公司和相关责任人作出处理:
∎一、由安徽省食品药品监督管理局没收该 企业2006年6月以来生产已销售“欣弗”药 品的违法所得,并处以2倍罚款;
PART ONE
04 思考与总结
思考与总结
∎ 有关部门重把“出生关”,轻把“监护关” ,重发证,轻管理,是主要原因。如此 ,不少GMP企业生产的药品事实上成了“ 免检产品”,一些企业“按规矩办事”的意 识因此变得麻痹,致使GMP这一原本具 有较强“质量自律”功能的规范,丧失了“ 保安”效能。
∎ “欣弗事件”闹得沸沸扬扬,事实证明 ,药品的安全性不在药价高低,而在于生 产者和使用者是否严格按照规定流程生产 和使用。“欣弗事件”的警示意义在于: 当我们注意了医药领域销售环节的不正之 风之后,决不能忽略了药品生产者这一药 品安全性的最基础环节。
——以上信息源自新华网2008年对“欣弗”事件的回顾
PART ONE
02 “欣弗”事故原因分析
原因——①
TEXT
∎10月16日上午,安徽省通报了欣弗不良事件的处理结果,并
TEXT
详细描述了“欣弗”事件的过程。
TEXT
TEXT
∎安徽省通报:由于安徽华源生物药业有限公司在生产克林霉
素磷酸酯葡萄糖注射液(欣弗)过程中,未按批准的工艺参数
“欣弗”事件
01 “欣弗”事件概述 02 “欣弗”事故原因分析 03 “欣弗”处理结果 04 思考与总结
PART ONE
01 “欣弗”事件概述
诚实做人,诚信做事
欣弗注射液
名称:克林霉素磷酸酯葡萄糖注射液 批准文号:国药准字H20010813 性状:无色或几乎无色的澄明液体
医院药品不良反应总结分析报告

医院药品不良反应总结分析报告一、引言医院作为提供医疗服务的机构,扮演着维护人民健康的重要角色。
然而,即使在药品生产、使用过程中严格遵守规范,仍然无法完全避免药品不良反应的发生。
本报告旨在对医院药品不良反应进行总结和分析,以提供科学有效的对策,减少不良反应对患者健康的危害。
二、药品不良反应的发生情况根据最近一年的统计数据,本医院共收集到药品不良反应报告200例,其中男性占55%,女性占45%。
不良反应主要集中在30岁至60岁之间的患者(占80%),而在70岁以上的老年患者中不良反应发生率较低。
不同科室中,内科(40%)和外科(30%)的发生率最高,其次为儿科(20%)和妇产科(10%)。
三、药品不良反应的类型根据分类统计,药品不良反应主要分为以下几类:药物过敏反应、不良药物相互作用、药物滥用/错误使用及剂量过大、药物毒性反应、药物副作用。
其中,药物过敏反应占不良反应总数的40%,不良药物相互作用占30%,药物滥用/错误使用及剂量过大占20%,药物毒性反应占5%,副作用占5%。
四、药物过敏反应的原因和对策药物过敏反应主要是由于患者对其中一种成分或药物敏感所致。
对于患者进行详细的过敏史询问和药物过敏试验是发现患者是否存在过敏反应的有效方法。
对于过敏反应较轻的患者,建议停止使用该药物,并及时使用抗过敏药物进行处理。
对于过敏反应较严重的患者,建议在医生指导下逐步减少药物使用剂量,或者寻找其他适用的替代药物。
五、不良药物相互作用原因和对策不良药物相互作用主要是由于多种药物同时使用,导致药物之间相互干扰或增强药物的作用。
医生在开具处方时应充分了解患者的病史和正在使用的药物,并仔细评估可能的相互作用。
对于可能存在相互作用风险的药物应选择其他药物代替,或者采取适当的剂量调整措施。
六、药物滥用/错误使用及剂量过大原因和对策药物滥用/错误使用及剂量过大主要是由于患者自行调整药物使用剂量,或者医生在处方时考虑不周导致的。
198例药品不良反应报告分析

对使用的药 品种类及其构成 的 比例、 给药途径及 不 良反 应 的症状 进行 分 类 。
2 结 果
2 . 1 A D R 的年龄 、 性 别分 布
A D R的性别分布女性多于男性 , 女性 1 0 5 例, 男性 9 3例 , 男 女 比例 1 : 1 . 1 2 。老 年 患 者 发生 A D R多 于青 壮年 患者 , A D R在不 同 年龄 段 的分 布
参 考 文献 :
[ 1 ] 刘俊 田. 药理 学[ M] . 郑州 : 郑州大 学出版社 , 2 0 0 4 : 8 [ 2 ] 张慧英, 薛凤 霞.阴道 炎 性 疾 病 治 疗 中的过 度 不足 [ J ] . 中国实用 妇科与产科杂 志 , 2 0 1 1 , 2 7 ( 7 ) : 5 0 6 [ 3 ] 狄文 , 徐亚 楠. 盆腔 炎性疾 病 的抗 生 素治疗 [ J ] . 中国 实用妇科 与产 科杂志 , 2 0 1 2 , 2 8 ( 7 ) : 4 9 6
3 4 7
代 谢 动力 学 , 更 应 该 重 视 药 物对 胎 儿 和新 生 儿 的
致畸性和毒副反 应 , 全面权衡抗 菌药对孕产妇 的 治疗 作用 及对 围生儿 的潜 在危 害 。 综上所述 , 在选择抗菌素时 , 不仅要掌握抗 菌 药物使用 的基本要求、 注意事项 , 熟悉 了解抗菌谱 和抗 菌 活 性 , 还应考虑老人 、 儿童 、 妊 娠 期 和 哺乳 期 的生理变化对 药物代谢 方面 的影 响, 正确选择 能有 效 控 制感 染 , 同 时对 胚 胎 、 胎儿 、 新 生儿 无 损 害的抗菌药物。严格 执行 《 抗菌药物 临床应用指 导原则》 ] , 才能更好地保障安全用药 , 科学、 合理 使用抗菌药物。
药品不良反应分析报告实例完整版

药品不良反应分析报告实例完整版药品不良反应分析报告实例HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】药品不良反应分析报告(20 年月--20 年月)生产企业: (盖章 )地址:联系人:电话:报告日期:一、企业监测体系建设概况我司于2006年已建立药品不良反应报告和监测体系,并有效实施。
2012年按《药品不良反应报告和监测管理办法》(卫生部令第81号)》和《浙江省药品不良反应报告和监测管理实施细则》完善我司药品不良反应监测体系、组织机构,明确其职责。
我司监管网络为一线销售人员从医院收集药品不良反应报告,汇总至市场部相关人员。
市场部相关人员将数据汇总至相应QA人员,QA人员将数据上报至国家药品不良反应监测系统中。
组织机构:我司处理药品不良反应/事件的专职部门为质量保证部,监测部门为市场部。
组成人员:质量负责人、质保部负责人、一名市场部人员、一名QA人员。
职责:(1)市场部人员和QA人员及时收集与公司生产的药品有关的安全性信息,发现与公司有关的药品不良反应,及时通过药品不良反应监测信息网络报告。
每年向所在地药品不良反应监测机构提交药品不良反应监测工作报告;(2)对严重药品不良反应或者药品群体不良事件进行调查,必要时对药品采取紧急控制措施,如召回;(3)配合各级食品药品监督管理局、卫生行政部门和药品不良反应监测机构对药品不良反应或者群体不良事件的调查,并提供调查所需的资料,并填写《药品不良反应/事件报告表》,填报内容应真实、完整、准确。
(4)开展药品不良反应报告数据与药品质量的关联性研究,必要时进行重点监测或再评价;(5)按要求撰写和提交定期安全性更新报告;(6)正确介绍药品的使用要求和注意事项等,将说明书修改等安全性信息及时告知相关药品经营企业和医疗机构。
(7)经常查阅国家食品药品监督管理局定期通报国家药品不良反应报告和监测情况。
二、公司品种概况我司现有1个品种:****(批准文号:国药准字*****)。
药品不良反应的案例

药品不良反应的案例药品不良反应是指在正常用药剂量下,药物引起的不良症状或体征。
不良反应可能会对患者的身体健康造成严重影响,甚至危及生命。
以下是一些药品不良反应的案例,希望能引起大家对药品使用的重视和警惕。
案例一,阿司匹林过敏反应。
小王因头痛服用了阿司匹林片,结果出现了皮肤瘙痒、红肿、呼吸困难等过敏症状。
经医生诊断确认为阿司匹林过敏反应。
阿司匹林是一种常用的镇痛药,但也是一种常见的致敏药物。
过敏体质的患者在使用阿司匹林前应先进行皮肤过敏试验,以免引发不良反应。
案例二,抗生素肝损伤。
小李因感冒服用了抗生素,结果出现了恶心、呕吐、黄疸等肝损伤症状。
经检查发现是抗生素引起了肝功能异常。
抗生素是一类常用的抗菌药物,但长期或过量使用会对肝脏造成损害。
患者在使用抗生素时应按照医嘱用药,避免自行增减药量或延长用药时间。
案例三,非甾体抗炎药胃溃疡。
小张因关节疼痛服用了非甾体抗炎药,结果引发了胃部疼痛、黑便等胃溃疡症状。
经胃镜检查确认为非甾体抗炎药导致的胃溃疡。
非甾体抗炎药是一类常用的镇痛消炎药,但长期或大量使用会对胃黏膜造成损伤。
患者在使用非甾体抗炎药时应避免空腹服用,同时注意保护胃部。
案例四,心脏药物心律失常。
小刘因心脏病服用了心脏药物,结果出现了心悸、胸闷、心律失常等症状。
经心电图检查确认为心脏药物引起的心律失常。
心脏药物是一类常用的治疗心脏病的药物,但不同药物对心脏的影响也不同。
患者在使用心脏药物时应定期进行心电图检查,及时发现心律失常的情况。
以上案例提醒我们,药品不良反应可能随时发生,患者在用药过程中应注意以下几点,首先,严格按照医嘱用药,避免自行增减药量或延长用药时间;其次,定期进行身体检查,及时发现药物不良反应;最后,对于过敏体质的患者,应提前进行过敏试验,避免引发严重不良反应。
总之,药品不良反应是一个需要引起重视的问题,患者在用药过程中应谨慎对待,避免因药物不良反应而导致身体健康受损。
希望大家能够加强对药品不良反应的了解,做到用药安全、科学、合理。
99例药品不良反应报告分析
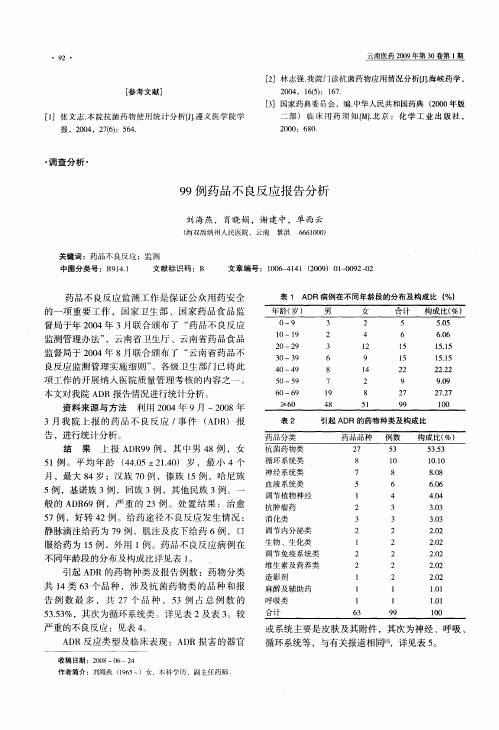
2 .引 起 A R的 药 物 种类 ,给 药 途 径 及 临 床 D
表 现 :从 表 3和 表 4看 出 ,抗 菌 药物 类 引 起 的 不
良反 应 比例 明 显 高 于 其他 类 药 物 ,以左 氧 氟 沙 星 和 青 霉 素 发 生 率最 高 ,不 良反 应 主要 表 现 过 敏 性 休 克 、呼 吸 困难 ,皮疹 、瘙 痒 、精 神 异 常 等 , 以 过 敏反 应 多见 。 中药 注 射 液 AD R发生 率 较高 ,一 旦 发 生 比较 严 重 ,如 细辛 脑 注射 液 引起 的过 敏 性 休 克 ,莪 术 油 引起 的 四肢 抽 搐 ,溶 血 。近 年 来 中 药 制 剂 在 临 床 上 使 用 越 来 越 广 泛 , 由其 引 起 的 A R特 别 是 中药 注射 剂 不 容 忽 视 。有 文 献 报 道 , D 中药 注 射 剂 与 其 他 药 物 联 合 、混 合 用 药 是 导 致
云南医药 2 0 年第 3 卷第 1 09 0 期
[]林志强. 2 我院门诊抗菌药物应用情况分 析【. J海峡药学 , 1
[ 参考文献] []张文志 . 院抗菌药物 使用统 计分析 【. 医学 院学 1 本 J遵义 1
报 ,2 0 ,2 ( :5 4 04 76 ) 6. 2 0 ,1(1 17 0 4 65: 6 .
例次 ,构 成 比为 1 . %。 41 4
讨
论
1 D .A R病 例 的年 龄 、性别 、民族 分
布 特点 :从 表 1中看 出 AD R发 生性 别 无 差异 ;在 6 0—6 年龄 段发 生 A R 的病例 最高 ,这 与老 年 9岁 D
人发生 A DR的 比例 高 于 其 他 人 群 的报 道 相 伺 I l l 。 老 年 人 由于 肝 肾代 谢 功 能 减退 ,对 药 物 的敏 感 性
药品不良反应报告表填写示例及填写说明
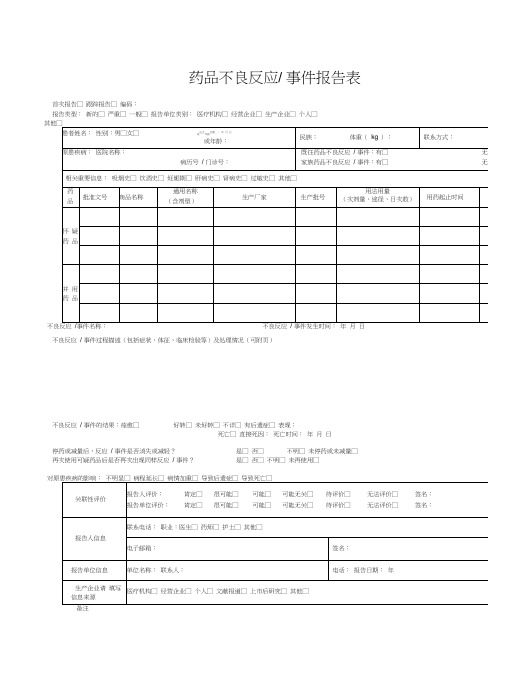
药品不良反应/ 事件报告表首次报告□ 跟踪报告□ 编码:报告类型:新的□ 严重□ 一般□ 报告单位类别:医疗机构□ 经营企业□ 生产企业□ 个人□不良反应事件名称:不良反应事件发生时间:年月日不良反应/ 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/ 事件的结果:痊愈□好转□ 未好转□ 不详□ 有后遗症□ 表现:死亡□ 直接死因:死亡时间:年月日停药或减量后,反应/ 事件是否消失或减轻?是□ 否□不明□ 未停药或未减量□再次使用可疑药品后是否再次出现同样反应/ 事件?是□ 否□ 不明□ 未再使用□电子邮箱: 签名:×××药 品 不 良 反 应 / 事 件 报 告 表示例不良反应 / 事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页) 一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×× ×时间出现×××反应(反应描述须明确、具体) ,×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂 和其他处理措施) ,处理后×××时间患者转归情况。
对原患疾病的影响: 不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:××× 报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:×××报告人信息患者姓名:×××性别:男□女□出生日期: 年 月 日 或年龄: ××民族:××体重( kg ):××联系方式:××××××原患疾病:指患者此次入 诊的主要疾病(如果有多 疾病可以补充在相关重要 是备注里面),不能写字院或就 种慢性信息或 母缩写。
92例药品不良反应报告分析

2 1 患者基本情 况 .
在9 2例 A R报告 中, 3 D 男 3例, 5 女 9例; 有过敏史者 8例, 无过敏史者 6 , 4例 不详者 2 ;其 中单 一用药 6 O例 7例, 合并用
例 (15 % , 3 . 2 ) 无后遗症和死亡病例, 对原患疾 病无明显影响 8 4
例 (13 % 。 9 .0 ) 绝大 多数 发生 A R的患者经过及 时停药和对症处 D 理后能够治愈, 对原患疾病 的影响不明显。详见表 1 。
[ 5 a i , h r n R E n , t a . 1 y m r a t c p o r 1 e 2 ]T l a M A a o , d a P e 1 A l l e c p o a t p i :a n w a t h p r e s v r g J . rJo y e t n in 2 0 , 7 1 :7 - 7 . n i y e t n ied u [] A fH p r e s o , 0 4 1 () 1 3 Ⅱ
2 0 年 1 月第 1 卷第 1 期 08 2 5 2
中国中医药信息杂志
・O ・ 1 7
● 医 院 药 学 ●
9 例药 品不 良反应报 告分析 2
黄咏梅 邓景赞 ,
(. 1 广州市 白云区人 民医院药剂科, 广东 广州 5 0 0 :2 广州市奇星药业有 限公司, 15 0 . 广东 广州 5 0 1) 13 0
t r u h p 8 A K i e n t lr t J .C i e e J u n l o h o i h o g 3 M P n n o a a a [] h n s o r a f C r n c
2 3 关 联 性 评 价 .
自 《 药品不 良反应报 告和监测管理办法》正式实施 以来, 本院加 强了药品不 良反应 (D ) 告和监测力度 , 取各种措 AR报 采 施对 其加 以学 习、宣传, A R上报工作有 了一定进展 。为更 使 D 好地促进 A R工作 的开展, D 现就本 院 2 0 0 7年收集 的 9 2例 A R D 报告进行 统计 分析 , 以增强医务人员对 A R 的上报 意识 , D 掌握 A R发生特点, D 降低 A R发生率, D 促进 临床合理用药 。
药品不良反应报告案例 [某院2008~2009年208例药品不良反应报告分析]
![药品不良反应报告案例 [某院2008~2009年208例药品不良反应报告分析]](https://img.taocdn.com/s3/m/6dd7bcab2b160b4e777fcf6a.png)
《药品不良反应报告案例 [某院2008~2009年208例药品不良反应报告分析]》摘要:收集某院2008年1月1日至2009年9月30日间的ADR报告208份,采用回顾性分析的方法分类,统计其一般情况、药物种类、临床表现、给药途径等,药物种类涉及抗微生物药物、中药注射剂、心脑血管系统药物、解热镇痛药、呼吸系统、消化系统、激素类、生物制品等,其中抗菌药物28种94例,中药注射剂18种56例,具体结果详见表2,王慧媛,赵捷,赵志刚.我院2009年药品不良反应报告分析.中国药房,2008,19(17):1345. [2] 国家药典委员会编.中华人民共和国药典.临床用药须知.化学药和生物制品卷.人民卫生出版社,2005:775. [3] 李荔,赵环宇,杨静,等.我院医保处方分析.中国医院用药评价与分析,2009,9(3):194. [4] 顾奋觉.抗生素的合理应用.上海科学技术出版社,2004:9-10. 本文为全文原貌未安装PDF浏览器用户请先下载安装原版全文【摘要】目的分析药品不良反应的发生特点与一般规律,促进合理用药。
方法对某院2008年1月1日至2009年9月30日间收集到的208例ADR报告进行回顾性分析。
结果 208例不良反应中,涉及抗菌药物94例,占45.19 %,中药注射剂56例,占26.92%。
静脉给药引起的不良反应155例,占74.52%。
ADR的临床表现以皮肤及其附件损伤最为常见,其次是消化系统损害等。
结论应加强专业人员的业务培养和素质培养,合理使用抗感染药物及中药注射剂,减少不合理用药,以减少和避免ADR的发生。
【关键词】药品不良反应;抗感染药物; 报告; 分析近年来,随着新药的不断出现和临床用药品种的日益增多及联合使用药物的增加,药物不良反应和药源性疾病已引起广大临床医务工作者的关注。
为了全面了解医院不良反应发生情况及相关因素,加强对ADR的报告、监测和分析评价,对临床用药安全性提供信息,现将某院2008~2009年收集到的208例有效ADR报告进行回顾性分析,旨在促进临床安全、合理、有效用药提供参考依据。
2024年医院药品不良反应总结分析(二篇)

2024年医院药品不良反应总结分析摘要:本报告对医院药品不良反应进行了综合分析和总结,以便为医院管理层和医务人员提供参考,以优化药品使用和提高患者安全。
通过对药品不良反应的分类、发生率、原因和预防措施的研究,本报告得出了一些有价值的结论和建议。
第一部分:引言药品不良反应是指在合理使用药品的情况下,患者出现的对药物不良反应。
不良反应的发生率不仅影响患者的安全和治疗效果,也会对医院的声誉和医务人员的形象产生负面影响。
因此,对药品不良反应进行总结分析是非常必要的。
第二部分:分类和发生率根据药品不良反应的性质和严重程度,我们将其分为常见不良反应、严重不良反应和罕见不良反应三类。
对医院的总体药品不良反应进行分析,发现常见不良反应高发,占总反应的70%,严重不良反应占20%,罕见不良反应占10%。
第三部分:原因分析1. 药物因素:- 不同药物对不良反应的易感性不同。
- 药物的质量问题可能导致不良反应的发生。
2. 患者因素:- 个体差异是导致患者对同一药物出现不良反应的重要因素。
- 存在的基础疾病和同时使用的其他药物也会影响不良反应的发生。
3. 医务人员因素:- 用药过程中的错误操作和不当用药可能导致药物不良反应的发生。
- 医务人员对药物不良反应的认知和防范意识不足也是重要原因。
第四部分:预防措施1. 药物因素:- 对于常见不良反应的药品,应加强监测和预警,确保其安全性。
- 对于严重不良反应高发的药品,需重新评估其合理性和适应症。
- 对于罕见不良反应高发的药品,应加强严格的审批和管理。
2. 患者因素:- 医务人员应充分了解患者的基础情况,对易感患者进行个体化用药方案制定。
- 患者应主动告知个人过敏史和正在使用的其他药物,以便合理避免不良反应的发生。
3. 医务人员因素:- 提高医务人员的药物不良反应认知和职业素养,加强相关培训和教育。
- 强调用药操作的规范和标准,严格遵守制定的用药流程和安全操作规程。
第五部分:结论针对医院药品不良反应的总结分析,我们得出以下结论:- 常见不良反应是医院药品不良反应的主要类型,需重点关注。
医院药品不良反应总结分析报告.doc

医院药品不良反应总结分析报告.doc 药品不良反应(ADR)是指正常剂量的药物用于预防、诊断、治疗疾病或调节生理功能时出现的与用药目的无关和有害的反应。
ADR 监测是医院药学的重点工作内容,药品安全监测的重要手段,也是保证患者用药安全的有效途径。
为保障患者用药安全,找出现行工作中存在的薄弱点,进一步提高ADR监管工作的成效。
通过帕累托图分析,笔者在11个大类别共计158种药品中快速筛选出了抗感染药物、抗肿瘤药物、心血管系统药物和中药注射剂是引起ADR的主要因素。
鱼骨图是一种发现问题“根本原因”的方法。
用鱼骨图对引起ADR的要因进行深层次的原因分析,有助于理清思路,更好地寻找改进方法。
结果分析如下:1与高龄、女性患者相关的因素本研究结果显示,发生ADR的患者中,女性居多,>61患者占比较高。
高龄患者易发生ADR的原因如下:(1)肝、肾功能减退,对药物代谢、消除能力减退;(2)生理功能减退,靶器官对药物作用的敏感性增加;(3)合并多种基础疾病,联合用药多,药物相互作用复杂;(4)免疫功能下降,易感因素增多。
女性患者易发生ADR的主要原因分析如下:(1)月经期、妊娠期和哺乳期时,免疫功能下降,对药物较为敏感;(2)特殊的生理解剖特点,与男性身体素质存在差异,更易发生ADR。
因此,临床医师用药时应注意性别和年龄差异;临床药师应对老年、女性患者加强用药监测和用药宣教,制订合理的给药方案,提高患者用药依从性,减少ADR的发生。
2与静脉给药相关的因素静脉滴注的药物直接进入血液循环,无肝脏首过效应,达峰时间短,使得一些患者不能耐受,易出现药物ADR,因此静脉滴注引起的ADR一般在患者用药后很短的时间内就会发生。
同时,静脉给药时药物稀释浓度、pH值、渗透压、滴注速度、药物配伍、内毒素及热原等均可能引发ADR。
因此,临床应谨慎选择静脉途径给药,严格遵守“能口服不静脉注射,能静脉注射不静脉滴注”的原则,静脉滴注过程中加强用药监测。
我院203例药品不良反应报告分析

我院 23 0 例药品不良反应报告分析
张晓庆 李蓓华 刘 明忠
上海 203 ) 0 4 3 ( 同济大 学附属肺科 医院药剂科
摘
要 目的 : 过对 2 3 药 品不 良反 应 报 告进 行 统 计 分 析 , 临床 安 全 用药 提 供依 据 。方 法 : 用 回顾 性分 通 0例 为 采
析 , 究药品 不 良反 应的发 生 与 患者性 别 、 研 年龄 及 用 药情 况 的 关 系。结 果 :0 2 3例 药 品 不 良反 应 中 , 性 多 于女性 ; 茵 男 抗
药物的不 良反应 最 多 , 次是抗 肿 瘤 药物 ; 其 药品不 良 应 的 临床表 现 主要 以皮 肤及 其 附件 损 害 为主 。结 论 : 强 药品不 反 加
vd h vd n efrrto a s fd u si lnc lp a tc n e u e te ic d n er t fADR. M e ho s:T u . ie t e e i e c o ain u eo r g n ci ia rcie a d rd c h n ie c aeo l t d woh n
Zh n a qn a g Xio ig,L i u iBeh a,Li i z o g u M ngh n
( ea m n o h r aet s P l oayH sil fl t o ̄ nvri , hnh i 04 3 D pr et f am cui , um n r op a Afi e t T n i i sy S aga, 03 ) t P c t i a d o U e t 2 A S R T Ob ci : naa s nte 0 des r co A R eo sno r opt a m d r— B T AC j t e A n yio 3avr at n( D )r  ̄ u si l s ae o o e v l s h2 ee i p i h aw tp
药品不良反应100例分析

ed r , co nigfr O cue yA e jr o t fnrv n u d ii ain a cu t gfr 4 ADRmot o lel ac u t %; asdb DRit o ueo t eo s m ns t ,co ni %; y n o6 s ma r h i a a r t o no 7 sc mmo l i l nfs t n nci c i t i s n a ma ea o
2 1 年 2月第 9卷 第 6期 0 1
・
论
著 ・ 3 5
药 品不 良反 应1 0 例分析 0
李 峰 ( 南省 商丘 市第一人 民医 院,河南 商丘 4 6 0 ) 河 7 10
【 要】 目的 分析 药品不 良反应 ( D 摘 A R)的特 点 和 发生 情况 , 为临床 合理 用药提 供科 学的依据 。方法 收集 商丘 市 第一人 民医 院 2 0 09年 7
月至 2 1 年 1 00 O月发生 药品 不 良反应 的 10例 患者 的 临床 资料 ,对 A 0 DR的 临床 表现 、 药品种 类、 用药途 径 等进 行 回顾性 分析 。结 果 10 0
例A DR报 告 中, 中老 年人 发生率 最 高 , 占 6 %;引起 A R 的主要 用药途 径 为静 脉给 药 ,占 7 % ;A R 最 常 见的 ・床 表现 为皮肤 及 其 附 0 D 4 D 临
文 献标 识码 :B
文章 编号 :17- 14 (0 1 6 0 3- 2 6 1 8 9 2 1 )0 - 0 5 0
Ana yss of 1 0 C a e d r e D r e c ons l i 0 s s ofA ve s ug R a t i LIFe g n 、
105例药品不良反应报告分析

随 着 医药 事业 的迅 速 发展 和 临 床用 药 数 量 与 品种 的不
断增加 , 药品不 良反应 ( DR 也时有发生 。笔者对 我院 2 0 年 A ) 08 11 ~ 2月 收 集 的 15例 A R报 告 进 行 回顾 性 分 析 . 引 起 0 D 以 临 床医 、 、 人 员对 A 护 药 DR的重 视 , 一步 推进 A R监 测 和 进 D
原 因之 一 。
15例 A 0 DR中 ,静 脉滴 注 8 4例 (0 0 ,口服 1 8 . %) 0 8例 (Z 4 , 用 3例 ( . %) 共 涉 及 药 品 7 I 1%)外 28 6 ; 0种 , 中抗 感 染 其
药物 引起 的 A DR占总例数 的 5 .5 共 6 9o %( 2例 。 中氟喹诺 酮 其 类最 多 , 2 为 9例 , 占总例数 的 2 . %) 中药制剂 引起 的 AD 72 . 6 R 有 2例 , 0 占总例数 的 1.5 90 %。具 体见 表 2 。
采用 描述性 方 法 , 分别 按 患者 一般 情 况 、 药途 径 、 物 给 药 种类 、 告来 源 以及 AD 报 R临床表 现 等进 行统计 分析 。
2 结 果 2 1一 般 情 况 .
A
墨 曼 垒 旦 墨丝: 望 鲨墨 量塞垦 堕墨墨
I 表 现 临床 例数 构成 比( %)
15例 AD 0 R报告 中 , 4 男 3例 , 6 女 2例 , 年龄 最 小 4岁 , 最大 8 8岁 , 中以> 0岁 年 龄组 AD 其 6 R发 生率 最 高 。各年 龄
150例药品不良反应报告分析

年 收集到的 10例 A R 5 D S报告 进 行分 析。结果
了解我院药 品不 良反应 ( D S 发生特点 , AR) 促进临床 合理用药。方法 对我院 2O O7 我 院药 物不 良反应 报告 中, 感 染 药物 引起 的最 多 抗 ( 86 %) 其次为中药制剂 (46 % ) D S临床表现以皮肤及附件最常见(6 o% )其次为消化系统 4 .7 , 1.7 OA R 2 .0 , (93%) 1.3 。结论 应合理使用抗感染药物和中药注射剂 , 加强临床用药监测 , 以减少 A R 的发生。 DS 【 关键词】 药品不 良反应 ; 用药监测 ; 分析
【 e od] A v e r atn( D s ; ei tn oir A a s K yw rs de u r cosA R )M d ao n o; n ys s r d ge i ci m t l i 药 品不 良 反应是 医药 界高 度重视 而又 难 以彻底解 决 的 问题 。药 品不 良反应 ( D S 监 测是合 理用 药 的重要依 据 , A R)
【 摘要】 目的
Ad es rgR a t n : n ls f10 css J NG W iG O L— i i i. eat et fP 8_ v reD u e c o sA ayi o 5 ae I e. U i n MO Y- n Dp r n 危 r i s A m g q m o
c i e e me ii e e e r t n s . d me i a o nt rs o l e sr n t e e O鹊 t r v n n e u e h n s d cn s w r a o a u e a d c t n mo i h u d b te gh n d S i l n i o o p ee t drd c a h n i e c so RS t e i cd n e fAD .
资料药品不良反应分析报告实例

资料药品不良反应分析报告实例报告编号:XXXX/2024报告时间:2024年X月X日1.引言不良反应是指在正常用药剂量范围内,由于药物的药理作用或其他原因,引起患者出现的有害症状或体征。
及时准确地分析药品不良反应对于制定合理的临床用药方案、保障患者用药安全非常重要。
2.药品信息药品名称:XXX批准文号:XXX生产企业:XXX使用剂量:XXX3.不良反应描述根据患者反馈和医生报道,使用药品XXX后出现不良反应如下:3.1XX不适症状描述不适症状,如头痛,恶心、呕吐等。
3.2XX体征改变描述体征改变,如皮疹、腹泻等。
4.不良反应报告统计统计所有该药品不良反应的发生情况,包括发生率、时间分布等。
4.1不良反应发生率药品使用范围内,不良反应发生率为XX%。
4.2不良反应时间分布不良反应主要发生在用药初期,60%的不良反应在首次使用后48小时内出现。
5.不良反应风险因素分析基于患者特征、药品特征等因素,分析导致不良反应的可能风险因素。
5.1患者特征分析患者的年龄、性别、病情等特征对不良反应的影响。
比如,年龄大于65岁的患者更容易出现不良反应。
5.2药品特征分析药品的药理作用、药代动力学等特征对不良反应的影响。
比如,该药品的副作用与其在肝脏中的代谢机制相关。
6.不良反应处理措施提出针对不良反应的处理措施,包括调整用药剂量、联合用药、停药等。
7.不良反应预防建议提出预防不良反应的建议,包括临床使用上的提示、监测措施等。
8.结论根据以上分析,我院对药品XXX的不良反应进行了全面的分析与统计,并提出了相应的处理和预防建议,以确保患者在用药过程中的安全。
附录:不良反应报告表格表格包括不良反应的具体描述、出现时间、症状严重程度等。
某院对药品不良反应报告分析

药品不良反应 ( D A R)是指药品正常的用法用量下发生的与用药
容易发生妊高症等并发症,并且容易早产;巨大儿是妊娠合并糖代谢
异常 最常见 的并发症 ,因此 ,加强妊娠期糖代谢 异常孕妇 的管理 ,应 对糖 代谢异常孕妇早 发现 、早诊 断、严格监控 ,加 强孕 前健康指导 、
孕期检查、做好孕期管理,使母婴的预后有了明显改善,降低并发症
的发 生显。对妊娠 期糖代谢异常 的产妇要通过饮食 、运 动和 ( )胰 或 岛素等 的治疗 ,将血糖控制在满意范 围内。
参 考文 献
数资 料采用) [ z 检验。
2结 果 见表 1 。
[】 韩瑞花, 1 王鲁萍, 朱萍.7 例妊娠期糖代谢异常的血糖控制及妊 19
娠 结局分 析 [ 冲 国妇幼保 健 , 0 , (7: 1—8 6 J ] 2 8 32) 853 1. 0 2 3 [ 李颖 . 妊娠 期糖 代谢 异 常对母 儿 预后 的影 响【 . 中医药 2 】 分析 J 中国 】
内生长发育的主要能源,随着孕周的增加,胎儿对葡萄糖需求量也增 多 ,孕妇空腹血糖逐渐下降,随着孕周的增加,胎盘分泌的多种激
素 ,也逐渐增加 ,各种抗 胰岛素激素于2 ̄ 8 时决速上升 ,在3-4 4 2周 23 周达 到高峰 ,此时 胰岛素抵 抗作用最 强。孕妇 应在2 ̄ 8 时进行孕 4 2周 期糖 尿病筛查 ,降低母 儿并发症 。妊娠期糖 代谢 异常是妊娠 期最常 J 见 的并发症之一 ,已经威胁到威 胁孕妇的健康 。本 文研 究发现糖尿病 合 并妊娠的产妇 由于糖尿病病程 较长 ,病情程度相对 较重 ,所 以产妇
低 ,而引起机体 内糖 代谢发生变 化。孕妇血 中的葡 萄糖 是胎儿在子宫
周 在 门诊行5 葡 萄糖 负荷试验 ( C ) ,血糖 ≥1. m l 者直 0g G T 1 mo/ 2 L 接 进行 空腹 血糖 测定 ,两次 空腹血糖 ≥58 o/ ( 0 /L . mm l >l5mgd ) L
药品监管中的药品不良反应报告与分析案例研究方法探究与应用实例

药品监管中的药品不良反应报告与分析案例研究方法探究与应用实例药品不良反应(Adverse Drug Reaction,简称ADR)是指在合理用药过程中,以预期剂量和途径使用所致的不良医疗事件。
药品不良反应的监测、报告与分析,对于保障公众用药安全至关重要。
本文将探究与应用实例介绍药品不良反应报告与分析的案例研究方法。
一、药品不良反应报告的重要性及时准确地报告药品不良反应是药品监管系统中的关键环节。
通过药品不良反应报告,可以及时发现和确认药品的潜在风险,进而采取相应措施,保护患者用药安全。
同时,药品不良反应报告也有助于对药品的疗效和安全性进行监测和评估,以便制定更科学的用药策略。
二、药品不良反应报告与分析的案例研究方法1. 回顾性研究法:回顾性研究法是指通过对已有的病例记录和临床资料进行分析,来评估药品不良反应的发生率和相关因素。
这是一种常见的药品不良反应研究方法,可以从大量的病例中筛选出与特定药物有关的不良反应,并进行统计学分析,得出相关结论。
2. 前瞻性研究法:前瞻性研究法是指在一定时间内对特定药物的使用进行监测和记录,以评估其不良反应发生率和严重性。
这种方法可以较好地捕捉到不良反应的发生,有助于了解药物的安全性。
3. 自愿性报告系统:自愿性报告系统是指建立一套自愿性报告机制,鼓励医生、药师和患者主动向监管机构或药品生产企业报告药品不良反应。
这种方式可以迅速了解到不良反应事件,但其缺点是报告的主观性较强,不能代表全面的不良反应情况。
三、案例研究方法的应用实例1. 基于回顾性研究法的案例:通过回顾性研究,研究人员发现某药物使用后出现了较高的不良反应率。
进一步分析发现,这些不良反应主要与特定的基因多态性相关。
基于这一发现,监管机构可以提醒医生在给予该药物时注意患者的基因型,以降低不良反应的风险。
2. 基于前瞻性研究法的案例:通过前瞻性研究,研究人员发现一款新上市的药物,在药品不良反应的监测中显示出很好的安全性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品不良反应分析报告
(20 年月--20 年月)
生产企业:(盖章)
地址:
联系人:
电话:
报告日期:
一、企业监测体系建设概况
我司于2006年已建立药品不良反应报告和监测体系,并有效实施。
2012年按《药品不良反应报告和监测管理办法》(卫生部令第81号)》和《浙江省药品不良反应报告和监测管理实施细则》完善我司药品不良反应监测体系、组织机构,明确其职责。
我司监管网络为一线销售人员从医院收集药品不良反应报告,汇总至市场部相关人员。
市场部相关人员将数据汇总至相应QA人员,QA人员将数据上报至国家药品不良反应监测系统中。
组织机构:
我司处理药品不良反应/事件的专职部门为质量保证部,监测部门为市场部。
组成人员:
质量负责人、质保部负责人、一名市场部人员、一名QA人员。
职责:
(1)市场部人员和QA人员及时收集与公司生产的药品有关的安
全性信息,发现与公司有关的药品不良反应,及时通过药品不良反应监测信息网络报告。
每年向所在地药品不良反应监测机构提交药品不良反应监测工作报告;
(2)对严重药品不良反应或者药品群体不良事件进行调查,必要时对药品采取紧急控制措施,如召回;
(3)配合各级食品药品监督管理局、卫生行政部门和药品不良反应监测机构对药品不良反应或者群体不良事件的调查,并提供调查所需的资料,并填写《药品不良反应/事件报告表》,填报内容应真实、完整、准确。
(4)开展药品不良反应报告数据与药品质量的关联性研究,必要时进行重点监测或再评价;
(5)按要求撰写和提交定期安全性更新报告;
(6)正确介绍药品的使用要求和注意事项等,将说明书修改等安全性信息及时告知相关药品经营企业和医疗机构。
(7)经常查阅国家食品药品监督管理局定期通报国家药品不良反应报告和监测情况。
二、公司品种概况
我司现有1个品种:****(批准文号:国药准字*****)。
20**年1月1日至9月30日,我司对该品种进行了生产.........
无监测期品种和重点监测品种。
三、产品基本信息和不良反应收集情况
(一)不良反应反馈数据核实情况:
无。
(二)反馈数据涉及产品的基本信息:
产品的批准文号、通用名称、剂型、统计周期内的销量、不良反应报告例数、严重的不良反应例数及其构成比、新的一般的不良反应例数及其构成比、死亡病例数见附表1。
我司无文号转入或转出情况。
(三)其他不良反应信息收集情况:
在此次报告时间段内,我司未收集到到涉及本企业药品的不良反应或可疑不良反应信息情况。
四、公司产品近3年的不良反应发生趋势情况汇总
****年我司共收到***不良反应报告**例,不良反应发生率为‰,其中新的一般的2例,无严重病例和死亡病例。
****年我司共收到***不良反应报告**例,不良反应发生率为‰,其中新的一般的3例,无严重病例和死亡病例;
****年我司共收到***不良反应报告**例,不良反应发生率为‰,其中新的一般的**例,无严重病例和死亡病例。
公司产品近3年的不良反应发生趋势情况汇总见附表2。
五、综合评价分析(按品种分别分析)
(一)品种1
1、不良反应发生趋势及主要不良反应表现:
在此次报告时间段内,出现使用***的药品不良反应***例,只有皮肤及其附件损害。
皮肤系统瘙痒症状**人次、一般皮疹症状**人次........统计周期内***总体的不良反应表现见附表3。
上述收集的不良反应除个别病例外(见下面分析)均为一般不良反应。
不良反应症状在***说明书【不良反应】和【注意事项】中均有说明。
在此报告时间段内,收集的病例中有**例严重不良反应。
对其不良反应过程描述分析,均不属于***的严重不良反应。
****年第一季度反馈数据中1例药物性皮炎为严重不良反应。
不良反应过程描述(表格表编码:*****):****。
分析:此病例显示的不良反应为皮肤瘙痒、水肿性红斑,***不良反应中有瘙痒、红肿症状,水肿性红斑为红肿症状,故此例病例属于已有的一般不良反应,非严重的不良反应。
****不良反应清楚、明确,无严重不良反应,是一安全性很高的外用制剂,其安全性相关研究等相关工作已经研究的比较透彻。
2、需关注的风险信号:
在此次报告时间段内,无死亡病例、新的严重不良反应。
不良反应发生频率未提高。
3、临床使用问题:
在此次报告时间段内,未发现超范围、超剂量、超适应症使用情况,配伍禁忌和不合理溶媒情况。
4、其他注意事项:
无。
六、风险管理计划
针对该产品的风险点,列出风险管理计划或安全风险管理建议。
(一)存在影响产品安全的风险因素及改进措施:
严格按批准的注册工艺和2010修订版GMP要求进行生产、储存、运输临床使用、人员培训。
(二)品种是否需要修改产品说明书或产品内部核心数据(必要时说明拟修改项及内容、进展情况);
***暂不需修改产品说明书和产品内部核心数据。
(三)品种是否需要开展重点监测和上市后安全性研究工作(必要时说明计划或实施进度);
今后将对本产品的不良反应等情况进行收集、研究。
(四)其他(对医疗机构、监管单位等的建议)。
无。
附表1
产品基本信息(按不良反应报告数由多到少依次列明)
注:严重的不良反应:包括严重的和新的严重的不良反应
附表2
公司近三年不良反应发展趋势(自行增减品种)
附表3
***不良反应表现
注:1、此表按系统损害总例次数量由多到少排序。
2、不良反应表现中,若有多个不良反应名称,请列出前10位的不良反应名称和发生数量,其余以省略号表示。
