完整版双向电泳原理与流程
(完整版)双向电泳原理与流程

GE Healthcare Life Sciences ——实现从发现到功能研究,从体外到体内的突破
GE Healthcare milestones in 2-D electrophoresis
2002
Amersham Biosciences launched Ettan™ DIGE
1991
Pharmacia Biotech introduced Immobiline DryStrip
1973
1978
1982
LKB introduced Immobiline™
1979
Pharmacia Fine Chemicals introduced Pharmalyte™
The first multiple separation system, ISO-DALT, was developed
4/ GE Title or job number /
2/3/2020
Why 2DE?
Only “Proteomics” is the large-scale screening of the proteins of a cell, organism or biological fluid, a process which requires stringently controlled steps of sample preparation, 2-D electrophoresis, image detection and analysis, spot identification, and database searches.
2/3/2020
双向电泳

30% Acrylamide储液
搅拌溶解 10% NP40 两性电解质(pH3~9.5) 10% 过硫酸铵*
1.6 mL
1.5 mL 0.50 mL 15 µ L
TEMED*
10 µ L
State Key Laboratory of Food Science and Technology
PART 3 实验方法 (3)灌制第一向凝胶 取1支1 mL注射器和一根长针头,吸取约0.5mL第一向凝胶
约7~8 h)停止电泳。如果聚焦好的凝胶不能马上进行第二向电
泳,在管内放置了几小时以上, 可在走第二向电泳之前再聚焦 电泳1~2h,以消除样品受扩散的影响。 (7)退胶 电泳结束后,在整极端凝胶内插入约1cm长的铜丝作为标
记,用洗耳球从玻璃管上样端轻轻挤入空气,将凝胶退胶或
用10mL注射器和长针头吸入一定的蒸馏水,将长针头一边沿 管壁推入一边注入蒸馏水使凝胶退出。
入覆盖溶液至管口。
(5)安装电泳槽 加样后将玻璃管插入电泳槽的架子上,在上
槽中玻璃管上端露出1 cm,剥去玻璃管下端的封口膜,准备 电泳。在电泳槽的下槽加2000 mL 10 mmol/L H3PO4溶液,将 柱胶下端浸入到H3PO4溶液中,注意胶下端不可有气泡(如果
有气泡,可以先用注射器将胶下端用H3PO4溶液灌满,再将
冰箱中可保存3~4个星期。
State Key Laboratory of Food Science and Technology
PART 3 实验方法 3.实验步骤 (1)准备玻璃管 取4支18 cm的长玻璃管,洗净晾干。
表1 第一向凝胶溶液配方 尿素 重蒸水 3.84 g 2.0 mL
(2)配制第一向凝胶溶液(8mL /4组) 配制方法见表1。
双向电泳详细操作过程
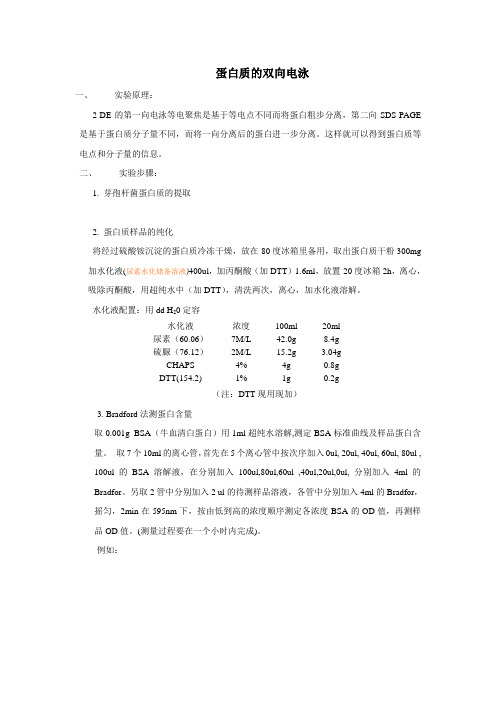
蛋白质的双向电泳一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE 是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:1. 芽孢杆菌蛋白质的提取2. 蛋白质样品的纯化将经过硫酸铵沉淀的蛋白质冷冻干燥,放在-80度冰箱里备用,取出蛋白质干粉300mg 加水化液(尿素水化储备溶液)400ul,加丙酮酸(加DTT)1.6ml,放置-20度冰箱2h,离心,吸除丙酮酸,用超纯水中(加DTT),清洗两次,离心,加水化液溶解。
水化液配置:用dd H20定容水化液浓度100ml 20ml尿素(60.06)7M/L 42.0g 8.4g硫脲(76.12)2M/L 15.2g 3.04gCHAPS 4% 4g 0.8gDTT(154.2) 1% 1g 0.2g(注:DTT现用现加)3. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 20ul, 40ul, 60ul, 80ul , 100ul的BSA溶解液,在分别加入100ul,80ul,60ul ,40ul,20ul,0ul, 分别加入4ml的Bradfor。
另取2管中分别加入2 ul的待测样品溶液,各管中分别加入4ml的Bradfor,摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
例如:标准曲线方程式:Y= aX+b.其中Y为OD值,X为蛋白含量。
a、b通过作图输入数据可知G250的配置:称取G250 固体0.1g加水定容至1L。
使用前滤纸过滤。
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
双向电泳的原理应用

双向电泳的原理应用1. 原理介绍双向电泳是一种用于分离和分析蛋白质的技术。
它利用电场的力作用将蛋白质分子根据其大小和电荷分离成不同的带状条带,从而实现对蛋白质的分离和分析。
在双向电泳中,电泳液在两个方向(水平和垂直)上施加电场。
水平的电场用于推动蛋白质分子在凝胶中移动,而垂直的电场用于将蛋白质分子根据其电荷进行分离。
2. 双向电泳的步骤双向电泳通常包括以下几个步骤:2.1 凝胶制备首先制备凝胶,常用的凝胶包括聚丙烯酰胺凝胶和聚酰胺凝胶。
凝胶的选择取决于所要分析的蛋白质的分子量范围。
2.2 样品制备将待分析的蛋白质样品进行处理,通常包括蛋白质提取、蛋白质纯化和蛋白质标记等步骤。
2.3 水平电泳将样品加载到凝胶上,并将凝胶放入水平电泳槽中。
施加水平电场后,蛋白质会根据其分子量在凝胶中移动,形成水平方向上的分离。
2.4 凝胶固定水平电泳后,将凝胶固定,通常使用乙醇或甲醛进行固定,以防止蛋白质在后续步骤中的移动。
2.5 垂直电泳固定后的凝胶被垂直放置,然后施加垂直电场。
此时,蛋白质会根据其电荷进行进一步的分离。
2.6 染色和可视化分离完成后,凝胶通常会被染色,以便观察和分析分离的蛋白质条带。
常用的染色方法包括银染和荧光染色。
3. 双向电泳的应用双向电泳在蛋白质分离和分析方面具有广泛的应用。
3.1 蛋白质组学研究双向电泳可以用于研究蛋白质组学,包括蛋白质的组成、结构和功能等。
通过双向电泳可以分离出不同的蛋白质条带,从而有助于研究蛋白质的表达和变化。
3.2 蛋白质质量测定双向电泳可以用于测定蛋白质的质量。
通过与已知质量的蛋白质进行比较,可以确定待测蛋白质的质量范围。
3.3 蛋白质互作研究双向电泳还可以用于研究蛋白质之间的相互作用。
通过在凝胶中一同加载多个蛋白质样品,可以观察到不同蛋白质之间的相互作用。
3.4 蛋白质标记双向电泳常常与蛋白质标记技术结合使用。
通过将蛋白质样品与荧光染料或同位素标记剂结合,可以在凝胶上可视化和定量分析蛋白质。
双向电泳操作步骤

双向电泳操作步骤双向电泳操作步骤及相关溶液配置A(实验过程一实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。
这样就可以得到蛋白质等电点和分子量的信息。
二实验步骤:1. 样品的溶解取纯化后的晶体蛋白3.0mg,加入300ul裂解液(1mg蛋白:100ul裂解液)振荡器上振荡10min左右,共处理一个小时。
其中每隔10,15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70ul,—80oC保存。
2. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0ul, 5ul,10ul, 15ul, 20ul 的BSA溶解液,另2管中分别加入2 ul的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80ul),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。
(测量过程要在一个小时内完成)。
3. 双向电泳第一向---IEF(双向电泳中一律使用超纯水)3.1 水化液的制备称取2.0mg 的DTT,用700ul水化液储液溶解后,加入8ul 0.05, 的溴酚兰,3.5ul(0.5,v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。
在含300ug 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340ul,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。
3.2 点样,上胶分两次吸取样品,每次170ul, 按从正极到负极的顺序加入点样槽两侧,再用镊子拨开 Immobiline DryStrip gels (18cm,pH 3—10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。
双向凝胶电泳原理(一)

双向凝胶电泳原理(一)双向凝胶电泳什么是双向凝胶电泳双向凝胶电泳,英文名字为Bisulfite-Sequencing PCR,缩写为BSP,是一种检测DNA甲基化的方法。
双向凝胶电泳主要是将DNA进行酶切、连接、甲基化等处理,然后采用PCR扩增方法得到一组产物,经过电泳反应,通过测量DNA片段长度的差异和带的强度来检测DNA的甲基化状态。
双向凝胶电泳的原理双向凝胶电泳的原理是利用亲核性亚硫酸酯对甲基化的DNA进行转化,通过反应后将DNA分成两条互补链,在两条链上分别添加标记,如磷酸酯和辣根过氧化物酶等。
其中,磷酸酯标记的DNA是单链的,而辣根过氧化物酶标记的DNA是双链的,可以通过电泳移动。
在电泳过程中,根据DNA带的大小和强度,判断DNA片段的长度和甲基化状态。
双向凝胶电泳的步骤双向凝胶电泳需要进行以下五个步骤:1.DNA甲基化转化:将DNA处理为亲核性亚硫酸酯,反应生成甲磺酰脲基化的DNA片段。
2.PCR扩增:将转化后的DNA进行PCR扩增,得到一组产物。
3.芯片制备:将PCR扩增产物用聚丙烯酰胺凝胶电泳进行分离,然后将DNA嵌入在聚合物芯片上。
4.双向标记:在两个DNA链上分别添加辣根过氧化物酶和磷酸酯等标记。
5.双向凝胶电泳:将DNA芯片通过电泳反应,根据DNA带的大小和强度,判断甲基化的DNA状态。
双向凝胶电泳的应用双向凝胶电泳主要应用于检测DNA甲基化状态、遗传疾病、肿瘤等方面。
在癌症研究中,双向凝胶电泳可以检测癌细胞的DNA甲基化状态,有助于癌症的早期诊断、治疗以及预测复发等方面。
此外,双向凝胶电泳还可以应用于基因组学、生物研究、医学科研等方面。
总结双向凝胶电泳是一种检测DNA甲基化状态的方法,通过亲核性亚硫酸酯对DNA进行转化,采用PCR扩增方法得到产物,再通过电泳反应来判断DNA片段的长度和甲基化状态。
双向凝胶电泳在生物研究、医学科研和癌症研究方面的应用非常广泛,未来也将是一个热门的研究方向。
双向电泳原理及实验步骤

银染(Silver Stain Plus™ stain)
荧光染色(SYPRO® Ruby protein gel stain)
适用于质谱的染色方法
考马斯亮蓝染色
银染的检测灵敏度很高,可达到200pg,但其线性很差。普通的银染过程中因醛类的特异反应,而与下游质谱不兼容。
快速银染法,可与下游质谱兼容,但其检测灵敏度较低,并伴有很深的背景干扰。
聚焦时间的优化
IEF的基本条件
Stemp 1
Stemp 2
Stemp 3
total
voltage
Time
Volt-Hours
Ramp
250
20min
---
Linear
4000
4000
2hr
---
---
10,000V-hr
Linear
Rapid
5 hr
14,000V-hr
7 cm
Stemp 1
Stemp 2
双向电泳样品的溶解
是成功进行双向电泳的最关键因素之一 溶解的目标: 样品中非共价结合的蛋白质复合物和聚积体完全破坏,从而形成各个多肽的溶解液; 必须允许可能干扰2-DE分离的盐、脂类、多糖和核酸等物质的去除; 保证样品在电泳过程中保持溶解状态。
离液剂:通过改变溶液中的氢键结构使蛋白质充分伸展,将其疏水中心完全暴露,降低接近疏水残基的能量域。典型代表是尿素和硫尿。
02
样品上样缓冲液
标准溶液:
Reagent
Amount
8M urea
47ml of 8.5 stock or 24g urea in 25ml H2O
50mM DTT or 2mM TBP
385mg or 500ul of 200mM TBP stock
双向电泳的基本原理

双向电泳的基本原理
双向电泳是蛋白质组学研究中最重要的技术,在蛋白质组学研究中发挥了重要作用。
其基本原理是:样品中含有两种或两种以上不同分子量的蛋白质,它们的分子量分布不同,在加有等电聚焦(IEF)等电聚焦缓冲液的一台凝胶电泳仪(如UMEACO)上,蛋白质分子按其大小和分子量进行分离,并可在不同的pH 范围内进行电泳。
由于等电聚焦缓冲液具有强的选择性,不同分子量的蛋白质在同一胶上得到分离,经凝胶染色后在垂直于凝胶的方向上能显示出清晰的条带。
蛋白质分子量大的向小的方向移动,分子量小的向大的方向移动。
每一条带就是一个独立的分子。
双向电泳技术可以大大缩短实验时间、降低实验成本、提高分析效率。
例如:已知蛋白序列为a/b/c,对某一蛋白进行研究,只需分离出a/b/c三条带,再经双向电泳技术分离后即可得到含有三条带的蛋白质条带。
双向电泳技术是蛋白质组学研究中最重要的技术之一,其基本原理是:将样品制备成胶后,在垂直于凝胶电泳方向上将蛋白进行分离。
—— 1 —1 —。
双向电泳法

双向电泳法双向电泳法(Bidimensional Electrophoresis,2-DE)是一种常用的蛋白质分离技术,可以同时分析样品中上千种蛋白质。
本文将详细介绍双向电泳法的原理、步骤和应用。
原理双向电泳法结合了等电聚焦(IEF)和SDS-PAGE两种技术,通过两个维度的分离将复杂的蛋白质混合物分解为一系列单独的斑点。
在第一维度中,根据蛋白质的等电点(pI)进行分离;在第二维度中,根据蛋白质的分子量进行分离。
通过将这两个维度的分离结果叠加,可以获得高分辨率的蛋白质图谱。
双向电泳法的关键步骤如下:1.等电聚焦(IEF):在第一维度中,使用等电聚焦技术将样品中的蛋白质按照其等电点进行分离。
等电聚焦是一种基于蛋白质在电场中向氧化物离子(OH-)或氢离子(H+)方向移动的分离方法。
在等电聚焦过程中,蛋白质会在pH梯度中向其等电点迁移,直到净电荷为零。
通过控制pH梯度和应用的电压,可以将蛋白质在等电聚焦过程中分离开。
2.SDS-PAGE分离:在第二维度中,将第一维度的等电聚焦凝胶与SDS-PAGE凝胶垂直叠加。
在SDS-PAGE凝胶中,蛋白质通过聚丙烯酰胺凝胶的孔隙随着电场的作用向阳极迁移。
由于SDS(十二烷基硫酸钠)的存在,蛋白质在SDS-PAGE凝胶中的迁移速度与其分子量成反比。
因此,蛋白质在SDS-PAGE 凝胶中会根据其分子量进行分离。
3.染色和分析:经过双向电泳分离后,凝胶可以通过染色方法显示出一系列斑点,每个斑点代表一个蛋白质。
常用的染色方法包括银染法、荧光染色、贵金属染色等。
对于银染法,它在灵敏度和线性范围上具有优势。
染色后可以使用成像设备捕捉图像并进行定量分析。
通过对斑点的比较和定量,可以识别不同样品之间的差异和变化。
步骤双向电泳法的步骤如下:1.样品制备:将待分析的生物样品(如细胞提取物)进行蛋白质提取,并使得蛋白质在石蜡中可溶解。
常用的方法包括总蛋白提取、亲和层析、激光捕获等。
2.等电聚焦(IEF):将蛋白质样品与具有连续pH梯度的凝胶进行接触。
双向电泳的原理及步骤

双向电泳的原理及步骤
双向电泳是一种分离蛋白质的方法,基于蛋白质在电场中的电荷和大小的不同进行分离。
以下是双向电泳的原理及步骤:
原理:
双向电泳是将蛋白质样品首先进行等电聚焦,然后再进行垂直于等电聚焦方向的SDS-PAGE电泳,从而获得更高的分离效率。
等电聚焦可以将蛋白质按照等电点的不同进行分离,而SDS-PAGE电泳可以将蛋白质按照分子量的大小进行分离。
通过这两个步骤的组合,可以更加准确地分离出蛋白质。
步骤:
1. 等电聚焦:将蛋白质样品加入到等电聚焦电极中,该电极包含有一系列等电点缓冲液。
在等电聚焦过程中,电极会产生一个电场,该电场会将带有不同电荷的蛋白质分子朝向不同方向移动,最终在等电点处停留。
这样可以将蛋白质按照等电点的不同进行分离。
2. SDS-PAGE电泳:在等电聚焦完成后,将电极旋转90度,使其与等电聚焦电极垂直。
然后将电极中的蛋白质样品注入到SDS-PAGE凝胶中,并进行电泳。
在SDS-PAGE电泳中,蛋白质会在电场中移动,但由于SDS的存在,蛋白质会被完全线性化。
这样可以将蛋白质按照分子量的大小进行分离。
3. 结果分析:通过电泳分离,可以得到一系列不同的蛋白质带,每个带代表一个蛋白质。
通过比对蛋白质带的大小和位置,可以鉴定蛋白质的分子量和等电点,从而确定蛋白质的特征。
蛋白质组双向电泳原理及实验步骤

胶条的平衡
冰箱中取出的胶条,于室温放置10分钟。 配制胶条平衡缓冲液 I 。 吸去胶条上的矿物油及多余的样品。 第一次平衡。振荡15分钟。 配制胶条平衡缓冲液 II 。 第二次平衡 ,振荡15分钟。
吸去玻璃板中液体。将玻璃板倒扣在桌面上。
琼脂糖封胶液进行加热溶解。配制1×电泳缓冲液。
快速
任意时间
l l l
选择所放置的胶条数。 设置每根胶条的极限电流。(30-50A/根) 设置等电聚焦时的温度。(17℃)
配制SDS-PAGE凝胶
配制 12% 的丙烯酰胺凝胶,直接用双向电 泳专用梳子;或在上部留 0.5cm 的空间, 用MilliQ水、乙醇或水饱和正丁醇封胶。 聚合30分钟。 待凝胶凝固后,拔去梳子,用MilliQ水冲 洗;或倒去分离胶表面的乙醇或水饱和正 丁醇,用MilliQ水冲洗,备用。
PDQuest软件分析(Software analysis)
质谱鉴定(Protein identification)
样品制备基本原则:
• 使所有待分析的蛋白样品全部处于溶解状态,制 备方法应具有可重现性。 • 防止样品在聚焦时发生蛋白的聚集和沉淀。 • 防止样品制备过程中发生样品抽提后的化学修饰。 • 完全去除样品中的核酸和某些干扰蛋白。 • 尽量去除起干扰作用的高丰度或无关蛋白,从而 保证待研究蛋白的可检测性。
等电聚焦的 操作
等 电 聚 焦 程 序 的 设 置
7c 1000V 4000V 4000V 慢速 快速 线性 快速
12小时(17℃) 被动水化
30分钟 60分钟 3小时 24,000伏小时 ~28,000伏小时 除盐 除盐 升压 聚焦
S5
500V 保持
蛋白质双向电泳

模块五蛋白质双向电泳1. 实验目的掌握双向电泳能根据等电点和分子量分离蛋白质的原理,第一向等电聚焦电泳(IEF)和第二向聚丙烯酰胺凝胶电泳(SDS-PAGE)操作步骤,掌握凝胶染色方法,掌握凝胶分析软件的使用,了解对分离出的特异蛋白质的进一步分析方法,了解利用电泳技术分析生物大分子的方法。
2. 实验原理从广义上讲,双向电泳是将样品电泳后为了不同的目的在垂直方向再进行一次电泳的方法。
目前蛋白质双向电泳常用的组合第一向为等电聚焦(载体两性电解质pH梯度或固相pH梯度),根据蛋白质等电点进行分离,第二向为SDS-PAGE,根据相对分子质量分离蛋白质。
这样经过两次分离后,在凝胶上显示出的蛋白点可以获得蛋白质等电点和相对分子质量信息。
双向电泳技术作为分离蛋白质的经典方法,目前得到了相当广泛的应用。
在植物研究中,成功建立了拟南芥、水稻、玉米等植物种类的双向电泳图谱数据库,对推动植物蛋白质组研究起到重要作用。
第一向等电聚焦:等电聚焦(isoelectrofocusing,IEF)是在凝胶柱中加入一种称为两性电解质载体(ampholyte)的物质,从而使凝胶柱在电场中形成稳定、连续和线性pH梯度。
以电泳观点看,蛋白质最主要的特点是它的带电行为,它们在不同的pH值环境中带不同数量的正电荷或负电荷,只有在某一pH时,蛋白质的净电荷为零,此pH即为该蛋白质的等电点(isoeletric point,PI)。
在电场中,蛋白质分子在大于其等电点的pH环境中以阴离子形式向正极移动,在小于其等电点的pH 环境中以阳离子形式向负极移动。
如果在pH梯度环境中将含有各种不同等电点的蛋白质混合样品进行电泳,不管混合蛋白质分子的原始分布如何,都将按照它们各自的等电点大小在pH梯度某一位置进行聚集,聚焦部位的蛋白质质点的净电荷为零,测定聚焦部位的pH即可知道该蛋白质的等电点。
第二向SDS聚丙烯酰胺凝胶电泳:SDS是一种阴离子表面活性剂,当向蛋白质溶液中加入足够量的SDS时,形成了蛋白质-SDS复合物,这使得蛋白质从电荷和构象上都发生了改变。
双向电泳

双向电泳(two-dimensional gel electrophoresis, 2-DE)是一种分析从细胞、组织或其他生物样本中提取的蛋白质混合物的有力手段,是目前唯一能将数千种蛋白质同时分离与展示的分离技术,其高分辨率、高重复性和兼具微量制备的性能是其他分离方法所无与伦比的。
双向电泳技术、计算机图像分析与大规模数据处理技术以及质谱技术被称为蛋白质组研究的三大基本支撑技术。
2D 电泳优越性●对未处理样本耐受性好●不需要预纯化(如:色谱层析)●分辨率非常高●2D 可以有效的组分收集器●蛋白在凝胶介质中受到保护●在蛋白质组学技术中应用范围最广(front-end )●与其他技术相比,在一次试验中可检测到的蛋白点更多●与后续分析技术兼容性好一、基本原理:先将蛋白质根据其等电点在pH梯度胶内(载体两性电解质pH梯度或固相pH 梯度)进行等电聚焦,即按照它们等电点的不同进行分离。
然后按照它们的相对分子质量大小进行SDS-PAGE第二次电泳分离。
样品中的蛋白经过等点电和分子质量的两次分离后,可以得到分子的等电点、分子质量和表达量等信息。
值得注意的是,双向电泳分离的结果使蛋白质点而不是条带。
根据Cartesin坐标系统,从左到右是pI的增加,从下到上是分子质量的增加。
第一向:等电聚焦1.[基本原理]从电泳观点看,蛋白质最主要的特征是它的带电行为。
蛋白质是由20种不同的氨基酸按不同比例通过肽键的连接构成的。
由于蛋白质的一些氨基酸侧链在一定的pH值的溶液中是可解离的,从而带有一定的电荷。
构成蛋白质的所有氨基酸残基上所带正负电荷的总和便是蛋白质所带的净电荷。
蛋白质在不同的pH环境中带不同数量的正电或负电,在低pH时,蛋白质的净电荷是正的,在高pH时,其净电荷是负的,但在某一pH时,它的净电荷为零,此pH即为该蛋白质的等电点(isoelectric pointpI)。
蛋白质的等电点值取决于其氨基酸的组成,是一个物理化学常数。
双向电泳步骤--标准操作完整版

细胞裂解(蛋白质提取)一、试剂配置:PBS配方PBS缓冲液一般作为溶剂氯化钠(MW 58.44) 130mM 8g氯化钾(MW 74.5) 2.7mM 0.2g十二水和磷酸氢二钠(MW 358) 10 mM 3.63g磷酸二氢钾(MW 136) 2 mM 0.24g加水至1L配好后进行高压灭菌。
Washing buffer(500mL)配方Tris(MW 121.1) 10mM 0.605g蔗糖(MW 342) 250mM 42.75g加水溶解,用HCl调pH至7.0后用孔径为0.22µm滤膜过滤(使用1M盐酸略高于2750uL调pH)裂解储液配方(细胞):尿素(MW 60.06) 7M 4.2g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 4%(W/V)0.4g 加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解储液配方(组织):尿素(MW 60.06) 5M 3g硫脲(MW 76.12) 2M 1.52gCHAPS(MW614.89) 2% 0.2gTris(MW 121.1) 40mM 0.048g加超纯水定容至10mL后经0.22µm一次性滤膜过滤,过滤后分装成20小管,每小管500uL,-20℃冰箱保存。
裂解液:裂解液储液 100uLIPG buffer(pH可选) 2% 2uLPi 2uLNucLease mix(100×) 1uLPMSF(100mM:20mg/mL) 1mM 1uLDTT(0.411g/mL) 40mM 1.5uLPi:每片使用200uL超纯水溶解后按10 uL分装考马斯亮蓝G-250:考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在465nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。
其光吸收值与蛋白质含量成正比。
简述双向电泳的原理

简述双向电泳的原理全文共四篇示例,供读者参考第一篇示例:双向电泳是一种分离蛋白质或核酸的方法,其原理基于电泳技术。
电泳是一种根据带电粒子在电场中的迁移速度不同而实现分离的方法,双向电泳则是在两个方向上施加电场,使样品能够在水平和垂直方向上进行迁移,以实现更加高效的分离。
双向电泳的原理主要包括以下几个方面:2. 分子大小和电荷:蛋白质或核酸的迁移速度取决于其大小和电荷。
较小的分子会更快地迁移,而带有更多负电荷的分子会受到更大的排斥力,迁移速度更快。
3. 凝胶介质的选择:凝胶是双向电泳中的分离载体,其选择对于分离效果至关重要。
凝胶的孔隙结构和导电性会影响样品的迁移速度和分离效率,因此需要根据样品的特性选择合适的凝胶介质。
4. 蛋白质或核酸的分子量和异质性:在双向电泳中,样品中存在不同分子量和异质性的蛋白质或核酸,这些成分会在电泳过程中以不同速度迁移,最终实现分离。
双向电泳技术的发展为蛋白质组学和基因组学研究提供了重要手段,能够有效实现不同类型的蛋白质或核酸的分离与鉴定。
通过结合其他分析技术,如质谱或序列测定,可以更全面地了解生物样品的组成和功能。
双向电泳在疾病诊断、药物研发和生物学研究等领域具有广泛的应用前景,成为生命科学研究中不可或缺的重要工具之一。
第二篇示例:双向电泳是一种常用的分离和分析生物分子的方法,它结合了水平电泳和垂直电泳的优点,能够在同一实验中同时进行两个方向上的电泳,从而达到更高的分辨率和更全面的信息提取。
双向电泳的原理基于生物分子在电场中的迁移速度与其电荷量、大小和形状有关。
在双向电泳中,通常先将样品加载在一维电泳胶中,然后将电泳胶直立放置,施加一个水平电场使样品向两侧扩散,形成一个均匀扩散的带状样品。
接下来,在垂直方向上施加另一个电场,使生物分子根据其电荷量、大小和形状不同而向上或向下迁移,从而实现在两个方向上的电泳。
双向电泳需要结合两个方向上的电场来进行,这样可以使得样品在两个维度上都得到分离,从而获得更加准确和直观的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1/ GE Title or job number /
2/16/2020
Proteomics
“...the analysis of complete complement of proteins.
Proteomics includes not only the identification and quantification of proteins, but also the determination of their localization, modifications, interactions, activities, and, ultimately, their function.
5/ GE Title or job number /
2/16/2020理论 pI nd Mr 图酵母细胞表达6,216种蛋白
1000
至今1,484 个蛋白被鉴定 (Nat.Biotechnol. 17,676 and 19, 242)
2DE 工作范围
100
[Da]
k Mr
10
注: 图片中没有特别强调蛋白丰度和疏水性
4/ GE Title or job number /
2/16/2020
Why 2DE?
Only “Proteomics”is the large-scale screening of the proteins of a cell, organism or biological fluid, a process which requires stringently controlled steps of sample preparation, 2-D electrophoresis, image detection and analysis, spot identification, and database searches.
资源环境
8/ GE Title or job number /
2/16/2020
寻找差异蛋白质
细 胞
环孢素 A处理前
组 织
正常 组织
环孢素 A处理后
肿瘤组织
9/ GE Title or job number /
2/16/2020
Life Sciences 的历史
LKB ——电泳发明者
Pharmacia ——层析技术开创者
. From: Wildgruber et al. Electrophoresis 21 (2000) 2610-2616
1
2
4
6
8
10
12
14
pI (理论值 )
6/ GE Title or job number /
2/16/2020
2D 电泳优越性
? 对未处理样本耐受性好
- 不需要预纯化 (如:色谱层析)
The core technology of proteomics is 2-DE.
At present, there is no other technique that is capable of simultaneously resolving thousands of proteins in one separation procedure.
Wasinger VC et al, Electrophoresis 16 (1995)
“Proteomics is the study of quantitative changes of expression levels and their application to drug discovery, diagnostics and therapy.”
Two basic technologies:
2-D electrophoresis of complex protein mixtures Identification and structure analysis of proteins with mass spectrometry methods
蛋白质组学应用举例
研究细胞结果功能和分子组成 相互作用蛋白质组学
发现细菌、病毒感染和疾病监测的分子标志物
病理生理学研究
发现新型生物学活性的分子和药物
差异蛋白质组学
研究药物作用方式和毒性机理
发现新的药物靶位点
海洋生物 修饰蛋白质组学 植物抗虫抗旱抗逆
遗传育种和分子育种
遗传或药理学扰动的分子解剖
中药机理
从基因组学上我们无法检测到转录后修饰、翻译调节、选择性 剪切、以及蛋白复合物形成、蛋白质相互作用等生命现象; 此 外并不是细胞内的所有的DNA都翻译转录成蛋白质
3/ GE Title or job number /
2/16/2020
Proteome Analysis and Proteomics
The analysis of the entire PROTEin complement expressed by a 敧佮??牯戠??散汬漠?楴獳敵琠灹?
Stanley Fields, University of Washington, Seattle, in Science [ 291, 1221 (2001)]
2/ GE Title or job number /
2/16/2020
Proteomics
一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称 为蛋白质组(proteome) 仅仅从基因组学水平上无法彻底的了解各种生命现象, 因为蛋 白质才是生命活动的真正执行者
? 分辨率非常高 ? 2D 可以有效的组分收集器 ? 蛋白在凝胶介质中受到保护 ? 在蛋白质组学技术中应用范围最广(front-end ) ? 与其他技术相比,在一次试验中可检测到的蛋白点更多 ? 与后续分析技术兼容性好 (如. MDLC)
7/ GE Title or job number /
2/16/2020
Amersham Biosciences ——提供基因组、蛋白组学研究整体解决方案
GE Healthcare Life Sciences ——实现从发现到功能研究,从体外到体内的突破
GE Healthcare milestones in 2-D electrophoresis
