第三章 固体表面
第三章 固体流态化技术

沟流对反应过程的影响:沟流现象发生时,大部分气体没有 与固体颗粒很好接触就通过了床层,这在催化反应时会引起催 化反应的转化率降低。由于部分颗粒没有流化或流化不好,造 成床层温度不均匀,从而引起催化剂的烧结,降低催化剂的寿 命和效率。
4、恒定的压降
流化床的重要优点
流化床床层压降 =(重量-浮力)/单位床截面积
固定床阶段 床层不动 u1 ut
流化床阶段 u1 ut开始悬浮
颗粒输送阶段 u1 ut 颗粒带走
u ,u1 ,u1 ut
(a)固定床
(b)流化床
(c)气力输送
此时流体的真正速 度 u < 颗粒的沉降 速度u0
此时u= u0 颗粒悬浮于流体中,床层 有一个明显的上界面,与 沸腾水的表面相似
流化阶段,压降与气速无关,始终保持定值
固定床 流化床 C ΔP B A ¢ u 带出开始
m P ( p ) g Ap
起始流化速度
表观速度 流体通过颗粒床层的压降
D( 带出速度 )
推导:
流化床阶段,近似认为颗粒处于动态平衡。
即:总曳力 总重力 总浮力
p f A Fg Fb AL(1 )(s ) g
此时u> u0
固体流态化运用在粉粒状物料的输送、混合、加热或冷 却、干燥、吸附、煅烧和气固反应等过程中。
3、流化床存在的基础—大量颗粒群居 颗粒能在相当宽范围内悬而不走,离开群体的个别颗粒上 升后, 速度将减小,则会回落。
浮力
曳力 u1(实际速度) 重力
u(表观速度)
二、实际流化现象
流态化按其性状的不同,可以分成两类, 即散式流态化和聚式流态化。
主要用途:
第三章 1地球表层系统PPT课件

外生能:主要是太阳辐射能,其次占极小部 分者还有星际间的引力能,如太阳、月亮对 地球的潮汐作用,陨石堕落的机械能以及各 种宇宙线所放射的能量。
11
地球表层的物质循环:
12
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
13
Hale Waihona Puke 谢谢大家荣幸这一路,与你同行
It'S An Honor To Walk With You All The Way
演讲人:XXXXXX
时 间:XX年XX月XX日
14
7
二、 地球表层特征
地球表层是物质三态存在和相互作用的场所: 界面机制、异质机制
地球表层是内外力相互作用的场所 地球表层是有机界和无机界互相转化的场所 地球表层是人类的生存环境
8
三、 地球表层能量和物质循环
地球表层的能量循环
9
第一节 地球表层系统
地球表层的能量转换 : 内生能:内生能由两部分组成:一是地球本身的引力
3
水圈:是地球上水的各种存在形式覆盖的圈 层,包括海洋、河流、湖泊、冰川及岩石孔 隙中的地下水,最大厚度约20千米。水圈总 水量达1386000立方千米,海洋占地球总 面积的70.8%,占地球总水量的96.5%。 陆地水占总水量的3.5%,其中冰川占 1.74%,为淡水总量的68.7%;地下水占 总水量的1.7%,其他江、河、湖、沼的地 表水仅占极小部分,但却对人类具有重要意 义。
第三章 理论地理学
材料表界面第三章固体表面

V1= V2 即 k1 P (1-θ) =k2θ
k1 p
k2 k1 p
令
b k1 k2
3.3.2 Langmuir吸附等温式
3. Langmuir吸附等温式
= bp
(3-10)
1+bp b为吸附系数
(1)低压或吸附很弱时,bp《1, 则θ=bp,即θ与p成直线关系,符 合Herry定律;
固-气界面吸附的影响因素:
2、压力 无论是物理吸附还是化学吸附,压力增加,吸附量皆 增大。 无论是物理吸附还是化学吸附,吸附速率均随压力的 增加而增加。
3.3 固-气界面吸附
固-气界面吸附的影响因素:
3、吸附剂和吸附质性质
(1)极性吸附剂易于吸附极性吸附质。如硅胶、硅铝催化剂等极性吸 附剂易于吸收极性的水、氨、乙醇等分子。 (2)非极性吸附剂易于吸附非极性吸附质。如活性炭、碳黑是非极性 吸附剂,故其对烃类和各种有机蒸气的吸附能力较大。炭黑的情况比较 复杂,表面含氧量增加时,其对水蒸气的吸附量将增大。 (3)一般吸附质分子的结构越复杂,沸点越高,被吸附的能力越强。 这是因为分子结构越复杂,范德华引力越大;沸点越高,气体的凝结力 越大,这些都有利于吸附。 (4)酸性吸附剂易吸附碱性吸附质,反之亦然。例如,石油化工中常 见的硅铝催化剂、分子筛、酸性白土等均为酸性吸附剂或固体酸催化剂, 故它们易于吸附碱性气体(如NH3、水蒸气和芳烃蒸气等)。 (5)吸附剂的孔结构。
例 2 在239.55 K,不同平衡压力下的 CO 气体在活 性炭表面上的吸附量 V (单位质量活性炭所吸附的 CO 气体在标准状态下的体积值)如下:
p /kPa 13.466 25.065 42.663 57.329 71.994 89.326
材料表界面 作业答案

πA=RT
表面压较小的情况下成立
pv=RT
忽略了分子间互相作用力,利用理想化模型推导公式 低压、高温条件下成立
总结: 界面化学四大ຫໍສະໝຸດ 律 Laplace 方程 Kelvin 公式
p (1/ r1 1/ r2 )
P 2 V 2 M P0 r r
求出表面张力σ,即:
(2)修正的原因:①把凹凸月面当作球面近似处理。②只有在凹月面的最低点毛细上升的高 度才是h ,凸月面的最高下降才为h ,其余各点均大于h 。
6.试用Kelvin公式解释空气中水蒸汽过饱和的原因。在20℃下水的密度ρ =998.2kg/M3,表面张力为72.8*10(-3)N/m,若水滴半径为10(-6)cm,求水的 过饱和度。 答:(1)由Kelvin公式: P 2 V 2 M RT ln (2-40) P0 r r P0 为平液面的蒸汽压,P 为弯液面的蒸汽压,V 为液体摩尔体积,r 为弯液面的 曲率半径。 由上式可知,液滴的半径越小,其蒸气压越大。下面图示为根据 Kelvin 公式得 出的正常液体(平面)与小液滴的饱和蒸气压曲线。
5. 毛细管法测定液体表面张力的原理是什么?为什么要对毛细管法进行修正? 答:原理:液体在毛细管中易产生毛细现象。由Laplace方程推广到一般情况:
gh=2 /r (2-20) 其中△ρ 为气液两相密度之差, θ 为液体与管壁之间的接触角
,r为毛细管的半径,由上式,从毛细管上升或下降高度h可以
v a3 a v1/ 3 0.00951/ 3
其表面积为: A=6a =6*0.0095 =
2 2/3
比表面积=
表面积 6*0.00952/3 = (cm 2/g) 质量 0.1
摩擦学第三章表面接触

摩擦学第三章表面接触
C
三、微凸体模型和接触模型 1、微凸体模型 1)球形模型 2)柱形模型 3)锥形模型 2、接触模型 1)球面与球面接触 2)球面与平面接触 3)棒与棒接触
有关接触表面的特点:
(1)固体间接触不连续性,即接触的离散性 (2)固体间接触面积的三种类型:名义接触、轮廓接触、实际接触 (3)固体间接触具有分子和力学双重性 (4)摩擦过程中,微凸体的接触部位上的闪温比基体平均温度高的多
表面1
1
h
2
表面2
若两个表面的粗糙度均方根值分别为Rq1( 1)、 Rq2( 2 ) ,且参考中线之间
距离为 h 。他们的接触可转化为一个光滑刚性平面和另一个具有均方根值为:
Rq
R2 q1
Rq22
的粗糙当量表面相接触。
设 f ( z ) 为当量表面上微凸体高度概率分布函数,当光滑表面与当量表面参考中线
1 11 R R1 R2
m ax0.3883
pE2 R2
五、结论与讨论
(1)在弹性变形状态下,最大接触应力与载荷成非线形
(2)球与平面接触最大剪应力在表层下0.5 a处,且
0 .3 1 4 5m a x
H m a x
(3)圆柱与平面接触时在表层下0.786 b 处 ,且 4 5m ax0 .3 0 .3 3 H m ax
=
20.583PE R'2 2
(3-6)
当两个球均为钢球时
E 1 = E 2 = E 1 = 2 =0.3
max
0.3893
PE2 R2
(3-7)
二、两圆柱体接触
由赫兹公式
b 4P R l E'
如圆柱 长度为L
中国石油大学(北京)催化原理(3-8)章复习整理

2)微孔吸附能力强,反应物的有效浓度高 4)可作为固体酸催化剂或金属催化剂载体
四、 固体超强酸(Ho<-11.9,酸强度超过 100%硫酸的酸强度) 主要可分为含卤素和不含卤素两大类 1. 卤素促进剂类:原料价格高,稳定性较差,腐蚀设备 SbF5、TaF5、BF3、AlCl3、AlBr3 等担载在 SiO2、Al2O3、SiO2-Al2O3、SiO2-TiO2 载体上 2. SO 4 2- 促进剂类:SO 4 2- /M x O y 型(锆系、钛系、铁系) 3. 氧化物促进剂类:金属氧化物(WO3、Mo O3 )/M x O y 型 4. 酸性: •载体表面存在大量的羟基 OH(B 酸中心) ,裸露的金属阳离子(L 酸中心) •受到促进剂卤素或共轭 S=O 的强烈诱导效应 ① 体表面羟基的 O-H 更松动(超强 B 酸) ②载体表面金属离子更缺电子(超强 L 酸) 5. 失活:促进剂流失、配位方式多样化、积碳 五、 杂多酸:杂多酸由不同的无机含氧酸缩合而成,如磷钼杂多酸 •杂多酸(盐)的催化特点: (1) 强酸性:适用于异构化、烷基化、醇脱水 (2) 氧化还原性:用于多相或液相的氧化 (3) 特殊的选择性: 用于均相或多相催化
第三节
固体酸的种类、结构及性质
种类:1)负载于 SiO2、Al2O3 上的液体酸(H2SO4 、H3PO4) 2)天然粘土:高岭土、活性白土、天然沸石 3) 金属氧化物、复合氧化物 4)金属盐 5)杂多酸 6)固体超强酸 一、金属氧化物的酸碱性 1、金属氧化物的 B 酸中心为表面羟基,M-O 键越强,羟基酸性越强 L 酸中心为裸露的金属离子 2、氧化铝的表面酸性 •氧化铝表面存在配位不饱和 Al3+(L 酸)和 O2-(L 碱 ) •室温下表面吸附水(羟基)OH 邻近没有 O2-的为 B 酸,OH 与四个 O2-相邻为 B 碱
最新第三章(3-2)润湿性课件PPT

表8—4 不同烃类组分在聚四氟乙烯光面上的前进角
烃 类戊
烷己
烷辛
烷十 二 烷
(C5H12)
(C6H14)
(C8H18)
(C12H 26)
前进角
0
8
26
42
(度)
原油中烃类所含碳原子数越多,接触角就越大。
2、油藏岩石润湿性的认识
第三章(3-2)润湿性
一、储层岩石润湿性
1、润湿的基本概念:
(1)润湿:
自然界现象:将水滴在玻璃板上,水在玻璃板上迅速铺开,而如果 是水银滴在玻璃板上,水银液滴在玻璃板上呈现球滴。
空气 水
空气 水银
玻璃
玻璃
润湿:是指液体在分子力的作用下沿固体表面流散的现象。
润湿研究对象: 不混容的两相液体-固体三相体系,或液体-气体-固体
静止时,θ= 30°,岩石亲水
1
2
水驱油速度为V1时,θ= 60°,岩石亲水性减弱
水驱油速度为V2> V1时,θ= 75°,岩石亲水性再减弱
水驱油速度为V3> V2时,θ= 115°,岩石类似亲油性, 发生润湿反转
研究动润湿滞后的意义:
亲水油藏水驱油时,当水驱油的速度过大时,将 导致油藏岩石具有“亲油”的性质。实践证明,亲油 油藏水驱油的残余油饱和度比亲水油藏水驱油的残余 油饱和度大;因此,从提高原油采收率的目的出发, 注水开发的油藏,并非注水速度越大就越好。
如下图所示,油水在岩石孔隙中静止时,接触角为30°,岩石表面具有较强 的水润湿;当水驱油在岩石孔隙中流动时,接触角发生了改变,接触角随水驱油 速度的增大而变大,即滞后现象越严重,当水驱油速度的增大到某一值时,岩石 表面变为亲油性,发生了润湿反转现象。
材料表界面思考题答案汇总

考试
答案
第二章:液体表面 2. 试述表面张力(表面能)产生的原因。
P6 原因为液体表面层的分子所受的力不均匀而产生的。液体表面层即气液界面中的分子受到指向液体内 部的液体分子的吸引力,也受到指向气相的气体分子的吸引力,由于气相吸引力太小,这样,气液界面的分 子净受到指向液体内部并垂直于表面的引力作用,即为表面张力。这里的分子间作用力为范德华力。
17. 表面活性剂的浓度对溶液的表面张力有怎样的影响?为什么有这样的影响? P41 (1)随着表面活性剂浓度的增加,表面张力而下降,当达到临界浓度时,表面张力就不 再发生变化。 (2)表面活性剂其亲水端向水,亲油段相空气,其浓度的上升会使分子聚集在表面,这样, 空气和水的接触面减小,表面张力急剧下降,与此同时,水中的表面活性剂也聚集在一起,排 列成憎水基向里,亲水基向外的胶束。表面活性剂浓度进一步增加,水溶液表面聚集了足够多 的表面活性剂的分子,无间隙地布满在水溶液表面上,形成单分子膜。此时,空气和水完全处 于隔绝状态,表面张力趋于平缓。 18. 表面活性剂按亲水剂类型可怎样分类? P43 表面活性剂溶于水能电离成离子的叫做离子型表面活性剂,R 基不能电离的叫做非离子型 表面活性剂。 其中离子型表面活性剂可分成阴离子、阳离子和两性表面活性剂。
度降低,HLB 值下降,使得乳状液从原来的(O/W)型转变为油包水型(W/O)所对应的温度.又称为亲 水-亲油平衡温度.
共 12 页 当前第 5 页
《材料表界面》复习思考题答案汇总
(2) PIT与HLB都可以反映出亲水亲油性,但是,PIT可以反映出油的种类、水溶液性质、温度 和相体积等的影响。 同时 PIT 测定简单、精度高。
13. 比较物理吸附和化学吸附的区别。
项目 吸附力 吸附热 选择性 吸附层 吸附速度 可逆性 发生吸附速度 物理吸附 范德华力 小,接近液化热 无 单、多分子层 快,不需要活化能 可逆性 低于吸附质临界温度 化学吸附 化学键力 大,接近反应热 有 单分子层 慢,需要活化能 不可逆性 远高于吸附质沸点
第三章 固体材料中质点的运动与迁移

式中D为扩散系数( 式中 为扩散系数(m2/s或cm2/s);负号表示粒子 为扩散系数 或 ) 从浓度高处向浓度低处扩散,即逆浓度梯度的方向扩散。 从浓度高处向浓度低处扩散,即逆浓度梯度的方向扩散。
2.菲克第二定律: 菲克第二定律: 菲克第二定律 适用于求解扩散质点浓度分布随时间变化的不稳 定扩散问题。 定扩散问题。
∂ 2c ∂ 2c ∂ 2c ∂c = D 2 + 2 + 2 ∂x ∂t ∂y ∂z
第二节 扩散机制
晶体中原子都在平衡位置振动, 晶体中原子都在平衡位置振动 由于晶体中存在 着能量起伏, 着能量起伏 在任一时刻都会有一些能量高的原子 可以克服周围质点的束缚进行迁移而成为活化原子 (图3-2-1)。 图 。 活化原子数目符合波尔兹曼分布
表明在面心立方结构中(111)晶面上的 图3-1表明在面心立方结构中 表明在面心立方结构中 晶面上的 一个原子移向邻近空位的情况。 一个原子移向邻近空位的情况。 原子将沿着与空位运动相反的方向迁移。 原子将沿着与空位运动相反的方向迁移。
图3-1 空位扩散示意图
实现空位机制的条件
1.扩散原子的近邻应当有空位
3.易位扩散: 是指正负离子换位 易位扩散: 是指正负离子换位. 易位扩散
需要的能量就大,至今未见报道 需要的能量就大 至今未见报道
4.环形易位扩散:一般只同粒子易位 所需能量小 环形易位扩散:一般只同粒子易位, 所需能量小, 环形易位扩散
但是几个粒子恰好同时成环形移动的几率低
易位
环易位
第三节 扩散的分类 1. 按机制 空位机制和间隙机制 按机制: 2. 按发生区域 按发生区域: 体积扩散(晶格 晶 体积扩散 晶格)—晶体内 晶格 表面扩散 晶界扩散 位错扩散(攀移等) 位错扩散(攀移等)
第三章_溅射镀膜

(1)靶材料 (表 3-2、图 3-9)
a.溅射率S 随靶材元素原子序数增加而增大。 b.晶格结构不同,S不同,六方晶格〉面心立方。 c.与表面清洁度有关,清洁度高,S大。 d.升华热大,S小。
均逸出速度如图3-19和图3-20所示。原子序数Z>20时,
各元素的平均逸出能量差别增大,而平均速度差别较小。
整理版ppt
3838
整理版ppt
3939
由图3-21可见,不同方向逸出原子的能量分布
不相同的。
整理版ppt
4040
溅射原子的能量和速度具有以下几个特点: (1)重元素靶材被溅射出来的原子有较高的逸出能 量,而 轻元素靶材则有高的原子逸出速度;
击,即使自然游离源不存在,导电也 将继续下 去。 (2)维持辉光放电的电压较低,且不变 。 (3)电流的增大与电压无关,只与阴极板上产生辉光
的表面积有关。 (4)正常辉光放电的电流密度与阴极材料和气体的种类
有关。
气体的压强与阴极的形状对电流密度的大小 也有影响。电流密度随气体压强增加而增大。凹面形阴 极的正常辉光放电电流密度,要比平板形阴极大数十倍 左右。
离子层已无法向四周扩散,正离子层便向阴极 靠拢,使正离子层与阴极间距离缩短。要想提 高电流密度,必须增大阴极压降使正离子有更 大的能量去轰击阴极,使阴极产生更多的二次 电子。 ➢ 由于正常辉光放电时的电流密度仍比较小,一 般薄膜溅射选择在非正常辉光放电区工作,有 利于提供大面积的均匀溅射和薄膜沉积。
整理版ppt
8
(3)过渡区 (CD区域 ) 离子轰击阴极,释放出二次电子, 二次电子与中性气体分子
第三章 表面活性剂要点

三、表面活性剂的吸附性
2.表面活性剂在固体表面的吸附 • 表面活性剂溶液与固体接触时,表面活 性剂分子可能在固体表面发生吸附,使 固体表面性质发生改变。 • 对于极性固体物质在表面活性剂浓度较 低时形成单层吸附,当其达到临界胶束 浓度时,转为双层吸附。对于非极性固 体,一般只发生单分子层吸附。
表面活性剂在溶液表面的吸附
1800 (实际为1750,取整数);8代表聚氧乙烯链段分子量
在共聚物中所占的比例80%;由此可以推算Poloxamer188 的分子量为9000(实际为8350)。 5以下为半固体或液体。
2. 在Poloxamer命名规则中,尾数为7或8的共聚物均为固体,
第三节 表面活性剂的基本性质
(掌握CMC、HLB的定义和HLB的计算)
脂质体主要原料;
氨基酸型和甜菜碱型两性离子型表面活性剂。
后者最大优点:适用于任何pH溶液,在等电点 时也无沉淀。
性质:碱性水溶液中呈阴离子性质,去污力强;
酸性水溶液中呈阳离子性质,杀菌力强。
二、非离子表面活性剂
1. 结构组成 ① 亲水基团 (甘油、聚乙二醇、山梨醇); ② 亲油基团(长链脂肪酸、长链脂肪醇、烷 基或芳基); ③ 亲水基和亲油基以酯键、醚键结合 2. 性质: 毒性小,不解离,不受pH的影响; 能与大多数药物配伍,广泛应用于外用、 内服、注射制剂。
第三章
表面活性剂
(本教材重点章节)
学习要求
1. 掌握表面活性剂的概念及表面活性剂的结构特征 2. 掌握按分子组成特点,表面活性剂的分类 3. 熟练掌握CMC,Krafft点,昙点的定义。 4. 掌握HLB值的定义,熟练掌握HLB值的计算
5. 掌握表面活性剂的增溶作用的机制
第一节
传热学思考题参考答案(陶文铨第四版)

传热学思考题参考答案第一章:1、用铝制水壶烧开水时,尽管炉火很旺,但水壶仍安然无恙。
而一旦壶内的水烧干后水壶很快就被烧坏。
试从传热学的观点分析这一现象。
答:当壶内有水时,可以对壶底进行很好的冷却(水对壶底的对流换热系数大),壶底的热量被很快传走而不至于温度升得很高;当没有水时,和壶底发生对流换热的是气体,因为气体发生对流换热的表面换热系数小,壶底的热量不能很快被传走,故此壶底升温很快,容易被烧坏。
2、什么是串联热阻叠加原则,它在什么前提下成立以固体中的导热为例,试讨论有哪些情况可能使热量传递方向上不同截面的热流量不相等。
答:在一个串联的热量传递过程中,如果通过每个环节的热流量都相同,则各串联环节的总热阻等于各串联环节热阻的和。
例如:三块无限大平板叠加构成的平壁。
例如通过圆筒壁,对于各个传热环节的传热面积不相等,可能造成热量传递方向上不同截面的热流量不相等。
第二章:1、扩展表面中的导热问题可以按一维问题处理的条件是什么有人认为,只要扩展表面细长,就可按一维问题处理,你同意这种观点吗|答:条件:(1)材料的导热系数,表面传热系数以及沿肋高方向的横截面积均各自为常数(2)肋片温度在垂直纸面方向(即长度方向)不发生变化,因此可取一个截面(即单位长度)来分析(3)表面上的换热热阻远远大于肋片中的导热热阻,因而在任一截面上肋片温度可认为是均匀的(4)肋片顶端可视为绝热。
并不是扩展表面细长就可以按一维问题处理,必须满足上述四个假设才可视为一维问题。
2、肋片高度增加引起两种效果:肋效率下降及散热表面积增加。
因而有人认为随着肋片高度的增加会出现一个临界高度,超过这个高度后,肋片导热热流量会下降,试分析该观点的正确性。
答:的确肋片高度增加会导致肋效率下降及散热表面积增加,但是总的导热量是增加的,只是增加的部分的效率有所减低,所以我们要选择经济的肋片高度。
第三章:1、由导热微分方程可知,非稳态导热只与热扩散率有关,而与导热系数无关。
第三章 固体表面

两式相减,得
dUS = dUdU0A = T(dS dS0A) P(dVdV0A)+(A0A)dnA +SdnS 即 dUS =TdSSPdVS + (A0A)dnA + SdnS
(3-5)
假定(A0A)dnA一项是由于某个力在表面做功的结果,并设该力为, 使面积的改变为dA,则 (A0A)dnA = dA 代人(3-5)式得
面心立方晶格金属的表面形成
在晶体内部原子的配位数是12。如果形成表面的原子面是(100)时, 由于外层原子不存在了,因此配位数变为8。即其余四个原子的键被 断掉。
设两个原子间的键能为Ua,则制造表面时每断一根键,该
原子的能量将增加Ua/2,切断4根键增加能量2Ua。
这种能量的增加称为断键功。
断键功不仅与原子的内聚功有关,也与表面上的原子取向 有关。 当表面为(111)面时,断键功是3Ua/2,当表面(110) 面时为5Ua/2。
对于各向同性的固体,1=2,则 = = Gs + A(dGs/dA) 对于液体,dGs/dA=0,所以 = Gs,即 = Gs =。
如果某种固体,在发生面积变化dA时,始终保持着平衡的表面构型, 则如同液体,也有 = GS = 。
但是,如果不能保持表面的平衡构型,则会出现表面应力不等于表面 自由能GS,相差的值决定于A(dGS/dA)一项,并且与时间有关。
根据吸附力的本质,可将固体表面的吸附作用区分为 物理吸附和化学吸附:
(1) 物理吸附的作用力是Vanderwaals力,因此物理吸附层可看作
是蒸汽冷凝形成的液膜,物理吸附热的数值与液化热相似, 一般在40 kJ/mol以下。
在化学吸附中,作用力与化合物中形成化学键的力相似,这种 力比Vanderwaals力大得很多,化学吸附热也与化学反应热相
热质交换原理与设备-第三章

对于水,米海耶夫推荐的在105~ 4x106Pa压力下大容 器饱和沸腾的计算式为
按q=hΔt的关系,上式亦可转化为
基于核态沸腾换热主要是气泡高度扰动的强制对流换 热的设想,文献[9,10]推荐以下适用性广的实验关联式:
水在不同压力下沸腾的实验数据与式(3-6)的比较见图 3-5。 式(3-6)还可以改写成为以下便于计算的形式:
高时,壁面上越来越小的存气凹穴处将成为工作的汽化核 心,从而汽化核心数随壁面过热度的提高而增加。
关于加热表面上汽化核心的形成及关于气泡在 液体中的长大与运动规律的研究,无论对于掌握沸腾换热 的基本机理以及开发强化沸腾换热的表面都具有十分重要 的意义。现有的预测沸腾换热的各种物理模型都是基于对 成核理论及气泡动力学的某种理解面建立起来的。正是20 世纪50年代末关于汽化核心首先是在表而上一些微小凹坑 上形成的这一基本观点的确立,才导致了20世纪70年代关 于沸腾换热强化表面开发工作的开展。
的压力pv必大于气泡外的压力pt。根据力平衡条件,气泡内
外压差应被作用于汽液界面上的表面张力所平衡,即
若忽略液柱静压的影响,则pt可认为近似等于沸腾系统
的环境压力,即 pt ps 。而热平衡则要求气泡内蒸汽
的湿度为pv压力下的饱和温度tv。界面内外温度相t等l ,tv即
所以气泡外的液体必然是过热的,过热度为tv ts
式中,hc、hr分别为按对流换热及辐射换热计算所得的 表面传热系数,其中hc按式(3-10)计算,而hr则按下式确定:
(4)制冷剂水平管束外大空间的沸腾放热 制冷剂的沸腾放热是一个很复杂的过程,目前尚
未有统一的、适用范围广泛的公式予以描述,只能采用某 些在特定条件下得出的经验公式进行计算。
对于光管管束上的沸腾,其放热公式可按如下公 式近似计算:
第三章 固体界面性质(1)

(2)容量法 ) 装置: 主要由样品管、 装置:图 主要由样品管 量气管和压力计等组成。 (1)2-8 量气管的五个球的体积在安装系统之前就已经准确地测量了。 )重量法 、量气管和压力计等组成。 量气管的五个球的体积在安装系统之前就已经准确地测量了。 原理: 吸附量是通过吸附前后系统的体积和压力的变化来计算。 原理: 吸附量是通过吸附前后系统的体积和压力的变化来计算。 系统的真空度: 系统的真空度:1.33X10−8 Pa。测定吸附量之前,先测定自由体积与死空间。 。测定吸附量之前,先测定自由体积与死空间。 吸附量的测定过程:将死空间内的气体抽走后,关上活塞 。 吸附量的测定过程:将死空间内的气体抽走后,关上活塞A。将样品全部浸 入液氮中,放入适量氮气,测定压力和 入液氮中,放入适量氮气, 液氮的温度。打开活塞A,由于样品吸附 液氮的温度。打开活塞 , N2,压力将逐渐下降。待压力恒定后, 压力将逐渐下降。待压力恒定后, 记下此压力值和液氮的温度。这样, 记下此压力值和液氮的温度。这样, 就完成了一个点的样品对氮气吸附量的 测定。调节量气管中的汞面, 测定。调节量气管中的汞面,使各个球 逐个被汞充满, 逐个被汞充满,每充满一个球就重复一 次上述步骤,记下需要的数据, 次上述步骤,记下需要的数据,直到所 有球全部为汞充满为止,就可以获得在各个压力下的样品对氮的吸附量。 有球全部为汞充满为止,就可以获得在各个压力下的样品对氮的吸附量。
三、吸附量的测定 1、静态法 、 (1)重量法 )
三、吸附量的测定 1、静态法 、
装置: 采用真空微量磁天平技术直接测定吸附量。 装置:图2-7 采用真空微量磁天平技术直接测定吸附量。 原理:在一定范围内,石英弹簧的伸长度与吸附气体的重量成正比。 原理:在一定范围内,石英弹簧的伸长度与吸附气体的重量成正比。 采用弹簧秤的优点: 采用弹簧秤的优点: ①不与气体反应; 不与气体反应; ②弹性恢复好; 弹性恢复好; ③不随温度和时间而变。 不随温度和时间而变。 国外已有定型商品。 国外已有定型商品。 已制成连续自动测定吸附等温线的 装置并配有电子计算机, 装置并配有电子计算机,可计算比表面 和孔径分布。 和孔径分布。
表面与胶体化学—第三章 表面张力与润湿作用R

γ
∆G γ = ∆A
对于纯液体,在只做膨胀功和表面功的可逆过程中, 根据热力学基本关系式可知: dU = TdS − pdV + γdA dH = TdS + Vdp + γdA dF = − SdT − pdV + γdA dG = − SdT + Vdp + γdA 因此, γ 是不同的指定条件下,扩大单位 面积,体系内能,焓,Helmhotz自由能, Gibbs自由能的增量。
三.决定和影响液体表面张力的主要因素 1.物质的本性 液体的表面张力(或表面自由能)表 示将液体分子从体相拉到表面上所做功的 大小,故于液体分子间相互作用力的性质 与大小有关。相互作用强烈,不易脱离体 相,表面张力就大。
2.温度的影响 温度升高,分子键引力减弱,故表面 张力多随温度升高而减小。同时,温度升 高液体的饱和蒸气压增大,气相中分子密 度增加,也是气相分子对液体表面分子的 引力增大,导致液体表面张力减小。当温 度达到临界温度Tc时,液相与气相界线消 失,表面张力降为零。
− ∆Gs = γ gs − γ lg − γ sl = S
(铺展系数)
铺展系数S>0,过程自发进行。
浸湿
固体浸于液体中的过程称为浸湿。此过 程是固气界面被固液界面取代,气液界面无 变化,此过程自由能变化为
− ∆GI = γ sg − γ sl = WI
WI>0,过程自发进行。
(浸润功)
接触角与Young方程 二.接触角与 接触角与 方程 将一液体滴到一平滑均匀的固体表面上, 若不铺展,将形成一平衡液滴,其形状由 固液气三相交界面处所作气液界面之切线 经液滴至固液界面所成之夹角决定,此角 称为该种液体在所研究固体表面上之接触 角,或称润湿角。接触角常以θ表示。
第3章固体表面的接触
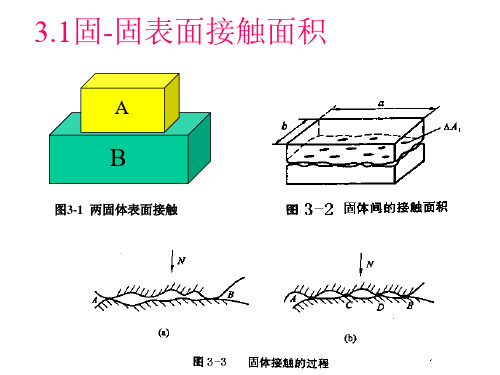
3.2 赫兹接触
3.2.1 定义: ➢赫兹接触:曲面之间的弹性接触。 ➢ 接触应力:压力经过接触表面传递到第二个表 面而在按触面上形成的应力,称为接触应力。
3.2.2 赫兹接触的四点假设:
➢材料为完全弹性体 ➢表面是光滑的 ➢接触物体没有相对滚动 ➢接触物不传切向力
3.2.3 两圆柱体的接触
两圆柱体接触,半 径各为R1和R2,受法向 载荷W作用,形成2aL 一个带状的平面接触 区。在此接触面上压 力分布不均匀,呈半 椭圆形分布,在中心 处的接触应力最大为 Pmax。
a2 r2
3/
2
2
1
a2 r2
1/ 2
法向:
z
Pmax
1
a2 r2
1/ 2
两个弹性球体的接触应力在中心连结线剖面是 服从半椭圆形。
在接触圆外(r>a,z=0)
r
Pmax
Pmax
1 2
3
a2 r2
在接触圆周上(r=a,z=0) 出现最大的拉应力
F 1 2
Pmax
3
(4)接触表面切应力的分布
• 切应力:
1 2
z
r
•最大剪应力: 在接触中心以下离表面0.48a的材料内部
τmax=0.47Pmax
•接触中心 : τ=0.10Pmax
•接触边缘 : τ=0.13Pmax
3.2.6 赫兹接触的几个特点
•最大接触压应力在接触面中心,其值与载荷成 非线性关系,与载荷的平方根或立方根成正比。 •接触应力与材料的力学性能(E,υ)有关。 •最大剪应力不在接触表面上,而在距表面一定 距离的材料内部。 •材料的塑性变形最早发生表面以下的0.48a 或 0.78a的材料内部,只有当平均压应力Pmean=H 时,表面才出现塑性变形。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五种吸附等温线
第三类吸附等温线
,曲线向上凹
C〈〈1,在x不大时,二常数公式转化为
V Cx Vm (1 x)(1 Cx x)
Cx Cx V Vm Vm (1 2 x) (1 x) 2
dV Vm C 0 2 dx (1 2 x)
4Vm C d 2V 0 2 3 dx (1 2 x)
(3-16)
同理
B ' =b PB 1 A B
(3-17)
bpA A 1 bpA b ' pB
b pB B 1 bpA b ' pB
推广到多种气体吸附
'
(3-18)
(3-19)
i
bi pi 1 bi pi
1 i
(3-20)
3.3.3 Freundlish吸附等温式
P 1 P V ( P0 P) Vm P0
(3-55)
B点法测定比表面积图3-9所示
对第二类曲线,以VB代替Vm
例:77K时N2在硅胶上的吸附数据如
下,其中吸附量已折算成S.T.P。已 知硅胶的质量为0.5978g,用BET法 求此硅胶的比表面积。
P/po 0.07603 0.09687 0.1567 2.2213 0.2497 V(cm3) 0.8984 0.9228 1.076 1.166 1.58
以Y~ P/po作图,最小二乘法回归得一直线, 其斜率 k=1.0048,截距 b=0.01684 Vm=1/(k+b)=0.9788
Vm N A As 22400W
式中NA=6.02×1023 W=0.5987 =0.162nm2 代入得 As=7.13 m2/g
V KP
1
n
(3-25)
(3-24)和(3-25)式表明,以lgθ或lgV对lgP作图, 可得一条直线。因此以实验数据作图,察看是不是 一条直线,可以判断吸附体系是否符合Freundish吸 附等温式,从直线的斜率和截距可以求出常数k和n。
图3-7 CO在活性炭上的吸附等温线和等温 线的对数图
解,由BET二常数式
p 1 C 1 p V(p0 p) VmC VmC p0
先计算
p p0 p Y V(p 0 p ) V (1 p p0 )
P/po Y
0.07603 0.09687 0.1567 2.2213 0.2497 0.09159 0.1162 0.1727 0.2437 0.2645
设单层中每一个被吸附的分子所占的面积为 ω ,吸附剂质量为W,则比表面积As可表示为:
Vm N 0 As V0W
(3-54)
式中Vm——气体标准状况下的体积(cm3) NA——Avogadro常数。
一点法
p 1 C 1 p V(p0 p) VmC VmC p0
当C>>1时,1/C≈0,C-1≈C (3-21)式简化为
3.3.4 BET多分子层吸附理论
(1)吸附是多分子层的。
(2)各相邻吸附层之间存在着动态平衡。 (3)第一层吸附是固体表面与气体分子之间 的相互作用,其吸附热为q1。第二层以上 的吸附都是吸附质分子之间的相互作用,吸 附热接近被吸附分子的凝聚热qL。
图3-8 BET模型
BET二常数吸附等温式:
(3-7) (3-8)
式中q和q’为吸附量,x为被吸附气体的量,v为被吸附 气体的体积,m为吸附剂的质量。
平衡时吸附量取决于温度T和气体
的压力P0即:
q = f(T,p)
(3-9)
恒温下,q=f(p),称为吸附等温式; 恒压下,q=f(T),称为吸附等压式; 恒q下,p=f(q),称为吸附等量式;
五种吸附等温线
第四类和第五类等温线
可将第Ⅳ类与第Ⅱ类对照,第Ⅴ类
与第Ⅲ类对照,所区别的只是,在 发生第Ⅳ,第Ⅴ类吸附等温线的吸 附剂中,其大孔的孔径范围有一尽 头,即没有某一孔径以上的孔。因 此,高的相对压力时出现吸附饱和 现象。吸附等温线又平缓起来。
3.3.4 气体吸附法测定固体的比表面积
图3-2 面心立方结构上的原子排列
(a)(100)面 (b)(111)面 (c)(110)面
(3)固体表面污染
固体表面吸附外来物质
3.1.3固体表面吸附性
固体表面具有吸附其他物质的能力。
如果被吸附物质深入到固体体相中,
则称为吸收。 根据吸附力的本质,可将固体表面的 吸附作用区分物理吸附和化学吸附。
2)应用 如以Vm代表表面上吸满单分子层气体的吸附量,则
V bp = Vm 1+bp
重排得:
p 1 p V Vmb Vm
(3-11)
以p/V~p作图,可得一直线,从直线的斜率和截距可 以求出Vm和b。 Vm与固体的比表面积As有如下关 系:
Vm N 0 As V0
(3-12)
BET模型常用来测定固体的比表面积,
p 1 C 1 p V(p0 p) VmC VmC p0
将p/V(p0-p)对p/p0作图,应得一直线(p/p0在 0.05~0.35范围)。从直线的斜率和截距可计算出固 体表面被单层覆盖时所需的气体体积Vm。
1 Vm 斜率 截距
(3-53)
定义τ为单位长度上的表面应力,则沿 着相互垂直的两个表面上的表面应力与表 面张力有如下关系:
=(1 2 ) / 2
(3-4)
此时可理解为固体表面张力的力学 定义。
3.3 固-汽表面吸附
3.3.1吸附等温线 吸附量可用单位质量吸附剂所吸附气体的量或体积 来表示,即:
q=x/m 或 q' v/m
五种吸附等温线
3.3.2 langmuir等温式
1) 推导 Langmuir的基本假定: (1)固体表面存在一定数量的活化位置, 当气体分子碰撞到固体表面时,就有一部 分气体被吸附在活化位置上,并放出吸附 热。 (2)吸附是单分子层的。 (3)固体表面是均匀的,被吸附分子间没 有相互作用力。 (4)吸附与解吸附动态平衡。
1 b p
式中b=k1/k2,低压下,b1/2p1/2<<1,上式简化为
b p
1 2
1 2
(3-15)
如果同一表面吸附了A、B两种粒子,
这种情况称为混合吸附 A的吸附速度为
Va1=k1PA(1-θ A-θ B)
A的解吸速度为
Va2= k2θ A 平衡时Va1= Va2,所以:
A =bPA 1 A B
定义单位质量的吸附剂具有的表面积 为比表面积。可按下式计算:
A0 A / W (3-3)
提高固体 比表面积方法
将固体粉碎成微粒
使固体内部具有多孔性
例:1g某种固体,其密度为2.2 g/cm3, 把它粉碎成边长为10-6 cm的小立方 体,求其总表面积。
解:设小立方体的边长为a,则其
在等温下达到平衡时有
V1= V2
即
k1 P (1-θ) =k2θ
bp = 1+bp
(3-10)
此式称为Langmiur吸附等温式,b称
为吸附系数。
图3-6Langmuir等温式示意图
1)当压力足够低时,bp<<1,则
θ =bp,即θ 与p成直线关系,符合 Herry定律; 2)当压力足够高时,bp>>1,则 θ ≈1,即θ 与p无关; 3)当压力适中,θ 用式(3-10)表 示。(或θ ∝Pm,m介于0→1之间)
吸附系数b随温度和吸附热而变化,其 关系式为:
Q RT
b=b0e
(3-13)
例:用活性炭吸附CHCl3,符合
Langmuir吸附等温式,在0 ℃时的饱 和吸附量为93.8 dm-3*kg-1。已知 CHCl3的分压为13.4kPa时的平衡吸 附量为82.5 dm-3*kg-1 。试计算CHCl3 的分压为为6.67kPa时的平衡吸附量。
P 1 C 1 P V ( P0 P) Vm C Vm C P0
(3-26)
V Cx Vm (1 x)(1 Cx x)
(3-27)
BET三常数吸附等温式
V Cx 1 n 1x n nxn 1 n 1 Vm 1 x 1 C 1x Cx
第三章
固体表面
3.1固体表面特性
3.1.1固体表面分子(原子)的运动受缚性
固体表面的特性之一是表面分子 (原子)的运动受到束缚。
在形成新表面的过程中可以认为包 括以下两个步骤:
(1)首先体相被分开,形成新表面。 (2)然后表面的分子或原子重排,
迁移到平衡位置。 对液体这两个过程同时完成; 对固体第二个过程难完成,产生表 面应力
体积V=a3,表面积为6a2,1g某固体 的体积为1/ρ,这样的小立方体的个 数n=(1/ρ)/V,所以,总表面积:
1 S 6a N 6a V 6 6 2 1 5 2 6a 2.8 10 cm 3 6 a a 2.2 10
2 2
3.2固体表面的自由能
3.2.1固体的表面能和表面应力
3.1.2固体表面的不均一性
固体表面的最突出特性之一是其不均一 性。表现为:
(1)表面粗糙
图3-1 固体表面的不均一性
平均高度
hav
h
i 1
n
i
n
均方根高度
2 hrms= hi / n i 1
n
1 2
(2)固体中晶体晶面的不均一性 (晶格缺陷、空位、错位)
(3-28)
n=∞, 上式成为二常数式; n=1,上式转化为Langmuir式
