九年级化学化学方程式的计算题20套(带答案)及解析
九年级化学化学计算题题20套(带答案)及解析
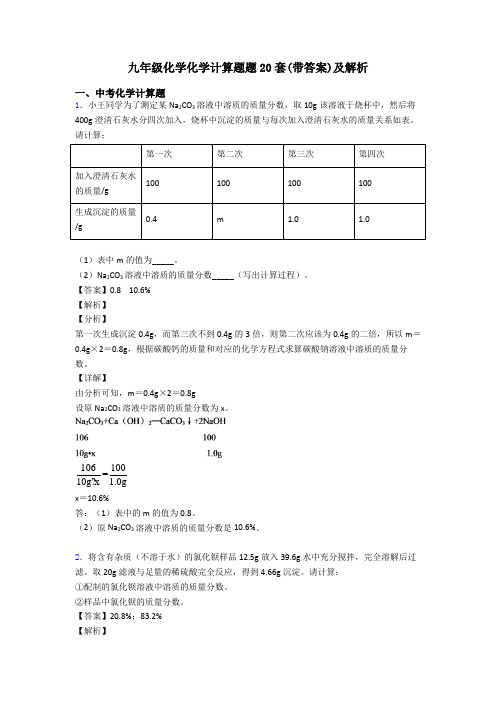
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
(化学)初三化学化学方程式的计算题20套(带答案)

(化学)初三化学化学方程式的计算题20套(带答案)一、中考化学方程式的计算1.高铁快速发展方便了人们的出行。
工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。
若用足量铝与48 kg 氧化铁反应,理论上可制得铁的质量是多少?【答案】33.6kg【解析】【分析】【详解】解:理论上可制得铁的质量为x 。
23232Al+Fe O =Al O +2Fe16011248kgx高温16048kg =112xx=33.6kg答:用足量铝与48 kg 氧化铁反应,理论上可制得铁的质量是33.6kg 。
2.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O 2+2H 2SO 4=2CuSO 4+2H 2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算: (1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg ,则该稀硫酸溶质的质量分数是多少_____?【答案】40% 12.25%【解析】【分析】【详解】(1)CuSO 4中Cu 元素质量分数=6464100%=100%=40%6432416160⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO 2CuSO 2Cu O 2=2982160x 40kg2H O+++⨯⨯ x 29840kg 2160⨯=⨯ x=24.5kg则稀硫酸溶质的质量分数=24.5kg 100%=12.25%200kg⨯。
3.“侯氏制碱法”制得的纯碱中含有少量氯化钠。
为了测得该纯碱的组成,进行以下实验:取NaCl和Na2CO3的固体混合物25克溶于适量的蒸馏水中,逐滴滴入溶质质量分数为10%的稀盐酸。
回答下列问题:(1)NaCl在生活中的用途广泛,请写出一种用途:_____。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是_____(填化学式)。
(3)求:原固体混合物中NaCl的质量分数_____(写出计算过程)。
【化学】九年级化学化学方程式的计算题20套(带答案)

【解析】
【分析】
【详解】
生成二氧化碳的质量为0.88g,设5g样品中碳酸氢钠的质量为x,则
解得x=3.36g;
该样品中碳酸氢钠的质量分数为 。
8.某水泥厂新进一批石灰石原料,该厂检验室为了测定该石灰石中碳酸钙的质量分数,取该样品12g与足量稀盐酸在烧杯中恰好完全反应(假设石灰石样品中的杂质不与稀盐酸反应,而且也不溶于水),有关实验数据如表:(烧杯的质量为82g)
(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A点表示恰好完全反应,此时溶质为氯化钠,B点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl和BaCl2;
(3)当滴加氯化钡溶液至图中A点时,所得溶液中溶质为氯化钠
设生成氯化钠质量为x反应硫酸钠质量为y,生成沉淀质量为z。
反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;
答:该石灰石中碳酸钙的质量分数83.3%;
(3)反应后生成溶液的溶质质量分数是: ×100%=14.7%
答:反应后生成溶液的溶质质量分数是14.7%。
答案:
(1)4.4g;
(2)83.3%;
(3)14.7%。
【点睛】
本考点考查了根据化学方程式的计算,属于根据化学方程式计算的综合应用,是中考计算题中经常出现的题型。做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”,本考点主要出现在计算题中。
反应前
反应后
实验数据
烧杯和稀盐酸的质量
石灰石样品的质量
烧杯和其中混合物的总质量
(化学)九年级化学化学计算题题20套(带答案)及解析

【解析】氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,铜不能和稀硫酸反应,根据反应的化学方程式及其提供的数据可以进行相关方面的计算。
设氧化亚铜质量为x。
Cu2O+H2SO4═CuSO4+Cu+H2O固体质量差量
144 64 144-64=80
x 6.8g-4.8g=2g
x=3.6g
答:原混合物中的Cu2O的质量为3.6g。
考点:质量守恒定律根据化学方程式的计算溶质的质量分数
8.氧化亚铜(Cu2O)可用于船底防污漆,防止海洋生物对船舶设备的污损,现将Cu2O和Cu的固体混合物6. 8 g放入烧杯中,加入过量稀硫酸,充分反应后,过滤、洗涤、干燥,得到4. 8 g固体。已知:铜和稀硫酸不能反应,Cu2O+H2SO4=CuSO4+Cu+H2O。计算:原混合物中的Cu2O的质量。
(1)取2.62g固体混合物加水完全溶解后,加入氯化钡溶液至不再产生沉淀为止,过滤干燥后,称得沉淀的质量为2.33g.求2.62g固体混合物中硫酸钠的质量是多少?
(2)另取等质量的固体混合物溶于56.38g水后,再加入12g一定质量分数的稀硫酸,恰好完全反应,试计算反应后所得溶液中溶质的质量分数.
【答案】(1)1.42g;(2)5%
考点:质量守恒定律根据化学方程式的计算溶质质量分数
x y z 4.4g
列比例式得:106:X=98:Y=142:Z=44:4.4克
解得:x=10.6g y=9.8g z=14.2g
硫酸溶液中溶质的质量分数:9.8克/100克×100%=9.8%
原样品的质量为:10.6g+(15.6g-14.2g)=12g
原样品中碳酸钠的质量分数为:10.6克/12克×100%=88.3%
初三化学化学计算题题20套(带答案)含解析

初三化学化学计算题题20套(带答案)含解析一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数:(1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%)比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大.【解析】【分析】【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x 1.88CO g高温 10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
【化学】中考化学《化学方程式》题20套(带答案)

【化学】中考化学《化学方程式》题20套(带答案)一、选择题1.在反应2A+5B═2C+4D中,C、D的相对分子质量之比为9∶22,若2.6g A与B完全反应后,生成8.8g D.则在此反应中B与D的质量比为()A.4∶9 B.8∶1 C.10∶11 D.31∶44【答案】C【解析】【分析】根据C、D的相对分子质量之比及反应中C、D物质的分子个数关系,计算出参加反应中两物质的质量关系;根据C、D物质的质量关系,由生成D的质量计算出生成C物质的质量;最后使用质量守恒定律,求得参加反应的B物质的质量,即可计算出B与D的质量比。
【详解】根据C、D相对分子质量之比为9∶22,则假设C、D相对分子质量分别为9、22,设生成8.8gD同时生成C的质量为x,2A+5B=2C+4D⨯⨯29422x8.8g29422⨯⨯=x8.8gx=1.8g根据质量守恒定律参加反应的B的质量为1.8g+8.8g-2.6g=8g,则B与D的质量比为8g∶8.8g=10∶11。
故选C。
2.在化学反应2A+B2=2AB中,A 与B2反应的质量关系如图所示,现将6g A和8g B2充分反应,则生成AB的质量是A.12g B.11g C.9g D.14g【答案】A【解析】【详解】由两者反应时的质量关系可知,两者反应的质量比是1:1,则可判断6g A和8g B2充分反应时B2会剩余2g,根据质量守恒定律可知生成的AB会是12g。
故选A。
3.下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。
下列说法正确的是()A.该反应属于置换反应B.参加反应的两种分子个数比为1:1C.1个X分子中含有3个原子D.1个X分子中含有3种不同的原子【答案】C【解析】【分析】由图可知,不同球代表不同元素的原子,两种化合物反应生成单质与化合物,由原子守恒可知,X中含1个大黑球和2个小白球,以此来解答。
【详解】A.反应物无单质,不属于置换反应,故A错误;B.由图可知,参加反应的两种分子个数比为1:2,故B错误;C.原子守恒可知,X中含1个大黑球和2个小白球,即1个X分子中含有3个原子,故C 正确;D.X中含1个大黑球和2个小白球,有2种不同原子,故D错误;故选:C。
【化学】化学化学方程式的计算题20套(带答案)

【化学】化学化学方程式的计算题20套(带答案)一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x8.8g100x =448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO2HCl=CaCl CO H O7344x 4.4g73x=,x=7.3g44 4.4g++↑+答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量3.有一种自生氧防毒面具,其使用的生氧剂的主要成分是(KO2)。
取100g生氧剂放入质量为20g的烧杯中,再向其中加入20g水,使生氧剂KO2全部反应,其充分反应后(4KO2+2H2O═4KOH+3O2↑),称得烧杯及烧杯中物质的总质量为116g,计算(假设杂质不含钾元素且不与稀硫酸反应)(1)100g生氧剂生成氧气的质量_____;(2)KO2中钾元素的质量分数为_____;(计算结果精确到 0.1%)(3)要将烧杯中的溶液完全中和,通过计算,需要溶质质量分数为10%的稀硫酸溶液的质量_____。
最新初三化学化学计算题题20套(带答案)

最新初三化学化学计算题题20套(带答案)一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C)与足量稀硫酸反应,得到0.48gH2(Fe x C与稀硫酸反应不产生H2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO2.试通过计算确定:(1)此粗还原铁粉中单质铁的质量_____(2)此粗还原铁粉中杂质Fe x C的化学式。
_____【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。
2442Fe +H SO =FeSO +562x0H .48g562=x 0.48gx=13.44gFe x C 的质量=14.06g ﹣13.44g=0.62g ; Fe x C 的中铁元素的质量=0.62g ﹣0.06g=0.56g则:56x 0.56g=120.06gx=2所以化学式为Fe 2C3.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl 的量为4.5g ~9g .(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g 生理盐水,则该病人每天可补充食盐约___g .(2)若用50g 溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g .(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g 溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g 沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____. 【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
(化学)中考化学化学方程式的计算题20套(带答案)含解析

(化学)中考化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金 10g ,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示:求:合金中铜的质量分数______。
【答案】67.5% 【解析】 【分析】铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据图示数据可以得出生成氢气的质量,根据氢气的质量可以计算出锌的质量,进一步计算出铜锌合金中铜的质量分数。
【详解】由图示数据可知,当加入20g 稀硫酸时,合金中的锌恰好反应完全,产生0.1g 氢气。
设参加反应的锌的质量为ag 。
2442n +H SO nSO H 652ag0.1gZ Z =+↑65a =20.1,解得a=3.25g 则合金中铜的质量为10g-3.25g=6.75g , 合金中铜的质量分数=6.75g10g×100%=67.5%, 答:合金中铜的质量分数为67.5%。
2.海洋是地球上最大的聚宝盆,浩瀚的海洋蕴含着丰富的化学资源,海水中化学资源的利用具有非常广阔的前景,目前世界上60%的镁是从海水中提取的,主要步骤如下图(1)在第①步中观察到的实验现象是_____。
(2)步骤②产生的氯化镁的质量与原卤水中氯化镁的质量相比_____(填“增大”、“减小”或“不变”之一)。
(3)某兴趣小组的同学取一定量的氢氧化镁固体,放入干净的烧杯中,向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中固体的质量与加入稀盐酸的质量关系如图所示,当加入10%的稀盐酸73g (即A 点)时,请通过计算,求此时所得不饱和溶液的质量_____。
【答案】产生白色沉淀 不变 78.8g 【解析】 【分析】 【详解】(1)石灰乳中的氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,在第①步中观察到的实验现象是产生白色沉淀;(2)根据中镁元素守恒,所以步骤②产生的氯化镁的质量与原卤水中氯化镁的质量相比不变;(3)设反应的氢氧化镁的质量为x222Mg(OH)2HCl =MgCl 2H O5873x73g 10%5873=x 73g 10%++⨯⨯x=5.8g此时所得不饱和溶液的质量为73g+5.8g=78.8g 答:所得不饱和溶液的质量为78.8g 。
初三化学化学方程式的计算题20套(带答案)含解析

初三化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO 2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO 2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO 2的质量为8. 8g 。
(2)设该大理石中碳酸钙的质量为x3222CaCO +2HCl =CaCl +H O +CO 10044x 8.8g↑100x =448.8gx=20g答:大理石中所含碳酸钙的质量为20g 。
2.氯酸钾24.5g 加热完全反应后,制得氧气的质量是___________?【答案】9.6g【解析】【分析】【详解】解:设制得氧气的质量是x 。
232MnO 2KClO 2KCl +3O 2459624Δ.5g x ↑2459624.5g x=x=9.6g答:制得氧气的质量是9.6g。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
3.过氧化钙(CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.某过氧化钙样品中含有少量不溶于水且不与水反应杂质,取该样品15.0g投入盛有108.0g水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气质量为3.20g,计算该样品中过氧化钙的质量分数____(写出计算过程)。
【答案】96%【解析】【分析】【详解】解:设过氧化钙质量为x,22222CaO2H O=2Ca(OH)O14432x 3.2g14432=x 3.2g++↑x=14.4g,该样品中过氧化钙的质量分数是:14.4g15.0g×100%=96%,答:该样品中过氧化钙的质量分数是96%。
【化学】化学化学方程式的计算题20套(带答案)及解析

【化学】化学化学方程式的计算题20套(带答案)及解析一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6%【解析】【分析】【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl 208142233117104g 20%y z x 208104g 20%208104g 20%208104g 20%===117x 142y 233zx=11.7g y=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g 100%10.6%205g ⨯≈ 答:溶质质量分数为10.6%2.如图是某胃药标签的部分内容,某校同学测定该药品 中 NaHCO 3 含量的过程如下:取 10 粒该药剂研碎后放入烧杯中,加入 50g 水后充分搅拌,再向其中滴加稀盐酸至恰好完全反应(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),共消耗稀盐酸 11.5g 。
(化学)九年级化学化学方程式的计算题20套(带答案)含解析

(化学)九年级化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.将一定质量的金属锌投入到100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)完全反应后生产氢气的质量为___________g。
(2)所用硫酸溶液的溶质质量分数_________。
(计算结果精确到0.1%)。
【答案】0.4 19.6%【解析】【分析】【详解】(1)由图可知,完全反应后生成氢气的质量为0.4g;(2)设所用硫酸溶液的溶质质量分数为xZn+H SO=ZnSO+H2442982100gx0.4g98100gx=x=19.6%20.4g答|所用硫酸溶液的溶质质量分数为19.6%。
2.利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。
每次取100 g样品配制成溶液,向其中加入质量分数为10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:测定次数第一次第二次第三次第四次样品质量/g100100100100氢氧化钠溶液质量/g3*******沉淀质量/g 2.32 4.64 5.8 5.8(1)求粗盐的纯度________。
(2)当样品与所加氢氧化钠溶液恰好完全反应时,求溶液中氯化钠的质量________。
(写出解题过程)【答案】90.5% 102.2 g【解析】【分析】【详解】解:根据题意设样品中MgCl2的质量为x,反应生成NaCl的质量为y。
22 MgCl2NaOH=2NaCl+Mg(OH)9511758x y 5.8g ↓+95x=58 5.8gx=9.5g117y=58 5.8gy=11.7gx=9.5 g,y=11.7 g(1)该粗盐纯度为:100g-9.5g100%=90.5%100g⨯(2)当恰好完全反应时,溶液中氯化钠的质量为:100 g-9.5 g+11.7 g=102.2 g答:(1)样品中粗盐的纯度为90.5%;(2)恰好完全反应时,溶液中氯化钠的质量为102.2 g。
九年级化学化学计算题题20套(带答案)含解析
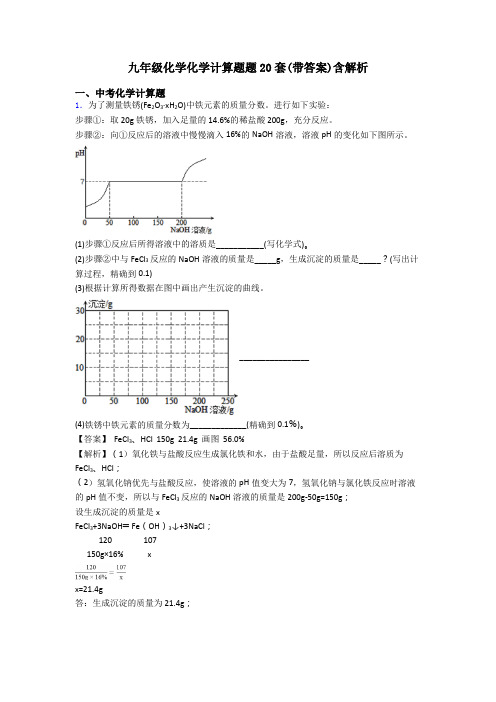
九年级化学化学计算题题20套(带答案)含解析一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
求:(1)铜锌合金中,Zn的质量分数是________。
(2)所用稀硫酸溶液中溶质的质量分数是__________?【答案】65% 19.6%【解析】试题分析:(1)铜锌合金与稀硫酸反应,其中只有锌与硫酸反应,故固体减少的量即为锌的质量=10g-3.5g=6.5g,则Zn%=6.5g/10g×100%=65%(2)解:设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑65 986.5g 50gx65/98=6.5g/50gxx=19.6%答:锌的质量是65%;所用稀硫酸中溶质的质量分数为19.6%考点:合金、化学方程式计算3.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O 3质量(x)的比例式_____ (3)铝土矿样品中A12O 3的含量_____;(4)坐标图中B 点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率是_____。
化学化学方程式的计算题20套(带答案)及解析

【答案】Na+、Cl﹣相符
【解析】
【详解】
(1)该注射液为氯化钠注射液,含有大量的Na+、Cl-;
(2)解:设溶液中含有的氯化钠的质量为x
x=1.17g
氯化钠注射溶液的质量分数:
答:与标签相符。
(1)该混合物中硫酸钡的质量为________g;
(2)求恰好完全反应时所得溶液中溶质的质量分数______。(结果精确到0.1%)
【答案】510.5%
【解析】
【分析】
【详解】
(1)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳。而硫酸钡不能与稀盐酸反应。所以最终剩余固体的质量是硫酸钡的质量。故答案为:5;
5.小明同学为了测定市面销售的某品牌纯碱中碳酸钠的质量分数(杂质为氯化钠,氯化钠溶于水且不与氯化钙反应),进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%的氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。实验所得数据见下表,请你分析并进行有关计算:
【答案】01.22.22.210.6%称量固体质量
【解析】
【分析】
【详解】
解:(1)由图表信息可知:实验2,产生气体质量为0g;实验3产生气体质量为1.2g;实验4,盐酸过量,则产生气体质量为2.2g;
(2)上述生成气体的总质量为2.2g;
(3)设:参加反应碳酸钠的质量为x。
x=5.3g
废水中Na2CO3的质量分数= ;
(知识卡片)
①洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
②HCl和NaHCO3反应的化学方程式为HCl+NaHCO3=NaCl+H2O+CO2↑
(化学)九年级化学化学计算题题20套(带答案)

(化学)九年级化学化学计算题题20套(带答案)一、中考化学计算题1.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是____g。
(2)所用稀硫酸的溶质质量分数____(写出计算过程)。
【答案】19.519.6%【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑65 98 2x y 0.4g659820.4x y g==x=13gy=19.6g混合物中铜的质量为32.5g-13g=19.5g所以稀硫酸中溶质的质量分数为19.6g0010019.600 100g⨯=答:(1)样品中金属铜的质量是19.5g。
(2)所用稀硫酸中溶质的质量分数为19.6%。
2.现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。
请在如图画出利用l00g8%的NaOH 溶液吸收CO2与生成NaHCO3的曲线。
____(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
【化学】初三化学化学计算题题20套(带答案)

【化学】初三化学化学计算题题20套(带答案)一、中考化学计算题1.将14.06g 粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C )与足量稀硫酸反应,得到0.48gH 2 (Fe x C 与稀硫酸反应不产生H 2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO 2.试通过计算确定: (1)此粗还原铁粉中单质铁的质量_____ (2)此粗还原铁粉中杂质Fe x C 的化学式。
_____ 【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。
2442Fe +H SO =FeSO +562x0H .48g562=x 0.48gx=13.44gFe x C 的质量=14.06g ﹣13.44g=0.62g ; Fe x C 的中铁元素的质量=0.62g ﹣0.06g=0.56g则:56x 0.56g=120.06gx=2所以化学式为Fe 2C2.鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。
化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:请回答下列问题:(1)鸡蛋壳发生反应的化学方程式为___________________________; (2)根据已知条件列出求解碳酸钙质量(X)的比例式______________;(3)该鸡蛋壳中碳酸钙的质量分数为_______;(4)最终所得溶液中溶质的质量分数为_______;(5)用36.5%的浓盐酸配制上述稀盐酸需加水的质量为_______。
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑80%7.7%50g【解析】【详解】(1)鸡蛋壳发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑。
化学化学计算题题20套(带答案)及解析

化学化学计算题题20套(带答案)及解析一、中考化学计算题1.某校兴趣小组在实验室中完成制取氧气的实验。
他们取氯酸钾和二氧化锰的混合物共6g 放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),请分析表中数据,完成下列问题:(1)完全反应时,生成氧气的质量为_____g ;(2)原混合物中氯酸钾的质量分数是____________?(计算结果精确到0.1%) 【答案】1.92g 81.7% 【解析】(1)氯酸钾发生分解反应生成氯化钾和氧气,二氧化锰作催化剂,反应前后二氧化锰的质量不变,根据质量守恒定律,生成氧气的质量为:6g-4.08g=1.92g 。
(2)设原混合物中氯酸钾的质量为x 。
2KClO 32MnO Δ2KCl+3O 2↑ 245 96 x 1.92g24596=1.92x g,解得x=4.9g 原混合物中氯酸钾的质量分数是:4.96gg×100%=81.7%点睛:首先根据质量守恒定律求出氧气的质量,然后根据化学方程式找出氧气与氯酸钾的质量关系,利用反应中物质的质量比不变进行列比例式计算,易错点是,由质量比算数错误,所以这一步一定要仔细检查。
2.我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na 2CO 3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na 2CO 3中常混有少量的NaCl ,现有样品11.0g ,将其放入干净的烧杯中,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数_____(计算结果精确至0.1%)【答案】纯碱或苏打 NH4+ Na2CO3与盐酸或HCl恰好完全反应 NaCl、HCl 96.4%。
【解析】(1)Na2CO3的俗名是纯碱或苏打,氯化铵中的阳离子是铵根离子,符号为NH4+。
【化学】化学化学方程式的计算题20套(带答案)含解析

【化学】化学化学方程式的计算题20套(带答案)含解析一、中考化学方程式的计算1.硝酸铵是农业生产中常用的化学肥料。
为测定某含有少量NaNO 3的硝酸铵样品中 NH 4NO 3的纯度,取2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH 溶液。
反应过程中放出的氨气质量及加入的NaOH 溶液的质量的关系如图所示:完成有关计算:(1)样品中硝酸铵的质量是____________ g 。
(2)所得溶液中 NaNO 3的质量分数是___________(保留一位小数)。
【答案】1.6 31.5%【解析】【分析】(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数。
【详解】(1)设2.0g 样品中含NH 4NO 3的质量为x 。
43332NH NO NaOH NaNO NH H O4g 20%+=++8040x ↑⨯48g 0x =4020%⨯ x= 1.6g答:样品中硝酸铵的质量是1.6g 。
(2)反应生成 NaNO 3的质量为 y ,反应生成的NH 3的质量为z 。
43332NH NO NaOH N +=++408517y aNO NH H O40%zg 2↑⨯404g 20%=85y⨯ 404g 20%=17z⨯ y= 1.7gz= 0.34g 反应后所得溶液中NaNO 3的质量分数为= 1.7g+(2g-1.6g)100%=31.5%2g+5g-0.34g⨯ 答:所得溶液中 NaNO 3的质量分数是31.5%。
【点睛】做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克。
(化学)初三化学化学计算题题20套(带答案)

NaOH + HCl = NaCl + H2O
40
36.5
x 50g 7.3%
40
x
36.5 50g 7.3%
x 0.4g
该瓶烧碱溶液的溶质质量分数 = 0.4g 100% 10% 40g
答:该瓶烧碱溶液的溶质质量分数为 10%。
3.取某碳酸钠样品放入烧杯中,加入 95.8g 水充分溶解,再向其中加入稀硫酸,反应放出 气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好 ___________________时,停止滴加稀盐酸。 (2)通过计算确定该瓶烧碱溶液的溶质质量分数。(写出计算步骤)___________。 【答案】无色 10%
【解析】
【分析】
(1)根据酚酞溶液遇碱性溶液呈红色,遇中性溶液为无色解答;
加入稀盐酸次数
1
2
34ຫໍສະໝຸດ 5烧杯及所称物质总质量/g 72.2
91.9
111.6
131.3
152.1
请计算: ⑴大理石样品中碳酸钙的质量分数;____________ ⑵恰好完全反应时烧杯内溶液的溶质质量分数。_____________ 【答案】80% 12.5% 【解析】 【详解】 分析表中数据可知,前四次加入盐酸后,共产生二氧化碳:1.1g×4=4.4g 设大理石中 CaCO3 的质量为 x,完全反应时,生成 CaCl2 的质量为 y
求: (1) 完全反应后,产生二氧化碳气体的体积是多少 L?,保留一位小数。(已知二氧化碳 气体密度为 1.9g/L) ⑵加入稀盐酸的的质量分数? ⑶计算原混合物中 NaCl 的质量分数,保留一位小数。 【答案】(1)2.3L;(2)7.3%;⑶53.6% 【解析】 NaOH、NaCl 和 Na2CO3 固体混合物中的 Na2CO3 固体能与稀盐酸反应生成二氧化碳气体,根据
初三化学化学方程式的计算试题(有答案和解析)含解析

【解析】
【详解】
设理论上可以制取硫酸锌的质量为x,则
解得x=80.5kg;
答:理论上可以制取硫酸锌的质量为80.5kg。
【点睛】
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
8.在实验室里加热30g氯酸钾和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g,将剩余固体加入85.1g的水中,氯化钾全部溶解。请计算:
(2)解:设所用稀硫酸溶液中溶质的质量分数是x
x=9.8%
答:所用稀硫酸溶液中溶质的质量分数是9.8%。
7.硫酸锌溶液可以作木材防腐剂。工业上常用红锌矿(主要含ZnO)和稀硫酸为原料制取硫酸锌,化学反应方程式为: 。现有50kg含ZnO81%的红锌矿,理论上可以制取硫酸锌的质量为____________?
【答案】17696.0%
【解析】
【分析】
【详解】
(1)设需要加水的质量为x,20.0g×98%=(20.0g+x)×10%,x=176g;
(2)设该样品中过氧化钙的质量为y
y=14.4 g
样品中过氧化钙的质量分数:
答:样品中过氧化钙的质量分数为96.0%。
3.配置溶液、计算练习
(1)实验室需配制100克质量分数为5%的食盐溶液,该实验中需要准确量取水______毫升。若某学生用量筒取水时,面对刻度线仰视凹液面最低处,则其所配制溶液中NaCl的质量分数_______5%(填“>”、“<”或“=”)。
【答案】95<2.5kg8056%33.5%
【解析】
【分析】
溶液稀释前后溶质质量不变,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,第一次和第二次两个实验所加合金质量相同,而所加稀硫酸的质量不同,但最后产生氢气的质量相同,说明第一次和第二次两个实验中合金均反应完,第二次实验中的酸一定过量;第三次实验与前两次实验相比,合金质量加倍,而稀硫酸的质量减少,但产生氢气质量不变,20g合金反应完需要消耗稀硫酸80g。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学化学方程式的计算题20套(带答案)及解析一、中考化学方程式的计算1.某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少?_____(写出计算过程)(3)y=_____。
(4)a点对应的溶液的溶质是(填化学式)_____。
【答案】5 11.1% 2.2g NaCl和CaCl2【解析】【分析】碳酸钙和稀盐酸反应氯化钙、水和二氧化碳,稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,稀盐酸反应完,碳酸钠再与氯化钙溶液反应生成碳酸钙沉淀和氯化钠。
【详解】(1)实验室用大理石和稀盐酸制备二氧化碳后溶液为稀盐酸与氯化钙的混合溶液,向其中加入10%的碳酸钠溶液,稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,稀盐酸反应完,碳酸钠再与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,故生成沉淀的质量是5g。
(2)设溶液中CaCl2质量为x2233CaCl+Na CO=2NaCl+CaCO111100x5g↓111100=x5gx=5.55g故溶液中CaCl2的质量分数为5.55g100%11.1% 50g⨯=(3)设生成二氧化碳的质量为y2322Na CO +2HCl =2NaCl +H O CO 1064453g 10%y+↑⨯ 10644=53g 10%y ⨯ y=2.2g (4)在a 点,稀盐酸与碳酸钠溶液恰好完全反应生成氯化钠、水和二氧化碳,故a 点对应的溶液的溶质是生成的氯化钠和大理石和稀盐酸制备二氧化碳得到的氯化钙,化学式为NaCl 和CaCl 2。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.为测定某过氧化钠样品的纯度,将2g 该样品与足量水发生如下反应(杂质不参与反应) :22222Na O + 2H O=4NaOH+O ↑ 。
生成气体质量与时间的关系如图所示。
计算该样品中过氧化钠的质量分数。
____________【答案】78%【解析】【分析】=100%⨯过氧化钠的质量样品中过氧化钠的质量分数样品的质量【详解】 由生成气体质量与时间的关系图可知,完全反应生成的氧气的质量为0.32g 。
设样品中过氧化钠的质量为x22222Na O +2H O =4NaOH +O 15632x 0.32g↑15632=x 0.32gx=1.56g该样品中过氧化钠的质量分数为1.56g 100%78%2g⨯=答:该样品中过氧化钠的质量分数为78%。
3.某造纸厂排放的废水中含有Na2CO3和NaOH。
为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次缓慢加入到烧杯中,产生气体质量与稀盐酸溶液的质量关系如图曲线所示。
回答下列问题:(1)请仔细分析如图数据,完成下表实验记录:实验次数1234稀盐酸的质量(g)10101010生成气体质量(g)0____________(2)上述生成气体________ g。
(3)计算该废水中Na2CO3的质量分数________。
(4)测定Na2CO3的质量分数,也可用下列方法:另取上述废水样品50g,向废水中逐滴加入CaCl2溶液,至反应完全时,经过滤、洗涤、干燥、_________,即可计算出Na2CO3的质量分数。
【答案】0 1.2 2.2 2.2 10.6% 称量固体质量【解析】【分析】【详解】解:(1)由图表信息可知:实验2,产生气体质量为0g;实验3产生气体质量为1.2g;实验4,盐酸过量,则产生气体质量为2.2g;(2)上述生成气体的总质量为2.2g;(3)设:参加反应碳酸钠的质量为x。
2322Na CO+2HCl=2NaCl+H O+CO10644x 2.2g↑106442.2x g= x=5.3g废水中Na2CO3的质量分数=5.3g100%10.6% 50g⨯=;(4)测定Na2CO3的质量分数,也可用下列方法:另取上述废水样品50g,向废水中逐滴加入CaCl2溶液与碳酸钠反应产生碳酸钙沉淀,至反应完全时,经过滤、洗涤、干燥、称量固体碳酸钙质量,根据该反应的化学方程式,即可计算出Na2CO3的质量分数。
4.在合成氨工业中,常用碳酸钾溶液吸收产生的二氧化碳得到碳酸氢钾,反应的化学方程式为:K2CO3+CO2+H2O=2KHCO3。
现向碳酸钾溶液中通入二氧化碳,完全反应后得到溶质质量分数为10%的溶液50 g。
(1)把该50 g溶液稀释成溶质质量分数为4%的溶液,需加水的质量是_____g。
(2)碳酸钾溶液中所含溶质的质量是多少?_____(请写出解题过程)。
【答案】75 3.45g【解析】【分析】溶液稀释前后溶质质量不变。
【详解】(1)设需加水的质量是x()⨯⨯50g10%=50g+x4%x=75g故把该50 g溶液稀释成溶质质量分数为4%的溶液,需加水的质量是75g。
⨯(2)碳酸氢钾的质量为50g10%=5g设碳酸钾溶液中所含溶质的质量是xK CO+CO+H O=2KHCO23223138200x5g138200=x5gx=3.45g故碳酸钾溶液中所含溶质的质量是3.45g。
【点睛】=⨯溶质质量溶液质量溶质质量分数5.取碳酸钙和硫酸钡的混合物15.0g于烧杯中,将150.0g的稀盐酸平均分成三次加入烧杯中,加入稀盐酸与烧杯中固体的质量关系如图所示,请完成下列问题:(1)该混合物中硫酸钡的质量为________g;(2)求恰好完全反应时所得溶液中溶质的质量分数______。
(结果精确到0.1%)【答案】5 10.5%【解析】【分析】【详解】(1)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳。
而硫酸钡不能与稀盐酸反应。
所以最终剩余固体的质量是硫酸钡的质量。
故答案为:5;(2)由图分析可知,10g碳酸钙恰好和100g的盐酸反应。
则恰好完全反应时,溶液中的溶质是氯化钙。
设生成氯化钙的质量为x。
3222CaCO+2HCl=CaCl+H O+CO1001114410g x y10011144==10g x y↑解得x=11.1g,y=4.4g。
恰好完全反应时,溶液的质量为:10g+100g-4.4g=105.6g。
则恰好完全反应时,所得溶液中溶质的质量分数为:11.1g×100%10.5% 105.6g≈。
6.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:烧杯质量样品的质量稀盐酸的质量烧杯+剩余物的总质量50g 5.8g94.6g150.2g注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:(1)恰好完全反应时,生成氢气的质量为_____ g;(2)样品中碳的质量分数_____(计算结果保留到0.1%);【答案】0.2g 3.4%【分析】【详解】(1)根据质量守恒定律可知,恰好完全反应时,生成氢气的质量:50g+5.8g+94.6g-150.2g=0.2g ,故填0.2;(2)解:设样品中铁的质量 x22Fe +2HCl =FeCl +H 562x0.2g ↑ 56:2=x :0.2g x=5.6g铁合金中碳的质量分数=5.8g-5.6g 5.8g×100%≈3.4% 答:铁合金中碳的质量分数为3.4%。
7.工业上冶炼 150吨含杂质为 2%的生铁,需要含杂质 20%的赤铁矿石多少吨?【答案】262.5t【解析】【分析】【详解】解:设需要纯氧化铁的质量为 x232Fe O 2Fe +3CO 160112x 150t (1-2%)3CO+⨯高温 160x =112150t (12%)⨯- x=210t故需要含杂质为 20%的铁矿石的质量为:210t =262.5t 1-20%答:需要含杂质 20%赤铁矿石的质量为 262.5t 。8.过氧化钙是一种常用的制氧剂,过氧化钙与水反应的化学方程式为:()22222CaO +2H O=Ca OH +2O ↑ ,当反应消耗掉150g 含过氧化钙96%的样品时,请计算:(1)过氧化钙中氧元素的质量分数是多少? (结果保留至0.1%)_____________(2)理论上可以制得氧气的质量是多少?_____________【答案】44.4% 32g【解析】【详解】(1)过氧化钙中氧元素的质量分数为:32100%44.4%40+32⨯≈ (2)解:设理论上可以制得氧气的质量为X 。
22222CaO +2H O=2Ca(OH)+O 14432150g 96%X↑⨯ 144150g 96%=32XX=32g⨯ 答:理论上可以制得氧气的质量为32 g 。
9.生铁是铁和碳的合金为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g ,放入烧杯中,向其中加入65. 0g 稀硫酸,恰好完全反应(假设杂质不参与反应).测得的实验数据如表:请你完成有关计算:(1)反应放出的氢气是多少?_____(2)生铁样品中铁的质量分数是多少。
_____(写出计算过程)(结果保留一位小数)【答案】0.2g 93.3%【解析】【分析】【详解】(1)据质量守恒定律可知,反应前后物质的总质量不变,反应放出的氢气是:97.0g-96.8g=0.2g ;(2)设生铁样品中铁的质量为x2442Fe + H SO ==F 562x0eSO +H .2g↑562=x 0.2gx=5.6g 生铁样品中铁的质量分数是:5.6g 100%93.3%6.0g⨯≈。
10.在煤中加入适量的生石灰制成供居民采暖用的“环保煤”,以减少二氧化硫的排放,减轻二氧化硫对空气的污染。
“环保煤”燃烧时用生石灰吸收二氧化硫,其反应的化学方程式为:2CaO +2SO 2+O 2=2CaSO 4。
某煤厂一次共加入含氧化钙80%的生石灰70 t ,计算:理论上最多可吸收二氧化硫的质量___。
【答案】64t【解析】【详解】解:一共加入氧化钙的质量为:70t 80%=56t设:理论上最多可吸收二氧化硫的质量为X 。
224+=11212856t X2CaO 2SO O 2CaSO +11256t =128XX=64t答:理论上最多可吸收二氧化硫的质量为64t 。
【点睛】本题是有关混合物的化学方程式计算,要注意把混合物的质量转化为纯净物的质量,再代入方程式进行计算。
