气固相催化反应实验-预习
气固相催化反应过程

气固相催化反应过程
气固相反应本征动力学是研究不受扩散干扰条件下的固体催化剂与其相接触的气体之间的反应动力学。
一般而言,气固相催化反应过程经历一下七个步骤:
①反应组分从流体主体向固体催化剂外表面传递(外扩散过程)
②反应组分从催化剂外表面相催化剂内表面传递(内扩散过程)
③反应组分在催化剂表面的活性中心吸附(吸附过程)
④在催化剂表面上进行化学反应(表面反应过程)
⑤反应产物在催化剂表面上脱附(脱附过程)
⑥反应产物从催化剂内表面向催化剂外表面传递(内扩散过程)
⑦反应产物从催化剂外表面向流体主体传递(外扩散过程)
七个步骤中,第①和第⑦步是气相主题通过气膜与颗粒处表面进行物质传递,称为外扩散过程;第②和⑥步是颗粒内的传质,称为内扩散过程;第③和第④步是在颗粒表面上进行化学吸附和化学脱附的过程;第⑤步是在颗粒表面上进行的表面反应动力学过程。
以上气割步骤是前后串联的:
外扩散内扩散
表面过程
由此可见,气固相催化反应过程是一个步骤过程。
如果其中某一步骤的反应速率与其他各步的反应速率相比要慢得多,以致整个反应速率取决于这一步的反应速率,该步骤就称为反应速率控制步骤。
反应过程达到定态时,各步骤的反应速率应该相等,且过程的反应速率等于
控制步骤的反应速率。
这一点对于分析和解决实际问题非常重要。
气固相催化反应的动力学步骤

气固相催化反应的动力学步骤以气固相催化反应的动力学步骤为标题,本文将从理论和实践两方面介绍气固相催化反应的动力学步骤。
一、理论部分1.催化剂的吸附在气固相催化反应中,催化剂的吸附是反应的第一步。
催化剂表面存在各种吸附位,其中最常见的是吸附位和活性位。
吸附位是催化剂表面的一个缺陷,其表面结构与晶体结构不同,因此吸附能力较强。
活性位则是吸附位上的一些具有活性的物种,如氢原子、羟基、氧原子等。
催化剂表面的吸附位和活性位对反应物的吸附和反应至关重要。
2.反应物的吸附反应物吸附在催化剂表面的吸附位和活性位上,通过化学键形成催化剂-反应物复合物,这是反应的第二步。
3.反应反应物在复合物的作用下发生反应,形成产物。
反应速率取决于反应物的浓度、催化剂的活性、反应温度等因素。
4.产物的脱附产物脱附是反应的最后一步,当产物与催化剂之间的键断裂时,产物会从催化剂表面脱离。
二、实践部分以催化裂化反应为例,介绍气固相催化反应的动力学步骤。
1.催化剂的选择在催化裂化反应中,催化剂的选择非常重要。
催化剂应具有较高的活性和选择性,同时还应具有较高的稳定性和寿命。
2.反应条件的控制催化裂化反应需要适宜的反应温度、反应压力、反应时间等条件。
反应温度一般在450-550℃之间,反应压力一般为1-2MPa。
3.反应物的选择催化裂化反应的反应物为长链烷烃,反应物的选择对反应的效果有很大影响。
一般来说,碳数较多的长链烷烃反应活性较低,而碳数较少的烷烃反应活性较高。
4.反应机理的研究通过对反应物和产物的分析,可以确定反应的机理和动力学参数,如反应速率常数、反应级数等。
这对于优化反应条件、提高反应效率具有重要意义。
气固相催化反应的动力学步骤包括催化剂的吸附、反应物的吸附、反应和产物的脱附。
在实践中,催化剂的选择、反应条件的控制、反应物的选择和反应机理的研究是保证反应效率和催化剂寿命的关键。
气固相催化反应实验-预习

化工专业实验预习报告【1】实验名称气固相催化反应实验班级姓名学号成绩实验时间同组成员一、实验预习1.实验目的(1)掌握乙醇脱水实验的反应过程和反应机理、特点。
(2)学习气固管式催化反应器的构造、原理和使用方法。
(3)学习如何对实验体系进行物料衡算,确定收率和转化率。
(4)学习气体在线分析的方法和定性、定量分析,学习手动进样分析液体成分。
(5)学习微量泵的使用,学会使用湿式流量计测量气体流量。
2.实验原理1)乙醇脱水反应历程实验表明,乙醇脱水可生成乙烯和乙醚两种化合物,但在浓硫酸或三氧化二铝催化下,控制温度可使反应生成其中一种化合物为主,反应如下:可见,乙醇的脱水方式随反应温度而异,在较高温度时主要发生分子内脱水生成乙烯,在较低温度下则发生分子间脱水生成乙醚。
对于乙醇脱水反应,由于对机理及动力学的研究结论很难达成一致,主要存在两方面的争论:○1乙醇脱水机理是连串反应机理、平行反应机理还是平行-连串反应机理;○2反应机理是吸附于催化剂上的两个临近乙醇分子间进行的L-H模型,还是一个气相乙醇分子和一个催化剂上处于吸附态的乙醇分子之间进行的R-E模型。
乙醇脱水反应的催化剂主要由γ-Al2O3和酸性ZSM-5分子筛两大类。
Blaszkowski和Van Santen指出:氧化铝型催化剂的催化机理和分子筛不同,γ-Al2O3的催化活性与其表面脱氢过程中形成的Lewis酸-Lewis碱对有关,富电子的阴离子氧表现出碱的特性,缺电子的阳离子铝表现出酸的特性。
相反,酸性分子筛的催化活性与Bronst酸-Lewis碱对有关,Bronst酸发生氢转移,而它邻近的Lewis碱能接受质子。
在此基础上,Cory B.Phillips等以ZSM-5分子筛为催化剂,提出乙醇脱水反应属于平行反应,会生成乙氧基这一中间产物,并且他们认为生成乙醚的过程与甲醇脱水生成二甲醚的过程非常相似。
Junko N.Kondo 等利用原位红外检测也证实在反应过程中乙氧基这一中间产物的存在。
气固相催化反应本征及宏观动力学

阿尔法队 队长:徐晓杰
主要内容
1
气固相催化 过程及其特 征
2
固体催化剂 及其结构特 征参数
3
气固相催化 剂反应本征 动力学
4
气固相催化 本征动力学 实验测定
气固相催化反应过程步骤
催化剂多为多孔性介质,相对于丰富的内孔,外表面 的催化作用贡献量可忽略不计
• 1 外扩散:反应组分由物流主体→催化剂外表面 • 2 内扩散:反应组分由催化剂外表面→催化剂内表面 • 3 吸附:反应组分在催化剂活性中心上吸附 • 4 表面化学反应:在催化剂表面进行化学反应 • 5 脱附:反应产物在催化剂表面解吸 • 6 内扩散:反应产物由催化剂内表面→催化剂外表面 • 7 外扩散:反应产物由催化剂外表面→物流主体
催化反应过程的特征
Ø 1 催化剂改变反应历程和反应速率 Ø 2 催化剂的存在不改变反应过程的热 力学平衡特性(∆GO=-RTlnK) Ø 3 催化剂等速加快/减小可逆反应的正 逆反应速率 Ø 4 催化剂对反应过程的选择性至关重要 Ø 5 如果希望催化剂充分发挥作用,应当 尽可能增加反应物与催化剂的接触
固体催化剂的组成
固体催化剂由三部分组成:活性组分、助剂和载体; 三者不能截然分开。
• 1 活性组分
双重催化剂:异构 化、重整反应 半导体催化剂:金属氧 化物、硫化物等(氧化、 还原、脱氢、环化、脱 硫(少量用于加氢))
1 3
2 4
金属催化剂:Pd、 Ag、Fe、Cu等(加 氢、脱氢、裂解(少 量用于氧化)) 绝缘体催化剂:IIIA、 IVA、VA族金属或非 金属氧化物、卤化物 等
• 2助催化剂(促进剂)
• 电子型:碱金属或碱土金属氧化物(K2O、Na2O) • 结构型:用高熔点、难还原的氧化物可增加活性组分表 面积和热稳定性
气固相催化反应宏观反应速率的测定

2.1.3气-固催化反应过程与控制步骤(精)
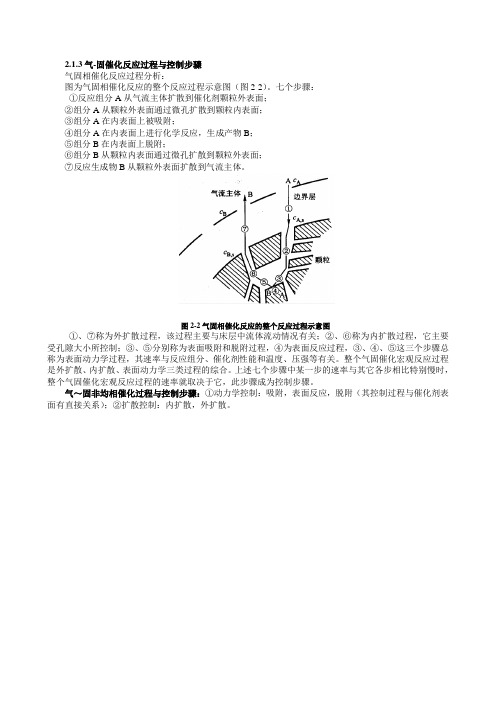
2.1.3气-固催化反应过程与控制步骤
气固相催化反应过程分析:
图为气固相催化反应的整个反应过程示意图(图2-2)。
七个步骤:
①反应组分A从气流主体扩散到催化剂颗粒外表面;
②组分A从颗粒外表面通过微孔扩散到颗粒内表面;
③组分A在内表面上被吸附;
④组分A在内表面上进行化学反应,生成产物B;
⑤组分B在内表面上脱附;
⑥组分B从颗粒内表面通过微孔扩散到颗粒外表面;
⑦反应生成物B从颗粒外表面扩散到气流主体。
图2-2气固相催化反应的整个反应过程示意图
①、⑦称为外扩散过程,该过程主要与床层中流体流动情况有关;②、⑥称为内扩散过程,它主要受孔隙大小所控制;③、⑤分别称为表面吸附和脱附过程,④为表面反应过程,③、④、⑤这三个步骤总称为表面动力学过程,其速率与反应组分、催化剂性能和温度、压强等有关。
整个气固催化宏观反应过程是外扩散、内扩散、表面动力学三类过程的综合。
上述七个步骤中某一步的速率与其它各步相比特别慢时,整个气固催化宏观反应过程的速率就取决于它,此步骤成为控制步骤。
气~固非均相催化过程与控制步骤:①动力学控制:吸附,表面反应,脱附(其控制过程与催化剂表面有直接关系);②扩散控制:内扩散,外扩散。
化学反应工程-15-第四章-气固相催化反应

0.5
1.5 PH 2
PNH
3
P PN 3 2 P H2 PNH k 2 1.53 PH
2
2 NH 3
0.5
KA kd K2 P
0.5
P 3 PH 2
2 NH 3
0.5
该式子一直到现在仍广泛应用。
4.4本征动力学方程的实验测定法
故
PR k PA K r 1 K1PA
4、两种活性中心 对反应: A B R S ,设表面反应控制
' r r3 k3 A B k3 R S
S K5 PSV 2 A K1 PAV 1 , B K 2 PBV 2 , , R K 4 PRV 1
r r3 k3 A B
应用Langmuir均匀吸附理论,可以求出 A 和 B 的值! 对(1):因达到平衡
k1 PAV k1 A
A K A PAV
同理对(2)
k1 设K A k 1 1
B K B PBV
2
2
h g h
2 K PNH 3 k a PN A 3 2 K2 P P H2
g g h
2 K PNH 3 kd A 2 3 KP PH 2
由实验获得模型参数g=h=0.5,上式:
KA r ka K2 P k1 PN
2、内扩散影响的检验:
方法:改变催化剂的粒度(直径 d P),在恒定的 w / FA0下测量转化率 x A 以xA ~ d P 作图:
若 d P 在b点左边,x A 不变。表明内扩散无影响。
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
气固相催化反应动力学

第五章气-固相催化反应动力学本章核心内容:介绍了气-固相催化反应的特点、固体催化剂的特征参数和均匀及不均匀吸附等温方程的要点,在此基础上,阐述了不同控制步骤的气-固相催化反应本征动力学方程。
本章的重点在于讨论有关固体催化剂的反应-传质 - 传热耦合的宏观过程、宏观动力学方程的建立及求解方法。
前已述及,化学反应可分为均相反应和非均相反应两大类。
均相反应动力学因无相间传质传热阻力属于本征动力学范畴,而气固两相催化反应存在相间传递阻力,使可测的主体气流温度和浓度与实际反应值不同,为了描述真实的反应速率,进行有效的气固催化反应器设计,从第五章开始,将学习和讨论气固非均相反应动力学及其反应器设计内容。
本章从它的机理方程入手,详细讨论气固相催化反应宏观动力学规律。
5-1气-固相催化反应5-1-1气-固相催化反应概述所谓气固相催化反应是指在反应条件下,在固体催化剂表面上进行的、反应物和产物均呈气态的一类化学反应。
例如,氮气和氢气在固体铁催化剂表面上进行的合成反应,二氧化硫在固体钒催化剂表面上转化为三氧化硫的反应,合成气在铜基催化剂表面上进行合成甲醇的反应等等,都属于气固相催化反应。
这一类型的催化反应在化工生产中所占的份额相当大,因此气固相催化反应动力学研究及其反应器设计等相关内容成为化学反应工程学的核心内容之一。
气固相催化反应的最大特点莫过于固体催化剂表面这个反应平台,它不仅可以改变反应路径、降低反应活化能,加快反应速率。
因此,在定义气固相催化反应速率时,离不开固体催化剂表面积 S 这个参变量的引入,即1 dn i(5-1)r iS dt固体催化剂表面积是固体催化剂的重要性能参数之一,对于特定的催化剂而言,单位质量催化剂所具有的表面积几乎是一个常量,两者之间具有高度的对应关系,所以在定义气固相催化反应速率时,也常常用固体催化剂质量W 替代式(5-1)中的 S。
气- 固相催化反应动力学研究的目的就是要建立气固相催化反应动力学方程,为气固相催化反应器的开发设计、选型、优化操作与控制提供理论依据。
气固相催化反应本征动力学教学

对于多步骤反应,需将各步骤的速 率方程组合起来,形成总速率方程。
动力学参数的确定
表观动力学参数
通过实验测定的参数,包 括表观活化能、指前因子 等。
本征动力学参数
反应物质本身的性质决定 的参数,需要通过理论计 算或实验测定。
参数估计方法
最小二乘法、极大似然法 等统计方法用于估计动力 学参数。
准确性和适用范围。
验证过程中可以采用多种方法, 如线性回归分析、残差分析、交 叉验证等,以评估模型的预测能
力和可靠性。
04
实验技术与数据处理
实验设备与操作流程
• 实验设备:气固相催化反应实验装置、气体流量计、温度 计、压力计、天平等。
实验设备与操作流程
操作流程 准备实验器材和催化剂样品;
按照实验装置图搭建实验装置;
微分形式
以反应速率对时间求导数 的方式建立模型,描述反 应速率随时间的变化。
积分形式
通过积分微分方程得到, 描述反应物浓度随时间的 变化。
反应机制与速率方程
反应机制
反应过程中各步骤的顺序和转化 关系,决定了反应的途径和速率。
速率方程
根据反应机制推导出的数学表达式, 描述了反应速率与反应物浓度的关 系。
03
本征动力学模型
理想动力学模型
理想物理过程的影响。
理想动力学模型适用于描述反 应初期阶段,当反应物浓度较 高时,反应速率受化学反应速 率控制。
理想动力学模型通常采用幂函 数形式表示反应速率与反应物 浓度的关系。
非理想动力学模型
非理想动力学模型考虑了扩散、传质等物理过程对反应速率的影响,适用于描述反 应后期阶段。
详细描述
甲烷燃烧反应在气固相催化反应中具有代表性,通过对其反应动力学的研究,可以深入 了解催化剂的作用机制和反应速率控制步骤。在实验中,通常采用原位光谱技术如红外 光谱、拉曼光谱等来实时监测反应过程,结合理论计算和模型拟合,可以获得准确的反
气固相催化反应的七个步骤

气固相催化反应的七个步骤一、反应物准备在进行气固相催化反应之前,首先需要准备好反应物。
反应物可以是气体和固体之间的反应,也可以是气体与固体催化剂之间的反应。
无论是哪种情况,反应物的准备都是必不可少的。
通常情况下,反应物会经过一系列的处理步骤,以确保其纯度和活性。
二、反应器选择选择合适的反应器对于气固相催化反应来说非常重要。
反应器的选择应该考虑到反应物的性质、反应条件、反应速率等因素。
常见的反应器包括管式反应器、固定床反应器、流化床反应器等。
不同的反应器有不同的优缺点,需要根据具体情况进行选择。
三、催化剂的选择催化剂是气固相催化反应中起关键作用的物质。
催化剂可以提高反应的速率和选择性,降低反应的温度和能量消耗。
选择合适的催化剂对于反应的成功进行非常重要。
催化剂的选择应考虑到反应物的性质、反应条件、催化剂的活性和稳定性等因素。
四、反应条件控制反应条件的控制对于气固相催化反应来说至关重要。
反应条件包括温度、压力、气体流速等。
不同的反应对于反应条件有不同的要求。
在确定反应条件时,需要考虑到催化剂的活性、反应物的稳定性和选择性等因素。
五、反应过程监控在进行气固相催化反应时,需要对反应过程进行监控。
监控反应过程可以了解反应的进行情况,及时调整反应条件,以达到预期的反应效果。
常用的监测手段包括温度、压力、气体流速等参数的监测,以及反应物和产物的分析等。
六、反应产物分离在气固相催化反应完成后,需要进行反应产物的分离。
反应产物的分离可以通过不同的物理和化学方法实现,如蒸馏、吸附、结晶等。
分离产物的纯度和收率对于反应的成功与否有着重要的影响。
七、反应废物处理气固相催化反应过程中会产生一些废物,这些废物可能对环境和人体健康造成潜在的危害。
因此,在进行气固相催化反应时,需要合理处理反应废物,以减少对环境的污染。
常见的处理方法包括回收利用和安全处置等。
通过以上七个步骤,可以完成气固相催化反应的整个过程。
每个步骤都有其重要性和特殊性,需要仔细考虑和操作。
6.5 气固催化反应
1 D Ae
_______ ________ D D __
1 1
AB KA
D eff
De
( r A ) g = k G S e ( c Ag - c A ) k G S e ( c Ag - c AS )
*
此种情况发生在活性组分分布均匀.催化剂颗粒相当小.外扩散 传质系数相对较小而反应速率常数又相对较大的时候。
如果反应是二级不可逆反应,则反应的宏观 ( r 速率可表示为: S c ) k S c c k
*
颗粒内浓度分布如右图
。
此种情况发生在催化剂颗粒相当大,并且外扩 传质系数和反应速率常数都相对较大的时候。
3.外扩散控制
( rA ) g = c Ag - c A 1 kG Se + 1 k s S i
*
1 kG Se
1 k s S i
且 1,及外扩散 总阻力的
过程的阻滞作用占过程 主要部分,有:
表面的反应组分量也等于颗粒内的实际反应量,因此:
( r A ) g k G S e ( c Ag c AS ) k s S i f ( c AS )
(rA)g-组分A的宏观反应速率 Se-单位体积催化剂床层中颗粒外表面积 kG-外扩散传质系数
若在颗粒内发生的是一级可逆反应,则f(cA)= cA- cA*,有:
*
推动力
( rA ) g =
c Ag - c A 1 kG Se + 1 k s S i
*
阻力
化学反应阻力
内扩散阻力
三、催化反应控制阶段 的判别 c - c (r ) = 1 1 1、本征动力学控制 +
* Ag A A g
9气固相催化反应动力学的测定

三、撰写实验报告1.数据处理(包括计算示例、数据图表)根据实验过程总结实验步骤如下(一)准备工作1.检查各个气瓶气体压力,确保气体足够实验。
2.检查各气瓶接口的气密性,打开气瓶阀门,利用肥皂水检测接口是否漏气。
3.检查工作面板、仪表等设备是否正常工作。
4.检查相关阀门的开闭状态。
(二)具体操作1.称取一定量的Ni催化剂与石英砂,在坩埚中混合均匀。
2.装样。
在反应器内石英衬管上装一层石英棉,小心倒入催化剂和石英砂的混合物,再在其上铺一层石英棉。
将反应器两端安装拧紧不漏气,插入热电偶。
3.把CO、氢气、氮气钢瓶的总阀打开,调节CO、氢气的减压阀到0.2 MPa,氮气为0.3MPa。
检查反应装置气密性。
4.打开氢气开关截止阀,打开氢气质量流量计,向反应器中通入50 SCCM流量的氢气。
以10 o C/min的升温速率将反应器温度升高至550o C,在此温度下用氢气还原Ni催化剂1h。
5.打开反应器炉膛,将床层温度降低到预定温度。
实验反应温度定为250-275 o C。
将氢气流量调节至280 SCCM。
当温度稳定后,打开CO 开关截止阀,打开CO质量流量计,向反应器中通入一定量的CO,以控制CO浓度在2%~15%之间。
6.监测反应器温度,稳定10分钟后通过六通阀向气相色谱进样,由气相色谱检测未反应的CO和反应产物甲烷的峰面积。
重复2-3次,直至所得结果基本不变。
改变CO流量,在相同的测定温度下重复以上实验,测出不同CO分压下出口气体中CO和甲烷的峰面积。
7.改变反应温度,重复以上实验。
实验结束后,停止加热,关闭质量流量计、气体截止阀和气瓶阀门。
2.实验结果及讨论(包括误差分析)根据以上实验测得数据结果列表如下:10 300 303 80 54.3 80 200.0191序号CH4峰面积/μVsCO2峰面积/μVsCO峰面积/μVsCH4含量/%CO2含量/%CO含量/%1 274 1578194 342 0.0174 99.9610 0.02162 1449 1181449 473 0.1225 99.8376 0.04003 2323 1129000 662 0.2052 99.7363 0.05854 4535 1147850 1070 0.3932 99.5141 0.09275 9474 1151513 1738 0.8148 99.0357 0.14946 16661 1147577 2706 1.4277 98.3404 0.23197 18876 2321474 5500 0.8148 98.9609 0.23458 19854 3560369 8856 0.5532 99.2001 0.24689 20462 4884977 11216 0.4162 99.2157 0.228110 34332 5162293 14133 0.6589 99.0699 0.2712 将rCO对pCO作图,由下式求各温度下的CO级数:即以lnrCO对lnpCO做图,直线拟合其斜率即为反应级数。
气固相催化反应的步骤

气固相催化反应的步骤
1. 催化剂预处理:将催化剂进行预处理,以去除表面的杂质和活性物种,并提高催化剂的活性和选择性。
常用的预处理方法包括煅烧、还原和氧化等。
2. 催化剂加载:将经过预处理的催化剂加载到固体底物上,形成催化剂-底物体系。
加载方法可以采用浸渍、沉积或物理吸附等。
3. 底物进料:将气体底物通过气体供给系统导入反应器。
底物可以是单一气体或混合气体,取决于具体反应的要求。
4. 反应发生:底物分子在催化剂表面发生吸附和解析反应。
此过程中,催化剂促进了底物分子之间的化学反应,并降低了反应的活化能,从而提高了反应速率和选择性。
5. 产物分离:反应产物经过催化剂表面的解析,从催化剂表面脱附,并通过分离系统进行分离和收集。
常用的分离方法包括凝固、吸附和脱附等。
6. 催化剂再生:催化剂在反应过程中可能会受到中毒或失活,需要进行再生以恢复催化剂活性。
催化剂再生方法根据具体反应的特点而不同,常用的再生方法包括煅烧、洗涤和修复等。
以上是气固相催化反应的一般步骤,具体情况会因反应种类不同而有所差异。
化学反应工程 第五章 气-固相催化反应工程

气-固相催化反应工程
第一节 概述 5-1 气-固相催化反应器的基本类型 5-2 反应器设计原则 5-3 催化反应器的数学模型 第二节 第三节 第四节 第五节 第六节 第七节 第八节 第九节 固定床的三传特性
各类固定床及其数学模型
流化床及其数学模型 催化反应过程进展
第一节
5-1
概述
气-固相催化反应器
床 层 深 度
反 应 进 度
温度
温度
轴向反应器VS径向反应器
Rp 3 kv Deff
1 1 1 ζ= th(3 ) 3
VS
固定床反应器优缺点
① 固定床中催化剂不易磨损; ② 床层内流体的流动接近于平推流,与返混式的 反应器相比,可用较少量的催化剂和较小的反应 器容积来获得较大的生产能力。 ③ 由于停留时间可以严格控制,温度分布可以适 当调节,因此特别有利于达到高的选择性和转化 率,在大规模的化工生产中尤为重要。 ① 固定床中的传热较差; ② 催化剂的更换必须停产进行。
原料气
x
平衡温度线
催化剂
最佳温度线
产物
T
2,多段固定床绝热反应器 (a)间接换热式
Ⅰ
Ⅱ
Ⅲ
x
平衡温度线
最佳温度线
Ⅳ T
2,多段固定床绝热反应器
Ⅰ Ⅱ
(b)原料气冷激式
Ⅲ Ⅳ
x
平衡温度线
最佳温度线
T
2,多段固定床绝热反应器 Ⅰ
Ⅱ
(c)非原料气冷激式
Ⅲ Ⅳ
x
平衡温度线
最佳温度线
T
二、连续换热式固定床催化反应器
ΔP 500
流化床反应器 fluidized reactor
气-固相表面催化反应

反应速率
一个物质的压力,
则速率随压力的变
化图上会出现一个
极大值
O
pA (或pB )
(b) Rideal 历程 吸附质点A与气态分子B之间的反应
若表面反应为速决步,反应速率方程为
r
k2 pBA
k2aA pA pB 1 aA pA aB pB
r
k2 pBA
k2aA pA pB 1 aA pA aB pB
(a)如果 aA pA 1
r
dpA dt
k2aA pA
kpA
一级反应
(b)如果 aA pA 1
r
dpA dt
k2
零级反应
pA pA0 k2t
例如,NH3在金属钨上的分解就属于这一类型
(c)如果压力适中,反应级数处于 0 1 之间
r k2aA pA 1 aA pA
如果除反应物被吸附外,产物也能吸附,这时
r k2aA pA pB
如果在速率与某一反应物分压的曲线中有极大 值出现,基本上可以确定该双分子反应是L-H历程 而不是Rideal历程。因此根据速率与分压的曲线形 状,可以作为判别双分子反应历程的一种依据。
吸附热沿DE线上升,合 成速率沿AB上升。
速率达到最高点B后, 吸附热继续上升,由于吸 附太强,合成速率反而下 降。
对应B点的是第八族第 一列铁系元素。
从吸附热衡量催化剂的优劣
气-固相表面催化反应速率
多相催化在固体催化剂表面上实现有下列五步: (i)反应物从气体本体扩散到固体催化剂表面; (ii)反应物被催化剂表面所吸附; (iii)反应物在催化剂表面上进行化学反应; (iv)生成物从催化剂表面上脱附; (v)生成物从催化剂表面扩散到气体本体中。
气固相催化反应乙醇脱水流化床实验报告

气固相催化反应乙醇脱水流化床实验报告1. 引言在化工领域,乙醇脱水是一种重要的反应过程,常用于生产乙烯、乙醚和乙醛等化合物。
传统的乙醇脱水方法往往采用酸催化剂,但这种方法存在环境污染和产品纯度不高等问题。
气固相催化反应是一种新兴的绿色技术,在乙醇脱水中具有广泛的应用前景。
本实验旨在通过流化床反应器进行乙醇脱水反应,探究不同反应条件对乙醇脱水反应的影响。
2. 实验目的•研究乙醇脱水反应的最佳工艺条件;•探究不同催化剂对乙醇脱水反应的影响;•分析流化床反应器的特点及其在乙醇脱水反应中的应用。
3. 实验方法3.1 实验材料•乙醇•催化剂:X、Y、Z3.2 实验设备•流化床反应器•传感器及数据采集系统3.3 实验步骤1.将催化剂X放入流化床反应器中,并预热至设定温度;2.启动流化床反应器,使其达到稳定状态;3.注入乙醇,并调节进料流量;4.收集反应产物,并进行分析;5.更换催化剂Y和Z,重复步骤1-4。
4. 实验结果与讨论4.1 不同催化剂对乙醇脱水反应的影响通过实验我们发现,催化剂对乙醇脱水反应具有显著影响。
在催化剂X的作用下,乙醇脱水反应产物中主要为乙烯。
而催化剂Y和Z则分别导致乙醚和乙醛的生成。
这说明不同催化剂具有不同的催化活性,可以选择合适的催化剂来控制反应产物的选择性。
4.2 乙醇脱水反应的最佳工艺条件我们进一步研究了乙醇脱水反应的最佳工艺条件。
通过调节反应温度和进料流量,我们发现在温度为300°C、进料流量为X时,乙烯的收率最高。
这表明在一定的温度和进料流量范围内,乙烯的产生达到了峰值。
4.3 流化床反应器的特点及其在乙醇脱水反应中的应用流化床反应器具有良好的传质与传热性能,能够提高反应速率和产物选择性。
在乙醇脱水反应中,流化床反应器能够有效控制反应温度和催化剂的分散性,提高反应效果。
此外,流化床反应器还具有连续生产的优势,适用于工业化生产。
5. 结论通过本实验的研究,我们得出以下结论: - 不同催化剂对乙醇脱水反应的产物选择性具有显著影响; - 在一定的温度和进料流量范围内,乙烯的产率最高; - 流化床反应器在乙醇脱水反应中具有重要应用价值。
2.2.2气~固相催化反应动力学.

2.2.2气~固相催化反应动力学宏观动力学:工业反应器中实际反应速度(不排除外界因素影响)的动力学关系。
本征动力学(微观动力学):排除外界因素影响,进行动力学研究得出的规律。
(一)气-固相催化反应速率气~固相催化反应速度定义:单位催化剂质量(或体积),单位时间内反应物数量的变化。
()dtdN w r A A 1-=-=反应消耗A 的摩尔数/催化剂质量、反应时间()/A r -=反应消耗A 的摩尔数/催化剂体积,反应时间=dtdN V Ap 1-(2—9)Cat V p ~体积有时以单位床层体积为基准,()dtdN V r AB A 1//-=- (2—10)~B V 床层体积关系()()()BA pA A r r r ρρ///-=-=- ~p ρ催化剂密度粒子[][][]33/m mkg kg 密度质量体积=~B ρ 催化剂床层堆积密度 (二)双曲线型的反应速率式(L-H-H-W )型基本假设:①反应发生在吸附分子之间或吸附分子与气体分子之间 ②()A r -与各组分在催化剂表面上的覆盖率成正比 基本步骤:①已知:反应物,产物,设想反应机理 ②定出每种机理的动力学方程式③实验推定动力学方程式参数的最佳值 ④检验模型的准确性 (一)表面反应控制1.双分子不可逆反应 S R B A +→+ 设想机理步骤:A 的吸附:σσA ↔+A ~σ吸附位B 的吸附:σσB ↔+B表面反应:σσσσS R +→B +A (控制步骤) R 的脱附:σσ+↔R R 其它步骤达到平衡 S 的脱附:σσ+↔S A表面反应速度:()B A r A k r θθ=- r k ~反应速率常数 根据L-H 吸附模型:SS R R B B A A AA A p K p K p K p K p K ++++=1θ (2—11)SS R R B B A A BB B p K p K p K p K p K ++++=1θ (2—12)()()()21S S R R B B A A BA B A r A p K p K p K p K p p K K k r ++++=-则()21S S R R B B A A BA p K p K p K p K p kp ++++=(2—13)2.双分子可逆反应S R B A +⇔+表面反应为 σσσσS R +⇔B +A 其它吸附、脱附同不可逆反应()SR k k r θθθθ21-=-B A A()2211S S R R B B A A SR S R B A B A p K p K p K p K p p K K k p p K K k ++++-=B A K K k k 1=令()221S S R R B B A A RS S R B A p K p K p K p K p p K K k k kp kp ++++-= SR B A K K k K K k K 21=令 ()()21/S S R R B B A A S R B A p K p K p K p K K p p p p k ++++-=(2—14)k K K k K SR 21=SS R R B B A A R R R p K p K p K p K p k ++++=1θ SS R R B B A A SS S p K p K p K p K p k ++++=1θ说明:分子有两项→可逆反应分母 A 、B 、R 、S→四种物质被吸附括号上的平方项→控制步骤是三步及到两个吸附位之间的反应(双分子反应) 3.2A 在吸附时解离 +⇔B +A R 2S 与上不同的是:*2σσσσσ++⇔B +A S R 反应速率式:()V S R A A k k r θθθθθ221-=-B ~V θ裸露率整理 ()()32221/SS R R B B A A S R B A p K p K p K p K K p p p p k ++++-=(2—15)说明:分母222A →A A p K 是解离吸附 4.吸附的A 与气相的B 进行不可逆反应 S R +→B +A 机理:σσA ⇔+Aσσ++→B +A S R反应速率:()AA BA A rB A r A p K p p K k p k r +==-1θ (2—16)其中 AA AA A p K p K +=1θ5.两类不同吸附位的情况 R →B +A机理11σσA ⇔+A22σσB ⇔+B 1σ吸附A *1221σσσσ+→B +A R 2σ吸附B 22σσ+⇔R R反应速率 ()B A r A k r θθ=-其中A θRR B B BB B A A A A p K p K p K p K p K ++=+=11θ()()()R R B B A A BA A p K p K p K p kp r +++=-11 (2—17)B A r K K k k = 说明:分母两个因子→两类不同吸附位吸附(二)吸附控制 化学反应式R ⇔B +A 若A 的吸附是控制步骤设想,机理: σσA ⇔+A σσB ⇔+Bσσσσ+⇔B +A R σσ+⇔R R反应速率(为A 的净吸附速度): ()b a A r r r -=-A d V A A k p k θθ-=其余各步达平衡:V B B B p K θθ= (2—18)V R R R p K θθ= (2—19) 而:1=+++V R B A θθθθ (2—20)令BB A VR R B R B A V R r p K p K K θθθθθθθθ⎪⎪⎭⎫ ⎝⎛=代入 BA VR r K R θθθθσσσσ=∴+⇔B +A 则V BRB r R A p p K K K θθ=(2—21) V V R R B B B RB r R R B A p K p K p p K K K θθθθθ-=⎪⎪⎭⎫⎝⎛++=++1 (2—22)RR B B BRB r R V p K p K p p K K K +++=∴11θ (2—23)则()A d A A a A k p k r θθ-=- (2—24)V B RB r R d A a p p K K K k p k θ⎪⎪⎭⎫⎝⎛-= (2—25)RR B B BR B r R BR B r r d A a p K p K p p K K K p p K K K k p k ++⎪⎪⎭⎫ ⎝⎛+-=1RR B B BRRB B R A a p K p K p p K K p p p k +++⎪⎪⎭⎫ ⎝⎛-=1 (2—26)其中R b B r a K k K K k K =Br RRB K K K K =⎪⎪⎭⎫⎝⎛=B A θθθθVR r K (三)脱附控制设:R 的脱附为控制步骤:④*σσ+⇔R RR ⇔B +A (①σσA ⇔+A ②σσB ⇔+B ③σσσR →B +A ) 推导结果:()()BA AB B B A A R B A A p p K p K p K Kp p p k r +++-=-1 (2—27)式中:B A r AB K K K K =;B A r b K K K k k =;BA r b aK K K k k K =例1镍催化剂在200℃进行苯加氢反应,若催化剂的平均孔径0510d m=⨯,p,4τ=,求系统总压力为3039.3kpa时,氢在催化剂内的有效扩散系数e D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化工专业实验预习报告
实验名称 气固相催化反应实验 班级
姓名
学号 成绩 实验时间 同组成员
一、实验预习 1.实验目的
(1)掌握乙醇脱水实验的反应过程和反应机理、特点。
(2)学习气固管式催化反应器的构造、原理和使用方法。
(3)学习如何对实验体系进行物料衡算,确定收率和转化率。
(4)学习气体在线分析的方法和定性、定量分析,学习手动进样分析液体成分。
(5)学习微量泵的使用,学会使用湿式流量计测量气体流量。
2.实验原理
1)乙醇脱水反应历程
实验表明,乙醇脱水可生成乙烯和乙醚两种化合物,但在浓硫酸或三氧化二铝催化下,控制温度可使反应生成其中一种化合物为主,反应如下:
可见,乙醇的脱水方式随反应温度而异,在较高温度时主要发生分子内脱水生成乙烯,在较低温度下则发生分子间脱水生成乙醚。
对于乙醇脱水反应,由于对机理及动力学的研究结论很难达成一致,
主要存在两方面的争论:○1乙醇脱水机理是连串反应机理、平行反应机理还是平行-连串反应机理;○
2反应机理是吸附于催化剂上的两个临近乙醇分子间进行的L-H 模型,还是一个气相乙醇分子和一个催
化剂上处于吸附态的乙醇分子之间进行的R-E 模型。
乙醇脱水反应的催化剂主要由
γ-Al 2O 3和酸性ZSM-5分子筛两大类。
Blaszkowski 和Van Santen 指出:氧化铝型催化剂的催化机理和分子筛不同,γ-Al 2O 3的催化活性与其表面脱氢过程中形成的Lewis 酸-Lewis 碱对有关,富电子的阴离子氧表现出碱的特性,缺电子的阳离子铝表现出酸的特性。
相反,酸性分子筛的催化活性与Bronst 酸-Lewis 碱对有关,Bronst 酸发生氢转移,而它邻近的Lewis 碱能接受质子。
在此基础上,Cory B.Phillips 等以ZSM-5分子筛为催化剂,提出乙醇脱水反应属于平行反应,会生成乙氧基这一中间产物,并且他们认为生成乙醚的过程与甲醇脱水生成二甲醚的过程非常相似。
Junko N.Kondo 等利用原位红外检测也证实在反应过程中乙氧基这一中间产物的存在。
Chang 等提出只要催化剂上存在足够多的酸性位,乙醇可以直接反应生成乙烯。
R. Le Van Mao 等在ZSM-5分子筛基础上提出在523~598 K 范围内乙醇直接生成乙烯,448~498 K 范围内乙醇生成乙醚,而498~523K 范围内生成乙烯和乙醚,反应是在Bronst 酸中心上进行的。
河北工业大学及上海石油化工研究院等对乙醇脱水反应进行了研究,同样
认为乙醇脱水反应符合平行反应机理。
实验以改性分子筛为催化剂,在消除内外扩散的前提下,对乙醇脱水反应的机理进行了研究。
结合文献,对本体系条件下提出如下反应机理:乙醇脱水生成乙烯和乙醚的反应属于平行反应,反应机理模型是吸附于催化剂上的2 个邻近乙醇分子之间进行的L-H 模型,具体反应历程如下:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
反应(3)、(7)或(8)、(12)分别为乙醇吸附、表面反应、水脱附的反应,均有可能成为反应的控制步骤,其余步骤为快速平衡的过程。
2)乙醇脱水反应所采用的催化剂
目前已报道的乙醇脱水催化剂有: 白土、活性氧化铝、氧化硅、磷酸、硫酸、氧化钍、氧化镉、
氧化锆、磷酸钙、杂多酸盐、分子筛、铝酸锌、Al2O3 /SiO2、Al2O3 /Cr2O3、Al2O32MgO /SiO2等,在工业上有应用报道的乙醇脱水催化剂主要有:活性氧化铝、活性白土、Al2O3 /SiO2、Al2O32MgO /SiO2等。
本实验采用的催化剂(ZSM-5分子筛)。
ZSM一5沸石分子筛的晶体,具有丰富的微孔通道和孔穴,在ZSM一5分子筛中进行的催化反应面临以下三种不同的条件和结果(即选择性):
(1) 由于大多数活性中心都已被限制在孔结构之内,所以,只有那些半径与分子筛孔径相当(较大或略大)的反应物分子,才有可能进入孔内,并在其中的活性中心上发生反应。
而无法进入孔内的反应物,只有在为数很少的外表面的活性中心上反应。
(2) 只有那些进入孔后而又能再从孔中扩散出来的分子,才可能作为产品出现。
当然,这种分子也只占一部分,而其余的产物分子,或者体积较大,或裂解成堵塞孔道、或使催化剂失活的小分子,则也不能从孔中排除作为产物出现。
(3) 某些孔内反应,因为需要形成体积较大的过度状态(或中间态)分子,由于它们受到分子筛孔道孔穴尺寸的约束和限制,使得这些过度态的中间产物,难以在孔中形成;反之,分子较小的过度态产物,则可以形成。
由于ZSM-5分子筛具有巨大的内表面,因此分子筛的活性中心不仅存在于分子筛表面上,而且内表面业存在催化活性中心起到催化作用。
在实验中,由于反应生成的产物乙醚和未反应的乙醇留在了液体冷凝器中,而其他几个产物都是挥发气体,进入尾气湿式流量计计量总体积后排出。
对于不同的反应温度,通过计算不同的转化率和反应速率,可以得到不同反应温度下的反应速率常数,并得到温度的关联式。
3.实验仪器和药品
仪器:乙醇脱水气固反应器、气相色谱及计算机数据采集和处理系统、精密微量液体泵。
药品:乙醇脱水催化剂、化学纯乙醇、分析纯乙醚、蒸馏水。
4.实验步骤
(1)装填催化剂
(2)流量计准备
(3)安装反应器
(以上三步实验时已做好)
(4)打开电源总开关,按照实验要求,调整好色谱条件:载气;氢气(氢气发生器);柱箱温度:150 o C;进样器温度:150 o C;检测器温度:150 o C;色谱柱:乙醇脱水专用(内径4 mm,长3 m)。
(5)将反应器加热温度设定为260 o C,预热器温度设定为200 o C(可以根据反应器温度的分配情况调节)。
温度设定无误后,打开加热开关,在开始加热时可用自整定设置。
(6)在温度达到设定值后,继续稳定10~20分钟,然后开始加入乙醇。
乙醇的加料速度为0.5~1.5 mL/min。
(7)反应进行20分钟后,正式开始实验。
先换掉反应器下的吸收瓶,并换上清洗干净的新瓶,检查升降台的高度,应该调节升降台,使冰水混合物尽可能多的浸没分离器。
记录湿式流量计读数,应每隔一定时间记录反应温度,压力等实验条件。
(8)反应开始每隔10~20分钟取一次数据,每个温度至少取两个数据,粗产品从分离器中放入量筒内。
(9)取少量样品,用气相色谱分析其组成,并计算出各组分的百分含量。
(10)改变反应温度,每次提高20~30 o C,重复上述实验步骤,则得到不同反应温度下的原料转化率、产物乙烯,乙醚收率,并根据动力学模型,可以得到反应速率常数。
二、实验记录260°C:
280°C:
如有侵权请联系告知删除,感谢你们的配合!。
