免疫抑制剂类药物评价体系
免疫细胞功能状态量化检测评估与临床应用专家共识

· 指南与共识·免疫细胞功能状态量化检测评估与临床应用专家共识中国医疗保健国际交流促进会肝脏移植学分会 中国医疗保健国际交流促进会肾脏移植学分会 中国医药生物技术协会生物诊断技术分会 【摘要】 免疫系统是维持机体器官功能健康和预防疾病的重要保障,免疫健康管理和疾病免疫治疗目标是恢复免疫系统的正常功能状态。
免疫学领域研究解决了如何抑制或提高免疫状态的技术性难题,随之带来亟需回答的问题是如何全面地检测和量化评估免疫状态,这是下一个挑战,目前国际上尚无成熟解决方案。
免疫状态量化检测与可视化评估对疾病防控、亚健康状态管理和疾病免疫治疗均具有重要意义。
本专家共识针对正常免疫状态定义和免疫细胞功能状态(免疫力)全面量化评估及可视化评分技术手段等问题进行了初步讨论,提出了正常免疫状态相关的基础概念和思考,探讨免疫细胞功能状态量化检测评估方向和原则,并以此为契机,推动免疫力解码以及免疫健康领域基础课题和临床试验的深入研究。
【关键词】 免疫力;免疫细胞;免疫评估;免疫治疗;健康管理【中图分类号】 R617, R392.4 【文献标志码】 A 【文章编号】 1674-7445(2024)04-0005-10Expert Consensus on quantify monitoring and assessment of immune cell function status and clinical application China International Exchange and Promotive Association for Medical and Health Care (CPAM), Society of Liver Transplantation ,Society of Kidney Transplantation; China Medicinal Biotech Association (CMBA ), Society of Biological Diagnostics.Corresponding authors: He Qiang, Beijing Chaoyang Hospital of Capital Medical University, Beijing 100020, China, Email:*******************Li Xianliang, Beijing Chaoyang Hospital of Capital Medical University, Beijing 100020, China, Email:***********************【Abstract 】 The immune system is the important guarantee for maintaining the health of organ function and preventing diseases. The goal of immune health management and immune treatment is to restore the normal function of the immune system. The technical problems of how to inhibit or enhance the immune status has been solved in the field of immunology, but how to comprehensively detect and quantitatively evaluate the immune status is still a challenge. There is no mature solution at present. The quantification detection and visualization evaluation of immune status are of great significance for disease prevention and control, sub-health status management, and immune treatment. This expert consensus has carried out preliminary discussions on the definition of normal immune status and the comprehensive quantitative evaluation and visual scoring techniques of immune cell function status (immune function), put forward the basic concepts and thinking related to normal immune status, discussed the direction and principles of quantitative detection and evaluation of immune cell function status, and taken this as an opportunity to promote the decoding of immunity and the study of basic and clinical trials in the field of immune health.【Key words 】 Immunity; Immune cell; Assessment of immunity; Immunotherapy; Health managementDOI: 10.3969/j.issn.1674-7445.2024078基金项目:国家自然科学基金(82370665);北京市自然科学基金(7232068、7232065)通信作者单位: 100020 北京,首都医科大学附属北京朝阳医院(贺强、李先亮)通信作者:贺强,Email : *******************;李先亮,Email : ***********************第 15 卷 第 4 期器官移植Vol. 15 No.4 2024 年 7 月Organ Transplantation Jul. 2024 免疫系统是人类健康的基石,大多数疾病和健康状况与免疫状态密切相关,因此免疫状态管理是健康核心问题。
免疫制剂评价体系

免疫抑制剂类药物评价体系一、概述免疫抑制剂是对机体的免疫反应具有抑制作用的药物。
能抑制与免疫反应有关细胞(T细胞和B细胞等巨噬细胞)的增殖和功能,能降低抗体免疫反应的制剂。
免疫抑制剂主要用于器官移植抗排斥反应和自身免疫病如类风湿性关节炎、红斑狼疮、皮肤真菌病、膜肾球肾炎、炎性肠病和自身免疫性溶血贫血等。
常用的免疫抑制剂主要有五类:(1)糖皮质激素类,如可的松和强的松、泼尼松龙等;(2)微生物代谢产物,如环孢菌素和藤霉素等;(3)抗代谢物,如硫唑嘌呤和6-巯基嘌呤等;(4)多克隆和单克隆抗淋巴细胞抗体,如抗淋巴细胞球蛋白和OKT3等;(5)烷化剂类,如环磷酰胺等。
二、点评依据1. 《处方管理办法》(卫生部令第53号)及其附件2. 《医疗机构药事管理规定》(卫医政发〔2011〕11号)3. 《医院处方点评管理规范(试行)》(卫医管发〔2010〕28号)4. 《国家基本药物目录 2009年版基层部分》中华人民共和国卫生部三、实施方案1. 抽样标准:处方中含有静脉用或口服给予免疫制剂类药物的处方;2. 抽样频率:1次/月;3. 抽样时间:每月1日到月末;4. 抽样方法:随机抽样或全样本抽样;5. 点评方法:点评所抽取患者的处方或用药医嘱,按“免疫制剂类药物点评处方规范性的参照指标”要求内容点评。
四、点评要点【点评标准】1. 适应证不适宜的;2. 遴选药品不适宜的;3. 药品剂型或给药途径不适宜的;4. 用法、用量不适宜的;5. 联合用药不适宜或有配伍禁忌;6. 重复给药的;7. 医师超权限使用糖皮质激素的;8.其他用药不适宜情况的。
五、工作表格临床病历用药点评表科室病历号主管医师诊断:用药点评:点评人:日期:。
《儿童难治性肾病综合征的临床及病理研究与应用》项目公示材料pdf

关于调整推荐2016年度湖南省科学技术奖项目的公示一、项目名称儿童难治性肾病综合征的临床及病理研究与应用二、推荐单位意见该项目探讨的是儿童肾脏疾病临床诊治的难题,也是肾脏病领域的焦点及热点问题。
课题组有5项主要的科学发现:①建立了儿童难治性肾病综合征(RNS)的肾脏病理损害定量评价体系,使得对儿童肾脏损害的病理分析从过去定性分析上升为定量分析评价。
②率先将免疫抑制剂霉酚酸酯应用于2岁以下的婴幼儿难治性肾病综合征,推动了对婴幼儿NS治疗的发展。
③发现肾病综合征患儿肾脏局部肾素血管紧张素系统的激活与儿童肾病综合征的临床表型及肾脏病理损害密切相关;并率先将血管紧张素转换酶抑制剂(ACEI)—福辛普利应用于儿童RNS的治疗,为ACEI药物在儿童RNS中的应用提供了宝贵的临床经验。
④首次报道了FLG基因突变在RNS中的意义。
⑤发现儿童PNS的发病年龄、临床表型、病理类型等的构成比近年在发生着变化,丰富了儿童的临床及病理资料库。
该项目具有较好的学术性和实用性,拓展了儿科肾科临床医师对儿童NS的治疗途径,改善了RNS患儿的预后,并且适合于在儿科学、临床肾脏病领域推广应用,具有较好的社会效益和经济效益。
同意推荐申报湖南省科技进步奖。
三、项目简介主要技术内容和创新点:①研发制订儿童难治性肾病综合征(RNS)肾脏病理损害的评分系统,使得对儿童肾脏损害的病理分析从过去定性分析上升为定量分析评价,为儿科医生及肾脏科医生诊治、评估RNS患儿提供了依据。
②研究免疫抑制剂—霉酚酸酯(MMF)治疗2岁以下的婴幼儿RNS的疗效及安全性,推动了婴幼儿肾病综合征治疗的发展,改善了婴幼儿RNS患儿预后。
③探讨肾病综合征患儿肾脏局部血管紧张素系统(RAS)、激素反应性、肾脏病理损害程度间的关系,阐明了儿童RNS的部分机制。
并率先将血管紧张素转换酶抑制剂(ACEI)—福辛普利钠应用于儿童难治性肾病综合征的治疗,为ACEI药物在儿童RNS中的应用提供了宝贵的临床经验。
茶碱血药浓度室内质量控制方法的建立

茶碱血药浓度室内质量控制方法的建立!苗仁华**,庄星星,张鹏(安徽医科大学附属巢湖医院药剂科,安徽巢湖238000)!基金项目:安徽医科大学校科研基金(Nr. 2020xkj222)*副主任药师。
研究方向:治疗药物监测及个体化用药。
E-maii :zzshzh@163. com中图分类号 R974文献标志码 A文章编号 1672-2124( 2021) 04-0441-04DOI 10. 14009/j. issn. 1672-2124. 2021.04. 014摘 要 目的:运用Westgard 多规则理论建立酶联免疫法测定茶碱血药浓度的室內质量控制方法"方法:制备茶碱质控血清5. 0、10.0及20.0 $a/nil ,在连续20个工作日內对上述低、中及高浓度的质控血清进行监测,绘制Levey-Jennings 质控图和Z-分数 质控图,采用Westgard 多规则进行质量评估"结果:茶碱低、中及高浓度质控血清的精密度、稳定性和回收率试验结果均符合要求$ Levey-Jennings 方法和Westgard 多规则控制方法均未提示失控情况。
结论:利用室內质量控制评价体系对茶碱血药浓度监测 数据进行评估,可以保证血药浓度测定的准确性、可靠性,从而为临床合理化给药提供准确信息"关键词 茶碱血药浓度$治疗药物监测$室內质量控制Establishment of Internal Quality Control Method for Blood Concentration of Theophylline !MIAO Renhua & ZHUANG Xingxing , ZHANG Peng ( Dept. of Pharmacy & Chaohu Hospital of Anhui Medical University & Anhui Chaohu 238000 & China )ABSTRACT OBJECTIVE : To establish an intern! quality control method for the blood concantration of theophyllineby enzyme-linked immunosorbent assay ( ELISA ) using Westgard multiple rules theoo , METHODS : 5. 0 $gml,10. 0 $g/ml and 20. 0 $g/ml of quality controO serum of theophylline wera prepared , after 20 consecutive working dayt of monitoring on low, medium and high concentration of quality contcO serum, LeeyJennings quality contcO chatsand Z-scora quality controO charta were plotted & and Westgard multipie ruie wat used Or ita quality ysessment. RESULTS : The precision & stability and recovero test osu O s of the low, medium and high concentration of qualitycontroO serum of theophylline were all i accordanco with the requirementt ; both the Levey -J ennings method and Westgard multiple rule contror method euggested no uncontrolled eituatione. CONCLUSIANS : Using the internal qualitycontror assessment system te conduct evaluation on blood concentration monitoring datg of theophylline con ensure theaccuocy and reliability of blood concentetion degrmination & gius providing accurate information foe c0nicyl rational drug administration.KEYWORDS Blood concentration monitoring of theophylline ; Therapeutic drug monitoring ; Internal quality controO茶碱的临床治疗安全窗较窄,相同剂量个体血药浓度差 异大[1-2];其体内药动学过程个体差异大,血药浓度超过临床 推荐治疗范围时极易出现中毒症状(34) %因此,在使用茶碱类药物时对其进行血药浓度监测显得尤为重要,血清茶碱浓度监测逐渐被临床医师和患者所接受,血药浓度监测被认为是 保证茶碱类药物合理使用的最重要手段灼%室内质量控制(internal quality control , A )C )作为全面质量管理体系的重要环节,是检测实验室测定结果准确性、及时发 现检测方法实验误差的管理体系(6-)%现阶段,治疗药物监测工作实现IQC 的一般方法是由实验室工作人员采取特定的方 法和程序,连续一段时间内评价本实验室检测结果的可靠性,以判断实验结果的真实性 W 治疗药物监测室实行IQC 旨在对实验室检测数据的真实性进行评价,以判断实验室检验工作的可靠性% IQC 结果对实验室检测结果的有效性和准确性有着参考价值%因此,本研究采用自制不同浓度的茶碱质控血清,连续 20 d 不间断监测质控血清,绘制质控图,结合Westgard 多规则[6'11]质量控制评价体系评价本实验室IQC 情况,建立、完善茶碱血药浓度监测IQC 体系[12],提高血药浓度监测的准 确性%1材料1.1仪器Viva-E 型全自动生化分析仪(德国SIAMENS 公司); Sartorius 型电子天平(赛多利斯科学仪器(北京)有限公司); TGL-16E 型高速离心机(长沙英泰仪器有限公司);海尔DW-4OL188型医用低温保存箱(青岛海尔特种电器有限公司)%1.2药品与试剂Emit 法茶碱检测试剂(德国SIAMENS 公司,批号为4P01946963)'茶碱对照品(中国食品药品检定研究院,规格为100Rg/支,批号为100121-201805);Emit法茶碱定标液(0、2.5、5.0*10.0*20.0及40.0$/ml,德国SIEMENS公司,批号为4P10938092)'空白血清(上海斯信生物科技有限公司,批号为MR16118)2方法与结果2.1质控样品的制备精密称定茶碱对照品10.0m/置于10.0ml容量瓶中,定容,制备1.0m/ml的茶碱对照品溶液,备用。
新型抗肿瘤药物的研发与应用评价

新型抗肿瘤药物的研发与应用评价第一章引言近年来,肿瘤成为全球范围内最具挑战的健康问题之一。
传统的治疗方法,如手术切除、放射疗法和化疗,存在一定局限性。
因此,研发新型抗肿瘤药物成为医学领域的重要研究方向。
本章将对新型抗肿瘤药物的研发与应用评价进行介绍。
第二章新型抗肿瘤药物的研发2.1 分子靶向治疗分子靶向治疗是一种基于肿瘤细胞分子特征的治疗策略。
通过研究癌症发生和发展的分子机制,针对特定的分子靶点,设计和合成药物,以达到抑制肿瘤细胞增殖和促进凋亡的目的。
阿尔兹海默症治疗药物“多奈哌齐”是一种典型的分子靶向药物。
2.2 免疫治疗免疫治疗是通过调节机体的免疫系统,增强机体抗肿瘤能力,达到治疗肿瘤的目的。
免疫检查点抑制剂是免疫治疗的主要手段之一,通过抑制肿瘤细胞对免疫系统的逃避机制,使机体的免疫细胞能够主动攻击肿瘤细胞。
免疫治疗在黑色素瘤等恶性肿瘤的治疗上取得了显著的成果。
第三章新型抗肿瘤药物的应用评价3.1 临床效果评价临床效果评价是评价新型抗肿瘤药物应用效果的重要指标。
通常采用化疗疗效评价标准、病理学指标、影像学检查等方法来评价患者的治疗效果。
同时,还需考虑药物的副作用和耐药性问题。
3.2 经济效益评价经济效益评价是评价新型抗肿瘤药物应用效果的重要方面之一。
药物研发和生产需要巨大的投入,因此,要综合考虑药物的疗效和费用,评估其在临床应用中的经济效益。
此外,还需考虑患者的支付能力,以及药物的可及性。
3.3 安全性评价安全性评价是评价新型抗肿瘤药物应用效果的重要内容。
药物的安全性直接关系到患者的生命安全和身体健康。
因此,在药物研发和临床应用中,要进行严格的安全性评估,确保药物的安全性。
第四章指标体系的建立为了更好地评价新型抗肿瘤药物的研发与应用效果,需要建立科学合理的评价指标体系。
指标体系应包括临床效果、经济效益、安全性等方面的指标,综合考虑多个因素,并根据不同的肿瘤类型和药物特点进行调整和改进。
第五章评价方法的选择选择合适的评价方法是评价新型抗肿瘤药物的研发与应用效果的关键。
细胞治疗产品研究与评价技术指导原则(试行)

附件细胞治疗产品研究与评价技术指导原则(试行)一、前言近年来,随着干细胞治疗、免疫细胞治疗和基因编辑等基础理论、技术手段和临床医疗探索研究的不断发展,细胞治疗产品为一些严重及难治性疾病提供了新的治疗思路与方法。
为规范和指导这类产品按照药品管理规范进行研究、开发与评价,制定本指导原则。
由于细胞治疗类产品技术发展迅速且产品差异性较大,本原则主要是基于目前的认知,提出涉及细胞治疗产品安全、有效、质量可控的一般技术要求。
随着技术的发展、认知的提升和经验的积累,将逐步完善、细化与修订不同细胞类别产品的具体技术要求。
由于本指导原则涵盖多种细胞类型的产品,技术要求的适用性还应当采用具体问题具体分析的原则。
二、范围本指导原则所述的细胞治疗产品是指用于治疗人的疾病,来源、操作和临床试验过程符合伦理要求,按照药品管理相关法规进行研发和注册申报的人体来源的活细胞产品。
本指导原则不适用于输血用的血液成分,已有规定的、未经体外处理的造血干细胞移植,生殖相关细胞,以及由细胞组成的组织、器官类产品等。
—1—三、风险控制由于细胞治疗产品种类多、差异大、性质复杂多变、研究进展快、技术更新迅速、风险程度不同,因此,对于不同类型产品,可基于风险特征和专项控制措施,采用适合其产品的特有技术。
细胞治疗产品的风险很大程度上取决于细胞的来源、类型、性质、功能、生产工艺、非细胞成分、非目的细胞群体、全生产过程中的污染和/或交叉污染的防控,以及具体治疗途径及用途等。
不同细胞治疗产品的制备及使用过程可能会给患者带来不同程度的风险。
细胞治疗产品应根据不同的风险制订相应的风险控制方案。
从细胞治疗产品研发初始,应根据已有认识及其预期用途进行全面分析,并应在整个产品生命周期内不断地收集和更新数据,明确和防范风险。
在评估产品的整体风险时,应考虑各种因素对产品风险的影响,比如细胞的来源,细胞的操作程度,细胞的增殖、分化、迁移能力,细胞体外暴露于特定培养物质时间、细胞培养时间、细胞存活情况和细胞代次,非细胞成分的毒性作用,物理性及化学性处理或基因修饰/改造对细胞特性的改变程度,细胞和生物活性分子或结构材料组成的组合产品,激活免疫应答的能力,免疫识别的交叉反应,使用方式以及对受者的预处理,类似产品的经验或相关临床数据的可用性等多方面因素。
药物作用机制及药效评估

药物作用机制及药效评估药物作用机制与药效评估是药物研究的重要环节。
了解药物的作用机制有助于我们理解药物如何产生治疗作用,进而评估药物的药效。
药物作用机制是指药物与生物体内的靶点结合,改变靶点的结构或功能,从而发挥治疗作用的过程。
药物的作用机制可分为多种类型,常见的有以下几种:1. 受体结合型药物:这类药物与生物体内的受体结合,改变受体的构象或激活受体下游的信号通路。
例如,乙型受体阻滞剂可以选择性地结合乙受体,从而抑制受体的活性,降低心脏收缩力和心率,用于治疗高血压和心力衰竭。
2. 酶抑制型药物:这些药物可以抑制生物体内的特定酶的活性,从而阻断代谢途径或调节生物体内的信号传导。
例如,贝他受体阻滞剂通过抑制β受体下的腺苷酸环化酶的活性,从而减少儿茶酚胺的合成,降低中枢神经系统的兴奋性,用于治疗焦虑症和高血压。
3. 离子通道调节型药物:这类药物可以与生物体内的离子通道结合,改变通道的活性,调节细胞内外的离子流动。
例如,钙离子通道阻滞剂可以选择性地抑制钙离子通道的开放,降低心肌细胞的兴奋性和纤维蛋白原的合成,用于治疗心绞痛和心肌梗死。
除了了解药物的作用机制,还需要对药物的药效进行评估。
药效评估是指通过实验室和临床试验,评估药物对特定疾病的治疗效果和安全性。
常见的药效评估方法包括以下几种:1. 体外实验:通过细胞培养或离体器官等模型进行实验,评估药物在体外对靶点的结合能力和影响。
这可以帮助研究人员了解药物与靶点的相互作用,并选择潜在的有效药物候选。
2. 动物实验:通过在动物体内进行实验,评估药物对特定疾病的疗效和安全性。
这类实验可以提供初步的药物效果和毒性信息,为进一步的临床试验提供依据。
3. 临床试验:在人体中进行的临床试验是评估药物疗效的最关键步骤。
通过进行随机对照试验,比较药物治疗组与安慰剂或现有治疗组的差异,评估药物对特定疾病的治疗效果和安全性。
这类试验需要经过伦理委员会的批准,并严格监管。
药物研究中的药物作用机制和药效评估是相辅相成的。
实施重点监控药品管理措施对促进临床合理用药的应用效果分析

·456·药品评价 Drug Evaluation 2021,18(08)作者简介:黄狄娜,本科,副主任药师。
研究方向:医院药事管理和临床药学。
E-mail :huangnana6668@实施重点监控药品管理措施对促进临床合理用药的应用效果分析黄狄娜普宁市人民医院,广东 普宁 515300[摘要]目的:建立重点监控药品管理制度,探索其对临床合理用药的应用效果。
方法:选择2018年10月到2019年6月(实施重点监控药品管理措施之前)及2019年7月到2020年3月(实施重点监控药品管理措施之后)被纳入普宁市人民医院重点监控管理的能量及营养成分补充药物、免疫增强剂、脑循环与促智药、质子泵抑制剂、活血化瘀类药物、中药注射剂、抗肿瘤辅助药等多类共计32种药品使用的合理率进行分析评价。
结果:相比进行药物重点监控前,质子泵抑制剂合格使用率提升19.4%,活血化瘀药合格使用率提升25.2%,改善脑代谢药合格使用率提升7.3%,心肌保护剂合格使用率提升19.9%。
且管理后,4类药物平均每月使用金额均较管理前显著降低(P <0.05)。
结论:建立重点监控药品管理制度具有临床有意义,能促进临床合理用药。
[关键词]药物疗法管理;处方不当;重点监控药品管理;合理用药;应用效果DOI: 10.19939/ki.1672-2809.2021.08.03Analysis of the Effect of Implementing Key Monitoring Drug Management Measures on Promoting Clinical Rational Use of DrugsHUANG DinaPuning People's Hospital, Puning Guangdong 515300, China.[Abstract] Objective: To establish a key monitoring drug management system and explore its effect on clinical rational use of drugs. Methods: Selection October 2018 to June 2019 (before the implementation of key monitoring drug management measures) and July 2019 to March 2020 (after the implementation of key monitoring drug management measures) were included in Puning People's Hospital focused on monitoring and management of energy and nutritional ingredients supplement drugs, immune enhancers, cerebral circulation and nootropic drugs, proton pump inhibitors, blood circulation and blood stasis drugs, traditional Chinese medicine injections, anti-tumor adjuvants, and a total of 32 drugs use reasonable rates for analysis and evaluation. Results: Compared with the prior drug monitoring, the qualified use rate of proton pump inhibitors increased by 19.4%, the qualified use rate of blood-activating drugs to remove blood stasis increased by 25.2%, the qualified use rate of drugs for improving brain metabolism increased by 7.3%, and the qualified use rate of cardioprotective agents increased by 19.9%. And after administration, the average monthly usage amount of the 4 types of drugs was significantly lower than before administration, and the difference was statistically significant (P <0.05). Conclusion: The establishment of a management system for key monitoring drugs is clinically meaningful and can promote the clinical rational use of drugs.[Key Words] Medication therapy management; Inappropriate prescribing; Key monitoring drug management; Rational drug use; Application effect随着我国医疗改革的进行,国家卫健委,发改委等相继提出对部分药物滥用的现象进行严格管控,2017年,广东省卫计委等多个部门响应相关规定精神,联合发布《广东省卫生计生委办公室关于建立全省医疗机构重点药品监控制度的通知》[粤卫办(2017)74号][1],特别针对其中突出的质子泵抑制剂、保肝护肝药,建立完善相关监管机制,加强对其专项管理。
总结:PD-L1免疫组化检测难点与要点
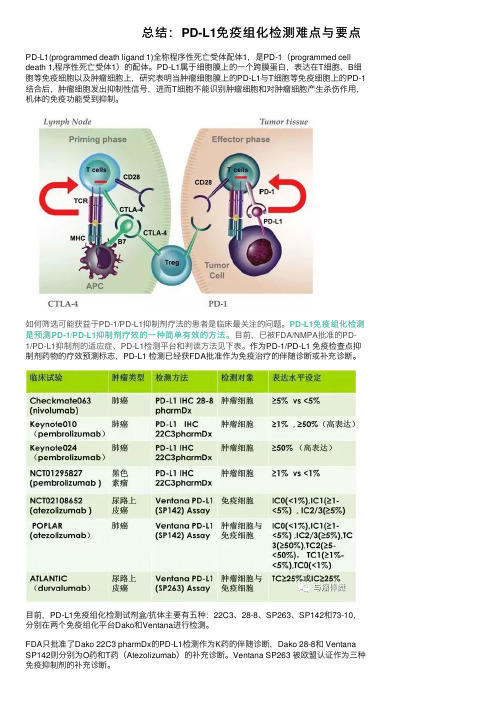
总结:PD-L1免疫组化检测难点与要点PD-L1(programmed death ligand 1)全称程序性死亡受体配体1,是PD-1(programmed cell death 1,程序性死亡受体1)的配体。
PD-L1属于细胞膜上的⼀个跨膜蛋⽩,表达在T细胞、B细胞等免疫细胞以及肿瘤细胞上,研究表明当肿瘤细胞膜上的PD-L1与T细胞等免疫细胞上的PD-1结合后,肿瘤细胞发出抑制性信号,进⽽T细胞不能识别肿瘤细胞和对肿瘤细胞产⽣杀伤作⽤,机体的免疫功能受到抑制。
如何筛选可能获益于PD-1/PD-L1抑制剂疗法的患者是临床最关注的问题。
PD-L1免疫组化检测是预测PD-1/PD-L1抑制剂疗效的⼀种简单有效的⽅法。
⽬前,已被FDA/NMPA批准的PD-1/PD-L1抑制剂的适应症、PD-L1检测平台和判读⽅法见下表。
作为PD-1/PD-L1 免疫检查点抑制剂药物的疗效预测标志,PD-L1 检测已经获FDA批准作为免疫治疗的伴随诊断或补充诊断。
⽬前,PD-L1免疫组化检测试剂盒/抗体主要有五种:22C3、28-8、SP263、SP142和73-10,分别在两个免疫组化平台Dako和Ventana进⾏检测。
FDA只批准了Dako 22C3 pharmDx的PD-L1检测作为K药的伴随诊断,Dako 28-8和 Ventana SP142则分别为O药和T药(Atezolizumab)的补充诊断。
Ventana SP263 被欧盟认证作为三种免疫抑制剂的补充诊断。
当前⾯临的检测难题:1 不同抗体要求使⽤不同的检测平台主流检测平台为两家公司的4种抗体检测平台,分别为DAKO 22C3和28-8检测的AutoStainerLink 48平台和Ventana SP142和SP263检测的Ventana Benchmark Ultra平台。
2 不同的抗体检测结果判读标准不同⽬前主要PD-L1检测抗体使⽤的判读⽅法有TPS、CPS以及分别计算TC和IC判读⽅法,不同判读⽅法的主要差异在与是否计算肿瘤区域阳性表达的免疫细胞数量。
晚期nsclc免疫跨线治疗

根据RECISTv1.1
40
37%
未PD n=93, 22%
20
0 0
20% 9%
3 6 9 12 15 18 21 24 27 自首例PD报告后时间 (月)
PD后持续Atezo N=168, 51%
中位OS 12.7个月 (95%CI: 9.3, 14.9)
数据截止日2016年7月7日
*包括接受非研究翻案免疫治疗,在其他非研究方案治疗之外 NPT: 非研究方案治疗
• 大部分患者(~50%)接受atezolizumab TBP治疗 • OS数据成熟(至少随访19个月)
• 局限性
• 非随机比较接受和未接受atezolizumab TBP治疗的患者 • 继续atezolizumab TBP治疗的标准引入偏倚 • 解释结果时需要考虑基线和进展后的临床特征
• 多西他赛组进展后OS数据也会受选择偏倚及后续非计划性治疗疗 效影响,不能得出最优顺序的结论
20 10
0
0 3 6 9 12 15 18 21 24 27
0
时间 (月)
PFS
中位2.8个月 (95% CI.2.6,3.0)
HR 0.95a (95%CI,0.82,1.10)
中位4.0个月 (95% CI.3.3,4.2)
Atezo N=425 多西他赛 N=425
3 6 9 12 15 18 21 24 27 时间 (月)
*包括接受非研究翻案免疫治疗,在其他非研究方案治疗之外 NPT: 非研究方案治疗
PD后OS:各治疗组
PD后OS(%)
100 80 60 40 20 0 0
Atezolizumab n=332 多西他赛 n=290
18个月OS
2023年版《免疫药物临床药学专家共识》解读ppt课件

作用机制
免疫药物通过影响免疫细胞的活性 、增殖、分化等环节,调节机体免 疫功能,达到治疗目的。
临床应用
免疫药物广泛应用于自身免疫性疾 病、移植排斥反应、肿瘤免疫治疗 等领域。
共识更新要点
新药纳入
随着研发进展,更多新型免疫药物纳 入共识,为临床提供更多治疗选择。
用药规范
更新后的共识更加详细地阐述了免疫 药物的用药规范,包括剂量调整、给 药方式、疗程等。
血药浓度监测
通过定期检测患者血液中的免疫药物浓度,确保药物在有效浓度 范围内,以实现最佳疗效。
基因多态性
考虑患者的基因多态性对免疫药物代谢和疗效的影响,制定个体 化给药方案。
药物相互作用
关注免疫药物与其他药物的相互作用,避免不良药物反应,确保 患者用药安全。
05 未来展望与建议
新型免疫药物研发与应用前景
2023年版《免疫药物临床药学专 家共识》解读
汇报人:XXX 2023-11-16
contents
目录
• 前言与概述 • 免疫药物临床应用原则 • 免疫药物安全性与合理用药 • 免疫药物监测与评估 • 未来展望与建议
01 前言与概述
共识目的和意义
01
02
03
规范免疫药物使用
通过制定专家共识,明确 免疫药物在临床医学中的 使用规范,提高治疗效果 。
胃肠道反应
免疫药物可能导致胃肠道 不适,如恶心、呕吐、腹 泻等。
免疫药物与其他药物的相互作用
免疫抑制药物的相互作用
与其他免疫抑制药物合用时,可能会增加感染的风险和药物的毒 性。
与抗生素的相互作用
某些抗生素可能会影响免疫药物的疗效,需要合理安排合用药物的 时机和剂量。
与心血管药物的相互作用
《国际药品安全性评价策略:ICH指导原则解读》札记

《国际药品安全性评价策略:ICH指导原则解读》阅读札记目录一、内容简述 (1)1.1 国际药品安全评价现状与发展趋势 (2)1.2 ICH指导原则概述及重要性 (3)二、ICH指导原则概述 (4)三、国际药品安全性评价策略解析 (5)四、ICH指导原则下的药物安全性研究实例分析 (6)4.1 药物不良反应报告与评价标准解读 (8)4.2 特定药物安全性问题及应对策略探讨 (8)五、ICH指导原则与其他国际指南的比较分析 (10)5.1 与世界卫生组织指南的比较分析 (11)5.2 与美国食品药品监督管理局指南的比较分析 (13)六、ICH指导原则在我国的实施现状及建议 (14)6.1 我国药品安全性评价现状分析 (16)6.2 ICH指导原则在我国的实施现状评述与展望 (17)6.3 提高我国药品安全性评价水平的建议措施 (18)七、总结与展望 (19)一、内容简述在阅读过程中,我了解到国际药品安全性评价策略对于保障药品安全、促进新药研发具有重要意义。
ICH指导原则作为国际药品注册的重要准则,为药品的安全性评价提供了明确的指导和规范。
通过阅读相关文献和资料,我对ICH指导原则的核心内容有了更深入的了解。
该指导原则主要包括药品安全性评价的基本原则、评价方法、评价标准等方面。
基本原则强调药品的安全性应贯穿药品研发的全过程,确保药品对人体无害或危害最小化。
评价方法涉及临床试验、非临床试验、不良反应监测等多种手段,以全面评估药品的安全性。
评价标准则是对药品安全性评价的量化指标和判定依据,以确保评价结果的科学性和客观性。
我还了解到ICH指导原则在药品监管方面的应用和实施情况。
各国药品监管机构根据ICH指导原则制定相应的法规和政策,以确保药品的安全性。
跨国药企也需要遵循ICH指导原则进行新药研发和生产,以便在全球范围内推广和应用。
通过阅读《国际药品安全性评价策略:ICH指导原则解读》,我对国际药品安全性评价策略有了更全面的认识和理解,也意识到自己在未来的学习和工作中需要不断学习和更新知识,以跟上国际药品安全性评价的最新发展。
国家卫生健康委员会办公厅关于持续做好抗菌药物临床应用管理有关工作的通知

国家卫生健康委员会办公厅关于持续做好抗菌药物临床应用管理有关工作的通知文章属性•【制定机关】国家卫生健康委员会•【公布日期】2018.05.09•【文号】国卫办医发〔2018〕9号•【施行日期】2018.05.09•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文关于持续做好抗菌药物临床应用管理有关工作的通知国卫办医发〔2018〕9号各省、自治区、直辖市及新疆生产建设兵团卫生计生委:为贯彻落实党的十九大精神和习近平新时代中国特色社会主义思想,按照《“健康中国2030”规划纲要》和《遏制细菌耐药国家行动计划(2016-2020年)》要求,进一步加强抗菌药物临床应用管理,针对当前存在的问题,提出以下工作要求:一、加快建设多学科抗菌药物管理和诊疗团队(一)逐步转变抗菌药物临床应用管理模式。
各地要转变管理思路,逐步将抗菌药物临床应用管理从“以行政部门干预为主”转变为“以多学科专业协作管理为主”。
通过建立多学科的专业化工作团队,开展宣传教育、技能培训、监测预警、干预指导等,持续提高抗菌药物管理水平。
(二)持续完善多学科诊疗体系。
加强感染性疾病科、临床微生物学、临床药学和医院感染控制等学科建设,完善感染性疾病的多学科诊疗体系。
落实《关于提高二级以上综合医院细菌真菌感染诊疗能力的通知》(国卫办医函〔2016〕1281号)有关要求,将细菌真菌感染诊疗能力的建设情况纳入抗菌药物管理评价指标。
(三)充分发挥临床微生物检验在多学科抗菌药物管理中的作用。
加强临床微生物实验室建设,加强临床微生物检验人才培养,联合使用传统微生物学、分子生物学和免疫学检验方法,提高临床微生物检验能力。
积极引进临床微生物新技术、新项目。
借助医联体建设,提高区域微生物检验的整体能力和水平。
鼓励有条件的地区建立区域临床微生物检验中心,加强实验室室内质量控制和室间质量评价,满足临床微生物检验需求。
二、继续加强抗菌药物临床应用重点环节管理(一)继续实施抗菌药物专档管理。
2023年抗菌药物使用管理制度

2023年抗菌药物使用管理制度抗菌药物运用管理制度1一、医院抗菌药物管理工作组加强对医院抗菌药物临床应用状况的监督检查。
二、医院建立抗菌药物临床应用状况排名、公示和诫勉谈话制度。
对各临床科室和医务人员抗菌药物运用量、运用率和运用强度等状况进行排名,对排名状况予以公示;对排名后位或者发觉严峻问题的部门负责人、医师进行诫勉谈话,状况严峻的予以通报。
三、医院组织相关专业技术人员对抗菌药物处方、医嘱实施点评,并将点评结果作为临床科室和医务人员绩效考核依据。
四、医疗机构应当对出现抗菌药物超常处方3 次以上且无正值理由的医师提出警告,限制其特别运用级和限制运用级抗菌药物处方权;限制处方权后,仍连续出现2 次以上超常处方且无正值理由的,取消其抗菌药物处方权。
五、医师出现下列情形之一的,医疗机构应当取消其抗菌药物处方权:(一)抗菌药物培训考核不合格的;(二)未根据规定开具抗菌药物处方造成严峻后果的;(三)未根据规定运用抗菌药物造成严峻后果的;(四)开具抗菌药物处方牟取私利的。
六、药师连续3 次以上未根据规定审核抗菌药物处方与医嘱,或者发觉处方不相宜、超常处方未进行干预且无正值理由的,取消其抗菌药物调剂资格。
七、医师出现以下情形之一的,由县级以上卫生行政部门根据《执业医师法》第三十七条的规定赐予警告或者责令暂定六个月以上一年以下执业活动;情节严峻的,吊销其执业证书;构成犯罪的,依法追究刑事责任:(一)未取得抗菌药物处方权或者被取消抗菌药物处方权后仍开具抗菌药物处方的;(二)未根据本方法规定开具抗菌药物处方造成严峻后果的;(三)运用未经批准抗菌药物的;(四)索娶收受药品生产、经营企业财物或者通过开具抗菌药物牟取不正值利益的;(五)违反本方法其他规定的。
八、药师出现以下情形之一的,由县级以上卫生行政部门根据《药品管理法》有关规定,赐予警告或者责令暂定六个月以上一年以下执业活动;情节严峻的,依法给子降级、撤职、开除处分;构成犯罪的,依法追究刑事责任:(一)违反《药品管理法》其次十六条、三十四条的规定,违法购入未经批准抗菌药物的;(二)违反《药品管理法》其次十七条的规定,未调剂审核处方、医嘱,造成患者严峻损害的;(三)未根据本方法规定,私自增加抗菌药物品种和规格的;(四)违反《药品管理法》第九十条的规定,在药品购销、临床应用中牟取不正值利益的;(五)违反本方法其他规定的。
药学中的药物毒性评价与毒物学研究

计算机模拟技术
分子对接模拟
利用计算机模拟技术,预测药 物与生物大分子(如蛋白质、 酶等)的相互作用,评估药物 的潜在毒性和作用机制。
药代动力学模拟
通过建立药代动力学模型,预 测药物在生物体内的吸收、分 布、代谢和排泄过程,评估药 物的毒性和安全性。
定量构效关系分析
利用统计学方法,分析药物结 构与活性之间的关系,预测新 药物的毒性和作用效果。
促进合理用药
通过对药物毒性的深入了解,可以指导医生在临床用药时 选择合适的药物、剂量和疗程,提高治疗效果,减少不良 反应的发生。
国内外相关法规与指导原则
国内相关法规
《药品注册管理办法》、《药品非临床研究质量管理规范》等法规对药物毒性评价有明确 规定,要求新药在上市前必须进行严格的毒性评价。
国外相关法规
药学中的药物毒性评价与毒物 学研究
演讲人:
日期:
目
CONTENCT
录
• 药物毒性评价概述 • 药物毒性评价方法与技术 • 毒物学研究基础 • 药物毒性评价与毒物学关系探讨 • 案例分析:典型药物毒性事件回顾
与反思 • 未来展望与挑战
01
药物毒性评价概述
毒性定义及分类
毒性定义
毒性是指外源化学物与机体接触或进入体内的易感部位后,能引 起损害作用的相对能力,或简称为损伤生物体的能力。
政策法规对药物毒性评价影响和挑战
政策法规对药物毒性评价的指导和规范
政策法规的制定和实施对药物毒性评价具有重要的指导和规范作用。未来,应进 一步完善相关法规和标准,明确药物毒性评价的原则、方法、程序等,确保药物 毒性评价的科学性和公正性。
政策法规对药物毒性评价的挑战
政策法规的不断变化和调整可能对药物毒性评价带来新的挑战。例如,新的法规 可能对药物毒性评价的方法和标准提出更高的要求,需要相关企业和机构不断适 应和更新。
中重度特应性皮炎系统药物达标治疗专家指导建议

中重度特应性皮炎系统药物达标治疗专家指导建议[摘要]特应性皮炎(AD)是一种常见的慢性、复发性、炎症性、瘙痒性疾病,如何提高中重度AD患者的系统治疗效果是临床面临的巨大挑战。
目前国际上已经提出中重度特应性皮炎系统药物达标治疗的核心框架体系。
达标治疗是一种设计治疗策略的理念,强调以患者需求为中心、重视患者在疾病管理中的参与、尊重患者个人需求,其核心是明确治疗目标。
治疗方案的制定要以目标为导向,通过对目标的分解,结合病情,综合权衡可选治疗药物的疗效和安全性,同时考虑患者的个人需求,并根据患者对治疗的应答情况持续动态地调整治疗方案。
为了提升我国特应性皮炎的临床管理水平,提高患者满意度,专家组在解读国际共识的基础上,通过梳理特应性皮炎近期学术进展,结合中国特应性皮炎管理的临床实践特点,提出本指导建议供临床实践参考。
[关键词]特应性皮炎;系统治疗;达标治疗;指导建议特应性皮炎(atopicdermatitis,AD)以慢性反复发作的瘙痒和多形性炎症性皮损为特征[1],全球AD患者数至少2.3亿[2]。
流行病学研究显示,我国1岁以下婴儿AD患病率为30.5%,1~7岁儿童患病率达12.9%[3⁃4];基于全球疾病负担研究2019(globalburdenofdisease,GBD2019)数据分析,中国AD年龄标化患病率为2.5%[5]。
中重度AD患者的比例随年龄增加而增加[6]。
AD发作情况与疾病严重程度相关,疾病严重程度越高,发作持续时间和发作频率越高,并且发作时的瘙痒和皮损越严重,因而对AD患者生活质量的影响越大[7⁃8]。
控制瘙痒和清除皮损是AD患者的最迫切治疗需求[9],对于中重度AD,局部药物往往不能很好地控制病情,需要启动系统治疗[10]。
然而,在临床中,中重度AD患者启动系统治疗往往较晚、依从性不佳、总体控制率较低[11⁃13]。
如何提高中重度AD患者系统治疗的效果是临床面临的巨大挑战[14]。
特殊药品管理全书大全

特殊药品管理全书大全一、引言特殊药品是指用于治疗特殊疾病或具有特殊作用的药品,包括抗肿瘤药品、抗病毒药品、抗真菌药品、抗结核药品、抗凝血药品、免疫抑制剂、激素类药品等。
特殊药品在治疗疾病的同时,也可能带来一定的毒副作用,因此,加强特殊药品的管理,确保患者用药安全,成为医药行业关注的焦点。
本文将从特殊药品的定义、分类、管理原则、管理措施等方面进行详细阐述。
二、特殊药品的定义与分类(一)定义特殊药品是指用于治疗特殊疾病或具有特殊作用的药品,其特点是疗效显著,但毒副作用较大,使用过程中需要严格控制。
(二)分类1.抗肿瘤药品:用于治疗各种恶性肿瘤的药品,如化疗药物、生物靶向药物等。
2.抗病毒药品:用于治疗病毒感染的药品,如抗艾滋病病毒药物、抗乙肝病毒药物等。
3.抗真菌药品:用于治疗真菌感染的药品,如抗念珠菌药物、抗曲霉菌药物等。
4.抗结核药品:用于治疗结核病的药品,如一线抗结核药物、二线抗结核药物等。
5.抗凝血药品:用于预防和治疗血栓形成的药品,如抗血小板药物、抗凝血酶药物等。
6.免疫抑制剂:用于抑制免疫系统功能的药品,如环孢素、他克莫司等。
7.激素类药品:具有调节内分泌功能的药品,如糖皮质激素、性激素等。
三、特殊药品管理原则(一)安全第一原则确保患者用药安全是特殊药品管理的首要原则。
药品生产企业、医疗机构和药品经营企业应严格遵守国家有关法律法规,加强药品质量管理,确保特殊药品的质量安全。
(二)合理用药原则特殊药品的使用应根据患者病情、药物适应症、药物相互作用等因素进行合理选择,遵循药品说明书或相关指南,确保用药安全、有效、经济。
(三)全程监控原则特殊药品的生产、流通、使用等环节应实施全程监控,确保药品质量稳定、流向清晰、使用合规。
四、特殊药品管理措施(一)生产环节管理1.生产企业应具备相应的生产资质,严格按照药品生产质量管理规范(GMP)组织生产。
2.生产企业应加强原辅料采购、生产过程、产品质量检验等环节的管理,确保特殊药品的质量安全。
肿瘤的免疫治疗和疗效评价

目前临床常用于治疗恶性肿瘤的细胞因子主要包括IFN-α和IL-2。
不仅免疫调节剂能调节免疫效应,分子靶向药物、血管生成抑制剂、内分泌治疗和部分化 疗药物也能调节免疫反应。例如,伊马替尼、索拉非尼、舒尼替尼等靶向药物可通过减少髓 系衍生的抑制细胞和调节性T细胞等免疫抑制细胞的募集和增殖,来调节肿瘤免疫微环境。5氟尿嘧啶、 紫杉醇、吉西他滨和奥沙利铂等化疗药物也能从不同环节调节免疫反应。
现在是7页\一共有55页\编辑于星期二
肿瘤免疫治疗相关假说
双相调节假说:
在肿瘤免疫逃逸阶段,免疫细胞对肿瘤细胞的作用取决于肿瘤微环境,它们既可能抑制、也可能促进肿瘤的
生长和转移。参与这一过程的免疫细胞包括T淋巴细胞、巨噬细胞、树突细胞(DC)、自然杀伤细胞 (NK)、自然杀伤T细胞(NKT)、肥大细胞和B细胞等。在不同的肿瘤微环境下,它们都有可能抑
现在是22页\一共有55页\编辑于星期二
肿瘤疗效评价-非靶病灶
•完全缓解(CR ) – 非靶病灶消失,肿瘤标记物正常。 •未达完全缓解(PR)/稳定(SD)– 非靶病灶减少,但一个或多个 非靶病灶存在;和/或肿瘤标记物高于正常;如病灶减少、但肿瘤 标记物不正常,可判断为SD。 •疾病进展(PD) – 出现一个或多个新病灶和/或非靶病灶明显进展。
Approvato
Investigazionale (Fase I/II)
Approvato
Approvato
Approvato
Investigazionale (Fase I/II) Investigazionale (Fase I/II) Investigazionale (Fase I) Investigazionale (Fase II/III) Investigazionale (Fase I/II) Investigazionale (Fase I-II) Investigazionale Investigazionale (Fase I)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫抑制剂类药物用药评价一、概述免疫抑制剂是对机体的免疫反应具有抑制作用的药物。
能抑制与免疫反应有关细胞(T细胞和B细胞等巨噬细胞)的增殖和功能,能降低抗体免疫反应的制剂。
免疫抑制剂主要用于器官移植抗排斥反应和自身免疫病如类风湿性关节炎、红斑狼疮、皮肤真菌病、膜肾球肾炎、炎性肠病和自身免疫性溶血贫血等。
常用的免疫抑制剂主要有五类:(1)糖皮质激素类,如可的松和强的松、泼尼松龙等;(2)微生物代谢产物,如环孢菌素和藤霉素等;(3)抗代谢物,如硫唑嘌呤和6-巯基嘌呤等;(4)多克隆和单克隆抗淋巴细胞抗体,如抗淋巴细胞球蛋白和OKT3等;(5)烷化剂类,如环磷酰胺等。
二、点评依据1. 《处方管理办法》(卫生部令第53号)及其附件2. 《医疗机构药事管理规定》(卫医政发〔2011〕11号)3. 《医院处方点评管理规范(试行)》(卫医管发〔2010〕28号)4. 《国家基本药物目录 2009年版基层部分》中华人民共和国卫生部三、实施方案1. 抽样标准:处方中含有静脉用或口服给予免疫制剂类药物的处方;2. 抽样方法:随机抽样或全样本抽样;3. 点评方法:点评所抽取患者的处方或用药医嘱,按“免疫制剂类药物点评处方规范性的参照指标”要求内容点评。
四、点评要点【点评标准】1. 适应证不适宜的;2. 遴选药品不适宜的;3. 药品剂型或给药途径不适宜的;4. 用法、用量不适宜的;5. 联合用药不适宜或有配伍禁忌;6. 重复给药的;7. 医师超权限使用糖皮质激素的;8.其他用药不适宜情况的。
【点评细则】1、适应证不适宜的;处方药品与临床诊断不符;⏹糖皮质激素有抑制自身免疫的药理作用,但并不适用于所有自身免疫性疾病的治疗,如慢性淋巴细胞浸润性甲状腺炎(桥本病)、I型糖尿病、寻常型银屑病等。
属于滥用糖皮质激素的情况;⏹常规用作解热药以降低体温;⏹用于预防输液反应;⏹滥用于慢性疾病;⏹局部治疗滥用。
例如,上呼吸道感染发热,仅应用地塞米松退热。
参见药品说明书。
2、遴选药品不适宜的;药品适应症适宜,但特殊人群禁用的;⏹儿童儿童长期应用糖皮质激素更应严格掌握适应证和妥当选用治疗方法。
应根据年龄、体重(体表面积更佳)、疾病严重程度和患儿对治疗的反应确定糖皮质激素治疗方案。
更应注意密切观察不良反应,以避免或降低糖皮质激素对患儿生长和发育的影响。
⏹妊娠期妇女大剂量使用糖皮质激素者不宜怀孕。
孕妇慎用糖皮质激素。
特殊情况下临床医师可根据情况决定糖皮质激素的使用,例如慢性肾上腺皮质功能减退症及先天性肾上腺皮质增生症患者妊娠期应坚持糖皮质激素的替代治疗,严重的妊娠疱疹、妊娠性类天疱疮也可考虑使用糖皮质激素。
⏹哺乳期妇女哺乳期妇女应用生理剂量或维持剂量的糖皮质激素对婴儿一般无明显不良影响。
但若哺乳期妇女接受中等剂量、中程治疗方案的糖皮质激素时不应哺乳,以避免经乳汁分泌的糖皮质激素对婴儿造成不良影响。
药品选择与患者性别、年龄不符;患者有药物禁忌的疾病史;⏹存在以下疾病史的不可使用糖皮质激素类药物:对糖皮质激素类药物过敏;严重精神病史;癫痫;活动性消化性溃疡;新近胃肠吻合术后;骨折;创伤修复期;单纯疱疹性角、结膜炎及溃疡性角膜炎、角膜溃疡;严重高血压;严重糖尿病;未能控制的感染(如水痘、真菌感染);活动性肺结核;较严重的骨质疏松;妊娠初期及产褥期;寻常型银屑病。
但是,若有必须用糖皮质激素类药物才能控制疾病,挽救患者生命时,如果合并上述情况,可在积极治疗原发疾病、严密监测上述病情变化的同时,慎重使用糖皮质激素类药物。
⏹慎重使用糖皮质激素的情况:库欣综合征、动脉粥样硬化、肠道疾病或慢性营养不良的患者及近期手术后的患者慎用。
急性心力衰竭、糖尿病、有精神病倾向、青光眼、高脂蛋白血症、高血压、重症肌无力、严重骨质疏松、消化性溃疡病、妊娠及哺乳期妇女应慎用,感染性疾患必须与有效的抗菌药合用,病毒性感染患者慎用;儿童也应慎用。
未根据不同疾病和各种糖皮质激素的特点正确选用糖皮质激素品种。
按作用时间分类:可分为短效、中效与长效三类。
短效药物如氢化可的松和可的松,作用时间多在8~12小时;中效药物如泼尼松、泼尼松龙、甲泼尼龙,作用时间多在12~36小时;长效药物如地塞米松、倍他米松,作用时间多在36~54小时。
3、药品剂型或给药途径不适宜的;●药品剂型不适宜;●给药途径不适宜。
⏹未按照说明书用法给药的;⏹应采用全身给药的给予局部给药。
如急性肾上腺功能不全患者仅应用激素口服治疗。
4、用法、用量不适宜的;●疗程过长或过短;⏹疗程。
不同的疾病糖皮质激素疗程不同,一般可分为以下几种情况:1.冲击治疗:疗程多小于5天。
适用于危重症病人的抢救,如暴发型感染、过敏性休克、严重哮喘持续状态、过敏性喉头水肿、狼疮性脑病、重症大疱性皮肤病、重症药疹、急进性肾炎等。
冲击治疗须配合其他有效治疗措施,可迅速停药,若无效大部分情况下不可在短时间内重复冲击治疗。
2.短程治疗:疗程小于1个月,包括应激性治疗。
适用于感染或变态反应类疾病,如结核性脑膜炎及胸膜炎、剥脱性皮炎或器官移植急性排斥反应等。
短程治疗须配合其他有效治疗措施,停药时需逐渐减量至停药。
3.中程治疗:疗程3个月以内。
适用于病程较长且多器官受累性疾病,如风湿热等。
生效后减至维持剂量,停药时需要逐渐递减。
4.长程治疗:疗程大于3个月。
适用于器官移植后排斥反应的预防和治疗及反复发作、多器官受累的慢性自身免疫病,如系统性红斑狼疮、溶血性贫血、系统性血管炎、结节病、大疱性皮肤病等。
维持治疗可采用每日或隔日给药,停药前亦应逐步过渡到隔日疗法后逐渐停药。
5.终身替代治疗:适用于原发性或继发性慢性肾上腺皮质功能减退症,并于各种应激情况下适当增加剂量。
●给药频次不合理;●给药时间不适宜;⏹时辰用药如皮质激素宜采用早晨1次给药或隔日早晨1次给药,疗效较好。
●用药剂量过大或不足;⏹药物剂量:生理剂量和药理剂量的糖皮质激素具有不同的作用,应按不同治疗目的选择剂量。
一般认为给药剂量(以泼尼松为例)可分为以下几种情况:1.长期服用维持剂量:2.5~15.0 mg/d;2.小剂量:<0.5mg·kg-1·d-1;3.中等剂量:0.5~1.0 mg·kg-1·d-1;4.大剂量:大于1.0 mg·kg-1·d-1;5.冲击剂量:(以甲泼尼龙为例)7.5~30.0 mg·kg-1·d-1。
●溶媒选择不适宜;●溶媒容量不适宜;●不同适应证用法用量不适宜;●药品停药方法不适宜;⏹糖皮质激素减量应在严密观察病情与糖皮质激素反应的前提下个体化处理,要注意可能出现的停药反应和反跳现象。
●特殊原因需要调整用量而未调整用量的;无指征地使用超大剂量糖皮质激素和“冲击疗法”。
5、联合用药不适宜或有配伍禁忌;●同类药物,相同作用机制的药物合用;●不需联合用药而采用联合用药的情况;●药物配伍使用时,能发生浑浊、沉淀、产生气体及变色等外观异常的现象等理化反应的;●药品配伍使副作用或毒性增强,引起严重不良反应;●药品配伍使治疗作用过度增强,超出了机体所能耐受的能力,也可引起不良反应,乃至危害病人等;●药品配伍使治疗作用减弱或药品的稳定性降低。
不可与糖皮质激素类药物联用的药物:⑴ 排钾利尿药:这类药物主要有呋塞米、布美他尼、托拉塞米、氯噻酮、吲达帕胺、氢氯噻嗪、碳酸酐酶抑制剂等。
糖皮质激素与这些利排钾利尿药联用,可导致严重的低血钾,并且糖皮质激素的水钠潴留作用会减弱利尿药物的利尿效应。
⑵ 抗真菌药:两性霉素B为抗人体深部组织真菌感染的药物,与糖皮质激素类药物合用,会导致或加重低血钾,使真菌病灶扩散,还会造成肝损害等。
酮康唑、伊曲康唑可抑制糖皮质激素在体内的消除,抗真菌药物会抑制肝药酶对糖皮质激素在肝脏中的代谢,还有可能使内源性肾上腺皮质功能受到抑制,出现不良反应。
⑶ 抗癫痫药:如苯妥英钠、巴比妥等。
这类药物为肝药酶诱导剂,可促使糖皮质激素类药物在肝脏中的排泄,使糖皮质激素类药物药效降低。
⑷ 抗菌药:氨基糖苷类药物如与糖皮质激素合用,同样会导致糖皮质激素的作用降低,因氨基糖苷类等也为肝药酶诱导剂,也可使糖皮质激素类药物在肝脏中的代谢加快。
氯霉素可使糖皮质激素效力增强,氯霉素为肝药酶抑制药,抑制糖皮质激素在肝脏中的代谢。
此外,糖皮质激素可使甲硝唑从体内排泄加快,与肝药酶有关。
⑸ 解热消炎镇痛药:阿司匹林、吲哚美辛、双氯芬酸、布洛芬、酮洛芬、萘普生等解热消炎镇痛与糖皮质激素联用,易导致消化性溃疡等并发症。
糖皮质激素可使水杨酸盐的消除加快,疗效也降低,与对氨基乙芬合用,可增加对肝脏的毒性。
⑹ 降糖药:糖皮质激素可促进糖异生,减少外周组织对葡萄糖的摄取与利用,从而使血糖升高,减弱口服降血糖药物或胰岛素的作用。
⑺ 强心苷:糖皮质激素与强心苷联用,能增加洋地黄毒性及心律失常的发生,其原因是糖皮质激素的水钠潴留和排钾作用而致。
⑻蛋白质同化激素:如甲睾酮、比唑甲氢龙、达那唑、丙酸睾酮等,蛋白质同化激素与糖皮质激素合用,可增加水肿的发生率,诱发或加重痤疮。
6、重复给药的;●同一药物成份但不同通用名的药物一起处方;●含有相同主要成分的复方制剂联用;药理作用相同的药物重复使用。
7、医师超权限使用糖皮质激素的;●冲击疗法需具有主治医师以上专业技术职务任职资格的医师决定;●长程糖皮质激素治疗方案,需由相应学科主治医师以上专业技术职务任职资格的医师制定。
先天性肾上腺皮质增生症的长程治疗方案制订需三级医院内分泌专业主治医师以上专业技术职务任职资格的医师决定。
随访和剂量调整可由内分泌专业主治医师以上专业技术职务任职资格的医师决定;●紧急情况下临床医师可以高于上条所列权限使用糖皮质激素,但仅限于3天内用量,并严格记录救治过程。
*《糖皮质激素类药物临床应用指导原则》(卫办医政发〔2011〕23号)8、其他用药不适宜情况。
