波谱分析碳谱化学位移
核磁共振碳谱和氢谱中 化学位移产生的原因

核磁共振(NMR)技术是一种应用广泛的谱学技术,常用于分析有机物和生物分子的结构和性质。
在核磁共振谱中,化学位移是一个重要的参数,它与化合物中原子核周围的电子环境有关。
化学位移在碳谱和氢谱中都是十分常见的,在本文中,我们将探讨化学位移在核磁共振碳谱和氢谱中产生的原因。
1. 基本概念在核磁共振谱中,化学位移是指核磁共振信号的频率与参考物质(通常是三氯化甲烷或二甲基硅烷)信号频率之差。
化学位移通常用ppm (parts per million)表示,它是一个相对值,可以用来比较不同化合物中原子核的化学环境差异。
2. 碳谱中化学位移的影响因素碳谱中的化学位移受到多种因素的影响,其中主要包括化学环境、电子效应和磁场效应。
- 化学环境:不同化学环境下的碳原子核受到不同的化学位移影响。
芳香环上的碳原子与脂肪链上的碳原子所受的化学环境不同,因此它们的化学位移也会有所差异。
- 电子效应:分子中的电子密度分布会影响到周围原子核的化学位移。
含有电子丰富基团的碳原子通常会表现出较低的化学位移,而含有电子贫瘠基团的碳原子则会表现出较高的化学位移。
- 磁场效应:外加磁场对原子核周围的电子运动轨迹会产生影响,从而影响原子核的化学位移。
这种效应在核磁共振谱分析中是不可忽视的。
3. 氢谱中化学位移的影响因素类似于碳谱,氢谱中的化学位移也受到化学环境、电子效应和磁场效应的影响。
- 化学环境:不同化学环境下的氢原子核受到不同的化学位移影响。
α-位置上的氢原子与β-位置上的氢原子所受的化学环境不同,因此它们的化学位移也会有所差异。
- 电子效应:分子中的电子密度分布会影响到周围原子核的化学位移。
对甲苯中的甲基氢和对位氢受到的电子效应不同,因此它们的化学位移也会有所差异。
- 磁场效应:外加磁场对原子核周围的电子运动轨迹会产生影响,从而影响原子核的化学位移。
这种效应在氢谱分析中同样需要考虑。
4. 结语化学位移在核磁共振碳谱和氢谱中的产生是一个复杂而又精密的过程,受到多种因素的影响。
波谱分析碳谱化学位移 ppt课件

苯的C为128.5 ppm,除联苯撑以外,所有芳烃的 C在123~142 ppm。
而取代芳烃的C基本在110~170 ppm。与碘相连的 芳碳C可在96.7 ppm的较高场。
取代苯中取代基对苯环碳C的影响是具有加和性 的,环上第K个碳的C值可由下式计算:
C(K)=128.5
十 Ai(R)
i
Ai是在环上第i个位置上的取代基Ri对第K个碳的
4.4.3 烯烃
烯碳为sp2杂化,C为l00~165 ppm,与芳环碳C范 围相同.
线性及开链枝化烯烃中的烯碳C可以用下式计算:
C(K)=123.3+ Aki (Ri ) + Aki'(R'i ) + 校正项
i
i
k k’ , , , -C–C-C-C=C-C-C-C-
其中Aki(Ri)表示在碳链中第i位置引入取代基Ri对 烯碳K的化学位移的增值。i’为双键另一边的取代基 位置。
(3)若-H被甲基取代,如C-C-H C-C-CH3, 则C的C向低场移动9 ppm左右,叫效应。
(4)若-H被甲基取代,C-C-C-H C-C-CCH3,则C的C向高场移动2.5ppm左右。此效应与 、效应相反,叫效应。
(5)及更远的甲基影响很小。
(6)直链烷烃及开环支链烷烃中第K个碳原子的化 学位移C(K)可以用经验公式Lindeman和Adams方法 计算,其表达式为:
个CH3中心碳C发生近似9ppm的去屏蔽效果,这叫取 代效应。(如甲烷C为-2.1、乙烷C为5.9,5.9、丙烷 C
为15.6,16.1,15.6 )
碳数n >4 端甲基 C=13-14 ppm C>CH> CH2 >CH3,邻碳上取
波谱分析碳谱化学位移ppt课件

B3 23.46 A32 6.60 A33 11.14 A34 14.70 3 -2.07 3 0
B4 27.77 A42 2.26 A43 3.96 A44 7.35 4 0.68 4 0
7
例:3-甲基庚烷的C-5的C计算如下:
123
4 5 67
CH3-CH2-CH(CH3)-CH2-CH2-CH2-CH3
- - 6 15
- - 13 13
-- 9
4
-- 7
6
- - 15 -10
Aki(Ri)
7.2
-1.5
6
-
2
-
-
-
-
-
-
-
-
-
-
-
-
-12
Aki’(Ri’)
Aki(Ri)
Ri
’ ’ ’
Cl
- - -6 3
-1
-
Br
- 2 -1 -8
0
-
I
- 2 7 -38
-
-
C6H5
- - -11 12
-
-
校正项
有机波谱分析
1
4.4 各类碳的化学位移 碳原子在13C-NMR中的C与很多因素有关,主
要是杂化轨道状态及化学环境。
sp3-C在-2.1~43 ppm sp2-C在100~165 ppm sp-C在67~92 ppm 各类碳的化学位移顺序与氢谱中各类碳上对应质子的 化学位移顺序有很好的一致性。
若质子在高场,则该质子连接的碳也在高场;反之, 若质子在低场,则该质子连接的碳也在低场。
O
CH3
H2C
C H
O
CH3
84.2 153.2
波谱分析碳谱化学位移

=123.1 ppm
实测值为122.8 ppm
14
4.4.4 炔烃 炔的sp杂化碳原子C为65~90 ppm。
端基炔键的C1的C与C2的C差别约15 ppm,而不对称的2-炔及3-炔烃中,炔碳C值 差仅为3~4及1~2 ppm。在取代炔烃中炔碳的C变化范围可达100 ppm 。
9
4.4.3 烯烃 烯碳为sp2杂化,C为l00~165 ppm,与芳环碳C范围相同.
线性及开链枝化烯烃中的烯碳C可以用下式计算:
C(K)=123.3+
+ Aki ( Ri ) + 校正项Aki' ( R 'i )
i
i
k k’ , , , -C–C-C-C=C-C-C-C-
其中Aki(Ri)表示在碳链中第i位置引入取代基Ri对烯碳K的化学位移的增值。i’ 为双键另一边的取代基位置。
(e)将有关参数值代入,得 C5= B2+ D2 A22+2 Nk3+2 Nk4 =15.34+29.75+(-2.69)2+0.251 =29.7(ppm) (实测值29.7ppm)
8
4.4.2 环烷烃 环烷烃中C与环的大小无明显内在关系,除环丙烷外,环烷烃中碳的C变化幅 度不超过 6ppm。 环丙烷C在 2.6 ppm,其余环烷烃(环丁烷到环十七烷) C在23.3~29.4 ppm。
碳数n >4 端甲基 C=13-14 ppm C>CH> CH2 >CH3,邻碳上取
代基增多C 越大。
取代烷烃:
H3 C CH 2 CH 2 CH 2 CH 3
13.9 22.8 34.7
4
(3)若-H被甲基取代,如C-C-H C-C-CH3,则C的C向低场移动9 ppm 左右,叫效应。
波谱分析碳谱化学位移PPT课件

=29.7(ppm) (实测. 值29.7ppm)
8
4.4.2 环烷烃
环烷烃中C与环的大小无明显内在关系,除环丙烷 外,环烷烃中碳的C变化幅度不超过 6ppm。 环丙烷C在 2.6 ppm,其余环烷烃(环丁烷到环十七 烷) C在23.3~29.4 ppm。
.
9
4.4.3 烯烃
烯碳为sp2杂化,C为l00~165 ppm,与芳环碳C范 围相同.
线性及开链枝化烯烃中的烯碳C可以用下式计算:
C(K)=123.3+ Aki (Ri ) + Aki'(R'i ) + 校正项
i
i
k k’ , , , -C–C-C-C=C-C-C-C-
其中Aki(Ri)表示在碳链中第i位置引入取代基Ri对 烯碳K的化学位移的增值。i’为双键另一边的取代基
位置。
.
10
化学位移规律:烯烃
CC
C= 100-165 ppm(成对出现)
端碳=CH2 110;邻碳上取代基增多C越大:
2 5 .4
CH 3
CH 3
H 3C 3 0 .4
2 9 .9 H 3C
C
CH 2
CH 3 5 2 . 2
CH 3 5 3 . 5
C
CH 2
C
CH 2
1 4 3 .7 1 1 4 .4
.
16
4.4.5 芳烃及取代苯
苯的C为128.5 ppm,除联苯撑以外,所有芳烃的 C在123~142 ppm。
而取代芳烃的C基本在110~170 ppm。与碘相连的 芳碳C可在96.7 ppm的较高场。
取代苯中取代基对苯环碳C的影响是具有加和性 的,环上第K个碳的C值可由下式计算:
波谱解析第4章 核磁共振碳谱

谱线复杂重叠
韦 国 兵
谱线简单分立
2015-7-11
药物分析学科组
药学院
碳谱的缺点:
韦 国 兵
• 灵敏度低,所需样品量比氢谱大; • 峰面积一般与碳数不成比例。
2015-7-11
药物分析学科组
波 wei 谱 分 析 第 4 章 核 磁 共 振 碳 谱
第一节 碳谱的特点
2015-7-11
药学院
第一节
药物分析学科组
药学院
1、碳原子的杂化
韦 国 兵
• 碳谱的化学位移受杂化影响较大,sp3杂 化碳在最高场,其次为sp杂化碳,sp2杂 化碳在最低场。 •
2015-7-11
药物分析学科组
药学院
1、碳原子的杂化
韦 国 兵
• 碳原子的化学位移杂化大小顺序与氢谱 中的顺序一致: • sp2﹥sp ﹥ sp3 • sp3 :甲基﹤亚甲基﹤次甲基﹤季碳 0--60 • sp2 :烯基碳和芳香碳:100—167 • sp2 :羰基:160—220 • sp :炔基碳:60—90
2015-7-11
药பைடு நூலகம்分析学科组
药学院
3.诱导效应的影响
韦 国 兵
CH3X型化合物的化学位移
CH3X CH3F CH3Cl CH3Br CH3I CH4
X
δ
F
Cl
3.1
Br I
H
第 三 章 核 磁 共 振 氢 谱
电负性 4.0
2.8 2.5 2.1
75.4 24.9 10 -20.7 -2.5
由于诱导效应,取代基电负性越强,与取代 基连接于同一碳原子上的氢的共振峰越移向低场, 反之亦然。
2015-7-11
碳谱化学位移

碳谱化学位移
碳谱的化学位移与氢谱基本原理相同,也用TMS作为碳谱化学位移的零点。
影响碳谱化学位移的因素很多,主要有杂化效应、诱异效应及磁各向异性等。
而且磁各向异性中的顺磁屏蔽效应占主导作用,使碳核的核磁共振倍号大幅度移向低场。
此外,化学位移还受碳原子杂化影响,其顺序大致为:> > 。
具体的碳谱化学位移数值因物质不同而有所差异,但大体上符合以下规律:
1. 羰基或叠烯区δ>150ppm,一般δ>165ppm。
δ>200ppm只能属于醛、酮类化合物,靠近160\~170ppm的信号则属于连杂原子的羰基。
2. 不饱和碳原子区(炔碳除外)δ=90\~160ppm。
由前两类碳原子可计算相应的不饱和度,此不饱和度与分子不饱和度之差表示分子中成环的数目。
3. 脂肪链碳原子区δ<100ppm。
饱和碳原子若不直接连氧、氮、氟等杂原子,一般其δ值小于55ppm。
炔碳原子δ=70\~100ppm,其谱线在此区,这是不饱和碳原子的特例。
若需获取更多有关“碳谱化学位移”的信息,建议查阅相关的专业书籍或咨询专业人士。
波谱分析-第四章(碳谱)

para:非球形各向异性的电子(如p电子)环流产生的顺磁屏蔽
(去屏蔽),它与dia方向相反。是13C核屏蔽常数的主要决定 因素。 e2h2 para = (ΔE)-1(r2p)-3(Qnn+ QNB) B≠N 2m2c2 1) 平均激发能E 大, para负值小,去屏蔽弱,其共振位 置在高场; 例:饱和烷烃 *, E 大,共振位置在高场 羰基 n *, E 小,共振位置在低场 2) 2p电子与核间距离的影响:2p轨道扩大,r-3减小, para负 值亦减小,去屏蔽弱,其共振位置在高场。 3) 2p轨道电子云密度(QNN)和键序矩阵元QNB
化学位移与结构之间的关系 自旋偶合与偶合常数 自旋-晶格弛豫
13C
四
五 六 七
NMR测绘技术
DEPT 谱 谱图解析与化合物结构确定
具有磁矩的原子核在外磁场中将发生能级分裂,核
磁矩以不同取向绕外磁场回旋。当另一个垂直于外磁场 的射频磁场同时作用于核上,并且其照射磁场的频率等 于核在外磁场中的回旋频率时即发生核磁共振,处于低 能级的核跃迁到高能级,产生相应的吸收信号。
共轭效应:
由于共轭作用引起的电子云分布均匀。
H3C 132.8 H C C H 152.1 CHO 191.4
H2C CH2 123.3
CH3CHO 201
共轭羰基化合物的d移向高场,当共轭作用破坏时,d移向低场。
O
195.7
O
199.0
O
205.5
共轭双键化合物,中间碳原子因共轭作用移向低场。
3.3.2
质子偏共振去偶法(Off-resonance decoupling)
采用一个频率范围很小,比质子宽带去偶弱很多的射频场 B2,使1H与13C一定程度上去偶,消除2J~4J的弱偶合。 偏共振去偶的目的是降低1J,改善因偶合产生的谱线重叠而 又保留了偶合信息,从而确定碳原子级数。
CNMR核磁共振碳谱化学位移总览表

醇、醚、酮类化合物的碳原子的化学位移与其连接的氧原子和氢原子 数量成反比关系,即氧原子和氢原子数量越多,化学位移越低。
04
取代基对醇、醚、酮类化合物的碳原子的化学位移影响较大,例如烷 基取代会使化学位移减小,而芳基取代会使化学位移增大。
醛、酸、酯类化合物
醛、酸、酯类化合物的碳原子的化学 位移通常在200-300ppm范围内。
CNMR碳谱的优点与局限性
优点:
高灵敏度:碳原子具有高磁敏感性,使其成为核磁共振中的理想检测目标 。
结构信息丰富:碳谱能够提供丰富的化学结构信息,有助于确定有机分子 中的官能团和连接方式。
CNMR碳谱的优点与局限性
• 非破坏性:核磁共振技术对样品无破坏性,可以重复使用 。
CNMR碳谱的优点与局限性
取代基的影响
取代基的电负性
电负性强的取代基会使碳谱的化学位移向低场移 动。
取代基的电子效应
给电子取代基会使碳谱的化学位移向低场移动, 而吸电子取代基则会使化学位移向高场移动。
取代基的空间效应
空间位阻较大的取代基会使碳谱的化学位移向低 场移动。
溶剂的影响
溶剂的极性
极性溶剂会使碳谱的化学位移向低场移动,非极性溶剂则会使化 学位移向高场移动。
01自然丰度 较低,需要较高的检测灵敏度。
03
谱图解析复杂:由于碳谱的复杂性,解析 碳谱需要较高的专业知识。
04
对水质和温度敏感:水质和温度的变化可 能影响核磁共振信号的稳定性。
CNMR碳谱未来的发展方向
提高检测灵敏度
通过改进检测技术和仪器,提高碳谱 的检测灵敏度,以适应更多样品的检 测需求。
卤代烃类化合物
卤代烃类化合物的碳原子的化学位移通常在80150ppm范围内。
波谱解析 第四章 碳谱作业参考答案
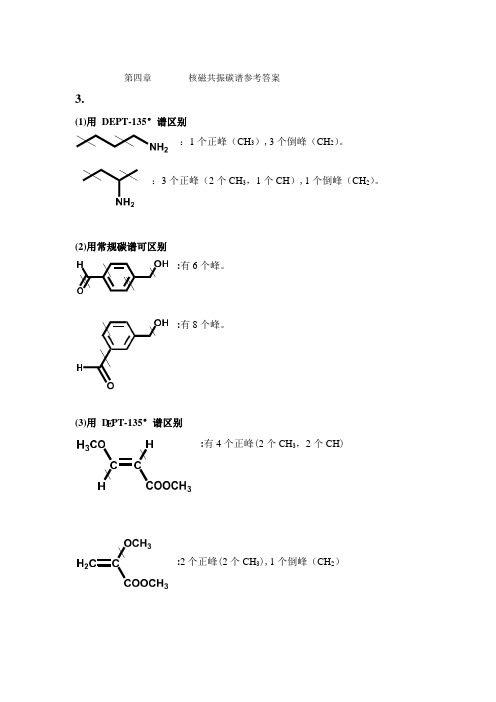
E : (3)用 D PT-135°谱区别 第四章 核磁共振碳谱参考答案3.(1)用 DEPT-135°谱区别:1 个正峰(CH 3),3 个倒峰(CH 2)。
:3 个正峰(2 个 CH 3,1 个CH ),1 个倒峰(CH 2)。
(2)用常规碳谱可区别:有 6 个峰。
有 8 个峰。
:有 4 个正峰(2 个 CH 3,2 个 CH ):2 个正峰(2 个 CH 3),1 个倒峰(CH 2)6.1)由分子式C5H9O2Br 计算不饱和度Ω=1,结构中可能含一个双键或一个环。
2)1H NMR 解析:1.25(t):CH x-CH2- ;2.85(t): 弱吸电子基团-CH y-CH2- ;3.55(t): 弱吸电子基团-CH z-CH2- ;4.20(q): -CO2-CH m-CH3(该基团CH m必定与吸电子基团相连。
根据化学位移和分子式可初步判断是与酯基氧原子相连) 3)13C NMR 解析:共有五条峰,与结构式中碳数一致,说明分子中不含对称元素。
178.2(s): 羧酸或其衍生物的C=O;60.8(t): -CH2-,与氧原子相连37.8(s): -CH2-,可能与弱吸电子原子相连26.5(t): -CH2-,可能与弱吸电子原子相连14.2(q): -CH34)推断过程:碳谱表明分子中有1 个羰基,3 个亚甲基和1 个甲基,因此氢谱中4.20ppm 处必定为亚甲基,所以分子中含CO2CH2CH3片段,再结合氢谱,该片段中CH3出峰应该在1.25ppm 处。
这样一来,可以进一步推断2.85 和3.55ppm 处的信号必然是剩余两个亚甲基,由于都为t 峰,这两个亚甲基必定相连,所以推测出分子含有片段CH2CH2,且两端都连有弱吸电子基团。
至此,分子中含有如下片段:一个B(r(端基),因此该化合物的结构为:端基),一个CH2CH2,一个CO2CH2CH38.1)由分子式C8H5NO2可算出不饱和度Ω=7,结构中可能含有苯环。
有机波谱解析课件核磁共振碳谱
首先通过1H NMR确定H3和H4(易识别),然后分别选择照射H3和H4, 13C NMR中相应的C3和C4变为单峰.
C3
H3 照射 43
5
2
O CHO
-CHO
180 160 140 120 100
80
60
40
20
(b)
180 160 140
120 100
80
60
40
20
例2:某化合物分子组成为C8H5NO2,其宽带去偶13C NMR如下所 示.另外,信号1,2,5,6的偏共振去偶为单峰, 3,4为双峰.
试推测该化合物的结构.
34
1
2
56
O HO C
CN
DMSO-d6
180
160
140
120
诱导效应对化学位移的影响
OC CC
O
150 140 130 120 110 100 90 80 70 60 50
d (ppm)
3. 重氢溶剂的化学位移和峰型
重氢的自旋量子数:I = 1 重氢偶合给出的分裂信号(13C):2In + 1 = 2n + 1 (n 重氢数)
Solvent
CDCl3 CD2Cl2 C6D6 CD3OD CD3CN Aceton-d6 DMSO-d6 DMF-d7 Pyridine-d5 CD3COOD
120
100
80
60
40
20
0
PPM
宽带去偶13C谱的优缺点
优点:减少谱线的重叠,谱图清晰、明了 缺点:失去许多分子结构信息
碳谱化学位移影响因素

碳谱化学位移影响因素
碳谱化学位移是指分子中碳原子的核磁共振谱的峰位相对于内部参考物质(通常为甲基硅烷化合物)的偏移量。
碳谱化学位移受到以下几个主要因素的影响:
1. 水平共轭效应:共轭的双键或环状结构会导致共轭系统中的碳原子显示更低的化学位移。
这是因为共轭系统会使电子的分布更为扩散,使得这些碳原子周围的电子密度降低,减小了电子云对核磁共振的屏蔽效应。
2. 取代基效应:碳原子周围的取代基会对其化学位移产生影响。
电负性取代基,例如卤素原子,会导致相邻的碳原子显示更高的化学位移。
而电荷给予基团,例如甲基基团,会导致其附近的碳原子显示更低的化学位移。
3. 空间效应:碳原子周围的立体效应也会对其化学位移产生影响。
例如,轴向立体效应可以通过改变碳原子周围的环角度来改变化学位移。
4. 溶剂效应:溶剂的极性和酸碱性也会对碳原子的化学位移产生影响。
通常,极性溶剂会对碳原子显示更低的化学位移,而酸性溶剂会对碳原子显示更高的化学位移。
需要注意的是,以上列举的因素只是其中的一部分,并且可能存在相互影响的情况。
在实际的核磁共振谱解析中,通常需要综合考虑多个因素来解释化学位移的变化。
波谱分析碳谱化学位移

苯环碳谱出峰数目:
无对称性:
6个峰
单取代:
4个峰
对位取代:
4个峰
邻位相同取代基: 3个峰
间位三相同取代基: 2个峰
单个苯环不可能只有5个碳峰!
Y X
X
Y
R
X
Y
X
X X
X X 19
R
H
CH3 SiMe
Et CH(CH3)2 C(CH3)3
CF3 C6H5 CH=CH2 CCH CH2OH COOH COO-
(5)及更远的甲基影响很小。
(6)直链烷烃及开环支链烷烃中第K个碳原子的化学位移C(K)可以用经验公式 Lindeman和Adams方法计算,其表达式为:
4
C(K)=BS+
Dm Asm s N k 3 s N k 4
m2
5
C(K) = BS+
4
Dm Asm s N k 3 s N k 4
192.4 191.4 191.0 192.5
RCOCH3 205.1 206.3 206.6 204.7 197.2 196.5 196.0 199.5
RCOR 205.1 209.3
195.2 -
27
(3)羧酸及其酯 (丙酮C(C=O)约205 ppm)
羧酸羰基碳C(C=O)在165~185 ppm,形成相应的阴离子后去屏蔽~5 ppm(注 意此特殊效应)。
酯羰基碳C(C=O)在160~180 ppm。在酯R'COOR中羰基碳的C(C=O)与R'及R 皆有关系。
28
(4)酸酐、酰卤、酰胺
酸酐羰基的化学位移与相应羧酸相比屏蔽增大~l0 ppm,C(C=O)约150~175 ppm。 酰氯羰基C(C=O)与相应羧酸相比屏蔽4~8 ppm,而酰溴和酰碘分别屏蔽5和l0 ppm。 酰胺羰基化学位移范围为160~180 ppm,氮原子上取代基相对于羰基的构象对羰基化 学位移有明显影响。 例如N-甲基甲酰胺中,两个异构体羰基化学位移差异为3.3 ppm。
实用波谱:第四章. 碳谱(13C-NMR)

影响因素
C 诱导效应
CI4 δ-292.5
14
影响因素
取代基的诱导效应和数目 取代基数目,影响, 诱导效应随相隔键的数目增加而减弱; 随取代基电负性,
15
15
影响因素
D 共轭作用
16
影响因素
e. 效应(1,3-效应) 较大基团对γ-位碳上的氢通过空间有一种挤压作用,使电子 云偏向碳原子,使碳化学位移向高场移动,这种效应称为γ-效 应。
第四章. 碳谱(13C-NMR)
碳谱为结构解析提供的信息
化学位移宽:1~250; 分辨率高,谱线简单,可观察到季碳; 可给出化合物骨架信息。 缺点:测定需要样品量多,测定时间长, 13C信号灵敏度
是1H信号的1/6000。 而吸收强度一般不代表碳原子个数,与种类有关。
1
1
2
3
碳谱特点
1 化学位移分布宽 2 峰强度不反应碳原子数 3 碳谱必须对1H去偶
4
化学位移等价
5
6
7
8
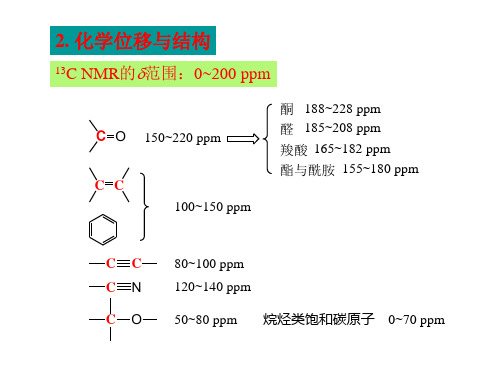
碳谱(13C-NMR):必记基础数据
常见一些基团的化学位移值: 脂肪C: <50 连杂原子C: C-O,C-N 40-100 C-OCH3 : 50-60 糖上连氧C: 60-90 糖端基C : 90-110
9
9
必记基础数据
炔碳: 60-90,氰基碳:120 芳香碳,烯碳: 110-150 连氧芳碳,烯碳:140-170;其邻位芳碳,烯碳:90120 C=O: 160-220 C=N : 145-165
17
18
影响因素 f 其他因素
19
不同化合物碳的化学位移
1烷烃
环烷烃
20
2烯碳
21
碳谱化学位移0-15

碳谱化学位移0-15
碳谱化学位移是指分子中的一个碳原子所产生的化学位移。
它通常由下式表示:
δ = (ν - νref)/νref x 10^6
其中,δ是化学位移,ν是分子中该碳原子与天然碳的共振频率,νref是参考物质的共振频率。
在常见有机分子的^13C NMR谱中,参考物质通常为二氯甲烷(CDCl3),其共振频率为77.0 MHz。
对于有机分子中的碳,它的化学位移范围通常在0到220 ppm之间。
其中,0 ppm对应的是甲基羰基碳(如乙酰基中的CH3CO-),220 ppm对应的是芳香环上的氢化碳(如苯环上的C-H)。
在其中,常见的一些化学位移值如下:
- 0-60 ppm:sp3杂化碳(如甲基、乙基、异丙基等)
- 60-90 ppm:α-烯丙基、β-烯丙基碳等
- 90-120 ppm:芳香环上的杂环、烷基等
- 120-150 ppm:烯烃、α,β-不饱和羰基、α,β-不饱和酮、α,β-不饱和酸等
- 150-220 ppm:芳香环上的加成基团(如酰基、烷氧基等)
需要特别说明的是,不同的分子、不同的实验条件(如溶剂、温度等)可能导致化学位移发生变化。
因此,在实际实验中,需要结合分子的结构和实验条件来解读^13C NMR谱。
波谱分析-碳谱数据表
③ 末端三键碳比分子内部三键碳处于高场;
④ 三键与极性基团相连时,2个sp碳的δ可相差20-95ppm。
4.3 各类碳核的化学位移
二、不饱和烃:芳香化合物—取代规律
4.3 各类碳核的化学位移
二、不饱和烃:芳香化合物—取代规律
4.3 各类碳核的化学位移
二、不饱和烃:芳香化合物—取代规律
4.3 各类碳核的化学位移
供电屏蔽
羧基富电子态,C=C吸电去屏蔽
值小 羧基富电子态,δ C=O
吸电去屏蔽
供电屏蔽
羧基富电子态,C=C吸电去屏蔽
4.3 各类碳核的化学位移
三、羰基化合物—羧酸(富电子态)
值小 羧基富电子态,δ C=O
羧基富电子态,C=C吸电去屏蔽
4.3 各类碳核的化学位移
三、羰基化合物—酰胺和内酰胺(富电子态)
值小 羧基富电子态,δ C=O
吸电去屏蔽
二、不饱和烃:芳香化合物—取代规律
4.3 各类碳核的化学位移
三、羰基化合物—醛(贫电子态)
羧基贫电子态,δ
值大
C=O
羧基贫电子态,C=C供电屏蔽
4.3 各类碳核的化学位移
三、羰基化合物—酮(贫电子态)
羧基贫电子态,δ
值大
C=O
羧基贫电子态,C=C供电屏蔽
4.3 各类碳核的化学位移
三、羰基化合物—羧酸酯和内酯(富电子态)
4.3 各类碳核的化学位移
一、烷烃及其衍生物—取代规律
4.3 各类核的化学位移
二、不饱和烃:烯烃C=C—取代规律
4.3 各类碳核的化学位移
二、不饱和烃:烯烃C=C—取代规律
4.3 各类碳核的化学位移
二、不饱和烃:炔烃C≡C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
校正项
校正项
,‘(反式) 0 ,‘(顺式) -1.1
, -4.8 , 2.3 ’,‘ 2.5 其它作用 ~0
13
例:求下列顺式化合物中C-2的C值。
K K’ ’ ’
CH3CHCHCH2CH3
1
23
4
5
解:C(2)=123.3+A()+A(’)+A(’)+ ,‘(cis)
=123.3+10.6+(-7.9)+(-1.8)+(-1.1)
(f)醛酮的羰基使邻近-C去屏蔽。
25
(2)酮、醌、醛 酮羰基和其他羰基相比,化学位移在最低场。环状或
开链的烷基取代的脂肪酮C在200~220 ppm。
(丙酮C(C=O)约205 ppm) 卤代酮C在170~200 ppm。 、一不饱和酮C在190~2l0 ppm。
醛羰基与相应的甲基酮相比,C一般小5~l0 ppm。
18
苯环碳谱出峰数目:
无对称性:
6个峰
单取代:
4个峰
Y X
X
Y
R
对位取代:
4个峰
X
Y
邻位相同取代基: 3个峰 间位三相同取代基: 2个峰
X
X X
X
单个苯环不可能只有5个碳峰!
X
19
R
H
CH3 SiMe
Et CH(CH3)2 C(CH3)3
CF3 C6H5 CH=CH2 CCH CH2OH COOH COO-
84.7 67.0
73.6
H3C CH2 CH2 CH2 C 12.9 21.2 29.9 17.4 82.8
C CH3
CH 67.4
HC C OCH2CH3 H3C C C OCH3
23.9 89.4
28.0 88.4
15
表4-15 线性炔烃中sp-C之C值
化合物
C C-1 C-2 C-3 C-4 C-5
学位移C(K)可以用经验公式Lindeman和Adams方法 计算,其表达式为:
4
C(K)=BS+ Dm Asm s N k 3 s N k 4
m2
5
4
C(K) = BS+ Dm Asm s N k 3 s N k 4
m2
其中Bs、Asm 、s、s为下表中的常数。
S为直接与第K个碳原子连接的碳原子数。
(a)与C5直接相连的碳原子数是2, S=2。 (b)连接C5的两个碳皆为仲碳,所以D2=2; D3=0; D4=0。
(c)与C5相隔三个键的碳原子数为2,相隔四个键的碳原子 数为1,因此Nk3=2, Nk4=1。 (d)Bs为B2=15.33; Asm为A22=9.57; s为2= -2.69; 为 2=0.25;
24
4.4.9 羰基化合物 (1)羰基碳的C特征
(a)羰基碳一般在很低场,干扰很少,只有丙二烯及叠 烯的中央碳及强去屏蔽的芳碳在此区域有峰。
(b)醛基的质子被甲基取代后,C(C=O)仅向低场移动约 5ppm。
(c)与烯键或苯环共轭后,C(C=O)向高场位移。 (d)羰基上连接有未共用电子对的杂原子时,由于p-共 轭使羰基屏蔽增加,移向高场。 (e)羰基碳变化范围约60ppm,所以对结构变化很敏感。
13.9 22.8 34.7
4
(3)若-H被甲基取代,如C-C-H C-C-CH3, 则C的C向低场移动9 ppm左右,叫效应。
(4)若-H被甲基取代,C-C-C-H C-C-CCH3,则C的C向高场移动2.5ppm左右。此效应与 、效应相反,叫效应。
(5)及更远的甲基影响很小。
(6)直链烷烃及开环支链烷烃中第K个碳原子的化
- - 6 15
- - 13 13
-- 9
4
-- 7
6
- - 15 -10
Aki(Ri)
7.2
-1.5
6
-
2
-
-
-
-
-
-
-
-
-
-
-
-
-12
Aki’(Ri’)
Aki(Ri)
Ri
’ ’ ’
Cl
- - -6 3
-1
-
Br
- 2 -1 -8
0
-
I
- 2 7 -38
-
-
C6H5
- - -11 12
-
-
校正项
(e)将有关参数值代入,得
C5= B2+ D2 A22+2 Nk3+2 Nk4 =15.34+29.75+(-2.69)2+0.251
=29.7(ppm) (实测值29.7ppm)
8
4.4.2 环烷烃
环烷烃中C与环的大小无明显内在关系,除环丙烷 外,环烷烃中碳的C变化幅度不超过 6ppm。 环丙烷C在 2.6 ppm,其余环烷烃(环丁烷到环十七 烷) C在23.3~29.4 ppm。
碳的位置
X
Cl Br
I
31.2 20.0 -6.0
10.5 10.6 11.3
-4.6 -3.1 -1.0
0.1 0.1
0.2
0.5 0.5
1.0
23
4.4.7 醇
醇中由于氧原子的吸电子性质,与相应烷烃比较, -C、-C、-C分别向低场位移35~52, 5~12及 0~6 ppm。
4.4.8 胺 伯胺基沿烷基链中各取代效应的平均值分别为位29.3 ppm;位11.3 ppm;位4.6 ppm;位0.6 ppm。
酸酐羰基的化学位移与相应羧酸相比屏蔽增大~l0 ppm, C(C=O)约150~175 ppm。
=123.1 ppm
实测值为122.8 ppm
14
4.4.4 炔烃 炔的sp杂化碳原子C为65~90 ppm。
端基炔键的C1的C与C2的C差别约15 ppm,而不对称 的2-炔及3-炔烃中,炔碳C值差仅为3~4及1~2 ppm。 在取代炔烃中炔碳的C变化范围可达100 ppm 。
H3C CH2 C CH H3C C
有机波谱分析
1
4.4 各类碳的化学位移 碳原子在13C-NMR中的C与很多因素有关,主
要是杂化轨道状态及化学环境。
sp3-C在-2.1~43 ppm sp2-C在100~165 ppm sp-C在67~92 ppm 各类碳的化学位移顺序与氢谱中各类碳上对应质子的 化学位移顺序有很好的一致性。
若质子在高场,则该质子连接的碳也在高场;反之, 若质子在低场,则该质子连接的碳也在低场。
个CH3中心碳C发生近似9ppm的去屏蔽效果,这叫取 代效应。(如甲烷C为-2.1、乙烷C为5.9,5.9、丙烷 C
为15.6,16.1,15.6 )
碳数n >4 端甲基 C=13-14 ppm C>CH> CH2 >CH3,邻碳上取
代基增多C 越大。
取代烷烃:
H3 C CH 2 CH 2 CH 2 CH 3
位置。
10
化学位移规律:烯烃
CC
C= 100-165 ppm(成对出现)
端碳=CH2 110;邻碳上取代基增多C越大:
CH3
25.4 CH3
H3C 30.4
29.9 H3C
C CH2 CH3 52.2
CH3 53.5
C
CH2
C
CH2
143.7 114.4
24.7 CH3
CH CH3
CH3
H2C
C H
B3 23.46 A32 6.60 A33 11.14 A34 14.70 3 -2.07 3 0
B4 27.77 A42 2.26 A43 3.96 A44 7.35 4 0.68 4 0
7
例:3-甲基庚烷的C-5的C计算如下:
123
4 5 67
CH3-CH2-CH(CH3)-CH2-CH2-CH2-CH3
O
CH3
H2C
C H
O
CH3
84.2 153.2
11
表4-12 单烯烃中烯碳化学位移计算用的经验参数
Ri C(CH,CH2,CH3)
OH OR OAC COCH3 CHO COOH COOR CN
Aki’(Ri’)
’ ’ ’
1.5 -1.8 -7.9 10.6
- -1 -
-
- -1 -39 29
- - -27 18
例:化合物
的C(a)和C(b)计算如下
C(a)=128.5-14.4+0=114.1 ppm C(b)=128.5+31.4-2.9=157.0 ppm
22
4.4.6 卤代烷 卤代烷中各个碳的C不仅要考虑诱导效应,还要考
虑重原子效应。卤素对-C、-C、-C有显著影响。
取代效应的平均值列于下表。 表5-20 卤代烷中X的取代效应
26
R 甲基 乙基 丙基 烯丙基 乙烯基 丙烯基 苯基 萘基
表6-23 醛酮羰基的C
RCHO 199.6 201.8 201.6
192.4 191.4 191.0 192.5
RCOCH3 205.1 206.3 206.6 204.7 197.2 196.5 196.0 199.5
RCOR 205.1 209.3
化学位移的贡献。
17
的范围及影响因素:
1) 苯:128.5 ppm,取代苯环:100~160 ppm;被取 代碳原子值有明显变化,邻、对位碳原子值有较大 变化,间位碳原子值几乎不变化; 2) 一般,取代基电负性越强,被取代碳原子值越大; 3)取代基烷基分枝多,被取代碳原子值增加较多; 4)重原子效应:被碘、溴取代的碳原子值向高场位 移; 5)共振效应:第二类取代基使邻、对位碳原子值向 高场位移,第三类取代基则使邻、对位碳原子值向低 场位移; 6)电场效应:例:硝基取代的邻位碳原子值移向高 场。
