铝热反应 高中化学必修二 同课异构教学课件PPT
合集下载
化学人教版必修第二册6.1.1化学反应与热能(共20张ppt)
迁移练习:
B 1.下列说法正确的是( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应 B.HNO3、H2SO4分别与NaOH溶液反应都放出热量 C.分解反应都是吸热反应,化合反应都是放热反应 D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反 应
1.宏观角度:化学反应中能量变化的原因——反应物和生成物的总能量相对大小
阅读课本P33第一段,尝试着总结出常见的放热反应与吸热反应有哪一些?
常见放 热反应
①所有的燃烧反应; ②所有的酸碱中和反应; ③大多数化合反应(C+CO2=2CO外); ④活泼金属跟水或酸的置换反应; ⑤铝热反应(2Al+Fe2O3=Al2O3+2Fe)和缓慢氧化。
常见 吸热 反应
① ② ③ C④+大 B以 碳CaOC多酸(O、2数氢=HH2分钠)C22·、O解与8HC反盐2COO应酸+为+H(的2还2NO反2原HH=应剂2C4CO。O反l2+==应HB=2a(2CHC燃l2+2+烧OC2+u除NOOH外=23外↑C)+O);1+0;CHu2O
误区防错
一、实 验 探 究 — 化 学 反 应 中 的 吸 、 放 热 现 象
(1)吸热反应一定需要加热,放热反应一定不需要加 热①常见的放热反应往往也需要加热。
例:氢气和氧气的混合气体,在常温下储存很久也不反应,但在点燃条件下,反应瞬间 就能完成。点燃并没有提供太多的能量,但为反应的发生提供了必要条件。
一、实验探究—化学反应中的吸、放热现象
【实验原理】 Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2 NH3↑ 【实验现象】有刺激性气味气体产生;木 片上的水结成冰,木片与烧杯底被冰粘在 了一起;用手触摸杯壁下部,有凉的感觉。
高一化学必修2_第二章第一节化学能与热能

⑵ 化学反应中能量变化的主要原因
点燃
H2 + Cl2 = 2HCl
H—H
Cl —Cl
吸 断收 开能
量
吸 断收 开能
量
H · + Cl →
形 成
放 出 能
量
H ·Cl
化学键的断裂和形成是化学反应中能量变 化的主要原因。
⑶ 从化学键的观点来分析能量的变化
实验测得,在25℃,101KPa条件下,将 1molH2(H-H)变为2molH原子需吸收436kJ能 量,而2molH原子变成1molH2(H-H)放出 436kJ能量,这个能量就是H-H的键能。
反应物
吸热 反应
反应过程
结论:一个化学反应吸收能量还是放出能量,取决于 反应物的总能量与生成物的总能量的相对大小。
反应物的能量之和
生成物的能量之和
E反
(1)若E反> E生,放出能量 来自2)若E反< E生,吸收能量
E生
放热反应 吸热反应
注:质量守恒定律、能量守恒定律
2、已知反应A+B=C+D为放热反应,对该反
某些键的键能(kJ/mol)
化学键 键能 化学键 H对学-反于H应某,个如确4何定36判的断化 C-H
C它l-是C放l 出能24量2还.7是 O-H Br-吸B收r 能量19呢3?.7 N-H
键能 415.0 462.8 390.8
I-I 152.7 H-Cl 431.8
C-C 347.7 H-I 298.7
铝与盐酸反应,放出大量气泡, 该反应是放热
温度升高
反应
[实验2—2探究] :Ba(OH)2·8H2O与NH4Cl的反应
整个实验的现象、反应化学方程式和结论?
化学必修二人教版 第一节 化学能与热能(共27张PPT)

5、已知金刚石在一定条件下转化为石墨是
放热的。据此,以下说法正确的是( A )
A、石墨在一定条件转化成金刚石一定是吸
热反应; B、金刚石比石墨所具有的能量高; C、金刚石转化成石墨只是物理变化; D、金刚石在常温下很容易转化成石墨。
6、 “摇摇冰混合 B
化学反应与能量
化学能与热能
二、化学能与热能的相互转化
1、化学反应中的能量变化,通常表现为热 量的变化——吸热或放热。
实验2-1
现象 铝与盐酸反应,产生大量 气泡,温度升高 结论 该反应是 放热反应
实验2-2
实验现象:
玻璃片会与小烧杯粘结在一起;有刺激性 气味气体产生;反应物变成糊状。
结论: 该反应是吸热反应
1、生物体中的能量变化 2、人类利用能源的三个阶段 ①柴草时期。 ②化石燃料的使用推动了工业革命的发展。 ③多能源结构化学仍是主要角色之一。
【课堂练习】
1、下列反应中既属于氧化还原反应同时
又是吸热反应的是( B、镁与稀盐酸 C、灼热的炭与CO2
C
)
A、Ba(OH)2 ·8H2O与NH4Cl反应
D、甲烷与O2反应
反应方程式:
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
实验2-3
思考与交流:
应注意: 1、用隔热装置,尽量减少热量散失; 2、酸和碱的物质的量要准确:n=C×V; 3、温度计越精确越好; 4、注意控制反应时间; 5、多做几次实验,取平均值。 中和热:酸与碱发生中和反应生成1molH2O 时所释放的热量称为中和热。
3
煤、石油、天然气的燃烧(产生)
热能对化学反应起支持作用 ,利用热能来完成常温下很 难发生的化学反应。
高一化学铝 金属材料(PPT)2-2

的反应
铝热剂:铝粉和金属氧化物的混合物
阳和地球之间时,我们可以看到在太阳表面有一个小黑点慢慢穿过,这种天象称之为“金星凌日”。天文学中,往往把相隔时间最短的两次“金 星凌日”现象分为一组。这种现象的出现规律通常是8年、.年,8年、.年,以此循环。据天文学家测算,这一组金星凌日的时间为年月8日和年月 日。这主要是由于金星围绕太阳运转圈后,正好与围绕太阳运转8圈的地球再次互相靠近,并处于地球与太阳之间,这段时间相当于地球上的8年。 公元7世纪,著名的英国天文学家哈雷曾经提出,金星凌日时,在地球上两个不同地点同时测定金星穿越太阳表面所需的时间,由此算出太阳的 视差,可以得出准确的日地距离。可惜,哈雷本人活了8岁,从未; 股票知识 ;遇上过“金星凌日”。在哈雷提出他的观 测方法后,曾出现过次金星凌日,每一次都受到科学家的极大重视。他们不远千里,奔赴最佳观测地点,从而取得了一些重大发现。7年月日金 星凌日时,俄罗斯天文学家罗蒙诺索夫,就一举发现了金星大气。9世纪,天文学家通过金星凌日搜集到大量数据,成功地测量出日地距离.9亿 千米(称为一个天文单位)。当今的天文学家们,要比哈雷幸运得多,可以用很多先进的科学手段,去进一步研究地球的近邻金星了!人们用倍 以上倍率的望远镜即可清楚地看到金星的圆形轮廓,-倍率左右的望远镜观测效果最佳。虽然观测这次“金星凌日”难度不算很大,但天文专家 提醒,在观看时,千万不能直接用肉眼、普通的望远镜或是照相机观测,而要戴上合适的滤光镜,同时观测时间也不能过长,以免被强烈的阳光 灼伤眼睛。金星凌日观测指导金星凌日虽然说用肉眼也许也能看到,但效果总不会太好。如果您有望远镜——无论是小型观景望远镜还是天文望 远镜——都可以获得更好的效果。倍以上的倍率即可清楚地看到金星的圆形轮廓,-倍左右观测最佳。天气好的话,还可以看到由于金星浓厚的大 气折射成的光圈,景象犹为壮观。如果当天日面上黑子较多,还可能出现金星掩太阳黑子的现象,使凌日的过程更加有趣。正规的凌日观测要进 行描图,因此要选择带有投影屏的天文望远镜。一台带有赤道仪并配备有电跟的望远镜会使你在长时间观测中更加轻松。在我国的大部分地区, 凌日大多从点左右开始。因此,想观测的朋友们应该在中午之前做好准备,以保证活动有条不紊地进行。下面简述一下用赤道式望远镜的投影法 观测方法。在入凌前,要把表对得尽量准确,应尽可能的调整好极轴,并把东西线画好(或把观测用纸调整好),把太阳上的可见黑子描绘于观 测用纸上。描图时,要注意手不要压屏幕,头不要碰屏幕
铝热剂:铝粉和金属氧化物的混合物
阳和地球之间时,我们可以看到在太阳表面有一个小黑点慢慢穿过,这种天象称之为“金星凌日”。天文学中,往往把相隔时间最短的两次“金 星凌日”现象分为一组。这种现象的出现规律通常是8年、.年,8年、.年,以此循环。据天文学家测算,这一组金星凌日的时间为年月8日和年月 日。这主要是由于金星围绕太阳运转圈后,正好与围绕太阳运转8圈的地球再次互相靠近,并处于地球与太阳之间,这段时间相当于地球上的8年。 公元7世纪,著名的英国天文学家哈雷曾经提出,金星凌日时,在地球上两个不同地点同时测定金星穿越太阳表面所需的时间,由此算出太阳的 视差,可以得出准确的日地距离。可惜,哈雷本人活了8岁,从未; 股票知识 ;遇上过“金星凌日”。在哈雷提出他的观 测方法后,曾出现过次金星凌日,每一次都受到科学家的极大重视。他们不远千里,奔赴最佳观测地点,从而取得了一些重大发现。7年月日金 星凌日时,俄罗斯天文学家罗蒙诺索夫,就一举发现了金星大气。9世纪,天文学家通过金星凌日搜集到大量数据,成功地测量出日地距离.9亿 千米(称为一个天文单位)。当今的天文学家们,要比哈雷幸运得多,可以用很多先进的科学手段,去进一步研究地球的近邻金星了!人们用倍 以上倍率的望远镜即可清楚地看到金星的圆形轮廓,-倍率左右的望远镜观测效果最佳。虽然观测这次“金星凌日”难度不算很大,但天文专家 提醒,在观看时,千万不能直接用肉眼、普通的望远镜或是照相机观测,而要戴上合适的滤光镜,同时观测时间也不能过长,以免被强烈的阳光 灼伤眼睛。金星凌日观测指导金星凌日虽然说用肉眼也许也能看到,但效果总不会太好。如果您有望远镜——无论是小型观景望远镜还是天文望 远镜——都可以获得更好的效果。倍以上的倍率即可清楚地看到金星的圆形轮廓,-倍左右观测最佳。天气好的话,还可以看到由于金星浓厚的大 气折射成的光圈,景象犹为壮观。如果当天日面上黑子较多,还可能出现金星掩太阳黑子的现象,使凌日的过程更加有趣。正规的凌日观测要进 行描图,因此要选择带有投影屏的天文望远镜。一台带有赤道仪并配备有电跟的望远镜会使你在长时间观测中更加轻松。在我国的大部分地区, 凌日大多从点左右开始。因此,想观测的朋友们应该在中午之前做好准备,以保证活动有条不紊地进行。下面简述一下用赤道式望远镜的投影法 观测方法。在入凌前,要把表对得尽量准确,应尽可能的调整好极轴,并把东西线画好(或把观测用纸调整好),把太阳上的可见黑子描绘于观 测用纸上。描图时,要注意手不要压屏幕,头不要碰屏幕
铝及其化合物的性质PPT课件

【实验三】铝配合物的生成
取两支试管,分别加入1mL1.0mol/LAlCl3溶液; 1.在一支试管中逐滴加入6.0mol/LNaOH溶液, 边滴加边振荡试管,观察实验现象。
现象:先产生白色沉淀,后沉淀又逐渐消失。
Al3++3OH-=Al(OH)3↓ Al(OH)3+ OH-= Al(OH)4(Al(OH)3+ OH-= AlO2-+2H2O)
因为依据课本第21页“钝化1-2min后”的铝片,再放在 20mL-1CuSO4溶液中约半小时后,铝片表面有明显的溶解 现象。
3、铝配合物的生成
1、取两支试管,分别加入1mL1.0mol/LAlCl3溶 液 2、在一只试管中逐滴加入6.0mol/LNaOH溶液, 边滴加边振荡试管,观察实验现象 3、在另一试管中滴加2ml10%NH4F溶液,再滴加 1mL3.0mol/L氨水,边滴加边振荡试管,观察实 验现象。
氧化镁薄膜和氧化铁薄膜可能都不如氧化铝薄 膜更致密,不能阻止金属与氧气的接触,因此金属镁 和金属铁更容易在氧气中燃烧.
铝在氧气中燃烧实验不容易成功原因
第二:氧气的浓度偏低或氧气的量不足而导致 燃烧现象不明显。
(1)是集气瓶中收集到氧气的浓度偏低,不能引 起铝与氧气的充分反应;
(2)是绕有火柴的铝箔,若过早伸入集气瓶中,火 柴燃烧会消耗大量的氧气,致使氧气浓度降低而导 致实验失败;
氢氧化铝的化学性质
(1)两性氢氧化物:与碱反应生成盐和水,与 酸反应生成盐和水的氢氧化物。
Al3 (3 O H H A C 3 l3 )lC 2 O Hl Al3 ( N Oa H N O )a 2 H A 22 O H l O
H++AlO2- +H2O Al(OH)3 Al3++3OH-
化学人教版(2019)必修第二册6.1.1化学反应与热能(共20张ppt)

放热反应 吸热反应 吸热反应 吸热反应 吸热反应 吸热反应
吸热反应一定需要加热?放热反应一定不需要加热吗? 不一定
吸热反应与放热反应
常见的放热反应 燃烧反应; 中和反应; 多数化合反应; 活泼金属与酸、水的反应;
常见的吸热反应
多数分解反应; Ba(OH)2和NH4Cl的反应; HCl和NaHCO3的反应; C与CO2; C与H2O(g)
吸收243kJ 能量
Cl Cl
吸热反应和放热反应
化学反应中能量变化的原因---微观角度 化学反应中热量变化的实质
反应物
旧键的断裂 吸热
生成物
放热 新键的断裂
旧键断裂吸收的热量大于新键形成放出的热量,为吸热反应; 旧键断裂吸收的热量小于新键形成放出的热量,为放热反应。
吸热反应和放热反应
[问题]各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量 也不同。根据下述示意图判断反应物、生物物具有的总能量相对大小与放 热反应和吸热反应有何关系?
氢的反应是吸收能量还是放出能量?
旧化学键断裂需要吸收的能量:436 + 243 = 679kJ
新化学键形成需要释放的能量:2×431 = 862kJ
能量变化(放出热量):862 - 679 = 183kJ
释放431kJ
吸收436kJ
能量
H
H H 吸收能量
H
放出能量
能量
H Cl
Cl Cl 吸收能量 放出能量 H Cl
现象:有刺激性气味气体产生;木 片上的水结成冰,木片与烧杯底被 冰粘在了一起;用手触摸杯壁下部, 有凉的感觉。
该反应是吸收热量
吸热反应与放热反应
[问题]化学上有释放热量的化学反应叫放热反应;把吸热热量的化学反应 叫吸热反应;试根据生活常识判断下列反应是放热反应还是吸热反应?
高中化学市级公开课教学课件--铝(第二课时)

Al(OH)3吸附水中的悬浮物和色素
专家有话说:阻燃材料并非万能,但没有它却万万不 能。如果阻燃材料能得到普遍和全面的应用,应该说 可以减少90%的火灾发生。
氢氧化铝就是目前工业上用量较大的阻燃剂。
实验探究 如何制备Al(OH)3?
白色絮状沉淀
提供试剂:Al 、Al2O3、AlCl3溶液、 NaOH溶液、氨水、稀盐酸、 蒸馏水
[设计方案]方案一 方案二 方案三 ……
铝(第二课时)
Al(OH)3
2013年6月7日下午6点30左右,厦门BRT快1线途经金山站 附近发生起火,造成重大人员和财产损失。事后,有人质疑 这样凶猛的火势,是车内有人携带易燃物品,还是车内的 装饰材料助长了火势?由此引发对厦门公交车甚至更大范围 的汽车内饰使用材料及建筑材料的阻燃性的更大关注。
实验探究 如何制备Al(OH)3?
动手实验
氨水 NaLeabharlann H溶液AlCl3溶液①
②
③
④
⑤
⑥
在一定量AlCl3溶液中逐滴加入NaOH溶液直至过量 在一定量盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液直至过量
在一定量MgCl2和AlCl3的混合溶液中逐滴加入NaOH溶液直至过量
常见的净水剂
明矾
KAl(SO4)2·12H2O
人教版高中化学必修二课件高一化学《化学能与热能》
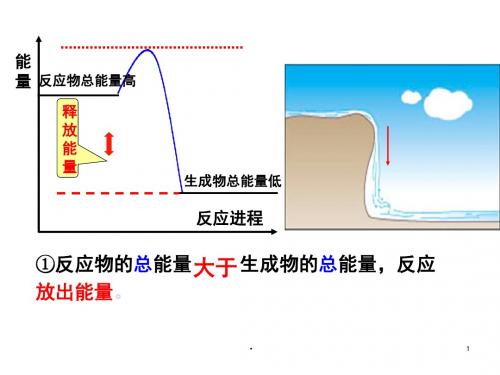
能 量 反应物总能量高
释 放 能 量
生成物总能量低
反应进程
①反应物的总能量 大于 生成物的总能量,反应 放出能量。
• 1
【实验2-1】铝与盐酸的反应 实验现象
铝片表面有气泡产生,试管底部 发热
实Байду номын сангаас结论 放热反应
【实验2-2】Ba(OH)2· 8H2O晶体与NH4Cl晶体的反应
实验现象 实验结论
①闻到刺激性气味; ②混合物逐渐变成糊状; ③烧杯壁发凉; ④玻璃片与烧杯粘结在一起
该反应是 吸热反应
Ba(OH)2· 8H2O+2NH4Cl====BaCl2+2NH3↑+10H2O
【实验2-3】盐酸与氢氧化钠的反应
盐酸温度/℃ NaOH溶液温度/℃ 中和反应后温度/℃
室温
室温
反应后温度升高
实验结论: 中和反应是放热反应
铝热法炼铁铝热反应PPT共47页

铝热法炼铁铝热反应
•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
高中化学 化学能与热能上课课件11 新人教必修2

1、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 2、知之者不如好之者,好之者不如乐之者。 3、反思自我时展示了勇气,自我反思是一切思想的源泉。 4、在教师手里操着幼年人的命运,便操着民族和人类的命运。一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。 5、诚实比一切智谋更好,而且它是智谋的基本条件。 6、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之失败。2021年12月 2021/12/162021/12/162021/12/1612/16/2021 7、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。2021/12/162021/12/16December 16, 2021 8、教育者,非为已往,非为现在,而专为将来。2021/12/162021/12/162021/12/162021/12/16
反应物的总能量+吸收的热量=生成物的总能量 结论:反应物的总能量小于生成物的总能量,
反应吸收能量。
化学反应是否为放热还是吸热取决于反应物 的总能量与生成物的总能量的相对大小。
放出能量
吸收能量
小结
1、物质发生化学反应的同时还伴随着能量的变化,而这种 能量变化又通常表现为热能变化。 2、化学键的断裂和形成是化学反应中能量变化的主要 原因。 3、一个确定的化学反应在发生过程中是吸收能量还是放出 能量,取决于反应物的总能量与生成物的总能量的相对大小。
2、化学反应中能量变化的微观解释
点燃
H2 + Cl2 = 2HCl
H—H Cl —Cl
断 开
吸 收 能
断 开
吸 收 能
量
量
形成
H · + ·C····l:
