第31届中国化学奥林匹克(决赛)理论试题及标准答案
2017年第31届中国化学奥林匹克(初赛)试题卷(含参考答案解析)

中国化学会第 31 届全国高中学生化学竞赛(省级赛区)试卷估分用答案(2017 年8 月27 日9:00 ~ 12:00)·竞赛时间 3 小时。
迟到超过半小时者不能进考场。
开始考试后 1 小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-1 2NH4HCO3 + Mg2B2O4(OH)2 = 2MgCO3 + 2NH3 + 2H3BO3(2 分)NH4HCO3 + Mg2B2O4(OH)2 + 2H2O = Mg2(OH)2CO3 + NH3 + 2H3BO31-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将 Pu3+氧化为 Pu4+。
1-2 4H+ + 2HNO2 + 4Pu3+ = N2O + 4Pu4+ + 3H2O(2 分)1-3N aBH4与氯化镍(摩尔比 2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比 1:3)。
1-3 8NaBH4 + 4NiCl2 + 18H2O = 6H3BO3 + 2Ni2B + 8NaCl + 25H2(2 分)1-4通过 KMnO4和H2O2在KF-HF 介质中反应获得化学法制 F2的原料 K2MnF6。
1-4 2KMnO4 + 3H2O2 + 2KF + 10HF = 2K2MnF6 + 3O2 + 8H2O(2 分)1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
1-5 2PH3 + 8HCHO + H2SO4 = [P(CH2OH)4]2SO4(2 分)第 2 题(10 分)2-1氨晶体中,氨分子中的每个 H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?n2-2 P 4S 5 是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足 8 电子,S 的氧化数为-2。
第31届中国化学奥林匹克竞赛(决赛)实验试题

第31届中国化学奥林匹克(决赛)实验试题CCHD2017年11月126日深圳实验指南:请在实物开始前仔细阅读实验试题和实验报告的内容。
1.实验时间:09.30-14.00.迟到超过30分钟不得进入实验室。
开考后1小时内不得离开实验室。
2.开始实验前,必须在实验报告每业的页眉写上座位号,3.实验试题和实验报告均已分别装订成府,不得拆开,4.不得带任何纸张进入实验室。
附草稿纸1张。
收回但不作为评判依据。
5.禁止在实验室内饮食。
6实验全程须穿无任有标记的实验服,佩戴防护眼镜。
过肩长发须束起或戴防护帽盖住。
若不佩戴防护康镜进行实验。
将予以警告,若再次犯规,将失去参你资格。
7.实验考试期间严禁交谈,若要离开实验室须经监与老师同意,由专人引导去、回。
8.天平宽更离实验室较远,称量物品途中务必小心。
9.务仍将废弃物例入指定的回收容器中。
10严格遵守实验安全操作规测。
一旦发生安全事故。
须立即报告监考老师。
因个人操作错误而引起安全事故者,需按规定扣分(见“特别提示”③).11.若因个人原因导政合成实验失败,可自行决定是重做,若重做,需按评分标准扣除相应分值(参见“特别提示”⑨)12.若因他人原因导致合成实验失败,允许重做,且不扣除索要新试剂、原料、器材及损杯器材分数,并重新计时,13.所有实验记录及问题解答一律填写在实验报告的指定位置,写于其他位置无效。
若需改动原始记录,须经监考老师签名确认。
14.实验结束后,将实验试题、实验报告、合成产品和薄层层析硅胶板一并交给监考老师,记录实验完成时间,监考老师须在实验报告上签名。
营员需用油性笔在合成产品袋上写上考号。
15最后,清洗仪器,整理台面(不计入考试时间),经监考老师许可后,方可离开实验室。
由工作人员引导至食堂就餐。
实验一香草酸的合成1.实验内容香草提取物约含20种物质,主要是香草醛,4-羟基苯甲醛、香草酸和4一羟基苯甲酸。
其中香草醛是目前世界上用量最大的香精香料,它可以通过成熟的工业方法大量制备,香草酸是香草醛的氧化形式,它在食品、红酒、医药等领域有着广泛的应用。
2017年第31届中国化学奥林匹克(初赛)试题及答案(WORD版)

第31 屆中國化學奧林匹克(初賽)試題(2017 年8 月27 日9:00 ~ 12:00)●競賽時間3 小時。
遲到超過半小時者不能進考場。
開始考試後1 小時內不得離場。
時間到,把試卷(背面朝上)放在桌面上,立即起立撤離考場。
●試卷裝訂成冊,不得拆散。
所有解答必須寫在指定の方框內,不得用鉛筆填寫。
草稿紙在最後一頁。
不得持有任何其他紙張。
●姓名、報名號和所屬學校必須寫在首頁左側指定位置,寫在其他地方者按廢卷論處。
●允許使用非編程計算器以及直尺等文具。
第 1 題(10 分)根據條件書寫化學反應方程式。
1-1工業上從碳酸氫銨和鎂硼石[Mg2B2O4(OH)2]在水溶液中反應制備硼酸。
1-2從乏燃料提取鈈元素の過程中,利用亞硝酸鈉在強酸溶液中將Pu3+氧化為Pu4+。
1-3N aBH4與氯化鎳(摩爾比2:1)在水溶液中反應,可得到兩種硼化物:硼化鎳和硼酸(摩爾比1:3)。
1-4通過KMnO4和H2O2在KF-HF 介質中反應獲得化學法制F2の原料K2MnF6。
1-5磷化氫與甲醛の硫酸溶液反應,產物僅為硫酸鏻(鹽)。
第 2 題(10 分)2-1氨晶體中,氨分子中の每個H 均參與一個氫鍵の形成,N 原子鄰接幾個氫原子?1摩爾固態氨中有幾摩爾氫鍵?氨晶體融化時,固態氨下沉還是漂浮在液氨の液面上?2-2P4S5是個多面體分子,結構中の多邊形雖非平面狀,但仍符合歐拉定律,兩種原子成鍵後價層均滿足8 電子,S の氧化數為-2。
畫出該分子の結構圖(用元素符號表示原子)。
2-3水煤氣轉化反應[CO(g) + H2O(g) → H2(g) + CO2(g)]是一個重要の化工過程,已知如下鍵能(BE)數據:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反應熱,該反應低溫還是高溫有利?簡述理由。
第31届国际化学奥林匹克竞赛理论试题

‘
,
问题
,
一
若
若
,
用
处理后 完全水解得到
。
请写 出
一
的顺 序 的一来自撷氨酸一问题 和 问题
端和
端 的 氨 基 酸 分 别被 确 定 为
。
请写 出
用 如 同表
。
的顺 序
一
表
的缩 写 符号 写 出
的完全顺序
,
氮基 酸 中某 些皿要基 团 的
平 衡方 程 式
并标 出 双 硫键 的位置
护
,
基团
然 而 基 于 上 述顺序计算 出 来 的
问题
一
学
。
教
育
年第
期
每 个 双 硫键 氧 化 生 成 几 个 磺 酸 基
精氨酸
一 一
崛
一 一 一
的 不 完全水解得 到 一 系列 双 肤 和 三肤
一
一
一
。
天冬酞胺 天冬 氨酸
这 些 水 解 产 物 的 氨 基酸顺 序 可 通过 如 下 方法 确 定 端 氨 基 酸是通 过 肤 与
一
,
半脆 氨 酸
二 硝 基氟 苯
一
一‘
“ ‘
未测量
为单 位
问题
,
一
年 发生
波长
表
颜色 和 波 长 的 关 系
和 吸 收 的颜 色 补色
衰 变 能量 产 生 的 速率 为 多 少 瓦
问题
一
钾 是 牡 的衰 变 系 列 成 员 之 一 若
,
年 在
计算产 生
问题
一
,
大气 压下储藏
为单 位 的半衰期 短
第31届中国化学奥林匹克初赛试题含参考
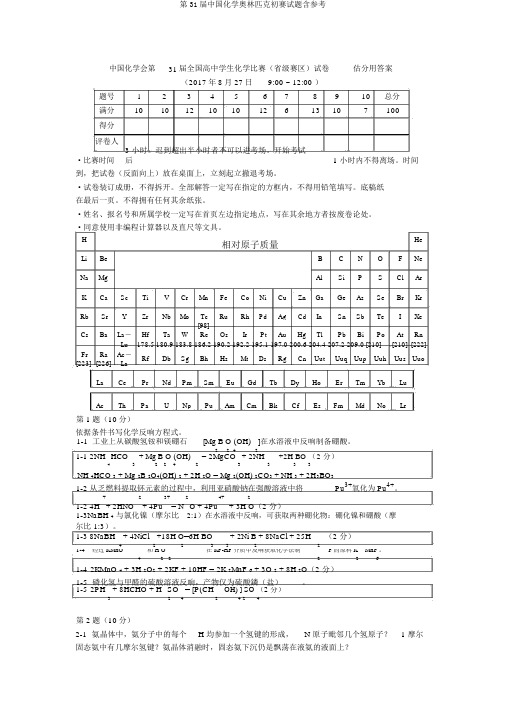
中国化学会第31 届全国高中学生化学比赛(省级赛区)试卷估分用答案(2017年8月27日9:00 ~ 12:00 )题号 1 2 3 4 5 6 7 8 9 10 总分 满分 101012101012613107100得分评卷人·比赛时间3 小时。
迟到超出半小时者不可以进考场。
开始考试后1 小时内不得离场。
时间到,把试卷(反面向上)放在桌面上,立刻起立撤退考场。
·试卷装订成册,不得拆开。
全部解答一定写在指定的方框内,不得用铅笔填写。
底稿纸在最后一页。
不得拥有任何其余纸张。
·姓名、报名号和所属学校一定写在首页左边指定地点,写在其余地方者按废卷论处。
·同意使用非编程计算器以及直尺等文具。
H相对原子质量HeLiBeB C N O F NeNaMgAlSi P S Cl ArKCa Sc Ti V Cr Mn Fe Co Ni CuZnGaGeAsSeBrKrRbSrYZrNbMoTc Ru Rh Pd Ag Cd In Sn Sb Te I Xe [98]Cs Ba La - Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At RnLu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra Ac - Rf Db Sg BhHs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo[223] [226] LaLa Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb LuAcThPaUNpPuAmCmBkCfEsFmMdNoLr第 1题(10分)依据条件书写化学反响方程式。
1-1 工业上从碳酸氢铵和镁硼石[Mg B O (OH) ]在水溶液中反响制备硼酸。
第31届中国化学奥林匹克(决赛)试题解析(一)

根据氧化还原转移电子数的关系得到金属与气体的摩尔比:
Zn ∝ H2 Al ∝ 1.5H2 Zn ∝ SO2 Cu ∝ SO2 Al ∝ 1.5SO2 根据 pV = nRT,求算 H2 和 SO2 的物质的量:
H2: n = pV/RT = 101.325 × 0.1493/(8.314 × 298.15) mol = 6.103 × 10−3 mol SO2: n = pV/RT = 101.325 × 0.4111/(8.314 × 298.15) mol = 1.680 × 10−2 mol 设在 0.1000 g 合金中,Zn、Al、Cu 的物质的量分别为 x、y、z,根据两个反应方程式和质量守
=
1.000 g
解得:
⎧ ������Zn = 4.440 × 10−3 mol
⎪ ⎨ ������Al
=
1.109 × 10−3 mol
⎪ ⎩ ������Cu
=
1.070 × 10−2 mol
所以 Zn、Al、Cu 的质量分数分别为:
wZn = MZn × x/1.000 g = 29.02% wAl = MAl × y/1.000 g = 2.992% wCu = MCu × z/1.000 g = 68.00% 1-2 主要考查方程式书写,Cu 的元素性质,以及对体系概念的理解。注意体系酸碱性对于生成
收稿:2018-02-06;录用:2018-02-08 *通讯作者,Email: ctw@
80
大学化学
Vol.33
化率。并对此作出解释。
分析与解答
1-1 主要考查 Cu、Al、Zn 三种金属元素单质的性质以及相关计算。Al、Zn 为相对较活泼的金
属,与稀硫酸作用可释放出 H2,Cu 则不发生此反应。而将稀硫酸换成热浓硫酸时,合金全部溶解, 释放的气体(还原产物)变为 SO2。注意热浓硫酸不会使 Al 钝化。
2017年全国高中学生化学竞赛(决赛)理论试题、参考答案、详细解析

第31届中国化学奥林匹克(决赛)试题第1题(11分)1-1 1.000 g铝黄铜合金(设只含有铜、锌、铝)与0.100 moldm-3硫酸反应,在25 °C和101.325 kPa下测得放出的气体的体积为149.3 cm3,将相同质量的该合金溶于足量热浓硫酸,在相同温度和压强下测得放出的气体的提交为411.1 cm3,计算此铝黄铜合金中各组分的质量分数。
主要考察基本的计算和硫酸的酸性和氧化性。
铜不能和常温下的硫酸反应,所以第一步只有Zn和Al被H+ 氧化成Zn2+和Al3+;当硫酸温度提高浓度加大时,SO42-具有氧化性,可将Cu,Al和Zn全部氧化到最高价态,自身被还原成SO2。
计算的具体步骤很简单,如下:由已知三种组分的总质量为1.000 g,即M(Cu)n(Cu)+ M(Al)n(Al)+ M(Zn)n(Zn)= m(总)(1)合金与0.100 mol/L 的硫酸在低温下反应的方程式如下:Zn + 2 H+→ Zn2+ + H2 (g)2 Al + 6 H+→ 2 Al3+ +3 H2 (g)放出气体H2 149.3 cm3,由pV = nRTn(H2)= pV(H2) /RT(2)由上述方程式知n(Zn)+ 3/2 n(Al)= n(H2)(3)合金与0.100 mol/L 的浓硫酸在高温下反应的方程式如下:Zn + 2 H2SO4 (浓) → ZnSO4 + SO2 (g) + 2 H2O2 Al + 6 H2SO4 (浓) → Al2(SO4)3 + 3 SO2 (g) + 6 H2OCu + 2 H2SO4 (浓) → CuSO4 + SO2 (g) + 2 H2O放出气体SO2 411.1 cm3,由pV=nRTn(SO2)= pV(SO2)/RT(4)由上述方程式知:n(Zn)+ 3/2 n(Al)+ n (Cu) = n(SO2)(5)由已知M(Cu)= 63.55 g/mol,M(Al)= 26.98 g/mol,M(Zn)= 65.38 g/molR = 8.31441 J/K mol,T = 25 + 273.15 = 298.15 K,p = 101.325 kPaV(H2) = 149.3 cm3,V(SO2) = 411.1 cm3,m(总)= 1.000 g联立(1)、(2)、(3)、(4)、(5)可得n(Cu)= 1.070 ×10-2n(Al)= 1.112 ×10-3n(Zn)= 4.434 ×10-3w%(Cu)= m(Cu)n(Cu)/m(总)= 68.0%w%(Al)= m(Al)n(Al)/m(总)= 3.0%w%(Zn)= m(Zn)n(Zn)/m(总)= 29.0%1-2 向[Cu(NH3)4]SO4水溶液中通入SO2气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。
第31届中国化学奥林匹克(决赛)理论试题及答案(精品范文).doc

【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】 【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理ቤተ መጻሕፍቲ ባይዱ下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
【最新整理,下载后即可编辑】
最新第31届中国化学奥林匹克(初赛)试题及答案(WORD版)

C 12.01
N 14.01
O 16.00
F 19.00
Ne 20.18
Na 22.99
Mg 24.31
Al 26.98
Si 28.09
P 30.97
S 32.07
Cl 35.45
Ar 39.95
K 39.10
Ca 40.08
Sc 44.96
Ti 47.88
V 50.94
Cr 52.00
Ru 101.1
Rh 102.9
Pd 106.4
Ag 107.9
Cd 112.4
In 114.8
Sn 118.7
Sb 121.8
Te 127.6
I 126.9
Xe 131.3
Cs 132.9
Ba 137.3
La-
Lu
Hf 178.5
Ta 180.9
W 183.8
Re 186.2
Os 190.2
Ir 192.2
Uuo
La
Ce
Pr
Nd
世界上的每一个国家和民族都有自己的饰品文化,将这些饰品汇集到一起再进行新的组合,便可以无穷繁衍下去,满足每一个人不同的个性需求。Pm
一、消费者分析Sm
Eu
Gd
Tb
2、传统文化对大学生饰品消费的影响Dy
Ho
营销环境信息收集索引Er
(四)大学生对手工艺制品消费的要求Tm
Yb
Lu
Ac
Pt 195.1
Au 197.0
Hg 200.6
Tl 204.4
Pb 207.2
Bi 209.0
Po[210]
At [210]
Rn [222]
第31届中国化学奥林匹克(初赛)试题及答案(WORD版)精编版

第31 届中国化学奥林匹克(初赛)试题(2017 年8 月27 日9:00 ~ 12:00)●时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第1根据条件书写化学反应方程式。
1-1工业上从碳酸氢铵和镁硼石[Mg2B2O4(OH)2]在水溶液中反应制备硼酸。
1-2从乏燃料提取钚元素的过程中,利用亚硝酸钠在强酸溶液中将Pu3+氧化为Pu4+。
1-3N aBH4与氯化镍(摩尔比2:1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比1:3)。
1-4通过KMnO4和H2O2在KF-HF 介质中反应获得化学法制F2的原料K2MnF6。
1-5磷化氢与甲醛的硫酸溶液反应,产物仅为硫酸鏻(盐)。
第2 题(10 分)2-1氨晶体中,氨分子中的每个H 均参与一个氢键的形成,N 原子邻接几个氢原子?1 摩尔固态氨中有几摩尔氢键?氨晶体融化时,固态氨下沉还是漂浮在液氨的液面上?2-2P4S5是个多面体分子,结构中的多边形虽非平面状,但仍符合欧拉定律,两种原子成键后价层均满足8 电子,S 的氧化数为-2。
画出该分子的结构图(用元素符号表示原子)。
2-3水煤气转化反应[CO(g) + H2O(g) → H2(g) + CO2(g)]是一个重要的化工过程,已知如下键能(BE)数据:BE(C≡O) =1072 kJ·mol-1,BE(O-H) = 463 kJ·mol-1,BE(C=O) = 799 kJ·mol-1,BE(H-H) = 436 kJ·mol-1估算反应热,该反应低温还是高温有利?简述理由。
2-4硫粉和S2-反应可以生成多硫离子。
在10 mL S2-溶液中加入0.080 g 硫粉,控制条件使硫粉完全反应。
第31届国际化学奥林匹克竞赛理论试题

科目 化学 年级 高三文件 aosai004.doc 考试类型 奥赛 考试时间 1999 关键词 化学竞赛标题 第31届国际化学奥林匹克竞赛理论试题 内容第一题化合物Q (摩尔质量 122.0 g mol -1) 含碳、氢、氧。
A 分题CO 2(g) 和 H 2O(l) 在 25.00 o C 的标准生成焓分别为 –393.51和–285.83kJ ·mol -1。
气体常数R 为 8.314 J ·K -1·mol -1。
(原子量: H = 1.0, C = 12.0, O = 16.0)质量为0.6000g 的固体Q 在氧弹量热计内充分燃烧,在25.000o C 下开始反应, 此时量热计内含水710.0 g 。
反应完成后温度上升至27.250 o C, 反应生成1.5144 g CO 2 (g) 和 0.2656 g H 2O(l)。
问题1-1 确定Q 的分子式,并写出Q 燃烧反应的配平的化学方程式(标明物质状 态)。
问题1-2 若水的比热为4.184 J ·g -1·K -1,反应内能变化(∆U o )为–3079kJ ·mol -1,请计算量热计的热容(不包括水)。
问题1-3 计算Q 的标准生成焓(H f o )。
B 分题在6o C 时Q 在苯和水中的分配情况见下表,表中C B 和C w 分别表示Q 在苯和水中的平衡。
假定Q 在苯中的物种是唯一的,并与浓度与温度无关。
问题1-4 假定Q 在水中是单体,通过计算说明Q 在苯中是单体还是双聚体。
问题1-5 理想稀溶液的凝固点表达式如下:fs 20f f 0f Δ.)(H X T R T T =- 其中T f 是溶液的凝固点, T f 0是溶剂的凝固点, ∆H f 是溶剂的熔化热, X S 是溶质的摩尔分数,苯的摩尔质量为78.0 g mol -1。
纯苯在1大气压下的凝固点为5.40 o C ,苯的熔化热为9.89 kJ mol-1。
