《中国药典》2015年版勘误表
2015年版药典勘误(第二次)
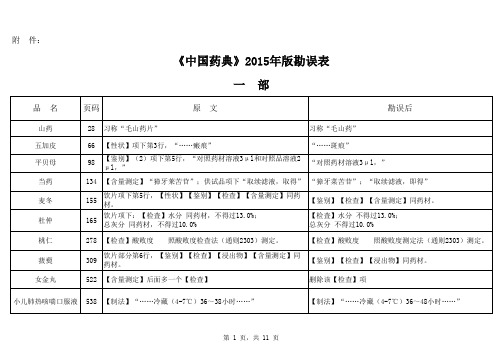
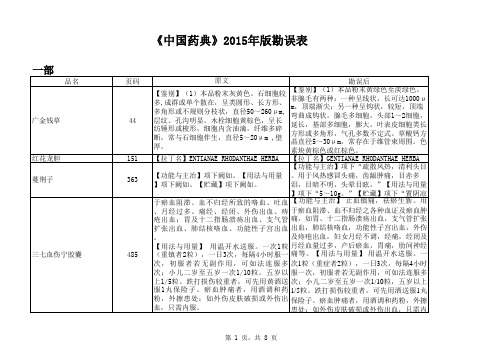
附 件:《中国药典》2015年版勘误表一 部二 部雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部四 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……465【折光率】本品的折光率(通则0621)……【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
《中国药典》2015年版勘误表.xls
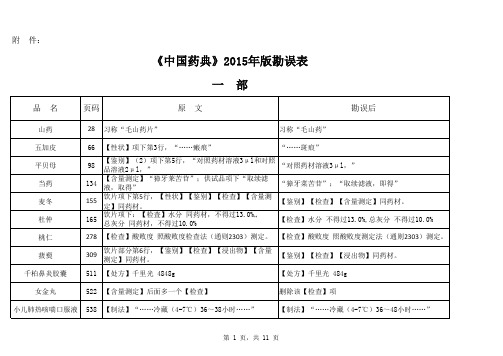
附 件:《中国药典》2015年版勘误表一 部二 部蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲氧基…….附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)-8-甲氧基…….雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446四 部第 11 页,共 11 页。
《中国药典》2015年版中药材增修订内容
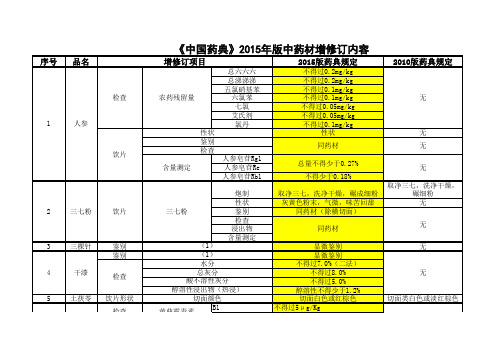
取净大黄片,照炒炭法 炒至表面焦黑色,内部 焦褐色
10 11 12
山银花 山楂 千金子
13
川木香 饮片
煨川木香
无
14 15 16 17 18 19 20 21
川贝母 川芎 广金钱草 女贞子 马兜铃 天仙子 天冬 天花粉
鉴别 性状 饮片 鉴别 鉴别 鉴别 鉴别 检查 饮片 检查 饮片
(2) (3) 表面颜色 表面颜色 (1) (1) (1) (1) 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 (1)
鉴别 22 天竺黄
(2) (3)
检查 性状 鉴别 检查 23 天麻 浸出物 含量测定 饮片
体积比 表面颜色 (3) 二氧化硫残留量 醇溶性浸出物 天麻素 对羟基苯甲醇 性状
贝母素乙及贝母辛 无 表面黄褐色 外表皮黄褐色 无 无 无 无 无 无 无 无 (1)溶媒为盐酸与硝酸 (1)溶媒为醋酸2滴,显色剂一滴 的等混合液,显色剂无 变化 (2)显色反应 (2)显示反应 增加天竺黄为对照药材的薄层色谱 无 鉴别 体积比:中粉10g。轻轻 中粉10g,轻轻装入量筒,体积比 装入量筒,体积比不得 不得少于24ml 少于35ml 黄白色至黄棕色 黄白色至淡黄棕色 增加对羟基苯甲醇为对照品的薄层 无 色谱鉴别 不得过400mg/Kg 无 不得少于10%,溶媒为乙 不得少于15.0%,溶媒为稀乙醇 醇 不得少于0.20% 总量不得少于0.25% 无 淡黄色至黄棕色 淡黄色至淡黄棕色
《中国药典》2015年版中药材增修订内容
序号 品名 增修订项目
总六六六 总涕涕涕 五氯硝基苯 六氯苯 七氯 艾氏剂 氯丹 性状 鉴别 检查 含量测定 人参皂苷Rg1 人参皂苷Re 人参皂苷Rb1 炮制 性状 鉴别 检查 浸出物 含量测定
2015年版《中国药典》药用辅料标准有关问题的答复意见

附件:2015年版《中国药典》药用辅料标准有关问题的答复意见品种反馈问题答复意见聚山梨酯80(供注射用)【脂肪酸组成】项下对照品溶液浓度为每1ml中各含0.01mg的溶液(2015年版《中国药典》勘误第二批)认为该浓度下进样的对照品峰面积过小。
脂肪酸组成按面积归一化法计算,对照品仅仅作为定位用。
乳糖【性状】描述中白色的结晶性颗粒或粉末的理解问题。
【溶液的澄清度与颜色】溶液应澄清无色(不超过0.5号浊度标准液的浊度)。
认为标准过于严格,建议修订浊度限度为:与1号浊度液对比,不得深于对照。
【含量测定】项下以乙腈-水(70:30)为流动相基线不稳,建议以乙腈-水(61:39)为流动相。
加水溶解并稀释制成每1ml各含1mg的溶液响应值太低,导致积分不准确,重现性不好,系统适应性RSD不符合要求。
系统适用性试验理论板数以乳糖峰计算低于5000,达不到要求,建议修订为不低于4000。
1.对性状正确的理解应为:白色的结晶性颗粒,或者白色粉末。
2.乳糖作为注射剂的冻干保护剂使用,为保证药品的安全,药典标准应严格。
3.含量测定项下以乙腈-水(70:30)为流动相基线可以稳定。
每1ml各含1mg的溶液浓度合适,系统适应性RSD可以符合要求。
由于示差折光检测器需要较长时间稳定,建议增加稳定时间。
乳糖峰理论塔板数可以达到要求。
硬脂酸镁【镉盐】【镍盐】两个检测项目,照原子吸收分光光度法(通则0406第二法)测定,均未规定具体的原子化方法,建议两个检测项目标准中均加注“以石墨炉为原子化器,照原子吸收分光光度法(通则0406第二法)测定。
按照本版药典通则0406原子吸收分光光度法的规定,采用原子吸收分光光度法进行的检验,通常不指定原子化器。
检验人员应根据所测元素、仪器性能及工作经验选择相应的原子化器,即使选用了火焰原子化器,可根据被测元素及仪器性能改变燃气和助燃气的种类及比例控制火焰温度,以获得较好的火焰稳定性和测定灵敏度。
《中国药典》2015一部中药材部分Word版91-258页

中国药典2015年版石榴皮• 91 •【检查】水分不得过13.0%(通则0832第二法)。
总灰分不得过6.0%。
(通则2302)。
【漫出物】照醇溶性浸出物测定法(通则2201)项下的 热浸法测定,用稀乙醇作溶剂,不得少于17.0%。
【含置测定】照髙效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶 为填充剂;以甲醇-水(68 : 32)为流动相;检测波长为334nm 。
理论板数按石吊兰素峰计算应不低于3000。
对照品溶液的制备取石吊兰素对照品适量,精密称定, 加甲醇制成每lml 含25网的溶液,即得。
供试品溶液的制备取本品中粉约〇.5g ,精密称定,置 具塞锥形瓶中,精密加人75%甲醇25ml ,密塞,称定重量,超 声处理(功率240W ,频率45kHz )20分钟,放冷,再称定重量, 用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法 '分别精密吸取对照品溶液与供试品溶液各 1(^1,注人液相色谱仪,测定,即得。
本品按干燥品计算,含石吊兰素(C 18 H 16 〇 )不得少于0.10%。
饮片【炮制】除去杂质,洗净,切段,干燥。
【性味与归经】苦,温。
归肺经。
【功能与主治】化痰止咳,软坚散结。
用于咳嗽痰多,瘰 疬痰核。
【用法与用置】9〜15g 。
外用适量,捣敷或煎水外洗。
【贮藏】置干燥处。
石决明ShijuemingHALIOTIDIS CONCHA本品为鲍科动物杂色鲍Haliotis diversicolor Reeve 、皱 纹盘鲍 Haliotis discus hannai Ino 、羊鲍 Haliotis ovina Gmelin 、澳洲鲍 Haliotis (Leach)、耳鲍 Haliotis asinina Linnaeus 或白鲍 Haliotis Zaen*贫 (Donovan)的贝壳。
夏、 秋二季捕捞,去肉,洗净,干燥。
《中国药典》2015年版勘误表
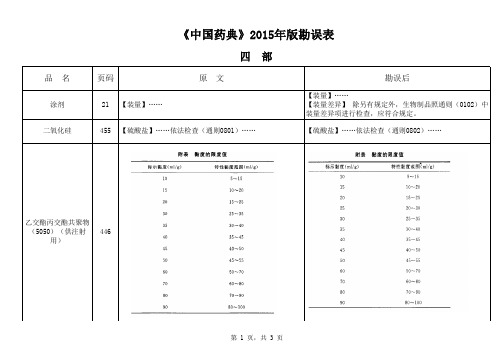
品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……《中国药典》2015年版勘误表四 部乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,......【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量, (465)【折光率】本品的折光率(通则0621)......【折光率】本品的折光率(通则0622) (466)【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 、200μg的混合溶液,......【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 的混合溶液, (469)【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……正丁醇489【相对密度】 本品的相对密度(通则0612)……【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
2015年版《中国药典》中有关问题的探讨

2015年版《中国药典》中有关问题的探讨
2015年版《中国药典》中有关问题的探讨
________________________________
2015年版《中国药典》是我国药典编纂和修订的重要一环,它不仅收录了药物本身的各种性质,而且还收录了一些与药物有关的问题。
在本文中,我们将从三个方面对2015年版《中国药典》中有关问题的探讨进行详细的分析。
#### 一、药物名称
2015年版《中国药典》对药物名称的规定是,在列入药典中的药物,应当有一个完整的、可靠的名称,以便消费者和消费者可以更加清楚地了解该药物。
同时,药物名称中不得出现不正确、模糊或引人误解的词语,以及不符合国家相关法律法规的词语。
#### 二、使用方法
2015年版《中国药典》还规定了对于使用方法有关的问题,即使用该药物时,应当遵循科学的使用方法,如选择合适的用法、用量、剂量、用药时间等,避免不必要的危害,以及不当或者错误的使用方法。
#### 三、成分含量
2015年版《中国药典》还对于成分含量有着明确的规定,即所收录的药物中,必须列明该药物中各成分的含量,以便消费者了解该药物的成分,避免使用不当。
总之,2015年版《中国药典》中有关问题的探讨,主要围绕着三个方面进行:一是药物名称;二是使用方法;三是成分含量。
这些内容都是为了保障消费者的权益,使其在使用过程中受到最小的伤害。
《中国药典》2015年版勘误表
《中国药典》2015年版勘误表
大豆磷脂(供注射用)469【微生物限度】取本品,……每1g供试品
中除细菌、霉菌及酵母菌数不得过
100cfu,……
【微生物限度】取本品,……每1g供试品中
除需氧菌总数、霉菌及酵母菌数不得过
100cfu,……
油酸钠528【微生物限度】……,再用预热至45℃的
无菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗
液冲洗二次,每次100ml,取膜,贴膜培养
检查细菌数;……
【微生物限度】……,再用预热至45℃的无
菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗液冲
洗二次,每次100ml,取膜,贴膜培养检查
需养菌总数;……
粉状纤维素551
续表续表
硅化微晶纤维素559【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入钼酸32ml与水
40ml的混合溶液中,……)2ml,……
【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入硝酸32ml与水
40ml的混合溶液中,……)2ml,……
微晶纤维素605
续表
聚山梨酯80(供注射用)625【脂肪酸组成】……。
分别取肉豆蔻酸甲
酯、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸
甲酯、亚油酸甲酯、亚麻酸甲酯以及油酸
甲酯对照品适量,加正庚烷溶解并制成每
1ml中各含0.1g的溶液,……
【脂肪酸组成】……。
分别取肉豆蔻酸甲酯
、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸甲酯
、亚油酸甲酯、亚麻酸甲酯以及油酸甲酯对
照品适量,加正庚烷溶解并制成每1ml中各
含0.01mg的溶液,……。
2015年版《中国药典》药材修订内容汇总.

鉴别(1)
照黄曲霉毒素测定法(通则2351)测定。 33-麦芽 检查-黄曲 本品每1000g含黄曲霉毒素B1不得过5μ g,黄曲霉 霉毒素 毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉 毒素B1总量不得过10μ g。 饮片-检查 -黄曲霉毒 同本品每1000g含黄曲霉毒素B1不得过5μ g,黄曲霉 霉毒素 毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉 34-远志 毒素B1总量不得过10μ g。 饮片-检查 同药材。 -黄曲霉毒 本品粉末灰棕色至棕色。种皮表皮细胞淡黄色, 表面观呈长条形,常与下皮细胞上下层垂直排列 。下皮细胞含棕色或红棕色物。色素层细胞多皱 纹,内含深红棕色物。油细胞类圆形或长圆形, 54-豆蔻 鉴别(1) 含黄绿色油滴。内种皮厚壁细胞黄棕色、红棕色 或深棕色,表面观多角形,壁厚,胞腔内含硅质 块;断面观为1列栅状细胞。外胚乳细胞类长方形 或不规则形,充满细小淀粉粒集结成的淀粉团, 有的含细小草酸钙方晶。 特征图谱 37-羌活 饮片 略 ……体轻,质脆。香气,味微苦而辛。 【鉴别】【检查】【特征图谱】【浸出物】【含 量测定】同药材。
23-山楂
性状 47-川芎
饮片
取本品粉末1g,加乙醇5ml,超声处理15分钟,离 心,取上清液作为供试品溶液。另取丹参对照药 材1g,同法制成对照药材溶液。再取丹参酮ⅡA对 照品、丹酚酸B 对照品,加乙醇制成每1ml分别含 0.5mg 和1.5mg的混合溶液,作为对照品溶液。照 薄层色谱法(通则0502)试验,吸取上述三种溶液 各5μ l,分别点于同一硅胶G薄层板上,使成条 鉴别(2) 状,以三氯甲烷-甲苯-乙酸乙酯-甲醇-甲酸(6 : 4 : 8 : 1 : 4 ) 为展开剂,展开,展至约4cm, 取出,晾干,再以石油醚(60〜90°C)-乙酸乙酯 24-丹参 (4 : 1)为展开剂,展开,展至约8cm,取出,晾 干,分别在日光及紫外光(365nm)下检视。供试 品色谱中,在与对照药材色谱和对照品色谱相应 的位置上,显相同颜色的斑点或荧光斑点。
中药分析——2015版《中国药典》一部修订情况解读

本品每1000g含黄曲霉毒素不得过5μg,黄曲霉毒
素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1
总量不得过10μg。
第二十三页,共50页。
一、安全性控制项目大幅提升
(五)操作人员安全控制 主要针对中药鉴别展开剂中含苯的修订
为建立绿色标准,对67个中成药标准鉴别项薄层 色谱检测中使用的展开剂进行了研究,主要涉及展开 剂中含有苯的品种。
第四页,共50页。
2015版《中国药典》主要变化
主要变化包括以下七个方面:
(一)收载品种大幅增加 (二)药典标准更加系统化、规范化 (三)健全了药品标准体系 (四)附录(通则)、辅料独立成卷 —— 四部 (五)药用辅料品种收载数量显著增加,标准水平
明显提高 (六)安全性控制项目大幅提升
(七)进一步加强有效性控制
气质联用 —— 测定74种农药残留 液质联用 —— 测定153种农药残留
第二十页,共50页。
一、安全性控制项目大幅提升
(三)农药残留的检测要求
人参、西洋参2个品种项下增加了16种有机氯农药 残留限度检查要求,规定:
含总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC) 之和不得过0.2mg/kg;总滴滴涕(pp'-DDE、pp'-DDD、
(一)根据中医药特点,控制与功效相关的药味 或成分 根据中药材特别是中药制剂的功效,加强
控制与功效相关的药味或成分,使得质量标准
更好地体现中医药特色,从有效性方面更好地 控制药品质量。
第二十六页,共50页。
二、进一步加强有效性质量控制
(一)根据中医药特点,控制与功效相关的药味或成分
功能与主治:
清热燥湿,杀虫止痒。
2015版《中国药典》纠错集锦(一)

2015版《中国药典》纠错集锦(一)汇总:北重楼1.2015版药典一部保和丸纠错(论坛ID:海纳百川369 )2015版药典一部,保和丸(水丸)的标准中,(性状)项下是“大蜜丸”/thread-283108-1-1.html2.白色念珠菌液制备条件疑似错误(论坛ID:红茶)1101 无菌检查法1105非无菌产品微生物限度检查四部,1101,无菌检查法,137页,写着是20-25℃下培养24-48小时。
而1105,非无菌产品微生物限度检查:微生物计数法,141页,写着的是20-25℃下培养2-3天。
这里不明白到底是写错了,还是两种方法下,制备时间的确有区别?2010版下,时间是一样的,当然培养基换掉了。
/thread-283109-1-1.html3.黑曲霉菌液制备疑似有问题(论坛ID:红茶)1101,无菌检查法1105,非无菌产品微生物限度检查:微生物计数法四部,1101,无菌检查法,137页,黑曲霉菌液的制备使用的是沙氏葡萄糖琼脂斜面培养基。
而1105,非无菌产品微生物限度检查:微生物计数法,141页,写着的是多了一种培养基:马铃薯葡萄糖琼脂培养基。
这里是不是也有潜在的错误,或者的确是有实际意义上的区别?马铃薯葡萄糖琼脂培养基到底能不能用于无菌检查法中的菌液制备?如果不能,两种培养基究竟有什么区别?如果有,那逻辑上推导出,1105里,沙氏葡萄糖琼脂和马铃薯葡萄糖琼脂培养基也产生某些区别咯?这种“区别”在1105微生物限度计数法里面则无影响,但到了1101就不可接受了?PS: 如果的确没有错误的,出于工作效率和节约的成本的角度来说,我会只选择沙氏葡萄糖琼脂斜面培养基,这样两边都能用,而且只用制备一次,还不用担心做实验的时候拿错菌液。
/thread-283111-1-1.html4.一部药典的通窍鼻炎颗粒(论坛ID:红花鼠尾草 )检查应符合胶囊剂项下有关的各项规定。
增补本就错了,这次还是错了/thread-283071-1-1.html5.2015版药典一部中:这个应该不是“毛山药片”,而是“毛山药”吧?(论坛ID:孙药师 )如题,应该是明显的文字输入错误。
中药分析——2015版《中国药典》一部修订情况解读

2015版《中国药典》一部修订情况解读朱晓静第一部分2015版《中国药典》概况根据国家食品药品监督管理总局2015年第67号令,《中华人民共和国药典》2015年版于2015年12月1日起实施。
作为从事药品领域的相关人员,有必要对2015版《中国药典》的修订情况进行深入了解,以便更好地实施药典相关规定。
一、2015版《中国药典》修订概况《中国药典》由国家药品监督管理部门颁布,是国家为保证药品质量、保证人民用药安全有效、质量可控而制定的药品法典。
《中国药典》对于保证药品质量,维护和保障公众身体健康及用药的合法权益,促进我国医药产业健康发展,具有十分重要的作用。
中国药典是药品行业的最重要的文件之一,其修订一直备受瞩目。
2015版《中国药典》是继我国1953年第一版药典以来的第十版药典。
2015版药典共分为四部出版,其中一部为中药;二部为化学药;三部为生物制药;四部为药典通则、药用辅料。
药典委员会副主任委员、国家食品药品监管总局吴浈副局长指出,2015年版药典无论是在药典品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
二、2015版《中国药典》的主要变化2015版《中国药典》的主要变化包括以下七个方面。
(一)收载品种大幅增加2015版药典收载品种5924个,与2010版药典相比新增品种1125个,修订品种1201个。
新版药典收录药品数量达5608个,比2010年版药典新增1082个,覆盖基本药物目录和医疗保险目录的大部分品种,更加适应临床用药。
(二)药典标准更加系统化、规范化通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
(三)健全了药品标准体系药用辅料品种增加至270个,新增相关指导原则;标准物质新增相关通则和指导原则;药包材新增相关指导原则;在归纳、验证和规范的基础上实现了《中国药典》各部共性检测方法的协调统一。
2015年版药典查阅与使用

查阅项目
药典中位置
查阅结果
几部
哪部分
页数
例1:
氢化可的松的鉴别
二
正文品种第一部分
765
四项:
1.化学鉴别:显黄色
2.化学鉴别:显黄色至红色、绿色荧光、少量絮状沉淀
3.色谱鉴别:HPLC法,供试品主峰应与对照品主峰保留时间一致。
4.光谱鉴别:红外光谱法,与光谱集283图一致。
2
乳糖的性状
四
正文品种八画
三
预防类
158
应小于10EU/ml (通则1143凝胶限度试验)。
19
巴豆的功能与主治
一
药材和饮片四画
80
外用蚀疮。用于恶疮疥癣,疣痣。
20
蛋白质含量测定法
二
含量测定法0731
通则50
共有六法:
(1)凯氏定氮法(2)福林酚法(Lowry法)(3)双缩脲法(4) 2,2'-联喹啉-4,4'-二羧酸法(BCA法)(5)马斯亮蓝法(Bradford法) (6)紫外-可见分光光度法•
3
硫酸盐检查
四
通则目次第八部分
99
1.除另有规定外,取各品种项下规定量的供试品,加水溶解使成约40ml(溶液如显碱性,可滴加盐酸使成中性);溶液如不澄清,应滤过;置50ml纳氏比色管中,加稀盐酸2 m l,摇匀,即得供试品溶液。另取该品种项下规定量的标准硫酸钾溶液置50ml纳氏比色管中,加水使成约40ml,加稀盐酸2ml,摇匀,即得对照溶液。于供试品溶液与对照溶液中,分别加人25%氣化钡溶液5ml,用水稀释至50ml,充分摇匀,放置10分钟,同置黑色背景上,从比色管上方向下观察、比较,即得。
524
1.本品为白色的结晶性颗粒或粉末;无臭,味微甜。
《中国药典》2015年版勘误表
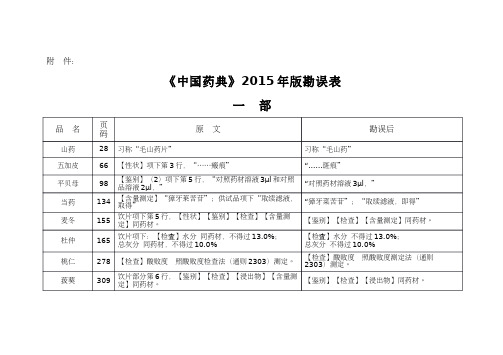
功劳去火片
756
心悦胶囊
720
【功能与主治】项下:“……利血……”
【功能与主治】项下:“……和血……”
二
品 名 页 码
399 至“米力农注射液”标准最后 【贮藏】 密封,置阴凉干燥处保存。 【贮藏】 遮光,密闭保存 【含量测定】取本品 20 片,……,置 25ml 量瓶中 英文名:Galantamine Hydrobromide Tablets 附:杂质Ⅱ 分子量:385.34 【含量限度】“……107.0%,含氯化钠(NaCl)应为 标示量的 95.0%~105.0%”
天麻丸
592
【鉴别】(2)“……或取小蜜丸或大蜜丸 【鉴别】(2)“……或取小蜜丸或大蜜丸 5g……” 8g……” 【含量测定】“……水蜜丸每 1g 不得少于 0.2mg;大蜜 【含量测定】“……水蜜丸每 1g 不得少于 丸每丸不得少于 1.2mg。” 0.2mg;小蜜丸每 1g 不得少于 0.13mg;大蜜 丸每丸不得少于 1.2mg。” 【性状】项下:本品为浅黄色澄明液体。 【鉴别】(2)项下:“……供试品色谱中,在与对照品 色谱相应的位置上,显相同颜色的荧光斑点。” 【制法】项下:“…炒僵蚕,丹参各半量…”, 【用法与用量】“小蜜丸一次 6g,水蜜丸一次 4g,水丸 一次 3g...” 【规格】(4)水蜜丸每 100 丸重 10g,或每袋装 4g 【鉴别】(2)项下:“…...吸取上述供试品溶液 3μl、 对照药材溶液及对照品溶液三种溶液各 1μl,…...” 【性状】项下:本品为浅黄棕色澄明液体。 【鉴别】(2)项下:“……供试品色谱中,在 与对照药材和对照品色谱相应的位置上,显相同 颜色的荧光斑点。” 【制法】项下:“...炒僵蚕以及丹参 50g...” 【用法与用量】“小蜜丸一次 6g,水丸一次 3g...” 删除【规格】(4) 【鉴别】(2)项下:“…...吸取上述供试品溶 液 3μl、对照药材溶液及对照品溶液各 1μl, …...”
2015版《药典》中药材标准的变化情况
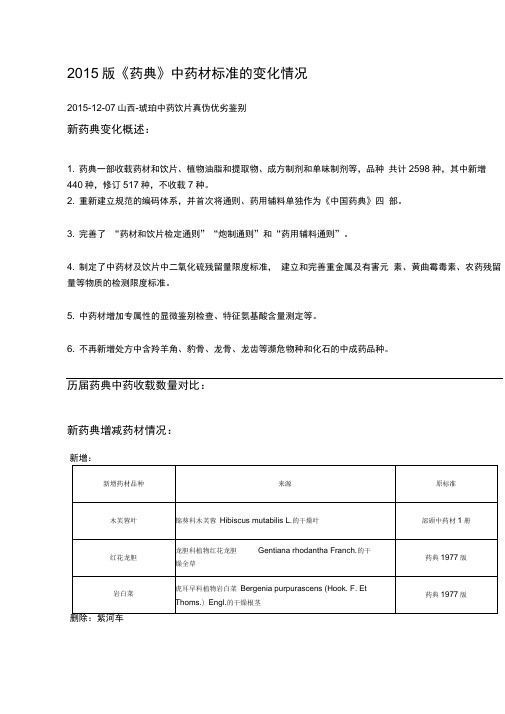
2015版《药典》中药材标准的变化情况2015-12-07山西-琥珀中药饮片真伪优劣鉴别新药典变化概述:1. 药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2. 重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3. 完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4. 制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5. 中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6. 不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
历届药典中药收载数量对比:新药典增减药材情况:新增:新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、稀莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量«总六六六(a -BHC、3 -BHC、丫-BHC、S -BHC 之和)不得过0.2mg/kg ;*总滴滴涕(pp〔DDE、pp〔DDD op〔DDT、pp-DDT 之和)不得过0.2mg/kg ;*五氯硝基苯不得过0.1mg/kg ;«六氯苯不得过0.1mg/kg ;«七氯(七氯、环氧七氯之和)不得过0.05mg/kg ;*艾氏剂不得过0.05mg/kg ;*氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
《中国药典》2015年版勘误表3
第 281 页
第 282 页
第 283 页
第 284 页
第 285 页
第 286 页
第 287 页
第 288 页
第 289 页
第 290 页
第 291 页
第 292 页
第 293 页
第 294 页
第 295 页
第 296 页
第 297 页
第 298 页
第 299 页
第 319 页
第 320 页
第 321 页
第 322 页
第 323 页
第 324 页
第 325 页
第 326 页
第 327 页
第 328 页
第 329 页
第 330 页
第 331 页
第 332 页
第 333 页
第 334 页
第 335 页
第 336 页
第 337 页
第 376 页
第 377 页
第 378 页
第 379 页
第 380 页
第 381 页
第 382 页
第 383 页
第 384 页
第 385 页
第 386 页
第 387 页
第 388 页
第 389 页
第 390 页
第 391 页
第 392 页
第 393 页
第 394 页
第 45 页
第 46 页
第 47 页
第 48 页
第 49 页
第 50 页
第 51 页
第 52 页
第 53 页
第 54 页
第 55 页
第 56 页
第 57 页
第 58 页
第 59 页
第 60 页
2015年版《中国药典》药用辅料标准有关问题的答复意见

附件:2015年版《中国药典》药用辅料标准有关问题的答复意见品种反馈问题答复意见聚山梨酯80(供注射用)【脂肪酸组成】项下对照品溶液浓度为每1ml中各含0.01mg的溶液(2015年版《中国药典》勘误第二批)认为该浓度下进样的对照品峰面积过小。
脂肪酸组成按面积归一化法计算,对照品仅仅作为定位用。
乳糖【性状】描述中白色的结晶性颗粒或粉末的理解问题。
【溶液的澄清度与颜色】溶液应澄清无色(不超过0.5号浊度标准液的浊度)。
认为标准过于严格,建议修订浊度限度为:与1号浊度液对比,不得深于对照。
【含量测定】项下以乙腈-水(70:30)为流动相基线不稳,建议以乙腈-水(61:39)为流动相。
加水溶解并稀释制成每1ml各含1mg的溶液响应值太低,导致积分不准确,重现性不好,系统适应性RSD不符合要求。
系统适用性试验理论板数以乳糖峰计算低于5000,达不到要求,建议修订为不低于4000。
1.对性状正确的理解应为:白色的结晶性颗粒,或者白色粉末。
2.乳糖作为注射剂的冻干保护剂使用,为保证药品的安全,药典标准应严格。
3.含量测定项下以乙腈-水(70:30)为流动相基线可以稳定。
每1ml各含1mg的溶液浓度合适,系统适应性RSD可以符合要求。
由于示差折光检测器需要较长时间稳定,建议增加稳定时间。
乳糖峰理论塔板数可以达到要求。
硬脂酸镁【镉盐】【镍盐】两个检测项目,照原子吸收分光光度法(通则0406第二法)测定,均未规定具体的原子化方法,建议两个检测项目标准中均加注“以石墨炉为原子化器,照原子吸收分光光度法(通则0406第二法)测定。
按照本版药典通则0406原子吸收分光光度法的规定,采用原子吸收分光光度法进行的检验,通常不指定原子化器。
检验人员应根据所测元素、仪器性能及工作经验选择相应的原子化器,即使选用了火焰原子化器,可根据被测元素及仪器性能改变燃气和助燃气的种类及比例控制火焰温度,以获得较好的火焰稳定性和测定灵敏度。
中国药典》2015年版通则目录及增修订内容

《中国药典》2015年版通则目录及增修订内容 0100 制剂通则 0101 片剂 0102 注射剂 0103 胶囊剂 0104 颗粒剂 0105 眼用制剂 0106 鼻用制剂 0107 栓剂 0108 软膏剂 0109 乳膏剂 0110 糊剂 0111 吸入制剂 0112 喷雾剂 0113 气雾剂 0114 凝胶剂 0115 散剂 0116 滴丸剂 0117 糖丸 0118 糖浆剂 0120 涂剂 0121 涂膜剂 0122 酊剂 0123 贴剂 0124 贴膏剂 0125 口服溶液剂口服混悬剂口服乳剂 0126 植入剂 0127 膜剂 0128 耳用制剂 0129 洗剂 0130 冲洗剂 0131 灌肠剂 0181 丸剂 0182 合剂 0183 锭剂 0184 煎膏剂(膏滋) 0185 胶剂 0186 酒剂 0187 流浸膏剂与浸膏剂 0189 露剂 0190 茶剂 0200 其他通则 0211 药材和饮片取样法(未修订) 0212 药材和饮片检定通则(第二增补本) 0213 炮制通则(未修订) 0251 药用辅料通则 0261 制药用水 0271 药包材通则(待定) 0272 玻璃容器(待定) 0291 国家药品标准物质通则(第二增补本) 0300 0301 一般鉴别试验(第二增补本) 0400 光谱法 0401 紫外-可见分光光度法 0402 红外分光光度法 0405 荧光分光光度法 0406 原子吸收分光光度法 0407 火焰光度法 0411 电感耦合等离子体原子发射光谱法 0412 电感耦合等离子体质谱法(增订) 0421 拉曼光谱法(新增) 0431 质谱法 0441 核磁共振波谱法 0451 X射线衍射法 0500 色谱法(未修订) 0501 纸色谱法 0502 薄层色谱法 0511 柱色谱法(未修订) 0512 高效液相色谱法 0513 离子色谱法 0514 分子排阻色谱法 0521 气相色谱法 0531 超临界流体色谱法(拟新增) 0532 临界点色谱法(拟新增) 0541 电泳法 0542 毛细管电泳法 0600 物理常数测定法 0601 相对密度测定法(未修订) 0611 馏程测定法 0612 熔点测定法 0613 凝点测定法 0621 旋光度测定法 0622 折光率测定法(未修订) 0631 pH值测定法 0632 渗透压摩尔浓度测定法 0633 黏度测定法 0661 热分析法(第二增补本) 0681 制药用水电导率测定法(未修订) 0682 制药用水中总有机碳测定法(未修订) 0700 其他测定法Other Assays 0701 电位滴定法与永停滴定法(未修订) 0702 非水溶液滴定法 0703 氧瓶燃烧法(未修订) 0704 氮测定法 0711 乙醇量测定法 0712 甲氧基、乙氧基与羟丙氧基测定法(未修订) 0713 脂肪与脂肪油测定法(未修订) 0721 维生素A测定法(未修订) 0722 维生素D测定法(未修订) 0731 蛋白质含量测定法 0800 限量检查法 0801 氯化物检查法(未修订) 0802 硫酸盐检查法(未修订) 0803 硫化物检查法(未修订) 0804 硒检查法(未修订) 0805 氟检查法(未修订) 0806 氰化物检查法 0807 铁盐检查法(未修订) 0808 铵盐检查法(第二增补本) 0821 重金属检查法(第一增补本) 0822 砷盐检查法(未修订) 0831 干燥失重测定法 0832 水分测定法 0841 炽灼残渣检查法(第二增补本) 0842 易炭化物检查法(未修订) 0861 残留溶剂测定法(未修订) 0871 甲醇量检查法 0872 合成多肽中的醋酸测定法(未修订) 0873 2-乙基己酸测定法(未修订) 0900 物理特性检查法 0901 溶液颜色检查法 0902 澄清度检查法 0903 不溶性微粒检查法 0904 可见异物检查法 0921 崩解时限检查法 0922 融变时限检查法(未修订) 0923 片剂脆碎度检查法(未修订) 0931 溶出度测定法(合并释放度测定法) 0941 含量均匀度检查法 0942 最低装量检查法 0951 吸入制剂微细粒子的空气动力学评价方法(原雾滴粒分布测定法) 0952 贴膏剂黏附力测定法 0981 结晶性检查法(未修订) 0982 粒度和粒度分布测定法(第一增补本) 0983 锥入度测定法 1000 分子生物学技术 1001 核酸分子鉴定法(待定) 1100 生物检查法 1101 无菌检查法 1105 非无菌产品微生物限度检查:微生物计数法 1106 非无菌产品微生物限度检查:控制菌检查法 1107 非无菌药品微生物限度标准 1121 抑菌效力检查法(第三增补本、新增) 1141 异常毒性检查法 1142 热原检查法 1143 细菌内毒素检查法 1144 升压物质检查法 1145 降压物质检查法(未修订) 1146 组胺类物质检查法(新增) 1147 过敏反应检查法(未修订) 1148 溶血与凝聚检查法 1200 生物活性测定法 1201 抗生素微生物检定法(未修订) 1202 青霉素酶及其活力测定法(未修订) 1205 升压素生物测定法 1206 细胞色素C活力测定法(未修订) 1207 玻璃酸酶测定法(未修订) 1208 肝素生物测定法(第三增补本) 1209 绒促性素生物测定法 1210 缩宫素生物测定法 1211 胰岛素生物测定法(未修订) 1212 精蛋白锌胰岛素注射液延缓作用检查法(未修订) 1213 硫酸鱼精蛋白生物测定法(未修订) 1214 洋地黄生物测定法(未修订) 1215 葡萄糖酸锑钠毒力检查法(未修订) 1216 卵泡刺激素生物测定法 1217 黄体生成素生物测定法 1218 降钙素生物测定法 1219 生长激素生物测定法(未修订) 1401 放射性药品检定法(未修订) 1421 灭菌法(未修订) 1431 生物检定统计法(未修订) 2000 中药相关检查方法 2001 显微鉴别法(第二增补本) 2002 中药材DNA条形码分子鉴定法(新增) 2101 膨胀度测定法(第二增补本) 2102 膏药软化点测定法(未修订) 2201 浸出物测定法(未修订) 2202 鞣质含量测定法(第二增补本) 2203 桉油精含量测定法(未修订) 2204 挥发油测定法(未修订) 2301 药材和饮片杂质检查法 2302 灰分测定法(未修订) 2303 酸败度测定法(未修订) 2321 铅、镉、砷、汞、铜测定法(未修订) 2322 元素形态及其价态测定法(拟新增) 2331 二氧化硫残留量测定法 2341 农药残留量测定法(第二增补本+增订) 2351 黄曲霉毒素测定法(第二增补本+增订) 2400 中药注射剂有关物质检查法(拟修订) 2401 中药注射剂蛋白质检查法(待定) 2402 中药注射剂鞣质检查法(待定) 2403 中药注射剂树脂检查法(待定) 2404 中药注射剂草酸盐检查法(待定) 2405 中药注射剂钾离子检查法(待定) 2406 中药注射剂高分子聚合物检查法(待定) 3000 生物制品相关检查方法(待定) 3100 含量测定法 3101 固体总量测定法 3102 唾液酸测定法 3103 磷测定法 3104 硫酸铵测定法 3105 亚硫酸氢钠测定法 3106 氢氧化铝(或磷酸铝)测定法 3107 氯化钠测定法 3108 枸橼酸离子测定法 3109 辛酸钠测定法 3110 乙酰色氨酸测定法 3111 苯酚测定法 3112 间甲酚测定法 3113 硫柳汞测定法 3114 对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法 3115 O-乙酰基测定法 3116 己二酰肼含量测定法 3117 高分子结合物含量测定法 3118 人血液制品中糖及糖醇测定法 3119 人血白蛋白多聚体测定法 3120 人免疫球蛋白类制品IgG单体加二聚体测定法 3121 人免疫球蛋白类制品甘氨酸含量测定法 3122 重组人粒细胞刺激因子蛋白质含量测定法 3123 组胺人免疫球蛋白中游离磷酸组胺测定法 3124 IgG含量测定法 3200 化学残留物测定法 3201 乙醇残留量测定法 3202 聚乙二醇残留量测定法 3203 聚山梨酯80残留量测定法 3204 戊二醛残留量测定法 3205 磷酸三丁酯残留量测定法 3206 碳二亚胺(EDAC)残留量测定法 3207 游离甲醛测定法 3208 人血白蛋白铝残留量测定法 3300 微生物检查法 3301 支原体检查法 3302 病毒外源因子检查法 3303 鼠源性病毒检查法 3400 生物测定法 3401 免疫印迹法 3402 免疫斑点法 3403 免疫双扩散法 3404 免疫电泳法 3405 肽图检查法 3406 质粒丢失率检查法 3407 SV40核酸序列检查法 3408 外源性DNA残留量测定法 3409 抗生素残留量检查法(培养法) 3410 激肽释放酶原激活剂测定法 3411 抗补体活性测定法 3412 牛血清白蛋白残留量测定法 3413 大肠杆菌菌体蛋白质残留量测定法 3414 假单胞菌菌体蛋白质残留量测定法 3415 酵母工程菌菌体蛋白质残留量测定法 3416 类A血型物质测定法 3417 鼠IgG残留量测定法 3418 无细胞百日咳疫苗鉴别试验(酶联免疫法) 3419 抗毒素、抗血清制品鉴别试验(酶联免疫法) 3420 A群脑膜炎球菌多糖分子大小测定法 3421 伤寒Vi多糖分子大小测定法 3422 b型流感嗜血杆菌结合疫苗多糖含量测定法 3423 人凝血酶活性检查法 3424 活化的凝血因子活性检查法 3425 肝素含量测定法 3426 抗A、抗B血凝素测定法 3427 人红细胞抗体测定法 3428 人血小板抗体测定法 3429 猴体神经毒力试验 3500 生物活性/效价测定法 3501 重组乙型肝炎疫苗(酵母)体外相对效力检查法 3502 甲型肝炎灭活疫苗体外相对效力检查法 3503 人用狂犬病疫苗效价测定法 3504 吸附破伤风疫苗效价测定法 3505 吸附白喉疫苗效价测定法 3506 类毒素絮状单位测定法 3507 白喉抗毒素效价测定法 3508 破伤风抗毒素效价测定法 3509 气性坏疽抗毒素效价测定法 3510 肉毒抗毒素效价测定法 3511 抗蛇毒血清效价测定法 3512 狂犬病免疫球蛋白效价测定法 3513 人免疫球蛋白中白喉抗体效价测定法 3514 人免疫球蛋白Fc段生物学活性测定法 3515 抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验) 3516 抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验) 3517 人凝血因子Ⅱ效价测定法 3518 人凝血因子Ⅶ效价测定法 3519 人凝血因子Ⅸ效价测定法 3520 人凝血因子Ⅹ效价测定法 3521 人凝血因子Ⅷ效价测定法 3522 重组人促红素体内生物学活性测定法 3523 干扰素生物学活性测定法 3524 重组人白介素-2生物学活性测定法 3525 重组人粒细胞刺激因子生物学活性测定法 3526 重组人粒细胞巨噬细胞刺激因子生物学活性测定法 3527 重组牛碱性成纤维细胞生长因子生物学活性测定法 3528 重组人表皮生长因子生物学活性测定法 3529 重组链激酶生物学活性测定法 3600 特定生物原材料/动物 3601 无特定病原体鸡胚质量检测要求 3602 实验动物微生物学检测要求 3603 实验动物寄生虫学检测要求 3604 新生牛血清检测要求 3611 细菌生化反应培养基 8000 试剂和标准物质(待定) 8001 试药 8002 试液 8003 试纸 8004 缓冲液 8005 指示剂与指示液 8006 滴定液 8061 标准物质 9000 指导原则 9001 原料药与药物制剂稳定性试验指导原则(待定) 9011 药物制剂人体生物利用度和生物等效性试验指导原则(待定) 9012 生物样品定量分析方法指导原则(待定) 9013 缓释、控释和迟释制剂指导原则(未修订) 9014 微粒制剂指导原则(待定) 9015 注射剂制备指导原则(拟新增,待定) 9101 药品质量标准分析方法验证指导原则 9102 药品杂质分析指导原则 9103 药物引湿性试验指导原则(未修订) 9104 近红外分光光度法指导原则(未修订) 9105 多晶型药品的质量控制技术与方法指导原则(新增) 9106 基于基因芯片技术的药物安全性和有效性评价技术指导原则(新增) 9201 药品微生物检验替代方法验证指导原则(未修订) 9202 微生物限度检查法应用指导原则 9203 药品微生物实验室质量管理指导原则(第三增补本) 9204 微生物鉴定指导原则(新增) 9205 药品洁净实验室微生物监测和控制指导原则(新增) 9206 无菌检查用隔离系统验证指导原则(新增) 9301 注射剂安全性检查法应用指导原则 9302 有害残留物限量制定指导原则(新增) 9401 中药生物活性测定指导原则 9501 正电子类放射性药品质量控制指导原则(未修订) 9502 锝[99mTc]放射性药品质量控制指导原则(未修订) 9701 药用辅料性能指标研究指导原则(第三增补本、拟新增) 9901 国家药品标准物质制备指导原则(第二增补本)。
2015年版药典方法确认表
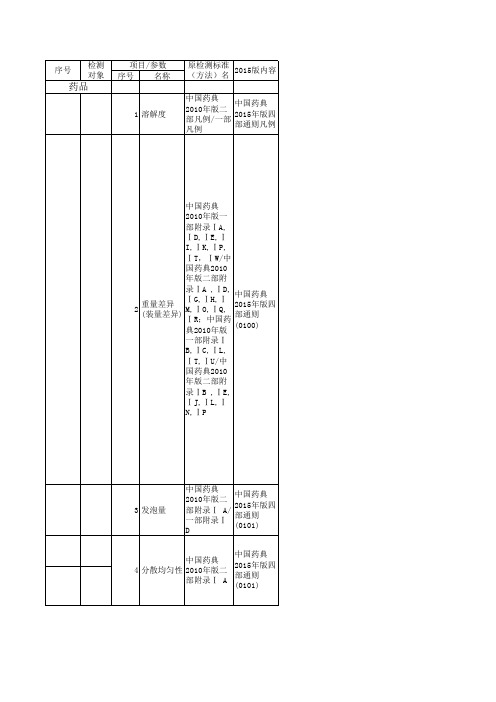
中国药典 中国药典 2015年版四 39 蛋白质含量 2010年版二 部通则 部附录Ⅶ M (0731)
中国药典 中国药典 合成多肽中 2015年版四 40 2010年版二 的醋酸 部通则 部附录Ⅶ N (0872) 中国药典 中国药典 2010年版二 2015年版四 41 氯化物 部附录Ⅷ A/ 部通则 一部附录Ⅸ (0801) C 中国药典 中国药典 2015年版四 42 硫酸盐 2010年版二 部通则 部附录Ⅷ B (0802) 中国药典 中国药典 2015年版四 43 硫化物 2010年版二 部通则 部附录Ⅷ C (0803) 中国药典 中国药典 2015年版四 44 氟 2010年版二 部通则 部附录Ⅷ E (0805) 中国药典 中国药典 2015年版四 45 氰化物 2010年版二 部通则 部附录Ⅷ F (0806) 中国药典 中国药典 2010年版二 2015年版四 46 铁盐 部附录Ⅷ G/ 部通则 一部附录Ⅸ (0807) D 中国药典 中国药典 2010年版二 2015年版四 47 重金属 部附录Ⅷ H/ 部通则 一部附录Ⅸ (0821) E 中国药典 中国药典 2010年版二 2015年版四 48 砷盐 部附录Ⅷ J/ 部通则 一部附录Ⅸ (0822) F 中国药典 中国药典 2015年版四 49 铵盐 2010年版二 部通则 部附录Ⅷ K (0808)
中国药典 2015年版四 部通则 (0841)
中国药典 中国药典 2015年版四 53 易炭化物 2010年版二 部通则 部附录Ⅷ O (0842) 中国药典 中国药典 2015年版四 54 残留溶剂 2010年版二 部通则 部附录Ⅷ P (0861) 中国药典 中国药典 2015年版四 55 热分析 2010年版二 部通则 部附录Ⅷ Q (0661) 中国药典 总有机碳 中国药典 2015年版四 56 (制药用 2010年版二 部通则 水) 部附录Ⅷ R (0682) 中国药典 中国药典 电导率(制 2015年版四 57 2010年版二 药用水) 部通则 部附录Ⅷ S (0681)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附 件:
《中国药典》2015年版勘误表
一 部
二 部
蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲
氧基…….
附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)
-8-甲氧基…….
雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules
磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸
钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分
装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷
酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注
射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定
(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则
0101)。
依托度酸666
【检查】有关物质【检查】有关物质
雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为
37.0℃±0.5℃的溶出介质1000ml,
【检查】溶出度 分别取出溶出杯中全部溶液并即时加入
溶出介质1000ml,
水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积
(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部
品 名页码原 文勘误后
涂剂21【装量】……【装量】……
【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……
四 部
乙交酯丙交酯共聚物
(5050)(供注射
用)
446
丁香油460
【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……
465【折光率】本品的折光率(通则0621)……
【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……
【脂肪酸组成】……进样口温度为260℃,……
大豆磷脂
468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μ
g的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品
中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、
100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……
正丁醇489【相对密度】 本品的相对密度(通则0612)……
【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……
阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
【鉴别】……供试品溶液所显斑点的位置与颜色应与半乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
苯甲醇
519
【细菌内毒素(供注射用)】 ……每1g苯甲醇中含内毒素的量应小于0.1EU。
【细菌内毒素(供注射用)】 ……每1mg苯甲醇中含内毒素的量应小于0.1EU。
活性炭(供注射用)
541【氰化物】……放冷,加盐酸试液1ml……
【氰化物】……放冷,加盐酸1ml……
大豆油
大豆磷脂(供注射
用)
第 11 页,共 11 页。
