浅谈2015年版中国药典的变更年版中国药典的变更
浅谈2015年版中国药典的重点变更-PDF (简)

2015 年版药典收载品种总数约为 5515 个,増幅达到 26.2%。
2010 版药
2015 年版药典
类别
典收载 总收载品种 新增品种 修订品种
中药
2165
化药
2139
药用辅料
132
生物制品
品种 通则、总论
131 10
小计
4567
通则(附录)
---
指导原则
---
2627 2617 约 271 145 14 约 5515 321 31
约 462 约 500
139 14 4 约 1201 29 15
约 400 149 132 62 8
约 751 145 8
不收载 品种
2 5 --6 --13 -----
4. 2015 年版药典的部份增加及修订的项目: 附录是药典的重要部份,药典的灵魂和水平均集中反映在附录中。本版是将三部 药典的附录合一,加强共性的系统化、完善化及规范化,新版 <中国药典> 的附 录调整为凡例、通则与方法、指导原则、药用辅料等单独成卷,为第四部。把以 往各部药典附录里相同的方法之间的归纳统一作为本版药典的工作重点,同时, 亦解决长期以来各部药典之间相同方法/通则要求不统一的问题。再且,附录对 药典以外的其他国家标准具同等法律效力。
4.6 二氧化硫残留的限制 通则里说明,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得 超过 150mg/kg (ppm)。
正文品种说明山药、牛膝、粉葛、天冬、天麻、天花粉、白及、白芍、白朮、党 参 10 味药材及其饮片二氧化硫残留量不得超过 400mg/kg(ppm)。
新版药典锐意加强科学监管,防止中药材加工过程中滥用或过度使用硫磺熏蒸,
《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介

《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介作者:陈佳钱琛陈桂良来源:《上海医药》2016年第07期摘要本文简要介绍《中华人民共和国药典(2015年版)》中中药部分的增、修订情况及技术特点。
本版药典不仅中药收载品种数大幅增加,而且进一步加强了多药味(成分)的检测、活性成分的控制和杂质(有害物质)的检查,更注重现代分析技术的应用,包括广泛应用了指纹(特征)图谱技术,对提高中药的安全性及其质量整体控制水平具有重要作用。
关键词《中华人民共和国药典(2015年版)》中药药品标准中图分类号:R921.2 文献标识码:C 文章编号:1006-1533(2016)07-0003-02A brief introduction to quality standards of traditional Chinese medicines in the Pharmacopoeia of the People’s Republic of China (2015 version)CHEN jia*, QIAN Chen, CHEN Guiliang* *(Division of Quality Assurance, Shanghai Institute for Food and Drug Control, shanghai 201203, China)ABSTRACT The main changes and the technical characteristics related to the quality standards of traditional Chinese medicines (TCM)in the Pharmacopoeia of the People’s Republic of China (2015 version) was briefly introduced. Not only was the content related to the collection of TCM substantially increased but also the detection of multi-composition, the control of active ingredients and the examination of harmful impurity (or substances) were strengthened, and furthermore,the application of modern analysis technology including the wide use of feature/fingerprint technology was more focused on in this new pharmacopoeia. We believe that these will play an important role in improving the safety of TCM and strengthening their quality control.KEY WORDS Pharmacopoeia of the People’s Republic of China (2015 version); traditional Chinese medicines; drug standards《中华人民共和国药典(2015年版)》(以下简称为“2015年版《中国药典》”)已自2015年12月1日起正式实施。
2015版药典通则变化总结

黏度测定法
10版:每次测定值与平均值的差值不得超过平均值的±5%。 15 版:“每次测定值与平均值的差值不得超过平均值的 ±0.25%”
铅、镉、砷、汞、铜测定法
10 版:“其中以 72 Ge 作为内标, 114 Cd 以 115 In 作为内标, 202Hg、208Pb 以209Bi作为内标,” 15版:“其中63Cu、75As以72Ge作为内标,114 Cd 以115In作 为内标,2Байду номын сангаас2Hg、208Pb以209Bi作为内标,”
10版:为增加稳定性、掩盖药物不良臭味、改善片剂外观 等,可对制成的药片包糖衣或薄膜衣。对一些遇胃液易破 坏、刺激胃黏膜或需要在肠道内释放的口服药片,可包肠 溶衣。必要时,薄膜包衣片剂应检查残留溶剂。 15版:为增加稳定性、掩盖原料药物不良臭味、改善片剂 外观等,可对制成的药片包糖衣或薄膜衣。对一些遇胃液 易破坏、刺激胃黏膜或需要在肠道内释放的口服药片,可 包肠溶衣。必要时,薄膜包衣片剂应检查残留溶剂。
10 版:胶囊剂应整洁,不得有粘结、变形、渗漏 或囊壳破裂现象,并应无异臭。 15 版:胶囊剂应整洁,不得有黏结、变形、渗漏 或囊壳破裂现象,并应无异臭。 10版:除另有规定外胶囊剂应密封贮存。 15 版:除另有规定外,胶囊剂应密封贮存,其存 放环境温度不高于 30 ℃,湿度应适宜,防止受潮、 发霉、变质。生物制品原液、半成品和成品的生 产及质量控制应符合相关品种要求。
旋光度检查法
10版:“偏振光透过长1dm且每1ml中含有旋光性物质1g的溶液,在一 定波长与温度下测得的旋光度称为比旋度。测定比旋度(或旋光度) 可以区别或检查某些药品的纯杂程度,亦可用以测定含量。” 15版:“在一定波长与温度下,偏振光透过每1ml含有1g旋光物质的溶 液且光路为长1dm时,测得的旋光度称为比旋度。比旋度(或旋光度) 可以鉴别或检查光学活性药品的纯杂程度,亦可用以测定光学活性药 品的含量。” 15版:增加 3.1“旋光度的测定一般应在溶液配制后 30分钟内进行测 定。”
《中国药典》2015年版制剂通则变化比较

《中国药典》2015年版制剂通则变化比较2015年版《中国药典》无论是在品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
通过学习、熟悉2015 年版《中国药典》制剂通则的变化,了解目前我国用药水平、制药水平和监管水平现状,解读未来我国药品行业的趋势。
学习重点:熟悉药典制剂通则,掌握其标准的提升。
第一部分制剂通则比较2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布,于2015年12月1日正式实施。
新版药典是国家药品标准的组成部分,是国家药品标准体系的核心。
按照党中央提出的“四个最严”要求,新版药典的制修订始终坚持“科学、先进、实用、规范”的原则,依据试验数据、研究结果、专家评估,体现药典编制的科学性和严谨性,以持续改进提高药品质量。
新版药典的颁布标志着我国用药、制药以及监管水平的全面提升,将促进药品质量的整体提高,对于保障公众用药安全有效意义重大。
《中国药典》2015年版进一步扩大药品品种的收载和修订,共收载品种5608种。
其中,一部收载品种2598种,二部收载品种2603种,三部收载品种137种。
本版药典是将三部药典的附录合一,加强共性的系统化、完善化及规范化,新版《中国药典》的附录调整为凡例、通则与方法、指导原则、药用辅料等单独成卷,为第四部。
第四部的名称为“《中国药典》2015 年版总则”,包括现有药典一部、二部、三部的附录(现改为“通则”)内容和药用辅料品种正文。
一、《中国药典》2015 年版总则(四部)项目组成:1、前言2、第十届药典委员会委员名单3、目录4、中国药典沿革5、品种及通则变化名单6、凡例(三部合一)7、品名目次(保留笔画索引,品种正文拟改为按拼音排序)8、通则(原药典附录内容):包括导引图、制剂通则、通用方法/检测方法及指导原则9、附表:包括原子量表、国际单位换算表及新旧附录/通则编码对照表10、药用辅料品种正文(原收载于药典二部正文品种第二部分)11、总索引(中英文索引)二、修订说明1、使分类更加清晰明确,药典标准更加系统化、规范化将上一版药典中中药、化学药、生物制品三部分别收载的附录(凡例、制剂通则、分析方法、指导原则、药用辅料等)三合一,独立成卷作为第四部。
15版药典变化解析

2015版《药典》中药材标准的变化情况新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
新药典增减药材情况:删除:紫河车新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量注:•总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;•总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;•五氯硝基苯不得过0.1mg/kg;•六氯苯不得过0.1mg/kg;•七氯(七氯、环氧七氯之和)不得过0.05mg/kg;•艾氏剂不得过0.05mg/kg;•氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
2015版中国药典变化内容

2015药典七大变化一是收载品种增幅达到27.4%。
2015版药典拟收载5800个品种,比2010版药典增加1200多个,修订品种751个。
二是通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
三是健全了药品标准体系。
特别是药用辅料品种增加至260个,新增相关指导原则;在归纳、验证和规范的基础上实现了《中国药典》各部共性检测方法的协调统一。
四是2015版药典附录(通则)、辅料独立成卷,构成《中国药典》四部的主要内容。
五是药用辅料品种收载数量显著增加。
拟新增128个,共计260个,增长率高达97%。
六是安全性控制项目大幅提升。
中药:制定了中药材及饮片中二氧化硫残留量限度标准,推进建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准;加强对重金属以及中药材的有毒有害物质的控制等。
化学药:有关物质加强了杂质定性和定量测定方法的研究,实现对已知杂质和未知杂质的区别控制,优化抗生素聚合物测定方法,设定合理的控制限度,整体上进一步提高有关物质项目的科学性和合理性等。
生物制品:增加相关总论的要求,严格生物制品全过程质量控制要求,以保证产品的安全有效性,同时增订“生物制品生产用原辅材料质量控制通用性技术要求”,加强源头控制,最大限度降低安全性风险等。
七是进一步加强有效性控制。
中药材加强了专属性鉴别和含量测定项设定。
化学药适当增加了控制制剂有效性的指标,研究建立科学合理的检查方法。
生物制品进一步提高效力测定检测方法的规范性,加强体外法替代体内法效力测定方法的研究与应用,保证效力测定方法的准确性和可操作性。
版药典变化(精选、)

2015版《药典》中药材标准的变化情况新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
新药典增减药材情况:删除:紫河车新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量注:•总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;•总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;•五氯硝基苯不得过0.1mg/kg;•六氯苯不得过0.1mg/kg;•七氯(七氯、环氧七氯之和)不得过0.05mg/kg;•艾氏剂不得过0.05mg/kg;•氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
2015版药典一部凡例变化总结

• 总则七 • 10版:《中国药典》英文缩写为Ch.P. • 15版:《中国药典》英文缩写为ChP
• 正文八 • 10版:品种项下收载的内容统称为正文,正文 系根据药物自身的理化与生物学特性,按照批 准的来源、处方、制法和运输、贮藏等条件所 制定的、用以检测药品质量是否达到用药要求 并衡量其质量是否稳定均一的技术规定 。 • 15版:《药物自身的理化 与生物学特性,按照批 准的来源、处方、制 法和运输、贮藏等条件所 制定的、用以检测 药品质量是否达到用药要求并衡量其质量是否 稳定均一的技术规定 。
• 总则 二 • 10版:国家药品标准由凡例与正文及其 引用的附录共同构成。本部药典收载的 凡例、附录对药典以外的其他中药国家 标准具有同等效力。 • 15版:国家药品标准由凡例与正文及其 引用的通则共同构成。药典收载的凡例、 通则对未载入本部药典但经国家药品监 督管理部门颁布的其他中药标准具有同 等效力。
• 检验方法与限度 • 10版:无 • 15版:新增“采用本版药典收载的方法, 应对方法的适用性进行确认”
谢谢大家!
总则三 10版:凡例是为正确使用《中国药典》 进行药品质量检定的基本原则 ,是对 《中国药典》正文、附录及与 质量检定 有关的共性问题的统一规定。 15版:凡例是正确使用《中国药典》进 行药品质量检定的基本原则 ,是对《中 国药典》正文、通则及与质量检定有关 的共性问题的统一规定。
• 总则四 • 10版:凡例和附录中采用“ 除另有规定 外” 这一用语,表示存在与凡例或附录 有关规定不一致的情况时,则在正文中 另作规定,并按此规定执行。 • 15版:凡例和通则中采用 “ 除另有规 定外” 这一用语 表示存在与凡例或通则 有关规定不一致的情况时,则在正文中 另作规定,并按此规定执行。
2015版药典增修订内容简介

2016年3月24日
了解新版药典变化的目的
了解新版药典增修订情况的变化,更好地理解药
典、更好地执行药典。 了解药品国家标准制修订理念的变化,把握今后 药品标准制修订的方向,提高标准控制水平,促 进产品质量的提升。
《中国药典》2015年版概况
《中国药典》2015年版,共分为四部。
5
《中国药典》2015年版概况
药典四部收载通则和药用辅料 通则(附录),共317个(其中新增43个、修 订67个)。包括制剂通则共38个,检测方法 240个,指导原则30个,标准物质、标准品9 个。 药用辅料270个(其中新增137个、修订97个、 不收载2个)。
《中国药典》2015年版特点 -1
建立了药典标准体例 凡例为统领规定 通则和总论为同类药品基本准则 各论为具体品种基本要求 药品标准体系更加健全,首次将“国家药品标准物质 制备”、“药包材” 以及“药用玻璃容器”等指导原 则纳入药典。
《中国药典》2015年版特点-3
对凡例、通则、总论进行了全面修订,整体上提 升了对药品质量控制的要求。 药典凡例、通则、总论对药典收载以外的药品 具有同样的约束力。 对整合后的通则重新建立了通则编码体系(与 中国药典2010年版附录有编码对照表)
收载品种有较大幅度的增加(新增1082个), 增幅达到23.7%。 扩大收载品种范围,覆盖了国家基本药物目 录品种的90%以上。 对于部分标准不完善、多年无生产、临床不 良反应多的药品,加大调整力度,2010年版 收载而本版药典未收载的品种共计43种。
《中国药典》2015年版特点-2
药品标准更加系统化、全面化、规范化
2015版中国药典发布,附7大变化清单

2015版中国药典发布,附7大变化清单2015-6-12 医学界临床药学《中华人民共和国药典》(2015年版,以下简称药典)经第十届药典委员会执委会全体会议审议通过,予以发布,自2015年12月1日起实施。
6月10日,国家药典委员会发布公告,称根据《中华人民共和国药品管理法》,《中华人民共和国药典》(2015年版,以下简称药典)经第十届药典委员会执委会全体会议审议通过,予以发布,自2015年12月1日起实施。
药典是药品行业的最重要的文件之一,其修改一直备受瞩目。
2015年版是继我国1953年第一版药典以来的第十版药典。
公开资料显示,2015年2月4日,第十届药典委员会执行委员会全体会议审议并通过了《中国药典》2015年版草案。
药典委员会副主任委员、国家食品药品监管总局吴浈副局长做了会议总结,他指出,2015年版药典无论是在药典品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
《中国药典》的颁布实施体现了我国的用药水平、制药水平和监管水平。
因此,要不断加强药典标准工作,发挥其引领和规范作用。
下一版的药典将是2020年版,要认真做好2020年版药典的规划工作,使2020年版药典水平再上新台阶。
药典七大变化清单在中国药典2015的后期编制时,国家药典委员会秘书长张伟曾经介绍了2015版药典主要有七个方面的变化,由于张伟介绍时仍然不是最终定稿,所以这个方面的变化中,一些具体数字可能会有所变化,但是整体精神仍可供参考。
一是收载品种增幅达到27.4%。
2015版药典拟收载5800个品种,比2010版药典增加1200多个,修订品种751个。
(此数字是否是最终数字,有待业内人士指正)。
二是通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
三是健全了药品标准体系。
讲义五:2015年版版中国药典四部增修订情况

2015 年版《中国药典》四部增修订概况2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部内容包括凡例、通则和药用辅料,药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平; 同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1. 2015 年版《中国药典》四部增修订整体情况2015 年版《中国药典》四部收载通则总数317个; 将药典一部、二部、三部制剂整合后共计38个; 检测方法附录287个,其中新增通则28个(检定方法通则27个、制剂通则1个) ,整合通则63个,修订通则67 个; 新增生物制品总论3个; 指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2. 2015 年版《中国药典》四部主要特点2. 1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定(表2),从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
药品标准控制更加全面化、系统化、规范化。
2. 2 药典标准体系更加完善2015年版《中国药典》四部首次纳入“国家药品标准物质通则”以及“国家药品标准物质制备指导原则”、“药包材通用要求”和“药用玻璃材料和容器”等指导原则,进一步完善了药用辅料和药包材通用性要求,从影响药品质量的等各方面,包括原料药及其制剂、药品标准物质、药用辅料和药包材的制定控制要求,形成了全面、完善的药典标准体系。
《中国药典》2015年版实施通告有关问题的解读(一)

《中国药典》2015年版实施通告有关问题的解读(一)第一篇:《中国药典》2015年版实施通告有关问题的解读(一) 《中国药典》2015年版实施公告有关问题的解读(一)1.问:国家食品药品监督管理总局关于实施《中华人民共和国药典》2015年版(以下简称“2015年版药典”)有关事宜的公告(以下简称“公告”)(2015年第105号)中规定,为符合2015年版药典而需进行补充申请的,应在2015年12月1日前进行申报,2015年12月1日后是否仍可提交相应补充申请?答:对2015年版药典发布前已上市药品,生产企业应在2015年12月1日前完成原标准与新版药典相关要求的研究和比对,并应按公告要求进行相应的备案或补充申报。
2015年12月1日以后仍可以提交相应补充申请。
2.问:企业的注册标准已经对2010年版药典相关品种进行评估的,且2010年版与2015年版药典品种质量标准和检测方法无变化的,是否需要重新对产品进行评估?答:虽然品种正文内容与2015年版药典品种规定无变化,但由于2015年版药典通用性要求,包括凡例、通则、制剂通则以及通用性检验方法等进行了全面的增修订,因此,生产企业仍需针对2015年版药典通用性要求方面对本产品进行相应的评估。
3.问:关于药品执行标准的表述方式的问题答:对于注册标准不低于《中国药典》项目的制品,执行注册标准,其执行标准表示方式为:“执行药品注册标准且符合《中国药典》2015年版要求”。
4.问:对于进口药品生产企业,能否使用注册代理公司出具的说明信来代替国外的声明信,进行备案或补充申请的申报?答:原则上注册代理公司应出具持证商的声明信。
如使用说明信代替国外的声明信,应同时提供进口药品生产企业出具的委托注册代理公司办理该事项的委托书。
5.问:国家食药总局2015年第67号公告中规定,2015年版药典自2015年12月1日起实施”。
如何界定产品的执行日期?答:按是历版药典执行惯例要求,自2015年12月1日起生产或进口的药品应符合2015年版药典的相关规定。
2015年版《中国药典》四部增修订概况

,
ABS TRACT :T h e ma i n s i g n i i f c a n t c h a n g e o f t h e Ch i n e s e P h a r ma c o p o e i a( C h . P)2 01 5 e d i t i o n i s t h e d e v e l o p me n t o f v 0 l u me I V f o r
o l o g i c s ) , i n c l u d i n g t h e g e n e r a l r e q u i r e m e n t s f o r p r e p a r a t i o n s , t e s t i n g me t h o d s , g u i d e l i n e s a s w e l l a s t h e e x c i p i e n t s s t a n d a r d s .T h e C h .
g r e s s i n i mp r o v i n g t e s t i n g me t h o d s ,a p p l i c a t i o n o f a d v a n c e d a n a l y s i s t e c h n o l o g y,s t r e n g t h e n i n g p r o c e s s q u a l i t y c o n t r o l ,i mp r o v i n g t h e c o n t r o l s y s t e m f o r e x c i p i e n t s a s we l l a s e s t a b l i s h i n g t h e e x e i p i e n t s mo n o g r a p h s .I t wi l l p l a y a n i mp o r t a n t r o l e i n i mp r o v i n g t h e o v e r a l l
2015年版药典标准变更项目
√
12 喷出总量
√
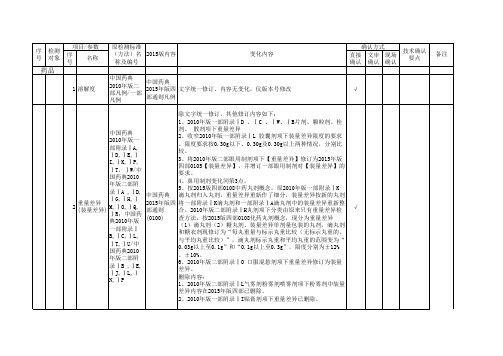
每喷喷量:原为2010年版二部和三部喷雾剂(附录Ⅰ L、附录 IH)的项目,现为2015年版四部喷雾剂(0112)的项目,2015 中国药典 年版药典与2010年版药典相比,增加了下列内容:凡规定测定递 中国药典 2010年版二 送剂量均一性的喷雾剂,不再进行每喷喷量的测定。 每喷(揿)喷 2015年版四 13 部附录Ⅰ L/ 每揿喷量:原为2010年版一部气雾剂(附录Ⅰ Z)的项 量 部通则 一部附录Ⅰ 目,现为2015年版四部气雾剂(0112)的项目,操作过程如喷量 (0112) Z 测定个数、连续喷射次数作了修改,文字作了修订,增加下列内 容:凡进行每揿递送剂量均一性检查的气雾剂,不再进行每揿喷 量检查。 中国药典 2010年版二 部附录ⅠN/ 一部附录Ⅰ C,I T 中国药典 2015年版四 修订内容:2010年版一部附录Ⅰ C颗粒剂溶化性检查检查混悬 部通则 颗粒,2015年版四部颗粒剂(0104)不检查混悬颗粒。其他仅作 (0100)、 文字统一修订,内容无变化 (0104)、 (0188)
除文字统一修订,其他修订内容如下: 1、2010年版一部附录ⅠD 、ⅠC 、ⅠW、ⅠB片剂、颗粒剂、栓 剂、 散剂项下重量差异 中国药典 2、收窄2010年版一部附录ⅠL 胶囊剂项下装量差异限度的要求 2010年版一 。限度要求按0.30g以下、0.30g及0.30g以上两种情况,分别比 部附录ⅠA, 较。 ⅠD,ⅠE,Ⅰ 3、将2010年版二部眼用制剂项下【重量差异】修订为2015年版 I,ⅠK,ⅠP, 四部0105【装量差异】,并增订一部眼用制剂对【装量差异】的 ⅠT,ⅠW/中 要求。 国药典2010 4、鼻用制剂变化同第3点。 年版二部附 5、按2015版四部0108中药丸剂概念,原2010年版一部附录ⅠK 录ⅠA ,ⅠD, 中国药典 滴丸剂归入丸剂,重量差异重新作了细分,装量差异按新的丸剂 ⅠG,ⅠH,Ⅰ 重量差异 2015年版四 将一部附录ⅠK滴丸剂和一部附录ⅠA滴丸剂中的装量差异重新整 2 M,ⅠO,ⅠQ, (装量差异) 部通则 合。2010年版二部附录ⅠH丸剂项下分类由原来只有重量差异检 ⅠR;中国药 (0100) 查方法,按2015版四部0108化药丸剂概念,现分为重量差异 典2010年版 (1)滴丸剂(2)糖丸剂、装量差异单剂量包装的丸剂,滴丸剂 一部附录Ⅰ 和糖衣剂现修订为“每丸重量与标示丸重比较(无标示丸重的, B,ⅠC,ⅠL, 与平均丸重比较)”,滴丸剂标示丸重和平均丸重的范围变为“ ⅠT,ⅠU/中 0.03g以上至0.1g”和“0.1g以上至0.3g”,限度分别为±12% 国药典2010 、±10%。 年版二部附 6、2010年版二部附录ⅠO 口服混悬剂项下重量差异修订为装量 录ⅠB ,ⅠE, 差异。 ⅠJ,ⅠL,Ⅰ 删除内容: N,ⅠP 1、2010年版二部附录ⅠL气雾剂粉雾剂喷雾剂项下粉雾剂中装量 差异内容在2015年版四部已删除。 2、2010年版一部附录ⅠI贴膏剂项下重量差异已删除。
《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介

《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介陈佳;钱琛;陈桂良【摘要】本文简要介绍《中华人民共和国药典(2015年版)》中中药部分的增、修订情况及技术特点。
本版药典不仅中药收载品种数大幅增加,而且进一步加强了多药味(成分)的检测、活性成分的控制和杂质(有害物质)的检查,更注重现代分析技术的应用,包括广泛应用了指纹(特征)图谱技术,对提高中药的安全性及其质量整体控制水平具有重要作用。
%The main changes and the technical characteristics related to the quality standards of traditional Chinese medicines (TCM) in the Pharmacopoeia of the People’s Republic of China (2015 version) was brielfy introduced. Not only was the content related to the collection of TCM substantially increased but also the detection of multi-composition, the control of active ingredients and the examination of harmful impurity (or substances) were strengthened, and furthermore, the application of modern analysis technology including the wide use of feature/fingerprint technology was more focused on in this new pharmacopoeia. We believe that these will play an important role in improving the safety of TCM and strengthening their quality control.【期刊名称】《上海医药》【年(卷),期】2016(037)007【总页数】3页(P3-4,8)【关键词】《中华人民共和国药典(2015年版)》;中药;药品标准【作者】陈佳;钱琛;陈桂良【作者单位】上海市食品药品检验所质量管理科上海 201203;上海市食品药品检验所质量管理科上海 201203;上海市食品药品检验所质量管理科上海 201203【正文语种】中文【中图分类】R921.2**通讯作者:陈桂良,主任药师。
2015年版中国药典三部增修订概况

治疗性生物制品
重组技术产品 注射用重组人白介素-11( 酵母) 注射用重组人白介素-11 尼妥珠单抗注射液
其他 注射用鼠神经生长因子
重组牛碱性成纤维细胞生长因子 滴眼液) ( 2010 年版增补本)
重组人表皮生长因子滴眼液( 酵 母) ( 2010 年版增补本)
表 3 2015 年版《中国药典》三部删除品种及相关说明
风险,是生物制 品 全 过 程 质 量 控 制 的 重 要 环 节。此 外,也 为 实施科学监管提供了技术支撑。
②对已收载通则的修订: 主要围绕强化全面质量管理 规范,降低生物制品质量控 制 风 险 为 目 的,修 订 后 整 体 内 容进一步完善、规范,并增强 与 国 内 外 现 行 相 关 技 术 规 范 的一致性。具体 修 订 包 括“生 物 制 品 生 产 检 定 用 菌 毒 种 规程”、“生物制品 国 家 标 准 物 质 制 备 和 标 定 规 程”、“生 物制品分装和冻干 规 程”、“生 物 制 品 贮 存 和 运 输 规 程 ”、 “免 疫 血 清 生 产 用 马 匹 检 疫 和 免 疫 规 程”、“血 液 制 品 生 产 用人血浆”、“生物 制 品 生 产 检 定 用 动 物 细 胞 基 质 制 备 及 检定规程”7 个通则。 1. 1. 3 总论 总论是对特定类别生物制品的通用性技术要 求,在生物制品国家标准体系中与其他部分内容共同形成凡 例、生物制品通则、总论、附录( 通则) 、各论在收载内容上互 为关联、衔接和补充的完整体系。总论是对中国药典收载的 品种各论生产、质量控制的补充,同时将尚未收载药典的所 有上市生物制品纳入国家标准的规范要求内,使生物制品国 家标准覆盖全部上市品种。此外总论对于生物制品研发也 具有重要的导向作用。
5
33
浅谈2015年版《中国药典》变化

浅谈2015年版《中国药典》变化
鄢胜君
【期刊名称】《湖北成人教育学院学报》
【年(卷),期】2016(22)1
【摘要】2015年版《中国药典》相较于2010年版《中国药典》主要变化有收载的品种增加、收载的辅料增加、附录整合、药物鉴别、含量测定、有关物质检查、有害物质的控制、方法验证要求、风险控制、检测项目、检测方法、指导原则等内容的增补、修订.
【总页数】3页(P23-25)
【作者】鄢胜君
【作者单位】湖北技能型人才培养研究中心,武汉 430074;长江职业学院,武汉430074
【正文语种】中文
【中图分类】R92
【相关文献】
1.基于2015年版《中国药典》(一部)分析含甘草止咳方剂的用药规律 [J], 沈莹; 樊建; 孟祥才
2.2015年版《中国药典》一部收载中药材及饮片测定信息的分析 [J], 张新军; 林志军; 金晓丽; 于蓓蓓; 李莹; 刘善新
3.2015年版中国药典收载的治疗糖尿病的中成药组方药味特点研究 [J], 马明华; 戴媛媛; 汪晓河; 年华
4.2015年版《中国药典》收载治疗高脂血症的中成药用药特点研究 [J], 王倩婷
5.2012年度《中国药典》专项培训与《中国药典》2015年版基础教育计划启动[J], 本刊编辑部
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浅谈2015年版中国药典的变更1.基本情况:1950年1月卫生部成立第一届国家药典委员会,组成8个专家的小组团队,展开中国药典的编制,亦是我国最早的标准化机构。
第一部<中国药典>1953年版由卫生部编印发行。
至今已组建十屇药典委员会,并经已编制共九版中国药典(英文名称为Pharmacopoeia of The People’s Republic of China; 英文简称为Chinese Pharmacopoeia; 英文缩写为Ch.P.)。
中国药典是为保证药品产量、保障人民群众用药安全、有效、稳定、质量可控的技术法典,亦是药品研究、生产、经营、使用和监管的法定依据。
作为国家药品标准体系的核心及对外的竞争力,药典收载范围遂步扩大,由1953年(第一版)共531品种增加至现有的2010版(第九版)共4567种(包括有中药: 2165种(一部),化学药: 2271种(二部)及生物药制品: 131种(三部)),当中涵盖了中药材、中药饮片、中药饮片、中成药、生物制品、药用辅料、凡例、通则及附录等等。
国家药品标准国家药品标准是由凡例与正文及其引用的附录共同构成。
并且对药典以外的其他国家标准具同等效力。
由此可见,药典是国家对药品监控及为企业建立质量体系的重要手段。
药典的法律地位:依照《药品管理法》规定:药品必须符合国家药品标准。
”“药品必须符合国家药品标准管理部门颁布的药典和药品标准为国家药品标准。
”“国务院药品监国务院药品监督督管理部门颁布的药典和药品标准为国家药品标准2.基本结构:凡例: 为正确使用<中国药典>进行药品质控的基本原则,是对正文、附录及与质量检定有关的共性问题的统一规定。
正文: 各品种项下收载的内容统称正文,是根据药物自身的理化与生物学特性,按照批准的来源、处方、制法、和运输、贮藏等条件所制定的、用以检测药品是否达到用药要求,并衡量其质量是否稳定均一的技术规定。
附录: 主要收载制剂通则、通用检测方法和指引原则。
方向:、工作目标及工作目标及方向3.新版药典的总体情况新版药典的总体情况、编制目的: 安全、有效、质量可控。
编制原则: 科学、先进、规范、实用。
编制策略: 中药标准以我为主、继承发展。
化学药、生物制品标准跟踪、创新。
正作机制: 政府引导、专家指导、企业主体、社会参与现行及新版药典基本已可达国际水平,中国既为世界上的企业大国,更是大部份出口中药材的来源,现今普遍人们对天然药物或膳食补充剂兴趣及需求不断增加,国际间对中国药典的编制及药品的监控手段尤其重视。
2011年11月及2013年9月所办的第一届及第二届全球药典领导者会议分别于北京及西安市举行。
中美药典国际论坛已在中国举办合共六届(包括11月中旬完成的第七届选址在成都举行),由此可见,中国逐步搭建药品标准交流与合作的国家平台。
2015年版的药典总体目标是进一步完善<中国药典> 结构,令药品安全保障和质量控制水平进一步提高。
以中药标准主导国际发展,以化学药和生物制品标准接近或达到国际水平。
从而令国家药品标准体系更加健全完善,在引导我国医药产业技术进步及优化升级中发挥更大作用。
2014年6月18日于广州市举行的中国药品新标准的发展与展望高峰研讨会-2015年版<中国药典> 广州研讨会(左)广州市药学会理事长兼前广州市药监局副局长金建忠先生, (中)国家药典委员会首席专家钱忠直教授, (右)广州市药学会副理事长兼前广州市药品检定所所长杨仲元先生“化药化药、、生物制品生物制品同步同步同步,,中药主导”2015年版药典收载品种总数约为5515个,増幅达到26.2%。
类别 2010版药典收载 2015年版药典 总收载品种 新增品种 修订品种 不收载品种中药 2165 2627 约462 约400 2 化药 2139 2617 约500 149 5 药用辅料132 约271 139 132 --- 生物制品品种 131 145 14 62 6 通则、总论10 14 4 8 --- 小计 45674567 约5515 约12011201 约751 13 通则(附录) --- 321 29 145 --- 指导原则 ---31158---4. 2015年版药典年版药典的部份增加的部份增加的部份增加及修订及修订及修订的项目的项目:附录是药典的重要部份,药典的灵魂和水平均集中反映在附录中。
本版是将三部药典的附录合一,加强共性的系统化、完善化及规范化,新版 <中国药典> 的附录调整为凡例、通则与方法、指导原则、药用辅料等单独成卷,为第四部。
把以往各部药典附录里相同的方法之间的归纳统一作为本版药典的工作重点,同时,亦解决长期以来各部药典之间相同方法/通则要求不统一的问题。
再且,附录对药典以外的其他国家标准具同等法律效力。
现行国内外的药典附录比较:药典数量编码分类内容不清晰较全面中国药典280 I A-Z空间不足美国药典272 <xxx> 不清晰较全面欧洲药典309 x.x.x 清晰全面英国药典195 I A-Z 不清晰较全面日本药局方112 x. xx 较清晰一般独立一卷的名称为“《中国药典》2015年版总则”,包括现有药典一部、二部、三部的附录(现改为“通则”)内容和药用辅料品种正文。
详情如下:一、前言二、第十届药典委员会委员名单三、目录四、中国药典沿革五、品种及通则变化名单六、凡例(三部合一)七、品名目次(保留笔划索引,品种正文拟改为按拼音排序)八、通则(原药典附录内容): 包括导引图制剂、通则、通用方法/检测方法及指导原则九、附表: 包括原子量表、国际单位换算表及新旧附录/通则编码对照表十、药用辅料品种正文(原收载于药典二部正文品种第二部分)十一、总索引(中英文索引)4.1 2015年版药典年版药典通则通则(原附录)新编码的组成:通则编码按照“XXYY”四位罗马数字方式表示,分两层其中XX 代表现有附录编码的大罗马字母(Ⅰ、Ⅱ、Ⅲ…… 等等) YY 代表现有附录编码的英文字母(A 、B 、C…… 等等)。
可分99大类,每类有99个条目。
<中国药国药典典> 2015年版年版部份通部份通部份通则则编码编码与与2010年版附年版附录编码对录编码对录编码对照表照表编号编号 通则名称通则名称 原附录原附录 原附录名称原附录名称0100 制剂通则 --- ------ 0101片剂一部I D 片剂 二部 I A 片剂 三部 I E 片剂 0102 注射剂一部 I U 注射剂 二部 I B 注射剂 三部 I A 注射剂 0103 胶囊剂一部 I L 胶囊剂 二部 I E 胶囊剂 三部I F 胶囊剂…9204 微生物鉴定指导原则新增 --- 9205药品洁净实验室微生物监测和控制指导原则新增---…9302 中药有害残留物限量制定指导原则新增 --- 9303 色素检测指导原则新增 --- 9304 中药中铝、铬、铁、钡元素测定指导原则新增 --- 9305中药中真菌毒素测定指导原则新增---4.2 加强制剂通加强制剂通剂的修订及完善剂的修订及完善:进一步规范常用剂型的分类和定义,加强共性要求及必要的检测项目的修订,例如: 软膏剂 乳膏剂 糊剂 (分列) 丸剂糖丸剂 (分列,丸剂作为传统中药剂型)同一剂型下的检查项应尽量统一,尤其涉及安全性和有效性指标。
片剂、颗粒剂等的 [装量差异] 检查。
4.3 将共性问题将共性问题移入凡例移入凡例如: 原料药物系指来源于动植物和矿物以及用化学合成和生物技术获得的供制剂用活性物质。
本通则中各剂型、亚剂型并不适合于所有药物(如中药和天然药物、生物制品原料药物等),而应由原料药物特性、临床给药需求以及药品的安全性、有效性、稳定性所决定。
(这可避免三部合并后,引起剂型无理扩展的争议)。
4.4 片剂以2010版二部制剂通则为主,整合一、三部有关要求,内容求大同存小异。
在原各亚剂型定义下,崩解时限测定等方法和要求,统一分列在【崩解时限】下: 除另有规定外,照崩解时限检查法(通则0921)检查,应符合规定。
咀嚼片不进行崩解时限检查。
阴道片照融变时限检查法(通则0921)检查,应符合规定。
凡规定检查溶出度、释放度的片剂,不再进行崩解时限检查。
【微生物限度】... 照非无菌产品微生物限度检查: 微生物计数法 (通则1105)和控制菌检查法 (通则1106)及非无菌药品微生物限度标准(通则1107) 检查,应符合规定.....。
4.5 颗粒剂【水分】 中药颗粒剂水分照水份测定法(通则0832),不得过8.0%。
(2010版是6.0%) 【溶化性】颗粒剂不得有异物,中药颗粒还不得有焦屑。
4.6 二氧化硫残留的限制通则里说明,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg (ppm)。
正文品种说明山药、牛膝、粉葛、天冬、天麻、天花粉、白及、白芍、白朮、党参10味药材及其饮片二氧化硫残留量不得超过400mg/kg(ppm)。
新版药典锐意加强科学监管,防止中药材加工过程中滥用或过度使用硫磺熏蒸,从而提升及发展绿色中药材。
4.7 重金属残留限度各国药典及香港中药材标准(港标)收载重金属的限值(mg/kg)重金重金属属 铅(Pb Pb)) 汞(Hg Hg)) 镉(Cd Cd)) 砷(As As)) *中国药典 ≤ 5 ≤ 0.2 ≤ 0.3 ≤ 2 美国药典 ≤ 10 ≤ 3 ≤ 0.3 --- 美国药典 (膳食补充剂) ≤ 0.02 ≤ 0.02 ≤ 0.006 ≤ 0.01 德国药典 ≤ 5 ≤ 0.1 ≤ 0.2 ≤ 5 WHO(草药) ≤ 10 --- ≤ 0.3 --- 港标 ≤ 5≤ 0.2≤ 0.3≤ 2*中国药典还要求对铜定立限值: ≤ 20 (mg/kg),但重金属的要求只列于部份药材的检查项里。
现需进行重金属检查的药材包括有西洋参、甘草、山揸、枸杞子及薄荷脑等等。
2015版药典新增品种: 新增蛤壳、海螵蛸、海藻、昆布、牡蛎、水蛭、珍珠等7种。
新版药典暂仍不对所有中药材及饮片规定统一的重金属限度。
4.8黄曲霉毒素的限制于柏子仁、莲子、使君子、槟榔、麦芽、肉豆蔻、决明子、远志、薏苡仁、大枣、地龙、蜈蚣、水蛭、全蝎等14味药材及其饮片项下,增加黄曲霉毒素的检查:黄曲霉毒素B1不得过 5 µg/kg; 黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2总量不得过10 µg/kg。
4.9新增修订农药残留测定法新增22种有机氯类农药残留量气相色谱测定法: 除另有规定外,每1 kg中药材或饮片中含:I.总六六六(α-BHC, β-BHC, γ-BHC, δ-BHC之和)不得过0.2mg;II.总滴滴涕不得过0.2mg;III.五氯硝基苯(Quintozene)不得过0.1mg;IV.六氯苯(Hexachlorocyclohexane)不得过0.1mg;V.七氯(Heptachlor)、顺式环氧七氯(Heptachlor-exo-epoxide)和反式环氧七氯(Heptachlor-endo-epoxide)之和不得过0.05mg;VI.艾氏剂(Aldrin)和秋氏剂(Dieldrin)之和不得过0.05mg;VII.异狄氏剂(Endrin) 不得过0.05mg;VIII.顺式氯丹(cis-Chlordane)、反式氯丹(trans-Chlordane)和氧化氯(oxy-Chlordane)之和不得过0.05mg;IX.α-硫丹(α-Endosulfan)、β-硫丹(β- Endosulfan)和硫丹硫酸盐(Endosulfan sulfate)之和不得过3mg。
