E.Z.N.A Gel Extraction Kit 琼脂糖凝胶回收试剂盒 中文 说明书
胶回收QC操作标准

琼脂糖凝胶DNA回收试剂盒(离心柱型)QC标准操作流程1. 实验试剂和耗材1.2 实验试剂1.3 耗材2. 实验操作流程胶回收试剂盒的检测须进行两个实验验证,第一个实验为GelRed染色法,第二个实验为EB染色法。
2.1 GelRed染色法2.1.1 1.5%琼脂糖凝胶的制备(1)准确称取1.5g琼脂糖置于250ml三角锥形瓶中,添加125ml 1×TAE溶液。
(2)轻微混匀后将其置于微波炉中,高火加热6min至溶液沸腾,取出锥形瓶放置室温2min。
(3)添加1×TAE溶液至110ml,再次于微波炉中高火加热3min至溶液沸腾。
(4)室温放置10min后将溶液倒入插有梳子的胶槽内,待胶块凝固后使用。
2.1.2 胶回收实验(1)取6个2ml离心管,依次编号为1-6号,使用分析天平准确称取空离心管的重量。
(2)用干净锋利的手术刀片切下不含核酸染料的1.5%琼脂糖凝胶胶块,放入已称重的2ml离心管中,称取胶块与离心管总重,计算凝胶块的重量。
要求胶块重量不超过200mg 为宜。
(3)添加溶胶液Binding Solution B,要求1、2号管中每100mg琼脂糖凝胶加入200ul Binding Solution B,3、4号管中每100mg琼脂糖凝胶加入300ul Binding Solution B,5、6号管中每100mg琼脂糖凝胶加入400ul Binding Solution B.(4)每管中添加50ul DL2502,混匀后置于60℃水浴5min,期间间断混合,直至凝胶块完全融化。
【注意事项】观察各管内溶胶液溶解胶块的快慢程度。
(5)将上述混合液转移至套放于2ml收集管的GenClean柱中,室温放置2min,10000rpm 室温离心1min,取出GenClean 柱,并倒掉收集管中废液。
(6)将GenClean 柱重新放回收集管中,加入500ul Wash Solution,于12000rpm,室温离心1min,倒掉收集管中废液。
琼脂糖凝胶DNA回收试剂盒大比对

3. 评估方法 • 使用Nanodrop 2000测量OD值
图: 取2ul纯化的质粒DNA上样于1.0%琼脂糖凝胶电泳 分析结果。M: DL5000 DNA Marker. 结果表明,Magen的HiPure Plasmid Micro Kit与其它品 牌对应的产品效果相当,质粒条带完整,超螺旋质粒含量 高。
2. 琼脂糖凝胶DNA回收试剂盒大比对
1. 选择品牌: • Qiagen, QIAquick Gel Extraction Kit , 28704 • Tiagen, 超薄琼脂糖凝胶回收试剂盒,DP208 4. 电泳结果
• Omega, E.Z.N.A. Gel Extraction Kit, D2500-02
1. 选择品牌: • Qiagen, QIAamp DNA Blood Mini Kit, D51104 • Tiagen, 血液基因组提取试剂盒(DP318) 4. 电泳结果
试剂盒回收DNA,然后电泳检测DNA回收效率。结果表明,
Magen的HiPure Gel Pure DNA Micro Kit在小片段和大片段上 有更高的回收率,其余片段则相差不大。
3. 评估方法
•
用1琼脂糖电泳分析DNA回收效率
Magen HiPure Gel Pure DNA Micro Kit(D2110)的优势:
3. 评估方法
•
用1琼脂糖电泳分析DNA回收效率
Magen HiPure PCR Pure DNA Micro Kit(D2120)的优势: 1. 高效去除引物二聚体。 2. 低洗脱体积,可低至7-10ul洗脱。 3. 长时间稳定的结合柱,无需平衡液处理 4. 更高的回收率
4.பைடு நூலகம்柱法血液DNA提取试剂盒大比对
E.Z.N.A Gel Extraction Kit

琼脂糖凝胶回收试剂盒E.Z.N.A Gel Extraction Kit适合于D2501-**,D2500-**&D2502-**准备工作1. 浓缩的SPW Buffer需用乙醇按如下稀释:D2500-00&D2501-00&D2502-00 加入20ml 100%的乙醇;D2500-01/02&D2501-01/02&D2502-01/02 每瓶加入100ml 100%的乙醇;注意:稀释后的DNA Wash Buffer需室温保存;所有步骤必须在室温下进行.操作方案配制琼脂糖EB凝胶,电泳以分离DNA片段.任何类型或等级的琼脂糖都可以使用.我们强烈的推荐使用新鲜的TAE/TBE电泳缓冲液.不要重复使用电泳缓冲液,旧的电泳缓冲液PH会增加而降低DNA的回收产量;2. 电泳足够时间后,在紫外灯下小心地把所需的DNA片段切下来.并尽量去除多余的凝胶.注意:DNA在紫外灯下的曝光的时间不要超过30秒,同时在紫外灯下操作的时候一定要戴保护眼镜.3.称取空离心管的重量,切下带目的片段的凝胶装在1.5ml离心管中并称其重量,求出凝胶块的重量,近似地确定其体积.一般情况下,凝胶的密度为1g/ml,于是凝胶的体积与重量的关系可按下面换算:凝胶薄片的重量为0.2g 则其体积为0.2ml;加入等倍凝胶体积的Binding Buffer,把混合物置于55℃~65℃水浴中温浴7min至凝胶完全融化,其间每隔2-3分钟混匀一次;重要提醒:在凝胶完全溶解之后,注意凝胶-Binding Buffer混合物的pH值.如果其pH值大于8的话,DNA的产量将大大减少.观察混合物的颜色,如果是橙色或红色,则要加入5μl 浓度为5 M,pH为5.2的醋酸钠,以调低其pH值.经过这一调节,该混合物的颜色将恢复为正常的浅黄色.一般情况下,使用新鲜的电泳缓冲液,凝胶-Binding buffer混合物的PH值的不会升高;4.转移700μl的DNA-琼脂糖溶液到一个HiBindTM DNA柱子,并把柱子装在一个干净的2ml收集管内,室温下,10,000×g离心1min,弃去液体.一个HiBind DNA柱子最多可容纳700μl的溶液,如果DNA-琼脂糖混合物的体积大于700μl,可先转移700μl溶液至柱子,离心完后,将余下的溶液继续加上柱子上.但是每一个HiBindTM柱子最多可以结合25~30μg DNA.如果预期产量较大,则把样品分别加到合适数目的柱中.5. 将柱子重新套回收集管中,加300μl Binding Buffer至HiBind DNA 柱子中;室温下,10,000×g离心1分钟,去弃滤出液;这一步相当关键,不要忽略此步.6.将柱子重新套回收集管中,加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟,去弃滤出液;注:SPW Wash buffer在使用前必须按瓶子标鉴要求用无水乙醇进行稀释.7. 将柱子重新套回收集管中,重复加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟, 弃去滤出液;,将空柱子重新套回收集管中,10,000×g离心1min以甩干柱基质残余的液体.这步可以去除柱子基质上残余的乙醇,不要省略此步―――对得到好的DNA产量是十分重要的.8. 把柱子装在一个干净的1.5ml离心管上,加入30~50μl洗脱液或灭菌水上柱子膜上,10,000×g离心1分钟,离心管中的溶液就是纯化的DNA产物,保存于-20度.如果再洗脱一次的话可以把残余的DNA洗脱出来,不过那样的浓度就会较低.DNA的产量及质量:把纯化产物的样品稀释一定的倍数后,分别在260nm和280nm下测其光吸收值,回收得到的DNA的浓度可按以下公式来计算: DNA浓度=光吸收260×50×稀释倍数μg/ml长度大于500bp的片段通常能纯化得到80%的产量. 而50bp~500bp的带则可达到55%~80%的回收率.(光吸收260/光吸收280)的比率是核酸纯度的一个标记.如果此值1.8,则意味着核酸的纯度>90%.另一方面,如果纯化产物的产量较低时,可以用琼脂糖EB电泳估算产物的浓度.载体。
琼脂糖凝胶电泳片断回收的常用方法

琼脂糖凝胶电泳片断回收的常用方法琼脂糖凝胶电泳片断回收的常用方法20世纪70年代是一个奠定现代分子生物学的时代,1973年冷泉港实验室的Joseph Sambroo k和Phillip Sharp发明了利用琼脂糖凝胶分离DNA 和EB染料观测DNA 相结合的技术。
现在,琼脂糖和聚丙烯酰胺凝胶电泳是分离、鉴定和纯化核酸和蛋白质片断的标准方法。
这里首先介绍的是琼脂糖凝胶电泳片断回收的常用方法:1.柱回收试剂盒:可谓目前最简单快速的回收方法,只需要将电泳凝胶中的产物条带切下,用溶解Buffer彻底溶解,上包埋有纯化填料的纯化柱,离心,再洗涤一次,离心后用洗脱缓冲液洗脱。
全程不过10多分钟,得到的产物溶液可以直接用于后继实验。
这个方法几乎不需要什么技巧就能得到稳定的结果,也是目前最多商品化试剂盒选择的方法。
但是这个方法不适合用于大片断的回收。
2.玻璃奶/纯化填料胶回收试剂盒:这个方法比前面的方法更为灵活,可以根据每次回收实验时预期回收量来调整纯化填料的量,使得实验不受限于柱子的载量,也不会造成浪费。
前面的操作步骤和上者一样,将电泳凝胶的条带切下,Buffer溶解,(区别在于这里)加入纯化填料填料吸附混合,快速离心沉淀去上清,洗涤沉淀后,干燥沉淀,最后用洗脱液纯化介质中吸附的片断释放出来,离心,取上清,就是回收的产物。
这个方法适合各种不同大小的片断,特别是大片断的回收,但是操作就较前者复杂一些,涉及到多次离心沉淀和取上清,有可能会误吸了微量的沉淀;另外干燥的程度也有点技巧,干过了不好洗脱,没干透又影响结果。
后来的改进版本有将混合了纯化介质后的凝胶溶解液加入到一种离心过滤柱上,这种柱子不带纯化填料,只有一层过滤膜,离心过滤后,填料在柱子里,溶液被甩掉,这样就避免了上述的问题。
3.低熔点琼脂糖:传统手工操作方法之一,低熔点琼脂糖制备凝胶,电泳后切割目的条带,在TE溶液中65度保温融化,用传统的酚氯仿抽提,乙醇沉淀。
分子生物学实验指导

实验一RT-PCR法钓取小鼠肝脏GAPDH基因一、TRlzol试剂提取小鼠肝脏总RNATRIzol RNA提取试剂盒是由GIBCOBRL公司推出的产品,其操作方法简捷、方便,lh之内即可完成,所制备的RNA可用于cDNA合成及Northern blot等。
【试剂】TRlZOL试剂氯仿异丙醇75%乙醇(DEPC水配制)无RNase水【操作方法】(1)收获细胞1~5×106;或50-100mg组织,加TRlzol试剂lml匀浆。
(2),移入1.5ml Ep管中,室温静置5min。
(3)每1ml TRIZOL中加氯仿0.2m1,摇振15s,置室温2~3min。
(4)4℃离心,12,000g×15min。
(5)仔细吸取上层水相,移至另一Ep管中。
(6)加0.5ml异丙醇,混匀,置室温10min。
(7)4℃离心,12,000g×10min。
(8)弃上清,加75%乙醇1m1,轻轻摇振,充分洗涤沉淀,4℃离心,7500g×5min。
(9)弃上清,真空干燥后,沉淀重悬于50μl无RNase水中。
一70℃保存备用。
二、核酸的定量(1)分光光度法测定核酸浓度。
组成核酸分子的碱基,均具有一定的吸收紫外线特性,最大吸收波长为250~270nm之间。
例如腺嘌呤的最大紫外线吸收值在260.5nm,胞嘧啶:267nm 鸟嘌呤:276nM胸腺嘧啶:264.5 nm尿嘧啶259nm。
这些碱基与戊糖、磷酸形成核苷酸后,其最大吸收峰不会改变,但核苷酸最大吸收波长是260nm,吸收低谷在230nm,这个物理特性为紫外分光光度法测定核酸溶液浓度提供了基础。
在波长260nm紫外线下,1OD值的光密度相当于双链DNA浓度为50ug/ ml;单链DNA或RNA为40ug/ml;单链寡核苷酸为20ug/ml。
另外,还可以通过测定260nm和280nm的紫外线吸收值,然后根据其比值来估计核酸的纯度。
DNA样品的比值为1.8,RNA样品的比值为2.0。
E.Z.N.A Gel Extraction Kit

琼脂糖凝胶回收试剂盒E.Z.N.A Gel Extraction Kit适合于D2501-**,D2500-**&D2502-**准备工作1. 浓缩的SPW Buffer需用乙醇按如下稀释:D2500-00&D2501-00&D2502-00 加入20ml 100%的乙醇;D2500-01/02&D2501-01/02&D2502-01/02 每瓶加入100ml 100%的乙醇;注意:稀释后的DNA Wash Buffer需室温保存;所有步骤必须在室温下进行.操作方案配制琼脂糖EB凝胶,电泳以分离DNA片段.任何类型或等级的琼脂糖都可以使用.我们强烈的推荐使用新鲜的TAE/TBE电泳缓冲液.不要重复使用电泳缓冲液,旧的电泳缓冲液PH会增加而降低DNA的回收产量;2. 电泳足够时间后,在紫外灯下小心地把所需的DNA片段切下来.并尽量去除多余的凝胶.注意:DNA在紫外灯下的曝光的时间不要超过30秒,同时在紫外灯下操作的时候一定要戴保护眼镜.3.称取空离心管的重量,切下带目的片段的凝胶装在1.5ml离心管中并称其重量,求出凝胶块的重量,近似地确定其体积.一般情况下,凝胶的密度为1g/ml,于是凝胶的体积与重量的关系可按下面换算:凝胶薄片的重量为0.2g 则其体积为0.2ml;加入等倍凝胶体积的Binding Buffer,把混合物置于55℃~65℃水浴中温浴7min至凝胶完全融化,其间每隔2-3分钟混匀一次;重要提醒:在凝胶完全溶解之后,注意凝胶-Binding Buffer混合物的pH值.如果其pH值大于8的话,DNA的产量将大大减少.观察混合物的颜色,如果是橙色或红色,则要加入5μl 浓度为5 M,pH为5.2的醋酸钠,以调低其pH值.经过这一调节,该混合物的颜色将恢复为正常的浅黄色.一般情况下,使用新鲜的电泳缓冲液,凝胶-Binding buffer混合物的PH值的不会升高;4.转移700μl的DNA-琼脂糖溶液到一个HiBindTM DNA柱子,并把柱子装在一个干净的2ml收集管内,室温下,10,000×g离心1min,弃去液体.一个HiBind DNA柱子最多可容纳700μl的溶液,如果DNA-琼脂糖混合物的体积大于700μl,可先转移700μl溶液至柱子,离心完后,将余下的溶液继续加上柱子上.但是每一个HiBindTM柱子最多可以结合25~30μg DNA.如果预期产量较大,则把样品分别加到合适数目的柱中.5. 将柱子重新套回收集管中,加300μl Binding Buffer至HiBind DNA 柱子中;室温下,10,000×g离心1分钟,去弃滤出液;这一步相当关键,不要忽略此步.6.将柱子重新套回收集管中,加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟,去弃滤出液;注:SPW Wash buffer在使用前必须按瓶子标鉴要求用无水乙醇进行稀释.7. 将柱子重新套回收集管中,重复加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟, 弃去滤出液;,将空柱子重新套回收集管中,10,000×g离心1min以甩干柱基质残余的液体.这步可以去除柱子基质上残余的乙醇,不要省略此步―――对得到好的DNA产量是十分重要的.8. 把柱子装在一个干净的1.5ml离心管上,加入30~50μl洗脱液或灭菌水上柱子膜上,10,000×g离心1分钟,离心管中的溶液就是纯化的DNA产物,保存于-20度.如果再洗脱一次的话可以把残余的DNA洗脱出来,不过那样的浓度就会较低.DNA的产量及质量:把纯化产物的样品稀释一定的倍数后,分别在260nm和280nm下测其光吸收值,回收得到的DNA的浓度可按以下公式来计算: DNA浓度=光吸收260×50×稀释倍数μg/ml长度大于500bp的片段通常能纯化得到80%的产量. 而50bp~500bp的带则可达到55%~80%的回收率.(光吸收260/光吸收280)的比率是核酸纯度的一个标记.如果此值1.8,则意味着核酸的纯度>90%.另一方面,如果纯化产物的产量较低时,可以用琼脂糖EB电泳估算产物的浓度.载体。
分子生物学实验课:胶回收-质粒提取-双酶切

子内部中央,放置2分钟,离心1分钟。收集管中的溶液即为已纯化的 GAPDH基因DNA片段。
连接
• 1)在微量离心管中配制下列DNA溶液,全 量为5 μl。
鉴定正反
• TA克隆有两种插入方式,造成正反向 • 常规PCR使得3’端多出一个A碱基
5’ nnnnnnnnnnA 3’ 3’ Annnnnnnnnn 5’
pMD®18-T Vector图谱
酶切鉴定
• 1. 建立酶切反应体系:
DNA
<=1μg
10Xbuffer2
3.0μl
10XBSA
3.0μl
• 42°C下作短暂的热刺激期间,这种复合物便会 被细胞吸收。
• 进入受体细胞的DNA分子通过复制,表达实现遗 传信息的转移,使受体细胞出现新的遗传性状。 将经过转化后的细胞在筛选培养基中培养,即可 筛选出转化子。
转化步骤
• 1. 于超净台中取连接产物10μl与100μl大肠杆菌感受态细胞 混合,置冰浴中30分钟。
C:溶液浓度(单位,mol/L) L:光路长度(单位,cm)
核酸纯度分析
• A280nm是蛋白和酚类物质最高吸收峰的吸收波长 • A260/A280比值可进行核酸样品纯度评估:
理论上,纯DNA的A260/A280比值为1.8,纯RNA的 A260/A280比值为2.0。如果比值低,表示受到蛋白(芳 香族)或酚类物质的污染,依据具体实验要求,考虑是否 纯化样品。
沉淀。 • 10,000g 离心1分钟,弃残液。 • 用500μl HB buffer 洗柱,10,000g 离心1分钟,去残液。 • 用700μl DNA wash buffer (乙醇稀释)洗柱,10,000g离心1分钟,去
Omega胶回收试剂盒操作

Introduction . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Benefits . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Binding Capacity . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Kit Contents . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Materials Supplied By User . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Gel Extraction Protocol . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 Optional Vacuum Protocol . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 Trouble Shooting Guide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 Short Protocol For Experienced Users . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7
Omega胶回收试剂盒操作

1
2
Kit Contents
Product Number D2500-00 D2501-00 D2502-00
5 5 5 5 ml 1 ml 5 ml 1
D2500-01 D2501-01 D2502-01
50 50 50 40 ml 10 ml 25 ml 1
D2500-02 D2501-02 D2502-02
Contents
Introduction
The E.Z.N.A.® family of products is an innovative system that radically simplifies extraction and purification of nucleic acids from a variety of sources. Key to the system is the new HiBind® matrix that specifically, but reversibly, binds DNA or RNA under certain optimal conditions, allowing proteins and other contaminants to be removed. Nucleic acids are easily eluted with Elution Buffer provided. Gel purification of DNA is a common technique for isolation of specific fragm ents from reaction mixtures. However, m ost methods either fail to com pletely rem ove agarose (which can lead to problem s in downstream manipulations), shear the DNA, or result in very low yields. The E.Z.N.A.® Gel Extraction Kit uses HiBind® technology to recover DNA bands 50 bp-40 kb from all grades of agarose gel in yields exceeding 85%. The DNA band of interest is excised from the gel, dissolved in Binding Buffer, and applied to a HiBind ® DNA spin-column. Following a rapid wash step, DNA is eluted with Elution Buffer and is ready for other applications. The product is suitable for ligations, PCR, sequencing, restriction digestion, or various labeling reactions.
EZNA Gel Extraction Kit

MicroElute Gel Extraction Kit 100bp-20kb 80-85% Poly-Gel DNA Extraction Kit 100bp-20kb 60-80%
Poly-Gel RNA Extraction Kit 30bp-10kb 85-90%
货号和次数
D2500/1-00(5) D2500/1-01(50) D2500/1-02(200)
简易说明书
离心操作方案 1. 琼脂糖凝胶电泳分离DNA片段,推荐使用新鲜的TAE/TBE Buffer和新配制的胶。 2. 片段完全分离后,在紫外灯下迅速切取所需条带,DNA在紫外灯下爆光时间不超过30s。 3. 称取凝胶块的重量,按照每1g凝胶加入1ml Binding Buffer对应量,加入适量体积的Binding
E.Z.N.A.TM Gel Extraction Kit
Cat. No: D2500,D2501
实验前准备 1. 调节水浴的温度为55-65°C。 2. 按下表用无水乙醇稀释SPW Wash Buffer,并于室温保存。
D2500-00,D2501-00: 加入20ml无水乙醇 D2500-01,D2501-01: 加入100ml无水乙醇 D2500-02,D2501-02: 每瓶中加入100ml无水乙醇
O me g a中 国 区 订 货/技 术 支 持 tel:020-32058425 fax:020-32058915
E.Z.N.A.TM Gel Extraction Kit
Cat. No: D2500,D2501 快速流程图
电 泳 后 , 切 下 凝 胶; 称重后,加入等体积Binding Buffer 5 5 - 6 0 ° C水 浴 溶 解 凝 胶
琼脂糖凝胶纯化回收试剂盒操作方法及步骤说明书

5. 快速、方便,不需要使用有毒的苯酚、氯仿等试剂,也不需要 乙醇沉淀。
注意事项
1. 所有的离心步骤均在室温完成,使用转速可以达到13,000rpm的 传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2. 溶胶液中含有刺激性化合物,操作时要戴乳胶手套,避免沾染 皮肤,眼睛和衣服。若沾染皮肤、眼睛时,要立即用大量清水 或者生理盐水冲洗。
1. 在长波紫外灯下,用干净刀片将所需回收的DNA条带切下,尽 量切除不含DNA的凝胶,得到凝胶体积越小越好。
2. 将切下的含有DNA条带凝胶放入1.5ml离心管,称重。 先称一个空1.5ml离心管重量,然后放入凝胶块后再称一次,两次 重量相减,得到凝胶的重量。
3. 加3倍体积溶胶液DD。 如果凝胶重为100mg,其体积可视为100μl,则加入300μl溶胶液。 如果凝胶浓度大于2%,应加入6倍体积溶胶液。 4. 56℃水浴放置10分钟(或直至胶完全溶解)。每2-3分钟涡旋震
3. 回收纯化的DNA片段一般在100bp到40kb之间,过长、过短片段 的回收效率迅速降低。
4. 回收DNA的量和起始DNA的量、洗脱体积、DNA片断大小有 关。一般1-15μg, 100bp-5kb的DNA片段,回收率可高达85%。
5. 切胶回收时,紫外灯观察对DNA片段有损坏作用,应该尽可能 使用能量低的长波紫外线,并且尽可能的缩短紫外线下处理的 时间。
试剂盒组成保存50次dr0101100次dr0102200次dr0103平衡液室温5ml10ml20ml溶胶液dd室温50ml50ml2200ml漂洗液wb室温15ml25ml50ml第一次使用前按说明加指定量乙醇洗脱缓冲液eb室温10ml15ml15ml吸附柱ec室温50个100个200个收集管2ml室温50个100个200个本试剂盒在室温储存12个月不影响使用效果
takara 胶回收试剂盒说明书

操作流程1. 使用TAE缓冲液或TBE缓冲液制作琼脂糖凝胶,然后对目的DNA进行琼脂糖凝胶电泳。
2. 在紫外灯下切出含有目的DNA的琼脂糖凝胶,用纸巾吸尽凝胶表面的液体。
此时应注意尽量切除不含目的DNA部分的凝胶,尽量减小凝胶体积,提高DNA回收率。
胶块超过300 mg时,请使用多个Column进行回收,否则严重影响收率。
注)切胶时请注意不要将DNA 长时间暴露于紫外灯下,以防止DNA损伤。
3. 切碎胶块。
胶块切碎后可以加快操作步骤6的胶块溶解时间,提高DNA回收率。
4. 称量胶块重量,计算胶块体积。
计算胶块体积时,以1 mg=1 μl 进行计算。
5. 向胶块中加入胶块溶解液Buffer GM,Buffer GM的加量如下表:凝胶浓度Buffer GM使用量1.0%3个凝胶体积量1.0%~1.5%4个凝胶体积量1.5%~2.0%5个凝胶体积量6. 均匀混合后室温15-25℃溶解胶块(胶浓度较大或比较难溶时可以在37℃加热)。
此时应间断振荡混合,使胶块充分溶解(约5~10分钟)。
7. 当凝胶完全溶解后,观察溶胶液的颜色,如果溶胶液颜色由黄色变为橙色或粉色,向上述胶块溶解液中加入3 M醋酸钠溶液(pH5.2)10 μl,均匀混合至溶液恢复黄色。
当分离小于400 bp的DNA片段时,应在此溶液中再加入终浓度为20%的异丙醇。
8. 将试剂盒中的Spin Column安置于Collection Tube上。
9. 将上述操作步骤7的溶液转移至Spin Column中,12,000 rpm离心1分钟,弃滤液。
注)如将滤液再加入Spin Column中离心一次,可以提高DNA的回收率。
10. 将700 μl 的Buffer WB加入Spin Column中,室温12,000 rpm离心30秒钟,弃滤液。
注)请确认Buffer WB中已经加入了指定体积的100%乙醇。
11. 重复操作步骤10。
12. 将Spin Column安置于Collection Tube上,室温12,000 rpm离心1分钟。
琼脂糖凝胶DNA回收试剂盒
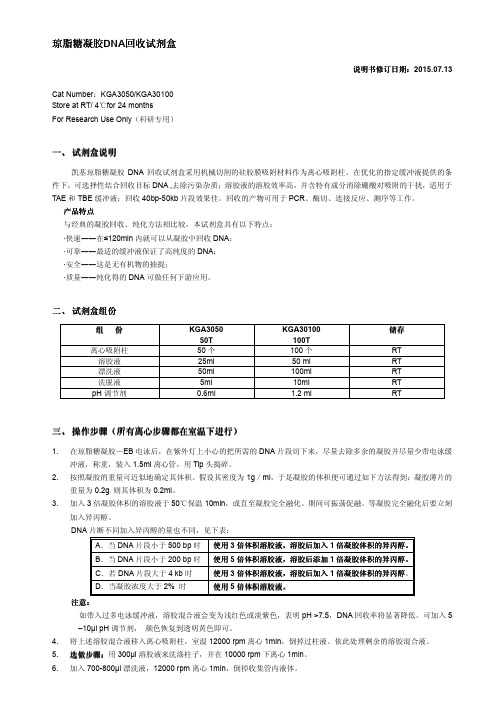
琼脂糖凝胶DNA 回收试剂盒说明书修订日期说明书修订日期::2015.07.13Cat Number :KGA3050/KGA30100 Store at RT/ 4for 24 months ℃For Research Use Only (科研专用)一、 试剂盒说明凯基琼脂糖凝胶DNA 回收试剂盒采用机械切割的硅胶膜吸附材料作为离心吸附柱,在优化的指定缓冲液提供的条件下,可选择性结合回收目标DNA ,去除污染杂质;溶胶液的溶胶效率高,并含特有成分消除硼酸对吸附的干扰,适用于TAE 和TBE 缓冲液;回收40bp-50kb 片段效果佳。
回收的产物可用于PCR 、酶切、连接反应、测序等工作。
产品特点与经典的凝胶回收、纯化方法相比较,本试剂盒具有以下特点:·快速――在≤120min 内就可以从凝胶中回收DNA ; ·可靠――最适的缓冲液保证了高纯度的DNA ; ·安全――这是无有机物的抽提;·质量――纯化得的DNA 可做任何下游应用。
二、 试剂盒组份组 份 KGA3050 50T KGA30100 100T 储存 离心吸附柱50个 100个 RT 溶胶液 25ml 50 ml RT 漂洗液 50ml 100ml RT 洗脱液 5ml 10ml RT pH 调节剂0.6ml1.2 mlRT三、 操作步骤操作步骤((所有离心步骤都在室温下进行所有离心步骤都在室温下进行))1. 在琼脂糖凝胶-EB 电泳后,在紫外灯上小心的把所需的DNA 片段切下来,尽量去除多余的凝胶并尽量少带电泳缓冲液,称重,装入1.5ml 离心管,用Tip 头捣碎。
2. 按照凝胶的重量可近似地确定其体积。
假设其密度为1g /ml ,于是凝胶的体积便可通过如下方法得到:凝胶薄片的重量为0.2g 则其体积为0.2ml 。
3.加入3倍凝胶体积的溶胶液于50℃保温10min ,或直至凝胶完全融化。
期间可振荡促融。
琼脂糖凝胶纯化回收试剂盒操作方法及步骤说明书
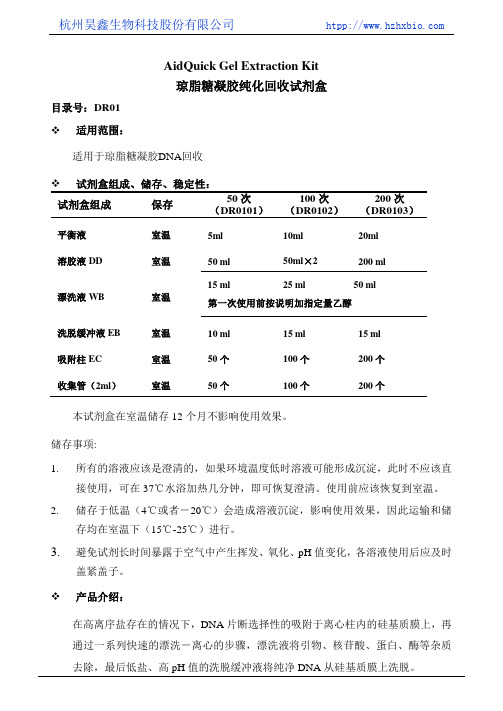
杭州昊鑫生物科技股份有限公司 htpp://AidQuick Gel Extraction Kit琼脂糖凝胶纯化回收试剂盒目录号:DR01❖适用范围:适用于琼脂糖凝胶DNA回收❖试剂盒组成、储存、稳定性:试剂盒组成保存50次(DR0101)100次(DR0102)200次(DR0103)平衡液室温5ml 10ml 20ml 溶胶液DD 室温50 ml 50ml×2 200 ml漂洗液WB 室温15 ml 25 ml 50 ml 第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温10 ml 15 ml 15 ml吸附柱EC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.所有的溶液应该是澄清的,如果环境温度低时溶液可能形成沉淀,此时不应该直接使用,可在37℃水浴加热几分钟,即可恢复澄清。
使用前应该恢复到室温。
2.储存于低温(4℃或者-20℃)会造成溶液沉淀,影响使用效果,因此运输和储存均在室温下(15℃-25℃)进行。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
❖产品介绍:在高离序盐存在的情况下,DNA片断选择性的吸附于离心柱内的硅基质膜上,再通过一系列快速的漂洗-离心的步骤,漂洗液将引物、核苷酸、蛋白、酶等杂质去除,最后低盐、高pH值的洗脱缓冲液将纯净DNA从硅基质膜上洗脱。
❖产品特点:1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
克服了国产试剂盒膜质量不稳定的弊端。
2.使用了优质溶胶液,不含传统溶胶液的碘化钠和高氯酸盐,不抑制回收后酶切、连接克隆等下游反应。
3.溶胶液加酚红调制成为了黄颜色,便于观察溶胶效果和监测pH值变化从而达到最佳结合效果,大大提高回收效率。
4.改进的溶胶液配方,大大提高了缓冲能力和稳定性,即使样品变化很大也能将PH缓冲在最佳结合范围内。
DNA凝胶回收操作流程

DNA凝胶回收QIAquick Gel Extraction Kit① (提前记录1.5ml离心管重量)在紫外灯光下切下含有目的DNA的琼脂糖凝胶,用纸巾吸干凝胶表面液体并切碎(方便融化),计算凝胶重量(重量作为凝胶体积,100mg≈100μl体积)②入3个凝胶体积的Buffer QG ,每个吸附柱的最大量为400mg。
对于>2%凝胶浓度,加入6个凝胶体积的Buffer QG。
③混个均匀后于50℃加热10min(或者直至凝胶全部溶解),每2-3min间断混合以助溶解,凝胶完全融化后,确认混合液的颜色为黄色(类似于Buffer QG没加入溶解的凝胶之前的颜色)。
如果混合液的颜色是橙色的或者紫色的,加入10μL 3M sodium acetate(醋酸钠), pH 5.0,混合。
混合液转变为黄色。
④加入一个体积的异丙醇于样品中,混合。
⑤将QIAquick吸附柱置于2ml 收集管中,为了吸附DNA,将样品置于吸附柱中, 17900×g(13000rpm) 离心1min。
弃去液体,将QIAquick吸附柱置于相同的收集管上。
⑥如果DNA用于后续测序,体外转录,显微注射,加入500μL Buffer QG于吸附柱上,离心1min,弃去液体,将吸附柱置于新的收集管上。
⑦洗涤,加入750μL Buffer PE于吸附柱中,离心1min,弃去液体,将吸附柱置于新的收集管上。
注意:如果将DNA用于盐敏感型应用(例如,测序,平末端连接反应中),加入Buffer PE后静置2-5min。
为了去除残留液体,继续离心1min。
⑧将收集柱置于新的1.5mL离心管中。
⑨为了洗提DNA,加入50μL Buffer EB(10mM Tris·Cl, pH 8.5),加入膜中央,离心1min。
为了增加DNA浓度,加入30μL Buffer EB于膜中央,静置1min,离心1min。
孵育50℃最多4min,可提高DNA提取效率。
凝胶DNA回收试剂盒使用说明

凝胶DNA回收试剂盒使用说明一、试剂盒组成1.碱性ELUTION缓冲液:用于回收DNA片段。
2.DNA绑定胶柱:用于吸附DNA片段。
3.洗涤缓冲液:用于去除琼脂糖凝胶残渣和其他杂质。
4.电子式试剂盒设备:用于快速洗脱DNA片段。
二、凝胶DNA回收试剂盒使用步骤1.准备工作:a.将碱性ELUTION缓冲液加热至65℃,并保存在试剂盒中。
b.手套和面具是使用过程中必需的,以确保实验环境的干净。
c.严格遵守实验室的安全操作规程。
2.凝胶切割:a. 切割需回收的DNA片段:将琼脂糖凝胶切割为片段大小约为50-5000 bp的目标DNA。
b.将切割好的琼脂糖凝胶片段放入微量离心管中,注意不要弄混不同大小的DNA片段。
c.记录每个DNA片段的位置和大小。
3.DNA回收:a.将切割好的琼脂糖凝胶片段放入DNA绑定胶柱中。
b.将绑定胶柱放入收集管中,通过离心将DNA片段吸附到胶柱上。
c.倒掉废液,并使用洗涤缓冲液洗脱胶柱上的残驻琼脂糖凝胶和其他杂质。
重复此步骤1-2次以确保彻底洗脱。
4.DNA洗脱:a.将洗柱放回空的收集管中。
b.加入预热的碱性ELUTION缓冲液(65℃),封闭试管盖,并放入电子式试剂盒设备中。
c.按照设备操作说明进行启动,并设置相应的洗脱温度和时间。
d.在洗脱完成后,将洗脱液转移到新的离心管中。
可以使用适当的方法(如乙醇沉淀或其他纯化方法)进一步纯化DNA。
5.质量检测:a.使用电泳进行质量检测,以确认回收的DNA片段大小和纯度。
b.如果需要,可以定量将DNA溶液保存在冰箱中以备后续实验使用。
三、注意事项1.使用前确保熟悉试剂盒的组成和使用步骤。
2.使用过程中务必佩戴手套和面具,确保操作环境的洁净。
3.严格按照试剂盒的说明进行操作,并遵循实验室的安全操作规程。
4.需要注意的是,琼脂糖凝胶切割和回收过程极易受到外源DNA污染,因此要确保实验环境的洁净,并尽量避免不必要的接触。
5.回收的DNA片段应尽快进行下一步的实验处理,以避免DNA降解和污染。
分子生物学实验技术实验内容

2006年《分子生物学实验技术》实验内容一、RT-PCR(一)总RNA的提取实验安排:每两人抽提一管。
为了使操作同步以节省时间,各组样品请一起离心。
操作步骤:1、将100μl液体样品加入1.5ml Ep管中,再加入900μl冰预冷的LS-Biotragents TM(苯酚和异硫氰酸胍的混合物)。
2、将样品剧烈混合后,在室温放置5min。
3、加入200μl氯仿,颠倒Ep管混和两次,并剧烈振荡混和10s。
4、在4℃条件下,以10000×g离心15min。
5、将上层水相转移到一个新的Ep管中,加入等体积的异丙醇(Isopropanol)并混匀,然后在4℃放置至少10min。
6、在4℃条件下,以10000×g离心15min后,小心并尽可能地去除全部上清夜。
7、用1ml 75%乙醇洗涤RNA沉淀和管壁。
8、将RNA沉淀进行干燥(不能完全干燥)处理后,用10μl无RNase污染的水(RNase-Free Water)将RNA溶解并于-20℃保存。
注意事项:1、所有的玻璃器皿均应在使用前于180℃的高温下干烤6hr或更长时间。
2、所用的塑料材料,如吸头、离心管等需用0.1% DEPC水浸泡过夜。
3、配制的溶液应尽可能用0.1% DEPC,在37℃处理12hr以上。
然后用高压灭菌除去残留的DEPC。
不能高压灭菌的试剂,应当用DEPC处理过的无菌双蒸水配制,然后经0.22μm滤膜过滤除菌。
4、操作人员需在超净工作台上操作,并戴一次性口罩、手套,实验过程中手套要勤换。
(二)反转录实验安排:每人做一管。
反应体系(20μl):按下列顺序加样反应条件:42℃ 1h注意事项:1、加样时,一般从体积大的开始加,样品最后加。
如在一般的PCR反应体系中,应先加水、Buffer、dNTPs、引物,最后加酶和模板。
2、液体应直接加到管底,且每加一种试剂后应更换新的吸头。
3、加完所有试剂后,应用手指轻弹混匀,然后低速离心数秒以收集管壁上沾有的液体。
DNA凝胶回收试剂盒
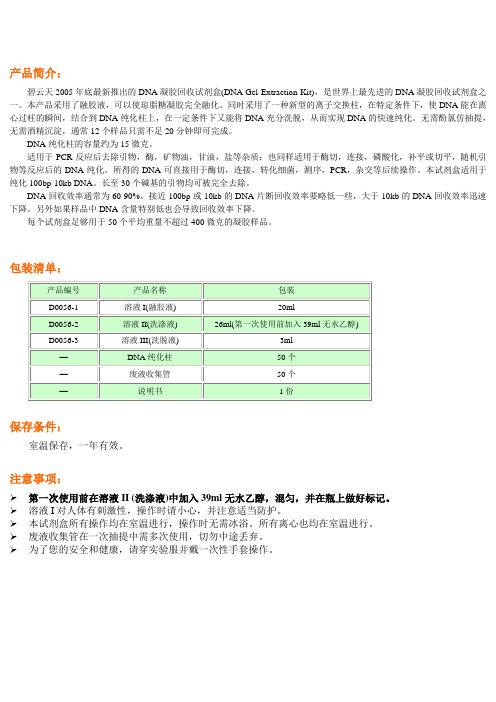
产品简介:碧云天2005年底最新推出的DNA凝胶回收试剂盒(DNA Gel Extraction Kit),是世界上最先进的DNA凝胶回收试剂盒之一。
本产品采用了融胶液,可以使琼脂糖凝胶完全融化。
同时采用了一种新型的离子交换柱,在特定条件下,使DNA能在离心过柱的瞬间,结合到DNA纯化柱上,在一定条件下又能将DNA充分洗脱,从而实现DNA的快速纯化。
无需酚氯仿抽提,无需酒精沉淀,通常12个样品只需不足20分钟即可完成。
DNA纯化柱的容量约为15微克。
适用于PCR反应后去除引物,酶,矿物油,甘油,盐等杂质;也同样适用于酶切,连接,磷酸化,补平或切平,随机引物等反应后的DNA纯化。
所得的DNA可直接用于酶切,连接,转化细菌,测序,PCR,杂交等后续操作。
本试剂盒适用于纯化100bp-10kb DNA。
长至30个碱基的引物均可被完全去除。
DNA回收效率通常为60-90%。
接近100bp或10kb的DNA片断回收效率要略低一些,大于10kb的DNA回收效率迅速下降。
另外如果样品中DNA含量特别低也会导致回收效率下降。
每个试剂盒足够用于50个平均重量不超过400微克的凝胶样品。
包装清单:保存条件:室温保存,一年有效。
注意事项:第一次使用前在溶液II (洗涤液)中加入39ml无水乙醇,混匀,并在瓶上做好标记。
溶液I对人体有刺激性,操作时请小心,并注意适当防护。
本试剂盒所有操作均在室温进行,操作时无需冰浴。
所有离心也均在室温进行。
废液收集管在一次抽提中需多次使用,切勿中途丢弃。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1. 切胶回收后,称重,将胶切碎或在离心管内用1ml枪头捣碎。
2. 加入等体积的溶液I(如胶为100mg,则加100微升溶液I),vortex或颠倒混匀。
3. 50-60℃水浴加热约10分钟至胶全融,期间,需vortex或颠倒混匀3-4次,以加速凝胶融解。
若果胶碎片较小,3-5分钟即可全融;凝胶碎片较大则需较长时间,胶全融后至少再在50-60℃水浴加热2分钟。
应用纳米磁珠快速检测芒果果核象甲

应用纳米磁珠快速检测芒果果核象甲刘若思;张丽杰;赵晓丽;张仑;邓丛良【摘要】利用纳米磁珠(magnetic nanoparticles,MNP)的磁性分离特性,结合PCR技术,建立一种简单方便的芒果果核象甲Sternochetus mangierae检测新方法.该方法可以较简便的提取出昆虫的DNA,且用时仅10 min左右,相对普通DNA 提取试剂盒效率明显提升.【期刊名称】《北京农学院学报》【年(卷),期】2013(028)004【总页数】2页(P8-9)【关键词】芒果果核象甲;纳米磁珠;检疫性有害生物;快速鉴定【作者】刘若思;张丽杰;赵晓丽;张仑;邓丛良【作者单位】北京出入境检验检疫局技术中心,北京101312;中国农业大学农学与生物技术学院,北京100193;北京出入境检验检疫局技术中心,北京101312;北京出入境检验检疫局技术中心,北京101312;重庆大学生命科学院,重庆401331;北京出入境检验检疫局技术中心,北京101312【正文语种】中文【中图分类】S763.38芒果果核象甲Sternochetus mangiferae,属鞘翅目Coleoptera,象虫科Curculionidae,隐喙象亚科Cryptorhynchinae,芒果象属Sternochetus,可随芒果的种子和成熟的果实传播,为中国进境植物检疫性有害生物。
芒果象属全世界共有5种,主要危害芒果果核和果肉,其中危害果核的2种、果肉的3种[1]。
该属成虫在形态学一般通过鞘翅上的斑纹进行辨别,而幼虫和蛹态极其相似,难以通过形态学鉴定。
应用线粒体DNA的特定片段,尤其是CO1片段进行测序分析,对昆虫进行快速鉴定,已成为检疫口岸广泛应用的技术,特别是对于形态学上难以鉴定卵、幼虫、蛹起到了很好的鉴定效果。
而纳米技术的兴起,又有了进一步推进该技术的可能。
纳米颗粒(Nano particles)一般为1~100nm,介于原子簇与一般微粒子之间,许多特有的性质如比表面积大、表面活性中心多、表面反应活性高、吸附能力强、催化能力高,毒性低且不易受体内和细胞内各种酶的降解等,为其在生物医学研究应用方面提供了更加科学的手段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
琼脂糖凝胶回收试剂盒E.Z.N.A Gel Extraction Kit
适合于D2501-**,D2500-**&D2502-**
准备工作
1. 浓缩的SPW Buffer需用乙醇按如下稀释:
D2500-00&D2501-00&D2502-00 加入20ml 100%的乙醇;
D2500-01/02&D2501-01/02&D2502-01/02 每瓶加入100ml 100%的乙醇;
注意:稀释后的DNA Wash Buffer需室温保存;所有步骤必须在室温下进行.
操作方案
配制琼脂糖EB凝胶,电泳以分离DNA片段.任何类型或等级的琼脂糖都可以使用.
我们强烈的推荐使用新鲜的TAE/TBE电泳缓冲液.不要重复使用电泳缓冲液,旧的电泳缓冲液PH会增加而降低DNA的回收产量;
2. 电泳足够时间后,在紫外灯下小心地把所需的DNA片段切下来.并尽量去除多余的凝胶.
注意:DNA在紫外灯下的曝光的时间不要超过30秒,同时在紫外灯下操作的时候一定要戴保护眼镜.
3.称取空离心管的重量,切下带目的片段的凝胶装在1.5ml离心管中并称其重量,求出凝胶块的重量,近似地确定其体积.一般情况下,凝胶的密度为1g/ml,于是凝胶的体积与重量的关系可按下面换算:凝胶薄片的重量为0.2g 则其体积为0.2ml;加入等倍凝胶体积的Binding Buffer,把混合物置于55℃~65℃水浴中温浴7min至凝胶完全融化,其间每隔2-3分钟混匀一次;
重要提醒:在凝胶完全溶解之后,注意凝胶-Binding Buffer混合物的pH值.如果其pH值大于8的话,DNA的产量将大大减少.观察混合物的颜色,如果是橙色或红色,则要加入5μl 浓度为5 M,pH为5.2的醋酸钠,以调低其pH值.经过这一调节,该混合物的颜色将恢复为正常的浅黄色.一般情况下,使用新鲜的电泳缓冲液,凝胶-Binding buffer混合物的PH值的不会升高;
4.转移700μl的DNA-琼脂糖溶液到一个HiBindTM DNA柱子,并把柱子装在一个干净的2ml收集管内,室温下,10,000×g离心1min,弃去液体.
一个HiBind DNA柱子最多可容纳700μl的溶液,如果DNA-琼脂糖混合物的体积大于700μl,可先转移700μl溶液至柱子,离心完后,将余下的溶液继续加上柱子上.但是每一个HiBindTM柱子最多可以结合25~30μg DNA.如果预期产量较大,则把样品分别加到合适数目的柱中.
5. 将柱子重新套回收集管中,加300μl Binding Buffer至HiBind DNA 柱子中;室温下,10,000×g离心1分钟,去弃滤出液;这一步相当关键,不要忽略此步.
6.将柱子重新套回收集管中,加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟,去弃滤出液;注:SPW Wash buffer在使用前必须按瓶子标鉴要求用无水乙醇进行稀释.
7. 将柱子重新套回收集管中,重复加入700μl SPW Wash buffer至HiBind DNA柱子中,室温下,10,000×g离心1分钟, 弃去滤出液;,将空柱子重新套回收集管中,10,000×g离心1min以甩干柱基质残余的液体.
这步可以去除柱子基质上残余的乙醇,不要省略此步―――对得到好的DNA产量是十分重要的.
8. 把柱子装在一个干净的1.5ml离心管上,加入30~50μl洗脱液或灭菌水上柱子膜上,10,000×g离心1分钟,离心管中的溶液就是纯化的DNA产物,保存于-20度.
如果再洗脱一次的话可以把残余的DNA洗脱出来,不过那样的浓度就会较低.
DNA的产量及质量:把纯化产物的样品稀释一定的倍数后,分别在260nm和280nm下测其光吸收值,回收得到的DNA的浓度可按以下公式来计算: DNA浓度=光吸收260×50×稀释倍数μg/ml长度大于500bp的片段通常能纯化得到80%的产量. 而50bp~500bp的带则可达到55%~80%的回收率.(光吸收260/光吸收280)的比率是核酸纯度的一个标记.如果此值1.8,则意味着核酸的纯度>90%.另一方面,如果纯化产物的产量较低时,可以用琼脂糖EB电泳估算产物的浓度.载体。
