南开大学有机化学课件(王积涛版) 02
有机化学第一章PPT

A
B
A+
+
+
B -
异裂
(C H3)3C C l
(C H3)3C + C l
发生异裂的反应条件是有催化剂、极性试剂、
极性溶剂存在。
异裂的结果产生了带正电荷或负电荷的离子。
发生共价键异裂的反应,叫做离子型反应或异 裂反应。
32
周环反应(协同反应): 反应经环状过渡态,旧键的断裂和新键 的生成同时进行。
11
1.原子轨道(Atomic orbital):
四、化学键
(1) 每个轨道最多只能容纳两个自旋反平行电子 (Pauli不相容原 理) (2) 电子尽可能占据能量最低的轨道,即能量最低原理.原子轨道 离核愈近,受核的静电吸引力愈大,能量也愈低 (1s<2s<2p<3s<3p<4s) (3) 有几个简并轨道而无足够的电子填充时,必须在几个简并轨 道逐一地各填充一个自旋平行的电子后,才能容纳第二个电子 (Hund 规则) 12
第二部分:烃的衍生物
第三部分:结构鉴定
第四部分:天然有机化合物
3
参 考 资 料
《有机化学》王积涛,胡青眉,张宝申,王永梅 南开大学出版社 《有机化学》(第二版)钱旭红主编
化学工业出版社
《有机化学习题精解与考研指导》章烨,黄孟娇
上海交通大学出版社
《有机化学习题解》张宝申,庞美丽
南开大学出版社
4
怎样学好有机化学
平均值:(423+439+448+347)÷4=414kJ/mol 因此,C—H的键能为414kJ/mol
化学键的键能越大,键越牢固。
24
3. 键角
有机化学第一章、第二章 绪论及烷烃(陈青)

Organic Chemistry
教材:王积涛 主编 南开大学出版社
第一章 绪论
1.1 有机化学的发展
有机化学是化学科学的一个分支,是与人类生活有着
极其密切关系的一门学科,它的研究对象是有机化合
物。其发展自19世纪初期至今已有200多年历史。
一、有机化合物
什么是有机化合物呢? C8H18 、C15H32 、C2H5OH 、C6H12O6 、CH3COOH
因此,有机化学中,有机合成占有独特的核心地位:
如:1973年,Woodward等近百人历时11年完成的VB12全合成
(获诺贝尔化学奖); 1989年美国Harvard大学kishi教授等完成海葵毒素 (palytoxin) 的全合成。
C63H90N14PCo
三、有机分子结构理论及其发展
为了研究有机化合物的性质,需要进行分子结构 的研究: ● 1856年德国化学家凯库勒(F· Kekule)和英国有机 A· 化学家库帕(A· Couper)分别提出了“碳的四价概 S· 念”和“碳碳可以相互结合成键”的学说。为有机
•生命科学(生物化学,分子生物学等)
•医药学(药物化学,病理学,药理生化分析等)
•农业(农业化学,农用化学品等)
•石油(石油化工等)
•材料科学(高分子化学,功能材料等)
•食品(食品化学,营养学,添加剂等)
•日用化工(染料,涂料,化妆品等)
有机合成化学 天然有机化学 生物有机化学 金属与元素有机化学 物理有机化学 有机分析化学 药物化学 香料化学 农药化学 有机新材料化学 ...... 等学科
八隅体规则(或称八电子规则)是化学中一个简单的 规则,它指出各个原子趋向组合,令各电子的价层 都拥有八个电子,与惰性气体拥有相同的电子排列。 主族元素,如碳、氮、氧、卤素族、钠、镁都依从 这个规则。简单而言,当组成离子或分子的组成原 子的最外电子层有八个电子,它们便会趋向稳定。
有机化学第一章完整课件

structure)
1.2.3 共价键(covalent bond)理论与杂
化轨道
1 未成对电子(注意!)又称价电子、
未共用电子.
2
价键法(Valence Bond Theory,
sigm a*1s( antibonding)
H 1 s
H 1 s
H 2 s ig m a1 s( b o n d in g )
原子核外电子排布遵循的规则 (1) 能量最低原理 (Aufbau principle, 电子尽可能占 能量最低轨道. Aufbau是德文,“建筑”) (2) 保里不相容原理
σ键头碰头、π键肩并肩 为什么用这两个字母(一个是对称 symmetrical,一个是平行parallel)
单键(single bond)一定是 σ键,σ键能独立存在. 烯烃双键(double bond) 里一定是一根σ键、 一根π键. π键不独立存在。 炔烃叁键(triple bond) 一定是一根σ键、两根π键
多名博士研究生及博士后研究人员。2006年1月24日 18时10分逝世,终年88岁
参考书
大学有机化学基础 ,荣国斌等
编,华东理工大学出版社,化 学工业出版社,2006 有机化学,伍越寰,修订版, 科技大出版社,2002 有机化学,胡宏纹(南京大 学),第三版, 高教出版社,
2006
伍越寰
伍越寰
(4)1931 Hückel 休克尔(1896-1984, Marburg马尔堡大学,Germany )用 量子化学法解决芳烃结构.
1933 英国Ingold 英果 尔德(1893-1970, University College, London) 用化学动力学法研究 亲核 取代反应机理.
南开最新有机化学课件

南开最新有机化学课件(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如成语大全、谜语大全、汉语拼音、经典美文、教案大全、合同范本、话题作文、写作指导、试题题库、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as idioms, riddles, Chinese Pinyin, classic American, lesson plans, model contracts, topic compositions, writing instructions, test question bank, and other materials. If you want to know different data formats and writing methods, please pay attention!南开最新有机化学课件实验一乙酸乙酯的制备一、实验目的1、通过学习乙酸乙酯的合成,加深对酯化反应的理解;2、了解提高可逆反应转化率的实验方法;3、掌握蒸馏、分液、干燥等操作。
《有机化学》第三版王积涛课后知识题目解析南开大学(无水印版本)
不反应
(5) HBr
CH 3
H Br
CH3
C H3- C= C H2
CH 3C- CH 3
Br
2- -2-
(6) HBr(
)
CH3 HBr CH3-C=CH2
CH3 Br CH3CH-CH2
1- -2-
(7) HI
CH3 HI
CH3-C=CH2
CH3 CH3C-CH3
I
2- -2-
(8) HI (
)
|CH3
CH3-CH-CH-CH2CH2-C-CH2CH3
||
|
3) H3C CH3
CH2CH3
2,3,6-三甲基-6-乙基辛烷
2,3,6-trimethyl-6-ethylocta ne
|CH3
CH3 |
4) CH3CH2CHH23-|CCH-|CC-HC3H2-CHCH2CH3
3,5,5,6-四甲基壬烷
( E) -1- -2- -2(E)-1-chl oro-2-methyl -2-butene
(3) (CH3)3CCH=CH2 3,3-
-1-
3,3-di methyl-1-butene
(4) CH3CH2 C=C CH2CH2CH3
-3-
H
H
3.
(1) H2,Ni
CH3 CH3-C=CH2
H2,Ni
3,5,5,6-tetra met hylnonac e
3、不要查表,试将下列烃类按沸点降低的次序排列。
① 3,3-二甲基戊烷 ②正庚烷 ③2-甲基庚烷 ④正戊烷 ⑤2-甲基已烷
沸点降低次序为:③>②>⑤>①>④ 4、写出下列化合物氯代时的全部产物的构造式及比例。
南开大学有机化学课件(王积涛版) 02

Alkane烃:由碳氢两种元素组成的化合物烷烃 烯烃 脂肪烃 炔烃 烃 芳香烃 脂环烃§1 烷烃的结构及表示式碳的核外电子排布C 1S2杂化轨道理论C 1S2 2S1 2P32S22P23SP3杂化轨道4甲烷结构H H C H H 构造式CH4 简式5乙烷结构H H H C C H H H 构造式CH3CH3 简式C2H6 分子式6乙烷透视式H H H H乙烷纽曼式H H架锯式H H H H H H7构象异构体H H H H交叉式σ键的自由旋转所产生的不同空间形象H H稳定性:交叉式>重叠式后碳绕C-C键旋转180oH HH H HH重叠式8丁烷的构象分析H2 H2 CH3 C C CH31 2 3 44CH3 H H H14 C3 绕C2 -C 3 键旋转60oHHCH3 HH H H4H CH360o160oH HH H CH3 CH31 4H CH3H CH31CH3反式交叉反错重叠邻位交叉顺式重叠稳定性:反式交叉>邻位交叉>反错重叠>顺式重叠91021§4烷烃的物理性质Phsical Properties of Some Unbranched Alkanes22Physical Properties of the Isomeric Alkanes of Molecular Formula C 6H 14色散力-范德华力瞬间偶极相互作用瞬间偶极228326. 反应活性与自由基稳定性的关系自由基的结构氢的反应活性:3o H >2o H > 1o H > CH 4自由基稳定性:3o > 2o > 1o > CH 3.33自由基的结构哈蒙特(Hammond)假说早期过渡态后期过渡态3536poor antiknock good antiknockC37。
《有机化学》第三版_王积涛_课后习题答案_南开大学(无水印版本)汇编

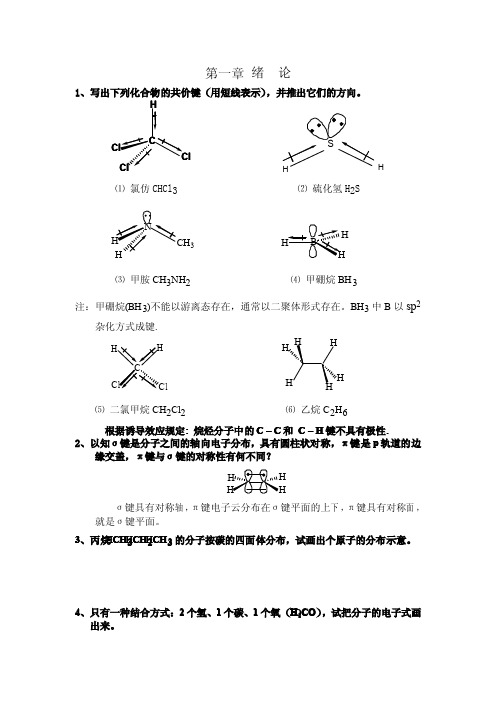
第一章绪论1、写出下列化合物的共价键(用短线表示),并推出它们的方向。
lCH⑴氯仿CHCl 3⑵硫化氢H 2S3H⑶甲胺CH 3NH 2⑷甲硼烷BH 3注:甲硼烷(BH 3)不能以游离态存在,通常以二聚体形式存在。
BH 3中B 以sp2杂化方式成键.l⑸二氯甲烷CH 2Cl 2⑹乙烷C 2H 6根据诱导效应规定:烷烃分子中的C–C 和C –H 键不具有极性.2、以知σ键是分子之间的轴向电子分布,具有圆柱状对称,π键是p 轨道的边缘交盖,π键与σ键的对称性有何不同?σ键具有对称轴,π键电子云分布在σ键平面的上下,π键具有对称面,就是σ键平面。
3、丙烷CH C H 3CH C H 2CHC H 3的分子按碳的四面体分布,试画出个原子的分布示意。
4、只有一种结合方式:2个氢、1个碳、1个氧(H 2CO C O ),试把分子的电子式画出来。
5、丙烯CH 3CH =CH 2中的碳,哪个是sp 3杂化,哪个是sp 2杂H OH 化?33226、试写试写出丁二烯分子中的键型:CH 2 = CH __ CH = CH 2σ-σ- σ- π-π- 7、试写出丙炔CH 3C≡CH中碳的杂化方式。
你能想象出sp 杂化的方式吗?332根据杂化后形成的杂化轨道有着最佳的空间取向,彼此做到了最大程度的远离,可想像2个sp 杂化轨道之间的夹角应互为1800,sp 杂化的碳原子应为直线型构型。
8、二氧化碳的偶极矩为零,这是为什麽?如果CO 2遇水后形成HCO 3-或H 2CO 3,这时它们的偶极矩还能保持为零吗?碳酸分子为什麽是酸性的?化合物分子的偶极矩是分子中所有键偶极矩的矢量和,二氧化碳分O = C = O 子中两个碳氧键的偶极矩大小相等、方向相反,故二氧化碳分子的偶极矩为零。
C -O O O -C HO O O H-2H+-O H 碳酸和碳酸氢根的偶极矩不为零。
碳酸根中的氧电负性比较大,具有容纳负电荷的能力。
换言之:碳酸失去H +后形成的共轭碱碳酸根负离子比较稳定,所以碳酸分子显示酸性。
南开大学有机化学课件(王积涛版) 24

(H.House)反应]
3.格氏(V.Grignard)试剂法
R'X:为饱和卤代烃时,产率不太高 4.柯尔伯法(Kolbe) H.Kolbe (1818-1884)于1849年将高浓度的羧酸钠盐或钾盐溶 液进行电解,在阴极产生烷烃。
在五或六个碳原子烷烃的异构体中含有季碳原子的可加上" 新某烷"
衡量汽油品质的基准物质异辛烷则属例外,因为它的名称沿用 日久,已成习惯了。
H3C
CH3
CH3
C
CH2
C H
CH3
CH3
2. 烷基 烷烃分子从形式上消除一个氢原子而剩下的原子团称为烷基, 通常用R-表示。
系统命名法(IUPAC命名法)
第四节 烷烃的构象
1.乙烷的构象 由于乙烷是由一个C-Cδ键,六个C-Hδ键连接形成的,δ 键单键可绕键轴旋转。所谓构象是指有一定构造的分子通过 单键的旋转,形成的各原子或原子团在空间的排布。由于单 键的旋转,使连接在碳上的原子或原子团在空间的排布位置 随之发生变化,所以构造式相同的化合物可能有许多构象。 它们之间互为构象异构体。
分子式相同,而构造不同的异构体称为构造异构 体。 在烷烃分子中随着碳原子数的增加,异构体的数目 增加得很快。对于低级烷烃的同分异构体的数目和 构造式,可利用碳干不同推导出来。
以己烷为例其基本步骤如下; 写出这个烷烃的最长直链式:
(省略了氢)
写出少一个碳原子的直链式作为主链把剩下的碳当 作支链。依次当取代基连在各碳原子上,就能写出 可能的同分异构体的构造式。
它们的空间取向是分指向四面体的顶点。Sp3轨道的对 称轴之间互成109.5o。
3.烷烃分子的形成
大学科目《有机化学》各章节课件

3
芳香烃的性质
具有较高的熔点和沸点,难溶于水,易溶于有机 溶剂;具有共轭体系和电子离域效应,容易发生 亲电取代反应。
芳香烃的命名与分类
芳香烃的命名
01
以苯环为母体,根据取代基的不同进行命名,如甲苯、二甲苯
医药化学
研发新药、合成药物中间体等, 用于治疗疾病和保障人类健康。
农业化学
合成农药、肥料等,提高农作物 产量和品质,保障粮食安全。
环境科学
研究有机污染物的来源、迁移转 化和治理方法,保护生态环境。
02 烷烃
烷烃的结构与性质
结构特点
化学性质
碳原子之间以单键相连,形成链状或 环状结构;每个碳原子上的剩余价键 均与氢原子相连。
卤代烃的反应与合成
反应类型
卤代烃的反应类型丰富多样,主要包括亲 核取代反应、消除反应、还原反应以及与 金属有机化合物的反应等。这些反应在有 机合成中具有重要的应用价值,可用于构 建碳碳键、引入或转化官能团等。
VS
合成方法
卤代烃的合成方法主要有两种:一种是通 过烃类的直接卤化反应得到相应的卤代烃; 另一种是通过烯烃或炔烃与卤化氢的加成 反应得到卤代烷。此外,还可利用醇与氢 卤酸的取代反应制备卤代烃。在实际合成 中,需根据目标产物的结构和性质选择合 适的合成路线和反应条件。
03 烯烃
烯烃的结构与性质
01
烯烃的通式与结构特点
烯烃是一类含有碳碳双键的烃类化合物,通式为CnH2n。其结构特点
包括碳碳双键的存在以及与之相连的四个原子共平面。
02 03
烯烃的物理性质
烯烃的物理性质与其分子量和双键位置有关。一般来说,随着分子量的 增加,烯烃的沸点、熔点和密度逐渐升高。双键位置对物理性质也有影 响,如顺式异构体的沸点通常高于反式异构体。
南开大学有机化学课件(王积涛版) 08

Slow
(CH3)3COH + HBr (CH3)3C + Br
Step 2 Step 3
(CH3)3C + HOH
fast (CH3)3COHH
(CH3)3COHH
-H+ fast (CH3)3COH
CH3
C
H3C CH3
19
20
2. SN2 Bimolecular Nucelophilic Substitution
Weak bases are good leaving groups
如何判断离去基团的碱性!--其共轭酸的酸性! 例:酸性 HI>HBr>HCl>HF 碱性 F->Cl->Br->I- 离去能力 I->Br->Cl->F-
亲核取代反应活性RI>RBr>RCl>RF
31
3. 亲核试剂的亲核性 SN1: 反应速度与亲核试剂的亲核性; SN2: 亲核试剂的亲核性强,反应快 影响试剂亲核性的因素? (1) 试剂的碱性—碱性强,亲核性也强
CH3Cl + NaOH H2O CH3OH + NaCl
Rate = k [CH3Cl][HO-] mol L-1S-1 Mechanism
21
Molecular-orbital description of the SN2 reaction
22
Potential
energy
diagram for an SN2 reaction. The process
5
§2 物理性质
1. The C-X bond is polarized Haloalkanes have higher boiling points than the corresponding alkanes
《有机化学》(王积涛第二版上册和下册)学习笔记_合并

酸是电子的受体,碱是电子的给体。
NH3 + BF3
碱酸
H3N- BF3
酸碱加和物
5
有机化学笔记
有机反应的类型:
按断键的方式分为均裂和异裂,此外还有协同
1 均裂反应-自由基反应
AB
AB
2 异裂反应-离子型反应
AB
3 协同反应-成键断键同步发生
≠ +
AB
第二章 烷烃(alkane)
开链饱和烷烃通式:CnH2n+2 同系列:结构相似,通式相同组成上差若干个 CH2 的一系列化合物 同系物:同系列的各化合物互为同系物 构造:分子中原子间相互连接的方式和次序 构象:由于键的旋转而产生的分子中原子或原子团在空间上的不同排 列方式(交叉式和重叠式是两种极限式) 命名法: 1 选最长的、取代基最多的为主链 2 从支链最近处开始编号 3 较优基团后列出 4 支链编号最小原则 较优基团的次序原则: 1 原子序数大较优
(SP、SP2、SP3) Br ö nsted 酸碱理论: 酸是质子的给体,碱是质子的受体。
HCl
H
Cl
酸Leabharlann 共轭碱NH3H
碱
N H4
共轭酸
酸强度用酸在水中的解离常数 Ka 来测定,碱也一样。
HA + H2O
H3O + A
Ka =
A
H3O
HA
PKa=-lgKa PKa<4 强 酸 PKa>4 弱
酸
Lewis 酸碱理论:
有机化学
王积涛第二版
课本笔记及自学心得
有机化学笔记
目录 引言................................................................................................. 2 第二章 烷烃(alkane).................................................................... 6 第三章 烯烃(alkene).................................................................... 9 第四章 炔烃和二烯烃(alkyne&alkadiene)......................... 15 第五章 脂环烃(alicylic hydrocarbon)................................... 19 第六章 芳烃(aromatic hydrocarbon)....................................... 22 第七章 立体化学(stereochemistry).........................................27 第八章 卤代烃(halide hydrocarbon)....................................... 29 第九章 醇和酚(alcohol&phenol).............................................35
南开大学有机化学课件(王积涛版) 18

Concerted Reactions1协同反应-反应中旧键的断裂与新键 的形成协同进行的反应 特点-不受溶剂,催化剂等的影响 经历环状过渡态,没有中间体产生 电环化反应, 环加成反应,σ迁移反应2§1 电环化反应Electrocyclic Reactions一、定义及反应特点电环化反应-开链共轭多烯在一定条件下(热或光) 环合及其逆反应hνhν特点-具有高度的立体专一性3CH3CH3 CH3hνH CH3 HCH3 CH3CH3CH3 CH3 hνH CH3 HCH3 CH3立体专一性决定于:多烯中双键的数目;反应的条件 是加热或光照4二、立体选择性的解释1、前沿轨道CH2=CH-CH=CH2LUMO-Lowest Unoccupied Molecular OrbitalHOMO-Highest Occupied Molecular Orbital前沿轨道-HOMO, LUMO 1,3-丁二烯π分子轨道 基态5CH2=CH-CH=CH-CH=CH2π6π5LUMOπ4LUMOHOMOπ3HOMOπ2π11,3,5-己三烯π分子轨道基态激发态62、立体选择性解释电环化反应立体选择性由前沿轨道的对称性决定 1,3-丁二烯型化合物 CH2=CH-CH=CH2 A 热电环化反应HOMO π2顺旋H3C HH3CCH3HCH3H3CH H3CH7B 光照下的电环化反应hνHOMO π3对旋H3C Hhν H3C HCH3 CH3H3CH H3CH81,3,5-己三烯型化合物 A 热电环化反应CH2=CH-CH=CH-CH=CH2HOMOπ3对旋CH3H H3C H3CCH3H3CH H3 CHH9B 光照下的电环化反应HOMOπ4顺旋hν H H3C H3C HCH3CH3H3C H H3C H10电开环反应的立体选择性开环反应的立体选择性与环合时相同 如1,3-丁二烯环合时有四个电子参与反应,那么涉及四个电子的开 环反应的立体选择性与它环合时相同,即加热为同旋,光照为对旋CH3CH3H3 C HH3CHCH3CH3hν H3CH H3C Hhν 1,3-丁二烯1,3,5-己三烯4个π电子6个π电子顺旋(同旋)对旋对旋顺旋(同旋)11Woodward-Hoffmann Roleshν 4n个π电子 (4n+2)个π电子hνH H顺旋(同旋) 对旋对旋 顺旋(同旋)HH12HOMO π3HH HHH4个π电子的开环H6个π电子的关环HHH H H HH H H HH H H HH4个π电子的 顺旋开环6个π电子的对旋关环13§2 环加成反应 Cycloaddition Reactions+ hν[2+2]环加成+[4+2]环加成14一、[4+2]环加成CO2Et + CO2EtCO2Et + EtO2C CO2Et CO2EtCO2Et CO2Et特点:高度的立体专一性15HOMO π2LUMO π2轨道同面/同面 加成-新形成 的两个键在同 一面上LUMO π3HOMO π116一般情况下,只要参与反应的π电子数符合(4n+2), 在加热条件下均可进行同面/同面环加成O + O[4 + 6]NN+ CH3O2C CO2CH3CH3O2C CO2CH3[8 + 2]17区域选择性G +LG LG 给电子取代基L 拉电子取代基G + LG L18N(C2H5)2 +C2H5O +CO2CH3N(C2H5)2 CO2CH3C2 H5O CO2CH3 CO2CH3CO2CH3 + CO2CH3CO2C2 H5 N N CO2C2 H5CO2CH3 CO2CH3+N CO2C2H5 N CO2C2H519RCN2 RN3R2C N N RN N NR2C N N RN N NN NH2C N N + H3C EtO2CO2NH2C H3CCO2EtCO2Et CH3CH3 CO2EtN N N+NN NNO220二、[2+2]环加成HOMO π1 异面x+No ReactionLUMO π2同面热禁阻hνHOMO π2+光允许LUMO π2同面同面21+ Ohν O H3C CH3CO2Et hνCO2Et一般情况下,只要参与反应的π电子数符合4n,在 光照条件下也可进行同面/同面环加成hν [10 + 2] + CH3O2C CO2CH3 CH3O2C CO2CH322§3 σ迁移-Sigmatropic ReactionsZ C C C1 2 3Z CZ CZ C C C1 2 3[1,3]-σ迁移Z C C C C C1 2 3 4 5Z C C C C C1 2 3 4 5[1,5]-σ迁移Z C C C nC C1 2 3Z C C C C nC1 2 3[1,j]-σ迁移 [3,3]-σ迁移 Cope重排23C C C C C C1 2 3C CC C C C C C1 2 3[1,j]- σ迁移同面异面2425具有奇数个轨道的自由基基态时HOMO轨道节点通过该碳,它的p轨 道对形MO轨道没有贡献C C C CCCC C C C CCCCCCCCC C C C C C CC C C C C C C C=C特点:在这些具有奇数个轨道的自由基基态 的HOMO轨道中,节点正好通过偶数碳原子26H [1,3]-H迁移 C C CHH C C C ??几何角度考虑,在加热 条件下[1,3]-H迁移困 难,张力太大H异面H hν C C CHH C C CH光照下[1,3]-H 迁移是允许的同面27[1,5]-H迁移H C C C C C1 2 3 4 5H C C C C C1 2 3 4 5HH同面加热条件下[1,5]H迁移易发生28H3C5 4 3H1 2CH3 [1,5]-H迁移 R.T H HCH3 [1,5]-H迁移 R.T H H 3-甲基环戊二烯CH35-甲基环戊二烯1-甲基环戊二烯NaH CH3CH3I+ H3C CH3 CH3CH3 + CH329CH3hν H HOHO7−脱氢胆固醇hν维生素D3[1,7]-sigmatic antarafacial reactionCH3HO30[3,3]-σ迁移-Cope重排2 1 1' 2'CH33 3'[3,3]-σ迁移CH3CH3 H CH3 H HCH3 H CH3CH3 H CH3 H31[3,3]-σ迁移热允 许,光禁阻的32OOOHOOHHOO33Claisen重排H2C H2C C CH2 H [3,3]-σ迁移 H O O C CH2 CH2 CHO C CH2 H H C CH2OCH=CH2OH CH-CH=CH2 CH3OH CH3OO-CH2-CH=CHCH3OCH3 CH-CH=CH2 HO-CH2-CH=CHCH3 CH3O OCH3OCH334CH2-CH=CHCH3ProblemExplain whether this reaction is allowed or forbidden and predict whether the reactant or product is favored at equilibrium.Solution: It’s a [3,3]-sigmatropic rearrangement and is thermally allowed. The reactant is favored at equibrium because it has less angle strain.35。
南开大学高等有机化学课件第四章有机反应机理的研究和描述-二

可以计算出Benson双自由基能量比过渡态高大约6 kcal/mol。
真正的单线态双自由基能量预计还要高些。
因此有理由可以排除双自由基作为反应中一个允许的中间体可能性, 但是,通过计算来排除却不像通过实验来排除那么严格。这只是因 为计算方法中引入的附加假设太多。这一点是不容忽视的
2. 周环反应和双自由基反应对∆H的取代基效应 有些特定类型的反应很难被包括到Benson基团加成法中。 其中的一种是周环反应,包括环加成反应、电开环反应和迁移反
应用∆V测量的一个典型是对-丙酸内酯在酸性介质中水解反应的 研究。 ∆V的实验值是2.5土2 cm3· mol-1。 机理B 应该有∆V < 0,因为过渡态中电荷的分离会引起静电吸引 现象。这样,机理A和机理B都被排除了 剩下了C。酸度函数研究的结果也有利于这样一个机理.
机理A,应该有∆V < 0,因为其决速步过渡态中加进了一个水分子。
当所假设的双自由基算出的其生成焓总是大于所测定的一个反应的 过渡态的生成焓时,从基团加成法所得到的结论是最消楚的。
环己烯通过反D—A反应生成丁二烯和乙烯的反应就是一个例子; 可以提出一个双自由基中间体。
计算得出双自由基的生成焓(包括Doering修正)是69.0 kcal/mol。 环己烯的生成焓的实验值∆Hf=-0.8 kcal/mol。 反应的活化焓实验值为63.9 kcal/mol,
4.6
活化参数的解释
三个常用的方程,描述温度与速率常数的关系:
遗憾的是,这三个模型不能取一个统一的n值。
Arrhenius方程中, n=0;
碰撞理论。 过渡态理论中, n=1/2; n=1。
只有幂项才真正控制k对温度的依赖,因此这三个方程中的任一个 都可以用来解释一套实验数据。这种不一致还可以提醒大家,用于 描述某个反应的活化参数的选择是相当任意的。 我们将使用过渡态模型(Eyring方程), 因为参数∆S和∆H可以很方便 地与它们的热力学项∆S和∆H联系起来,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Alkane
烃:由碳氢两种元素组成的化合物
烷烃 烯烃 脂肪烃 炔烃 烃 芳香烃 脂环烃
§1 烷烃的结构及表示式
碳的核外电子排布
C 1S
2
杂化轨道理论
C 1S2 2S1 2P3
2S
2
2P2
3
SP3杂化轨道
4
甲烷结构
H H C H H 构造式
CH4 简式
5
乙烷结构
H H H C C H H H 构造式
CH3CH3 简式
C2H6 分子式
6
乙烷透视式
H H H H
乙烷纽曼式
H H
架锯式
H H H H H H
7
构象异构体
H H H H
交叉式
σ键的自由旋转所产生的不同空间形象
H H
稳定性:交叉式>重叠式
后碳绕C-C键旋转180
o
H H
H H HH
重叠式
8
丁烷的构象分析
H2 H2 CH3 C C CH3
1 2 3 4
4
CH3 H H H
1
4 C3 绕C2 -C 3 键旋转60o
HH
CH3 H
H H H
4
H CH3
60o
1
60o
H H
H H CH3 CH3
1 4
H CH3
H CH3
1
CH3
反式交叉
反错重叠
邻位交叉
顺式重叠
稳定性:反式交叉>邻位交叉>反错重叠>顺式重叠
9
10
21
§4
烷烃的物理性质
Phsical Properties of Some Unbranched Alkanes
22
Physical Properties of the Isomeric Alkanes of Molecular Formula C 6H 14
色散力-范德华力
瞬间偶极相互作用
瞬间偶极
2
28
32
6. 反应活性与自由基稳定性的关系自由基的结构
氢的反应活性:
3
o H >2o H > 1o H > CH 4
自由基稳定性:3o > 2o > 1o > CH 3.
33
自由基的结构
哈蒙特(Hammond)假说
早期过渡态
后期过渡态
35
36
poor antiknock good antiknock
C
37。
