胡波元素-16碳硼及其化合物
第十二章碳硼族元素

含氧酸及其盐
• 化学性质: 氧化性:顺序与氧化物相同 还原性,与氧化物顺序相同(低氧化态) 不稳定性:所有酸和氢氧化物均不稳定,受热 易脱水成氧化物。 • 制备:盐与酸碱作用 • 用途:用于制备氧化物和分离 • 一些盐类 碳酸盐:热分解 硅酸盐:玻璃及孔道结构(分子筛) 硼酸盐:玻璃,硼砂珠实验
氢化物
• 结构:RH4;R2H6;结构说明:sp3 杂化,正四面体, 非极性分子,键能从上到下也迅速减小。 • 物理性质:熔沸点低,从上到下依次升高 (分子晶体); 水溶性均很小(非极性分子)。 • 化学性质: 酸性:水溶液中一般不表现出来 缺电子化合物(硼氢化合物) 还原性:从上到下增强;除CH4在空气中需点燃外, 其余均可自燃,生成相应氧化物和水: SiH4 + 2O2 = SiO2 + 2H2O B2H6 + 3O2 = B2O3 + 3H2O R-H键弱,很易水解(CH4除外): SiH4 + 4H2O = H4SiO4 ↓+ 4H2 B2H6 + 6H2O = 2B(OH)3 + 6H2
单 质 的 性 质
• 化学性质: N2 C,B,Si, Ge非常稳定,其余相对较活泼, 不同同素异形体差异很大。 同素异形体的形成方式: 成键方式上的差异引起同素异形体。此类同素 异形体的物理性质和化学性质差异均很大,如 红磷和白磷,金刚石和石墨,氧和臭氧等; 分子结构一样,但晶体堆积方式不同引起的同 素异形体。此类同素异形体的化学性质完全一 样,仅物理性质稍有不同,如单斜硫和正交硫 (斜方硫)。
-4,2,4
氮族元素
-3 1 3 5
失去电子
得到电子 共用电 对
易
不能单独 得到
高考化学一轮复习专题十六碳、硅及其化合物无机非金属材料考点二二氧化硅和二氧化碳教学案

eq \a\vs4\al(考点二 二氧化硅和二氧化碳 )1 一氧化碳CO 是无色无味有毒气体,不溶于水,可用作气体燃料与冶金工业复原剂。
(1)燃烧化学方程式为2CO +O 2=====高温2CO 2。
(2)复原CuO 化学方程式为CO +CuO=====△Cu +CO 2。
2 二氧化碳与二氧化硅比拟 CO 2+H 2O H 2CO 3与盐反响 H 2O +CO 2(缺乏)+Na 2SiO 3===H 2SiO 3↓+Na 2CO 3,2H 2O +2CO 2(足量)+Na 2SiO 3===H 2SiO 3↓+2NaHCO 3SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑与碱性氧化物反响 CO 2+Na 2O===Na 2CO 3SiO 2+CaO=====高温 CaSiO 3 制备 ①工业制法:CaCO 3=====高温CaO +CO 2↑;②实验室制法:CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑— 3 主要用途CO 2:制饮料、碳酸盐,干冰用作制冷剂。
SiO 2:作光导纤维,制光学仪器、电子部件,水晶可制作饰品。
学霸巧学卡(1)不能依据反响2C +SiO 2=====高温Si +2CO↑来说明C 复原性比Si 强,也不能依据反响SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑来说明SiO 2水化物酸性比H 2CO 3强。
由于酸性:H 2CO 3>H 2SiO 3,因而向Na 2SiO 3水溶液中通入CO 2生成H 2SiO 3,而高温下:SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑,该反响熵值增加,驱动反响向右进展。
(2)氢氟酸能腐蚀玻璃并用于雕刻玻璃,盛放氢氟酸不用玻璃瓶而用塑料瓶。
盛放碱性溶液试剂瓶不能用玻璃塞,因为SiO 2与碱溶液反响生成具有黏性Na 2SiO 3。
(3)水晶、石英、玛瑙主要成分为SiO 2;固态CO 2俗称干冰。
炭族元素

中放电, 用纯石墨作电极,在Ne中放电,电弧中产生的碳烟沉 纯石墨作电极, 中放电 积在水冷反应器的内壁上, 这种碳烟中存在着C 积在水冷反应器的内壁上, 这种碳烟中存在着 60 、 C70 等碳原子簇。 等碳原子簇。
温室效应成因
“温室效应”,是由包括 CO2 分子在内的某些多原子分子(其他如 2O 温室效应” 分子在内的某些多原子分子(其他如N 温室效应 氯氟烃)在大气中含量的上升造成的.在过去 大气中CO2 浓度 在过去, ,CH4,氯氟烃)在大气中含量的上升造成的 在过去 大气中 大体保持着平衡,随着工业化的进程, 大体保持着平衡,随着工业化的进程, CO2 增加的速度大于渗入海洋 深处与Ca 沉淀的速度. 深处与 2+结合成 CaCO3 沉淀的速度 太阳的可见光和紫外光穿过大气 层射至地球表面, 层射至地球表面,在地球表面产生的红外辐射却被这类多原子分子吸收 而无法迅速逸散到外层空间去,使到地球变暖. 但是, 而无法迅速逸散到外层空间去,使到地球变暖 但是,要确定地球是否 变暖并非易事, 变暖并非易事,长期和短期的气候变化可能掩盖了温室效应产生的结果 . 另外,现在的问题是地球是否在变暖? 另外,现在的问题是地球是否在变暖?
•1985年9月R.E.Smalley等在氦的脉冲气流里用激光气化石墨 年 月 等在氦的脉冲气流里用激光气化石墨
生成碳簇合物C 生成碳簇合物 60、C70。获1996年诺贝尔奖。 年诺贝尔奖 最稳定,其笼状结构酷似足球, 富勒烯中以C60 最稳定,其笼状结构酷似足球,相当于 一个由二十面体截顶而得的三十二面体。 一个由二十面体截顶而得的三十二面体 。 32 个面中包括 12 个六边形面, 个五边形面和20个六边形面,每个五边形均与5个六边形共 个五边形彼此隔开。与石墨相似, 边,而六边形则将12个五边形彼此隔开。与石墨相似,C60 分子中每个 C 原子与周围三个 C 原子形成 3 个σ键,剩余 的轨道和电子共同组成离域 π 键,可简单地将其表示为每 个双键。 个C原子与周围3个C原子形成2个单键和1个双键。
第13章 硼族元素和碳族元素

第13章 p区元素(一)—硼族和碳族
第一节 第二节 第三节 p区元素概述 硼族元素 碳族元素
8
二、单质硼
晶体硼惰性,无定形硼稍活泼, 高温下显还原性。
H3BO3 浓HNO3 X2 O2 BX3
+1, +3 +1, +3
浓H2SO4 H3BO3 NaOH Na2BO2+H2
B
B2O3 H2O(g) H3BO3+H2
单质硼的化学反应
9
1.与非金属反应 室温:2B(s) + 3F2(g) = 2BF3 高温下与O2、N2、S、Cl2、Br2、I2等反应: 4B(s) + 3O2(g) = 2B2O3(s)
◆
加 合: B2H6+2:PF3=2[H3B← PF3]
B2H6+2:CO=2[H3B ←CO] B2H6+2:NH3= 2[H3B ←NH3]
◆
还原性:B2H6+3O2 == B2O3+3H2O
△ rH m
ө
B
◆
= -2034 kJ·mol-1
B2H6+6X2 == 2BX3+6HX
H B
20
水 解: B2H6+6H2O == 2H3BO3+6H2
△ rH m
ө
= -509.2 kJ·mol-1
21
3、 BX3的成键特征及性质
胡波化学竞赛题库-原子结构

中学化学竞赛试题资源库——原子结构A组1.在化学反应中,会发生变化的是A 质子数B 中子数C 电子数D 质量数2.下列各组物质中,互为同位素的是A 重氢、超重氢B 氧、臭氧C 红磷、白磷D 乙酸、丙酸3.元素R核电荷数为16,原子的质量数32,则R离子应包含A 16e-、16Z、16NB 18e-、16Z、16NC 18e-、18Z、16ND 16e-、16Z、18N4.符号3517Cl中左上角的“35”代表A 元素的质量数B 同位素的质量数C 元素的平均原子量D 元素的近似原子量5.原子核内的质子数决定了A 原子的质量数B 核外电子数C 核电荷数D 核内中子数6.有五种微粒分别是4019X、4018Z、4019Q+、4020R2+、4120M,它们属于几种元素A 2种B 3种C 4种D 5种7.下列各组微粒中,核外电子总数相等的是A K+和Na+B CO2和NO2C CO和CO2D N2和CO8.元素的种类和原子的种类A 前者大B 后者大C 相等D 不能确定9.某元素原子L层电子数是K层电子数的2倍,那么此元素是A FBC C OD N10.若用x代表一个中性原子中核外的电子数,y代表此原子的原子核内的质子数,z 代表此原子的原子核内的中子数,则对23490Th的原子来说A x=90 y=90 z=234B x=90 y=90 z=144C x=144 y=144 z=90D x=234 y=234 z=32411.据最新报道,放射性同位素钬16667Ho可有效地治疗肝癌。
该同位素原子核内的中子数与核外电子数之差是A 32B 67C 99D 16612.下列离子中,所带电荷数与该离子的核外电子层数相等的是A Al3+B Mg2+C Be2+D H+13.氢原子的电子云图中的小黑点表示的意义是A 一个小黑点表示一个电子B 黑点的多少表示电子个数的多少C 表示电子运动的轨迹D 电子在核外空间出现机会的多少14.A元素的离子A n-,其核外共有x个电子,该原子的质量数为y,则原子核内含有的中子数为A y-x+nB y-x-nC y+x+nD y+x-n15.在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目为A A+n+48+xB A-n-24-xC A-n+24-xD A+n+24-x16.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是A 57B 47C 61D 29317.136C-NMR(核磁共振)可以用于含碳化合物的结构分析。
碳族元素及其化合物
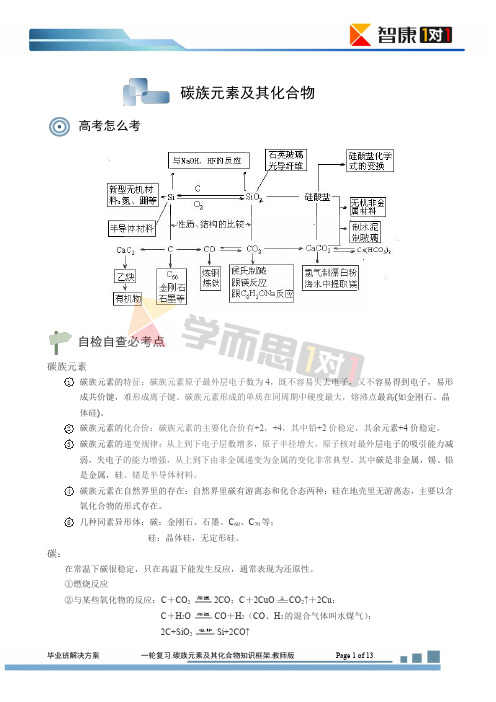
2 3
4
碳族元素在自然界里的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含 氧化合物的形式存在。 几种同素异形体:碳:金刚石、石墨、C60、C70 等; 硅:晶体硅,无定形硅。
5
碳:
在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。 ①燃烧反应 ②与某些氧化物的反应:C+CO2 C+H2O 2C+SiO2
碳族元素及其化合物
高考怎么考
自检自查必考点
碳族元素
1
碳族元素的特征:碳族元素原子最外层电子数为 4,既不容易失去电子,又不容易得到电子,易形 成共价键,难形成离子键。碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶 体硅)。 碳族元素的化合价:碳族元素的主要化合价有+2,+4,其中铅+2 价稳定,其余元素+4 价稳定。 碳族元素的递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减 弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。其中碳是非金属,锡、铅 是金属,硅、锗是半导体材料。
D.由于石墨转化为金刚石为吸热反应,因此石墨在任何条件下都不可能转化为金刚石 【解析】本题考查化学反应中的能量规律及其应用。用下一反应减去上一反应可得:C(金刚石) =C(石墨) △H=-1.9kJ·mol-1” ,说明等质量时金刚石的能量大于石墨,A 项错误;金刚石转化为石墨为放热 反应,B 项正确;石墨转化为金刚石为化学变化,C 项错误;石墨在一定条件下可能转化为金刚石, D 项错误。 【答案】B 【例 3】CaC2 和 ZnC2、Al4C3、Mg2C3、Li2C2 等都同属离子型碳化物,判断下列反应产物正确的是 A.ZnC2 水解生成乙烷(C2H6) C.Mg2C3 水解生成丙炔(C3H4) B.Al4C3 水解生成丙炔(C3H4) D.Li2C2 水解生成乙烯(C2H4)
4、碳、硼

石墨转化法可分为静态超高压高温法和动态法两种。
静态超高压高温法 用高压设备压缩传压介质产 生3~ 10 GPa的超高压,并利用电流通过发热体,将合成腔 加热到l000~2000℃高温。其优点是能较长时间保持稳定的 高温高压条件,易于控制。该法可得到磨料级金刚石,但设 备技术要求高。
硅 Si 14 3s23p2 +4(+2) 118 1.90
硼 B 5 2s22p1 +3 82 2.04
1-2 碳硅硼的结构特征
C成键形式 sp3杂化4个单键 C价键结构 正四面体
C
化合物举例 金刚石,CH4,CCl4
sp2杂化2个单键1个 平面三角形 石墨COCl2,C2H4 , C= 双键 C6H6 sp杂化: 1个单键1个叁键
① CH4极稳定,不与酸碱反应,而SiH4则被碱水解;
② CCl4极稳定,而SiCl4极易水解;
③ CO2是气体, SiO2是熔点极高的固体;
分子晶体 原子晶体 ④碳氢化物CnH2n+2 ,n很大,几乎可以无限扩大,而 SinH2n+2最高 n=15 ;
差别的原因:
①C—最高配位数为4,Si—最高配位数为6;
2 石墨及其石墨层间化合物
143pm
石墨
石墨具有层状晶体的结构。在晶体 中, C原子采用 sp2杂化轨道成键,彼此 间以 键连接在一起,同时在同一层上 还有一个大键。 同一层的碳C-C键长143pm,层与 层之间的距离为335pm。 石墨的碳原子层间有较大的空隙, 容易插入电离能小的碱金属和电子亲和 能大的卤素、卤化物及酸等,从而形成 石墨层间化合物(GIC)。
动态法 利用动态波促使石墨直接转变成金刚石。 动态冲击波可由爆炸、强放电和高速碰撞等瞬时产生,在被 冲击介质中可同时产生高温高压,使石墨转化为金刚石。该 法作用时间短 (仅几微秒 ),压力及温度不能分别加以控制, 但装置相对简单,单次装料多,因而产量高。产品为微粉金 刚石,可通过烧结成大颗粒多晶体,但质量较差。
胡波化学竞赛题库-元素周期表

中学化学竞赛试题资源库——元素周期表A组1.有X、Y、Z三种元素,X与Y可以形成XY、XY2两种化合物。
Z与X、Y分别形成XZ4和Z2Y两种化合物;在这两种化合物的分子中,总的电子数都为10个。
则X、Y、Z三种元素分别是A C、N、OB C、O、HC C、H、OD H、N、O2.某元素原子的最外层电子数与其电子层数相同,该元素的单质与酸反应放出氢气的物质的量比为2︰3。
该元素为A NaB MgC AlD K3.推测第八周期的最终未了元素的原子序数是A 168B 176C 170D 1694.第二周期的元素与氢元素所形成的常见的分子和阳离子中,电子总数为10的共有A 7种B 6种C 5种D 4种5.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是A 电子数B 最外层电子数C 电子层数D 次外层电子数6.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是A 半导体材料砷化镓B 吸氢材料镧镍合金C 透明陶瓷材料硒化锌D 超导材料K3C607.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是A HFB H3O+C NaHD H2O28.X、Y、Z三种主族元素的离子具有相同的电子层结构。
X的离子半径大于Y的离子半径,Y可与Z形成ZY2型的离子化合物,则三种元素原子序数的关系是A X>Y>ZB Z>X>YC Z>Y>XD Y>X>Z9.X、Y、Z是三种主族元素。
已知X m+与Y n-具有相同的电子层结构,Z m-半径大于Y n-半径,则它们的原子序数由大到小的顺序是A Z>X>YB X>Y>ZC X>Z>YD Z>Y>X10.A、B、C、D、E是同一周期的五种主族元素,A与B的最高氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物稳定性为C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的的顺序为A ABCDEB CDABEC BADCED ECDBA11.A、B、C、D、E是同周期的五种元素,A和B的最高氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是A CDEAB B ECDABC BAEDCD BADCE12.A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C -,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。
无机化学-硼族、碳族元素-硼化物、碳化物
碳化钨
C4-
6ห้องสมุดไป่ตู้位
N
Ph2P
N
N
Au
Au PPh2
Ph2P Au C Au PPh2
Au
Ph2P
Au
N
N
PPh2
N
+2Ag+ +2Cu+
王泉明 课题组
N
Ph2P
N
Ag
Au
N
Au PPh2
Ph2P Au C Au PPh2
Au
Ph2P N
Au
N
Ag
PPh2
N
Ph2P N
N
Cu
N
Ph2P
Au
Au
C Au
Au
PPh2 PPh2
Au
Ph2P N
Au
Cu
N
PPh2
N
CaO (s) + 3C (s) CaC2 (s) + CO (g) 2000oC Ca (l) + 2C(s) CaC2 (s) >2000oC 2Na (am) + C2H2 (g) Na2C2(s) + H2 (g)
碳化物
(2)共价型碳化物
B 和 Si 与碳形成机械硬度很大的共价型固体化合物 。 碳化硼和碳化硅是原子型晶体,都是硬质材料 。
(3)金属型碳化物
金属型碳化物具有金属的导电性和光泽。许多d区元素和f区 元素能形成金属型碳化物。 从价键的观点看,C 原子实际上进入金属原子空的d轨道而形 成的,金属原子空的d轨道越多,该金属与碳的结合力就越强, 它们的机械硬度和许多性质都表明存在强的M – C键 。 金属型碳化物是很有前途的硬质材料,但目前只有钨和钛的 碳化物 。
碳硅硼16CCBCB9E8C5F0

CO32-,ClO3-,NO3-,SO3等分子或离子具有相同的通 式:AX3,它们的总价电子数都等于24,因此它们有相同 的结构,即,它们是平面三角形分子,中心原子都取sp2杂 化,都有一套∏46键。
等电子体原理
SO42-,PO43-,ClO4-等离子属AX4型,总价电子数为32, 中心原子取sp3杂化轨道。中心原子上所有p能级的价 电子都参与杂化了,或者说,所有的p轨道都已用于形 成σ键,因此,分子里已经不可能有中心原子参与的p-p∏ 键。这些等电子体(32e)都是正四面体的,分子里的重键 是d-pπ键。
CO + 2 H2
Cr2O3,ZnO 623-673K
CH3OH
CO + 3H2
Fe/Co/Ni 523K,101KPa
CH4 + H2O
大
氧化物
气
污 染
(3)CO的配合性:由于CO分子中有孤对电子,
可物 对以作配体与一些有空轨道的金属原子或离子形成 人
配体 器合物。例如同VIB、VIIB和VIII族的过渡金属形成
(s2p)2],由一个s键,一个双电子p键和 一个电子来于O原子的p配键组成。
C
OC
O
氧化物
s2*p
CO分子中,电子云偏向
p*2p
氧原子,但是配键是由氧原子
的电子对反馈到碳原子上,这
s2p
样又使得氧原子略带正电性,
碳原子略带负电性,两种因素
p2p
相互作用使CO的偶极短几乎
s2*s
为零。正是因为碳原子略带负 电性使得孤电子对(体积稍大,
X-H键能都较大,它们都有一系列的氢化物。
碳、硅、硼的通性
碳、硅、硼的氧化态
碳族及硼族元素

4 铝的重要化合物
硫酸铝:
Al 2 (SO 4 ) 3
铝钾矾(明矾): KAl(SO 4 ) 2 12H 2 O
[Al(H2O)6 ]3
3 3 2-
[Al(OH)(H 2O)5 ]2 H
Ka 10-5.03
2Al 2S 6H 2 O 2Al(OH) 3 (s) 3H 2S(g) 2Al 3CO 3H 2 O 2Al(OH) 3 (s) 3CO 2 (g)
水解:
BX3 3H 2 O H 3 BO3 3HX (X Cl, Br, I) 4BF3 3H 2 O H 3 BO3 3H[BF4 ] BF3 HF HF BF3
2 卤化硅 SiX4 SiF4 聚集态 分子量 g 小 SiCl4 l SiBr4 l SiI4 s 大
硅酸
(1)制备:
Na 2SiO 3 2HCl H 2SiO 3 2NaCl Na 2SiO 3 2NH 4 Cl H 2SiO 3 2NaCl 2NH 3 (g)
Na2CO3 +SiO2 → Na2SiO3 + CO2 Na2SiO3水溶液又叫做水玻璃,粘合剂,很廉价, 用于铸造等行业。 胶冻状硅酸 -H2O 硅胶
PbO 2 4HCl( 浓) PbCl2 Cl 2 2H 2 O 2PbO 2 4H 2SO 4 2Pb(HSO4 ) 2 O 2 2H 2 O
Δ 2PbO 2 2H 2SO 4 2PbSO 4 O 2 2H 2 O
2PbO 2 4HNO3 2Pb(NO3 ) 2 2H 2 O O 2
化学活性高, 硬度大 熔点,沸点都很高。
α -菱形硼(B12)
硼族元素

CO
2 3
反应,生成
碳酸盐沉淀。
CO
2+Ba2+
3
BaCO3(s)
(2)氢氧化物碱性较弱的金属离子如
Cu2+、Zn2+、Pb2+、Mg2+,可与
CO
2反应,
3
为碱式碳酸盐沉淀。
2Cu2++
2CO
2 3
+H2O
Cu2(OH)2CO3(s)+CO2(g)
(3)强水解的金属离子,特别是两性的 (如Al3+、Fe3+、Cr3+、Sn2+、Sn4+),其氢 氧化物溶度积小,沉淀为氢氧化物。
铝以下的各元素虽然都是金属,然而+3这 一较高的氧化数以及镓、铟、铊的18电子层壳 层的结构,也容易使原子间成键时表现为极性 共价键。
(2)硼族元素的 +3 氧化数化合物叫做缺电子 化合物(Electron-Defect Compound) 硼族元素的价电子层有4个原子轨道: ns、npx、npy、npz
性质一:易燃性 B2H6是非常活泼的物质,暴露于空气
中易燃或易爆,并放出大量热。
B2H6(g)+3O2(g) 燃烧 B2O3(s)+3H2O(g) Δr Hm 2034 kJ mol -1
性质二:还原性 B2H6是强还原剂,能与氧化剂反应。
例如与卤素反应生成卤化硼。
2B2H6(g)+6Cl2(g)
B2H6+2LiH
2LiBH4
B2H6是一种在空 气中易燃、易爆、易 水解的剧毒气体。
所以制备时必须保持反应处于无氧、 无水气状态,原料亦需预先干燥,并且 作好安全防护工作。
1. 金刚石(Diamond)
安徽安徽高中化学竞赛无机化学第十一章 碳族和硼族元素

安徽安徽高中化学竞赛无机化学第十一章碳族和硼族元素第十一章碳族和硼族元素11. 1. 01 石墨和金刚石:石墨的硬度小,熔点极高,具有如下面左图所示的层状结构。
层中碳原子碳原子sp2杂化,每个碳原子与相邻的3个碳原子成σ键,构成平面层。
各碳原子的p z轨道均垂直于上述平面层,互相平行,在层内形成大π键。
因为有离域π电子,所以石墨导电。
层间的分子间作用力小,易滑动,故石墨有润滑性。
层内的共价键和层间的分子间力,使得石墨成为典型的混合晶体。
木炭和焦炭基本属于石墨类型,但是晶形不完整。
金刚石的硬度最大,熔点极高,它的结构如下面右图所示,其中碳原子sp3等性杂化,每个碳原子与相邻4个碳原子成σ键。
由于无自由电子,故金刚石不导电。
金刚石属于典型的原子晶体。
11. 1. 02 碳簇:以C60为代表的碳簇,是碳单质的第3种同素异形体,碳簇是20 世纪80 年代被发现的。
可以从正二十面体出发去理解C60的几何构型。
如下面左图所示,正二十面体共有20个面,每个面都是正三角形;共12个顶点;每个面角都是五面角。
将每个顶角都截掉,截口处产生12个正五边形,原来的20个正三角形都变成了正六边形。
C60的几何构型就是这种截角正二十面体,如下面右图所示,共有20 个正六边形,12 个正五边形。
11. 1. 03 碳在冶金工业中的用途:冶金工业上,用碳作还原剂还原金属氧化物矿物,例如下面的反应高FeO + C ======= Fe + CO↑是炼铁过程中的重要步骤。
一些金属硫化物矿经高温焙烧转化为氧化物后,也要用碳在高温下还原以得到金属。
11. 1. 04 二氧化碳的分子结构:CO2的分子为直线形。
CO2分子中的C原子sp等性杂化,sp杂化轨道与两个O原子的p轨道成两个σ键。
不参加杂化的p y轨道有一个单电子,左边O原子的p y轨道有一对电子,右边O原子的p y轨道有一个单电子,所以在y 方向形成一个。
同理在z方向也形成一个。
胡波化学竞赛题库-碳和碳的化合物

B组
26.目前排放到空气中的二氧化碳逐年增加,对此科学家最担心的
是 会使空气中的氧含量下降,不足以供给人类呼吸 会使地球温度升高,冰川融化,生态失衡 会使人体吸进大量二氧化碳,损害健康 会使石灰岩大量溶解,破坏自然风光 27.近来查明,二氧化三碳(C O )是金星大气层的一种成分。下 3 2 列有关说法错误的是 A 二氧化三碳的结构式为:O=C=C=C=O B C3O2、CO、CO2都是碳的氧化物 C C2O3和CO一样可以燃烧生成CO2 D C3O2和CO2都是碳酸的酸酐 28.2003年2月1日,美国哥伦比亚号航天飞机在空中解体失事,有 专家分析认为,飞机空中解体的最大可能原因是航天飞机机亮底部的石 墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石 墨 A 具有导电性、防辐射 B 密度小,减轻机身重量 C 熔点高、化学性质稳定 D 硬度小,有润滑作用 29.CCTV《科技博览》报道,2004年3月中科院首创用CO 合成可 2 A B C D
B的分子式 (2)当氧和碳的质量比等于2时,试确定A和B的可能组成以及A与 B的物质的量之比。 25.密闭容器中有CO和空气的混合气体14L,用电火花引燃,经充 分反应后总体积为VL(假设所有体积均在同温、同压下测定,且空气 中O2的体积分数以0.20计算。计算结果保留两位小数)。 (1)若CO和O2恰好反应,计算原混合气体中CO的体积分数(请写 出必要过程)。 (2)若反应后总体积数V=13时,则原混合气体可能的组成为(可 不填满,也可补充)。 第一种情况:V(CO)︰V(O2)=____________; 第二种情况:V(CO)︰V(O2)=____________; 第三种情况:V(CO)︰V(O2)=____________。 (3)反应后总体积数V的取值范围是__________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素化学16:碳、硼及其化合物(时间:2.5小时满分:100分)第一题(9分)硼的化合物选粹硼是硬而脆及相对不活泼的元素,只能溶于热浓HNO3、热浓H2SO4,在空气中燃烧生成B2O3和BN,但却无B3+离子,BN的结构和石墨相似,硼能形成原酸H3BO3及偏酸HBO2,其盐存在于自然界,B和H形成一系列具有高燃烧热值的化合物,其通式为B n H(n+4)(不稳定)、B n H(n+6)(稳定)。
最简单气态氢化物在标准状态下密度为1.235g/L。
1.写出XN的结构式。
2.写出最简单氢化物的电子结构。
3.最简单氢化物的燃烧热,ΔH o comb=-2020kJ/mol,基于此性质,请考虑氢化物有何种用途?4.硼酸晶体属于离子晶体、原子晶体、分子晶体、混合型晶体中的哪一种?指出硼酸中的硼采取的杂化形式,以及硼酸中的大B键类型;5.硼酸常温下为白色片状晶体,溶于水(273K时溶解度为6.35),在热水中溶解度明显增大(373K时为27.6)。
请分析其中原因。
6.指出化合物H3B-NH3的熔点比其等电子体H3C-CH3等要高的多的原因,并画出示意图;7.溴甲酚绿指示剂的pH值变色范围为3.8~5.4,由黄色变为蓝色。
该指示剂在饱和硼酸溶液中呈黄蓝过渡色,在二氟化氢钾溶液中呈黄色,但在加有适量硼酸的二氟化氢钾溶液中呈蓝色,写出后者有关反应方程式。
8.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。
上述阴离子[CB11H6Cl6]-的结构可以跟下左图的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。
请在下图右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。
第二题(8分)超临界CO2近年来,在超临界CO2(临界温度Tc=304.3K;临界压力pc=72.8×105Pa)中的反应引起广泛关注。
该流体的密度在临界点附近很容易调制,可认为是一种替代有机溶剂的绿色溶剂。
该溶剂早已用于萃取咖啡因。
然而,利用超临界CO2的缺点之一是二氧化碳必须压缩。
1.在超临界二氧化碳中氧化醇类,如将苄醇氧化为苯甲醛,是一种超临界工艺。
反应在催化选择性效率为95%的Pd/Al2O3催化剂作用下进行。
(1)写出主要反应过程的配平的反应式。
(2)除完全氧化外,进一步氧化时还发生哪些反应?写出它们的反应方程式。
2.在另一超流体工艺——合成有机碳酸酯和甲酰胺的例子中,二氧化碳既是溶剂,又可作为反应物替代光气或一氧化碳。
(1)写出甲醇和二氧化碳反应得到碳酸二甲酯的配平的方程式。
如以光气为反应物如何得到碳酸二甲酯?(2)用适当的催化剂可用吗啉(C4H9NO,结构右图所示)和二氧化碳合成甲酰基吗啉。
该反应还需添加什么反应物(无机小分子)?写出反应式。
若用一氧化碳替代,反应式将如何改变?3.用绿色化学的观念给出用CO2代替一氧化碳和光气的2个理由。
与以CO或COCl2为反应物对比,再给出用CO2为反应物的1个主要障碍(除必须对二氧化碳进行压缩外)。
第三题(8分)三卤化硼的结构问题三卤化硼都是硼原子配位未达饱和的缺电子化合物,因此都是很强的路易斯酸。
1.写出BF3的结构式和其成键特点。
分子的极性又如何?2.如果把BF3与乙醚放在一起,B—F键长从130 pm增加到141 pm,试问所生成的新化合物成键情况及其极性如何?BF3分子结构发生了哪些变化?3.BF3有两种水合物BF3·H2O和BF3·2H2O。
经测定在一水合物的液相中存在着与分子数相同的离子,其中一半为+1价阳离子,一半为-1价阴离子。
而在二水合化合物中,存在着与分子数相同的+1价阳离子和同样数目的-1价阴离子。
写出它们的结构。
4.BF3和弱酸HF作用,可以得到一个很强的酸。
写出该反应的化学方程式。
5.BF3与NH3反应得到一个加合物H3NBF3,后者在125℃以上分解得到两种晶体,一种晶体的结构与石墨相似,另一种晶体中含有两种离子,均为正四面体结构,比例为1︰1。
写出H3NBF3分解的化学反应方程式。
6.BF3和BCl3的水解性能差别很大,前者可以得到一系列的中间产物,而后者则迅速彻底地水解。
写出二者水解反应的化学方程式,并解释两者差别的原因。
第四题(9分)CO2一碳化学当前,由于全球温室效应的影响,科学家正在致力于CO2一碳化学的技术研究,将过多的CO2转化为人类所需要的物质,取得了一定成果。
1.据2002年6月17日的《中国环境报》报道,中国科学院广州化学研究所优秀“海归”科学家孟跃中博士成功进行了世界上首次“CO2聚合与利用”的工业化生产,制成了性能与聚乙烯相似,且能生物降解的塑料,不但解决了CO2的环境问题,也解决了“白色污染”问题。
请问:CO2在催化剂作用下生成聚合物的最本质的原因是什么?2.中国科学技术大学陈乾旺教授领导的研究组最近在人工合成金刚石研究中取得重大突破,他们用自制的高压反应釜做实验,以二氧化碳为原料,用金属钠作还原剂,在440℃和800个大气压的条件下,首次实现了从二氧化碳到金刚石的转变。
2003年8月3日,陈教授的论文发表在国际权威刊物(美国化学会志)上。
(1)请写出陈教授合成金刚石的反应方程式;(2)根据陈教授的科研成果,试分析研究天然金刚石矿的成因;(3)如果把陈教授合成金刚石的压力拆除,置于真空状态之下,其他条件都不变,化学反应的方程式也不会改变你认为,还原的碳会以怎样的结构形式出现?3.以前,生物学家都认为,地球上所有生态系统离不开阳光,通过光合作用为高级消费者提供能量源。
科学家1997年在2500m深海底热泉(黑烟囱)处发现了大量生物群落近年来又在11000m深海底发现了无脊椎动物。
在这样的深海域水中无光线,不可能存在光合作用。
科学家研究发现,这些生物完全依靠化学自养菌的初级生产力,它们以黑烟囱喷出的热液中的硫化物H2S为能量,利用CO2合成了与光合作用没有差别的有机物。
请写出该自养菌合成有机物的化学方程。
4.利用电化学法电解二氧化碳,使之转变成其他可溶于水的物质。
在丙烯碳酸酯和乙腈介质中,用铅做电极电解二氧化碳,其过程如下:CO2+e-=CO2—(慢);CO2 +CO2—=(CO2)2—;(CO2)2—+e-=C2O42—(1)在二氧化碳的电解过程中,有机相介质与水相哪一个更好?解释其原因。
(2)在研究中发现,有CO、CO32—生成,请用化学方程式表示其机理;(3)在水相中,二氧化碳大多被还原成甲酸根(HCOO—),请推导其机理。
第五题(8分)硼砂的结构、制备与性质硼砂是重要的硼酸盐之一,其主要成分是Na2B4O7·10H2O,溶于水时生成硼酸和硼酸盐。
1.硼砂按其结构应写成Na2B4O5(OH)4·8H2O,其酸根中含有两个六元环结构,画出该硼酸根离子的结构,并指出所带电荷及原因。
2.写出硼砂溶于水时所发生的离子反应方程式,其水溶液有什么用途,并估算其水溶液的pH。
已知硼酸的K a=5.8×10-10。
3.工业上硼砂可由浓碱溶液先分解硼镁矿(Mg2B2O5·H2O)成偏硼酸盐,然后用CO2调节碱度而得,写出反应方程式。
4.硼砂有多种用途,如和尿素反应可制备无机材料(BN)3,写出反应方程式。
第六题(9分)碳酸盐与碳酸氢盐1mol/L的氯化物A与1mol/L的钠盐B等体积混合,立即产生大量白色沉淀C和大量无色气体D;高温强热C得到E和D,E能与水反应得到F,F在水中的溶解度不大;往F的饱和溶液中通入纯净的D,发现沉淀逐渐增多后又减少,但未完全消失。
往A与B反应的残液中先通入过量气体G,则产生沉淀C,此时残液中继续通入气体D,则又产生沉淀C。
1.写出A~G各物质的化学式;2.写出A、B反应及其残液中依次通入G、D的反应方程式3.用化学原理解释A、B能够进行反应的原因,并预测反应后溶液的酸碱性。
第七题(14分)NaBH4的制备与性质NaBH4是1950年由Brown等人合成,NaBH4被称为有机化学家的“万能还原剂”,也是许多有机反应的催化剂,在有机合成里有极广泛的用途。
硼氢化钠水解可得高纯度氢气,也可为燃料电池提供高纯度燃料。
1.目前世界上制取硼氢化钠的方法主要有两种:①硼酸三甲酯-氢化钠法(Schlesinger 法),②硼砂——金属氢化还原法(Bayer法,在该方法中另需加入一种非金属氧化物)。
请写出Schlesinger方法与Bayer方法的化学反应方程式。
2.NaBH4可以将许多金属离子还原成金属,并使得到的金属沉积在金属、玻璃、陶瓷、塑料上,从而有广泛的应用场合。
例如,它把镍沉积在玻璃上,形成极薄的镍膜,用于太阳能电池;把金或铜沉积在塑料板上形成印刷板电路;还原废液中的贵重金属。
试以Ru3+为例写出一个配平的离子方程式。
3.NaBH4与氯化镍在水溶液里的反应十分令人瞩目,这个反应的主要产物是Ni2B是一种神奇的有机反应催化剂。
已知NaBH4与氯化镍的反应物质的量比是2︰l,反应使所有的镍转化为Ni2B,硼的另一产物则是H3BO3,反应还放出氢气,余留在溶液里的还有氯化钠。
试写出配平的化学方程式。
4.硼氢化钠储氢方式不但具有金属氢化物储氢的优点,而且质量储氢密度大幅度提高,具有溶液无可燃性,储运和使用安全、制得的氢气纯度高、不需要纯化过程、氢气的生成速度容易控制、氢的储存效率高、催化剂可循环使用、常温甚至0℃下也可生成氢气、过程无污染等特点。
这使得硼氢化钠制氢技术的开发研究具有十分重要的意义,成为后续能源的研究内容之一。
(1)NaBH4易溶于水,并会和水反应产生氢气,试写出该反应的离子方程式。
(2)NaBH4与水反应的速率受温度、浓度及溶液的pH影响,将发生改变。
①根据你的知识,说明pH值的变化将导致反应速率怎样变化。
②日本丰田研究中心的Kojimat等人使用TiO2负载的Ni,Fe,Ru等作为催化剂发现可以大大提高反应速率;Brown等人在研究中发现加入氯铂酸使硼氢化钠的水解速率明显加快。
请用方程式说明加入氯铂酸后反应速率加快的原因。
(3)虽然硼氢化钠制氢法在试验室已研究成功,但迟迟不能再工业上大规模的推广,请分析其中的原因。
(4)由于上述的成本问题,以上各个研究小组正在研究副产物的再利用问题,从而希望能够通过资源循环降低成本,Kucel-Merit小组已通过使用类似MgH2这样的金属氢化物将水解反应中的副产物转化成NaBH4,请写出方程式。
(5)该研究组还发现了用硼砂与MgH2通过磨球制得NaBH4 ,并且在反应中加入Na,Na2O2,Na2CO3等可以大大提高反应的产率,其中以Na2CO3最好,请写出方程式,并解释加入Na2CO3从而优化反应的化学原理。
