高中化学 专题3 第一单元 第1课时 脂肪烃的类别 烷烃学案 苏教版选修5
年高中化学专题3第1单元第1课时脂肪烃的性质教案苏教版选修5

年高中化学专题3第1单元第1课时脂肪烃的性质教案苏教版选修5目标与素养:1.了解常见脂肪烃的物理性质。
(宏观辨识与微观探析)2.理解常见脂肪烃的化学性质,初步体会有机物分子结构对性质的影响。
(宏观辨识与微观探析)一、脂肪烃的分类与物理性质1.脂肪烃的分类2.脂肪烃的物理性质物理性质变化规律状态当碳原子数小于或等于4时,烷、烯、炔烃在常温下呈气态,其他的烷、烯、炔烃在常温下呈液态或固态(新戊烷常温下为气态)溶解性都不溶于水,易溶于有机溶剂沸点随碳原子数的增加,沸点逐渐升高。
碳原子数相同的烃,支链越多,沸点越低密度随碳原子数的增加,相对密度逐渐增大。
烷、烯、炔烃的相对密度小于水的密度(1)碳原子数相同的烷烃,熔、沸点一定相同吗?[提示]不一定相同,支链越多,熔、沸点越低。
(2)分子通式符合C n H2n+2的两种有机物一定互为同系物吗?[提示]不一定。
如二者碳原子数不同,则互为同系物;二者碳原子数相同,则互为同分异构体。
二、脂肪烃的化学性质1.取代反应(1)取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
(2)烷烃的特征反应是取代反应,但烷烃的取代反应的生成物一般是混合物,例如甲烷与氯气反应就可以生成CH3Cl、CH2Cl2、CHCl3、CCl4等有机物。
2.加成反应(1)加成反应:构成有机化合物不饱和键的两个原子与其他原子或原子团直接结合而生成新物质的反应。
(2)烯烃、炔烃的特征反应是加成反应。
(3)示例①一般烯烃或炔烃②二烯烃(以1,3丁二烯为例)3.加聚反应(1)加聚反应:一些具有不饱和键的有机化合物通过加成反应得到高分子化合物的反应。
(2)乙烯的加聚反应的化学方程式为n CH 2CH 2――→催化剂CH 2—CH 2。
1,3丁二烯可以通过1,4加成得到高分子化合物,生成物是一种重要的合成橡胶,该反应的化学方程式为n CH 2====CH —CH====CH 2――→催化剂CH 2—CH====CH —CH 2。
高中化学专题3常见的烃第一单元脂肪烃学案苏教版选修5(2021年整理)

(浙江专版)2018年高中化学专题3 常见的烃第一单元脂肪烃学案苏教版选修5编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江专版)2018年高中化学专题3 常见的烃第一单元脂肪烃学案苏教版选修5)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江专版)2018年高中化学专题3 常见的烃第一单元脂肪烃学案苏教版选修5的全部内容。
第一单元脂肪烃第一课时脂肪烃的性质[选考要求]1.脂肪烃和芳香烃、饱和烃和不饱和烃的概念及判断(b)2.烷烃、烯烃和炔烃等脂肪烃的物理性质(a)3.烷烃、烯烃和炔烃等脂肪烃的化学性质(取代反应、加成反应、加聚反应)(c)1.分子中含有苯环的烃称为芳香烃,不含苯环的烃称为脂肪烃.脂肪烃包括烷烃、烯烃和炔烃,其中烷烃属于饱和烃,烯烃、炔烃和芳香烃属于不饱和烃.2.饱和烃(烷烃)的特征反应是取代反应,特点是“一上一下";不饱和烃的特征反应是加成反应,特点是“只上不下"。
3.单双键交替的烯烃(共轭二烯烃)可以按物质的量1∶1与溴发生1,4.加成或1,2加成。
也可以按物质的量比1∶2与溴发生1,2,3,4。
加成.错误!1.烃的分类(1)根据分子中是否含有苯环错误!(2)脂肪烃的分类错误!(3)链状烃:烃分子中碳和碳之间的连接呈链状,可以含有支链.(4)环状烃:烃分子中含有碳环。
分子中含有的碳环不是苯环的烃,称为脂环烃,如环己烷。
分子中含有一个或多个苯环的一类碳氢化合物,称为芳香烃,如苯.2.脂肪烃的物理性质物理性质变化规律状态当碳原子数小于或等于4时,烷、烯、炔烃在常温下呈气态,其他的烷、烯、炔烃常温下呈固态或液态(新戊烷常温下为气态)溶解性都不溶于水,易溶于有机溶剂沸点随碳原子数的增加,沸点逐渐升高分子数相同的烃,支链越多,沸点越低密度随碳原子数的增加,相对密度逐渐增大烷、烯、炔烃的相对密度小于水的密度[特别提醒] 当碳原子数超过5个的烃类,不可用于气体摩尔体积的计算。
高二化学苏教版选修5专题3第一单元脂肪烃学案含解析

互动课堂疏导引导一、烃的基本知识 1。
烃的分类烃分为脂肪烃和芳香烃,其中脂肪烃的分子中一定不含有苯环,芳香烃的分子中一定含有苯环。
根据脂肪烃的结构,人们把脂肪烃分为饱和烃和不饱和烃。
饱和烃:碳原子之间的共价键全部为碳碳单键,其中的碳原子皆为饱和碳原子.如:烷烃.不饱和烃:分子中含有双键和叁键等不饱和键的脂肪烃,其中的碳原子有不饱和碳原子。
如:烯烃、炔烃. 2。
常见的脂肪烃⎪⎩⎪⎨⎧⎩⎨⎧炔烃烯烃简称不饱和烃不饱和脂肪烃乙烷甲烷烷烃简称饱和烃饱和脂肪烃脂肪烃)(),(:)( 二、脂肪烃的性质 1。
烷烃的性质 (1)物理性质随着碳原子数的增多,烷烃同系物的物理性质呈现周期性变化,即熔沸点逐渐升高,密度逐渐增大。
注:①所有烷烃均难溶于水,密度均小于1。
②常温下烷烃的状态:C 1—C 4 气态 C 5—C 16 液态 C 17—固态 (2)化学性质①与卤素单质的反应 CH 3CH 3+Cl 2CH 3CH 2Cl+HCl可逐步取代,所得有机产物有:C 2H 5Cl 、C 2H 4Cl 2、C 2H 3Cl 3、C 2H 2Cl 4,C 2HCl 5、C 2Cl 6,其中氯乙烷为其一氯代物,以上物质均称为氯代物。
取代反应:像烷烃的卤代反应那样,有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
②与氧气的反应CH 4+2O 2−−→−点燃CO 2+2H 2OC n H 2n +2+213+n O 2−−→−点燃nCO 2+(n+1)H 2O知识总结不同的烃,碳元素所占的质量分数有所不同。
分子中碳原子数相同而碳元素的质量分数越低的烃,完全燃烧时放出的热量越多。
在所有烃中,烷烃(特别是甲烷)的碳元素的质量分数比相应的其他烃都低。
因此人们倾向于选用烷烃,尤其是相对分子质量小的烃作燃料。
2.烯烃、炔烃的性质 (1)物理性质①烯烃:随着分子里碳原子数的增加:a 状态:g→l→s;b 沸点:逐渐升高;c 密度:逐渐变大(但小于1 g·cm -3). 常温常压下,n≤4的烯烃为气态。
高中化学 专题3 常见的烃 3.1 脂肪烃教学设计 苏教版选修5

第一单元脂肪烃的性质(第1课时)一、教学目标【学问与技能】1.了解烷烃、烯烃、炔烃的物理性质的变化与分子中碳原子数目的关系。
2.把握烷烃、烯烃、炔烃的主要化学性质。
【过程与方法】1.通过对比甲烷、乙烯的结构和性质的方法,进一步争辩烷烃和烯烃的结构和性质。
【情感、态度、价值观】1.培育同学自主观看得出结论,验证结论的力量。
2.培育同学严谨求实、勇于探究的科学态度。
二、学情分析同学在化学2中已经简洁学习了烷烃和烯烃的典型代表物——甲烷和乙烯。
本节课在复习乙烷和乙烯结构与性质的基础上,重点引导同学把握有机化学的基本方法——“结构打算性质,性质反映结构”;留意培育同学的演绎思维、迁移力量,从甲烷、乙烯的结构和性质迁移到烷烃、烯烃的结构和性质。
三、教学思路本节课教学过程中以任务驱动为线索,将烷烃与烯烃物理性质的递变规律,有机物结构(官能团)与化学性质的关系,从个别到一般的演绎思维力量与按类别学习有机化合物的学习方法隐蔽在其中,教学过程中留意实施层层深化、演绎与归纳相结合的教学策略,并留意对同学分析问题的合理性及有序性等方面力量进行逐步培育,力图达到课堂教学的实效性。
四、教学重点烷烃、烯烃、炔烃的结构特点和主要化学性质五、教学难点烷烃、烯烃、炔烃的结构特点和主要化学性质六、教学过程【板书】一.烷烃和烯烃的物理性质的比较【师】:通过同学们的沟通与争辩,我们可以得出烷烃和烯烃的物理性质是?【师】:很好,同学们基本上归纳出了烷烃和烯烃的物理性质,再给同学们补充三点。
1、1~4个碳原子的烃常温常压下为气态2、同碳原子数的烷烃,支链越多沸点越低3、全部烷烃均难溶于水,密度均小于水的密度。
【同学】:依据老师要求开头争辩,并且得出答案。
【同学】:烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈现规律性的变化,沸点渐渐上升,相对密度渐渐增大,常温下的存在状态,也由气态渐渐过渡到液态和固态【同学】:补充笔记。
【过渡】:那他们的化学性质又如何呢?【师】1、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
2024年高中化学专题3常见的烃第一单元第1课时脂肪烃的类别、烷烃教案苏教版选修5

- 反馈与评价:及时给予学生反馈,鼓励学生积极参与课堂讨论,及时纠正学生的错误。
5. 教学过程调控
- 观察学生的参与程度,根据学生的反应调整教学节奏和内容。
- 适时进行课堂小结,确保学生对重点知识点的掌握。
2. 烷烃的结构特点
- 烷烃分子结构仅含有碳氢单键,具有饱和碳原子的特点。
- 碳原子形成四个共价键,每个碳原子都连接着相同数量的氢原子。
- 烷烃的碳原子排列成直链或支链状。
3. 烷烃的性质
- 烷烃的物理性质:烷烃均为无色、无味、无臭的气体或液体,难溶于水,密度比水小。
- 烷烃的化学性质:烷烃在常温下稳定,不易与其他物质反应,但燃烧时能产生大量热能。
2.新课导入:介绍脂肪烃的定义和分类,讲解烷烃的结构特点和性质。
3.案例分析:分析生活中常见的烷烃化合物,如甲烷、乙烷等,引导学生运用所学知识进行分析。
4.课堂互动:组织学生进行小组讨论,探讨烷烃的命名规则和同分异构体的判断。
5.实验操作:安排学生进行化学实验,观察烷烃的燃烧现象,巩固所学知识。
6.课堂小结:对本节课的内容进行总结,强调脂肪烃的类别和烷烃的特点。
6. 脂肪烃的制备方法
- 实验室制备:通过有机合成反应,如醇的催化脱水、卤代烃的消除反应等。
- 工业制备:通过石油炼制过程,如裂解、裂化等。
7. 脂肪烃的应用
- 烷烃:用作燃料,如天然气、石油气等。
- 烯烃:用于生产塑料、合成纤维、药物等。
- 炔烃:用于生产化学品、合成橡胶等。
板书设计
1. 重点知识点
六、教学资源
1.多媒体课件:制作相关的多媒体课件,用于辅助教学。
精品高中化学专题3常见的烃第一单元脂肪烃第1课时烷烃教学案苏教版选修5

【最新版】2019高中化学专题3常见的烃第一单元脂肪烃第1课时烷烃教学案苏教版选修5[目标导航] 1.了解烷烃的物理性质的变化与分子中碳原子数目的关系。
2.能以甲烷为例,理解烷烃的组成、结构和主要化学性质。
3.通过回忆甲烷及烷烃的分子结构,初步体会有机物分子结构的特点对性质的影响。
一、烷烃的结构1.脂肪烃的分类根据脂肪烃的结构,人们把含有双键或叁键等不饱和键的脂肪烃称为不饱和脂肪烃,简称不饱和烃,主要包括烯烃、炔烃等;把不含不饱和键的脂肪烃称为饱和脂肪烃,简称饱和烃,主要包括烷烃。
2.烷烃的结构与通式碳原子之间以单键结合成链状,剩余的价键均与氢原子结合,使每个碳原子的化合价都充分利用,达到饱和。
通式为CnH2n+2。
议一议分子式符合通式CnH2n+2的两种有机物一定互为同系物吗?答案不一定。
分子式符合通式CnH2n+2的有机物,若碳原子数不同,都属于烷烃,结构相似,互为同系物;若碳原子数相同,碳架结构不同,则为同分异构体。
二、烷烃的性质1.物理性质(1)熔沸点:随着分子中碳原子数目的增多熔沸点逐渐升高。
(2)密度:随着分子中碳原子数目的增多,密度逐渐增大,但都小于水的密度。
(3)溶解性:烷烃难溶于水,易溶于有机溶剂。
2.化学性质烷烃的化学性质稳定,常温下不与强酸、强碱、高锰酸钾溶液等发生反应。
(1)氧化反应——可燃性:烷烃燃烧的通式为CnH2n+2+O2nCO2+(n+1)H2O。
(2)取代反应:烷烃在光照条件下能与氯气、溴蒸气等发生取代反应。
如甲烷与氯气反应生成一氯甲烷的化学方程式为CH4+Cl2CH3Cl+HCl。
(3)裂解反应:烷烃在隔绝空气加强热的条件下可以分解成碳原子数较少的烷烃和烯烃。
如:C4H10C2H4+C2H6,C4H10CH4+C3H6。
议一议1.依据下图分析什么样的烷烃在常温常压下为气态?答案碳原子数小于等于4的烷烃为气态,其他的烷烃在常温、常压下一般都为液态或固态(新戊烷在常温常压下为气态)。
苏教版化学选修5 专题3 第一单元 脂肪烃1 烷烃(学案)

苏教版化学选修5 专题3 第一单元脂肪烃1 烷烃(学案)有CH 3Cl 是气态,其余均为液态,CHCl 3俗称氯仿,CCl 4又叫四氯化碳,是重要的有机溶剂,密度比水大。
二、烷烃(1)概念及通式分子中碳原子之间以单键结合成链状,碳原子剩余的价键全部跟氢原子结合的饱和烃,其通式为:n 2n 2C H (n ≥l )。
(2)物理性质● 状态:常温下含有1~4个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。
● 沸点:① 随着碳原子数的增多,沸点逐渐升高。
② 同分异构体之间,支链越多,沸点越低。
● 相对密度:随着碳原子数的增多,相对密度逐渐增大,密度均比水的小。
●在水中的溶解性:均难溶于水。
(3)化学性质① 氧化反应:均易燃烧,难被酸性KMnO 4溶液等氧化剂氧化。
② 取代反应,在光照条件下易和卤素单质发生取代反应。
【典例精析】例题1 1mol 某烷烃可与8molCl 2完全取代,此烷烃的分子式是____________。
思路导航:本题考查对取代反应的理解。
当烷烃分子中的1mol 氢原子被取代时,就需要有1mol 氯气参加反应,同时生成1mol 氯化氢,因此根据本题中的条件“参加反应的氯气为8mol”可知在该烷烃分子中应有8mol 氢原子。
再根据烷烃通式C n H 2n +2可知2n +2=8,则n =3,所以该烷烃的分子式为C 3H 8。
答案:C 3H 8例题2 10mL 某气态烃,在50mLO 2里完全燃烧,得到液态水和体积为35mL 的混合气体,则该烃可能是( )A. 甲烷B. 乙烷C. 丙烷D. 丙烯思路导航:该烃在O 2中完全燃烧,得到混合气体,说明O 2过量,混合气体为CO 2和剩余的O 2。
则可利用燃烧反应方程式进行计算。
设:该烃的分子式为C x H y ,则:C x H y +(x +4y )O 2−−→−点燃xCO 2+2y H 2O (液) △V1mL (x +4y)mL xmL(1+4y )mL10mL 10mL +50mL -35mL =25mL∴y =6。
化学:3.1《脂肪烃》教案(苏教版选修5)

化学:3.1《脂肪烃》教案(苏教版选修5)要点:一、饱和烃与不饱和烃的概念二、脂肪烃的分类及特性1 物理性质(1)烷烃的熔沸点(2)烷烃的水溶性2 化学性质(1)知识回顾(2)特征反应:a烷烃的取代反应b烯烃、炔烃的加成反应(不对称加成、二烯烃的加成) c加聚反应:乙烯型加聚反应1,3-丁二烯型加聚反应三脂肪烃的来源1工业制法2实验室制法(第一课时)【问】你知道什么是烃?烃是一类只含有C、H元素的有机物。
一烃的分类1 结构中有无苯环不含双键、叁键等不饱和键——饱和烃——烷烃不含苯环————脂肪烃含双键、叁键等不饱和键——不饱和烃——烯烃、炔烃烃含有苯环————芳香烃二脂肪烃的性质1 物理性质【交流与讨论】(1)烷烃的熔、沸点(见课本P40)【问】烷烃的沸点与其分子中所含有的碳原子数之间有什么关系?(a)随着分子里含碳原子数的增加,熔点、沸点逐渐升高,相对密度逐渐增大;(b)分子里碳原子数等于或小于4的烷烃。
在常温常压下都是气体,其他烷烃在常温常压下都是液体或固体;(c)烷烃的相对密度小于水的密度。
注意:表中所列烷烃均为无支链的烷烃,常温常压下是气体的烷烃除了上述碳原子数小于或等于4的几种分子之外,还有一种碳原子数为5的分子,但分子中含有支链的戊烷,【问】烷烃分子的熔沸点为什么会随着碳原子数的增大即相对分子质量的提高而升高呢?由于随着相对分子质量的增大,分子之间的范德华力逐渐增大,从而导致烷烃分子的熔沸点逐渐升高。
补充:烷烃的熔点在开始时随着碳原子数的增加而呈折线上升,这是由于其熔点不仅与分子间作用力有关,还与结构的对称性有关。
(2)水溶性——烷烃分子均为非极性分子,故一般不溶于水,而易溶于有机溶剂,液态烷烃本身就是良好的有机溶剂。
二化学性质1 【知识回顾】完成下表2 特成反应【学生回答】——完成下列填空(1)甲烷与纯卤素单质(Cl2)发生取代反应这类反应中,有机物分子中的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应(2)不饱和键的加成反应——构成有机物不饱和键的两个原子与其它原子或原子团直接结合生成新物质的反应A 单烯烃中的加成反应乙烯与HCl的反应乙烯与H2O的反应乙烯与氯气的反应乙烯与H2的反应乙炔(“能”或“不能”)使溴水褪色。
化学同步苏教版选修5学案:专题3第1单元第1课时脂肪烃的性质Word版含解析

第|一单元⎪⎪ 脂肪烃 第|一课时 脂肪烃的性质 [课标要求]1.以典型的脂肪烃为例 ,比拟它们在组成、结构和性质上的差异 .2.根据脂肪烃的组成和结构特点认识加成、加聚和取代反响 .1.分子中含有苯环的烃称为芳香烃 ,不含苯环的烃称为脂肪烃 .脂肪烃包括烷烃、烯烃和炔烃 ,其中烷烃属于饱和烃 ,烯烃、炔烃和芳香烃属于不饱和烃 .2.饱和烃(烷烃)的特征反响是取代反响 ,特点是 "一上一下〞;不饱和烃的特征反响是加成反响 ,特点是 "只上不下〞 .3.单双键交替的烯烃(共轭二烯烃)可以按物质的量1∶1与溴发生1,4-加成或1,2-加成 .也可以按物质的量比1∶2与溴发生1,2,3,4-加成 .烃的分类和脂肪烃的物理性质1.烃的分类(1)根据分子中是否含有苯环⎩⎪⎨⎪⎧脂肪烃:不含苯环芳香烃:含有苯环 (2)脂肪烃的分类⎩⎪⎨⎪⎧ 不饱和烃:含有双键或叁键等不饱和键的脂肪烃饱和烃:不含不饱和键的脂肪烃如烷烃(3)链状烃:烃分子中碳和碳之间的连接呈链状 ,可以含有支链 . (4)环状烃:烃分子中含有碳环 .分子中含有的碳环不是苯环的烃 ,称为脂环烃 ,如环己烷 .分子中含有一个或多个苯环的一类碳氢化合物 ,称为芳香烃 ,如苯. 2.脂肪烃的物理性质物理性质变化规律 状态当碳原子数小于或等于4时 ,烷、烯、炔烃在常温下呈气态 ,其他的烷、烯、炔烃常温下呈固态或液态(新戊烷常温下为气态) 溶解性都不溶于水 ,易溶于有机溶剂 沸点 随碳原子数的增加 ,沸点逐渐升高分子数相同的烃 ,支链越多 ,沸点越低密度随碳原子数的增加 ,相对密度逐渐增大烷、烯、炔烃的相对密度小于水的密度苯等均为液体,1 mol 的该物质其体积不等于22.4 L .1.以下不属于脂肪烃的是()A.B.C. CH3-CH3D. CH3-CH = = =CH2解析:选B A中不存在苯环,属于脂肪烃;B中含有苯环,属于芳香烃;C项属于烷烃,D属于烯烃,都属于脂肪烃 .2.①丁烷②2-甲基丙烷③正戊烷④2-甲基丁烷⑤2,2-二甲基丙烷,它们的沸点排列顺序正确的选项是()A.①>②>③>④>⑤B.⑤>④>③>②>①C.③>④>⑤>①>②D.②>①>⑤>④>③解析:选C丁烷和2-甲基丙烷碳原子数为4, 正戊烷、2-甲基丁烷、2,2-二甲基丙烷碳原子数都为5,2-甲基丙烷含支链,丁烷不含支链,故沸点:丁烷>2-甲基丙烷 .2-甲基丁烷含一个支链,2,2-二甲基丙烷含两个支链,正戊烷不含支链,故沸点:正戊烷>2-甲基丁烷>2,2-二甲基丙烷>丁烷>2-甲基丙烷.脂肪烃的化学性质1.烷烃的化学性质(1)稳定性:常温下,不与强酸、强碱、强氧化剂反响.(2)氧化反响①不能使酸性KMnO4溶液褪色;②可燃性:C n H2n+2燃烧反响的化学方程式为C n H2n+2+3n+12O2――→点燃n CO2+(n+1)H2O .(3)取代反响如乙烷与氯气反响生成一氯乙烷的化学方程式:CH3CH3+Cl2光照,CH3CH2Cl+HCl . 2.烯烃的化学性质(1)氧化反响①能使酸性KMnO4溶液褪色;②可燃性:C n H2n燃烧反响的化学方程式为C n H2n+3n2O2――→点燃n CO2+n H2O .(2)加成反响①单烯烃的加成反响:可与卤素单质、H 2、卤化氢、水加成 ,如乙烯与溴水反响:CH 2 = = =CH 2+Br 2―→Br -CH 2CH 2 -Br . ②不对称烯烃的加成反响:a .马氏规那么 - -烯烃与HX 在没有条件发生加成时 ,H 加到含H 原子多的不饱和碳原子上 ,称为 "亲(H)上加亲(H)〞 .b .实例:丙烯与HBr 发生加成反响的化学方程式为③二烯烃的加成反响:a .1,3-丁二烯的1,2-加成:b .1,3-丁二烯的1,4-加成反响:c .1,3-丁二烯的全加成反响:(3)加聚反响如乙烯加聚反响的化学方程式n CH 2 = = =CH 2――→催化剂CH 2 -CH 2 .3.炔烃的化学性质(1)氧化反响①能使KMnO 4酸性溶液褪色;②可燃性:C n H 2n -2燃烧反响的化学方程式为C n H 2n -2+3n -12O 2――→点燃 n CO 2+(n -1)H 2O . (2)加成反响与烯烃类似 ,炔烃也能与Br 2、H 2、HCl 发生加成反响 ,如:CH ≡CH +Br 2―→CHBr = = =CHBr 或CH ≡CH +2Br 2―→CHBr 2 -CHBr 2;CH ≡CH +HCl ――→催化剂CH 2 = = =CHCl . (3)加聚反响:如乙炔加聚反响的化学方程式:n CH ≡CH ――→催化剂CH = = =CH .1.烷烃性质的特征反响是什么 ?提示:取代反响 .2.烯烃性质的特征反响是什么 ?提示:氧化反响(使酸性KMnO 4溶液褪色)、加成反响、加聚反响 .3.炔烃性质的特征反响是什么 ?提示:氧化反响(使酸性KMnO 4溶液褪色)、加成反响 .取代反响与加成反响的比拟44A.乙烯(C2H4)B.丙烯(CH3CH = = =CH2)C.1-丁烯(CH3CH2CH = = =CH2)D.戊烷(C5H12)解析:选D烯烃能使酸性KMnO4或溴的CCl4溶液褪色,而烷烃不能.2.以下物质不可能是乙烯加成产物的是()A.CH3CH3B.CH3CHCl2C.CH3CH2OH D.CH3CH2Br解析:选B A项,由CH2 = = =CH2与H2加成产生;B项,不可能由CH2 = = =CH2与Cl2或HCl发生加成反响产生;C项,由CH2 = = =CH2与H2O加成产生;D 项,由CH2 = = =CH2与HBr加成产生.3.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少量乙烯的最|||正确方法是()A.混合气体通过盛水的洗气瓶B.混合气体通过装有过量溴水的洗气瓶C.混合气体和过量H2混合D.混合气体通过KMnO4酸性溶液解析:选B水既不能鉴别也不能除去乙烷中的乙烯,利用H2不能鉴别乙烯和乙烷,乙烯与氢气在一定条件下反响生成乙烷,但H2的量不易控制;KMnO4酸性溶液可用于鉴别乙烷和乙烯,但不能用于除去乙烷中的乙烯,因为KMnO4酸性溶液会将乙烯氧化成CO2,仍为杂质.只有溴水与乙烷不反响,与乙烯可发生加成反响而褪色,既可以鉴别乙烷和乙烯,也可以除去乙烷中的乙烯 .[方法技巧]气态烷烃和气态烯烃的鉴别与除杂(1)气态烷烃和烯烃的鉴别方法一:将两种气体分别通入溴水(或溴的四氯化碳溶液)中;溶液褪色那么为烯烃 ,溶液不褪色那么为烷烃 .方法二:将两种气体分别通入酸性KMnO 4溶液中;溶液褪色那么为烯烃 ,溶液不褪色那么为烷烃 .(2)除去气态烷烃中气态烯烃的方法将混合气体通入盛有溴水的洗气瓶 ,烯烃与Br 2发生加成反响生成液态产物而被除去 ,烷烃不反响而逸出 .加聚反响1.概念一些具有不饱和键的有机化合物可以通加成反响得到高分子化合物 ,这类反响称为加聚反响 .2.特点3.实例(1)烯烃加聚如n CH 2 = = =CH 2――→催化剂CH 2 -CH 2 (2)二烯烃加聚n CH 2 = = =CH -CH = = =CH 2――→催化剂CH 2 -CH = = =CH-CH 2(3)炔烃加聚n CH ≡CH ――→催化剂CH = = =CH (4)烯烃共聚 (5)其他含双键物质的加聚n CH 2 = = =CHCl ――→催化剂CH 2 -CHCl 1.以乙烯和丙烯混合物为原料 ,发生加聚反响 ,不可能得到的是( )A .CH 2 -CH 2CH 2CH 2CH 2 B .CH 2 -CH 2 C .D . 解析:选A 乙烯加聚生成CH 2 -CH 2;丙烯加聚生成 ,乙烯和丙烯之间发生加聚反响生成或,故A项不可能生成.2.写出以下物质发生加聚反响所得产物的结构简式,并写出反响的化学方程式.(1)1,2-二氯乙烯:_______________________________________________________ ,________________________________________________________________________;(2)1-丁烯_____________________________________________________________ ,________________________________________________________________________;(3)2-甲基-1,3-丁二烯:___________________________________________________ ,________________________________________________________________________ .答案:(1)[三级|||训练·节节过关]1.以下说法正确的选项是()A.甲烷与氯气反响只能生成一种含氯有机物B.乙烯与溴水反响只能生成一种含溴有机物C.乙炔与溴水反响只能生成一种含溴有机物D.乙炔与足量氯化氢反响只能生成一种含氯有机物解析:选B甲烷与氯气反响可以生成四种含氯有机物,乙炔与溴水反响可以生成两种含溴有机物,乙炔与足量氯化氢反响能生成多种含氯有机物,而乙烯与溴水反响能生成一种含溴有机物.2.关于2-丁烯结构或性质的表达正确的选项是()A.分子中四个碳原子在同一直线上B.分子中所有原子都在同一平面上C.与HCl加成只生成一种产物D.不能发生加聚反响解析:选C2-丁烯相当于两个甲基取代乙烯双键两端的两个H原子后形成的,所以四个碳原子不可能在同一直线上,A错;2-丁烯分子中存在甲基,所有原子不可能在同一平面上,B错;2-丁烯与HCl加成的产物只有一种,C正确;2-丁烯中含有碳碳双键,可以发生加聚反响.3.以下化合物能在一定条件下发生加聚反响,生成的是()A .氯乙烯和乙烯B .2-氯丙烯C .2-氯-1-丁烯D .2-氯-2-丁烯解析:选A 加聚反响可以看成是特殊的加成反响 ,先把双键翻开再相互连接起来 ,所以只要找到新形成的化学键 ,就很容易得到对应的单体 .4.某炔烃经催化加氢后 ,得到2-甲基丁烷 ,该炔烃是( )A .2-甲基-1-丁炔B .2-甲基-3-丁炔C .3-甲基-1-丁炔D .3-甲基-2-丁炔解析:选C 2-甲基丁烷的结构简式为CH 3CHCH 3CH 2CH 3 ,其对应的炔烃只能为CH 3CHCH 3CCH(3-甲基-1-丁炔) .5.写出以下反响的化学方程式 ,并指出反响类型 .(1)乙炔与氢气用镍作催化剂在加热条件下发生反响生成乙烷____________________ , ____________________________________________________ .(2)乙烯和水用硫酸作催化剂在加热条件下发生反响______________________________ ,__________________________ .(3)1,3-丁二烯与Br 2 1∶1发生反响 .______________ ,_________________;_________________________ ,______________________________________ .(4)环己烷与Cl 2在光照条件下反响生成一氯取代产物 .____________ ,______________________________________ .解析:(1)乙炔与H 2发生加成反响生成乙烷 .(2)乙烯与水发生加成反响生成乙醇 .(3)CH 2 = = =CH -CH = = =CH 2与Br 2发生1,2-加成生成,发生1,4-加成生成. (4)环己烷与Cl 2在光照条件下发生取代反响生成.答案:(1)CH ≡CH +2H 2――→Ni △CH 3CH 3 加成反响 (2)CH 2 = = =CH 2+H 2O ――→催化剂△CH 3CH 2OH 加成反响 (4) 1.以下有关烃的说法正确的选项是( )A .乙烯和乙炔中都存在碳碳双键B .甲烷和乙烯都可与氯气反响C .高锰酸钾可以氧化甲烷和乙炔D .乙烯可以与氢气发生加成反响 ,但不能与H 2O 加成解析:选B A项乙炔中存在碳碳三键;B项甲烷与Cl2发生取代反响,乙烯与Cl2发生加成反响;C项高锰酸钾不能氧化CH4;D项乙烯可以与H2O发生加成反响生成乙醇.2.关于丙烯()结构或性质的表达中,正确的选项是()A.不能使KMnO4酸性溶液褪色B.不能在空气中燃烧C.能使溴的四氯化碳溶液褪色D.与HCl在一定条件下能加成,且只能得到一种产物解析:选C由于丙烯含有碳碳双键结构,能使KMnO4酸性溶液褪色,A项错误;丙烯与乙烯的组成元素是相同的,可以燃烧,B项错误;丙烯也能和溴的四氯化碳溶液发生加成反响,使溴的四氯化碳溶液褪色,C项正确;乙烯与HCl加成只生成一种产物一氯乙烷,但是由于与HCl加成,氯原子连接的位置有两种,故加成产物也应该有两种,分别为和,它们分子式相同,结构不同,互为同分异构体,故不是同一种物质,D项错误 .3.含一个叁键的炔烃,氢化后的产物结构简式为此炔烃可能有的结构有()A.1种B.2种C.3种D.4种解析:选B由于炔烃与氢气发生加成反响时,是相邻的两个不饱和的碳原子上增加两个氢原子,所以根据炔烃的加成产物取代炔烃中碳碳叁键的位置,应该是相邻的两个碳原子上都含有至|||少两个氢原子.其可能的结构情况是两种不同的位置.4.以下各项中可以说明分子式C4H6的某烃是1-丁炔而不是CH2 = = =CH -CH = = =CH2的是()A.燃烧有浓烟B.能使酸性KMnO4溶液褪色C.所有碳原子不在一条直线上D.与足量溴水反响,生成物上只有两个碳原子上有溴原子解析:选D二烯烃和炔烃都是不饱和烃,燃烧时都有大量的浓烟;都可以使酸性高锰酸钾溶液褪色;1-丁炔中所有的碳原子不可能在一条直线上,而CH2 = = =CH -CH = = =CH2中的所有碳原子也都不在一条直线上;在与溴水加成时,由于1,3-丁二烯不饱和的碳原子有4个,故加上去的溴原子处于4个碳原子上,而1-丁炔中不饱和的碳原子有2个,所以加成时溴原子只能加在两个碳原子上 .5.柠檬烯是一种食用香料,其结构简式如图.有关柠檬烯的分析正确的选项是()A.它的核磁共振氢谱显示有6种峰B. 它和丁基苯()互为同分异构体C.它的分子中所有的碳原子一定在同一个平面上D.一定条件下,它分别可以发生加成、取代、氧化等反响解析:选D柠檬烯中有8种不同环境的H原子,即核磁共振氢谱显示有8种峰,A不正确;柠檬烯的分子式是C10H16 ,丁基苯的分子式是C10H14 ,分子式不同,B不正确;柠檬烯分子中所有的碳原子不可能在同一平面内,C不正确;碳碳双键可发生加成、氧化反响,烃基上的H可以被取代,D正确 .6.两种气态烃组成的混合气体0.1 mol ,完全燃烧得0.15 mol CO2和3.6 g H2O ,以下关于该混合气体的说法正确的选项是()A.一定有乙烯B.一定没有乙烯C.一定有乙烷D.一定有甲烷解析:选D 3.6 g H2O的物质的量是0.2 mol ,根据反响前后元素的原子个数不变,可知混合烃的平均化学式是CH4 ,C元素数小于1.5的只有甲烷,因此一定含有甲烷,甲烷分子中含有4个H原子,平均含有4个H原子,那么另外一种烃分子中含有的H原子个数也是4个,所以一定不含有乙烷,可能是乙烯,也可能是丙炔.7.某气态烃0.5 mol能与1 mol HCl加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,那么此气态烃可能是()A.HC≡CH B.CH2 = = =CH2C.CH≡C -CH3D.CH2 = = =C(CH3)2解析:选C 1 mol某气态烃能与2 mol HCl加成,故该烃为炔烃,或二烯烃而不是单烯烃,可排除选项B、D .1 mol加成产物分子上的氢原子又可被6 mol Cl取代,故该炔烃分子中的氢原子数为6-2=4 ,C项符合题意.8.三位科学家因在烯烃复分解反响研究中的杰出奉献而荣获2005年度诺贝尔化学奖,烯烃复分解反响可示意如下:以下化合物中,经过烯烃复分解反响可以生成的是()解析:选A从题中所给的信息得知,烯烃复分解反响双键的位置不会改变,并且不会断键,而要求制得的产物中双键的位置,从上面看,是在第三个碳原子上,从下面看是在第二个碳原子上,因此A选项正确.9.按要求填空.(1)相对分子质量为70的烯烃的分子式为__________;假设该烯烃与足量的H2加成后能生成含3个甲基的烷烃,那么该烯烃的可能的结构简式为__________________________________________________________________________________________________________ .(2)有机物A的结构简式为①假设A是单烯烃与氢气加成后的产物,那么该单烯烃可能有________种结构.②假设A是炔烃与氢气加成后的产物,那么此炔烃可能有________种结构.③假设A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构.a.写出A的该种同分异构体的结构简式:______________________________________ ________________________________________________________________________ .b.写出这种烯烃的顺、反异构体的结构简式:____________________________________ ________________________________________________________________________ .解析:(1)由烯烃的相对分子质量为70可得烯烃的分子式为C5H10;该烃加成后所得的产物(烷烃)中含有3个甲基,说明在烯烃分子中只含有一个支链.当主链为4个碳原子时, 支链为1个-CH3,此时烯烃的碳骨架结构为,其双键可在①②③三个位置,有三种可能的结构.(2)有机物A的碳骨架结构为,其双键可在①、②、③、④、⑤五个位置,而叁键只能处于①一个位置.10.玫瑰的香味物质中包含苧烯,苧烯的键线式为(1)1 mol苧烯最|||多可以跟__________mol H2发生反响.(2)写出苧烯跟等物质的量的Br2发生加成反响所得产物的可能的结构________________(用键线式表示) .(3)有机物A是苧烯的同分异构体,分子中含有"〞结构,A可能的结构为________________(用键线式表示) .(4)写出和Cl2发生1,4-加成反响的化学方程式__________________ .解析:(1)苧烯分子中含有2个CC,1 mol 苧烯最|||多能与2 mol H2发生加成反响 .(2)苧烯与等物质的量的溴加成 ,其中的某一个双键发生加成 .(3)苧烯的分子中含有,那么R 为-C4H9 ,丁基有4种同分异构体.答案:(1)2(2)、(3)(4)1.能说明某烃分子里含有碳碳不饱和键的是()A.分子组成中含碳氢原子个数比为1∶2B.完全燃烧生成等物质的量的CO2和H2OC.能与溴发生加成反响而使溴水褪色,还能使酸性KMnO4溶液褪色D.空气中燃烧能产生黑烟解析:选C含有碳碳不饱和键的物质能使溴水或酸性KMnO4溶液褪色.2.以下说法中,错误的选项是()A.无论乙烯与溴水的加成,还是乙烯能使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同D.利用燃烧的方法可以鉴别乙烯和甲烷解析:选C乙烯中含有碳碳双键,可与溴水发生加成反响,也可使酸性KMnO4溶液褪色 .因此可用溴水或KMnO4酸性溶液鉴别乙烯和乙烷,A、B两项正确;甲烷和乙烯中氢元素的含量不同,因此等质量的甲烷和乙烯完全燃烧后生成的水的质量不同,C项错误;甲烷燃烧产生淡蓝色火焰,乙烯燃烧火焰明亮并伴有黑烟,D项正确.3.鲨烯分子含有30个C原子及6个C = = =C且不含环状结构,那么其分子式为()A.C30H50B.C30H52C.C30H56D.C30H60解析:选A鲨烯分子含有30个C原子及6个C = = =C且不含环状结构,这说明相对于烷烃少12个氢原子.30个碳原子最|||多结合30×2+2=62个氢原子,那么该烃分子中含有62-12=50个氢原子,即分子式为C30H50 .4.始祖鸟烯(Pterodactyladiene)形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.那么以下有关始祖鸟烯的说法中正确的选项是() A.始祖鸟烯与乙烯互为同系物B.假设R1=R2=甲基,那么其化学式为C12H16C.假设R1=R2=甲基,那么始祖鸟烯的一氯代物有3种D.始祖鸟烯既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,那么两反响的反响类型是相同的解析:选C A项,始祖鸟烯为环状烯烃,与乙烯结构不同,不互为同系物,错误;B项,假设R1=R2=-CH3 ,那么其化学式为C12H14 ,错误;C项,假设R1=R2=甲基,那么有3种氢原子,一氯代物有3种,正确;D项,始祖鸟烯使酸性高锰酸钾溶液褪色,表达了始祖鸟烯的复原性,始祖鸟烯和溴水因发生加成反响而使得溴水褪色,原理不同,错误 .5.β-月桂烯的结构如以下图,一分子该物质与两分子溴发生加成反响的产物(只考虑位置异构)理论上最|||多有()A.2种B.3种C.4种D.6种解析:选C分子存在三种不同的碳碳双键,如图.1分子该物质与2分子Br2加成时,可以加成①②也可以加成①③或②③ ,还可以发生③与①②的1,4-加成,故所得产物共有4种,C项正确.6.某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,那么以下说法中正确的选项是()A.混合气体中一定没有乙炔B.混合气体中一定有乙烯C.混合气体可能由乙炔和丙烯组成D.混合气体一定由乙烯和乙炔组成解析:选C由题意推知混合物的平均相对分子质量为27 ,故必有一种物质的相对分子质量小于27 ,因此一定含有乙炔,乙炔相对分子质量为26 ,那么烯烃的相对分子质量必大于27 ,可以是乙烯、丙烯、丁烯等 .7.常压下,150 ℃ ,将CH4、C2H4、C3H4组成的混合气体x L ,与10x L氧气混合后充分燃烧,恢复到原温度和压强,那么此时的气体体积为()A.5x L B.11x LC.12x L D.无法计算解析:选B依题意,燃烧生成的水为气态.由三种烃的分子式特征可设燃烧通式为C n H4+(n+1)O2―→n CO2+2H2O ,因为n<4 ,所以该混合气体中氧气过量,由燃烧通式可知,反响前后气体体积不变,为11x L .8.:,如果要合成所用的原始原料可以是()①2-甲基-1,3-丁二烯和2-丁炔②1,3-戊二烯和2-丁炔③2,3-二甲基-1,3-戊二烯和乙炔④2,3-二甲基-1,3-丁二烯和丙炔A.①②B.②③C.③④D.①④解析:选D由题中信息知,炔烃断裂叁键中的一个键,然后与1,3-丁二烯发生1,4加成生成六元环状化合物.据此规律,用逆推法,按虚线处断裂可找回原料;按虚线处断裂可找回原料+(④);按虚线处断裂可找回原料+(①) .9.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,以以下图所示是有关合成路线图.反响:请完成以下各题:(1)写出物质的结构简式A________ ,C________ .(2)写出反响的化学方程式反响②___________________________________________________;反响③__________________________________________________________;反响⑥_____________________________________________________________ .10.异丁烯在催化剂存在下能发生加聚反响.(1)写出异丁烯聚合成的高分子化合物的结构简式:__________________ .(2)在一定条件下,二分子异丁烯之间也能发生加聚反响,生成两种二聚物A和B .A和B在催化剂作用下加氢后都能得到2,2,4-三甲基戊烷C .试写出A、B、C的结构简式:A________;B________;C________ .。
高中化学《脂肪烃》学案1(第一课时) 苏教版选修5

专题3《脂肪烃》学案(第一课时)第一单元脂肪烃教学目标:1.知识与技能①了解烷烃、烯烃、炔烃的物理性质的规律性变化。
②了解烷烃、烯烃、炔烃的结构。
2.过程与方法注意不同类型脂肪烃的结构和性质的对比;善于用于形象生动的实物、模型、多媒体课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力;要注意学生的主体性;培养学生的观察能力、实验能力、探究能力。
情感态度与价值观根据有机物的结构和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想。
教学重点:烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法。
教学难点:烯烃的顺反异构。
教学方法:交流讨论法教具准备:多媒体教学过程:知识点一、烷烃和烯烃1.物理性质递变规律[交流与讨论]P40完成P40图2-1结论:P40见课件2.结构和化学性质回忆甲烷、乙烯的结构和性质,引导学生讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。
[整理与归纳]P41化学反应类型小结完成课本中的反应方程式。
得出结论:取代反应:加成反应:聚合反应:[整理与归纳]进一步对比烷烃、烯烃的结构和性质:[拓展视野]丙稀与氯化氢反应后,会生成什么产物呢?试着写出反应方程式:烷烃和烯烃结构对比P42二烯烃的不完全加成特点:竞争加成 注意:当氯气足量时两个碳碳双键可以完全反应 3.烯烃的顺反异构体观察下列两组有机物结构特点:它们都是互为同分异构体吗? 归纳:什么是顺反异构?P32思考:下列有机分子中,可形成顺反异构的是A .CH 2=CHCH 3B .CH 2=CHCH 2CH 3—C —C —HHH H CH 3 CH 3—C —C —H HH H CH 3CH 3 第一组 C C =HHH 3CCH 3 C C =H HH 3CCH 3第二组C .CH 3CH =C(CH 3)2D .CH 3CH =CHCl知识点二、脂肪烃的来源与石油化学工业石油分馏是利用石油中各组分的沸点不同而加以分离的技术。
高二化学选修5 专题3第一单元脂肪烃 学案 含解析 精品

互动课堂疏导引导一、烃的基本知识 1.烃的分类烃分为脂肪烃和芳香烃,其中脂肪烃的分子中一定不含有苯环,芳香烃的分子中一定含有苯环。
根据脂肪烃的结构,人们把脂肪烃分为饱和烃和不饱和烃。
饱和烃:碳原子之间的共价键全部为碳碳单键,其中的碳原子皆为饱和碳原子。
如:烷烃。
不饱和烃:分子中含有双键和叁键等不饱和键的脂肪烃,其中的碳原子有不饱和碳原子。
如:烯烃、炔烃。
2.常见的脂肪烃⎪⎩⎪⎨⎧⎩⎨⎧炔烃烯烃简称不饱和烃不饱和脂肪烃乙烷甲烷烷烃简称饱和烃饱和脂肪烃脂肪烃)(),(:)( 二、脂肪烃的性质1.烷烃的性质 (1)物理性质随着碳原子数的增多,烷烃同系物的物理性质呈现周期性变化,即熔沸点逐渐升高,密度逐渐增大。
注:①所有烷烃均难溶于水,密度均小于1。
②常温下烷烃的状态:C 1—C 4 气态 C 5—C 16 液态 C 17—固态 (2)化学性质①与卤素单质的反应CH 3CH 3+Cl 2CH 3CH 2Cl+HCl可逐步取代,所得有机产物有:C 2H 5Cl 、C 2H 4Cl 2、C 2H 3Cl 3、C 2H 2Cl 4,C 2HCl 5、C 2Cl 6,其中氯乙烷为其一氯代物,以上物质均称为氯代物。
取代反应:像烷烃的卤代反应那样,有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应。
②与氧气的反应CH 4+2O 2−−→−点燃CO 2+2H 2O C n H 2n +2+213+n O 2−−→−点燃nCO 2+(n+1)H 2O 知识总结不同的烃,碳元素所占的质量分数有所不同。
分子中碳原子数相同而碳元素的质量分数越低的烃,完全燃烧时放出的热量越多。
在所有烃中,烷烃(特别是甲烷)的碳元素的质量分数比相应的其他烃都低。
因此人们倾向于选用烷烃,尤其是相对分子质量小的烃作燃料。
2.烯烃、炔烃的性质 (1)物理性质①烯烃:随着分子里碳原子数的增加:a 状态:g→l→s ;b 沸点:逐渐升高;c 密度:逐渐变大(但小于1 g·cm -3)。
苏教版高中化学选修五课件专题3-第1单元-第1课时

灿若寒星整理制作
第一单元 脂肪烃 第 1 课时 脂肪烃的性质
教师用书独具演示
●课标要求 1.以烷、烯、炔的代表物为例,比较它们在组成、结 构、性质上的差异。 2.认识取代、加成反应和加聚反应特点。
●课标解读 1.了解烷、烯、炔在组成、结构和性质上的差异及应 用。 2.领会取代、加成和加聚反应的原理。 ●教学地位 脂肪烃是烃类物质的一大类,主要来源于石油,弄清其 组成、结构和性质也就十分重要。近几年高考试题均有涉及。
【答案】 (1)2-甲基-1,3-丁二烯(异戊二烯) (2)C5H8O2
(4)加成反应 加成反应
加成反应与取代反应的区别
加成反应
取代反应
构成有机化合物不饱和键的 有机化合物分子中
概 两个原子与其他原子或原子 的某些原子或原子
念 团直接结合而生成新物质的 团被其他原子或原
反应
子团所代替的反应
“断一、加二,都进 来”“断一”是指双键或叁 特 键中的一个不稳定键断裂; “上一下一,有进 点 “加二”是指加两个其他原 有出” 子或原子团,每一个不饱和 碳原子上各加上一个
【解析】 注意到碳碳单键可以旋转,则可判断上述聚
合物重复的结构单元(即链节)为
,该聚合物的结构
简式为
,是由单体 CHCl===CHCl 通过加聚反应得
到的,其分子组成为(C2H2Cl2)n,其相对分子质量为 97n。 【答案】 CD
注意单体,链节的区别:单体是加聚反应的反应物小分 子,链节是高分子结构中的重复单元。
1.脂肪烃的分类 脂肪烃饱和烃:烷烃不饱和烃含双键的烯烃含叁键的炔 烃
2.脂肪烃的物理性质
物理 性质
状态
溶解 性
沸点
高中化学专题3第一单元第1课时脂肪烃的类别烷烃学案苏教版选修5

第一单元 脂肪烃第1课时 脂肪烃的类别 烷烃[学习目标定位] 1.熟知脂肪烃的类别及各类烃的通式、结构特点。
2.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
3.知道烷烃的化学性质。
1.甲烷的分子式是CH 4,结构式是,空间构型是正四面体型。
(1)通常状况下,甲烷性质稳定,与强酸、强碱、强氧化剂都不反应,但在特定条件下,甲烷也能发生某些反应。
(2)甲烷在空气中安静的燃烧,火焰呈淡蓝色,反应的化学方程式:CH 4+2O 2――→点燃CO 2+2H 2O 。
(3)甲烷与Cl 2在光照条件下发生反应的化学方程式:CH 4+Cl 2――→光照CH 3Cl +HCl(只写第一步),该反应为取代反应。
甲烷与Cl 2发生反应的产物有5种,其中常温下为气态的有2种,具有正四面体结构的物质是CCl 4,产物中量最多的是HCl 。
2.烃是仅由C 、H 两种元素组成的有机化合物,又叫碳氢化合物。
下列有机化合物中属于链烃的是①⑤⑥,环烃的是②③,芳香烃的是②,脂肪烃的是①③⑤⑥。
探究点一 脂肪烃的类别与通式烃分为脂肪烃和芳香烃。
常见的脂肪烃类别如下: 1.饱和脂肪烃分为烷烃和环烷烃(1)它们结构上的相同点是碳原子之间全以单键相结合。
(2)它们结构上的不同点是烷烃分子中碳原子形成碳链、环烷烃分子中形成碳环。
(3)烷烃的通式为C n H2n+2(n≥1),环烷烃的通式为C n H2n(n≥3)。
2.不饱和脂肪烃分为不饱和链烃和不饱和环烃(1)常见的不饱和链烃有单烯烃、炔烃、二烯烃,它们的通式分别为C n H2n(n≥2)、C n H2n-2(n≥2)、C n H2n-2(n≥4)。
(2)常见不饱和链烃在结构上的相同点是分子中碳原子结合为碳链,不同点是分子中的官能团种类或数目不同。
(3)不饱和环烃如环烯烃,其通式为C n H2n-2(n≥3),分子结构特点是分子中含有1个碳碳双键的环烃。
[归纳总结](1)脂肪烃分子结构中一定不含有苯环,含有苯环的烃一定为芳香烃。
河北省临漳县第一中学苏教版化学选修五专题三第一单元脂肪烃 学案
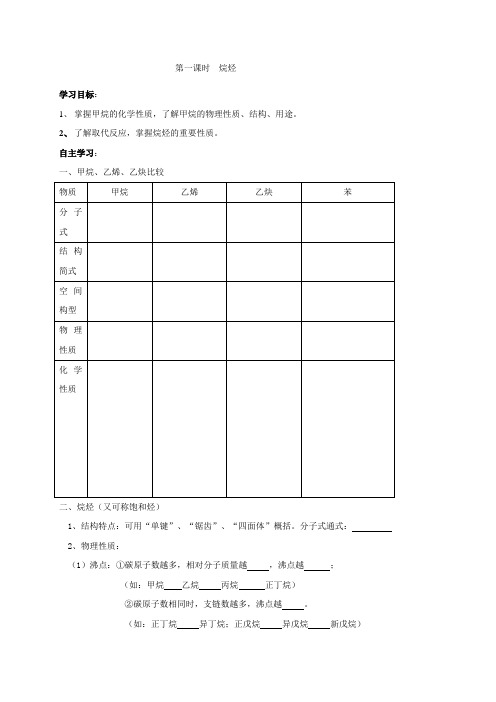
第一课时烷烃学习目标:1、掌握甲烷的化学性质,了解甲烷的物理性质、结构、用途。
2、了解取代反应,掌握烷烃的重要性质。
自主学习:一、甲烷、乙烯、乙炔比较二、烷烃(又可称饱和烃)1、结构特点:可用“单键”、“锯齿”、“四面体”概括。
分子式通式:2、物理性质:(1)沸点:①碳原子数越多,相对分子质量越,沸点越;(如:甲烷乙烷丙烷正丁烷)②碳原子数相同时,支链数越多,沸点越。
(如:正丁烷异丁烷;正戊烷异戊烷新戊烷)③常温常压下是气体的烷烃,其碳原子数,此外,新戊烷常温常压下也是气体。
(2)密度:碳原子数越多,密度越大;液态烷烃的密度小于水的密度。
(3)溶解性:不溶于水,易溶于有机溶剂。
有的液态烷烃本身就是有机溶剂,如己烷。
3、化学性质:一般比较稳定。
与酸、碱、氧化剂都不发生反应,也难与其它物质化合。
(1)取代反应写出乙烷光照下与Cl2反应生成一氯乙烷的方程式(2)氧化反应燃烧的通式:随着碳原子数的增加,往往燃烧越来越不充分,火焰明亮,并伴有黑烟。
(不能使酸性KMnO4溶液褪色)(3)高温分解反应:甲烷隔绝空气高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石油化工上有很重要的应用,称为_________________。
例1.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是( C )A.①是CCl4,②是苯,③是酒精B.①是酒精,②是CCl4,③是苯C.①是苯,②是CCl4,③是酒精D.①是苯,②是酒精,③是CCl4例2.有下列五种物质:①2-甲基丁烷;②2,2-二甲基丙烷;③戊烷;④丙烷;⑤丁烷。
它们的沸点由高到低的顺序正确的是( D )A.①②③④⑤B.②③④⑤①C.④⑤②①③D.③①②⑤④例3.不能支持甲烷分子是正四边形结构的事实是( B )A.一氯甲烷只有一种结构B.二氯甲烷只有一种结构C.三氯甲烷只有一种结构D.四氯甲烷只有一种结构例4.如图所示,把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,试推测可观察到的现象是:(1)(2)(3)(4)[参考答案](1)黄绿色逐渐消失;(2)试管壁上有黄色油珠;(3)水位在试管内上升;(4)水槽内有少量晶体析出。
2018-2019学年苏教版选修5 专题3 第一单元 脂肪烃 第1课时 学案

第一单元脂肪烃第1课时脂肪烃的类别烷烃[学习目标定位]1.熟知脂肪烃的类别及各类烃的通式、结构特点。
2.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
3.知道烷烃的化学性质。
一、烃的分类和脂肪烃的类别与通式1.烃的分类(1)脂肪烃:不含苯环芳香烃:含有苯环(2)不饱和烃:含有双键或叁键等不饱和键的脂肪烃饱和烃:不含不饱和键的脂肪烃,如烷烃(3)链状烃:烃分子中碳和碳之间的连接呈链状,可以含有支链。
(4)环状烃:烃分子中含有碳环。
分子中含有的碳环不是苯环的烃,称为脂环烃,如环己烷;分子中含有一个或多个苯环的一类碳氢化合物,称为芳香烃,如苯。
2.烷烃的结构特点与通式(1)甲烷的分子式是CH 4,结构式是,空间构型是正四面体型。
(2)有下列三种有机物:a.CH 3—CH 3b .CH 3—CH 2—CH 3c .CH 3—CH 2—CH 2—CH 3①它们共同的结构特点是碳原子间都以碳碳单键形成碳链、碳原子剩余的价键全部被氢原子饱和,其类别是烷烃(饱和链烃)。
②它们在分子组成上的主要差别是相差一个或若干个CH 2原子团,其通式是C n H 2n +2(n ≥1)。
3.烯烃、炔烃的结构特点与通式分析比较下列两组有机物,回答下列问题:A组:①CH2===CH2②CH2===CH—CH3③CH3—CH===CH—CH3B组:①CH≡CH②CH3—C≡CH③CH≡C—CH2—CH3(1)A组有机物的官能团是,类别是烯烃,它们在分子组成上的主要差别是相差一个或若干个CH2原子团,其通式是C n H2n(n≥2)。
(2)B组有机物在分子结构上的相同点是都含有一个—C≡C—,在分子组成上的主要差别是相差一个或若干个CH2原子团,其通式是C n H2n-2(n≥2)。
同系物的概念与判断(1)概念:结构相似,分子组成上相差一个或若干个CH2原子团的物质互为同系物。
(2)同系物的判断要点①一差(分子组成至少相差一个CH2原子团;相对分子质量相差14或14的整数倍)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一单元 脂肪烃第1课时 脂肪烃的类别 烷烃[学习目标定位] 1.熟知脂肪烃的类别及各类烃的通式、结构特点。
2.知道烷烃的物理性质的变化与分子中碳原子数目的关系。
3.知道烷烃的化学性质。
1.甲烷的分子式是CH 4,结构式是,空间构型是正四面体型。
(1)通常状况下,甲烷性质稳定,与强酸、强碱、强氧化剂都不反应,但在特定条件下,甲烷也能发生某些反应。
(2)甲烷在空气中安静的燃烧,火焰呈淡蓝色,反应的化学方程式:CH 4+2O 2――→点燃CO 2+2H 2O 。
(3)甲烷与Cl 2在光照条件下发生反应的化学方程式:CH 4+Cl 2――→光照CH 3Cl +HCl(只写第一步),该反应为取代反应。
甲烷与Cl 2发生反应的产物有5种,其中常温下为气态的有2种,具有正四面体结构的物质是CCl 4,产物中量最多的是HCl 。
2.烃是仅由C 、H 两种元素组成的有机化合物,又叫碳氢化合物。
下列有机化合物中属于链烃的是①⑤⑥,环烃的是②③,芳香烃的是②,脂肪烃的是①③⑤⑥。
探究点一 脂肪烃的类别与通式烃分为脂肪烃和芳香烃。
常见的脂肪烃类别如下: 1.饱和脂肪烃分为烷烃和环烷烃(1)它们结构上的相同点是碳原子之间全以单键相结合。
(2)它们结构上的不同点是烷烃分子中碳原子形成碳链、环烷烃分子中形成碳环。
(3)烷烃的通式为C n H2n+2(n≥1),环烷烃的通式为C n H2n(n≥3)。
2.不饱和脂肪烃分为不饱和链烃和不饱和环烃(1)常见的不饱和链烃有单烯烃、炔烃、二烯烃,它们的通式分别为C n H2n(n≥2)、C n H2n-2(n≥2)、C n H2n-2(n≥4)。
(2)常见不饱和链烃在结构上的相同点是分子中碳原子结合为碳链,不同点是分子中的官能团种类或数目不同。
(3)不饱和环烃如环烯烃,其通式为C n H2n-2(n≥3),分子结构特点是分子中含有1个碳碳双键的环烃。
[归纳总结](1)脂肪烃分子结构中一定不含有苯环,含有苯环的烃一定为芳香烃。
(2)环烷烃和单烯烃、炔烃和二烯烃它们的通式相同,但不是同系物。
(3)通式相同、类别不同的同碳烃类互为同分异构体。
[活学活用]1.科学家对卫星图像进行了分析,发现月球形成时可能存在稀薄的原始大气层,主要由氖、氢、氦、氩等气体组成,不含甲烷等碳氢化合物。
下列关于碳氢化合物的叙述正确的是( ) A.碳氢化合物的通式为C n H2n+2B.燃烧产物为二氧化碳和水的化合物一定是碳氢化合物C.碳原子间存在单键相连的烃是烷烃D.碳氢化合物分子的相对分子质量一定是偶数答案 D解析C n H2n+2只是烷烃的通式,A错误;燃烧产物为二氧化碳和水的化合物不一定是碳氢化合物,化学式为C x H y O z的有机物的燃烧产物也是二氧化碳和水,B错误;碳原子间全部以单键相连的链烃才是烷烃,C错误;因为碳原子的相对原子质量(12)为偶数,烃分子中的氢原子数也一定为偶数,所以碳氢化合物分子的相对分子质量一定是偶数是正确的。
2.下列说法正确的是( )A.烷烃、烯烃、炔烃和苯及其同系物都属于脂肪烃B.烷烃、烯烃、炔烃都属于脂肪烃C.苯及其同系物属于脂环烃D.烷烃、烯烃、炔烃都属于饱和烃答案 B解析烃的分类依据不同,有苯环的是芳香烃而不是脂肪烃。
探究点二烷烃的性质1.直链烷烃的熔点和沸点图如下:物理性质 变化规律状态 当碳原子数小于或等于4时,烷烃在常温下呈气态,其他的烷烃常温下呈固态或液态(新戊烷常温下为气态)溶解性 都不溶于水,易溶于有机溶剂沸点随碳原子数的增加,沸点逐渐升高。
碳原子数相同的烃,支链越多,沸点越低相对密度随碳原子数的增加,相对密度逐渐增大。
烷烃的密度小于水的密度2.物质的组成、结构决定物质性质,这个规律在有机物中体现的更为明显。
烷烃的化学性质与甲烷相似:(1)稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
(2)特征反应——取代反应烷烃可与卤素单质在光照条件下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(3)氧化反应——可燃性烷烃可在空气或氧气中燃烧生成CO 2和H 2O ,燃烧的通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(4)分解反应——高温裂化或裂解烷烃受热时会分解生成含碳原子数较少的烷烃和烯烃,如:C 16H 34――→催化剂高温C 8H 16+C 8H 18。
[归纳总结](1)随碳原子数的增加,烷烃物理性质的递变规律:熔点、沸点逐渐升高,相对密度逐渐增大,状态:常温下,气态(碳原子数≤4)→液态→固态(新戊烷除外)。
(2)烷烃的化学性质很稳定,常温下与强酸、强碱、强氧化剂不发生反应,能燃烧发生氧化反应,与卤素能发生取代反应,高温下发生裂化(或裂解)反应。
[活学活用]3.①丁烷②2甲基丙烷③戊烷④2甲基丁烷⑤2,2二甲基丙烷物质的沸点排列顺序正确的是( )A.①>②>③>④>⑤ B.⑤>④>③>②>①C.③>④>⑤>①>② D.②>①>⑤>④>③答案 C解析对于烷烃而言,含有碳原子数多,相对分子质量大的烃,分子间作用力大,沸点较高,即沸点(③、④、⑤)>(①、②);对于含有相同碳原子数的烷烃,支链越多,沸点越低,即①>②,③>④>⑤,故有③>④>⑤>①>②。
4.下列有关烷烃的叙述中,不正确的是( )A.在烷烃分子中,所有的化学键都是单键B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去C.分子通式为C n H2n+2的烃一定是烷烃D.甲烷在光照条件下能与氯气发生取代反应答案 B解析烷烃分子中碳原子之间全部以碳碳单键结合成链状,碳原子的剩余价键全部跟氢原子相结合而达饱和,无论是碳碳键还是碳氢键,都是单键,选项A说法正确;烷烃属饱和链烃,其化学性质一般比较稳定,通常烷烃不与酸、碱、氧化剂(如酸性KMnO4溶液)反应,选项B 说法不正确;因分子通式C n H2n+2中的氢原子已达完全饱和,因此符合通式C n H2n+2的烃一定是烷烃,选项C说法正确;甲烷在光照条件下能与氯气发生取代反应,这是甲烷的化学性质之一,选项D说法正确。
1.判断两种有机物互为同系物的关键:一看是否是同类物质,二看是否结构相似,三看是否相差“CH2”原子团。
2.比较烷烃的熔点、沸点思维流程:3.烷烃的分子结构特点:碳原子以单键形成链状结构;烷烃的主要性质:(1)取代(光照)、(2)氧化(点燃)、(3)分解(高温)。
1.下列物质属于脂肪烃的是( )A.①② B.②③ C.①③ D.②④答案 A2.下列说法中,正确的是( )A.烷烃的分子中,所有碳原子不可能位于同一平面上B.随着碳原子数的增加,烷烃的熔沸点逐渐降低C.所有的烷烃在光照条件下都能与Cl2发生取代反应D.所有的烷烃间一定互为同系物答案 C解析烷烃分子中的所有碳原子可能位于同一平面上(如CH3—CH3、CH3CH2CH3),也可能不都位于同一平面上[如(CH3)2CHCH3分子中最多只有3个碳原子共平面];随着碳原子数的增加,烷烃的分子间作用力逐渐增大,使其熔沸点逐渐升高;烷烃的特征反应是取代反应,也就是说烷烃在光照条件下都能与Cl2等卤素单质发生取代反应;分子式相同的不同烷烃之间互为同分异构体,分子式不同的烷烃之间互为同系物。
3.下列有关简单的烷烃的叙述中正确的是( )①都是易燃物②特征反应是取代反应③相邻两个烷烃在分子组成上相差一个甲基A.①和③ B.②和③C.只有① D.①和②答案 D解析烷烃含有碳和氢两种元素,都能燃烧生成二氧化碳和水,①正确;烷烃都易发生取代反应,②正确;相邻两个烷烃在分子组成上相差一个CH2,③不正确。
4.若要使0.5 mol甲烷和Cl2发生取代反应,并生成相同物质的量的四种取代物,则需要Cl2的物质的量为( )A.2.5 mol B.2 molC.1.25 mol D.0.5 mol答案 C解析相同物质的量的四种取代物即分别有0.125 mol CH3Cl、CH2Cl2、CHCl3、CC l4,则需Cl2:0.125×(1+2+3+4)=1.25 mol。
5.主链含5个碳原子,有甲基、乙基2个支链的烷烃有( )A.2种 B.3种 C.4种 D.5种答案 A解析符合题意要求的同分异构体有。
需要注意的是烷烃分子中乙基不能出现在第2位碳上,否则主链上就不是5个碳原子而是6个碳原子,如:。
6.根据碳的骨架对下列脂肪烃进行再分类:(1)CH3CH2CH3:_________________________________________________________;(2):______________________________________________________________;(3)CH2CH—CH2—CH3:___________________________________________________;(4)HCCCH2CH3:_________________________________________________________。
答案(1)烷烃(2)环烷烃(3)烯烃(4)炔烃[基础过关]一、甲烷的结构与性质1.CH4分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( ) A.CH3Cl不存在同分异构体B.CH2Cl2不存在同分异构体C.CHCl3不存在同分异构体D.CH4是气体分子答案 B2.光照对下列反应几乎没有影响的是( )A.氯气与氢气反应B.氯气与甲烷反应C.甲烷与氧气反应D.次氯酸分解答案 C解析甲烷与氧气点燃时才反应。
3.下列实验能获得成功的是( )①甲烷气体通入空气中点燃获得热量②甲烷气体通入氯水中制取一氯甲烷③甲烷通入酸性高锰酸钾溶液中,可使紫色褪去④甲烷通入浓硝酸中分解得到碳单质和氢气A.只有①② B.只有①C.只有④ D.①②③④答案 B解析甲烷分子结构稳定,通常不与强酸、强碱或强氧化剂反应,不能使溴水和酸性KMnO4溶液褪色。
但是在一定条件下,甲烷也会发生某些反应,如燃烧、与氯气的取代反应等。
4.我国西部地区的塔里木、柴达木、陕甘宁和四川盆地蕴藏着26万亿立方米的天然气资源,约占全国陆上天然气资源的87%。
关于天然气的下列叙述中不正确的是( )A.天然气和沼气的主要成分是甲烷B.改液化的石油气为天然气的燃料燃烧时,应减少进入的空气量或增大进入的天然气量C.天然气燃烧的废气中,二氧化硫等污染物的含量少D.天然气与空气混合点燃,不会发生爆炸答案 D解析可燃性气体如不纯时,点燃都有可能发生爆炸。
