硫及其化合物的化学方程式集锦
硫及其化合物的化学方程式

硫及其化合物的化学⽅程式⽅程式有H2SO3+2NaOH==Na2SO3+2H2O,2H2SO3+O2==2H2SO4,2Na+S=Na2S,SO3+H2O==H2SO4,SO2+2H2S=3S↓+2H2O,SO3+BaCl2+H2O==BaSO4↓+2HCl等。
关于硫的化学⽅程式1,⼆氧化硫⽣成三氧化硫。
2SO2+O2<--⾼温⾼压催化剂-->2SO32,亚硫酸⽣成亚硫酸钠。
H2SO3+2NaOH==Na2SO3+2H2O3,亚硫酸⽣成硫酸。
2H2SO3+O2==2H2SO44,三氧化硫⽣成硫酸。
SO3+H2O==H2SO45,三氧化硫⽣成硫酸钡。
SO3+BaCl2+H2O==BaSO4↓+2HCl6,硫酸⽣成⼆氧化硫。
Cu+2H2SO4(浓)==△==CuSO4+SO2↑+2H2O7,亚硫酸钠⽣成⼆氧化硫。
Na2SO3+H2SO4==Na2SO4+H2O+SO2↑硫和硫的化合物1、硫和钠反应的⽅程式:2Na+S=Na2S(条件:研磨)现象:轻微爆炸2、硫和铁反应的⽅程式:Fe+S=FeS(条件加热)3、硫和浓硫酸反应的化学⽅程式:S+2H2SO4=SO2↑+2H2O(条件:加热)4、硫和氢氧化钠溶液反应的化学⽅程式:3S+6NaOH=2Na2S+Na2SO3+3H2O(除硫的化学⽅法)5、SO2与⽔反应的⽅程式:SO2+H2O=H2SO3(可逆反应要⽤可逆符号)6、少量的SO2与NaOH溶液反应的化学⽅程式:SO2+2NaOH=Na2SO3+H2O7、过量的SO2与NaOH溶液反应的化学⽅程式:SO2+NaOH=NaHSO38、少量的SO2与澄清⽯灰⽔反应的化学⽅程式:SO2+Ca(OH)2=CaSO3↓+H2O9、少量的`SO2与饱和的碳酸氢钠溶液反应的化学⽅程式:SO2+2NaHCO3=Na2SO3+2CO2+H2O10、SO2与Na2SO3溶液反应的化学⽅程式:SO2+Na2SO3+H2O=2NaHSO311、SO2与氢硫酸反应的化学⽅程式:SO2+2H2S=3S↓+2H2O12、⼯业制硫酸的反应原理:2SO2+O2=2SO3(可逆反应、加热条件略)SO3+H2O=H2SO413、SO2与溴⽔反应的化学⽅程式:现象溴⽔褪⾊SO2+Br2+2H2O=2HBr+H2SO414、SO2与氯⽔反应的化学⽅程式:SO2+Cl2+2H2O=2HCl+H2SO415、SO2与酸性⾼锰酸钾溶液反应的离⼦⽅程式:15、SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+16、SO2与氯化铁溶液反应的离⼦⽅程式:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+17、SO2与双氧⽔反应的化学⽅程式:SO2+H2O2=H2SO418、实验室制SO2的反应原理:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O19、浓硫酸和H2S反应的化学⽅程式:H2SO4(浓)+H2S=S↓+SO2↑+2H2O20、铜和浓硫酸反应的化学⽅程式:Cu+2H2SO4(浓)=Cu2SO4+SO2↑+2H2O(加热条件⾃⼰写)21、碳和浓硫酸反应的化学⽅程式:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(加热条件⾃⼰写)。
非金属方程式(三)硫及其化合物化学方程式

硫及其化合物方程式1.硫与钠、铁、铜、汞反应化学方程式:S+2Na Na 2S S+Fe FeS S+2CuCu 2S S+Hg= HgS 2、硫与氧气、氢气反应化学方程式:S+O 2SO 23、硫和浓硫酸、浓硝酸反应化学方程式:S+2H 2SO 4(浓)3SO 2↑ +2H 2O S+6HNO 3(浓)=H 2SO 4+6NO 2 ↑+2H 2O4、硫和氢氧化钠溶液反应化学方程式:3S+6NaOH 2Na 2S+Na 2SO 3+3H 2O5、二氧化碳、二氧化硫分别和水反应化学方程式:CO 2+H 2O H 2CO 3 SO 2+H 2O H 2SO 36、二氧化碳、二氧化硫分别和氧化钙反应化学方程式:CO 2+CaO= CaCO 3 SO 2+CaO =CaSO 37、少量的二氧化碳、二氧化硫分别通入澄清石灰水反应化学方程式: CO 2+Ca(OH)2 = CaCO 3↓+H 2O SO 2+Ca(OH)2 = CaSO 3↓+H 2O8. 过量的二氧化碳、二氧化硫分别通入澄清石灰水反应化学方程式:2CO 2+Ca(OH)2 = Ca(HCO 3)2 2SO 2+Ca(OH)2 = Ca(HSO 3)29少量CO 2、SO 2通入氨水中离子方程式:2NH 3·H 2O+CO 2 =2NH 4++CO 32-+H 2O2NH 3·H 2O+SO 2 =2NH 4++SO 32-+H 2O10、过量CO 2、SO 2通入氨水中离子方程式:NH 3·H 2O+CO 2 =NH 4++HCO 3- NH 3·H 2O+SO 2 =NH 4++HSO 3-11、水溶液中SO 2被酸性高锰酸钾、FeCl 3、 H 2O 2、氯水(溴水、碘水)、HNO 3等氧化剂氧化成硫酸根离子离子方程式5SO 2+2MnO 4-+2H 2O=5SO 42-+2Mn 2++4H +SO 2+ 2Fe 3+ +2H 2O=4H ++SO 42-+ 2Fe 2+ SO 2+H 2O 2=2H ++SO 42-SO 2+X 2+H 2O=4H ++SO 42-+2X - X 代表Cl 、Br 、I3SO 2+ 2H 2O +2NO 3- =3SO 42-+2NO+4H +12、SO 2与氧气反应化学方程式:2SO 2+O 2 2SO 3;13、SO 2通入氢硫酸中反应化学方程式:SO 2+2H 2S =3S↓+2H 2O14、少量或过量SO 2与NaHCO 3溶液反应化学方程式:SO 2+NaHCO 3=CO 2+NaHSO 315、少量CO 2、SO 2通入Ca(ClO)2溶液中反应化学方程式:Ca(ClO)2+ CO 2 +H 2O=CaCO 3↓+2HClOCa(ClO)2+ SO 2+ H 2O=CaSO 4↓+HClO+HC l16、Mg 分别和二氧化碳、二氧化硫反应2Mg+CO 2 2MgO+C2Mg+SO 2 2MgO+S Mg+S MgS17、SO 3分别和H 2O 、CaO 、Ca(OH)2反应SO 3+H 2O=H 2SO 4 CaO +SO 3=CaSO 4 SO 3+Ca(OH)2=CaSO 4+H 2O18、浓硫酸常温下Al 、Fe 会钝化,写出加热时浓硫酸与铁反应化学方程式: === 点燃 === 点燃 === △ === 点燃 === 研磨2Fe+6H 2SO 4(浓) Fe 2(SO 4)3+3SO 2↑+6H 2O19、浓硫酸与少量Mg 、Zn 反应化学方程式:Mg +2H 2SO 4(浓)= MgSO 4+SO 2↑+2H 2OZn +2H 2SO 4(浓)= ZnSO 4+SO 2↑+2H 2O20、浓硫酸与足量Mg 、Zn 反应化学方程式:先:Mg +2H 2SO 4(浓)= MgSO 4+SO 2↑+2H 2O 再:Mg+H 2SO 4= MgSO 4+H 2↑ 先:Zn +2H 2SO 4(浓)= ZnSO 4+SO 2↑+2H 2O 再:Zn +H 2SO 4= ZnSO 4+H 2↑21、铜和浓硫酸加热条件下化学方程式:Cu +2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O22、碳和浓硫酸加热化学方程式:C +2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O23、硫和浓硫酸加热化学方程式:S +2H 2SO 4(浓)3 SO 2↑+2H 2O24、浓硫酸氧化NaI 、NaBr 化学方程式:2NaI+ 2H 2SO 4(浓)=Na 2SO 4+I 2+SO 2↑+ 2H 2O2NaBr+ 2H 2SO 4(浓)=Na 2SO 4+Br 2+SO 2↑+ 2H 2O25、工业制备硫酸4FeS 2+11022Fe 2O 3+8SO 2 2SO 2+O 2 2SO 3; SO 3+H 2O = H 2SO 4 26、H 2S 与O 2反应化学方程式:空气中:2H 2S+O 2(少量) 2S+2H 2O 2H 2S+3O 2(过量) 2SO 2+2H 2O 水溶液中:2H 2S+O 2=2S ↓+2H 2O27、H 2S 与X 2(X=Cl 、Br 、I)水溶液反应离子方程式:H 2S+X 2=S↓+2HX X:Cl 、Br 、I28、H 2S 与FeCl 3溶液反应离子方程式:H 2S+2Fe 3+=S↓+2H ++2Fe 2+29、H 2S 与SO 2、反应化学方程式:2H 2S+SO 2=3S↓+2H 2O30、H 2S 通入浓硫酸中化学方程式:H 2S + H 2SO 4(浓)= S↓+SO 2+2H 2O31、H 2S 通入H 2O 2中化学方程式: H 2O 2+H 2S=S↓+2H 2O32、硫化氢受热分解: 33、往CuSO 4溶液中通入H 2S 化学方程式:CuSO 4+H 2S=CuS↓+H 2SO 4离子方程式:Cu 2++H 2S=CuS↓+2H +34、用湿润的(CH 3COO)2Pb 试纸检验H 2S 化学方程式:(CH 3COO)2Pb+H 2S=PbS↓+2CH 3COOH35、将H 2S 通入Na 2S 溶液中化学方程式:Na 2S + H 2S =2NaHS36、实验室用硫化亚铁与稀硫酸反应制得硫化氢气体化学方程式:FeS+H 2SO 4(稀)=FeSO 4+H 2S↑37、用离子方程式解释Na 2S 为何被称为臭碱?S 2-+H 2O HS -+OH - HS - +H 2O H 2S+OH -38、硫化钠溶液和过量氯化铝溶液混合离子方程式:3S 2-+2Al 3++6H 2O=3H 2S↑+2Al(OH)3 ↓39、硫化钠溶液和过量氯化铁溶液混合离子方程式:S 2-+2Fe 3+= S↓+2Fe 2+40、过量硫化钠溶液和氯化铁溶液混合离子方程式:3S 2-+2Fe 3+= S↓+2FeS ↓ === 点燃=== 点燃 催化剂 △。
硫及其化合物方程式小结

硫及其化合物的化学方程式和离子方程式
1、铁与硫反应:
2、铜与硫反应:
3、硫在空气中燃烧:
4、硫与氢气反应:
5、SO2与水反应:
6、SO2与CaO反应:
7、SO2通入氯水中:
离子方程式:
8、SO2与H2S(气体、溶液均能反应):
9、澄清石灰水中通入少量SO2:
10、澄清石灰水中通入至过量SO2:
11、少量SO2通入中NaOH 溶液中:
离子方程式:
12、Na2SO3长期放置于空气中:
13、三氧化硫和水反应:
14、三氧化硫与氢氧化钠溶液反应:
15、硫化氢在少量的氧气中燃烧:
16、硫化氢在足量的氧气中燃烧:
17、氢硫酸中通入氯气:
18、氢硫酸中加入溴水:
19、氢硫酸中加入碘水:
20、氢硫酸中通入氧气:
21、向氢氧化钠溶液通入少量硫化氢:
22、向氢氧化钠溶液通入足量硫化氢:
23、硫酸铜溶液与氢硫酸混合:
24、加热硫化氢:
25、锌与稀硫酸反应:
26、氧化铜与稀硫酸反应:
27、铜与浓硫酸共热:
28、碳与浓硫酸共热:。
硫及其化合物的化学方程式集锦之欧阳学创编

硫及其化合物的化学方程式汇总时间:2021.03.03 创作:欧阳学一、硫单质Fe + S FeS (黑色不溶于水固体)2Cu + S Cu2S(黑色不溶于水固体)3Cl2+2Fe2FeCl3(棕黄色的固体,溶液为棕黄色)Cl2+Cu Cu Cl2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)3、硫在空气中燃烧: S + O2点燃SO24、硫与氢气反应: S+H2△H2S5、SO2与水反应:SO2+H2O H2SO36、钙基固硫: SO2+CaO==CaSO32CaSO3+ O2==2CaSO4二、硫化氢与氢硫酸1、受热分解H2S H2 + S2、往氢氧化钠溶液中通硫化氢气体H2S+ 2NaOH→Na2S +2 H2OH2S+ Na2S →2NaHS(连续反应)H2S+ 2NaOH→Na2S +2 H2OH2S+ NaOH→NaHS + H2O(平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H2S+X2→S+2HX(X2=Cl2、Br2、I2)4、H 2S + CuSO 4→ CuS ↓+ H 2SO 4(此反应可用于检验硫离子)H 2S + 2AgNO 3→Ag 2S ↓ + 2HNO 3H 2S + Pb (CH 3COO )2→PbS ↓ + 2CH 3COOH5、实验室制硫化氢气体FeS + 2HCl → FeCl 2 + H 2S ↑FeS + H 2SO 4→ FeSO 4 + H 2S ↑ 6、完全燃烧 方程式为2H 2S + 3O 22H 2O + 2SO 2不完全燃烧方程式为2H 2S + O 22H 2O + 2S7、H 2S +H 2SO 4(浓)→S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体)三、二氧化硫1、SO 2 + H 2O H 2SO 32、澄清石灰水中通入至过量SO 2:SO 2 + Ca(OH)2→CaSO 3↓+ H 2O (鉴别SO 2与 CO 2不能用澄清石灰水)SO 2 + CaSO 3 + H 2O →Ca (HSO 3)2(连续反应) SO 2(少量)+ Ca(OH)2→CaSO 3↓+ H 2OSO 2(过量) + Ca(OH)2→ Ca (HSO 3)2↓(平行反应)3、SO 2+CaO →CaSO 3→ 点燃→点燃2CaSO3+O2→2CaSO4(含硫煤燃烧时加生石灰)4、.少量SO2通入中NaOH溶液中:SO2+2NaOH==Na2SO3+H2OSO2 + 2OH-==SO32-+H2O5.二氧化硫的弱氧化性2H2S+SO2→3S+2H2O6、2SO2 + O2 2 SO37. SO2通入氯水中:SO2+Cl2+2H2O==H2SO4+2HClSO2+Cl2+2H2O==4H++SO42-+2Cl-8、SO2通入卤水中: SO2+X2+2H2O==H2SO4+2HXSO2+X2+2H2O==4H++SO42-+2X-(X=Cl、Br、I)9、SO2与H2S(气体、溶液均能反应):SO2+2H2S==3S↓+2H2O (氧化产物:还原产物=2:1)10、SO2 +2 FeCl3 +2H2O→H2SO4+2FeCl2+2HCl11、5SO2 + 2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO412、实验室制二氧化硫Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O13、酸雨形成的两个途径途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+H 2O→H2SO4途经2:SO 2 + H2O H2SO32H2SO3 +O2→2H2SO43NO2 + H2O==2HNO3 + NO14、Na2SO3长期放置于空气中:2Na2SO3 +O2→2Na2SO415.亚硫酸钠除余氯的原理Cl2+2Na2SO3+H2O →2Na2SO4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H2SO4(浓) NaHSO4+HCl(微热)NaCl+ NaHSO4 Na2SO4+HCl(连续反应)2NaCl+H2SO4(浓) NaHSO4+HCl2NaCl+H2SO4(浓) Na2SO4+2HCl(平行反应)NaNO3+H2SO4(浓) NaHSO4+HNO3(微热,硝酸受热易分解)CaF2+H2SO4(浓) CaSO4+2HF(不能在玻璃仪器中制取)2、Cu + 2H2SO4(浓)2SO2↑+CuSO4+2H2O3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H2SO4(浓)3SO2↑+Fe2(SO4)3+6H2OFe +Fe2(SO4)3→3FeSO4Fe+H2SO4→FeSO4+H2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2OZn+H2SO4→ZnSO4+H2↑6、浓硫酸不能干燥氨气、H2S、HBr、HI2NH3+H2SO4→( NH4)2SO4H2S +H2SO4(浓)→S +SO2 ↑+2H2O2HBr +H2SO4(浓)→ Br2+SO2 ↑+2H2O2HI+H2SO4(浓)→ I2+SO2 ↑+2H2O7、实验室用硫酸制取的气体制氢气:Zn+H2SO4→ZnSO4+H2↑制硫化氢:FeS + H2SO4→ FeSO4 + H2S ↑制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl(微热)2NaCl+H2SO4(浓) Na2SO4+2HCl(平行反应)制二氧化硫:Na 2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O 制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑8、硫酸的工业制备原理:4FeS2+11O22Fe2O3+8SO2 2SO2+ O2 2 SO3SO3+H2O→H2SO4尾气吸收: SO2(少量)+2NH3+H2O→(NH4)2SO3SO2+(NH4)2SO3+H2O→2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O→(NH4)2SO3SO2(足量)+ NH3+H2O→NH4HSO3(平行反应)。
硫及其化合物的化学方程式

硫及其化合物的化学方程式方程式有H2SO3+2NaOH==Na2SO3+2H2O,2H2SO3+O2==2H2SO4,2Na+S=Na2S,SO3+H2O==H2SO4,SO2+2H2S=3S↓+2H2O,SO3+BaCl2+H2O==BaSO4↓+2HCl等。
关于硫的化学方程式1,二氧化硫生成三氧化硫。
2SO2+O2--高温高压催化剂--2SO32,亚硫酸生成亚硫酸钠。
H2SO3+2NaOH==Na2SO3+2H2O3,亚硫酸生成硫酸。
2H2SO3+O2==2H2SO44,三氧化硫生成硫酸。
SO3+H2O==H2SO45,三氧化硫生成硫酸钡。
SO3+BaCl2+H2O==BaSO4↓+2HCl6,硫酸生成二氧化硫。
Cu+2H2SO4(浓)==△==CuSO4+SO2↑+2H2O7,亚硫酸钠生成二氧化硫。
Na2SO3+H2SO4==Na2SO4+H2O+SO2↑硫和硫的化合物1、硫和钠反应的方程式:2Na+S=Na2S(条件:研磨)现象:稍微爆炸2、硫和铁反应的方程式:Fe+S=FeS(条件加热)3、硫和浓硫酸反应的化学方程式:S+2H2SO4=SO2↑+2H2O(条件:加热)4、硫和氢氧化钠溶液反应的化学方程式:3S+6NaOH=2Na2S+Na2SO3+3H2O(除硫的化学方法)5、SO2与水反应的方程式:SO2+H2O=H2SO3(可逆反应要用可逆符号)6、少量的SO2与NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O7、过量的SO2与NaOH溶液反应的化学方程式:SO2+NaOH=NaHSO38、少量的SO2与澄清石灰水反应的化学方程式:SO2+Ca(OH)2=CaSO3↓+H2O9、少量的`SO2与饱和的碳酸氢钠溶液反应的化学方程式:SO2+2NaHCO3=Na2SO3+2CO2+H2O10、SO2与Na2SO3溶液反应的化学方程式:SO2+Na2SO3+H2O=2NaHSO311、SO2与氢硫酸反应的化学方程式:SO2+2H2S=3S↓+2H2O12、工业制硫酸的反应原理:2SO2+O2=2SO3(可逆反应、加热条件略)SO3+H2O=H2SO413、SO2与溴水反应的化学方程式:现象溴水褪色SO2+Br2+2H2O=2HBr+H2SO414、SO2与氯水反应的化学方程式:SO2+Cl2+2H2O=2HCl+H2SO415、SO2与酸性高锰酸钾溶液反应的离子方程式:15、SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+16、SO2与氯化铁溶液反应的离子方程式:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+17、SO2与双氧水反应的化学方程式:SO2+H2O2=H2SO418、试验室制SO2的反应原理:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O19、浓硫酸和H2S反应的化学方程式:H2SO4(浓)+H2S=S↓+SO2↑+2H2O20、铜和浓硫酸反应的化学方程式:Cu+2H2SO4(浓)=Cu2SO4+SO2↑+2H2O(加热条件自己写)21、碳和浓硫酸反应的化学方程式:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(加热条件自己写)。
硫及其化合物方程式
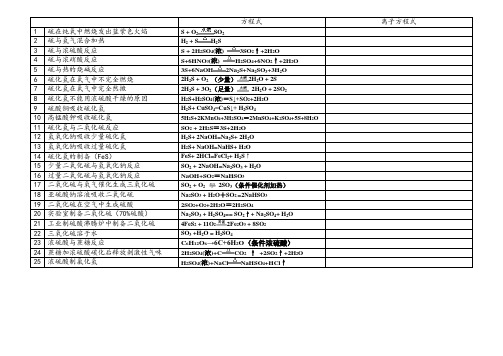
11
硫化氢与二氧化硫反应
SO2+ 2H2S=3S+2H2O
12
氢氧化钠吸收少量硫化氢
H2S+ 2NaOH=Na2S+ 2H2O
13
氢氧化钠吸收过量硫化氢
H2S+ NaOH=NaHS+ H2O
14
硫化氢的制备(FeS)
FeS+ 2HCl=FeCl2+ H2S↑
方程式
离子方程式
1
硫在纯氧中燃烧发出蓝紫色火焰
S + O2 SO2
2
硫与氢气混合加热
H2+ S H2S
3
硫与浓硫酸反应
S + 2H2SO4(浓) 3SO2↑+2H2O
4
硫与浓硝酸反应
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
5
硫与热的烧碱反应
3S+6NaOH 2Na2S+Na2SO3+3H2O
6
硫化氢在氧气中不完全燃烧
2H2S + O2(少量) 2H2O + 2S
7
硫化氢在氧气中完全然撒
2H2S + 3O2(足量) 2H2O + 2SO2
8
硫化氢不能用浓硫酸干燥的原因
H2S+H2SO4(浓)=S↓+SO2+2H2O
9
硫酸铜吸收硫化氢
H2S+ CuSO4=CuS↓+ H2SO4
10
高锰酸钾吸收硫化氢
2SO2+O2+2H2O=2H2SO4
(完整版)硫及其化合物的化学方程式集锦

硫及其化合物的化学方程式汇总一、硫单质 Fe + SFeS (黑色不溶于水固体) 2Cu + SCu 2S (黑色不溶于水固体) 3Cl 2+2Fe2FeCl 3 (棕黄色的固体,溶液为棕黄色) Cl 2+Cu Cu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)3、硫在空气中燃烧: S + O 2 点燃SO 24、硫与氢气反应: S+H 2 △ H 2S5、SO 2与水反应:SO 2+H 2O H 2SO 36、钙基固硫: SO 2+CaO==CaSO 3 2CaSO 3+ O 2==2CaSO 4二、硫化氢与氢硫酸1、受热分解H 2S H 2 + S2、往氢氧化钠溶液中通硫化氢气体H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ Na 2S → 2NaHS (连续反应)H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ NaOH → NaHS + H 2O (平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H 2S+X 2→S+2HX (X 2=Cl 2、Br 2、I 2)4、 H 2S + CuSO 4 → CuS ↓ + H 2SO 4(此反应可用于检验硫离子) H 2S + 2AgNO 3 → Ag 2S ↓ + 2HNO 3H 2S + Pb (CH 3COO )2 → PbS ↓ + 2CH 3COOH5、实验室制硫化氢气体FeS + 2HCl → FeCl 2 + H 2S ↑FeS + H 2SO 4 → FeSO 4 + H 2S ↑ 6、 完全燃烧 方程式为2H 2S + 3O 2 2H 2O + 2SO 2 不完全燃烧 方程式为 2H 2S + O 2 2H 2O + 2S7、H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体) 三、二氧化硫1、 SO 2 + H 2O H 2SO 32、澄清石灰水中通入至过量SO 2:SO 2 + Ca(OH)2 → CaSO 3↓+ H 2O (鉴别SO 2与 CO 2不能用澄清石灰水) SO 2 + CaSO 3 + H 2O → Ca (HSO 3)2(连续反应)SO 2 (少量)+ Ca(OH)2→ CaSO 3↓+ H 2OSO 2(过量) + Ca(OH)2 → Ca (HSO 3)2↓(平行反应)→ 点燃 → 点燃3、SO2+CaO→CaSO32CaSO3+O2→2CaSO4(含硫煤燃烧时加生石灰)4、.少量SO2通入中NaOH 溶液中:SO2+2NaOH==Na2SO3+H2OSO2 + 2OH-==SO32-+H2O5.二氧化硫的弱氧化性2H2S+SO2→3S+2H2O6、2SO2 + O2 2 SO37. SO2通入氯水中:SO2+Cl2+2H2O==H2SO4+2HClSO2+Cl2+2H2O== 4H++SO42-+2Cl-8、SO2通入卤水中: SO2+X2+2H2O==H2SO4+2HXSO2+X2+2H2O== 4H++SO42-+2X- (X=Cl、Br、I)9、SO2与H2S(气体、溶液均能反应):SO2+2H2S==3S↓+2H2O (氧化产物:还原产物=2:1)10、SO2 +2 FeCl3 +2H2O→H2SO4+2FeCl2+2HCl11、5SO2 + 2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO412、实验室制二氧化硫Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O13、酸雨形成的两个途径途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+ H 2O→H2SO4途经2:SO2 + H2O H2SO3 2H2SO3 +O2→2H2SO43NO2 + H2O==2HNO3 + NO14、Na2SO3长期放置于空气中:2Na2SO3 +O2→2Na2SO415.亚硫酸钠除余氯的原理Cl2+2Na2SO3 +H2O →2Na2SO4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)NaCl+ NaHSO4Na2SO4+HCl↑(连续反应)2NaCl+H2SO4(浓) NaHSO4+HCl↑2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)NaNO3+H2SO4(浓) NaHSO4+HNO3↑(微热,硝酸受热易分解)CaF2+H2SO4(浓) CaSO4+2HF↑(不能在玻璃仪器中制取)2、Cu + 2H2SO4(浓) 2SO2↑+CuSO4+2H2O3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H2SO4(浓) 3SO2↑+Fe2(SO4)3+6H2OFe +Fe2(SO4)3→3FeSO4Fe+H2SO4→FeSO4+H2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2OZn+H2SO4→ZnSO4+H2↑6、浓硫酸不能干燥氨气、H2S、HBr、HI2NH3+H2SO4→(NH4)2SO4H2S +H2SO4(浓) →S +SO2 ↑+2H2O2HBr +H2SO4(浓) →Br2 +SO2 ↑+2H2O2HI+H2SO4(浓) →I2 +SO2 ↑+2H2O7、实验室用硫酸制取的气体制氢气:Zn+H2SO4→ZnSO4+H2↑制硫化氢:FeS + H2SO4→FeSO4 + H2S ↑制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)制二氧化硫:Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑8、硫酸的工业制备原理:4FeS2+11O22Fe2O3+8SO2 2SO2 + O2 2 SO3SO3+H2O→H2SO4尾气吸收: SO2(少量)+2NH3+H2O →(NH4)2SO3 SO2+(NH4)2SO3+H2O →2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O →(NH4)2SO3SO2(足量)+ NH3+H2O →NH4HSO3(平行反应)。
硫及其化合物的化学方程式集锦

硫及其化合物的化学方程式汇总一、硫单质Fe + S FeS (黑色不溶于水固体)2Cu + S Cu2S(黑色不溶于水固体)3Cl2+2Fe2FeCl3(棕黄色的固体,溶液为棕黄色)Cl2+Cu Cu Cl2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)3、硫在空气中燃烧:S + O2点燃SO24、硫与氢气反应:S+H2△2S5、SO2与水反应:SO2+H2O H2SO36、钙基固硫:SO2+CaO==CaSO3 2CaSO3+ O2==2CaSO4二、硫化氢与氢硫酸1、受热分解H2S H2 + S2、往氢氧化钠溶液中通硫化氢气体H2 S+ 2NaOH→Na2S +2 H2OH2 S+ Na2S →2NaHS (连续反应)H2 S+ 2NaOH→Na2S +2 H2OH2 S+ NaOH→NaHS + H2O(平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H2S+X2→S+2HX(X2=Cl2、Br2、I2)4、H2S + CuSO4→CuS↓+ H2SO4(此反应可用于检验硫离子)H2S + 2AgNO3→Ag2S↓+ 2HNO3H2S + Pb(CH3COO)2→PbS↓+ 2CH3COOH5、实验室制硫化氢气体FeS + 2HCl →FeCl2 + H2S↑FeS + H2SO4→FeSO4 + H2S ↑6、完全燃烧方程式为2H2S + 3O22H2O + 2SO2不完全燃烧方程式为2H2S + O22H2O + 2S7、H2S +H2SO4(浓) →S +SO2 ↑+2H2O(不能用浓硫酸干燥硫化氢气体)三、二氧化硫1、SO2 + H2O H2SO32、澄清石灰水中通入至过量SO2:→点燃→点燃SO2 + Ca(OH)2→CaSO3↓+ H2O (鉴别SO2与CO2不能用澄清石灰水)SO2 + CaSO3 + H2O →Ca(HSO3)2(连续反应)SO2(少量)+ Ca(OH)2→CaSO3↓+ H2OSO2(过量)+ Ca(OH)2→Ca(HSO3)2↓(平行反应)3、SO2+CaO→CaSO32CaSO3+O2→2CaSO4(含硫煤燃烧时加生石灰)4、.少量SO2通入中NaOH 溶液中:SO2+2NaOH==Na2SO3+H2OSO2 + 2OH-==SO32-+H2O5.二氧化硫的弱氧化性2H2S+SO2→3S+2H2O6、2SO2 + O2 2 SO37. SO2通入氯水中:SO2+Cl2+2H2O==H2SO4+2HClSO2+Cl2+2H2O== 4H++SO42-+2Cl-8、SO2通入卤水中: SO2+X2+2H2O==H2SO4+2HXSO2+X2+2H2O== 4H++SO42-+2X- (X=Cl、Br、I)9、SO2与H2S(气体、溶液均能反应):SO2+2H2S==3S↓+2H2O (氧化产物:还原产物=2:1)10、SO2 +2 FeCl3 +2H2O→H2SO4+2FeCl2+2HCl11、5SO2 + 2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO412、实验室制二氧化硫Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O13、酸雨形成的两个途径途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+ H 2O→H2SO4途经2:SO2 + H2O H2SO3 2H2SO3 +O2→2H2SO43NO2 + H2O==2HNO3 + NO14、Na2SO3长期放置于空气中:2Na2SO3 +O2→2Na2SO415.亚硫酸钠除余氯的原理Cl2+2Na2SO3 +H2O →2Na2SO4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)NaCl+ NaHSO4Na2SO4+HCl↑(连续反应)2NaCl+H2SO4(浓) NaHSO4+HCl↑2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)NaNO3+H2SO4(浓) NaHSO4+HNO3↑(微热,硝酸受热易分解)CaF2+H2SO4(浓) CaSO4+2HF↑(不能在玻璃仪器中制取)2、Cu + 2H2SO4(浓) 2SO2↑+CuSO4+2H2O3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H2SO4(浓) 3SO2↑+Fe2(SO4)3+6H2OFe +Fe2(SO4)3→3FeSO4Fe+H2SO4→FeSO4+H2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2OZn+H2SO4→ZnSO4+H2↑6、浓硫酸不能干燥氨气、H2S、HBr、HI2NH3+H2SO4→(NH4)2SO4H2S +H2SO4(浓) →S +SO2 ↑+2H2O2HBr +H2SO4(浓) →Br2 +SO2 ↑+2H2O2HI+H2SO4(浓) →I2 +SO2 ↑+2H2O7、实验室用硫酸制取的气体制氢气:Zn+H2SO4→ZnSO4+H2↑制硫化氢:FeS + H2SO4→FeSO4 + H2S ↑制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)制二氧化硫:Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑8、硫酸的工业制备原理:4FeS2+11O22Fe2O3+8SO2 2SO2 + O2 2 SO3SO3+H2O→H2SO4尾气吸收: SO2(少量)+2NH3+H2O →(NH4)2SO3 SO2+(NH4)2SO3+H2O →2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O →(NH4)2SO3SO2(足量)+ NH3+H2O →NH4HSO3(平行反应)。
硫及其化合物的化学方程式集锦

硫及其化合物的化学方程式汇总一、硫单质 Fe + SFeS (黑色不溶于水固体) 2Cu + SCu 2S (黑色不溶于水固体) 3Cl 2+2Fe2FeCl 3 (棕黄色的固体,溶液为棕黄色) Cl 2+Cu Cu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)3、硫在空气中燃烧: S + O 2 点燃SO 24、硫与氢气反应: S+H 2 △ H 2S5、SO 2与水反应:SO 2+H 2O H 2SO 36、钙基固硫: SO 2+CaO==CaSO 3 2CaSO 3+ O 2==2CaSO 4二、硫化氢与氢硫酸1、受热分解H 2S H 2 + S2、往氢氧化钠溶液中通硫化氢气体H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ Na 2S → 2NaHS (连续反应)H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ NaOH → NaHS + H 2O (平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H 2S+X 2→S+2HX (X 2=Cl 2、Br 2、I 2)4、 H 2S + CuSO 4 → CuS ↓ + H 2SO 4(此反应可用于检验硫离子) H 2S + 2AgNO 3 → Ag 2S ↓ + 2HNO 3H 2S + Pb (CH 3COO )2 → PbS ↓ + 2CH 3COOH5、实验室制硫化氢气体FeS + 2HCl → FeCl 2 + H 2S ↑FeS + H 2SO 4 → FeSO 4 + H 2S ↑ 6、 完全燃烧 方程式为2H 2S + 3O 2 2H 2O + 2SO 2 不完全燃烧 方程式为 2H 2S + O 2 2H 2O + 2S7、H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体) 三、二氧化硫1、 SO 2 + H 2O H 2SO 32、澄清石灰水中通入至过量SO 2:SO 2 + Ca(OH)2 → CaSO 3↓+ H 2O (鉴别SO 2与 CO 2不能用澄清石灰水) SO 2 + CaSO 3 + H 2O → Ca (HSO 3)2(连续反应)SO 2 (少量)+ Ca(OH)2→ CaSO 3↓+ H 2OSO 2(过量) + Ca(OH)2 → Ca (HSO 3)2↓(平行反应)→ 点燃 → 点燃3、SO2+CaO→CaSO32CaSO3+O2→2CaSO4(含硫煤燃烧时加生石灰)4、.少量SO2通入中NaOH 溶液中:SO2+2NaOH==Na2SO3+H2OSO2 + 2OH-==SO32-+H2O5.二氧化硫的弱氧化性2H2S+SO2→3S+2H2O6、2SO2 + O2 2 SO37. SO2通入氯水中:SO2+Cl2+2H2O==H2SO4+2HClSO2+Cl2+2H2O== 4H++SO42-+2Cl-8、SO2通入卤水中: SO2+X2+2H2O==H2SO4+2HXSO2+X2+2H2O== 4H++SO42-+2X- (X=Cl、Br、I)9、SO2与H2S(气体、溶液均能反应):SO2+2H2S==3S↓+2H2O (氧化产物:还原产物=2:1)10、SO2 +2 FeCl3 +2H2O→H2SO4+2FeCl2+2HCl11、5SO2 + 2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO412、实验室制二氧化硫Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O13、酸雨形成的两个途径途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+ H 2O→H2SO4途经2:SO2 + H2O H2SO3 2H2SO3 +O2→2H2SO43NO2 + H2O==2HNO3 + NO14、Na2SO3长期放置于空气中:2Na2SO3 +O2→2Na2SO415.亚硫酸钠除余氯的原理Cl2+2Na2SO3 +H2O →2Na2SO4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)NaCl+ NaHSO4Na2SO4+HCl↑(连续反应)2NaCl+H2SO4(浓) NaHSO4+HCl↑2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)NaNO3+H2SO4(浓) NaHSO4+HNO3↑(微热,硝酸受热易分解)CaF2+H2SO4(浓) CaSO4+2HF↑(不能在玻璃仪器中制取)2、Cu + 2H2SO4(浓) 2SO2↑+CuSO4+2H2O3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H2SO4(浓) 3SO2↑+Fe2(SO4)3+6H2OFe +Fe2(SO4)3→3FeSO4Fe+H2SO4→FeSO4+H2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2OZn+H2SO4→ZnSO4+H2↑6、浓硫酸不能干燥氨气、H2S、HBr、HI2NH3+H2SO4→(NH4)2SO4H2S +H2SO4(浓) →S +SO2 ↑+2H2O2HBr +H2SO4(浓) →Br2 +SO2 ↑+2H2O2HI+H2SO4(浓) →I2 +SO2 ↑+2H2O7、实验室用硫酸制取的气体制氢气:Zn+H2SO4→ZnSO4+H2↑制硫化氢:FeS + H2SO4→FeSO4 + H2S ↑制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)制二氧化硫:Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑8、硫酸的工业制备原理:4FeS2+11O22Fe2O3+8SO2 2SO2 + O2 2 SO3SO3+H2O→H2SO4尾气吸收: SO2(少量)+2NH3+H2O →(NH4)2SO3 SO2+(NH4)2SO3+H2O →2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O →(NH4)2SO3SO2(足量)+ NH3+H2O →NH4HSO3(平行反应)。
硫和硫的化合物常用化学方程式

硫和硫的化合物常用化学方程式)(——)(————244232322S O S O H S O S O S O S S H 一、S (存在:游离态、化合态)硫磺,不溶于水,微溶于酒精,易溶于二硫化碳[CS 2] 化学性质:1.与非金属:S +O 2===SO 2 现象:在空气中发出微弱的淡蓝色火焰,在氧气中发出明亮的蓝紫色火焰 S +H 2H 2S2.与金属:S +FeFeS S +2Cu Cu 2S 二、SO 2(可引起酸雨,pH<5.6)实验室制法:Na 2SO 3+H 2SO 4===Na 2SO 4+SO 2↑+H 2O1.与H 2O 反应:SO 2+H 2O H 2SO 32.酸性氧化物:(1)SO 2+CaO===CaSO 3(2)SO 2和Ca(OH)2:①(少量SO 2)SO 2+Ca(OH)2===CaSO 3↓+H 2O②(过量SO 2)2SO 2+Ca(OH)2===Ca(HSO 3)2(3)SO 2和NH 3·H 2O :①(少量SO 2)SO 2+2NH 3·H 2O===(NH 4)2SO 3+H 2O②(过量SO 2)SO 2+NH 3·H 2O===NH 4HSO 33.还原性:①2SO 2+O 22SO 3②SO 2+Cl 2+2H 2O===H 2SO 4+2HCl (氯水褪色,Br 2、I 2反应相同)SO 2+Cl 2+2H 2O===4H ++SO 42-+2Cl -③5SO 2+2KMnO 4+2H 2O===K 2SO 4+2MnSO 4+2H 2SO 45SO 2+2MnO 4—+2H 2O===5SO 42—+2Mn 2++4H +④2Fe 3++SO 2+2H 2O===2Fe 2++4H ++SO 42-⑤2SO 2+O 2+2H 2O===2H 2SO 4(SO 2在大气中缓慢发生的环境化学反应) SO 2+H 2O 2===H 2SO 4SO 2+Na 2O 2===Na 2SO 44.氧化性:2H 2S +SO 2===3S ↓+2H 2O5.漂白性三、H 2SO 3、SO 32—(还原性酸,易被氧化)1.2H 2SO 3+O 2===2H 2SO 4 2Na 2SO 3+O 2===2Na 2SO 42.H 2SO 3+HClO===H 2SO 4+HCl ↑3.SO 2+NaHCO 3===NaHSO 3+CO 2 SO 2+Na 2CO 3===Na 2SO 3+CO 2四、SO 31.与水反应:SO 3+H 2O===H 2SO 42.酸性氧化物:①SO 3+CaO===CaSO 4②SO 3+Ca(OH)2===CaSO 4↓+H 2O③SO 3+2NaOH===Na 2SO 4+H 2O五、H 2SO 41.稀H 2SO 4具有酸的通性2.浓H 2SO 4的特性:①吸水性②脱水性(炭化)③强氧化性:Cu+2H2SO4CuSO4+SO2↑+2H2OC+2H2SO4CO2↑+SO2↑+2H2O2Fe+6H2SO4Fe2(SO4)3+3SO2↑+6H2O(铁、铝常温下在浓硫酸中钝化)六、H2S、S2—(还原性)1.FeS+H2SO4===FeSO4+H2S↑2.2Fe3++S2—===2Fe2++S↓3.H2S+Cl2===2HCl+S↓H2S+Cl2===2H++2Cl-+S↓4.Na2S+Cl2===2NaCl+S↓S2-+Cl2===2Cl-+S↓5.H2S+H2SO4(浓)===S↓+SO2↑+2H2O CuSO4+H2S===CuS↓+H2SO46.2H2S+3O22SO2+2H2O 2H2S+O2===2S↓+2H2O(O2足量)工业制硫酸的反应:4FeS2+11O2===2Fe2O3+8SO22SO2+O22SO3SO3+H2O===H2SO4。
硫及其化合物书写化学方程式

写出以下反响的化学方程式,是离子反响的,只写离子方程式1.硫磺燃烧S+O2=SO22.硫与钠混合加热2Na+S=Na2S3.将二氧化硫通入水中,溶液显酸性++HSO 3-SO2+H2O H2SO3 H2SO3 H-= SO32-4.二氧化硫通入过量氢氧化钠溶液中SO2+2O H +H2O-= HSO3-5.二氧化硫通入少量氢氧化钠溶液中SO2+OH2+-=CaSO3↓+ H2O 6.二氧化硫通入过量石灰水中SO2+Ca +2O H7.二氧化硫通入稀硝酸中有气体生成-2-+3SO2+ 2NO3 + 2H2O = 3SO4 +2N O↑+4 H8.二氧化硫通入酸性高锰酸钾溶液中,溶液褪色-2-+4H+5SO2+2MnO 4 + 2H 2O = 5SO4 +2Mn 2+2-+9.二氧化硫通入双氧水中SO2+H2O2= SO4 +2H2--+4H + 10.二氧化硫通入溴水中,溶液褪色SO2+Br 2+ 2H2O = SO4 +2B r2--+4H+ 11.将二氧化硫与氯气的混合气通入水中SO2+Cl 2+2H2O= SO4 +2Cl12.由二氧化硫制取三氧化硫2SO2+O2 2 SO3 (高温高压催化剂)13.三氧化硫与水反响SO3+ H2O= H 2SO42 -++2H SO3+ H2O= SO414.木炭与浓硫酸共热2H2SO4 (浓) +C= 2SO2↑+ CO 2↑+2 H 2O15.铜与浓硫酸共热2H2SO4 (浓) +Cu= CuSO 4+ SO2↑+2 H2O2H2SO4 (浓) +Cu= Cu 2++ SO42-+ SO2↑+2 H2O 16.铁与浓硫酸共热6H2SO4 (浓) +2Fe= Fe2(SO4)3+ 3SO2↑+6H2O3++3 SO42-+ 3SO2↑+6H2O 6H2SO4 (浓) +2Fe= 2Fe17.铝与浓硫酸共热6H2SO4 (浓) +2Al= Al 2(SO4)3+ 3SO2↑+6H2O3++3SO42-+ 3SO2↑+6H2O 6H2SO4 (浓) +2Al= 2Al18.氧化亚铁与浓硫酸反响4H 2SO4 (浓) +2FeO= Fe2(SO4)3+ SO2↑+4H2O3+2-+S O+3S O44H2SO4 (浓) +2FeO= 2Fe+ 2+19. 铁与稀硫酸反响 2 H +Fe= Fe +H 2↑++2Al= 2Al 3++3H 2↑20.铝与稀硫酸反响 6 H21.氧化铁溶于稀硫酸Fe2O3+ 6H += 2Fe3++ 3H 2O22.四氧化三铁溶于稀硫酸Fe3O4+ 8H += 2Fe3++ Fe2++4H 2O += 2Al 3++ 3H 2O 23.氧化铝溶于稀硫酸Al 2O3+ 6H24.氢氧化铝溶于稀硫酸Al(OH) 3+ 3H += Al 3++ 3H2O。
硫及其化合物必记化学方程式

硫及其化合物必记方程式1. 二氧化硫与水反应:SO2+H2O H2SO3离子方程式:SO2+2OH-=SO32-+H2O离子方程式:SO2+OH-=HSO3-4.消石灰吸收少量二氧化硫:化学方程式:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O离子方程式:Ca2++ 2OH- + SO2 ==== CaSO3 ↓+ H2O有白色沉淀生成5. 消石灰吸收足量二氧化硫化学方程式:Ca(OH)2 + SO2 ==== Ca(HSO3 )2+ H2O离子方程式:OH- + SO2 ==== HSO3- + H2O6. 二氧化硫与碱性氧化物氧化钙反应化学方程式:SO2 + CaO = CaSO37. SO2的催化氧化2SO2+O2△2SO38. SO2通入氢硫酸(H2S) SO2+2H2S=3S↓+2H2O产生黄色浑浊9.二氧化硫与氯气通入水中化学方程式:SO2 + Cl2 + 2H2O = 2HCl + H2SO4离子方程式:SO2 + Cl2 + 2H2O = 4H++2Cl- +SO42-(SO2和Cl2都有漂白性,但二者同时1:1通入水中,漂白性丧失,因为生成了盐酸和硫酸)10. 铜跟H2SO4共热Cu+2H2SO4浓△CuSO4+SO2↑+2H2O铜片溶解,产生蓝色溶液和无色有刺激性气味的气体11.碳跟H2SO4共热C+2H2SO4浓△CO2↑+2SO2↑+2H2O12.硫粉与铁粉混合:△Fe +S====FeS13..硫粉与铜粉混合:△2Cu +S====Cu2S14..三氧化硫与水反应:SO3 + H2O = H2SO4硫及其化合物化学方程式默写1. 二氧化硫与水反应:化学方程式:2.少量SO2通入烧碱溶液中化学方程式:离子方程式:3、足量SO2通入烧碱溶液中化学方程式:离子方程式:4.消石灰吸收少量二氧化硫:化学方程式:离子方程式:5. 消石灰吸收足量二氧化硫化学方程式:6. SO2的催化氧化化学方程式:7. SO2通入氢硫酸(H2S) 化学方程式:8.二氧化硫与氯气通入水中化学方程式:离子方程式:9. 铜跟浓H2SO4反应化学方程式:10.碳跟H2SO4共热化学方程式:11..硫粉与铁粉混合:化学方程式:12..三氧化硫与水反应:化学方程式:。
硫及其化合物的化学方程式答案

硫及其化合物的化学方程式汇总一、硫单质 Fe + SFeS (黑色不溶于水固体) 2Cu + SCu 2S (黑色不溶于水固体) 3Cl 2+2Fe2FeCl 3 (棕黄色的固体,溶液为棕黄色) Cl 2+Cu Cu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)二、硫化氢与氢硫酸1、受热分解H 2S H 2 + S2、往氢氧化钠溶液中通硫化氢气体H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ Na 2S → 2NaHS (连续反应)H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ NaOH → NaHS + H 2O (平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H 2S+X 2→S+2HX (X 2=Cl 2、Br 2、I 2)4、 H 2S + CuSO 4 → CuS ↓ + H 2SO 4(此反应可用于检验硫离子)H 2S + 2AgNO 3 → Ag 2S ↓ + 2HNO 3H 2S + Pb (CH 3COO )2 → PbS ↓ + 2CH 3COOH5、实验室制硫化氢气体FeS + 2HCl → FeCl 2 + H 2S ↑FeS + H 2SO 4 → FeSO 4 + H 2S ↑ 6、 完全燃烧 方程式为2H 2S + 3O 2 2H 2O + 2SO 2 不完全燃烧 方程式为 2H 2S + O 2 2H 2O + 2S7、H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体) 三、二氧化硫1、 SO 2 + H 2O H 2SO 32、 SO 2 + Ca(OH)2 → CaSO 3↓+ H 2OSO 2 + CaSO 3 + H 2O → Ca (HSO 3)2(连续反应)SO 2 (少量)+ Ca(OH)2→ CaSO 3↓+ H 2OSO 2(过量) + Ca(OH)2 → Ca (HSO 3)2↓(平行反应)3、 SO 2+CaO →CaSO 32CaSO 3+O 2→2CaSO 4(含硫煤燃烧时加生石灰)4、二氧化硫的弱氧化性 2H 2S +SO 2→3S +2H 2O5、2SO 2 + O 2 2 SO 36、SO 2 + X 2 + 2H 2O → H 2SO 4+2HX (X 为Cl 、Br 、I )7、SO 2 +2 FeCl 3 +2H 2O →H 2SO 4+2FeCl 2+2HCl8、5SO 2 + 2KMnO 4+2H 2O →K 2SO 4+2MnSO 4+2H 2SO 49、实验室制二氧化硫Na 2SO 3 (固)+H 2SO 4 (浓)→Na 2SO 4+SO 2↑ +H 2O →点燃 → 点燃10、酸雨形成的两个途径途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+ H 2O→H2SO4途经2:SO2 + H2O H2SO3 2H2SO3 +O2→2H2SO411、2Na2SO3 +O2→2Na2SO4亚硫酸钠除余氯的原理Cl2+2Na2SO3 +H2O →2Na2SO4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)NaCl+ NaHSO4Na2SO4+HCl↑(连续反应)2NaCl+H2SO4(浓)NaHSO4+HCl↑2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)NaNO3+H2SO4(浓)NaHSO4+HNO3↑(微热,硝酸受热易分解)CaF2+H2SO4(浓) CaSO4+2HF↑(不能在玻璃仪器中制取)2、Cu + 2H2SO4(浓)2SO2↑+CuSO4+2H2O3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H2SO4(浓)3SO2↑+Fe2(SO4)3+6H2OFe +Fe2(SO4)3→3FeSO4Fe+H2SO4→FeSO4+H2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2OZn+H2SO4→ZnSO4+H2↑6、浓硫酸不能干燥氨气、H2S、HBr、HI2NH3+H2SO4→(N H4)2SO4H2S +H2SO4(浓) →S +SO2 ↑+2H2O2HBr +H2SO4(浓) →Br2 +SO2 ↑+2H2O2HI+H2SO4(浓) →I2 +SO2 ↑+2H2O7、实验室用硫酸制取的气体制氢气:Zn+H2SO4→ZnSO4+H2↑制硫化氢:FeS + H2SO4→FeSO4 + H2S ↑制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)制二氧化硫:Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑8、硫酸的工业制备原理:4FeS2+11O22Fe2O3+8SO2 2SO2 + O2 2 SO3SO3+H2O→H2SO4尾气吸收: SO2(少量)+2NH3+H2O →(NH4)2SO3 SO2+(NH4)2SO3+H2O →2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O →(NH4)2SO3SO2(足量)+ NH3+H2O →NH4HSO3(平行反应)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
For personal use only in study and research; not for commercial use
For personal use only in study and research; not for commercial use
硫及其化合物的化学方程式汇总 一、硫单质 Fe + S
FeS (黑色不溶于水固体) 2Cu + S
Cu 2S (黑色不溶于水固体) 3Cl 2+2Fe
2FeCl 3 (棕黄色的固体,溶液为棕黄色) Cl 2+Cu Cu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)
3、硫在空气中燃烧: S + O 2 点燃
SO 2
4、硫与氢气反应: S+H 2 △ H 2S
5、SO 2与水反应:SO 2+H 2O H 2SO 3
6、钙基固硫: SO 2+CaO==CaSO 3 2CaSO 3+ O 2==2CaSO 4
二、硫化氢与氢硫酸
1、受热分解H 2S H 2 + S
2、往氢氧化钠溶液中通硫化氢气体
H 2 S+ 2NaOH → Na 2S +2 H 2O
H 2 S+ Na 2S → 2NaHS (连续反应)
H 2 S+ 2NaOH → Na 2S +2 H 2O
H 2 S+ NaOH → NaHS + H 2O (平行反应)
3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H 2S+X 2→S+2HX (X 2=Cl 2、Br 2、I 2)
4、 H 2S + CuSO 4 → CuS ↓ + H 2SO 4(此反应可用于检验硫离子)
H 2S + 2AgNO 3 → Ag 2S ↓ + 2HNO 3
H 2S + Pb (CH 3COO )2 → PbS ↓ + 2CH 3COOH
5、实验室制硫化氢气体
FeS + 2HCl → FeCl 2 + H 2S ↑
FeS + H 2SO 4 → FeSO 4 + H 2S ↑ 6、 完全燃烧 方程式为2H 2S + 3O 2 2H 2O + 2SO 2
不完全燃烧 方程式为 2H 2S + O 2 2H 2O + 2S
7、H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体) →
点燃 → 点燃
三、二氧化硫
1、SO2 + H2O H2SO3
2、澄清石灰水中通入至过量SO2:
SO2 + Ca(OH)2→CaSO3↓+ H2O (鉴别SO2与CO2不能用澄清石灰水)
SO2 + CaSO3 + H2O →Ca(HSO3)2(连续反应)
SO2(少量)+ Ca(OH)2→CaSO3↓+ H2O
SO2(过量)+ Ca(OH)2→Ca(HSO3)2↓(平行反应)
3、SO2+CaO→CaSO3
2CaSO3+O2→2CaSO4(含硫煤燃烧时加生石灰)
4、.少量SO2通入中NaOH 溶液中:
SO2+2NaOH==Na2SO3+H2O
SO2 + 2OH-==SO32-+H2O
5.二氧化硫的弱氧化性2H2S+SO2→3S+2H2O
6、2SO2 + O2 2 SO3
7. SO2通入氯水中:SO2+Cl2+2H2O==H2SO4+2HCl
SO2+Cl2+2H2O== 4H++SO42-+2Cl-
8、SO2通入卤水中: SO2+X2+2H2O==H2SO4+2HX
SO2+X2+2H2O== 4H++SO42-+2X- (X=Cl、Br、I)
9、SO2与H2S(气体、溶液均能反应):
SO2+2H2S==3S↓+2H2O (氧化产物:还原产物=2:1)
10、SO2 +2 FeCl3 +2H2O→H2SO4+2FeCl2+2HCl
11、5SO2 + 2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO4
12、实验室制二氧化硫Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O
13、酸雨形成的两个途径
途经1:2SO2 + O2 2 SO3(空气中烟尘作催化剂)SO3+ H 2O→H2SO4
途经2:SO2 + H2O H2SO3 2H2SO3 +O2→2H2SO4
3NO2 + H2O==2HNO3 + NO
14、Na2SO3长期放置于空气中:2Na2SO3 +O2→2Na2SO4
15.亚硫酸钠除余氯的原理Cl2+2Na2SO3 +H2O →2Na2SO4+2HCl
三、硫酸
1、高沸点的浓硫酸制挥发性的酸
2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)NaCl+ NaHSO4Na2SO4+HCl↑(连续反应)2NaCl+H2SO4(浓) NaHSO4+HCl↑2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)
NaNO3+H2SO4(浓) NaHSO4+HNO3↑(微热,硝酸受热易分解)
CaF2+H2SO4(浓) CaSO4+2HF↑(不能在玻璃仪器中制取)
2、Cu + 2H2SO4(浓) 2SO2↑+CuSO4+2H2O
3、2H2SO4(浓)+C 2SO2↑+CO2↑+2H2O
4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式
2Fe+ 6H2SO4(浓) 3SO2↑+Fe2(SO4)3+6H2O
Fe +Fe2(SO4)3→3FeSO4
Fe+H2SO4→FeSO4+H2↑
5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式
Zn + 2H2SO4(浓)→ZnSO4+2SO2↑+ 2H2O
Zn+H2SO4→ZnSO4+H2↑
6、浓硫酸不能干燥氨气、H2S、HBr、HI
2NH3+H2SO4→(NH4)2SO4
H2S +H2SO4(浓) →S +SO2 ↑+2H2O
2HBr +H2SO4(浓) →Br2 +SO2 ↑+2H2O
2HI+H2SO4(浓) →I2 +SO2 ↑+2H2O
7、实验室用硫酸制取的气体
制氢气:Zn+H2SO4→ZnSO4+H2↑
制硫化氢:FeS + H2SO4→FeSO4 + H2S ↑
制氯化氢:2NaCl+H2SO4(浓) NaHSO4+HCl↑(微热)
2NaCl+H2SO4(浓) Na2SO4+2HCl↑(平行反应)
制二氧化硫:Na2SO3(固)+H2SO4(浓)→Na2SO4+SO2↑ +H2O
制乙烯:(浓硫酸作催化剂,脱水剂)CH3CH2OH H2O + CH2=CH2 ↑
8、硫酸的工业制备
原理:4FeS2+11O22Fe2O3+8SO2 2SO2 + O2 2 SO3SO3+H2O→H2SO4
尾气吸收: SO2(少量)+2NH3+H2O →(NH4)2SO3 SO2+(NH4)2SO3+H2O →2NH4HSO3 (连续反应) SO2(少量)+2NH3+H2O →(NH4)2SO3
SO2(足量)+ NH3+H2O →NH4HSO3(平行反应)
For personal use only in study and research; not for commercial use.
Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.
Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.
толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.
以下无正文
For personal use only in study and research; not for commercial use.
Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.
Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.
толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.
以下无正文。
